
Бесплатный фрагмент - Аллерген-специфическая иммунотерапия у детей (на правах руководства)
Согласительный документ Ассоциации детских аллергологов и иммунологов России
Дисклеймер
Информация предназначена для медицинских и фармацевтических работников. Текст книги не может быть использован для самолечения. Не является медицинской консультацией. Имеются противопоказания. Перед применением требуется консультация специалиста.
Список сокращений
EAACI — Европейская академия аллергологии и клинической иммунологии
FOXP3 — Forkhead box P3 — рецепторный белок транскриптор
HDM — house dust mites — клещи домашней пыли
IGA — investigator global assessment — шкала оценки тяжести дерматита «тяжесть по оценке исследователя».
IgE, IgG — иммуноглобулины E, G
IL-10 — интерлейкин 10
PNU — (Protein Nitrogen Unit) единицы белкового азота
SCIT — subcutaneous immunotherapy — подкожная иммунотерапия
SLIT — sublingual immunotherapy — подъязычная иммунотерапия
АИТ — аллерген иммунотерапия (синоним АСИТ — аллерген специфическая иммунотерапия)
АПК — антигенпрезентирующие клетки
АР — аллергический ринит
АРК — аллергический риноконъюнктивит
АСИТ — аллерген специфическая иммунотерапия (синоним АИТ — аллерген иммунотерапия)
БА — бронхиальная астма
ГКС, иГКС — глюкокортикостероиды, ингаляционные глюкокортикостероиды
ДК — дендритные клетки.
КДП — клещи домашней пыли
МОС — максимальная объемная скорость выдоха
ОИТ — оральная иммунотерапия
ОФВ1 — объём форсированного выдоха за первую секунду
ПД — провокационная доза
ПКИТ — подкожная иммунотерапия
СЛИТ — сублингвальная АИТ
СЛИТ — сублингвальная иммунотерапия
Вступление
Когда заходит речь о специфической аллерген иммунотерапии (АИТ), врачебное сообщество немедленно разделяется на две когорты — те, кто не определились или не знают об этом методе и безусловные сторонники АИТ. Первую группу, в свою очередь, вполне можно разделить на специалистов, отдалённо представляющих о чём идёт речь, и это совершенно оправданно, в виду того, что они работают в областях медицины, не имеющих отношения к аллергологии-иммунологи. Другая часть первой когорты всё же понимает о чём идёт речь в виду того, что им приходится консультировать своих пациентов с врачами аллергологами, но отношение к методу у них чаще всего противоречивое, так как не берясь судить о чужой области знания, они всё же считают, что иметь дело с аллергеном непросто, опасно или что-то в этом роде. Эта часть медицинского сообщества, не рекомендующая выполнение иммунотерапии, представляет собой уж точно более 90% всех врачей. Вторая когорта, напротив, состоит из немногочисленной группы аллергологов-иммунологов, а также небольшого числа терапевтов и педиатров в силу профессиональных обстоятельств познакомившихся с методом через своих коллег аллергологов и своих пациентов, которые получили хорошие результаты от лечения. Самое удивительное, что немалая часть врачей, причастных к иммунологии, к специфической иммунотерапии относится по-разному. Ладно, если бы это были только терапевты и педиатры, в обязанности которых не входит проведение аллерген иммунотерапии. Часть аллергологов-иммунологов не использует метод АИТ, не понимают его или попросту боятся его применять. К сожалению, чаще мы видим таких коллег в числе тех, кто начал работать в специальности после курсов профессиональной переподготовки, не сформировался как специалист под руководством наставников из традиционной аллергологической школы, не прошёл ординатуру в немногочисленных специализированных учреждениях. Всё это находит отражение в вопиющих результатах статистических исследований, демонстрирующих ничтожно малый процент применения метода у пациентов, страдающих аллергическими заболеваниями IgE — зависимого типа с подтверждённой сенсибилизацией к пыльцевым, бытовым и другим видам аллергенов. И это при том, что доказательная база эффективности АИТ накоплена в течение целого столетия, подкреплена результатами доказательных исследований самого высокого уровня в последнюю декаду XXI века. На конгрессах европейской и американской аллергологических академий, обществ и ассоциаций не менее трети лекций и докладов посвящено специфической иммунотерапии, доказательствам её эффективности и безопасности, результатам хорошо продуманных контролируемых исследований, маркёрам и предикторам хорошего результата, и другим аспектам применения АИТ. И, тем не менее, мало обоснованный, но трудно преодолимый консерватизм медицинского сообщества, основу которого составляет главный тезис: «Аллерген? Это же опасно!» — тормозят прогресс в этой области знания и лишают миллионов людей шанса избавиться от своего недуга или значительно ослабить его, заметно улучшив качество жизни. Другую проблему составляют «новоиспеченные» специалисты или врачи, не имеющие сертификата аллерголога-иммунолога, которые в силу большого спроса на специалистов аллергологов-иммунологов в последние годы, гоняются за числом коммерческих консультаций, направо и налево назначая метод, не умея его применять, чем дискредитируют его и наносят большой ущерб как пациентам, так и специальности аллерголог-иммунолог.
В России дело обстоит ничем не лучше, чем в других регионах мира. Однако, преимуществом отечественной аллергологии, всё же является тот факт, что в нашей стране жили и работали такие выдающиеся люди, как Андрей Дмитриевич Адо и другие учёные советской аллергологической школы. Нашим учителям и наставникам удалось достигнуть серьезного прорыва в области аллергологии и иммунологии в 70-х — 80-х годах XX столетия. Фундаментальные и прикладные работы советской аллергологической школы были признаны специалистами мировой медицинской науки. Аллергологическая служба была выстроена в Советском Союзе на высоком уровне, а аллерген-специфическая иммунотерапия проводилась по показаниям большому числу пациентов в амбулаторной практике и в режиме дневных и круглосуточных стационаров. Были разработаны и успешно применялись водные экстракты аллергенов и модифицированные аллергоиды в виде подкожных инъекций. Метод применялся во всех крупных городах, от Москвы и Ленинграда (теперь С.-Петербурга), до Владивостока, от Мурманска до Екатеринбурга. Специфическая иммунотерапия была широко распространена во многих столицах и крупных городах советских республик: Киеве, Алма-Ате, Баку, Ереване, Тбилиси, Риге, Вильнюсе, Таллине, Кишинёве. Причем использовалась специфическая аллерген-иммунотерапия как у взрослых, так и у детей, начиная с 7-летнего возраста. Однако с изменением политического строя произошло разрушение связей, преемственности аллергологических медицинских школ. Только в столице и нескольких крупных городах, где имелись кафедры иммунологии и аллергологии, сохранялось какое-то подобие аллергологической службы, которая так и не была полноценно восстановлена.
За это время медицинская наука ушла далеко вперед. В области АИТ изменилось понимание механизмов метода, были открыты регуляторные клетки и нейтрализующие аллерген антитела. Поменялись схемы: от предсезонных, которыми мы пользовались ранее, в настоящее время аллергологами используются круглогодичные и предсезонно — сезонные методики. Мир отказался от стандартизации препаратов аллергенов по весу на основе белковых единиц азота (PNU) и перешел на биологическую стандартизацию сырья, хотя проблема стандартизации так до сих пор полностью не разрешена. Мы это обсудим в соответствующем разделе. Препараты аллергенов производства США, Франции, Германии, Дании, Испании за три последние декады стали значительно более эффективными и безопасными, были изучены в многократных рандомизированных исследованиях и нашли широкое применение в практике аллергологов многих развитых стран. Несколько лет назад в Российской Федерации были зарегистрированы и стали с успехом применяться препараты аллергенов французской компании Stallergen, а в последние 2 года на нашем рынке появились препараты датской компании ALK (аббревиатура «Аллергологическая Лаборатория Копенгагена» — такое историческое название имела компания при создании). Очень медленное появление препаратов аллергенов на нашем рынке во многом предопределяет и ограниченность терапевтического инструментария врача аллерголога-иммунолога, не говоря уже о том, что в нашей стране только начинается процесс создания собственных высокотехнологичных современных препаратов аллергенов.
Настоящий документ, созданный экспертами Ассоциации детских аллергологов и иммунологов России, является руководством по аллерген-специфической иммунотерапии для педиатров, а также аллергологов-иммунологов, работающих преимущественно с пациентами детского возраста. Данный метод терапевтического воздействия (АИТ) может рассматриваться как единственно способный привести организм ребенка, страдающего аллергическим заболеванием, к состоянию иммунной толерантности к причинно-значимым аллергенам. Наиболее применим метод АИТ при сенсибилизации к микроклещам домашней пыли и пыльцевым аллергенам — основным триггерам аллергического ринита и атопической бронхиальной астмы.
Мы надеемся, что создание и публикация данного согласительного документа АДАИР придаст новый импульс и поможет в практической работе большому числу специалистов, искренне заинтересованных в улучшении здоровья наших маленьких пациентов и значительном повышении качества их жизни.
Руководитель проекта
Президент АДАИР,
д.м. н. Юрий С. Смолкин
1.
Обзор истории АИТ, опыт применения
Ключевые положения:
1. АИТ предложена более 100 лет назад и показала свою эффективность в терапии заболеваний, опосредованных специфическими IgE — антителами.
2. В истории АИТ выделяют ряд ключевых этапов: от донаучного и эмпирического знания до современного, основанного на принципах доказательной медицины.
3. В развитии АИТ принимали участие ученые всего мира. АИТ распространена повсеместно и проводится для лечения аллергии к основным видам наиболее распространённых и значимых аллергенов.
4. Успехи в терапии аллергического ринита, конъюнктивита и бронхиальной астмы доказали, что АИТ — единственный метод, модифицирующий течение аллергического заболевания в сторону ремиссии.
Методики применения лечебных аллергенов непрерывно развиваются одновременно с медицинской наукой, с постоянным повышением её эффективности и безопасности для пациента.
История АИТ — это длинный путь от эмпирических знаний к доказательной медицине, от индивидуального опыта — к уверенному широкому применению в реальной практике. АИТ — метод со 110-летней, и отнюдь не оконченной историей, — развивался параллельно прогрессу медицины в целом и ее отраслей: иммунологии и аллергологии. Возникновению идеи метода иммунизации аллергенами предшествовали различные предпосылки задолго до известных открытий Нуна и Фримена. Достижения иммунологии и вакцинологии, понимание механизмов адаптивного иммунитета и большой практический опыт врачей — исследователей сделали возможным в XX веке появление тогда совсем нового метода лечения аллергических заболеваний. По мнению Гущина И. С. в развитии метода АИТ можно условно выделить 4 основные стадии:
1. Донаучная стадия — от древних веков до константинопольской вариоляции (1718 г) века.
2. Эмпирическая стадия — от Э. Дженнера (кон. XVIII — нач. XIX) до Л. Нуна и Д. Фримена (1911).
3. «Интуитивная» стадия (стадия гипотез) — от работ Р. Кука, Прауснитца–Кюстнера (20–30-е годы XX века) и до открытия IgE Ишизака (1966). То есть речь идет о верных находках, которые позднее были подтверждены более совершенными методами.
4. Стадия «истинного» (достоверного) знания — от открытия IgE до настоящего времени ⦋1, 2].
Сходство вакцинации и иммунотерапии аллергенами несомненна, почему всё большую популярность приобретает инициативный термин «аллерговакцинация». В обоих случаях в основе метода лежит формирование популяции иммунных клеток с искусственно заданными свойствами путем воздействия на них антигеном извне. Основываясь на медицинском научном знании и накопленном опыте вакцинологии, АИТ смогла модифицировать течение хронического заболевания путем перестройки, «тренировки» иммунной системы.
Отцом АИТ называют Леонарда Нуна (L. Noon). Данные Milton J. Rosenau и John F. Anderson о том, что возрастающие дозы лошадиной сыворотки индуцируют толерантность, позволили Л. Нуну в 1910 г. предположить, что предсезонные подкожные инъекции пыльцевых экстрактов в возрастающих дозах могут быть эффективными для лечения сенной лихорадки. Для приготовления экстрактов различной пыльцы и определения их правильного разведения он использовал кожные тесты, а измерял эффект лечения с помощью конъюнктивальных провокационных тестов, оценивая покраснение и воспалительную реакцию до терапии и после нее. Год спустя Л. Нун апробировал этот тип лечения, названный им «профилактической прививкой», на людях и опубликовал результаты в «Ланцете» [3].
Работа была продолжена Дж. Фрименом, после чего последовал ряд работ, показывающих клиническую эффективность и долговременный эффект АИТ, были выработаны схемы еженедельного введения аллергена и описаны первые нежелательные и системные реакции ⦋4⦌. Роберт Кук, один из родоначальников аллергологической науки и термина «атопия», ввел АИТ в Соединенных Штатах, назвав ее в 1914 году «активная иммунизация». Позже, в 1922 году, он предложил термин «гипосенсибилизация» — как лучшее название для этого типа лечения ⦋5⦌.
Период 20-60-х гг. XX в., вплоть до открытия IgE, характеризовался постепенным накоплением фактов в отношении теории, методологии и практики иммунологии и аллергологии. В 1924 г. Thommen сформулировал ряд положений, позволивших определить зависимость развития сенной лихорадки от цветения определенных групп растений. В том же году Кеrn описал существование аллергенов, действующих на больных постоянно. Принципы предсезонной гипосенсибилизации были перенесены на пациентов с круглогодичным ринитом и бронхиальной астмой, вызванных домашней пылью. Параллельно совершенствовалась диагностика аллергии — R. Cooke и O. M. Schloss стали использовать кожные пробы, что дало возможность проводить расширенную диагностику сенсибилизации пациента. Р. Кук разработал методику стандартизации экстрактов аллергенов с помощью метода Кьельдаля для определения PNU (единиц белкового азота), который с изменениями широко использовался в мире до 1980-х, а в России, согласно Государственной Фармакопее, применяется в качестве референса до настоящего времени.
На протяжении более чем 100-летней истории АИТ ее методы постоянно совершенствуются. Существует много способов применения АИТ, которые существовали ранее или используются в современной аллергологии.
Ускоренные курсы АИТ берут свое начало в 1930 г., когда Дж. Фримен предложил иммунотерапию ударными дозами, при которой инъекции пыльцевого экстракта делали с интервалами 1,5 — 2 ч в течение 14-часового периода под наблюдением в условиях стационара. Параллельно его коллеги врачи — аллергологи использовали ставшие классическими методики долговременного воздействия на иммунную систему, а также пытались повысить эффективность АИТ использованием депо-вакцин и адъювантов, которые обеспечивали продленное непрерывное высвобождение аллергена из места его введения.
В то время как классическим методом является подкожная инъекция экстрактов аллергенов, с начала 20-го века исследовались другие способы применения, такие как внутрикожный, интралимфатический, оральный, сублингвальный, назальный, ректальный (толерантность слизистой оболочки) ⦋6⦌.
Клиническое использование сублингвальной АИТ (СЛИТ) впервые описано в 1969 г. Дэвидом Моррисом. Оральный метод был предложен в 10-20-е гг. XX века при дерматите, вызванном пыльцой растений или пищевыми аллергенами и успешно применяется до настоящего времени и при других нозологических формах, таких как аллергический ринит и бронхиальная астма, но редко — при атопическом дерматите. Сравнительная эффективность сублингвального и подкожного метода обсуждается по настоящее время, и самые свежие данные свидетельствуют о сопоставимом эффекте, что позволяет врачу и пациенту выбирать любой удобный для врача и пациента метод [7].
Вот некоторые важные исторические вехи развития метода.
В 1955 г. William Frankland в Англии провел первое двойное слепое исследование эффективности АИТ, установившее прямой дозозависимый эффект.
В 1956 г. Loveless была впервые успешно применена АИТ ядами перепончатокрылых для лечения анафилактических реакций на яд жалящих насекомых.
В 1978 г. — исследование Hunt и соавторами доказало большую эффективность АИТ ядами по сравнению с экстрактами из пчелиных тел. Наблюдение подтверждает гипотезу о взаимосвязи качества и белкового состава лечебного аллергена и важности содержания в препарате определенных белков, ответственных за возникновение симптомов, а также о наличии некоторых «балластных» протеинов в насекомых, растениях и токсинах, которые не влияют на аллергенность экстракта ⦋8].
После открытия IgE в 1966 году, определяющих аллергическую реакцию I типа, появилась основа для углубленных исследований механизмов аллергии и места АИТ в лечении ринита и астмы. Было предложено и обсуждено множество гипотетических концепций для объяснения эффекта АИТ: от индукции «блокирующих» антител до воздействия на регуляторные Т-клетки. Практические исследования на людях стали дополняться экспериментальными работами на клеточном уровне.
Большая заслуга в становлении и развитии метода АИТ принадлежит аллергологам СССР. Под руководством акад. А. Д. Адо было организовано производство терапевтических и диагностических аллергенов и разработаны методики АИТ, используемые до настоящего времени ⦋1, 2, 8⦌. Под руководством проф. И. Балаболкина, являющегося президентом АДАИР в настоящее время, были защищены диссертации, посвящённые иммунотерапии аллергического ринита и астмы, а также разработана схема сублингвального введения водно — солевых натуральных экстрактов аллергенов, которая успешно применяется по сегодняшний день. В работах вице-президента АДАИР, д.м. н. Ю.С.Смолкина в 90-х годах ХХ века уже была продемонстрирована сравнительная эффективность подкожного и сублингвального методов АИТ и однотипность их влияния на неспецифическую систему нейроиммунного реагирования на примере влияния АИТ на эндогенную опиоидную систему (нейропептиды).
Основные теоретические обоснования АИТ и разработка новых препаратов для этого вида терапии проводились и проводятся на базе Института иммунологии ФМБА.
В 1970-х годах возникла концепция аллергоидов — химически модифицированных аллергенов, направленная на повышение эффективности и безопасности аллерген-иммунотерапии. Аллергоиды, изготовленные с помощью формальдегида, до сих пор являются основой аллерген-иммунотерапии, применяются и производятся в нашей стране и могут вводиться в довольно высоких дозах особенно после абсорбции на алюмогидроксиде (квасцы) или других адъювантах. В 1980-е в качестве адъювантов были опробованы тирозин, кальция фосфат или монофосфориллипид (MPL) — липополисахарид, полученный из Salmonella Minnesota ⦋9⦌.
Новой вехой в аллергологии стало создание рекомбинантных аллергенов в конце 1980-х. Первые клинические испытания рекомбинантных аллергенов были проведены с анафилаксией яда насекомых, где было показано, что они одинаково эффективны в диагностике и лечении с использованием препаратов фосфолипазы А1 ⦋3⦌. Однако, несмотря на широкое применение в диагностике и лечебной практике, чистые изолированные рекомбинантные аллергены пыльцы растений и клещей пыли широко не используются до настоящего времени.
В 1990-2000-е разрабатываются новые типы препаратов на основе химически модифицированного MPL-связанного аллергена, способного абсорбироваться в депо L-тирозина и медленно высвобождаться из него, что делает возможным достижение клинического эффекта уже после 4 инъекций ⦋10⦌.
В 1990-х годах была открыта еще одна новая возможность для АИТ с идентификацией новых модификаторов аллергического Th2-иммунного ответа. CpG-олигонуклеотиды индуцируют сильную Th1-поляризацию иммунных рецепторов, а клинические исследования выявили высокую эффективность этого метода АИТ при лечении аллергии на пыльцу амброзии ⦋11⦌.
Совсем недавно появились небольшие карбамилированные аллергоиды, устойчивые к перевариванию протеолитическими ферментами и быстро всасывающиеся через слизистую оболочку полости рта. Препараты производятся компанией «Лофарма» и используются для сублингвальной иммунотерапии пылевыми клещами и злаками. Для облегчения проникновение аллергена можно не только изменять структуру аллергена, но и совершенствовать носитель. Препараты компании ALK для сублингвальной иммунотерапии с 2000-х начали использовать технологию лиофилизации таблеток, что позволило ускорить высвобождение аллергена и улучшить его всасываемость ⦋12⦌.
Заключение. Хотелось бы отметить, что за последние 110 лет был получен огромный объем информации о патогенезе атопических заболеваний и механизмах терапевтического действия различных методов аллерген-иммунотерапии. Будучи первоначально экспериментальным методом лечения аллергических заболеваний с частыми и тяжелыми побочными эффектами, сегодня АИТ стала стандартом лечения основных IgE-опосредованных аллергических заболеваний, показавшим свою эффективность и безопасность в двойных слепых исследованиях. Совершенствование АИТ, разработка новых препаратов и методик их введения, вероятно, имеет большую перспективу, неразрывно связанную с получением новых знаний о механизмах развития аллергических болезней.
Литература к разделу
1. Воробьева ОВ. Развитие метода аллергенспецифической иммунотерапии в 20-60-х годах XX века-до обнаружения IgE. Российский аллергологический журнал. 2011 (2):3—12.
2. Воробьева ОВ, Гущин ИС. Исторические предпосылки создания метода аллергенспецифической иммунотерапии (К 100-летию открытия). Российский аллергологический журнал. 2010 (5):17—28
3. Ring J, Gutermuth J. 100 years of hyposensitization: history of allergen-specific immunotherapy (ASIT). Allergy 2011; 66: 713–724; Noon L. Prophylactic inoculations againsthay fever. Lancet 1911;1:1572–1573.
4. Freeman J. Further observations on the treatment of hay fever by hypodermic inoculations of pollen vaccine. Lancet 1911; 178:814–817
5. Cooke RA. The treatment of hay fever by active immunization. Laryngoscope 1914;25:108–112.
6. Meyer-Pittroff R, Behrendt H, Ring J. Specific immuno-modulation and therapy by means of high pressure treated allergens. High Pressure Research. 2007 Mar 1;27 (1):63—7.
7. Durham SR, Penagos M. Sublingual or subcutaneous immunotherapy for allergic rhinitis?. J Allergy Clin Immunol. 2016;137 (2):339—349.e10. doi:10.1016/j. jaci.2015.12.1298
8. Гущин ИС, Курбачева ОМ. Аллергия и аллергенспецифическая иммунотерапия. М.: Фармарус Принт Медиа. 2010;228:16.
9. Johnson AG, Tomai M, Solem L, Beck L, Ribi E. Characterization of a nontoxic mono phosphoryl lipid. Rev Infect Dis 1987;9:512–516
10. Puggioni F, Durham SR, Francis JN. Monophosphoryl lipid A (MPL) promotes allergeninduced immune deviation in favour of Th1 responses. Allergy 2006;60:678–684
11. Creticos PS, Schroeder JT, Hamilton RG, Balcer-Whaley SL, Khattignavong AP, Lindblad R et al. Immunotherapy with a ragweed-Toll-like receptor 9 agonist vaccine for allergic rhinitis N Engl J Med 2006;355: 1445–1455.
12. Lund K, Kito H, Skydtsgaard MB, Nakazawa H, Ohashi-Doi K, Lawton S. The Importance of Tablet Formulation on Allergen Release Kinetics and Efficiency: Comparison of Freeze-dried and Compressed Grass Pollen Sublingual Allergy Immunotherapy Tablet Formulations. Clin Ther. 2019;41 (4):742—753. doi:10.1016/j.clinthera.2019.02.008
2.
Механизмы аллерген иммунотерапии
Ключевые положения:
1. АИТ — это метод лечения аллергических заболеваний, направленный на формирование у пациентов иммунологической толерантности к определенным аллергенам.
2. Регуляторные Т-клетки (Treg) проявляют свою иммуносупресивную функцию посредством высвобождения ИЛ-10, блокирования дегрануляции тучных клеток и использования механизмов, связанных с цитотоксическим Т-лимфоцитарным антигеном 4 (CTLA-4) и запрограммированной гибелью эффекторных клеток.
3. Регуляторные В-клетки (Вreg) могут способствовать индукции толерантности при проведении АИТ через ИЛ-10 — опосредованное подавление эффекторных Т-клеток, ингибирование созревания дендритных клеток, индукцию Treg — клеток и продукцию плазматическими клетками противовоспалительных «блокирующих» антител IgG4.
4. Проведение АИТ ассоциировано со снижением количества врожденных лимфоидных клеток Lin– CD127+ CRTH2+ группы 2 (ILC2), увеличением количества регуляторных клеток и формированием супрессорной направленности иммунного ответа.
В зависимости от способа введения аллергена клетки иммунной системы вовлекаются в разной степени, но в итоге, в большинстве случаев, формируется иммунологическая толерантность и снижение выраженности симптомов заболевания и объема получаемой симптоматической терапии.
2.1. Клеточные и гуморальные механизмы индуцированной толерантности
Общепризнанно, что основной целью метода аллерген-иммунотерапии (АИТ) является формирование толерантности к определенным аллергенам у пациентов с атопическими заболеваниями (АЗ) для уменьшения (или исчезновения) выраженности клинических проявлений болезни, снижения потребности в фармакотерапии и повышения качества жизни пациентов. В последнее время все чаще обсуждается вопрос о возможности использования АИТ для предупреждения развития у пациентов новых клинических проявлений (например, бронхиальной астмы у пациентов с аллергическим ринитом) или новой сенсибилизации, и даже с целью первичной профилактики аллергии. Однако, следует отметить, что в настоящее время проведение АИТ с профилактическими целями людям с высоким риском аллергии, но без сенсибилизации или применение «бессимптомным» пациентам «заранее» не поддерживается научным сообществом [1].
АИТ приводит к развитию толерантности с участием множества различных молекулярных и клеточных механизмов, которые в настоящее время достаточно хорошо изучены и описаны. В первую очередь, к ним относится активация толерогенных дендритных клеток, Т- и В-регуляторных клеток. Эти индуцированные клеточные популяции продуцируют медиаторы, способные переключать иммунный ответ на толерогенный путь, который, в числе прочего, обеспечивает образование блокирующих IgG4 антител.
Иммуноглобулины в достижении толерантности
Механизмы адаптивного иммунного ответа подразумевают образование иммуноглобулинов плазматическими клетками и формирование специфических клеточных популяций — «клеток памяти», способных к реактивации при необходимости. При контакте с аллергеном, в том числе и при иммунотерапии, происходит естественное повышение уровня специфических IgE — антител (sIgE), особенно в начале лечения. Это не должно расцениваться как отрицательный эффект, повышение IgE не сопровождается усилением симптоматики и наблюдается у значительной части пациентов.
Специфические «блокирующие» антитела были названы подобным образом из-за способности связывать in vitro в сыворотке пациента молекулы IgE. Эти антитела в эксперименте способны к пассивному переносу, что доказывает возможность неклеточных механизмов защиты от аллергии. Блокирующими свойствами обладают антитела IgG4. Кроме того, при сублингвальном способе введения препарата образуются специфические IgA и IgG1 антитела со сходными функциями. Механизмом действия специфического IgG4 является ингибирование образования комплекса между рецептором IgE и антигеном на поверхности тучных клеток и В — лимфоцитов, что в конечном итоге, приводит к уменьшению количества активированных FcεR I—II рецепторов к IgE на мембране, а следовательно и к снижению эффекторного ответа тучных клеток, эозинофилов и базофилов, что ослабляет аллергическое воспаление [2, 3]. АИТ воздействует на обе фазы аллергического ответа — раннюю и позднюю, в результате чего происходит подавление миграции клеток в ткани, снижение их количества и активности в слизистой оболочке органов-мишеней, что приводит не только к торможению аллерген-специфической реакции, но и к угнетению тканевой гиперчувствительности к медиатору аллергии (гистамину) [4].
Тучные клетки и базофилы
Клетки играют наиболее заметную роль в развитии аллергического воспаления. Связанная с высокоаффинным рецептором к IgE (FcεRI) активация тучных клеток приводит к их дегрануляции и высвобождению огромного количества преформированных (гистамин, триптаза) и вновь образующихся медиаторов и цитокинов 2 типа (ИЛ-4, ИЛ-13 и др.), что обусловливает развитие аллергического воспаления и продукцию IgE [5]. Тучные клетки и базофилы реализуют два типа эффектов под влиянием АИТ, которые могут классифицироваться как ранняя десенситизация и поздний ответ в тканях. Ранняя десенситизация характеризуется преимущественно изменением порогов быстрой дегрануляции тучных клеток и базофилов, что сопровождается снижением ответа на аллергены, независимо от уровня аллерген-специфических IgE. Поздний ответ заключается в снижении тканевой инфильтрации и продукции медиаторов аллергического воспаления [6].
В настоящее время предложено несколько механизмов, объясняющих участие тучных клеток и базофилов в реализации эффектов АИТ. Главными из них являются взаимодействие с гистаминовыми рецепторами 2 типа и связывание IgG с рецепторами FcγRIIb [7, 8]. Было показано, что IgE-опосредованная активация и дегрануляция базофилов ингибируется различными подклассами IgG антител, продуцируемых во время проведения АИТ. Было обнаружено, что IgG3 и, в меньшей степени, IgG2 обеспечивают вовлечение CD32 в ингибирование активности FcεRI на поверхности базофилов и являются наиболее эффективными в подавлении их функции [9]. Другим механизмом, объясняющим раннюю десенсибилизацию, является быстрая активация рецептора гистамина 2 типа, который оказывает подавляющее действие на опосредованную активацию FcεRI и дегрануляцию базофилов. Эта ранняя толерантность к аллергенам была продемонстрирована у пациентов, получающих иммунотерапию ядом перепончатокрылых [7].
Регуляторные Т-клетки
Treg — лимфоциты и их цитокины, в первую очередь интерлейкин 10 (ИЛ-10) и трансформирующий фактор роста бета (TGF-β) подавляют иммунные реакции Т-хелперов 2 типа и во многих отношениях контролируют аллергические заболевания. АИТ вызывает сдвиг соотношения IL-4-секретирующих Т-хелперных клеток типа 2 в пользу IL-10-секретирующих индуцибельных Treg-клеток, специфичных для того же аллергенного эпитопа, количество и функция которых увеличиваются. Различные типы индуцибельных Treg-клеток контролируют несколько аспектов аллергического воспаления. Основными цитокинами эффективного переключения иммунных клеток признаются IL — 10, IL — 35, TGF-β [3]. Т-регуляторным лимфоцитам принадлежит ключевая роль в формировании и поддержании иммунологической толерантности к экзогенным антигенам, включая аллергены. К ним относятся субпопуляции Т-клеток CD4+, иммуносупрессорная активность которых обусловлена способностью продуцировать цитокины IL-10 и TGF-β и наличием ингибиторных поверхностных молекул (CTLA4 и PD1) [1]. Распознавание антигена Treg-клетками и дальнейшее активное подавление ими других клеток, в частности эффекторных Т-лимфоцитов, является необходимым условием для полного установления Т-клеточной толерантности [10]. Так, увеличение количества аллерген-специфических Treg-клеток и уменьшение количества эффекторных Th2-клеток в крови обнаруживалось как при длительном наблюдении за лицами, подвергающимися воздействию высоких доз антигена (пчеловоды), так и в исследованиях, изучавших иммунный ответ при проведении АИТ [11—13], что сопровождалось улучшением клинических показателей [14]. Более того, продемонстрирован защитный эффект адаптивного переноса Treg-клеток при Т-клеточно-опосредованных заболеваниях на анималистических моделях [15].
В многочисленных исследованиях изучены и описаны нарушения баланса и функциональной активности различных субпопуляций Treg-лимфоцитов при большинстве аллергических заболеваний (фолликулярные регуляторные клетки, IL-5+IL-13+CD27-CD161+CD4+, ST2+CD45RO+CD4+, FOXP3+ Helios+ CD25+ CD127-, Тreg-ILT3+, Treg-IL-22+, Treg-IL-10+ и др.) с последующей нормализацией их количественных и качественных характеристик на фоне успешного проведения АИТ [16—18]. Кроме того, на примере пищевой аллергии показано, что проведение подкожной АИТ приводит к образованию тканевой популяции LAP+Foxp3-Treg-клеток в слизистой оболочке пищеварительного тракта, которые TGFβ-зависимым путем подавляют местную активность тучных клеток, что подтверждает иммунную взаимосвязь между кожей и ЖКТ и определяет новые потенциальные механизмы действия АИТ [19]. Механизм в общем свойственен адаптивному иммунному ответу: любая вакцинация или контакт с антигеном индуцирует системный иммунный ответ за счет миграции дендритных клеток и лимфоцитов из центральных органов иммунной системы в периферические.
Регуляторные В-клетки (Breg)
Помимо Т-клеточного ответа, в индукции толерантности на фоне АИТ в настоящее время активно изучается роль регуляторных В-клеток — иммуносупрессивных В-лимфоцитов, оказывающих контролирующее влияние на развитие избыточного (в том числе, аллергического) воспаления путем выработки ИЛ-10, TGF- β и IL-35 [1]. ИЛ-10 поддерживает дифференцировку регуляторных Т-клеток, подавляет провоспалительный ответ, продукцию IgE — антител и усиливает образование IgG4 — антител [20]. Человеческие В-клетки, продуцирующие ИЛ-10, характеризуются высокой экспрессией рецепторов CD25 и CD71, сниженной экспрессией рецепторов CD73 на клеточной поверхности [21]. В недавних исследованиях продемонстрировано 2—5 кратное увеличение количества таких аллерген-специфических регуляторных В-клеток в крови пациентов с аллергией на яд перепончатокрылых и с аллергией на арахис в течение нескольких месяцев после начала проведения АИТ [22, 23]. Кроме того, часть Breg-клеток, экспрессирующих ИЛ-10 и антагонист рецепторов ИЛ-1, вносят вклад в формирование толерантности к аллергенам не только путем подавления синтеза IgE — антител, но и за счет влияния на функцию дендритных клеток и это крайне важный феномен. Спаринговый эффект в отношении дендритных клеток даёт возможность надеяться на общее изменение цитокинового профиля, снижение уровня аллергического воспаления, что обеспечивает дополнительное влияние на симптомы и течение других воспалительных заболеваний и уменьшение риска будущих сенсибилизаций, т.к. новые наивные иммунные клетки будут контактировать с толерогенными макрофагами, презентирующими антиген [21].
Дендритные клетки (DC-клетки)
DC как специализированные антиген-презентирующие клетки, также обладают способностью, с одной стороны, инициировать и усиливать аллергическое воспаление, с другой — поддерживать развитие толерантности путем регуляции Т-клеточного ответа [1, 24]. Толерогенный подтип дендритных клеток (tDC-клетки) может стимулировать образование Treg-клеток из необученных Т-клеток, а также стимулировать расширение популяции Treg-лимфоцитов [25, 26]. В исследованиях продемонстрировано, что tDC-клетки способны подавлять аллергическое воспаление дыхательных путей [27], а также принимать участие в транспорте аллергенов в регионарные лимфатические узлы и активации антиген-специфических Treg-клеток в ходе проведения оральной АИТ [28]. Таким образом, поскольку дендритные клетки способствуют формированию толерантности к аллергенам и действуют как связующее звено между врожденным и адаптивным иммунным ответом, использование их свойств может предоставить новые возможности для таргетной терапии не только пациентов с аллергией, но и с другими иммуно-опосредованными патологическими состояниями.
Клетки естественного иммунитета
Натуральные киллеры (NK-клетки). В настоящее время имеются доказательства вовлечения в процессы формирования иммунологической толерантности NK-клеток — субпопуляции лимфоцитов, обладающей цитотоксическим действием в отношении опухолевых и инфицированных вирусами клеток и принимающей участие в развитии воспаления и иммунорегуляции посредством выработки цитокинов [29]. Одна из субпопуляций этих клеток, продуцирующая ИЛ-10 (регуляторные NK-клетки), способна ограничивать реакцию антиген-специфических Т-клеток, а также обладает иммунорегуляторным механизмом стимуляции HR2-рецепторов на индуцибельных NK-Т-клетках с последующим подавлением их активности [30, 31], что может вносить вклад в достижение иммунологической толерантности при проведении АИТ.
Врожденные лимфоидные клетки (ILC-клетки) — относительно недавно обнаруженный новый субкласс лимфоцитов, не имеющие специфических антигенных рецепторов, что не позволяет отнести их к T или B — популяциям. Эти клетки обладают значительным функциональным разнообразием, делятся в зависимости от поверхностных маркеров, факторов транскрипции и продуцируемых цитокинов (по аналогии с Th-лимфоцитами) на 3 группы — ILC1, ILC2, и ILC3 и участвуют в патогенезе как аллергических, так и неаллергических воспалительных заболеваний [32]. В процессе развития аллергических заболеваний ILC2-клетки синтезируют цитокиновый профиль, сходный с профилем Th2-клеток. Высокий уровень представленности GATA-связывающего белка 3 (GATA3) в ILC2, стимулирует образование слизи, развитие эозинофилии и формирование скоплений тучных клеток [33]. Нарастающее количество данных о роли ILC2-клеток в развитии аллергии способствует повышению интереса к изучению их функций при проведении АИТ. Так, показано, что проведение АИТ приводит к значительному снижению количества ILC2-клеток периферической крови или подавляет их сезонное повышение у пациентов с аллергическим ринитом по сравнению с контролем [34, 35]. Кроме того, ILC2-клетки способны трансформироваться в ILCreg-клетки IL-10+ под действием ретиноевой кислоты в тканях дыхательных путей [36], а также вносить вклад в процессы иммунорегуляции в кишечнике [37]. Интересно, что другая субпопуляция врожденных лимфоидных клеток — ILC3-клетки экспрессируют лиганд CD40 и, действуя совместно с B-клетками, стимулирует развитие незрелых переходных Breg-клеток, роль которых в развитии толерантности упоминалась выше [1].
Все эти популяции регуляторных клеток в процессе проведения АИТ приводят к формированию единой супрессорной среды, обеспечивающей изменения в реализации гуморального иммунного ответа. Первоначальное временное повышение аллерген-специфических IgE при длительной АИТ сменяется снижением их уровня в периферической крови, что может способствовать долгосрочной клинической толерантности [38]. На фоне преобладания ингибиторных цитокинов и снижения уровня IgE повышается порог активации дегрануляции тучных клеток и базофилов, что происходит уже на раннем этапе десенсибилизации [1].
Одновременно с клеточными механизмами, реализуются гуморальные факторы иммунитета. Происходит раннее переключение активности В-клеток на выработку IgG — антител и, как следствие, увеличение количества IgG4-антител, которые захватывают аллерген до того, как он достигает IgE на поверхности тучных клеток или базофилов, что является важным механизмом иммунологической толерантности, предотвращающим активацию и дегрануляцию этих клеток. В то же время, имеются подтверждения участия и других подклассов IgG (в частности, IgG2-антител) в механизмах формирования толерантности к аллергенам в процессе АИТ [39]. Конкурентные отношения аллерген-специфических IgE и IgG в процессе связывания аллергена была продемонстрирована в недавнем исследовании [40], показавшем, что увеличение соотношения IgG/IgE путем прямого введения рекомбинантных аллергенспецифических антител IgG является хорошо переносимым и эффективным способом уменьшения выраженности проявлений аллергии.
Вследствие индукции аллерген-специфической толерантности происходит подавление активности Th2-клеток и снижение концентрации вырабатываемых ими цитокинов (например, IL-4, IL-5 и IL-13), а также супрессия пролиферации T-клеток [41]. В исследовании на мышах было выявлено снижение уровня GATA3, являющегося основным регулятором Th2-клеток, и повышение уровня FoxP3, фактора транскрипции Treg; эти изменения коррелировали со стойким защитным эффектом АИТ [42]. Поздний этап десенсибилизации характеризовался уменьшением количества тучных клеток и эозинофилов, присутствующих в тканях.
Важно отметить, что клиническая эффективность АИТ зависит от большого количества разнообразных эндогенных и экзогенных факторов, оказывающих влияние на механизмы формирования иммунологической толерантности, и в первую очередь, от вида и способа введения аллергена. Например, в настоящее время активно изучается эффективность иммунотерапии у пациентов с аллергией, проживающих в различных условиях, что необходимо для понимания влияния окружающей среды на иммунный ответ в период проведения АИТ. В одном из недавних исследований [43] проведен ретроспективный анализ эффективности трехлетней подкожной АИТ по поводу АР и/или БА у 87 детей в возрасте от 8 до 16 лет, проживающих на ферме и в городской местности. Дети из фермерских районов отвечали на терапию достоверно лучше по сравнению с остальными. Поправка на влияние пола и типа аллергии показала, что проживание на фермах было независимым фактором, который связан со значительным улучшением общего балла клинических проявлений после иммунотерапии — ОШ 10,9 (ДИ 95%: 3,7 до 32,2). Результаты исследования продемонстрировали защитное влияние так называемого «фермерского окружения» на эффективность АИТ у детей с астмой и аллергическим ринитом.
Тесная взаимосвязь между генетической основой, ее реализацией в клинический иммунологический фенотип под воздействием внешних факторов среды делает крайне сложным прогноз формирования толерантности у конкретного пациента. Отчасти клинические исследования, проведенные на больших популяциях, позволяют усреднить этот показатель. Результаты любых исследований следует трактовать осторожно, понимая, что в исследуемых группах будут пациенты с девиантным иммунным ответом как в положительную, так и в отрицательную стороны.
2.2. Особенности иммунологических механизмов АИТ в зависимости от способа введения аллергена
Подкожное введение аллергена
Большинство исследований иммунологических механизмов иммунотерапии проведены на пациентах, получавших подкожное введение аллергена, что считается в настоящее время золотым стандартом АИТ. Такой метод лечения подтвердил свою высокую эффективность при различных аллергических заболеваниях, хотя и сопряжен с некоторыми нежелательными явлениями и организационными неудобствами (необходимость парентерального введения аллергена и проведения процедуры в аллергологическом кабинете) [3]. Большинство исследований подтвердили иммуно-регуляторный эффект подкожной иммунотерапии и ее влияние на популяцию Treg-лимфоцитов. Показано, что подкожная иммунотерапия, помимо системного эффекта, индуцирует локальный рост количества FOXP3+CD25+ регуляторных клеток в назальной слизи получавших лечение пациентов [44].
Новые подходы в иммунотерапии, направленные на улучшение ее эффективности при одновременном сохранении безопасности, помимо использования модифицированных аллергенов, нового поколения адьювантов/носителей, включают также и изучение новых путей введения аллергена, к которым относятся оральное, сублингвальное, внутрилимфатическое, эпикутанное, внутрикожное, а также локальное назальное введение [2]. При этом, независимо от пути введения аллергена продемонстрировано влияние иммунотерапии на обе (раннюю и позднюю) фазы иммунного ответа, что сопровождается снижением активации тучных клеток и базофилов, однако при проведении подкожной иммунотерапии аллергеном яда перепончатокрылых это происходит в течение нескольких часов, а при оральной иммунотерапии может занимать от 3 до 4 месяцев [45].
Внутрикожная иммунотерапия
Во многих исследованиях показала себя как безопасный метод лечения, приводящий к улучшению клинических симптомов аллергии после введения даже нескольких доз аллергена и, как и подкожная иммунотерапия, оказывающий иммунорегуляторный эффект. При изучении эффективности внутрикожной иммунотерапии аллергеном тимофеевки луговой была продемонстрирована супрессия поздней фазы кожного ответа, а также повышение уровня сывороточных специфических IgE по сравнению с контролем, хотя клиническая эффективность в данном исследовании не была доказана [46]. Т-лимфоциты в образцах крови у пациентов, прошедших курс внутрикожной иммунотерапии, имели более высокий уровень экспрессии поверхностного Th2-маркера CRTH2 и более низкий уровень экспрессии Th1-маркера CXCR3. При этом, подавление отсроченного кожного ответа у этих пациентов сохранялось в течение 7 месяцев после окончания курса терапии.
Оральная иммунотерапия
ОИТ предполагает регулярное оральное введение небольших, но постоянно увеличивающихся доз пищевого аллергена и в настоящее время активно изучается в качестве потенциального метода лечения аллергии на арахис, яйцо и коровье молоко [47].
Одним из нерешенных вопросов патогенеза АИТ является гипотеза о том, возникают ли популяции десенсибилизированных клеток de novo или «патологические» клетки экспрессируют новые «толерогенные» рецепторы и цитокины. Одно из недавних исследований, основанное на изучении экспрессии специфических рецепторов к арахису (TCR класса β) у получающих ОИТ субъектов, показало, что индуцированная арахисовым аллергеном пролиферация клеток приводит к чрезвычайно разнообразному поликлональному ответу — разнообразным рецепторам на поверхности [48]. При этом согласованные клоны составляют лишь небольшую долю Т-клеточного ответа, но именно они являются наиболее стойкими и повторяемыми сочетаниями. ОИТ арахисом меняет распределение этой постоянной фракции аллерген-специфических Т-лимфоцитов, подтверждая гипотезу замещения Т-клеток, как основного механизма оральной иммунотерапии пищевыми аллергенами. Этот эксперимент дает надежду, что толерогенная популяция регуляторных T — клеток формируется в ходе проведения АИТ и может сохраняться длительно, но сроки жизни этих клеток не определены и пока неясно, можно ли при этом добиться формирования стойкой толерантности [47].
Сублингвальная иммунотерапия
СЛИТ предполагает регулярное введение и удерживание экстракта аллергена под языком в течение 1—2 минут перед проглатыванием экстракта. Аллергены проходят через слизистую оболочку за 15–30 минут, затем захватываются толерогенными дендритными клетками и обрабатываются в виде небольших пептидов. Затем через лимфатическую систему реализуется системный иммунный ответ, вызывающий раннее уменьшение дегрануляции тучных клеток и базофилов [3]. Недавнее исследование Tanaka с соавторами показало, что находящиеся в ротовой полости CD103–CD11b+ классические дендритные клетки принимают участие в транспорте сублингвального антигена в подчелюстные лимфатические узлы и индукции антиген-специфических Treg [49]. В моделях на сенсибилизированных к молоку мышах продемонстрирована выраженная индукция Treg клеток при проведении СЛИТ в сочетании с интраперитонеальным введением ИЛ-2 [50].
СЛИТ показала свою безопасность, эффективность, быстрое достижение положительного эффекта при отсутствии необходимости фазы наращивания дозы. Точнее доза при СЛИТ используется изначально крайне высокая, но период наращивания дозы может быть сокращен до минимального за счет меньшей реактогенности слизистых. Поскольку в исследованиях продемонстрирован эффект профилактики развития астмы и формирования новой сенсибилизации, СЛИТ показана пациентам с аллергическим ринитом, связанным с аллергией на пыльцевые аллергены и клещей домашней пыли [51]. Косвенные данные Кохрейновского мета-анализа показали, что СЛИТ, так же как подкожная иммунотерапия, высоко эффективна у пациентов с сезонным аллергическим ринитом при отсутствии однозначных доказательств их эффективности при круглогодичном рините. В то же время, неоднозначность интерпретации выводов исследования могла быть связана с различными ограничениями, включающими неоднородность группы пациентов с круглогодичными симптомами аллергии, географическую вариацию представленности присутствия аллергенов в окружающей среде, различие научных стандартов более ранних и современнымх исследований, что могло заметно повлиять на результаты сравнения. Вопросы эффективности и сопоставимости результатов рассмотрены ниже в соответствующем разделе, где приведены данные о стойком эффекте влияния СЛИТ на симптомы ринита, вызванного клещами пыли и пыльцы растений [52].
Прямое внутрилимфатическое введение аллергена
ВЛИТ характеризуется быстрым достижением клинической эффективности и высоким профилем безопасности АИТ, а также значительно повышает ее эффективность за счет сокращения количества введений и продолжительности лечения [53]. В долговременном исследовании интралимфатическое введение 3 доз аллергена луговых трав общей дозой 3000 SQ-U в течение 2 месяцев по эффективности было сопоставимо с традиционным лечением в течение 3 лет (кумулятивная доза ≈ 4 млн. SQ-U). По сравнению с подкожной иммунотерапией, ВЛИТ увеличивает секрецию ИЛ-1, ИЛ-4, ИЛ-10 и ИФН-γ [54]. Одно из недавних исследований показало высокую клиническую эффективность ВЛИТ у пациентов с пыльцевой и эпидермальной (аллерген кошки) аллергией, хотя при этом была отмечена возможность развития серьезных системных/локальных реакций у некоторых гиперчувствительных пациентов [55]. Риски, связанные с парентеральным введением, ограничивают распространение этого метода. В 2016 проведены более поздние исследования, которые показали безопасность при предсезонном введении аллергена в паховые лимфоузлы, сравнимую с плацебо, однако надо учитывать, что исследование проводилось высококлассными специалистами и на маленькой когорте пациентов (n=36), что не позволяет делать окончательные выводы о рисках анафилаксии [56].
Эпикутанная иммунотерапия
ЭПИТ — введение аллергена в организм происходит с помощью закрепляемых на коже пластырей. В различных клинических исследованиях такой путь доставки в ходе АИТ использовался для пыльцевых аллергенов, клещей домашней пыли и некоторых пищевых продуктов (коровье молоко и арахис) [57]. Campana R. (2017) приводит данные, что эпикутанная иммунотерапия у пациентов с аллергией на пыльцу березы с положительными аппликационными пробами приводила к существенному и значительному увеличению пролиферации аллерген-специфических Т-лимфоцитов (CLA+ and CCR4+ T-клеточный ответ), но не изменяла Bet v 1-специфический IgE и IgG ответы [58]. В противоположность этому исследования, в работе Jones S.M. (2017) ЭПИТ аллергеном арахиса приводила к увеличению уровней специфических IgG4 и соотношения IgG4/IgE у пациентов с аллергией на арахис, наряду с тенденцией к снижению активации базофилов и продукции арахис-специфических Th2 цитокинов [59]. Вопрос о стойкости защитного эффекта и необходимости поддержания защитного уровня антител остается не до конца решенным.
Продемонстрировано, что после эпикутанной иммунизации овальбумином (OVA) и аллергеном арахиса (CpG) продукция OVA-специфического IgE снижалась, а продукция IgG2a повышалась при подавлении ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-13 ответов и пероксидазной активности эозинофилов [60]. При этом снижение синтеза IgE зависело от TCRαβ + CD4 + CD25− клеток, а увеличение продукции IgG2a было связано с количеством как TCRαβ+, так и TCRγδ+ Т-клеток. Дальнейшие эксперименты показали, что наблюдаемые эффекты являются зависимыми от гена первичного ответа миелоидной дифференцировки–88, ИФН-γ и ИЛ-17A. Еще одно наблюдение за пациентами с пищевой аллергией показало, что эпикутанное нанесение аллергена в ходе реализации хоуминг-эффекта приводило к генерации популяции гастроинтестинальных самонаводящихся LAP+Foxp3− Treg клеток [60]. Тучные клетки подавлялись Treg клетками TGFβ-зависимым путем при отсутствии прямого влияния на ответ Т- и В-клеток. Эти данные подчеркивают наличие иммунной коммуникации между кожей и желудочно-кишечным трактом и определяют новые механизмы, с помощью которых формирование толерантности в ходе ЭПИТ может подавлять вызванную пищевыми аллергенами анафилаксию.
Поскольку мишенью эпикутанного введения аллергена являются эпидермальные клетки Лангерганса, ЭПИТ характеризуется низкой частотой как местных, так и системных нежелательных явлений [57].
Локальная назальная иммунотерапия
По всей видимости, может быть эффективна только при симптомах аллергического ринита и предполагает использование специальной техники введения аллергена, в связи с чем использование такого способа АИТ прогрессивно снижается [62].
Заключение. Классическими и наиболее эффективными методами признаются подкожная и сублингвальная иммунотерапия. По этим методикам введения накоплено наибольшее количество информации, существуют систематические обзоры, показывающие эффективность и безопасность методов. Отличные от единого стандарта методы оценки эффективности терапии, стандартизации аллергена и различные пути введения аллергенов затрудняют сравнение препаратов между собой. Этот же постулат верен в отношении оценки влияния АИТ на исходы заболевания.
Необходимо отметить, что кроме прямых клинических и иммунологических эффектов в исследованиях сублингвальная, оральная и эпикутанная иммунотерапия индуцировали эпигенетические изменения, включая гипометилирование в промоторной области FoxP3 Treg клеток, ответственные за супрессивные функции и длительную индукцию Treg [63, 64]. В элегантной работе Syed A. (2014) пациенты, получавшие ОИТ арахисом были разделены на тех, кто ответил на терапию и нетолерантных пациентов. В обеих группах концентрации антител IgG, IgE к арахису не отличались достоверно между участниками, принимая во внимание очень небольшие группы пациентов. Далее, через 3 месяца после повторной пробы, у части пациентов из группы, ответившей на терапию, симптомы вернулись. Таким образом было установлено, что у лиц с возвратом клинических проявлений, достоверно выше частота метилирования FOXP3 CpG участка гена в Тreg — клетках [63]. Исследование тесно связано с работой M.Pawlowski (2016) о которой мы упоминали выше [43]. Протективный эффект окружения, жизни на ферме, видимо приводит к уменьшению воздействия на ДНК неблагоприятных факторов, правильной экспрессии FOXP3 рецептора на клетке и, в конечном итоге, способствует более стойкому эффекту иммунотерапии.
Механизмы иммунотерапии остаются не до конца изученными. Данные о взаимодействии между клетками постоянно расширяются сообразно развитию научного знания в области иммунологии и фундаментальной медицины.
Литература к разделу
1. Alvaro-Lozano M, Akdis CA, Akdis M, Alviani C, Angier E et al. EAACI Allergen Immunotherapy User’s Guide. Pediatr Allergy Immunol. 2020;25 (25):1—101.
2. Mitsias D, Xepapadaki P, Makris M, Papadopoulos N. Immunotherapy in allergic diseases — improved understanding and innovation for enhanced effectiveness. Curr Opin Immunol. 2020;66:1—8.
3. Sahin E, Bafageeh SA, Guven SG, Cetinkaya EA, Muluk NB, Coskun ZO et al. Mechanism of action of allergen immunotherapy. Am J Rhinol Allergy. 2016;30:1—3.
4. Вишнева Е. А., Намазова-Баранова Л. С., Алексеева А. А., Селимзянова Л. Р., Левина Ю. Г., Эфендиева К. Е., Добрынина Е. А. Аллергенспецифическа иммунотерапия у детей: современное состояние вопроса. Педиатрическая фармакология. 2016;13 (4):404—408.
5. Głobińska A, Boonpiyathad T, Satitsuksanoa P, Kleuskens M, van de Veen W, Sokolowska M, Akdis M. Mechanisms of allergen-specific immunotherapy: Diverse mechanisms of immune tolerance to allergens. Ann Allergy Asthma Immunol. 2018;121 (3):306—312.
6. Berings M, Karaaslan C, Altunbulakli C, Gevaert P, Akdis M, Bachert C, Akdis CA. Advances and highlights in allergen immunotherapy: On the way to sustained clinical and immunologic tolerance. J Allergy Clin Immunol. 2017;140 (5):1250—1267.
7. Novak N, Mete N, Bussmann C, Maintz L, Bieber T, Akdis M et al. Early suppression of basophil activation during allergen-specific immunotherapy by histamine receptor 2. J Allergy Clin Immunol. 2012; 130: 1153—1158.
8. Clay CD, Strait RT, Mahler A, Khodoun MV, Finkelman FD. Anti-FcγRIIB monoclonal antibody suppresses murine IgG-dependent anaphylaxis by Fc domain targeting of FcγRIII. J Allergy Clin Immunol. 2018;141 (4):1373—1381.
9. MacGlashan J, Hamilton RG. Parameters determining the efficacy of CD32 to inhibit activation of FcepsilonRI in human basophils. J Allergy Clin Immunol. 2016; 137: 1256—1258.
10. Legoux FP, Lim JB, Cauley AW et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T cells rather than deletion. Immunity. 2015;43:896—908.
11. Meiler F, Zumkehr J, Klunker S, Ruckert B, Akdis CA, Akdis M. In vivo switch to IL-10-secreting T regulatory cells in high dose allergen exposure. J Exp Med. 2008;205 (12):2887—2898.
12. Ryan JF, Hovde R, Glanville J, Lyu SC, Ji X, Gupta S et al. Successful immunotherapy induces previously unidentified allergen-specific CD4+ T-cell subsets. Proc Natl Acad Sci USA. 2016;113:E1286-E1295.
13. Suarez-Fueyo A, Ramos T, Galan A et al. Grass tablet sublingual immunotherapy downregulates the TH2 cytokine response followed by regulatory T-cell generation. J Allergy Clin Immunol. 2014;133:130—138.
14. Boonpiyathad T, Sokolowska M, Morita H, et al. Der p 1-specific regulatory T-cell response during house dust mite allergen immunotherapy. Allergy. 2019;74:976—985.
15. Palomares O, Martin-Fontecha M, Lauener R, et al. Regulatory T cells and immune regulation of allergic diseases: roles of IL-10 and TGF-beta. Genes Immun. 2014;15 (8):511—520.
16. Boonpiyathad T, Sokolowska M, Morita H, et al. Der p 1-specific regulatory T-cell response during house dust mite allergen immunotherapy. Allergy. 2019;74:976—985.
17. Ihara F, Sakurai D, Yonekura S, et al. Identification of specifically reduced Th2 cell subsets in allergic rhinitis patients after sublingual immunotherapy. Allergy. 2018;73 (9):1823—1832.
18. Layhadi JA, Eguiluz-Gracia I, Shamji MH. Role of IL-35 in sublingual allergen immunotherapy. Curr Opin Allergy Clin Immunol. 2019;19 (1):12—17.
19. Tordesillas L, Mondoulet L, Blazquez AB, Benhamou PH, Sampson HA, Berin MC. Epicutaneous immunotherapy induces gastrointestinal LAP+ regulatory T cells and prevents food-induced anaphylaxis. J Allergy Clin Immunol. 2017;139:189—201.
20. van de Veen W, Wirz OF, Globinska A, Akdis M. Novel mechanisms in immune tolerance to allergens during natural allergen exposure and allergen-specific immunotherapy. Curr Opin Immunol. 2017;48:74—81.
21. Stanic B, van de Veen W, Wirz OF et al. IL-10-overexpressing B cells regulate innate and adaptive immune responses. J Allergy Clin Immunol. 2015;135:771—780.
22. Boonpiyathad T, Meyer N, Moniuszko M et al. High-dose bee venom exposure induces similar tolerogenic B-cell responses in allergic patients and healthy beekeepers. Allergy. 2017;72:407—415.
23. Patil SU, Ogunniyi AO, Calatroni A et al. Peanut oral immunotherapy transiently expands circulating Ara h 2-specific B cells with a homologous repertoire in unrelated subjects. J Allergy Clin Immunol. 2015;136:125—134.
24. Shamji MH, Kappen JH, Akdis M et al. Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper. Allergy. 2017;72:1156—1173.
25. Pulendran B, Tang H, Manicassamy S. Programming dendritic cells to induce T (H) 2 and tolerogenic responses. Nat Immunol. 2010;11 (8):647—655.
26. Gordon JR, Ma Y, Churchman L, Gordon SA, Dawicki W. Regulatory dendritic cells for immunotherapy in immunologic diseases. Front Immunol. 2014;5:7.
27. Sun W, Wei JW, Li H, Wei FQ, Li J, Wen WP. Adoptive cell therapy of tolerogenic dendritic cells as inducer of regulatory T cells in allergic rhinitis. International forum of allergy & rhinology. 2018;8 (11):1291—1299.
28. Tanaka Y, Nagashima H, Bando K et al. Oral CD103 (-) CD11b (+) classical dendritic cells present sublingual antigen and induce Foxp3 (+) regulatory T cells in draining lymph nodes. Mucosal Immunol. 2017;10:79—90.
29. Deniz G, Akdis M, Aktas E, Blaser K, Akdis CA. Human NK1 and NK2 subsets determined by purification of IFN-gammasecreting and IFN-gamma-nonsecretingNK cells. Eur J Immunol. 2002;32 (3):879—884.
30. Deniz G, Erten G, Kucuksezer UC, et al. Regulatory NK cells suppress antigenspecific T cell responses. J Immunol. 2008;180 (2):850—857.
31. Ferstl R, Frei R, Barcik W, et al. Histamine receptor 2 modifies iNKT cell activity within the inflamed lung. Allergy. 2017;72 (12):1925—1935.
32. Globinska A, Kowalski ML. Innate lymphoid cells: the role in respiratory infections and lung tissue damage. Exp Rev Clin Immunol. 2017;13 991—999.
33. Kortekaas Krohn I, Shikhagaie MM, Golebski K, et al. Emerging roles of innate lymphoid cells in inflammatory diseases: Clinical implications. Allergy. 2018;73 (4):837—850.
34. Lao-Araya M, Steveling E, Scadding GW, Durham SR, Shamji MH. Seasonal increases in peripheral innate lymphoid type 2 cells are inhibited by subcutaneous grass pollen immunotherapy. J Allergy Clin Immunol. 2014;134 (5):1193—1195.
35. Fan DC, Wang XD, Wang CS, Wang Y, Cao FF, Zhang L. Suppression of immunotherapy on group 2 innate lymphoid cells in allergic rhinitis. Chin Med J (Engl). 2016;129:2824—2828.
36. Morita H, Kubo T, Ruckert B, et al. Induction of human regulatory innate lymphoid cells from group 2 innate lymphoid cells by retinoic acid. J Allergy Clin Immunol. 2019;143:2190—2201.
37. Wang S, Xia P, Chen Y, et al. Regulatory Innate Lymphoid Cells Control Innate Intestinal Inflammation. Cell. 2017;171 (1):201—216.
38. Scadding GW, Calderon MA, Shamji MH et al. Effect of 2 years of treatment with sublingual grass pollen immunotherapy on nasal response to allergen challenge at 3 years among patients with moderate to severe seasonal allergic rhinitis: The GRASS randomized clinical trial. JAMA. 2017;317:615—625.
39. Freiberger SN, Zehnder M, Gafvelin G, Gronlund H, Kundig TM, Johansen P. IgG4 but no IgG1 antibody production after intralymphatic immunotherapy with recombinant MAT-Feld1 in human. Allergy. 2016; 71: 1366—1370.
40. Orengo JM, Radin AR, Kamat V et al. Treating cat allergy with monoclonal IgG antibodies that bind allergen and prevent IgE engagement. Nat Commun. 2018;9:1421.
41. Ozdemir C, Kucuksezer UC, Akdis M, Akdis CA. Mechanisms of Aeroallergen Immunotherapy: Subcutaneous Immunotherapy and Sublingual Immunotherapy. Immunology and allergy clinics of North America. 2016;36 (1):71—86.
42. Mondoulet L, Dioszeghy V, Busato F et al. Gata3 hypermethylation and Foxp3 hypomethylation are associated with sustained protection and bystander effect following epicutaneous immunotherapy in peanut-sensitized mice. Allergy. 2019;74 (1):152—164.
43. Pawlowski M, Jerzynska J, Podlecka D, Stelmach W, Majak P, Stelmach I. Effectiveness of immunotherapy in children depends on place of living — A pilot study. Allergol Immunopathol (Madr). 2017;45 (3):272—275.
44. Radulovic S, Jacobson MR, Durham SR, Nouri-Aria KT. Grass pollen immunotherapy induces Foxp3-expressing CD4+ CD25+ cells in the nasal mucosa. J Allergy Clin Immunol. 2008;121:1467—1472.
45. Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology/PRACTALL consensus report. J Allergy Clin Immunol. 2013;131:1288—1296.
46. Slovick A, Douiri A, Muir R, Guerra A, Tsioulos K, Hay E et al. Intradermal grass pollen immunotherapy increases TH2 and IgE responses and worsens respiratory allergic symptoms. J Allergy Clin Immunol. 2017;139:1830—1839.
47. Mantyla J, Thomander T, Hakulinen A et al. The effect of oral immunotherapy treatment in severe IgE mediated milk, peanut, and egg allergy in adults. Immun Inflamm Dis. 2018;6:307—311.
48. Begin P, Nadeau KC. Changes in peanut-specific T-cell clonotype with oral immunotherapy. J Allergy Clin Immunol. 2015;135:1636—1638.
49. Tanaka Y, Nagashima H, Bando K et al. Oral CD103 (-) CD11b (+) classical dendritic cells present sublingual antigen and induce Foxp3 (+) regulatory T cells in draining lymph nodes. Mucosal Immunol. 2017;10:79—90.
50. Smaldini PL, Trejo F, Cohen JL, Piaggio E, Docena GH. Systemic IL-2/anti-IL-2Ab complex combined with sublingual immunotherapy suppresses experimental food allergy in mice through induction of mucosal regulatory T cells. Allergy. 2018;73:885—895.
51. Okamoto Y, Fujieda S, Okano M, Yoshida Y, Kakudo S, Masuyama K. House dust mite sublingual tablet is effective and safe in patients with allergic rhinitis. Allergy. 2017;72:435—443.
52. Durham SR, Penagos M. Sublingual or subcutaneous immunotherapy for allergic rhinitis? J Allergy Clin Immunol. 2016;137:339—349.
53. Patterson AM, Bonny AE, ShielsWE, Erwin EA. Three-injection intralymphatic immunotherapy in adolescents and young adults with grass pollen rhinoconjunctivitis. Ann Allergy Asthma Immunol. 2016;116:168—170.
54. Johansen P, von Moos S, Mohanan D, Kundig TM, Senti G. New routes for allergen immunotherapy. Hum Vaccin Immunother. 2012;8:1525—1533.
55. Lee SP, Choi SJ, Joe E et al. A pilot study of intralymphatic immunotherapy for house dust mite, cat, and dog allergies. Allergy Asthma Immunol Res. 2017;9:272—277.
56. Hylander T, Larsson O, Petersson-Westin U, et al. Intralymphatic immunotherapy of pollen-induced rhinoconjunctivitis: a double-blind placebo-controlled trial. Respir Res. 2016;17:10. doi:10.1186/s12931-016-0324-9
57. Aricigil M, Muluk NB, Sakarya EU et al. New routes of allergen immunotherapy. Am J Rhinol Allergy. 2016;30:193—197.
58. Campana R, Moritz K, Neubauer A et al. Epicutaneous allergen application preferentially boosts specific T cell responses in sensitized patients. Sci Rep. 2017;7 (1):11657.
59. Jones SM, Sicherer SH, Burks AW et al. Epicutaneous immunotherapy for the treatment of peanut allergy in children and young adults. J Allergy Clin Immunol. 2017;139:1242—1252.
60. Majewska-Szczepanik M, Askenase PW, Lobo FM, Marcinska K, Wen L, Szczepanik M. Epicutaneous immunization with ovalbumin and CpG induces TH1/TH17 cytokines, which regulate IgE and IgG2a production. J Allergy Clin Immunol. 2016;138:262—273.
61. Tordesillas L, Mondoulet L, Blazquez AB, Benhamou PH, Sampson HA, Berin MC. Epicutaneous immunotherapy induces gastrointestinal LAP+ regulatory T cells and prevents food-induced anaphylaxis. J Allergy Clin Immunol. 2017;139:189—201.
62. Passalacqua G, Canonica GW. Local nasal specific immunotherapy for allergic rhinitis. Allergy Asthma Clin Immunol. 2006;2:117—123.
63. Syed A, Garcia MA, Lyu SC et al. Peanut oral immunotherapy results in increased antigen-induced regulatory T-cell function and hypomethylation of forkhead box protein 3 (FOXP3). J Allergy Clin Immunol. 2014;133:500—510.
64. Mondoulet L, Dioszeghy V, Busato F et al. Gata3 hypermethylation and Foxp3 hypomethylation are associated with sustained protection and bystander effect following epicutaneous immunotherapy in peanut-sensitized mice. Allergy. 2019;74 (1):152—164
3.
Иммунологические особенности индуцированной толерантности у детей
Ключевые положения:
1. В настоящее время АИТ является общепризнанным методом лечения IgE — опосредованного аллергического ринита и астмы у пациентов всех возрастных групп старше 5 лет; применение этого метода в более раннем возрасте в условиях формирующегося иммунитета и склонности к Th2-реакциям пока недостаточно изучена.
2. Накопленные к настоящему времени данные свидетельствуют о достаточно высокой клинической эффективности и безопасности подкожной и сублингвальной иммунотерапии при аллергическом рините и бронхиальной астме в детской практике, при этом остается необходимость дополнительных исследований для подтверждения эффективности и долгосрочной клинической пользы применения АИТ у детей, особенно в раннем возрасте.
3. Существуют доказательства превентивного эффекта АИТ у детей: возможность предотвращать дебют бронхиальной астмы у пациентов с аллергическим ринитом, вызванным пыльцой деревьев и трав, по крайней мере в течение первых 2 лет после окончания АИТ. В настоящее время получены разнородные данные, касающиеся превентивного действия АИТ у пациентов разных возрастных групп.
Аллерген-специфическая иммунотерапия (АИТ) в настоящее время признана единственным клинически эффективным, болезнь-модифицирующим способом лечения IgE-опосредованных аллергических заболеваний (ринита, астмы, пищевой аллергии), обеспечивающим достижение продолжительного эффекта, сохраняющегося после прекращения лечения [1]. Накоплено существенное количество данных, доказывающих эффективность и длительное поддержание эффекта лечения при применении АИТ у взрослых, однако лишь небольшое количество исследований было проведено у детей. В настоящее время АИТ назначается во всем мире как взрослым, так и детям, хотя использование этого метода в педиатрической практике в условиях формирующегося иммунитета и склонности к Th2-реакциям продолжает обсуждаться.
Несмотря на большое количество исследований, проведённых с целью изучения механизмов действия АИТ, многие вопросы до сих пор остаются не выясненными. При этом подавляющее большинство таких исследований осуществляется в популяции пациентов старше 18 лет. В педиатрической практике накоплено меньше данных о механизмах АИТ и их отличиях от таковых у взрослых. Кроме того, формирование индуцированной толерантности может отличаться у детей разного возраста в соответствии с периодами развития иммунной системы ребенка.
В настоящее время официальные клинические рекомендации и согласительные документы определяют возраст 5 лет и старше как оптимальный для возможного начала проведения АИТ. Связано это с особенностями созревания иммунного ответа у детей раннего возраста, а также со сложившейся практикой клинических исследований, при которых пациент должен сообщить о жалобах после приема аллергена и быть способен выполнять указания родителей и врача. Дети раннего возраста не способны быстро оценить свое состояние и дать вербальную обратную связь исследователю.
Известно, что иммунная система новорожденного является относительно незрелой, её созревание наиболее активно происходит в течение первых лет жизни ребёнка и напрямую связано с воздействием множества инфекционных и неинфекционных факторов, воздействующих на организм развивающегося малыша. До 5 лет наблюдается поляризация иммунного ответа в сторону Th2 клеток, что может частично объяснить высокую частоту развития пищевой аллергии и дебют многих аллергических болезней именно в детском возрасте [2].
Механизмы врождённого иммунитета (клеточные элементы — нейтрофилы, моноциты, макрофаги, врождённые лимфоидные клетки, натуральные киллеры и дендритные клетки; система комплемента) представляют собой первую линию защиты ребёнка от инфекционных патогенов. Они развиваются и частично созревают ещё в периоде внутриутробного развития, но в различное время, поэтому функциональная активность механизмов врождённого иммунитета в первые годы жизни, особенно в период новорождённости, слабее, чем у детей старшего возраста и взрослых [3]. Это может обусловливать как высокую восприимчивость к инфекционным заболеваниям, так и несовершенство процессов формирования толерантности.
Ещё более выраженные особенности иммунного реагирования у детей касаются формирования и развития адаптивной иммунной системы. К ним относятся функциональная незрелость Т-клеточного звена с преобладанием Th2-реакций и низкой продукцией Th1- и Treg- цитокинов (ИЛ-10, TGFβ), недостаточная способность к дифференцировке В-лимфоцитов, эффективному антительному ответу (в частности продукции IgG и IgA) и формированию иммунологической памяти. Низкая функциональная активность механизмов местного иммунитета связывается с неспособностью связать аллерген\антиген на слизистой, что облегчает его проникновение в лимфоидные фоликулы. Эти особенности усугубляются у детей с атопическими заболеваниями по причине дополнительной поляризации иммунитета в сторону Th-2 хелперов. Выше приведённые особенности могут привести к удлинению периода иммунологического созревания ребенка-атопика [4].
В связи с этим предполагается, что при проведении АИТ у детей младшего возраста эффективный ответ на иммунотерапию в виде восстановления иммунологической толерантности к аллергенам за счёт уменьшения количества эффекторных клеток, индукции ответов регуляторных Т- и В-клеток и продукции аллерген-специфических антител может не быть достигнут [5]. Результаты проведённых в педиатрической группе пациентов исследований подвергают сомнению эти выводы. Из практики известно, что именно в раннем возрасте формируются процессы толерантности к антигенам. Опыт вакцинации детей первого года жизни показывает, что несмотря на необходимость повторных введений вакцины, иммунологическая память является достаточно стойкой и позволяет защитить организм с помощью механизмов адаптивного иммунитета. Клинические исследования, посвящённые АИТ у детей демонстрируют достаточно высокую клиническую эффективность подкожной и сублингвальной иммунотерапии при аллергическом рините и бронхиальной астме, что может косвенно свидетельствовать об идентичности механизмов иммунного ответа на АИТ у взрослых и детей старшего возраста.
Результаты недавно опубликованного систематического обзора подтвердили эффективность подкожной и сублингвальной иммунотерапии у детей с сезонным аллергическим ринитом, вызванным пыльцой трав, и круглогодичным аллергическим ринитом, вызванным клещом домашней пыли (КДП), хотя к настоящему времени не опубликовано результатов долгосрочного проспективного наблюдения с большим числом участников за детьми в течение 10 и более лет [6].
Также, мета-анализ и систематический обзор данных показал, что сублингвальная АИТ клинически эффективна в отношении симптомов сезонного и круглогодичного аллергического ринита как у детей (-0.52 [-0.94, -0.10]), так и у взрослых (-0.44 [-0.56, -0.31]), причем в детской практике результаты были более убедительными [7].
Эффективность иммунотерапии АИТ клещами пыли и пыльцой подробно рассмотрена в соответствующих разделах. Здесь позволим себе отметить, что при использовании современных препаратов пациенты отмечают положительный эффект от терапии. В исследованиях кроме клинической эффективности часто изучаются иммунологические сдвиги после терапии. Показано, что СЛИТ с использованием таблеток с аллергеном КДП (Акаризакс, ALK) характеризовалась хорошей переносимостью и приводила к снижению выраженности симптомов ринита, вызванного КДП [8]. Схожие результаты получены при проведении терапии сублингвальными каплями аллергена 300 IR (Stallergenes) [9]. Кроме того, в исследовании эффективности 5-летней СЛИТ аллергеном тимофеевки (75000 SQ-T, Гразакс, ALK) у детей с аллергическим риноконьюнктивитом, вызванным пыльцой трав, продемонстрировано уменьшение выраженности клинических симптомов в группе, получавшей лечение, по сравнению с группой плацебо на 30%, снижение потребности в фармакотерапии на 27%, а также снижение уровня общего и специфического IgE и подавление реактивности, определяемой с помощью кожных прик-тестов [10].
Одновременно в вышеприведённых наблюдениях проведено изучение цитокинового и хемокинового профиля и антительного ответа у детей с аллергическим риноконьюнктитвитом, получавших в течение 3 лет сублингвальные таблетки, содержащие аллерген пыльцы трав (Гразакс, ALK). Оказалось, что к концу курса лечения и через 2 года после окончания иммунотерапии пациенты имели значительно более высокие уровни специфических локальных IgA в слюне и IgG4 в сыворотке крови, а также Th1-ассоциированных хемокинов CXCL10 и CXCL11 в плазме крови по сравнению с группой контроля [11]. Результаты были сравнимы с полученными у взрослых. Отношение индуцированных пыльцой трав IL-5/IL-13 к IFN-γ было значительно сниженным после окончания курса лечения, так же как и клинические проявления аллергического ринита. Часть пациентов отмечали снижение выраженности симптомов без значимых иммунологических изменений, у других несмотря на хороший антительный ответ, клиническая симптоматика изменялась мало, и это не позволило сделать заключение об устойчивой корреляции между клиническими исходами и иммунологическими параметрами.
Симметричное исследование VO53, включало 633 пациента, в нем исследовалась долгосрочная эффективность аллергена смеси 5 трав (Оралейр, 300 IR, StallergenesGreer) — продемонстрировавшего устойчивую эффективность таблеток смеси 5 трав 300 ИР в двух режимах дозирования с рандомизацией на группы со стартом за 2 и 4 месяца до сезона палинации по предсезонно-сезонному протоколу в течении 3-х сезонов палинации и последующих 2-х лет контроля симптомов и потребности в медикаментах (с плацебо-контролем). Данное долгосрочное исследование показало устойчивый эффект в уменьшении симптомов риноконьюктивита, снижении потребности в медикаментах и улучшение качества жизни вследствие уменьшения симптомов ринита у всех групп пациентов, получающих СЛИТ 300 ИР, включая пациентов со среднетяжелой астмой и полисенсибилизированных [6, 22]. В исследовании не исследовался цитокиновый профиль и динамика иммуноглобулинов,
Имеющиеся в настоящее время данные свидетельствуют о необходимости дополнительных клинических исследований для подтверждения и валидации эффективности и долгосрочной клинической пользы применения АИТ у детей, особенно в раннем возрасте.
Несмотря на то, что некоторые клинические исследования продемонстрировали эффективность и безопасность сублингвальной терапии аллергенами и мономерными аллергоидами у детей в возрасте от 3 лет, на момент публикации не существует консенсуса в отношении проведения АИТ у детей до 5-летнего возраста [12, 13].
Подкожная иммунотерапия, которая считается золотым стандартом АИТ, имеет ряд организационных недостатков в педиатрической практике. Следует иметь в виду, что повторные инъекционные введения аллергена могут оказывать негативное, а иногда и травмирующее влияние на состояние маленького ребёнка и его родителей, что приводит к проблемам с коммуникацией и приверженностью к лечению. Все медицинские вмешательства в младшей возрастной группе следует с особой тщательностью оценивать по соотношению польза/риск в каждом конкретном случае.
Превентивный эффект АИТ в отношении новых сенсибилизаций и прогрессирования текущего аллергического заболевания является предметом дискуссий. Хорошо известно, что отягощённый по атопии семейный анамнез является важнейшим фактором риска аллергического заболевания у ребёнка, а дети с сенсибилизацией или клиническими проявлениями атопического дерматита, пищевой аллергии и аллергического ринита подвержены повышенному риску других аллергических заболеваний (например, бронхиальной астмы) и дополнительной сенсибилизации. Поиск эффективной стратегии профилактики аллергии, предотвращение развития атопического марша, расширения спектра сенсибилизации и присоединения новых клинических симптомов у детей с уже имеющимися аллергическим заболеваниями — является приоритетной задачей современной аллергологии. С этой точки зрения АИТ представляет для исследователей серьёзный интерес, поскольку обладает болезнь-модифицирующим действием, приводит к индукции иммунологических и клинических эффектов, сохраняющихся и после прекращения лечения.
Перед исследователями и врачами встаёт вопрос: может ли АИТ обеспечивать превентивный эффект в различных клинических ситуациях: у здоровых детей и взрослых; у детей с ранними проявлениями пищевой аллергии и дерматита; у детей старшего возраста и подростков с аллергическим ринитом; у женщин, планирующих беременность и получающих АИТ с целью снижения риска возникновения аллергии у будущего ребёнка. Все эти сценарии применения АИТ представлены в Руководстве по аллергенной иммунотерапии для профилактики аллергических заболеваний, опубликованном в 2017 году [14]. Его целью является представление систематического обзора и обсуждение имеющихся в настоящее время доказательных данных в отношении использования АИТ для предотвращения развития аллергии.
При анализе накопленных к настоящему моменту данных оказалось, что результаты многих исследований неубедительны, часто противоречивы и не могут лежать в основе создания конкретных клинических рекомендаций. Авторы руководства не нашли убедительных доказательств эффективности использования АИТ для предотвращения развития аллергического заболевания у здоровых детей и взрослых, для профилактики развития респираторной аллергии у детей раннего возраста с АтД, а также использования АИТ у женщин, планирующих беременность, для предотвращения аллергии у ребёнка. В то же время, совокупный анализ результатов нескольких рандомизированных контролируемых исследований [15] и нерандомизированных исследований, оценивавших применение АИТ в реальной клинической практике [16], позволяет рассчитывать на превентивное воздействие ПКИТ и СЛИТ на дебют бронхиальной астмы у детей старшего возраста и подростков с уже имеющимся аллергическим ринитом. Данные были получены Zielen S (2018) при анализе баз данных пациентов после проведенных курсов иммунотерапии равзличными препаратами.
В отношении симптомов ринита, вызванным пыльцой луговых трав позитивный эффект сохранялся в течение не менее 2-х лет после окончания курса иммунотерапии в отношении симптомов ринита и объема получаемой терапии. Интересно, что АИТ оказывала такое профилактическое действие только у пациентов моложе 18 лет, причём наиболее выраженный позитивный эффект в отношении астмы наблюдался у детей более младшего возраста, что было показано в упомянутом выше исследовании GAP, проведенной группой Valovirta E. (2018) В исследовании использовались лиофилизированные таблетки пыльцы тимофеевки 75 000 SQ-T (препарат Гразакс, ALK). Основная цель исследования GAP по профилактике астмы таблетками СЛИТ SQ у детей (n=712) с аллергией на пыльцу трав состояла в том, чтобы изучить влияние СЛИТ талетками SQ по сравнению с плацебо на риск развития астмы, дебют которой документально подтверждался зафиксированным обратимым нарушением функции легких — это являлось первичной конечной точкой. Результаты исследования показали, что лечение сублингвальной иммунотерапевтической таблеткой травы SQ не оказало влияния на время до начала астмы и не продемонстрировало разницы с плацебо, однако в отношении вторичных конечных точек: симптомов развившейся обструкции, функции легких, частоты применении медикаментов было продемонстрировано позитивное действие на симптомы астмы. Ни в одном из регистрационных исследований препаратов, используемых в нашей стране, не смогло быть доказано превентивное воздействие АИТ на развитие бронхиальной астмы у пациентов с АР. Таким образом, в настоящее время отсутствуют какие-либо надёжные свидетельства в пользу применения АИТ в профилактических целях в данной возрастной группе для конкретных лекарственных средств, однако в пост — анализах и при динамическом наблюдении эффекты превенции выявлялись в группах сублиншвальной терапии. При анализе 75 тысяч пациентов, получивших суммарно 2851 курс СЛИТ различными препаратами (Гразакс и Оралейр) в Германии, относительный риск астмы был ниже в группе активного лечения ОР 0.696, p=0.002), время начала астмы hazard ratio: 0.523; p= 0.003. использование медикаментов по поводу аллергического ринита было ниже на 18,8%, по поводу астмы на 16,7% по сравнению с плацебо [16].
Что касается долгосрочного превентивного действия, гайдлайн EAACI 2017 (S. Halken at al.), о котором мы говорили выше приводит некоторые доказательства уменьшения риска развития бронхиальной астмы у детей и подростков с АР в долгосрочной перспективе (через 2 и большее количество лет после АИТ), но отмечает, что необходимы дальнейшие исследования в этой области. Не исключено, что отрицательный результат был обусловлен высокой степенью неоднородности данных и различием как критериев постановки диагноза, так и оценкой клинических иcходов наблюдения, что определяет потребность в проведении дополнительных исследований с хорошо спланированным дизайном для разрешения вопроса. Клинически, врачи проводящие АИТ чётко видят, если симптомы бронхильной астмы связаны с цветением, то после проведения АИТ ребёнка перестаёт нуждаться в противоастматической терапии и количество обострений резко снижается, в исследваниях эффективности все пациенты получают базисную терапию, тем самым величина эффекта по сравнению с плацебо становится меньше (т. е. Дети получают не просто плацебо, а традиционную терапию препаратами). Крупных исследований профилактики аллергии с помощью АИТ нет, т. к. они требуют долгосрочных наблюдений и заполнения опросников и прохождения осмотров в течение многих лет после лечения. Небольшие исследования, основанные на опросе пациентов и оценке их симптомов до и после терапии, показывают вероятную эффективность АИТ при большой длительности наблюдения (5—15 лет), что должно стать поводом для оптимизма в отношении формирования долгосрочной толерантности [17].
При изучении вопроса об эффективности АИТ для предотвращения новой аллергической сенсибилизации были проанализированы несколько рандомизированных контролируемых исследований, в которых использовались различные лечебные аллергены и были получены противоречивые результаты. Профилактическое применение препарата клещей домашней пыли (ALK. D. Pteronyssinus 50% + D. farinae 50%) орально в течение года у детей с высоким риском аллергии показало положительное влияние в отношении риска возникновения аллергии. Было получено незначительное (на 16%), но достоверное снижение частоты сенсибилизации к наиболее распространенным аллергенам, однако примечательно, что снижения частоты аллергии к КДП (которыми проводили АИТ) не отмечалось [18]. В открытом наблюдении детей (n=144) с уже имеющимся аллергическим ринитом использование иммунотерапии в обычном режиме СЛИТ в течение 3 лет показало прекрасные результаты в отношении новой сенсибилизации: в группе активного применения АИТ расширение спектра гиперчувствительности отмечалось в 3,1%, по сравнению с плацебо 34.8% [19]. Исследование со сходным дизайном c меньшим числом участников (n=31), использовавших препараты СЛИТ в течение 2 лет не показали значимых различий [20].
Позиция европейского аллергологического общества относительно снижения риска аллергии следующая: отмечается позитивный эффект АИТ в отношении краткосрочного риска развития астмы у пациентов с аллергическим ринитом. Влияние на прогноз долгосрочного развития астмы был положительный, но не смог достичь достоверного уровня значимости. Результаты проведённых исследований следует интерпретировать с осторожностью в связи с высокой степенью их неоднородности [21]. Надёжные доказательства, подтверждающие наличие превентивного эффекта АИТ в отношении развития новой сенсибилизации у детей в какой-либо популяции пациентов к настоящему моменту, отсутствуют.
Различия используемых препаратов (содержание в них аллергена и форма его доставки) и неодинаковость схем лечения, наряду с различиями дизайна и исследуемых популяций, может являться причиной значительных противоречий в результатах исследований, оценивающих превентивное действие АИТ. При планировании курса лечения каким-либо определённым препаратом целесообразно осуществление оценки имеющихся доказательных данных в отношении эффективности данного конкретного препарата.
В целом, в настоящее время в вопросах использования АИТ с профилактической целью имеется большое количество пробелов. Большинство из них касаются отсутствия доказательных данных в отношении отбора пациентов (например, оптимального возраста и клинических характеристик), оптимальных лечебных препаратов, путей и схем лечения, продолжительности иммунотерапии. Кроме того, существует высокая потребность в определении стандартизированных индексов и оценок симптомов для оценки эффективности терапии и изучении фармако-экономической пользы от подобных вмешательств.
Ассоциация не поддерживает назначение АИТ у здоровых детей с целью профилактики аллергии в рутинной практике, но подобные вмешательства могут быть проведены в рамках одобренных этическим комитетом клинических исследований, учитывая высокую безопасность сублингвальной аллерген иммунотерапии. При использовании АИТ у пациентов с аллергической патологией, учитывая данные литературы, можно надеяться на протективный эффект применения лечебных аллергенов в отношении развития БА и новой сенсибилизации, но величина эффекта будет колебаться в зависимости от препарата, схемы его применения и индивидуальных генетических особенностей пациента. Существующие лечебные аллергены, даже показавшие профилактическое действие в отношении появления астмы в эксперименте, не содержат в инструкции показаний, касающихся их превентивных свойств, поэтому должны назначаться детям только при наличии симптомов заболевания.
Литература к разделу
1. Mitsias DI, Xepapadaki P, Makris M, Papadopoulos NG. Immunotherapy in allergic diseases — improved understanding and innovation for enhanced effectiveness. Curr Opin Immunol. 2020;66:1—8. doi:10.1016/j.coi.2020.02.005
2. Simon AK, Hollander GA, McMichael A. Evolution of the immune system in humans from infancy to old age. Proc Biol Sci. 2015;282 (1821):20143085. doi:10.1098/rspb.2014.3085
3. Yu JC, Khodadadi H, Malik A, et al. Innate Immunity of Neonates and Infants. Front Immunol. 2018;9:1759. Published 2018 Jul 30. doi:10.3389/fimmu.2018.01759
4. Belderbos M, Levy O, Bont L. Neonatal innate immunity in allergy development. Curr Opin Pediatr. 2009;21 (6):762—769. doi:10.1097/MOP.0b013e3283325e3a
5. Arasi S, Corsello G, Villani A, Pajno GB. The future outlook on allergen immunotherapy in children: 2018 and beyond. Ital J Pediatr. 2018;44 (1):80. Published 2018 Jul 11. doi:10.1186/s13052-018-0519-4
6. Dhami S, Nurmatov U, Arasi S, et al. Allergen immunotherapy for allergic rhinoconjunctivitis: A systematic review and meta-analysis. Allergy. 2017;72 (11):1597—1631. doi:10.1111/all.13201
7. Radulovic S, Calderon MA, Wilson D, Durham S. Sublingual immunotherapy for allergic rhinitis. Cochrane Database Syst Rev. 2010; (12):CD002893. Published 2010 Dec 8. doi:10.1002/14651858.CD002893
8. Masuyama K, Okamoto Y, Okamiya K, et al. Efficacy and safety of SQ house dust mite sublingual immunotherapy-tablet in Japanese children. Allergy. 2018;73 (12):2352—2363. doi:10.1111/all.13544
9. Frati F, Scurati S, Puccinelli P, et al. Development of an allergen extract for sublingual immunotherapy — evaluation of Staloral. Expert Opin Biol Ther. 2009;9 (9):1207—1215. doi:10.1517/14712590903146869
10. Valovirta E, Petersen TH, Piotrowska T, et al. Results from the 5-year SQ grass sublingual immunotherapy tablet asthma prevention (GAP) trial in children with grass pollen allergy. J Allergy Clin Immunol. 2018;141 (2):529—538.e13. doi:10.1016/j. jaci.2017.06.014
11. Huoman J, Papapavlou G, Pap A, Alm J, Nilsson LJ, Jenmalm MC. Sublingual immunotherapy alters salivary IgA and systemic immune mediators in timothy allergic children. Pediatr Allergy Immunol. 2019;30 (5):522—530. doi:10.1111/pai.13047
12. Fiocchi A, Pajno G, La Grutta S, et al. Safety of sublingual-swallow immunotherapy in children aged 3 to 7 years. Ann Allergy Asthma Immunol. 2005;95 (3):254—258. doi:10.1016/S1081—1206 (10) 61222—7
13. Agostinis F, Tellarini L, Canonica GW, Falagiani P, Passalacqua G. Safety of sublingual immunotherapy with a monomeric allergoid in very young children. Allergy. 2005;60:133.
14. Halken S, Larenas-Linnemann D, Roberts G, et al. EAACI guidelines on allergen immunotherapy: Prevention of allergy. Pediatr Allergy Immunol. 2017;28 (8):728—745. doi:10.1111/pai.12807
15. Kristiansen M, Dhami S, Netuveli G, et al. Allergen immunotherapy for the prevention of allergy: A systematic review and meta-analysis. Pediatr Allergy Immunol. 2017;28 (1):18—29. doi:10.1111/pai.12661
16. Zielen S, Devillier P, Heinrich J, Richter H, Wahn U. Sublingual immunotherapy provides long-term relief in allergic rhinitis and reduces the risk of asthma: A retrospective, real-world database analysis. Allergy. 2018;73 (1):165—177. doi:10.1111/all.13213
17. Sahin E, Dizdar D, Dinc ME, Cirik AA. Long-term effects of allergen-specific subcutaneous immunotherapy for house dust mite induced allergic rhinitis. J Laryngol Otol. 2017;131 (11):997—1001. doi:10.1017/S0022215117002110
18. Zolkipli Z, Roberts G, Cornelius V, et al. Randomized controlled trial of primary prevention of atopy using house dust mite allergen oral immunotherapy in early childhood. J Allergy Clin Immunol. 2015;136 (6):1541—1547.e11. doi:10.1016/j. jaci.2015.04.045
19. Marogna M, Tomassetti D, Bernasconi A, et al. Preventive effects of sublingual immunotherapy in childhood: an open randomized controlled study. Ann Allergy Asthma Immunol. 2008;101 (2):206—211. doi:10.1016/s1081—1206 (10) 60211—6
20. Szépfalusi Z, Bannert C, Ronceray L, et al. Preventive sublingual immunotherapy in preschool children: first evidence for safety and pro-tolerogenic effects. Pediatr Allergy Immunol. 2014;25 (8):788—795. doi:10.1111/pai.12310
21. Kristiansen M, Dhami S, Netuveli G, et al. Allergen immunotherapy for the prevention of allergy: A systematic review and meta-analysis. Pediatr Allergy Immunol. 2017;28 (1):18—29. doi:10.1111/pai.12661
22. Didier A, Wahn U, Horak F, Cox LS. Five-grass-pollen sublingual immunotherapy tablet for the treatment of grass-pollen-induced allergic rhinoconjunctivitis: 5 years of experience. Expert Review of Clinical Immunology. 2014;10 (10):1309—1324. doi:10.1586/1744666X.2014.957677
4.
Стандартизация аллергенов
Ключевые положения
1. Не существует единых правил стандартизации аллергенов.
2. Преимуществом для использования обладают аллергены, стандартизированные биологическим способом.
3. Производители используют различные системы обозначения активности аллергенов. Нет соответствия и формул пересчета между различными единицами аллергенности.
4. В идеальном случае стандартизованный препарат должен содержать основные мажорные белки аллергена, но подобное требование в Европе предъявляется только для аллергенов березы и тимофеевки.
5. Стандартизованные препараты одного производителя имеют стабильный состав и воспроизводимость между сериями.
Результаты клинических исследований одного лечебного аллергена могут быть полноценно применимы только к конкретному препарату.
История применения аллергенов насчитывает более 100 лет. За этот срок трансформировалось представление о механизмах и возможностях иммунотерапии. Непрерывное развитие фармацевтической промышленности и науки делают возможным появление новых препаратов лечебных и диагностических аллергенов и способов их введения. В поисках оптимального соотношения эффективности и безопасности АИТ (кроме эмпирического подбора доз) в разные периоды развития аллергологии применялся ряд методов, включавших в себя совершенствование методов сбора, очистки, производства аллергена, изменение способа его введения, депонировании препарата на носителе и даже изменение структуры аллергенного эпитопа, уменьшение его аллергенности и увеличение иммуногенности. Эволюция аллергенов идет в сторону безопасности: сублингвальные аллергены более безопасны, чем подкожные. Аллергоиды и депонированные/адсорбированные аллергены при кожном тестировании вызывают меньшую реакцию, чем нативные водно — солевые экстракты при сохранной или большей терапевтической активности [1]. Однако, разнообразие лечебных препаратов и схем их применения привело к сложности оценки и сравнения аллергенов. Стабильность оказываемого эффекта является необходимым требованием к любому препарату, но, изменяя структуру молекулы, мы прямо влияем на биологическую активность аллергена. Изменяя схему, мы можем ждать других сроков наступления лечебного эффекта и т. д. К сожалению, в отношении лечебных аллергенов эти проблемы находятся на стадии решения. Производители не могут принять консенсусное решение в отношении не только содержания аллергена в препарате и периодичности его введения, но даже маркировка аллергенов вызывает споры.
Необходимость оценки активности аллергена на этапе лечения несомненна. На стадии производства важность стандартизации связана со следующими факторами:
• сильная зависимость активности и терапевтической эффективности от первоначального качества натурального сырья (сбор в естественных условиях или собственное производство, степень загрязненности другими биологическими видами).
• особенности технологии изготовления и очистки продукта у различных производителей, что делает затруднительным прямое сравнение аллергенов по массе, которое широко используется в традиционной фармакологической промышленности.
• опасность разрушения белков и потери аллергенности при производстве и транспортировке: очистка, замораживание, лиофилизация могут разрушать часть нестабильных эпитопов.
Все вышеперечисленное делает необходимым стандартизацию аллергена — приведение препарата к некоторому эталону, либо выражение его аллергенности (иммуногенности — способности вызывать иммунный ответ) в общепринятых единицах. Всеобщая стандартизация аллергенов могла бы позволить косвенно оценить активность лекарственного аллергена, оценить риски и предполагаемую пользу от его применения, а также не допустить появления препаратов неэффективных или ненадлежащего качества.
За время производства аллергенов был сделан ряд попыток прийти к референсу. Первоначально применялась стандартизация по массе действующего вещества, но в следствие вышеперечисленных препятствий она не смогла решить эту задачу. Биологическая стандартизация, которая проводится на сенсибилизированном организме пациентов-добровольцев, должна была привести все аллергены к единому эталону — ответу пациента «in vivo» на введение аллергена. Однако возник ряд трудностей:
• Аллергенность препарата и его способность вызывать кожную реакцию при введении не означает стабильного иммунного ответа с образованием клеток памяти, обеспечивающих долговременную эффективность.
• Компании — производители не смогли прийти к соглашению об использовании единой методики биологического тестирования. В Европе используются различные модификации прик — тестов с гистамином, кодеином, вообще без положительного контроля, в США — внутрикожные тесты, что не позволяет уверенно говорить о полной эквивалентности доз.
• Нет «референсных» значений нормального иммунного ответа после иммунотерапии и понимания какая доза аллергена должна быть в препарате. Разные способы введения аллергена требуют доз, отличающихся в десятки раз. При сублингвальной терапии суммарные дозы за год в разы превышают количества аллергена при подкожном введении. При проведении оральной иммунотерапии аллерген часто считается в граммах, биологичекая стандартизация сырья не применяется вообще.
Сама постановка задачи стандартизации лечебного аллергена является нетривиальной: требуется привести препарат к некоему единому значению (условно — безопасной, но эффективной дозе) для больных людей разного пола, возраста, расы, разной силы сенсибилизации, с девиантным иммунным ответом. Подчеркнем, что в условно — здоровом организме IgE — зависимый иммунный ответ в подавляющем случае на вышеперечисленные аллергены не возникает и вопрос о степени его «силы в норме» некорректен. Скорее мы говорим о некотором усредненном значении активности аллергена в препарате, которое можно очень условно перенести на генеральную популяцию.
В данном разделе будут рассмотрены основные особенности стандартизации применяемых в России лечебных аллергенов с точки зрения реальной клинической практики. В юридическом аспекте, производство и использование аллергенов в РФ регулируется государственной фармакопеей, разделом «ОФС.1.7.1.0001.15 Аллергены», где изложены основные принципы производства и стандартизации аллергенов. Принимая во внимание различные технологии у компаний производителей, фармакопея дает самые общие рекомендации, которые могут быть выполнены всеми участниками. Аналогичные документы существуют в Европе и США, и точно также они не позволяют жестко привести все лечебные аллергены к одному эталону. Появление новых препаратов, изменение лекарственных форм вносит коррективы в методы стандартизации аллергенов. Многие методы являются частью внутренних стандартов компаний производителей и являются коммерческой тайной. Информация, представленная в главе получена из общедоступных источников и может отличаться от действительной из-за постоянной модернизации производства аллергенов. Изложение принципов стандартизации не несет цели сравнения препаратов и выбора лучшего решения, а служит для ознакомления читателя с методикой производства и более глубокого понимания иммунотерапии лечебными аллергенами.
4.1. Проблематика. Подготовка сырья
Вопросы стандартизации аллергенов на сегодняшний день остаются решенными не в полном объёме. Многокомпонентность препарата, полученного из натурального сырья, делает сложным сравнение лекарственных средств, произведенных не только по разным технологиям, но и даже между партиями внутри одной компании.
Этапы производства аллергенов регламентируются статьями Государственной фармакопеи РФ. Существует ряд стандартов и требований, предъявляемых к производству, которые необходимо рассматривать с точки зрения гармонизации производства с акцентом на повышение однообразия антигенного состава натурального сырья.
Для производства пыльцевых аллергенов используется пыльца, собранная на специальных делянках в период активного пыления. Рекомендуется использование смеси пыльцы, полученной за 2—3 сезона, чтобы усреднить показатели биологического сырья, зависящие от климатических условий. В РФ допускается не более 10% пыльцы других видов растений в исходном сырье, в ЕС не более 5%. На первом этапе после сбора сырья, его измельчения, экстракции аллергена происходит первичный контроль качества биологического продукта визуально с помощью микроскопии. В препарате аллергена допускается наличие не более 0,5—1% посторонних примесей.
Пыльца является относительно простым продуктом, легко собирается, измельчается и при правильном культивировании достаточно однородна, что позволяет получать аллергенное сырье, содержащее естественную экспозицию белковых молекул.
Похожим образом получают аллергены плесени из предварительно высушенных и измельченных культивируемых грибов определенного вида. Содержание микотоксинов и вредных примесей минимизируется. Аллергены из клещей домашней пыли производят из искусственно выращенных насекомых, содержащихся в стерильных условиях 3—4 месяца и получающих определенный вид пищи с целью более однородного антигенного состава. На производстве поддерживается видовой контроль популяции, поэтому содержание основных антигенов клещей там более стабильно по сравнению с видами, живущими в естественных условиях.
Эти 3 группы аллергенных препаратов отличает возможность их искусственного выращивания, полного измельчения и, соответственно, в конечном продукте содержание белка будет более близко соответствовать натуральному сырью, с поправкой на термолабильность белков и возможное изменении их структуры при использовании консервантов. Однако, даже в этих случаях при сравнении препаратов различных производителей наблюдаются значительные колебания в составе белков.
Основные вопросы к производству и составу возникают при использовании аллергенов животных, библиотечной и домашней пыли вследствие очевидной сложности приготовления и сбора сырья. Невозможно стабильно воссоздавать комплексные аллергены из-за влияния различных факторов (сезона, географии и т.п.) или вследствие содержания в организме животного большого количества белка не являющегося причинно — значимым аллергеном.
Пыль, используемая при производстве бытовых аллергенов, собирается с поверхности мебели в домах пациентов, страдающих аллергией. Однако, стоит понимать, что пыль представляет собой сложный конгломерат минеральных и биологических частиц, который существенно различается в различных странах и домах. Подавляющей фракцией аллергена в домашней пыли являются пироглифные клещи, но в основе субстрата пыли — механические частицы тканей, минеральных веществ. Домашняя пыль кроме акарокомплекса всегда содержит примеси, которые зависят от климатической зоны и состава иных аллергенов помещений. Так по разным данным в пыли могут определяться значимые количества эпителия животных, пыльцы растений, белков пищи. Анализируя состав пыли из детских спален (США, Канзас), рабочая группа Barnes C. определила, что в образцах практически постоянно встречаются ряд антигенов (кроме клещей Der f 1 & Der p 1): таракан (Bla g 2), утероглобин кошки (Fel d 1), липокалин шерсти собаки (Can f 1), антигены мыши (Mus m 1) а также плесневых грибов (Alternaria, Aspergillus, Cladosporium, Penicillium) [2]. Позднее было показано, что в домашней пыли, собранной в помещениях, где проживали дети с пищевой аллергией, концентрация антигенов арахиса (Ara h 2) значительно превышала средние значения из образцов домов, где пищевая сенсибилизация не фиксировалась [3].
Более того, при долговременных исследованиях, проведенных в нашей стране, была замечена нестабильность состава акарокомплекса домашней пыли, проявившаяся в уменьшении доли D. Pteronyssinus в 2 раза и в возрастании значения D. farina в 2,6 раза. За 20 лет наблюдений доля клещей амбарно — зерновой группы в Москве уменьшилась с 14% до 1% в течение 20 лет [4].
Для практики следует подчеркнуть, что препараты аллергенов домашней пыли имеют нестабильный состав и следует использовать лечебные препараты аллергенов клещей домашней пыли определенного рода при любой возможности. Аллергены домашней пыли и клещей домашней пыли не являются взаимозаменяемыми, т.к. реакция на пыль может быть вызвана примесями других белков. Каждая серия домашней пыли должна проверяться по возможности с помощью кожных проб и переход между сериями требует снижения концентрации вводимого аллергена в целях безопасности.
Аллергены животных по современных данным не ограничиваются поверхностными белками шерсти: значимую роль играют аллергены слюны, желез внешней секреции, простатические половые антигены (утероглобин кошки, липокалин и аргининовая эстераза). Сенсибилизация к cывороточным альбуминам, находящимся в крови, моче, мясе встречаются у 35% пациентов с аллергией на собак и в 14—23% при гиперчувствительности к кошкам [5,6]. Для производства аллергенов эпидермальные аллергены получают с поверхности кожи (шерсти) здоровых представителей видов определенного животного, не имеющего кожных заболеваний и инфекций. Порода животного не регламентируется. Исследователями не найдено существенной разницы по содержанию аллергена Can f1 между различными породами собак. Породы, традиционно считающиеся гипоаллергенными (пудели, йорки), показывают сравнимое или даже более высокое содержание аллергена на единицу площади кожи. В более поздних наблюдениях было показано, что количество аллергена может значительно изменяться у разных представителей даже внутри одной породы в очень широких пределах. При измерении концентрации Can f 1 у пуделей (n=40) концентрация колебалась от 2.21 до 122.60 мг на 1 г шерсти [7]. Состав аллергена в сырье варьируется в зависимости от пола животного и состояния его кожи. Животные с себореей, самцы и пожилые собаки продуцируют больше Can f 1, чем особи той же породы без этих отягощающих факторов [8]. По данным Mattsson L., у 70% взрослых пациентов с клинически значимой аллергией на собаку определяется сенсибилизация к простатическому калликреину. По ясным причинам Can f 5 определяется в основном в моче, менее — на шерсти и только у самцов [9]. В международном референсе «аллерген из шерсти собаки» требований по концентрации Can f 5 нет. Кожные пробы и лечебные аллергены из шерсти собак содержат неизвестное количество Can f 5 и могут показывать разную эффективность при проведении диагностики и лечения. Это одна из причин, по которым стандартизация аллергена имеет крайне важное значение, поскольку применение натурального сырья всегда будет сопряжено с нестабильностью продукта.
После получения натурального сырья на следующем этапе оно измельчается механически или с помощью ультразвука и очищается от посторонних примесей путем концентрирования, центрифугирования, фильтрации и т.д., после чего происходит собственно стандартизация и разведение аллергена до необходимого объема.
Фармакопея регламентирует содержание белка в готовом препарате от 3000 до 12500 PNU и аллергенная активность должна соответствовать 50—150% от заявленной. Такие широкие колебания характерны для аллергенов, производимых в разных странах, и не являются особенностью РФ.
4.2. Теоретические основы стандартизации сырья
Препараты лечебных и диагностических аллергенов представляют собой сложную систему белков, полисахаридов, липидов и ферментов, которые входят в состав живого организма. Часть молекул иммунологически инертна, другая может вызвать IgE — зависимый ответ. Белки, к которым развивается чувствительность у более чем 50% пациентов называются «мажорными», главными. Они являются предикторами хорошего ответа на аллерген иммунотерапию, вызывают хороший иммунный ответ и толерантность после лечения. В настоящее время Европейская фармакопея рекомендует стандартизацию только по содержанию Phl p5 и Bet v1. Выглядит логичным предложение использовать стандартизацию по массе мажорного аллергена в молекуле, однако, необходимо учитывать, что для некоторых нативных аллергенов понятие мажорных аллергенов размыто. Так, для полыни аллерген Art v 1 (дефенсин) является безусловно основным и встречается у большинства пациентов, но LTP белок Art v 3 встречается у 30—40% пациентов и крайне важно его присутствие в препарате для развития толерантности к перекрестным пищевым продуктам и амброзии. Аналогично для амброзии: пектатлиаза Amb a 1 — мажорный аллерген, встречающийся у 90% пациентов, но наличие в лечебном препарате других белков — дефенсинов и LTP может обеспечить перекрестное развитие толерантности к другим сорным травам и продуктам. При производстве аллергена необходимо сохранить естественное разнообразие при условии сохранения высокой концентрации основных аллергенных молекул. С другой стороны, при рассмотрении одного мажорного белка из-за третичной конформации протеина, молекулярные структуры могут иметь изоформы и предоставлять различные эпитопы для распознавания.
Антиген — распознающий рецептор лимфоцита распознает один эпитоп в молекуле аллергена и после продуцируется специфическое IgE антитело. В реальности на сложный по структуре белок все равно будут продуцироваться изоформы IgE. Точность распознавания эпитопа зависит от внутренних особенностей синтеза IgE у индивида [10]. В практике этот феномен подтверждается примером перекрестной сенсибилизации: можно наблюдать пациентов с высокой сенсибилизацией к аллергену, у которых перекрестная активность к гомологичным аллергенам бывает различной как по данным лабораторного обследования, так по проявлениям симптомов. Помимо существования различных эпитопов аллергенной молекулы, источники аллергенов являются сложноорганизованными организмами и содержат множество белковых молекул (линейных и конформационных эпитопов), часть которых интенсивно распознается Т — рецепторами и приводит к формированию иммунной памяти, другая — не вызывает иммунного ответа, либо он начинается на поздних стадиях заболевания.
В настоящее время нет единой позиции, касающейся того, что в препарате для проведения терапии должны содержаться только избранные мажорные аллергены. Разрозненные рекомендации и консенсусные документы не смогли оказать значимого влияния на промышленное производство в Европе.
Несмотря на активную деятельность аллергологических обществ с конца 1970-х, во всем мире не существует единых правил производства и стандартизации аллергенов. Подавляющее большинство фирм — производителей пользуются внутренними стандартами качества и производства аллергенов, что вызывает опасения в отношении безопасности при использовании препаратов различных производителей, которая может возникнуть в случае необходимости эквивалентной замены терапевтического препарата. Кроме того, с точки зрения доказательной медицины, проведение метаанализа эффективности АИТ существенно затруднено, т.к. дозы, используемые в исследованиях, сравнивать сложно, а врачи — исследователи используют разные шкалы оценки симптомов.
Возможны два основных варианта стандартизации аллергена:
1. Проведение исследований и обнаружение аллергена in vitro с помощью различных лабораторных методов, направленных на определение количества и качественного состава белка. Обычно эти два метода сочетаются и заключаются в определении массы (концентрации) нативного или мажорного аллергена в образце и подтверждения его наличия путем связывания со специфическими сыворотками.
2. Проведение исследований на сенсибилизированных добровольцах (in vivo). Проведение кожных проб и сравнение их с положительным контролем или размером реакции на эталонную партию аллергена.
Практически реализована схема производства аллергена, при которой используется комплексный подход к стандартизации сырья: компания определяет необходимую концентрацию аллергена в препарате, стандартизует аллерген биологическим способом (провокационные пробы на добровольцах), а далее между партиями в процессе производства происходит лабораторный аналитический контроль качества продукта.
4.3. Стандартизация аллергенов по массе. Единицы PNU
Фармакологические препараты, полученные путем химического синтеза, стандартизуют по весу, т.к. действие препарата во многих случаях линейно и предсказуемо, действующее вещество представлено одной молекулой и концентрация в конечном лекарственном средстве зависит от чистоты химического синтеза.
В отношении аллергенов подобный подход широко применялся во второй половине XX века пока сохранялось представление о некой «цельности» аллергена и был неясен состав аллергенных белков натурального сырья. Аллергены всегда были представлены смесью протеинов, энзимов и липополисахаридов. Для упрощения сначала регламентировали сбор и производство сырья, чтобы быть уверенными в относительной «чистоте» вещества, после чего было предложено измерять массу аллергена в «однородном» образце. В основном применялись 2 способа выражения массы препарата.
В США в отношении «не стандартизированных» аллергенов до настоящего времени сохранился массово — объемный способ, когда концентрацию выражают дробью 1/100, 1/500 и т.д., например, маркировка «аллерген полыни 1/1000» указывает, что в препарате концентрация составляет 1 грамм натурального сырья на 1000 мл растворителя.
В Европе и в России аллергены чаще маркировались в PNU («protein nitrogen unit» с англ. — единица белкового азота), что, по сути, эквивалентно измерению массы белка в препарате. 1 PNU принимается равным 10—5 мг азота или, по данным литературы, примерно 0,06 мг белка [11].
Эти две системы не следует путать между собой, т.к. при использовании любого экстракта можно выполнять терапевтические разведения, которые тоже будут обозначаться дробью вида 1/100 и т.п., но исходная стандартизация от производителя и концентрация вещества в препарате будут иной.
Практический пример: сравним американский препарат «аллерген полыни» 1/1000 (в 1 мл 1 мг пыльцы) и препарат «аллерген полыни» 10 000 PNU, разведенный до 1/1000 в 1 мл — будет иметь концентрацию 10 PNU
(0,1 мг белка) пыльцы.
Объемный метод вид стандартизации был простым и позволял без особых затрат получать относительно сравнимые экстракты или по крайней мере иметь ориентировочную концентрацию аллергена в конечном продукте на ранних этапах развития аллергологии и иммунотерапии.
В конце 80-х годов появились наблюдения о высокой неоднородности аллергенов с одинаковой концентрацией, выраженных в PNU, как произведенных различными производителями, так и между различными сериями одного препарата. Среди сравниваемых аллергенов (43 аллергенных препарата со всего мира), лечебные аллергены, стандартизованные методом кожных проб, обладали более предсказуемой активностью по сравнению со стандартизованными в PNU [12]. Тем самым были созданы предпосылки и разработаны стандарты для биологической стандартизации аллергенов по способности вызывать аллергическую реакцию немедленного типа у сенсибилизированных пациентов [13]. Несмотря на приведенную выше информацию, все производимые аллергены в нашей стране до настоящего времени стандартизируются по массе белкового азота в PNU. Дополнительная биологическая стандартизация не проводится. Четких данных о содержании мажорных аллергенов в лечебных препаратах нет. Недостатком метода стандартизации по весу является возможный учет массы инертных неаллергенных белков при определении массы белкового азота, невозможность учесть разрушение эпитопов аллергена (масса не изменится), что в конечном итоге приводит к вариабельной биологической активности препарата.
4.4. Биологическая стандартизация
В основе метода биологической стандартизации лежит оценка силы реакции организма на аллерген. Исторически первым методом был способ Noon L., который проводил конъюнктивальный тест с 1 мкг зерен тимофеевки у пациентов с поллинозом, выясняя реактогенность подобных концентраций пыльцы. Единицы стандартизации по результатам конъюнктивального теста носят наименование — единицы Noon.
В современной практике сохранились общие принципы тестирования in vivo, но по соображениям удобства и безопасности было выбрано кожное тестирование с раствором аллергена у высоко сенсибилизированных пациентов с клиническими проявлениями заболевания. Обычно используют группы до 30 человек, проводят кожные прик — тесты в ЕС (или внутрикожные в США) и стандартизуют раствор по величине волдыря у добровольца после введения аллергена. По величине реакции можно оценивать качество и активность препарата. Необходимо подчеркнуть, что нет единых критериев включения в «эталонную» группу пациентов: размер выборки, степень сенсибилизации и группы разные у каждого производителя.
В конце 80-х Всемирная организация здравоохранения инициировала создание референсных растворов важнейших аллергенов, в которых позднее было определено массовое содержание мажорных компонентов. Это должно было стать первым шагом к единому стандарту. Препараты аллергенов (в количестве ≈ 8000 ампул) хранятся в Лондоне в Национальном институте стандартизации и контроля (The National Institute for Biological Standards and Control — NIBSC), работающем в настоящее время в тесном сотрудничестве с ВОЗ. Эти водные растворы содержат 1 мг аллергена в 1 мл растворителя и могут использоваться для сравнения биологической активности и концентрации аллергена. Например, для референсного аллергена березы — это просто сбор пыльцы березы одного вида, собранный в Великобритании в 1986 году. Активность этих стандартных препаратов принята ВОЗ за эталон и составляет 100 000 IU (International Units). В настоящий момент в качестве референса и международного стандарта доступен ограниченный список аллергенов — всего 5 наименований: Dermatophagoides Pteronyssinus, пыльца тимофеевки, березы, амброзии, экстракт шерсти собаки (см. таблицу). Дополнительно в качестве лабораторного стандарта ВОЗ биологической молекулы (не аллергена) представлен β2 — микроглобулин. Небольшой дополнительный перечень аллергенов хранится в NIBSC, но не является международным стандартом. Это аллергены пыльцы ежи, смеси 12 луговых трав, маннан (полисахарид клеточной стенки дрожжей) грибов Candida, яд пчелы, клещи пыли Acarus Siro, Glycyphagus destructor, Tyrophagus Putrescentiae, Tyrophagus Longior. Остальные аллергены не рассматриваются и не представлены. Список давно не обновлялся, и проект находится в стагнации.
Таблица. Концентрация эталонных аллергенов NIBSC, ампулы 1 мл, 100 000 IU
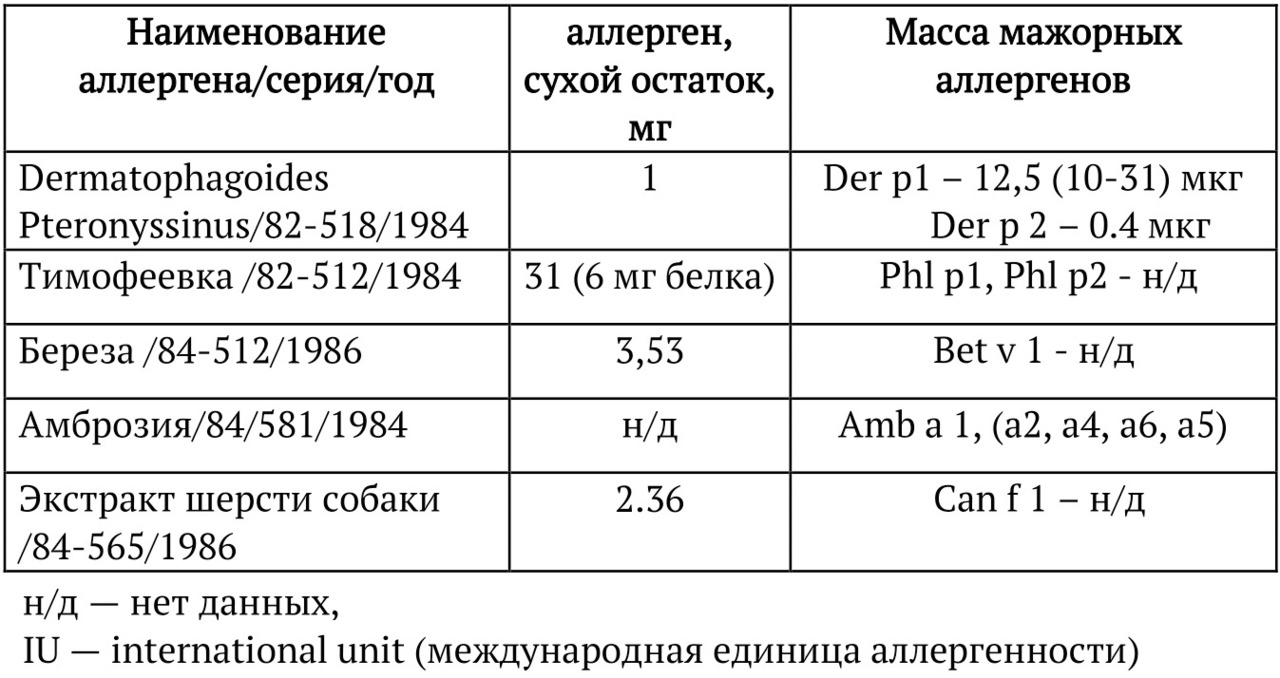
За 40 лет ВОЗ и NIBSC не смогли разработать методику стандартизации референсных препаратов и внедрить ее в клиническую и производственную практику. Список имеющихся аллергенов достаточно короткий и, по сути, измерение в IU не используется.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.