
Бесплатный фрагмент - Вода, активированная гиперзвуком
Преамбула
«Aqua lapidem non vi, sed saepe cadendo»
«Ignoramus et ignorabimus»
Книга, предлагаемая авторами читателям, по своей структуре точно соответствует заявленному названию.
Глава 1 — посвящена воде. Литература, рассказывающая о воде огромна по своему объему, направлениям, содержанию. Авторы не ставят целью объять необъятное — они напомнят читателям основные этапы изучения свойств воды, кратко расскажут об этих свойствах, и специально остановятся на современных моделях строения воды — так как это важно именно для данной брошюры.
Глава 2 — посвящена активации воды. Авторы кратко обозначат основные принятые на сегодняшний день способы активации воды — как научно обоснованные, так и из так называемой «параллельной» науки.
Глава 3 — посвящена гиперзвуку, а именно генерации гиперзвуковых колебаний в твердых телах и жидкостях.
Глава 4 — посвящена способу возбуждения гиперзвука в воде с помощью внешнего СВЧ поля, проработанному авторами.
Глава 5 — это небольшая обзорная экскурсия по проведенным авторами опытам с водой, активированной гиперзвуком.
Приложение содержит сведения о том, как использовать гиперзвук в быту для приготовления эффективных косметических растворов и полезных напитков, которые, разумеется, знакомы читателю, но приготовлены на основе гиперзвуковой воды.
Глава 1. Вода
Вода. Начало
Все мы прекрасно знаем, как нам кажется, что такое вода. В далекие времена воде уже придавалось огромное значение.
Около 585 г. до р.Х. греческий ученый Фалес из Милета считал воду основным началом всего мира — его основным элементом. Это мнение ученого точно соответствовало греческой мифологии, в которой Океан выступает как прародитель всех богов, и именно из воды произошел весь окружающий нас мир. Кстати, современная теория происхождения жизни на Земле также считает, что жизнь зародилась в мировом океане — т.е. эта теория недалеко ушла от греческих мифов и от Фалеса из Милета.
В 450 г. до р.Х. греческий философ Эмпедокл из Акрагоса считал основой мироздания наличие четырех вечных элементов — огня, воздуха, воды и земли, непрерывное превращение которых происходит под действием любви (притяжения) и ненависти (отталкивания). Элементы Эмпедокла не могли исчезнуть в никуда и появиться из ниоткуда, и его мысли нашли свое продолжение во многих современных законах химии и физики.
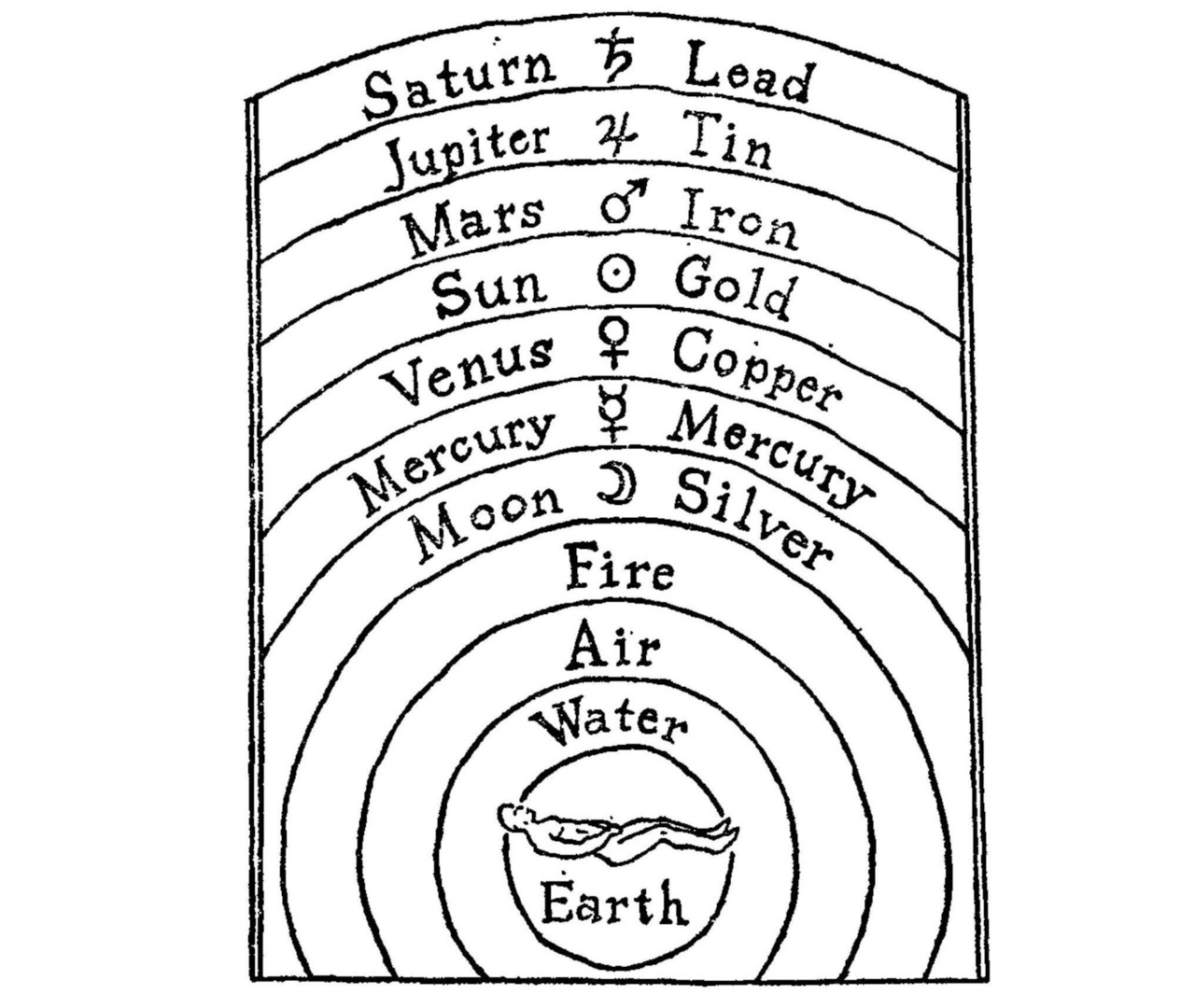
Около 335 г. до р.Х. греческий философ Аристотель из Стагиры дополнил систему четырех элементов Фалеса — своим пятым элементом — «квинт эссенцией» — эфиром, который пронизывает четыре других элемента. И в таком виде теория мироздания, понемногу модернизируясь, просуществовала достаточно долго — на рис.1 показана космология английского алхимика Роберта Фладда (1574—1637) — система химических элементов из 11 позиций, где вода (water) занимает второе место. При этом Фладд, не включил в свою систему «пятый элемент» Аристотеля — эфир.
Первый этап научного изучения, 17—18 век
Начиная с 1650-годов мистическая и «волшебная» наука «алхимия» постепенно отходит в сторону и уступает дорогу «химии» — классической науке. Принято считать, что все ученые, работавшие в этой отрасли знания с 300-го по 1600 год, в одночасье из алхимиков стали химиками. И здесь требуется лингвистическое пояснение. Греческий термин «χημεια» — «химия», который, возможно, означает «искусство приготовления соков», был позаимствован в 6-м веке арабами, которые образовали согласно своей грамматике слово в виде «al-kimyia» — «алхимия». Следовательно, алхимия это прямой грамматический родственник слов алгебра, алкоголь и т. п. Но последние 350 лет существуют два химических направления — названное греческим словом химия, которое обозначает дисциплину, имеющую строго научную основу, и названное арабским словом алхимия — которое обозначает учение в какой-то степени мистическое и «волшебное».
Первый документально зафиксированный биологический эксперимент с водой был проведен в 30-е годы 17-го века голландским естествоиспытателем Ван Гельмонтом (1580—1644). Ван Гельмонт в течение 5-ти лет выращивал иву [96], проводя точные замеры весовых характеристик дерева, почвы и поливальной воды. По завершению опыта ван Гельмонт обнаружил, что ива за 5 лет прибавила в весе на 74 кг (164 фунта), а земля, в которую ива была высажена, убавилась в весе лишь на 57 г. (2 унции). Это привело ван Гельмонта к выводу, что существуют всего два элемента — вода и воздух. А третий элемент — вещественный — включающий растения, деревья, и т.д., и даже землю, образуется в основном из воды. Не признавал ван Гельмонт и элемент «огонь», хотя вполне ясно, что ива, выращенная в темном помещении, будет существенно отличаться от ивы, выращенной ван Гельмонтом на солнечном свете. Пренебрег в своем опыте ван Гельмонт и газовым обменом растения, в данном случае ивы, что тем более удивительно, тем, что именно ван Гельмонт первым обозначил группу летучих химических веществ термином «газ», от греческого слова «χάος», а до ван Гельмонта применялся термин «αέρας» — воздух.
Химики с 1600 г. занимались многими вопросами в области научных химических опытов со многими веществами, но изучение воды, как основного элемента всей природы, целенаправленно проводили мало. Отметим основные достижения.
В 1665 г. голландский механик Христиан Гюйгенс (1629—1695) предлагает, как основные точки для термометра, точки плавления льда и кипения воды.
В 1667 г. Гюйгенс показывает, что вода при замерзании расширяется со значительной силой, в опыте он разрывает железную трубку силой замерзающей воды.
В 1674 г. французский физик Дени Папен (1674—1713) наблюдает зависимость температуры кипения воды от давления и устанавливает факт, что при более низком давлении вода закипает при более низкой температуре. Он же в 1681 г. проводит опыт на котле с предохранительным клапаном, и устанавливает повышение температуры закипания воды с увеличением давления в закрытом котле.
В 1704 г. английский физик Исаак Ньютон (1642—1727) изучал цвет чистой воды и определил его как зеленый.
В 1755 г. швейцарский ученый Жан Андре Делюк (1727—1817) впервые наблюдает, что для того, чтобы расплавить лед, недостаточно нагреть его до температуры плавления, т.е. до 0+10С, а требуется некоторое дополнительное количество теплоты, чтобы вода сменила свое агрегатное состояние. Он же в 1772 г. обнаружил, что вода имеет максимальную плотность не при температуре замерзания в 00С, а при +40С.
1766—1783 гг. оказались этапными в изучении химии воды. Последовательно химики получили водород, кислород, а затем разложили на эти газы (тогда их называли и эластичными жидкостями) воду. Для описания этих и последующих работ будем применять принятые в химии обозначения.
В 1766 г. английский физик Генри Кавендиш (1731—1810) описывает открытый им газ, который он назвал «легковоспламеняющимся воздухом» — это был водород. Водород Н2 выделялся при действии разбавленной серной H2SO4 или соляной HCl кислоты на металлы, в частности на железо Fe, цинк Zn. Возможна такая реакция:
Fe + H2SO4 = FeSO4 + H2
В 1770 г. французский ученый Антуан Лоран Лавуазье (1743—1794), исследуя предполагаемое ван Гельмонтом превращение воды в землю, приходит к заключению, что суммарный вес замкнутого стеклянного сосуда и долго кипевшей в нем воды (100 дней) остается неизменным, а земля (осадок) образуется из стекла сосуда. Для опыта Лавуазье применил дождевую воду, которую очистил восьмикратной перегонкой — дистилляцией.
В 1771 (или в 1772) г. английский химик Джозеф Пристли (1733—1804) получил кислород O2 путем нагрева селитры КNO3. Его опыт соответствует такой реакции:
2КNO3 + (нагрев) = 2КNO2 + O2
Пристли посчитал выделявшийся в указанном опыте газ за обычный воздух, в 1773 г. он видит в нем закись азота N2O (это «веселящий газ»), которую он получил при реакции влажных железных опилок и окиси азота («азотистого воздуха»), но в 1774 г. Пристли понял, что ему удалось получить «дефлогистированный воздух» — кислород.
Этому выводу предшествовал другой опыт Пристли, проведенный 1 августа 1774 г., схема которого приведена на рис 2.
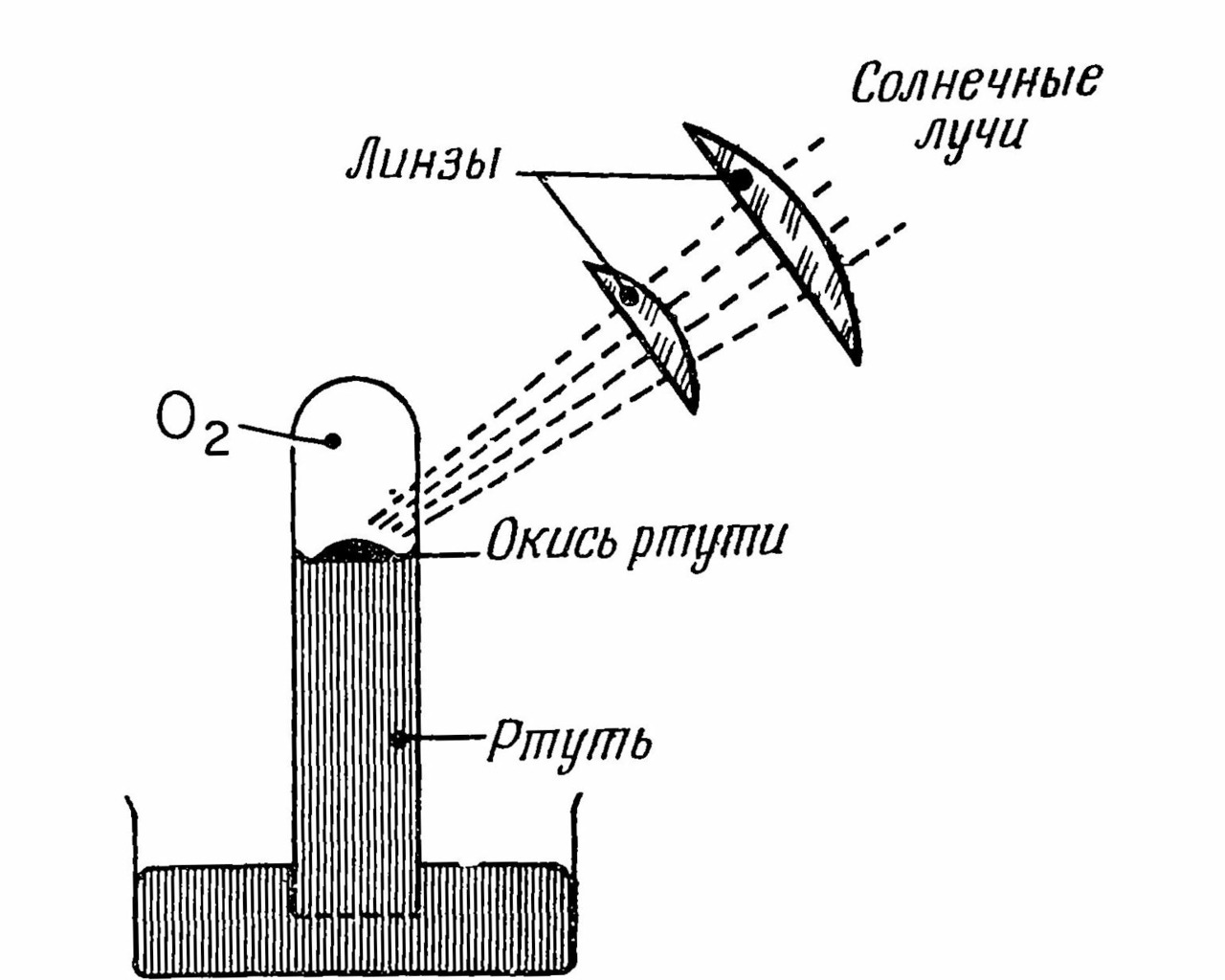
С помощью двойной линзы Пристли фокусировал солнечные лучи на красный окисел ртути HgO, его сильный нагрев приводил к выделению металлической ртути Hg в виде шариков, которые стекали на ртутный столбик, и газа, заполнявшего стеклянную пробирку и оказавшегося кислородом O2. Его опыт соответствует такой реакции:
2HgO + (нагрев) = 2Hg + O2
Газ Пристли назвал «дефлогистированным воздухом» и установил, что он повышает жизнедеятельность мыши, вдыхающей его, и вызывает яркое горение свечи.
Существует мнение, что в это же время, или даже чуть ранее, кислород получил и шведский аптекарь Карл Шееле (1742—1786). Шееле подробно описал в книге [97], изданной в 1777 г., свои опыты по получению кислорода, состоявшие в нагреве веществ, непрочно удерживающих кислород, и столь же подробно описал свойства кислорода, который он называл «огненный воздух». Впрочем, в указанной книге уже есть ссылки на работы Пристли, а в приведенном письме от 13 июля 1777 г., пояснено, что свои работы Шееле завершил за два года до даты письма, т.е. в 1775 г.
В конце 1774 г. при посещении Парижа Пристли встретился с Лавуазье и рассказал ему о своих опытах по получению «дефлогистированного воздуха». Лавуазье заинтересовался этими опытами и их результатами, в 1775 г. он провел свои опыты с нагревом окиси ртути и установил, что воздух состоит из двух газов в соотношении 1:5. В «огненном» — «дефлогистированном воздухе», который Лавуазье назвал кислородом, подопытная мышь чувствовала себя хорошо. В воздухе, в котором отсутствовала доля кислорода — мышь задыхалась. Эту часть воздуха Лавуазье назвал азотом от греческого слова «ἄζωτος» — безжизненный. Азот N2 уже был получен Генри Кавендишем в ходе химических опытов, выполненных в 1772 г.
В 1781 г. практически одновременно шотландский физик Джеймс Уатт (1736—1819) и Генри Кавендиш получили воду из водорода и кислорода. Опыт Кавендиша состоял в пропускании через смесь водорода и кислорода (это «гремучий газ») электрической искры в трубке над сосудом с ртутью. Смесь взрывалась с образованием воды. Кавендиш установил, что при взрыве смеси из двух объемов водорода и одного объема кислорода расходуется весь газ, а вес образовавшейся воды равен весу газовой смеси в трубке. Так фактически была установлена химическая формула воды — H2O. Результаты своих опытов Кавендиш опубликовал в 1785 г.
Окончательно формулу воды установил Лавуазье:
— в июне 1783 г. Лавуазье повторяет опыт Кавендиша — в присутствии французских ученых из кислорода и водорода он синтезирует 2,5 г. воды;
— в это же время Лавуазье проводит качественный химический опыт без использования электричества и взрывов — через раскаленный докрасна железный ружейный ствол он пропускает горячий водяной пар, при этом в стволе образуется окалина — ржавчина, а из дула ствола выходит газ — это оказался водород;
— окончательно состав воды Лавуазье определил в опыте с железными опилками. Он проводит водяные пары через раскаленные железные опилки, заранее взвешенные, и собирает водород, затем он взвешивает воду, водород и окислившиеся железные опилки. Результат взвешивания точно свидетельствует — вода состоит из одной доли кислорода и двух долей водорода.
Так в 1783 г. была точно установлена химическая формула воды — H2O.
Второй этап научного изучения, 19 век
На рубеже 19-го века, предположительно в декабре 1799 г., итальянский физик Алессандро Вольта изготовил первую электрическую батарею, которая представляла собой столбик из чередующихся медных и цинковых кружков, разделенных кружочками сукна или войлока вымоченного в слабом водном растворе серной кислоты. Первое сообщение об этой батарее, которую Вольта называет «снарядом, слабо заряженным, но действующим непрерывно, подобно лейденской банке», последовало 20 марта 1800 г. в письме от Вольта к президенту Лондонского Королевского общества Джозефу Банксу. Письмо содержит описание и рисунки Вольта, и рекомендации по применению в батарее разных металлов.
30 апреля 1800 г. английский химик Уильям Николсон (1753—1815) и его напарник хирург Энтони Карлайл (1768—1840) на основе вышеупомянутого письма изготовили «столб Вольта» и полностью проверили его работоспособность. Николсон в ходе опыта для улучшения контакта верхней проволоки с цинковым кружком налил на него немного воды и случайно (!) обнаружил, что на этой проволоке, выделяются пузырьки — экспериментатор по запаху предположил, что это водород. Николсон и Карлайл провели новый эксперимент — в пробирке с водой, в которую через пробки были введении проволоки от «столба Вольта», они впервые разложили воду с помощью электричества на водород и кислород. Водород исследователи собрали, а кислород определили по тому, что у них произошло окисление одной медной проволоки.
В сентябре 1800 г. немецкий физик Иоганн Риттер (177—1810) сообщает о своем опыте по разложению воды электричеством, при этом ему удалось собрать и водород и кислород.
Так в самом начале 19-го века для исследования состава воды частично случайно впервые была использована электрическая батарея постоянного тока.
В 1805 г. французский физик Жозеф Гей-Люссак (1778—1850) и немецкий натуралист Александр фон Гумбольт (1769—1859) устанавливают закон кратных объемов при химическом взаимодействии газов и находят, что два объема водорода соединяются с одним объемом кислорода в воду.
В 1815 г. удивительную и революционную гипотезу выдвинул английский химик Уильям Праут (1785—1850). Он утверждал, что первичной материей является водород, а все остальные элементы «сделаны» из него. Идея Праута базировалась на том, что если атомный вес водорода принять за 1, то атомные веса всех известных к тому времени элементов будут выражаться целыми числами, в частности кислород будет иметь атомный вес 16. Гипотезу Праута опровергли тем, что хлор уже имел при таком исчислении атомный вес 35,5. И все же Праут оказался прав — атомы всех элементов действительно имели в составе своего ядра — ядра водорода и нейтроны, имеющие практически такую же массу, как ядро водорода. Частицу, образующую ядро водорода, в честь Праута назвали «протон», а загадка хлора была разгадана — в его атомном весе наряду со стабильным изотопом Cl-35 большую роль сыграл стабильный изотоп Cl-37, о существовании которого в 19-м веке не знали. Так завершились поиски основного элемента нашего мира — это оказалась не вода, а ядро атома водорода, следовательно, древние философы оказались правы в своих воззрениях ровно наполовину.
В 1843 г. французский химик Жан Батист Дюма (1800—1884) занимался определением состава воды, и установил, что отношение весов водорода и кислорода в воде составляет 2:16.
В 1846 г. французский физик Эдмон Беккерель (1820—1891) провел измерение электропроводности жидкостей.
В 1847 г. немецкий химик Роберт Бунзен (1811—1899) исследует в длинных трубках воду исландских гейзеров и показывает, что чистая вода, кажется синей. Это было первое правильное использование спектра воды для определения ее чистоты (напомним, что Ньютон считал цвет воды зеленым). Впрочем, с давних времен люди знали, что свежевыпавший снег — кристаллы воды — имеют голубоватый оттенок.
В 1847 г. английский физик Майкл Фарадей (1791—1867) и независимо от него немецкий физик Юлиус Плюккер (1801—1868) занимались изучением магнитных свойств газов, и установили, что все газы — в т.ч. водород и водяной пар — диамагнитные. Исключение составил кислород, обладающий существенным парамагнетизмом. Термин «диамагнетизм» в сентябре 1848 г. предложил Фарадей. В научном плане диамагнетизм означает возникновение силы отталкивания у вещества от внешнего магнитного поля. В практическом плане невесомый магнит, например, кольцевой ток в невесомом сверхпроводнике будет отталкиваться от поверхности воды, т.е. явление левитации — хождения по воде — не является чудом, а имеет строгое научное объяснение.
Современные сведения о строении воды
В начале 20-го века знания о воде стабилизировались, и ничего не предвещало новых достижений.
В 1909 году датский биохимик Сёрен Сёренсен (1868—1939), возглавлявший лабораторию в пивной компании «Карлсберг» в Копенгагене, разработал методы определения концентрации ионов водорода в растворах, и ввел водородный показатель Рн (который называют и кислотностью) и шкалу Рн. Рн-метры, — приборы, работающие по шкале Сёренсена, используются и в настоящее время для контроля воды и пищевых продуктов на ее основе.
Прошло 10 лет и свою огромную лепту в изучение воды стали вносить физики-ядерщики.
В 1920 г. британский физик Эрнест Резерфорд (1871—1937) и независимого от него американский физик Уильям Харкинс (1873—1951) предсказали существование стабильного изотопа водорода, имеющего атомную массу 2 — 2Н.
В 1929 г. американские физики Херрик Джонстон (1898—1965) и Уильям Джиок (1895—1982) экспериментами доказали существование стабильных изотопов кислорода с атомными массами 17 и 18 — 17О, 18О. До этого открытия химики считали, что кислород существует только в виде стабильного изотопа с массой 16 — 16О. От массы изотопа 16О были рассчитаны массы всех известных к 1929 г. химических элементов. И неожиданно оказалось, что масса кислорода О в «Таблице Менделеева» не 16,0, а 16,0035. Открытие Джонстона и Джиока было очень значительным, оно заставило пересчитать все атомные массы. Кроме того, пошатнулась сама идея вписать все изотопы химического элемента в одну «клеточку» таблицы Менделеева. Особенно ярко это проявилось в 1932 г.
Сегодня за опорную массу принята масса изотопа углерода 12С. А «табличная» масса кислорода О = 15,9994 рассчитана с учетом распространенности его стабильных изотопов на Земле: 16О — 99,759%, 17О — 0,037%, 18О — 0,204%. Химия, казавшаяся в 19-м веке точной наукой, превратилась в оценочную науку, где масса элемента зависит от статистики нахождения тех или иных изотопов элемента на Земле, а «Таблица Менделеева», которую в будущем создадут, к примеру, для Марса будет отличаться от нашей «земной» таблицы.
В 1931 г. американский физик Гарольд Юри (1893—1981) теоретически обосновал существование стабильного изотопа водорода 2Н и назвал его дейтерием, а в 1932 г. практически получил его окись — тяжелую воду, ее формула имела такой вид: (2Н) 216О. Параллельно с Юри существование дейтерия в 1931 г. доказал американский физик Фрэд Аллисон (1882—1974) и предсказал американский физик Раймонд Бёрдж (1887—1980).
В 1933 г. американский физик Гилберт Льюис (1875—1946) методом многократного электролиза первым получил тяжелую воду из обычной воды и выделил из нее дейтерий 2Н. Он же обнаружил, что существует полутяжелая вода, имеющая в своем составе два разных изотопа водорода, т.е. такую формулу — (2Н) (1Н) 16О.
Американские физики несколько лет изучали тяжелую воду (2Н) 216О и обнаружили, что она химически существенно отличается от обычной воды — имеет другую массу, другие температуры замерзания и кипения, сладковатый вкус. Тяжелая вода стабильна и присутствует повсеместно — в речной воде на тонну воды приходится около 150 мл. тяжелой воды, в морской воде около 165 мл. тяжелой воды. Радиоактивной опасности тяжелая вода не представляет.
В 1934 году австралийский физик Маркус Олифант (1901—2000), работавший в Англии с Резерфордом, при проведении ядерной реакции получил полустабильный (период полураспада до 14 дней) изотоп водорода 3Н, названный тритием. Тритий может образовывать супертяжелую воду (3Н) 216О, которая радиационно опасна, но накопиться в водоемах не может, ввиду быстрого распада трития.
В настоящее время известны три изотопа водорода Н и три стабильных изотопа кислорода О (всего у кислорода 14 изотопов). Считается, что тонна речной воды может содержать: 2 литра воды (1Н) 218О, 300 мл. воды (1Н) 217О, 300 мл. полутяжелой воды (2Н) (1Н) 16О, 150 мл. тяжелой воды (2Н) 216О, и остальное это обычная вода (1Н) 216О. Следовательно, в 500 мл. воды в вашем чайнике может быть около 2,5 мл. «другой» воды, в которой около 0,4 мл. тяжелой и полутяжелой воды.
Изотопный состав воды зависит от ее происхождения, возраста, этапов «жизни». В тонком плане явно отличаются изотопные составы речной воды, морской воды, колодезной воды, ключевой воды, воды полученной таянием снега, воды полученной таяньем льда, горной воды, воды текущей с ледников, воды из айсбергов и т. п. Нужно ли это все учитывать? Наука и практика однозначного ответа не дает, а дешевых и надежных методов исправления изотопного состава воды не существует. Следствием этого явилось то, что практически все эксперименты с водой проведены не с обычной водой (1Н) 216О, а с этой водой с некоторым набором ее изотопных «братьев».
Сложной оказалась структура молекулы воды — здесь и далее под этим термином мы понимаем обычную воду (1Н) 216О — и взаимное расположение молекул жидкой воды в занимаемом объеме.
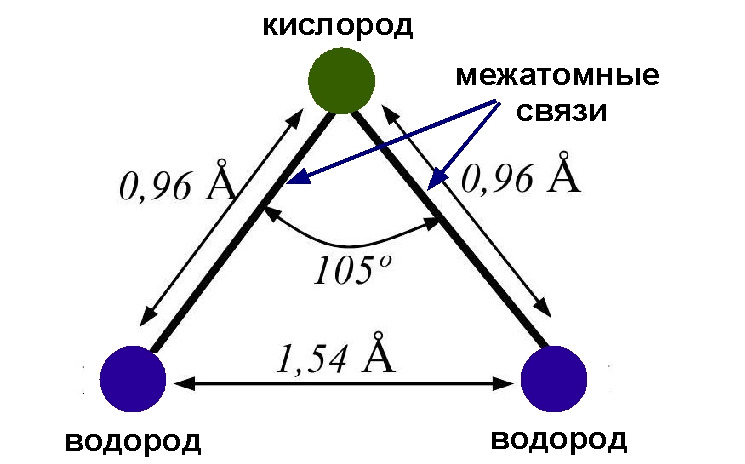
В молекуле воды атомы водорода относительно атома кислорода образуют равнобедренный треугольник, расположение атомов в молекуле воды, в состоянии жидкости, показано на рис 3. Размеры на рисунке приведены в ангстремах Å, как это принято в ядерной физике. Связано это с тем, что один ангстрем приблизительно равен диаметру орбиты электрона в атоме водорода. С другой стороны 1Å=10—10м. Отсюда следует, что по диаметру блюдца с водой (15 см) могут поместиться около миллиарда молекул воды.
Размеры молекулы, при изменении водой своего агрегатного состояния, меняются незначительно: молекула пара сжимается на 1%, молекула льда расширяется на 4%. Последнее свойство приводит к тому, что лед плавает в обычной воде, и водоем замерзает не всем своим объемом, а последовательно сверху — вниз.
Однако молекулы воды далеко не стабильны. Даже самая чистая вода обладает способностью к химической диссоциации — распаду некоторой части пар молекул Н2О в объеме жидкости на отрицательный ион гидроксила (ОН_) и положительный ион гидроксония (Н3О+). Этот процесс носит обратимый характер и может быть охарактеризован такой формулой:
2Н2О → (ОН_) + (Н3О+) → 2Н2О
Свойство диссоциации у воды приводит к тому, что даже чистая вода, не имеющая никаких посторонних примесей, например дистиллированная по ГОСТ 6709—72, может иметь при температуре +180С проводимость около 0,75 микросименс.
Конфигурация молекулы простой воды (1Н) 216О представляет собой полярное соединение, см. рис 4.
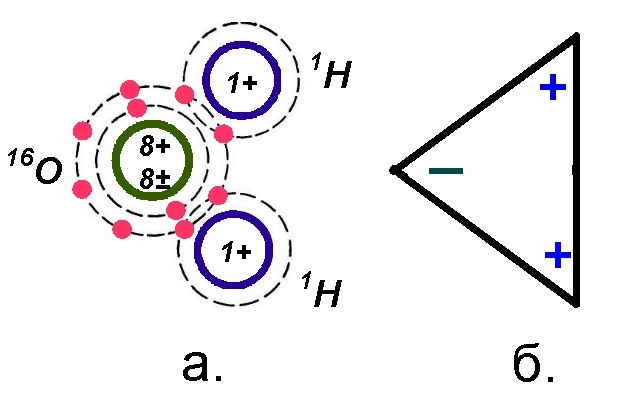
Полярное соединение, или, по химической терминологии, ковалентное соединение характеризуется том, что электронный заряд в нем распределен не однородно. На поз. а рис. 4 показано положение атома кислорода 16О и двух атомов водорода 1Н, у которых электроны как бы захвачены ядром кислорода. В результате кислородный угол молекулы воды несет отрицательный заряд, а два водородных угла — положительные заряды, это схематически показано на поз. б рис. 4.
Полярность воды приводит к тому, что ее молекулы притягивают ионы электровалентных соединений, при этом разрушая их кристаллическую структуру. Такой процесс происходит, например, с кристаллами поваренной соли NaCl, см. рис. 5.
В 1951 г. датский химик Нильс Бьеррум (1879—1958) предложил свою модель структуры льда, в которой молекула воды представляла собой четырехугольную пирамиду-тетраэдр, у которой широкую сторону занимали атомы водорода, а узкую — атом кислорода. Поэтому на рис 5. «треугольники» молекул воды — это тетраэдры Бьеррума — вид сверху.
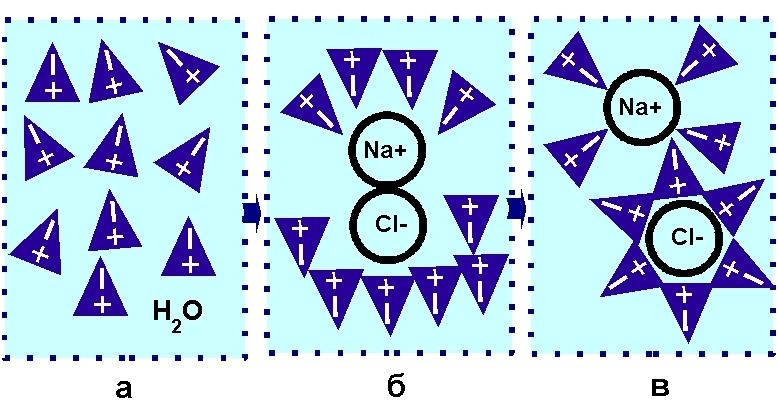
Если твердые кристаллы поваренной соли поместить в воду (поз. а рис. 5), то полярные молекулы воды окружают молекулу поваренной соли (поз. б рис. 5), при этом силы, удерживающие вместе ионы натрия и хлорид-ионы, оказываются слабее, чем силы притяжения этих ионов молекулами воды. В результате происходит растворение кристаллов поваренной соли в воде, и ионы натрия и хлорид-ионы «плавают» отдельно, окруженные молекулами воды (поз. в рис. 5). Такое свойство молекул воды делает воду одним из самых сильных растворителей из всех жидкостей.
Процесс, показанный на рис. 5, несколько упрощен, т.к. небольшое количество воды непрерывно распадается на ионы гидроксила (ОН_) и гидроксония (Н3О+), а непрерывно указанные ионы образуют молекулу воды. Но при этом разрыва кислородно-водородных связей в молекуле воды не происходит. Это связано с тем, что на это требуется большая энергия — в среднем 111 ккал/моль на одну такую связь. В молекуле воды две кислородно-водородные связи, следовательно, для их разрыва нужна энергия 222 ккал/моль = 12,3 ккал/г = 12300 ккал/л. Много это или мало? Приведем два примера:
— для того чтобы нагреть 1 л воды от 200С до 1000С необходимо 80 ккал;
— при взрыве гремучего газа (см. опыт Кавендиша в 1781 г.) с образованием 1 л воды выделяется 3172 ккал.
Приведенные цифры свидетельствуют — для разрыва кислородно-водородных связей в одном литре воды требуется очень большая энергия, в 4 раза превосходящая энергию взрыва гремучего газа, при котором образуется литр воды, и в 154 раза превосходящая энергию, необходимую для кипячения этой воды. Если нагревать воду в специальном закрытом сосуде, то даже при температуре 14000С будет разрушено не более 0,1% молекул воды от их общего нагреваемого количества.
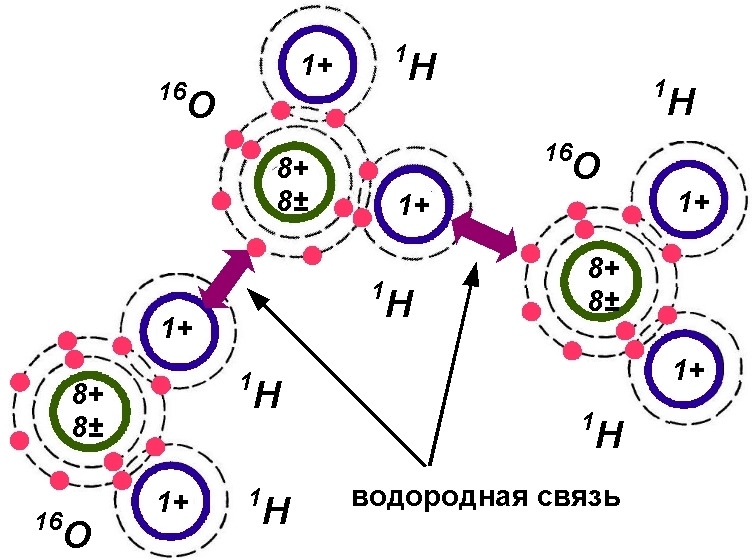
Однако взаимное расположение молекул воды существенно отличается от расположения, показанного на поз. а рис. 5. Воде свойственна особая структура — это принципиальное открытие сделано в 1932 г. английскими физиками Джоном Берналом (1901—1971) и Ральфом Фаулером (1889—1944) на основе данных рентгеноструктурного анализа. Бернал и Фаулер установили, что молекулы воды связаны между собой водородными связями, что приводит к образованию в жидкой воде групп молекул — ассоциатов. Причина возможного образования водородной связи состоит в смещении единственного электрона водорода в своей молекуле воды к атому кислорода, что позволяет положительному ядру водорода притягиваться к электронной оболочке кислорода у другой молекулы воды. Кластер из трех молекул воды показан на рис. 6.
Открытие Бернала и Фаулера показывало, что отдельные участки в жидкой воде напоминают структуры, которые вода образует в состоянии льда. Первооткрыватели не определили процентное отношение между свободными молекулами и молекулами, объединенными в кластеры. Нет общего мнения по этому вопросу и сегодня. Энергия водородной связи в кластере невелика — 6,9 ккал/моль, поэтому в отдельных микрообъемах воды упорядочение молекул носит статистический характер. Расстояние, на которые могут приблизиться друг к другу в кластерах атомы кислорода, достигает 5,5 Å, при этом для льда характерно расстояние 2,8 Å
Между молекулами в ассоциатах и свободными молекулами в воде при конкретной температуре наблюдается равновесие, возможно, среднее число ассоциированных в кластеры молекул в обычной воде в нормальных условиях находиться между 3 и 4. Согласно наиболее распространенным современным представлениям структура жидкой воды состоит из совокупности двух изменяющихся микрофаз: структурированные участки из льдоподобных кластеров; не структурированные отдельные молекулы воды. При этом простые кластеры воды имеют не менее 10 –ти различных метастабильных модификаций.
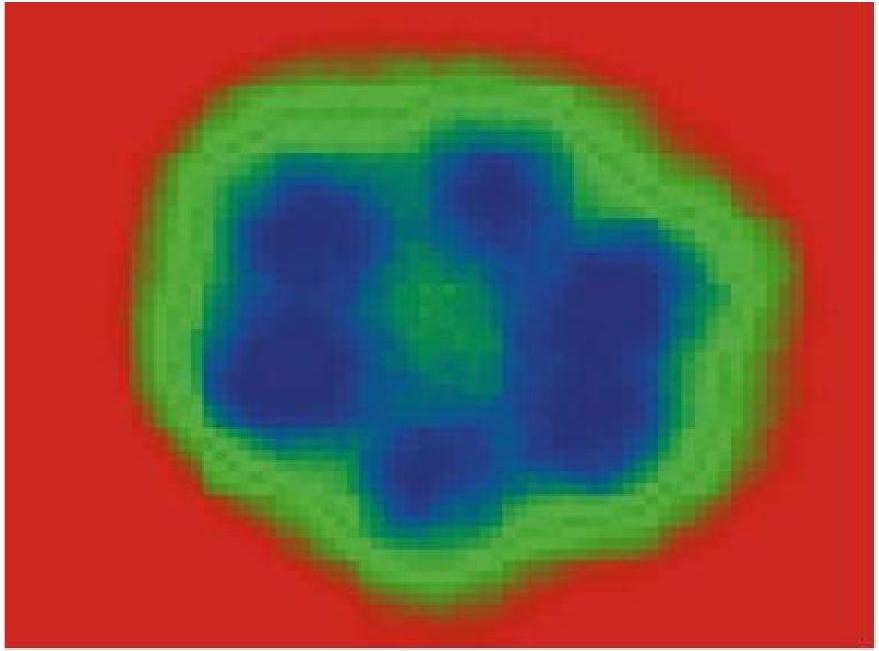
На рис. 7 показана фотография кластера воды из 6 молекул, полученная с помощью туннельного микроскопа [100], средний диаметр этого кластера около 10Å = 10—6 мм.
Одновременно с документальным обнаружением в воде малых кластеров в ходе ряда современных экспериментальных работ с использованием лазерной интерферометрии показано, что в воде происходит непрерывное образование и разрушение и гигантских кластеров воды с размерами 10–100 мкм, содержащих 1010 — 1012 молекул воды. Период образования и разрушения этих «гигантов» более 1 сек, его величина зависит от температуры воды, присутствия в воде растворенных веществ и многого другого.
На рис. 8 приведено лазерное фото участка воды с гигантскими кластерами, размер фото по вертикали 0,5 мм, кластеры достигают длины до 0,2 мм [101].

Молекулы воды и кластеры воды, как и все объекты, имеющие определенную массу, геометрию и размеры обладают и собственными, только им присущими частотами собственных колебаний. Этот параметр чрезвычайно важен для предмета нашей книги, т.к. мы планируем активировать воду гиперзвуком — т.е. раскачивать молекулы и кластеры воды и менять ее структуру. Разумеется, наиболее эффективно это можно сделать на собственных частотах молекул и кластеров воды.
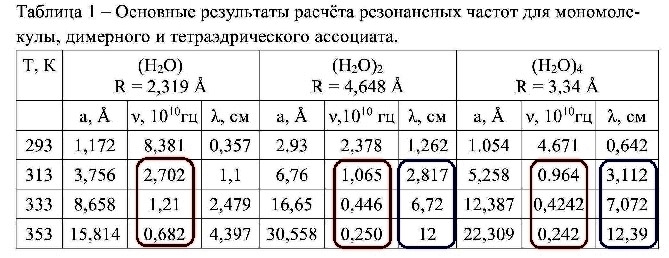
На рис. 9 показана таблица расчета резонансных частот собственных колебаний для мономолекулы воды, димерного ассоциата воды (двойного кластера), тетраэдрического ассоциата воды (четверного кластера) [88].
Обратим внимание на данные обведенные красным контуром.
При Т = 3130К = 400С частота собственных колебаний у молекулы воды Н20 очень велика — ν = 27 ГГц, при Т = 3530К = 800С частота понижается, но остается очень высокой ν = 6,82 ГГЦ.
При Т = 3130К = 400С частота собственных колебаний у двойного кластера воды (Н20) 2 равна ν = 10,6 ГГц, при Т = 3530К = 800С частота понижается до частоты ν = 2,50 ГГЦ.
При Т = 3130К = 400С частота собственных колебаний у четверного кластера воды (Н20) 4 равна ν = 9,64 ГГц, при Т = 3530К = 800С частота понижается до частоты ν = 2,42 ГГЦ.
При этом известно, что длина волны резонансного поглощения энергии для воды составляет λ = 12,24 см., что соответствует частоте ν = 2,45 ГГц.
Из вышесказанного можно сделать три вывода:
— длина волны резонансного поглощения энергии воды не соответствует длине волны собственного резонанса мономолекулы воды;
— длина волны резонансного поглощения энергии воды весьма близка к длине волны резонанса по 1-й гармонике у двойного и четверного кластера воды при Т = 3530К = 800С, и близка к длине волны резонанса по 4-й гармонике у двойного и четверного кластера воды при Т = 3130К = 400С.
— в процессе резонансного поглощения энергии наибольший вклад вносят не молекулы воды, а ее ассоциаты — в частности двойные и четверные кластеры.
Важным параметром при колебательном процессе у любого объекта является амплитуда колебаний. На рис. 10 показаны диаграммы влияния амплитуды колебаний у молекул и кластеров воды [88]. Данные диаграммы носят не очевидный характер — в нормальных условиях Т = 2930К = 200С амплитуда собственных колебаний у тетраэдрического ассоциата воды (четверного кластера) даже меньше, чем у обычной молекулы воды, и составляет величину менее 1 Å. Это меньше длины водородной связи (5,5 Å). И только при Т = 3130К = 400С амплитуда колебаний у четверного кластера становиться больше длины водородной связи.
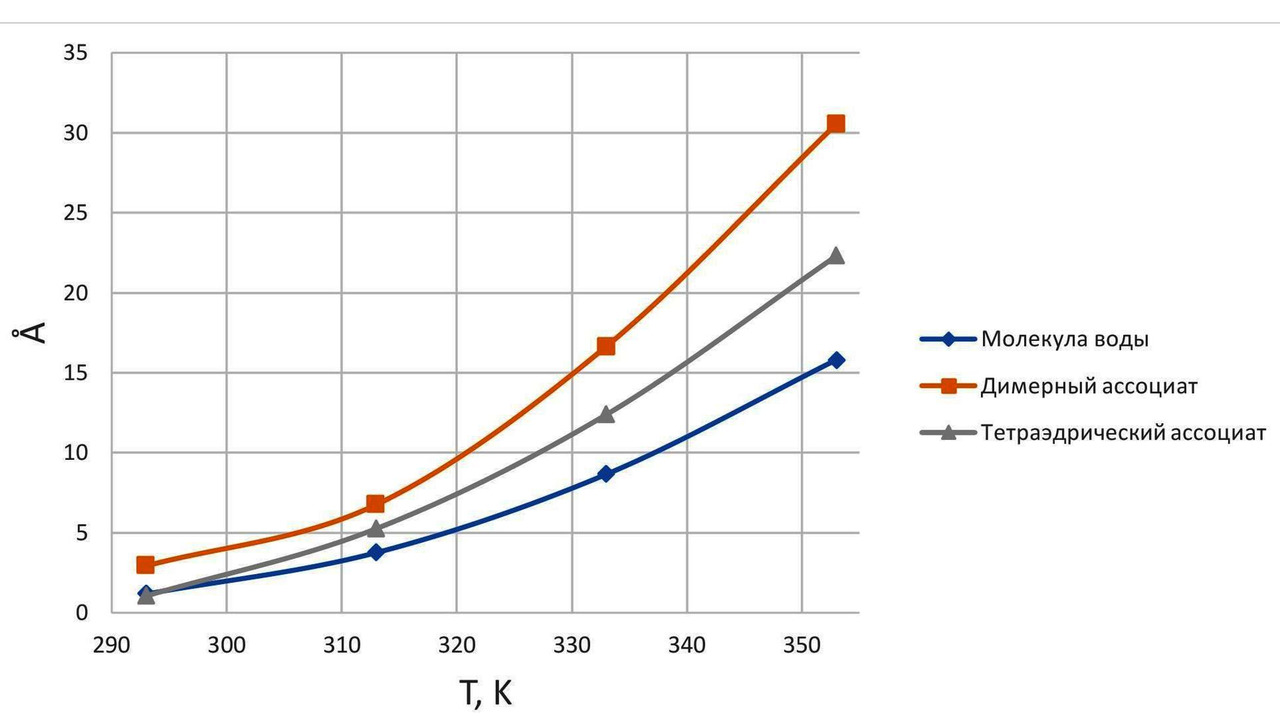
Из этой особенности собственных колебаний кластеров воды можно сделать два вывода:
— нагрев воды при ее активации в некотором смысле полезен;
— в нормальных условиях, а также при более низких температурах амплитуда колебаний кластеров воды меньше размера водородных связей, и изменений в структуре воды, вероятно, существенно меньше, чем при температуре Т = 3130К = 400С.
В заключение 1-й главы авторы докладывают читателю, что, несмотря на современное интенсивное теоретическое и практическое изучение структуры воды до сих пор не создано её единой теории, которая таким образом описывала бы все детали и особенности реальной структуры воды, что можно было бы точно объяснить все многочисленные непосредственно наблюдаемые факты и экспериментальные результаты.
Глава 2. Активация воды
Некоторые исторические факты
В 430 г. греческий ученый Зосима из Панополиса, проживавший в Александрии, вводит в обшее употребление слово «химия». Он ведет исследования и существенно совершенствует дистилляцию растворов и воды. На рис. 11 показано дистилляционное оборудование Зосимы (из манускрипта 15-го века).
В 945 г. арабский историк и путешественник Али Аль-Масуди (896—956), проживавший в Каире, провел опыт с выпариванием раствора соли в дистилляционной колбе и установил, что при этом перегоняется пресная вода. Он же предположил, что морская вода соленая, потому что реки, впадающие в море, растворяют в своем течении земли и соли из почвы.
В 1100 г. арабский врач Абульказис (? -1106), проживавший в Кордобе, в своей работе упоминает о перегонке вина при описании получения розовой воды, которую он использовал для лечения.
В 1735 г. немецкий врач Фридрих Гофман (1660—1742) готовит искусственные минеральные воды — кислые и горькие, и получает из природной минеральной воды карлсбадскую соль, для своих искусственных вод. Фридрих Гофман работал деканом медицинского факультета университета Галле, лично лечил от подагры короля Пруссии Фридриха Вильгельма I, эрцгерцога Австрии Карла VI и других важных особ.
В 1748 г. немецкий врач Андреас Маргграф (1709—1782) исследовал в Берлине воду из источника богатого железном. Маргграф подтвердил целебные свойства этой воды, в результате одному из берлинских районов дано название «Гезундбруннен» — «Целебный источник».
В 1751 г. Маргграф обнаружил наличие азотной кислоты в дождевой воде и предположил наличие азотной кислоты в снежной воде.
В 1761 г. Маргграф обнаружил наличие азотной кислоты в колодезной воде. Эта работа опровергала бытующее мнение о чистоте упомянутых вод.
В 1802—1803 гг. минералог академик Василий Севергин (1765—1826) предпринял экспедицию в западные области Европейской России, в ходе которой он исследовал берега многих рек. В 1804 г. он работал в Финляндии где, по всей видимости, проводил определение химического состава поверхностных вод, в 1809 г. в Тверской губернии он устанавливал врачебное значение Кашинских, Осташковских и Высоцких минеральных источников. [101].
В 1805 г. молодой литовский геолог (немец по национальности) Теодор Гротгиус (1785—1822) прибыл в Рим из Неаполя, где он принимал участие в экспедиции на Везувий. По прибытии он опубликовал на французском языке небольшое теоретическое исследование по вопросу разложения воды электричеством — первое научное исследование на эту тему, которое объясняло механизм разложения воды поляризацией молекул, при которой атом кислорода в молекуле поворачивался в сторону положительного полюса, а водород в сторону отрицательного. Исследование было напечатано в Париже в журнале «Annalen де Chemie», затем перепечатано в английских и немецких журналах. Постепенно к теории Теодора Гротгуса присоединились многие ведущие химики, в том числе английский химик Дэви. В большей степени теория уроженца Литвы Теодора Гротгиуса оказалась верной и сохранилась до наших дней. [100].
В 1807 г. российский химик Федор Рейсс (1778—1852) провел серию интересных опытов, от опытов лабораторных до опытов на Москва-реке и открыл явление переноса воды через пористое препятствие под действием электричества. Рейсс применял вольтов столб из 92 серебряных и цинковых пластинок, он наблюдал выделение водорода и кислорода на платиновых электродах, помещенных в воду (т.е. электролиз воды), и перемещение воды от положительного к отрицательному полюсу вольтова столба через пористое препятствие, в качестве которого в первом опыте использовался толченый камень [98]. Позднее явление, открытое Рейссом, получило название «электроосмос». Принцип электроосмоса, открытый Рейссом широко используется в медицине в аппаратах электрофореза.
В 1820—21 г. немецкий бальнеолог Фридрих Струве (1781—1840), владевший аптекой в Дрездене, впервые начал производить искусственную минеральную воду по своему рецепту на своей фабрике в Дрездене. В 1823 г. Струве совместно с Штольманом получает прусский патент на изготовление искусственных минеральных вод, после чего учреждения аналогичные дрезденскому были построены в Лейпциге, Берлине, Брайтоне — «Королевский немецкий курорт», Кенигсберге, Варшаве, Москве, Санкт-Петербурге, Киеве и в других городах.
Методы активации воды
Что такое активация воды и как ее активировать? Принято считать под активацией воды некое внешнее воздействие на нее. Это внешнее воздействие может быть выполнено и техническим, и природным и любым иным способом. Перечислим основные пути активации воды.
1. Активация воды с использованием постоянного электрического тока.
При такой активации непосредственно через воду пропускается электрический ток. Главный вопрос, который мы должны при таком виде активации поставить — будет ли получаемый в процессе активации продукт водой?
2. Активация воды использованием постоянного, либо переменного магнитного поля.
На Земле есть свое магнитное поле, оно имеет свою направленность и «характер» — изменение, движение, направление, магнитные «бури». Магнитное поле Земли разное в разных точках земной поверхности. Можно считать — и это будет правильно — что вся вода на Земле уже активирована земным магнитным полем. Разнообразные магнитные устройства вносят свою лепту в подобную активацию воды. Магнитная активация воды не столь долговечна — достаточно сильное земное магнитное поле может все исправить по-своему. Но в разнообразных промышленных установках магнитная активация может давать необходимый результат.
3. Активация воды с использованием постоянного либо переменного электрического поля.
Активация воды электрическим полем. В этом случае вода проходит, либо находится между обкладками конденсаторной установки. Степень активации воды таким способом зависит от ее диэлектрических свойств. И магнитная активация, и электростатическая активация используют в некотором смысле вторичные свойства молекул воды. Вода может некоторое время сохранять и электрический заряд, но быстро его потеряет, при извлечении из конденсаторной установки. Получить технический эффект (скажем, вести очистку воды от примесей и т.д.) в этом случае можно непосредственно в электрическом поле.
4. Активация воды в «электролизерах», получение «живой» и «мертвой» «воды».
Это один из видов активации воды с помощью электрического тока. При этом первичная вода, по сути, уничтожается, и из нее готовят два раствора — у анода собирается кислый раствор, который называют «мертвой водой», у катода собирается щелочной раствор, называемый «живой водой». «Живая вода» имеет водородный показатель рН=10—11, большую прозрачность, щелочной привкус. «Мертвая вода» имеет водородный показатель рН=4—5, коричневатый цвет, кислый привкус, запах. О применении упомянутых «вод» есть много литературы, но главное здесь то, что это не вода — это два раствора, полученные путем электролиза.
5. Активация воды гидродинамическим способом. «А» — вода.
Методика такой активации состоит в пропускании воды по трубопроводам различной конфигурации на больших скоростях — до 450 м/сек. Авторы способа ставят своей целью «дезинтегрировать» кластеры воды, разорвать водородные связи и якобы им это удается. Не будем обсуждать медицинские идеи и саму возможность такой активации.
6. Активация воды путем ее «домашней» дистилляции.
При такой активации используется и сахар, и активированный уголь, и яшма и магниты и настоящая дистилляция, и вымораживание. В этом случае действительно можно получить воду, лучше той, что течет из водопроводного крана. Но изменить молекулярную структуру воды путем ее выпаривания, конденсации и вымораживания невозможно.
7. «Озвученная вода».
Озвучивают воду воздействием на нее внешних звуковых вибраций. При этом считается, что вода будет запоминать и классическую музыку, и пение птиц, и шум моря, и звон колокола, весенний гром и т. п. В примитивном плане вода «активированная» музыкой Чайковского имеет один тип воздействия на человека, при ее употреблении, а «активированная» бубном шамана — другой тип воздействия.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.