
Бесплатный фрагмент - СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ХРОМОСОМ И ДИФФЕРЕНЦИРОВКА КЛЕТОК КРОВИ
STRUCTURAL ORGANIZATION OF CHROMOSOMES AND BLOOD CELL DIFFERENTIATION
Л. И. Чабала, В. А. Чабала
Структурная организация хромосом и дифференцировка клеток крови
STRUCTURAL ORGANIZATION OF CHROMOSOMES
AND BLOOD CELL DIFFERENTIATION
2019
Монография по материалам открытия в области цитогенетики на стыке с кроветворением и физиологией
2019
УДК 611.08 Все права защищены дипломом на открытие №442 от 2012 г..
ББК 52.5 Никакая часть книги не может быть воспроизведена
Ч 121 без письменного разрешения владельцев авторских прав
Чабала Л. И.
Ч 121 Структурная организация хромосом и дифференцировка клеток крови: монография по материалам открытия в области цитогенетики на стыке с кроветворением и физиологией/ Л.И.Чабала, В.А.. Чабала.
Издательство Ridero, 2019. 172 с.
В монографии представлены экспериментальные и теоретические исследования о структурно-функциональной организации хромосом из популяции клеток костного мозга млекопитающего Rattus norvegicus. Открытие преобразований в структуре у двух пар хромосом позволило выявить три типа хромосомных наборов и их связь с дифференцировкой кроветворных клеток. В результате обнаружено хромосомное определение дифференцировки лейкоцитарного, эритроидного и мегакариоцитарного рядов крови.
Открытие вносит новые представления о кариотипе и роли метафазных хромосомных конструкций в процессах реализации генома стволовых клеток в специализированные. Кроме того, дает новые знания об образовании трех типов хромосомных маркеров на разных этапах онтогенеза и о связи интенсивности этого процесса с физиологическим состоянием, зависящим от воздействующих факторов, от потребностей и возможностей организма.
Книга представляет интерес для генетиков, гематологов, физиологов и биологов.
The monograph presents the experimental and theoretical studies on the structural and functional organization of chromosomes from the population of the bone marrow cells of the Rattus norvegicus mammal. The discovery of transformations in the structure of the two pairs of chromosomes made it possible to identify the three types of sets of chromosomes and their relationship with the differentiation of the hematopoietic cells. As a result, the chromosomal determination of the differentiation of leukocyte, erythroid and megakaryocytic rows of blood was found.
The discovery introduces the new ideas about the karyotype and the role of metaphase chromosome structures in the transformation of stem cell genomes into specialized ones. In addition, it gives the new knowledge about the formation of the three types of chromosomal markers at different stages of ontogenesis and about the relationship between the intensity of this process and the physiological state depending on the factors affecting the needs and capabilities of the body.
The book shall be of interest to geneticists, hematologists, physiologists, and biologists.
УДК 611.08
ББК 52.5
© Чабала Л. И., 2019
© Чабала В.А, 2019
Предисловие
Нами впервые экспериментально обнаружено у крыс вида Rattus norvegicus, представителя класса млекопитающих, неизвестное ранее явление структурно-функциональных преобразований метафазных хромосом в популяции клеток костного мозга. В результате выделены три типа хромосомных наборов у каждого субъекта. А затем раскрыты закономерности их образования, зависящие от физиологического состояния организма.
Три разновидности хромосомных наборов имеют определенное конструктивное значение для процессов дифференцировки кроветворных клеток, что доказано экспериментально и проинтерпретировано с позиции существующих научных знаний.
Открытые закономерности структурно-функциональных преобразований хромосом в популяции клеток костного мозга и хромосомное определение трех ростков кроветворных клеток на разных возрастных этапах жизни и физиологических моделях уточняют знания о полиморфизме метафазных хромосом и кариотипе, а также способе реализации генетической программы стволовых клеток в специализированные. Это важно для гематологии и дальнейшего развития цитогенетики, и расширяет представления о состоянии физиологии и здоровья. В работе раскрыта связь структурно-функциональной организации метафазных хромосомных наборов с образованием клеток крови и с физиологией организма.
До наших исследований в гематологии было лишь известно, что родоначальные пролиферирующие клетки по морфологии не различаются. Следовательно, обнаруженные различия на уровне метафазных хромосомных наборов пролиферирующих клеток позволяют изучать гемопоэз на более ранней стадии по сравнению с распознаваемыми по морфологии лейкоцитами, эритроцитами и мегакариоцитами. Кроме того, информация о новом способе реализации генетической информации в онтогенезе организма позволила разработать способ определения состояния костномозгового кроветворения на хромосомном уровне, что существенно важно для гематологии, медицины и цитогенетики.
Открытые новое явление и закономерности образования трех типов метафазных хромосомных наборов по потребностям организма для обеспечения жизнедеятельности, возможно использовать для оценки гемопоэза и состояния физиологии организма, а также проводить исследования по адаптации к факторам разной природы и силы с целью выявлять условия для восстановления здоровья человека.
Introduction
We were the first to experimentally discover a representative of class Mammalia in Rattus norvegicus rats, a previously unknown phenomenon of structural and functional transformations of metaphase chromosomes in the population of bone marrow cells. As a result, the three types of sets of chromosomes were identified in each subject. And afterwards, the laws of their formation depending on the physiological state of the body were revealed.
The three varieties of the sets of chromosomes have a certain constructive meaning for the processes of differentiation of hematopoietic cells, which was proved experimentally and interpreted from the standpoint of the existing scientific knowledge.
The opened regularities of the structural and functional transformations of chromosomes in the population of the bone marrow cells and the chromosomal determination of the three hematopoietic cell sprouts at different age stages of life and physiological models clarify the knowledge about the polymorphism of the metaphase chromosomes and karyotype, as well as the method of implementation of the genetic program of stem cells transforming into specialized ones. It is important for the hematology and the further development of cytogenetics, and it expands the understanding of the state of physiology and health. The paper reveals the relationship of the structural and functional organization of the metaphase chromosomal sets with the formation of blood cells and with the physiology of the body.
Prior to our studies in hematology, it was only known that the original proliferating cells did not differ in morphology. Consequently, the revealed differences at the level of the metaphase chromosomal sets of proliferating cells allow us to study hematopoiesis at an earlier stage in comparison with leukocytes, erythrocytes and megakaryocytes recognized by morphology. In addition, the information on the new method for implementing genetic information in the ontogenesis of the body made it possible to develop a method for determining the state of bone marrow hematopoiesis at the chromosomal level, which is essential for hematology, medicine, and cytogenetics.
It is possible to use the new phenomenon and the regularities of the formation of the three types of metaphase chromosomal sets according to the needs of the body for life support to assess hematopoiesis and the physiological state of the body, as well as to conduct studies on adaptation to factors of different nature and strength in order to identify the conditions to restore the human health.
Глава 1
Представления о кариотипе до наших исследований
и наши приоритетные работы
До наших исследований были опубликованы многочисленные данные о структурной вариабельности метафазных хромосом при анализе клеток костного мозга у разных видов (Орлов В. Н., 1974; Бекасова Т. С., Межова О. Н., 1975; Орлов В. Н., Булатова Н. Ш., 1983; Ахвердян М. Р., 1989; Hungerford D.A., Nowell Т. C., 1963; Yosida Т. H., Amano K., 1965), что объясняли их внутривидовой или надвидовой изменчивостью и эволюцией. При этом сложилась точка зрения об одинаковом кариотипе у всех представителей одного вида по числу хромосом и их морфологии (Орлов В. Н., 1974; Дыбан А. П., Баранов B.C., 1978; Орлов В. Н., Булатова Н. Ш., 1983; Дубинин Н. П., 1976, 1985), и с учетом этого составляли карты хромосом.
У крыс Rattus norvegicus Berkenhout, объекта наших исследований, полиморфизм хромосом рассматривали также с этих же позиций. При этом все авторы у этого вида отмечали в диплоидных клетках на стадии метафазы 42 хромосомы и отдельные особенности в их морфологии. Классификацию хромосом с распределением их на группы с учетом морфологии, в которой хромосомы у лабораторной крысы распределили на четыре группы, предложили в 1963 году (Hungerford D. A., Nowell Т. C., 1963). В первую из них были объединены три пары самых крупных хромосом: субтелоцентрическая, акроцентрическая и субтелоцентрическая. Вторая группа включала 4—10 пары акроцентрических аутосом и половые хромосомы. В третьей группе расположили 11—13 субтелоцентрические пары, а к четвертой отнесли 14—20 пары метацентрических аутосом. Всего в кариотипе выявили 7 пар хромосом метацентрических, 5 пар — субтелоцентрических и 9 — акроцентрических.
Спустя десятилетие, в 1973 году, усовершенствована классификация хромосом у этого вида на основе дифференциальной окраски, аутосомы расположили в ранее принятом порядке, но провели идентификацию хромосомных пар, половые хромосомы поместили в конце кариограммы (Standard Karuotype, 1973). При этом 12 и 13 пары отнесли по морфологии уже к субметацентрическим. В результате в кариотипе выделили 7 пар хромосом метацентрических, 2 пары субметацентрических, 3 пары субтелоцентрических и 9 пар акроцентрических.
Но были опубликованы и другие данные. Так, для одних популяций крыс отмечали 2 пары субтелоцентриков и 11 акроцентриков (Yosida Т. H., Amano K., 1965; Yosida Т. H., 1973), для других — 3 пары субтелоцентриков и 10 акроцентриков (Бекасова Т. С., Межова О. Н., 1975; Yosida T. H., Sagai T., 1973), в третьих — 4 пары субтелоцентриков и 9 акроцентриков (Kral В., 1972), в четвертых — 5 пар субтелоцентриков и 8 пар акроцентриков (Дыбан А. П., Баранов B. C., 1978). И это явление объясняли надвидовыми различиями.
Кроме того, у этого вида описан полиморфизм для трех пар хромосом: 3, 12 и 13 на межпопуляционном и внутрипопуляционном уровнях. Вследствие изменения длины плеч гомологи у этих пар относили к телоцентрическим или субтелоцентрическим, а иногда их находили в гетероморфном состоянии (Дыбан А. П., Удалова А. Д.,1967; Бекасова Т. С., Межова О. Н.,1975; Бекасова Т. С., 1980; Yosida Т. H., Amano K. 1965; Yosida Т. H., 1973, 1979). Таким образом, в литературе явление структурного полиморфизма метафазных хромосом в клетках костного мозга крыс было известно много десятилетий до наших исследований, но объясняли его с позиции внутри- и межпопуляционной изменчивости вида.
Информация об изменениях метафазных хромосом на уровне популяции клеток костного мозга особи до наших исследований отсутствовала. Нами впервые экспериментально обнаружено неизвестное ранее явление структурно-функциональных преобразований метафазных хромосом в популяции клеток костного мозга у каждой особи Rattus norvegicus, представителя класса млекопитающих. При пролиферации стволовых клеток в костном мозге наблюдали у двух пар морфоструктуру хромосом в виде акроцентрической или метацентрической. В результате выделены три типа хромосомных наборов, три их разновидности, что обусловлено специфической упаковкой ДНК для реализации генетической информации в разных по физиологии и функциям кроветворных клетках. Вследствие этого формируются неоднородные метафазные хромосомные наборы по своей морфологической структуре в разных клетках одной популяции костного мозга, и проявляется взаимосвязь организации хромосом с процессами работы генов и физиологией организма. Это совершенно новое объяснение возникновения полиморфизма хромосом в популяции клеток костного мозга организма.
Явление структурно — функциональных преобразований метафазных хромосом в популяции клеток костного мозга млекопитающих при пролиферации стволовых клеток и закономерности образования трех типов хромосомных наборов вносят существенные дополнения и изменения в представления о полиморфизме хромосом и кариотипе, что немаловажно для дальнейшего развития цитогенетики, биологической науки и медицины. В гематологии считали, что родоначальные пролиферирующие клетки по морфологии не различаются (Абрамов М. Г., 1979; Моничев А. Я., 1984; Чертков И. Л., 1985; Груздев Г. П., 1988). Следовательно, хромосомные маркеры дифференцировки кроветворных ростков позволяют изучать гемопоэз на более ранней стадии по сравнению с морфологически распознаваемыми клетками.
Эти факты меняют существующее представление о кариотипе вида, дают информацию о новом способе реализации генетической информации в онтогенезе организма, что важно для генетики и биологии, для гематологии и медицины. На базе открытия разработан способ определения состояния костномозгового кроветворения на хромосомном уровне (Чабала Л. И., 1991).
Научное значение открытия заключается в том, что оно расширяет сложившиеся представления о полиморфизме метафазных хромосом и дает новые знания о реализации генетической программы стволовых кроветворных клеток костного мозга при их дифференцировке в специализированные, которые образуются с учетом потребности организма для обеспечения жизнедеятельности. Кроме того, подобные закономерности могут быть обнаружены и у других млекопитающих, включая человека.
Практическое значение исследований состоит в том, что этот объект Rattus norvegicus и способ определения состояния костномозгового кроветворения на хромосомном уровне можно использовать для изучения и оценки гемопоэза при конкретном состоянии физиологии организма и исследовать его адаптацию к биологическим, химическим и физическим факторам воздействия разной природы и силы. Такие исследования особенно важны в разных областях медицины.
Сведения о приоритете
Первая приоритетная работа: Чабала Л. И. — тезисы «Природа полиморфизма хромосом клеток костного мозга белой крысы» в сборнике тезисов II Всероссийского съезда гематологов и трансфузиологов, 1986. Затем более подробно сущность открытия о структурно-функциональных преобразованиях метафазных хромосом в популяции клеток костного мозга млекопитающего и закономерностях образования типов хромосомных наборов была опубликована также в 1986 году: Чабала Л. И. Функционально-структурные преобразования хромосом в различных пролиферирующих кроветворных клетках костного мозга белой крысы //Космическая биология и авиакосмическая медицина. — 1986. — №3. С. 78—80.
Было сообщение в журнале «Наука и жизнь» под названием «Неожиданные свойства хромосом» /Заметки о советской науке и технике //Наука и жизнь. — 1988. №11. С.40, где указывалось об открытии неизвестного прежде явления.
Далее в 1990 году материалы открытия изданы в журнале «Генетика»: Чабала, Л.И., Машкин, С. И. Особенности морфологии метафазных хромосом в кроветворных клетках белой крысы //Генетика. — 1990. Т.26. — С. 1858—1864.
Результаты теоретических и практических доказательств открытия были также представлены во многих изданиях:
— Чабала, Л. И. Особенности полиморфизма хромосом в клетках костного мозга белых беспородных крыс. Тезисы доклада на V съезде Всесоюзного общества генетиков и селекционеров. М., 1987. — С. 293.
— Чабала, Л. И. Закономерность образования трех типов хромосомных наборов в костном мозге в различные периоды онтогенеза. //Журнал «Доклады Академии Наук СССР», Т. 318, №1, 1991. — С. 217—220.
— Чабала, Л.И., Машкин, С. И. О закономерностях образования структурно-функциональных типов хромосомных наборов в костном мозге у интактных и экспериментальных крыс. //Журнал «Известия Российской АН», №1, 1992. — С. 130—134.
— Чабала, Л. И. Способ диагностики на хромосомном уровне функционального состояния кроветворения у экспериментальных животных. //Журнал «Гематология и трансфузиология», №1, 1995. — С. 32—33.
— Чабала, Л.И., Сливкин, А.И., Чабала, В. А. Явление структурно-функциональных преобразований хромосом в популяции клеток костного мозга у Rattus norvegicus. //Вестник ВГУ. Сер. Химия. Биология. Фармация. 2011, №1.- С.200 — 204, и других работах.
Наше открытие об образовании трех типов хромосомных наборов у крыс, различающихся количеством акроцентрических и метацентрических хромосом, в популяции клеток костного мозга подтвердили в республике Беларусь в институте радиобиологии Национальной академии наук согласно публикации: Николаевич Л. Н., Винник Л. М., Амвросьев А. П. Новый цитогенетический подход в изучении костномозгового кроветворения после действия ионизирующей радиации на организм// Проблемы радиационной генетики на рубеже веков. Москва, 20—24 ноября 2000 г. Тезисы докладов. Изд-во Российского университета дружбы народов.
Авторское свидетельство «Чабала Л. И. Способ определения функционального состояния кроветворения у экспериментальных животных: А.с. 1697747 СССР. — 2 с. 1991. Бюл. №48» также свидетельствует о существовании явления и закономерностей структурно-функциональной организации и преобразований хромосом при формировании трех типов в популяции клеток костного мозга.
Выдан диплом на открытие: Чабала Л. И., Машков О. А., Чабала В. А., Машкин С. И. Закономерность структурно-функциональных преобразований метафазных хромосом в популяции клеток костного мозга млекопитающих/ Диплом №442. Приоритет открытия 13 июня 1985 г. (по дате поступления статьи в редакцию). Регистрационный №554 от 3 декабря 2012 г.
Сущность открытия
Сущность открытия закономерностей структурно-функциональных преобразований метафазных хромосом в популяции клеток костного мозга у млекопитающего состоит в том, что при пролиферации стволовых клеток выявлены у каждой особи реорганизации в морфологии хромосом на примере крысы и три типа хромосомных наборов. Среди кроветворных родоначальных клеток, дифференцирующихся впоследствии в эритроциты, лейкоциты и мегакариоциты, при одном и том же наборе генов и одинаковом числе хромосом осуществляются у двух пар изменения длины плеч. Вследствие этого происходит преобразование морфологической структуры и на стадии метафазы образуется разное число акроцентриков и метацентриков в хромосомных наборах.
Сравнение структурной организации хромосом в наборах из культуры крови и костного мозга показало, что три типа хромосомных наборов образуются только в костном мозге, где происходит дифференцировка и образование лейкоцитов, эритроцитов и мегакариоцитов.
У каждой особи при одинаковом общем числе хромосом 42 были обнаружены три разновидности хромосомных наборов или три типа. Они отличаются количеством метацентрических и акроцентрических хромосом. Тип I включал 26 акроцентрических и 14 метацентрических, тип II соответственно — 24 и 16 и тип III — 22 и 18, и в каждом из типов имелась также одна пара самых больших субтелоцентрических аутосом.
Устойчивые и повторяющиеся преобразования морфологической структуры у 18 и 19 пар метафазных хромосом в маркерах трех ростков крови свидетельствуют о неизвестном ранее способе реализации генома стволовых клеток. Вероятно, это осуществляется при упаковке ДНК специфично в разных по физиологии клетках крови для выполнения специализированных функций.
Кроме того, интенсивность образования трех типов хромосомных наборов — маркеров трех рядов кроветворных клеток существенно различалась на этапах онтогенеза и при воздействии на организм факторов различной природы и силы, которые вызывали неодинаковые физиологические состояния и адекватно им соответствующую интенсивность образования этих маркеров.
Следовательно, открыто новое явление о качестве материи в виде трех типов хромосомных наборов в популяции костного мозга у каждого субъекта. Кроме того, обнаружены определенные количественные закономерности в их образовании, которые осуществляются специфично при различных воздействиях на организм и состоянии физиологии. При этом определены математические и функциональные зависимости, что дает возможность более точно оценивать состояние физиологии организма при разных воздействиях и, таким образом, решать вопросы на новых уровнях по проблеме здоровья человека.
Глава 2
Объекты и методы исследования
2.1. Объекты исследования
В качестве объектов исследования использовали из вида Rattus norvegicus лабораторных белых крыс линий Август, Вистар и беспородных обоего пола из питомников «Столбовая» и «Белый мох» (рис.1), а также серых диких крыс самцов. Всего на изучение различных моделей израсходовано около 500 животных.

Рис. 1. Белая крыса (Rattus norvegicus) — объект цитогенетических исследований структурно-функциональных преобразований хромосом
на уровне популяции клеток костного мозга
В основу исследования положено изучение структурного полиморфизма хромосом в популяции кроветворных клеток костного мозга у интактных животных разного возраста и экспериментальных моделей различной физиологии. На беспородных крысах воспроизводили модели трех разных уровней кроветворения: мегакариоцитопоэза, лейкопоэза, эритропоэза и другие патофизиологические состояния.
2.2. Воспроизведение моделей костномозгового кроветворения
Модель спленэктомии у крыс выполняли под наркозом. Для этого животным вводили внутрибрюшинно короткой иглой в области около средней линии живота и ближе к задней конечности тиопентал натрия из расчета 4 мг на 100 г массы. Операцию выполняли в соответствии с разработанными правилами (Островерхов Г. Е., Лубоцкий Д. Н., Бомаш Ю. М., 1972). Перед операцией животных фиксировали в целях обездвиживания в специальных станках спиной вниз за лапы и зубы и остригали шерстъ в области левого подреберья. Косой разрез делали параллельно левому реберному краю через кожу, мышцы и брюшину. Через вскрытую рану выводили селезенку, перевязывали кровеносные сосуды и затем селезенку отрезали. Рану ушивали наглухо через все слои брюшной стенки, под кожу вносили антисептик.
Модель асептического воспаления создавали по рекомендациям М. Г. Кахетлидзе (1970) и З. М. Долгиной (1972) путем подкожного введения крысам скипидара в области левой задней ноги из расчета 1 мл на 100 г массы.
Модель гипоксического состояния создавали воздействием на животных низким разрежением (Лир Э. В., Стиней К., 1967). Для этого крыс помещали в барокамеру объемом 0,09 м3, где скорость откачивания воздуха превышала скорость его поступления, нужное разрежение создавали с помощью вакуумного насоса. Для контроля барометрического давления использовали вакуумметр контрольный типа ВКО, с верхним пределом измерений 1 кгc/cм2, класс точности 0,6. В барокамере разрежение увеличивали постепенно до 0,70 атм., что соответствовало 9 тыс. м над уровнем моря. Значение разрежения высоте над уровнем моря определяли по таблице 1.
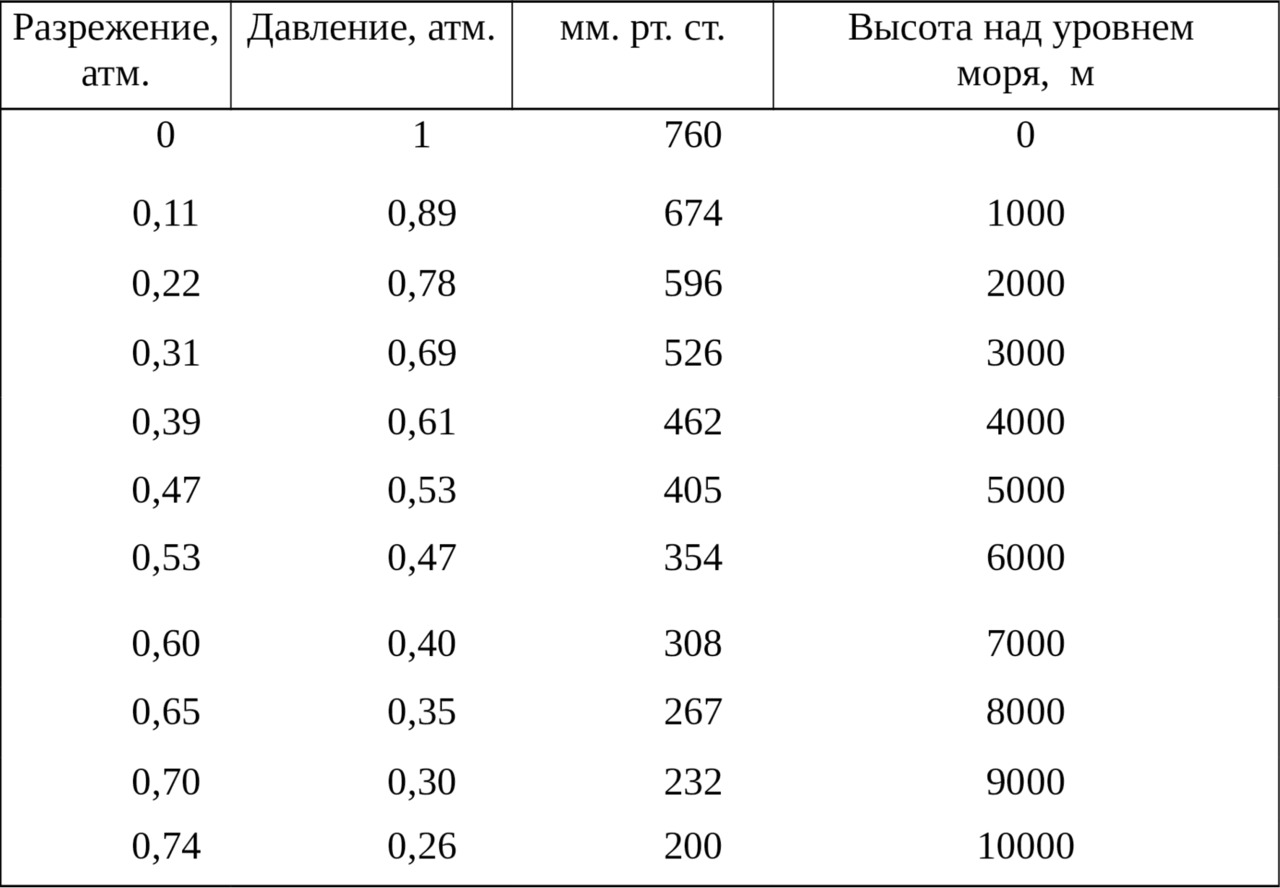
Соответствие разрежения высоте над уровнем моря
(Кошкин Н. И., Ширкевич M.Г., 1988)
2.3. Приготовление микропрепаратов хромосомных наборов и подходы к их изучению
Микропрепараты хромосом готовили по известной методике (Орлов В. Н., Чудиновская Г. А., Крюкова Е. П., 1976) из костного мозга и культуры крови. Для накопления метафазных пластинок в костном мозге животным вводили за 45 мин и 2 ч колхицин из расчета 1 мкг на 1 г массы. Затем крыс забивали путем декапитации, клетки костного мозга вымывали из бедренной кости в центрифужные пробирки 0,075 М раствором хлористого калия, подогретым до 37° С, и помещали их в термостат на 30 мин. По окончании инкубации клетки осаждали центрифугированием при 1000 об/мин в течение 5 мин, надосадочную жидкость осторожно отбирали и в пробирку наливали по 6—7 мл фиксатора из смеси этилового спирта и ледяной уксусной кислоты в пропорции 3:1. Фиксатор, выдержанный предварительно в морозильной камере не менее 1 часа, меняли три раза, фиксацию проводили по 15– 20 мин в морозильной камере. По окончании фиксации суспензию клеток центрифугировали и удаляли надосадочную жидкость. После последней фиксации оставляли около 2 мл жидкости, получали клеточную взвесь и наносили по пять капель на тщательно вымытые, хорошо охлажденные предметные стекла. Препараты подсушивали на воздухе.
Для культивирования клеток периферической крови у животных после анестезии эфиром брали стерильно 2—5 мл крови из яремной вены. Затем эритроциты осаждали 10%-м раствором желатины, плазму отсасывали и разводили в соотношении 1:2 питательной средой Игла или №199. После этого добавляли фитогемагглютинин в количестве 0,01 мл фирмы «Difco P» на 5 мл культуральной среды. Культивирование клеток проводили при 37 °С 72 ч. За 2 ч до окончания культивирования вводили колхицин из расчета 0,25 мкг на 1 мл культуры. Затем клетки осаждали центрифугированием (Захаров А. Ф., Бенюш В. А., Кулешов Н. П., Барановская Л. И., 1982). Все последующие манипуляции по обработке материала сходны с приготовлением хромосом из костного мозга животных.
Препараты хромосом красили методами равномерной и дифференциальной окрасок.
Для равномерной окраски хромосом заблаговременно готовили 0,1% растворы азура и эозина на дистиллированной воде. Рабочий раствор красителя составляли в соотношении: 6 частей азура, 3 части эозина и 9 частей водопроводной воды, длительность окраски была около 15 мин. Затем препараты ополаскивали водопроводной водой и высушивали. Кроме того, для окраски использовали и готовую краску Романовского-Гимза. Ее разведение подбирали в зависимости от качества, чтобы время окраски было 10– 15 мин.
Дифференциальную G -окраску хромосом проводили с учетом рекомендаций А. П. Дыбана и В. С. Баранова (1978). Перед окраской препараты погружали в этиловый спирт на 10– 15 мин, после чего высушивали их на воздухе. Затем препараты обрабатывали около 20 с 0,01% раствором трипсина производства фирмы «Spofa», ополаскивали в спирте и промывали водопроводной водой. Покраску проводили красителем Романовского-Гимза при разведении 1:10 фосфатным буфером (рН 7,0). Оптимальное время окрашивания подбирали эмпирически в зависимости от качества краски.
А также использовали рекомендации А. Ф. Захарова и соавторов (1982) о возможности добавления трипсина в раствор красителя на фосфатном буфере. Для получения G-окраски на каждые 10 мл красителя добавляли 0,3—0,5 мл 0,01% раствора трипсина, окраску препаратов проводили сразу после обработки этиловым спиртом.
Воспроизведение G-окраски зависело от индивидуальных особенностей крыс и сроков хранения препаратов, поэтому в каждом опыте подбор условий для окрашивания проводили эмпирически. При этом лучше красились препараты одно-двухнедельного хранения, хромосомные наборы самок были несколько устойчивее к трипсину и их подвергали большему воздействию фермента. В случае отсутствия дифференциальной окраски препараты отмывали в спирте и вновь повторяли обработку хромосом. А. Ф. Захаров и соавторы (1982) также отмечали, что ни одна из методик не дает хорошего воспроизведения дифференциальной окраски от опыта к опыту.
Дифференциальную С-окраску хромосом осуществляли с использова-нием гидрата окиси бария (Sumner А. Т., Evans H. J., Buckland R. A., 1971; Sumner A.T., 1972). Препараты в начале инкубировали в 0,2 М растворе соляной кислоты в течение 1 ч, затем промывали водой и обрабатывали в насыщенном растворе Ba (OH) 2 5–10 мин при комнатной температуре. После очередного ополаскивания водой стекла помещали в раствор 2xSSC (0,3 М NaCl и 0,3 М цитрата натрия, рН 7,0) при 600С на 1– 1,5 ч и отмывали в трех сменах этилового спирта. Высушенные препараты окрашивали раствором красителя Романовского-Гимза на фосфатном буфере при рН 6,8.
На С-окраску влияли также сроки хранения препаратов. Хромосомы с лучшей окраской получили при хранении препаратов 3—5 суток в условиях комнатной температуры, воздействии Ва (ОН) 2 — 5 мин и инкубировании в 2xSSC 1 ч.
Отбор метафазных пластинок для анализа, как известно (Орлов B.Н., Чудиновская Г. А., Крюкова Е. П., 1976), принято проводить в количестве 20—50 шт. с полным числом хромосом, четко различимой морфологией и минимальным наложением, что нами и соблюдалось. При этом мы отбирали все пластинки с хорошей морфологией из популяции клеток костного мозга и из культуры периферической крови без выбора по степени спирализации.
Для исследования микропрепаратов применяли микроскопы Биолам, МББ-1А, МБИ-6, JENAVAL. Поиск метафазных пластинок вели при малом увеличении микроскопа, просматривая предметные стекла «челноком». Изучение хромосомных наборов осуществляли при большом увеличении под микроскопом, а также после микрофотосъемки на фотографиях и рисунках.
Идентификацию морфологии хромосом в метафазных пластинках осуществляли на микрофотографиях и под микроскопом визуально с учетом положения центромеры и соотношения линейных параметров плеч. Морфологические типы определяли на основе известных рекомендаций по положению центромеры и длине плеч (Прокофьева-Бельговская А. А., 1969; Орлов B.Н., Чудиновская Г. А., Крюкова Е. П., 1976; Levan A., Fredga К., Sanderson A.A., 1964). При оценке считали, что у метацентрических хромосом плечи почти равной длины, у субметацентрических — положение центромеры несколько смещено от середины, у субтелоцентрических — плечи резко неравной длины, у акроцентрических хромосом центромера имеет терминальное расположение и второе плечо почти незаметно. Морфометрический анализ и идентификацию морфоструктуры также осуществляли по соотношению линейных параметров плеч: у метацентрических хромосом — 1—1,7, субметацентрических — 1,7—3, субтелоцентрических –3,0—7,0 и акроцентрических — 7 и более (Орлов B.Н., Чудиновская Г. А., Крюкова Е. П.,1976).
Распределение метафазных хромосом по группам провели по известным рекомендациям для изучения кариотипа человека (Захаров А. Ф., Бенюш В.А, Кулешов Н. П., Барановская Л. И., 1982).
Идентификацию трех типов хромосомных наборов осуществляли с учетом количества акроцентрических и метацентрических хромосом. При одинаковом числе хромосом 42 в типе I имелось 26 акроцентрических и 14 метацентрических, соответственно в типе II — 24 и 16 и в типе III — 22 и 18. Кроме того, в каждом из типов присутствовала одна пара самых больших субтелоцентрических хромосом.
Измерение линейных параметров хромосом выполняли с учетом известных приемов (Паушева З. П.,1970; Орлов B.Н., Чудиновская Г. А., Крюкова Е. П.,1976), но в нашей модификации (Чабала Л. И., 1988), что позволило точнее снимать параметры в микрометрах с рисунков или отображения с негатива.
Известен способ измерения микрообъектов в микрометрах под микроскопом с помощью шкалы окуляр-микрометра (Паушева З. П.,1970). При изучении хромосом на микроскопе МББ-1 под объективом 90 используют окуляр с увеличением 7, имеющий приспособление для окуляр-микрометра. В этом случае цена одного деления окуляр-микрометра равна 2 мкм.
Но у крыс большинство хромосом имеют линейные параметры 2 мкм и меньше. Следовательно, цена одного деления окуляр-микрометра 2 мкм является довольно большой величиной и не позволяет точно снять параметры с изучаемых нами объектов. Кроме того, при большом числе хромосом в кариотипе последовательно выделить и измерить каждую из них под микроскопом чрезвычайно трудно. В этой связи нами разработан способ измерения абсолютных линейных параметров хромосом, который позволяет проводить анализы с более высокой точностью. Для этого мы фотографировали при одном и том же увеличении хромосомные наборы и линейку объект-микрометра, затем их с негатива увеличивали также при одних и тех же условиях и измерение хромосом проводили линейкой-шкалой, построенной на основе линейки объект-микрометра (рис. 2).
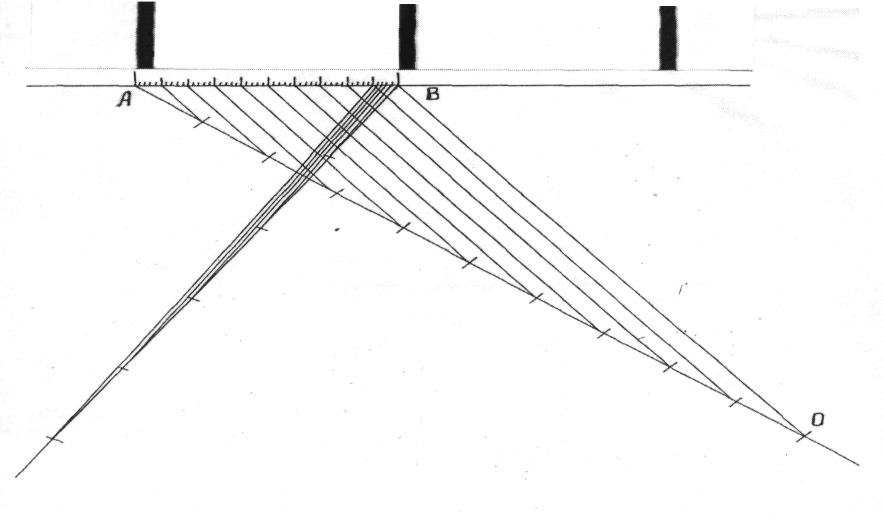
построение линейки-шкалы для измерения хромосом
Цена 1-ого деления линейки объект — микрометра, как известно, составляет 0,01 мм или 10 мкм. Фотографии таких участков в 10 мкм после увеличения показаны на рис. 2. На одном из них строили по теореме Фалеса линейку-шкалу для измерения хромосом. Для этого из крайней точки А провели под углом луч АО, отложили на нем 10 конгруэнтных отрезков и последнюю точку О соединили с точкой В калибруемого участка. Затем параллельно прямой ОВ из остальных 9 точек луча провели линии, разделившие калибруемый участок на 10 конгруэнтных отрезков, каждый из которых соответствовал 1 мкм. Последние аналогичным образом поделили еще на пять частей и получили отрезки с ценой 0,2 мкм. Эту линейку-шкалу использовали для измерения линейных параметров хромосом.
Микрофотографирование проводили с помощью фотонасадочной камеры и аппаратом «Зенит» или «Зоркий» на пленку микрат-300. Фотосъемку осуществляли при увеличении объектива 90, апп. 1,30, ок.10 или 15 с фиолетовым светофильтром.
Митотическую активность клеток в костном мозге определяли путем подсчета числа клеток во всех фазах митоза, встречающихся при просмотре 6000 клеток, а затем пересчитывали их количество на 1000 штук (Бобкова Н. Н., 1981).
2.4. Методы исследования кроветворных клеток
Морфологические типы клеток распознавали с учетом данных гемма-тологического атласа М. Г. Абрамова (1979, 1985) и «Руководства по гемато-логии» (Тодоров И., 1963).
Лейкоэритробластическое соотношение изучали на микропрепаратах клеток костного мозга. Для этого делали отпечатки клеток на предметные стекла, их фиксировали в метиловом спирте и для покраски использовали азур-эозин по Романовскому-Гимзе. Концентрацию рабочего раствора и время окраски подбирали эмпирически. Разбавление краски проводили дистиллированной водой с рН 6,8–7,0. Это обусловлено тем, что при кислой или щелочной реакции рабочего раствора изменяется тональность окраски органоидов клетки и время прокрашивания. Кислую воду (рН ниже 6,8) подщелачивали по каплям 1%-ым раствором карбоната натрия, щелочную (рН выше 7,0) подкисляли 1% — ым раствором уксусной кислоты (Тодоров И., 1963).
Рабочий раствор готовили перед окраской препаратов в небольшом количестве. Например, для покраски одного препарата разводили 4 капли краски в 2 мл дистиллированной воды, время окраски было 13 минут.
На препаратах отпечатков клеток костного мозга считали соотношение клеток эритроидного и лейкоцитарного рядов в расчете на 500 клеток.
Мегакариоциты считали на препаратах из костного мозга для анализа хромосом, их количество определяли на 6000 клеток костного мозга и затем пересчитывали на 1000 штук.
Подсчет лейкоцитов в крови проводили по следующей методике. Кровь для анализа брали у крысы из хвостовой вены, при этом хвост подогревали в теплой воде, затем надрезали. После взятия крови надрез смазывали йодом (Ахметов И. З., 1981). Подсчет клеток крови выполняли в счетной камере Горяева определенного объема, поделенной на квадраты, которые вышлифованы в особой стеклянной пластинке.
Кровь разводили в пробирках в отношении 1:20 3%-ым раствором уксусной кислоты, подкрашенной генцианфиолетом. Камеру заполняли разведенной кровью, накрывали покровным стеклом и под микроскопом проводили подсчет в 100 средних квадратах, имеющих длину 1/5 мм, то есть в объеме 2/5 куб. мм. Для пересчета количества лейкоцитов в 1 куб. мм умножали число лейкоцитов, обнаруженных в камере, на число, показывающее во сколько раз подсчитанный объем меньше 1 куб. мм (число, обратное величине подсчитанного объема, то есть 5/2), и степень разведения (Тодоров И., 1963).
2.5. Статистическая обработка
Статистическую обработку результатов исследований осуществляли на основе рекомендаций Е. К. Меркурьевой (1970), Е. М. Четыркина, И. Л. Калихмана (1982). Мы определяли ошибку средней арифметической и средней взвешенной по методу Стъюдента, а также достоверность разности между средними арифметическими двух выборок. Взаимосвязь исследуемых признаков оценивали с помощью коэффициента корреляции и корреляционного отношения.
Статистическую обработку экспериментальных данных проводили и по соответствующим программам с использованием ЭВМ.
Кроме того, при анализе полученных опытных результатов наблюдений от разных периодов онтогенеза и сроков использовали множественный регрессионный анализ и создали аппроксимирующие уравнения. Выбор класса аппроксимирующей функции осуществляли с учетом характера связи исследуемых признаков и на основе значений, полученных экспериментальным путем. Расчет коэффициентов уравнений проведен по специальной программе, реализованной на ЭВМ ЕС-1840 (Исследования…, 1991). Она предназначена для решения задач, связанных с построением аппроксимирующих уравнений исследуемых зависимостей малоинформативных членов из предварительно полученного уравнения. В качестве показателей точности и адекватности аппроксимации описываемых зависимостей использованы коэффициенты детерминации регрессии (квадрат коэффициента множественной корреляции) и стандартное отклонение полученной аппроксимирующей функции.
Коэффициент детерминации регрессии является мерой эффективности регрессионной модели и выражает собой отношение суммы квадратов отклонений значений от среднего, обусловленных регрессией, к сумме квадратов полных отклонений экспериментальных данных от среднего в соответствующих точках. Таким образом, коэффициент детерминации регрессии измеряет долю общего разброса относительно среднего, а также показывает насколько полно выбранное уравнение аппроксимации характеризует рассматриваемую зависимость.
Стандартное отклонение остатков показывает разброс отклонений выборочных значений зависимой переменной от поверхности отклика, описываемой аппроксимирующим уравнением.
Глава 3 Структурно-функциональные преобразования метафазных хромосом в популяции клеток костного мозга
3.1. Явление вариабельности метафазных хромосом в костном мозге и классификация хромосомных наборов
У объекта наших исследований в популяции клеток костного мозга мы находили в клетках диплоидное число хромосом 42 (Чабала Л. И., 1986, 1988, 1991; Чабала Л. И., Машкин С. И., 1990; Чабала Л. И., Сливкин А. И., Чабала В. А., 2011), что совпадало с данными других исследователей. Но нами на уровне клеточной популяции костного мозга выявлено явление структурно-функциональных изменений в организации метафазных хромосом в популяции клеток костного мозга у каждой особи Rattus norvegicus. А это является новым фактом в науке и отличием от ранее описанного в литературе полиморфизма хромосом при характеристике вида.
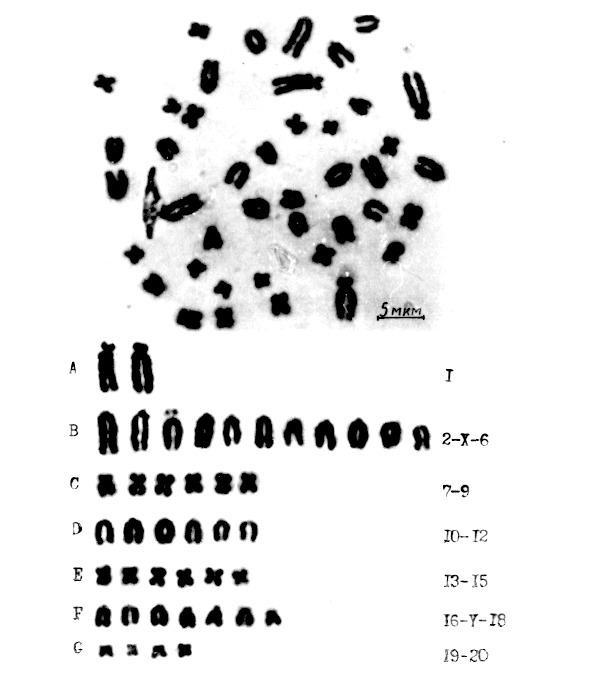
Для анализа обнаруженного явления нами разработана новая условная классификация с учетом линейных параметров, формы и структурной изменчивости хромосом. При этом мы использовали известные подходы к классификации хромосом человека, выработанные на международных совещаниях (Захаров А. Ф. и др., 1982).
Хромосомы в нашей классификации распределили на 7 групп от A до G в порядке уменьшения линейных параметров, с учетом морфологической структуры и дифференциальной окраски различных пар. Аутосомные пары пронумеровали с 1 по 20, последовательность их расположения совпадала с ранее принятой классификацией лишь по 1 — 6 паре. Для идентификации половых хромосом использовали принятый принцип исключения их из гомологичных пар с учетом индивидуальной морфологии и особенностей окраски, а также выводы Бекасовой Т. С. (1980) и других авторов (Yosida T.H., Sagai T., 1973; Satoh R. и др., 1989), что X — хромосома большая и Y — самая мелкая акроцентрические.
Групповая идентификация хромосом показана на идеограмме (рис. 3). В группах А, В и С расположены наиболее крупные хромосомы, но А имеет одну пару субтелоцентриков (1), В — пять пар акроцентриков и Х- хромосому (2-Х-6), а С содержит три пары метацентрических аутосом (7—9).
В следующих двух группах D и Е находятся по три пары средних по размерам хромосом, в первой из них акроцентрические (10—12), а во второй — метацентрические (13 — 15 пары). Группы F и G включили остальные самые мелкие хромосомы, но в F — акроцентрические и V- хромосому, а в G — метацентрические.
Итак, самые крупные легко распознаваемые субтелоцентрические хромосомы находятся в группе A. Соотношение плеч у них варьировало в большинстве случаев от 3 до 4,5, но иногда это значение было около 5.
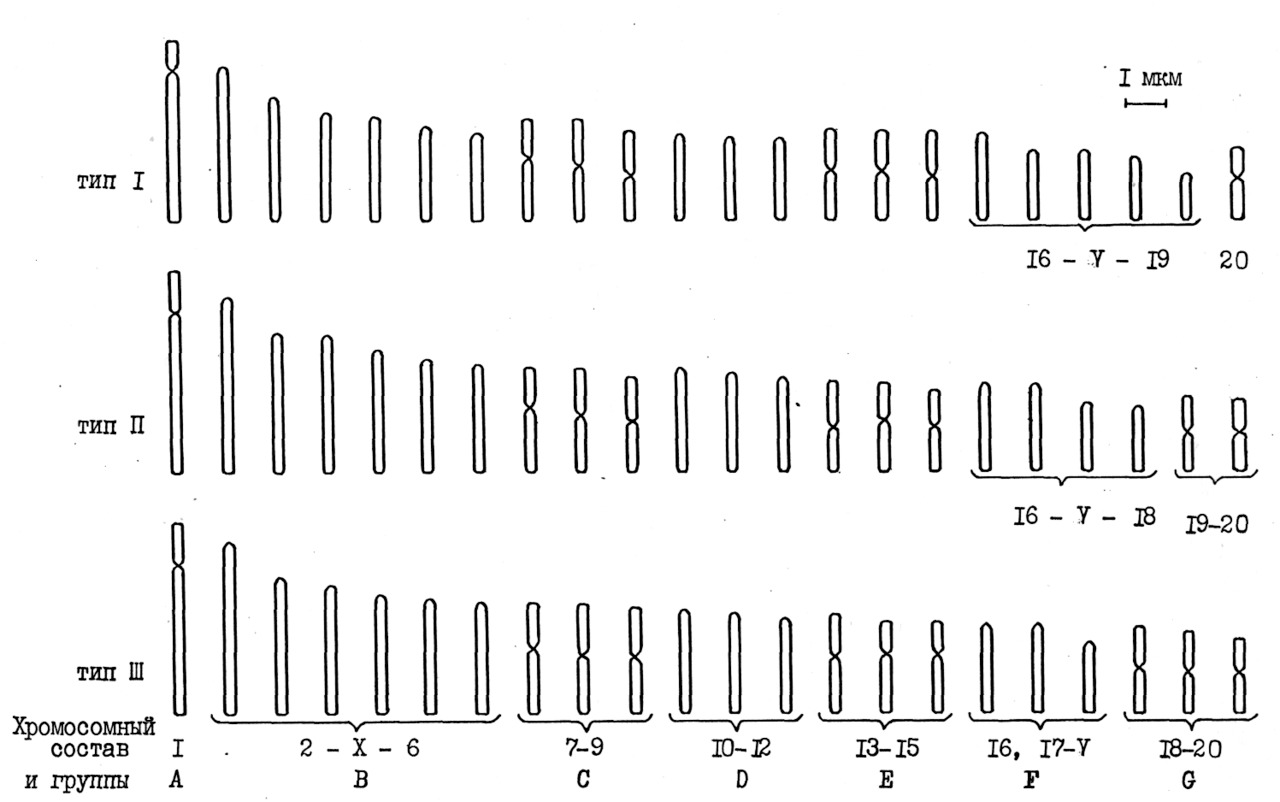
из клеток костного мозга самцов крыс
Группа B имеет 5 пар самых больших акроцентрических одноплечих аутосом и X — хромосому. Среди них по наибольшим размерам выделяется пара 2. Следующая пара чаще всего выглядела как резко акроцентрическая с расположением центромеры в конце плеч, но иногда у одного или обоих гомологов наблюдали спутники. При этом соотношение плеч у хромосом было от 6,6 до 9, то есть форма варьировала в принятых пределах акроцентрического типа. Полиморфизм у этой пары хромосом, связанный с появлением спутников, был ранее описан для разных популяций крыс (Бекасова Т. С., 1980; Yosida Т. H., Amano K., 1965). Но в наших исследованиях спутники у пары 3, а иногда у более мелких хромосом в этой группе наблюдали на уровне популяции клеток костного мозга.
Группа C содержит три пары наиболее крупных метацентрических хромосом и близких к ним. У аутосом этой группы иногда наблюдали изменение соотношений плеч, и их значение было 2 — 2,3, следовательно, форма таких хромосом приближалась к субметацентрической.
Группы D и E имеют по три пары аутосом, средних по размерам и константным по форме, но в D — акроцентрические, а в E — метацентрические.
Группы F и G объединяют самые мелкие хромосомы, но в F — акроцентрические и близкие к ним со смещением центромеры к концу плеч, а в G — метацентрические с соотношением плеч от 1 до 1,7.
В некоторых клетках хромосомы 16 пары из группы F имели спутники. Соотношение плеч у них было от 4,6 до 7,6, то есть имели субтелоцентрический фенотип. Более значительные изменения вследствие варьирования длины плеч обнаружили у двух других пар хромосом: 18 и 19, морфологическая структура которых изменялась от акроцентрической до метацентрической. Поэтому их относили или к группе F или G. С учетом этой изменчивости выделили три типа хромосомных наборов в популяции клеток костного мозга и по количеству пар метацентриков в группе G их обозначили как типы I, II и III.
Таким образом, первые пять групп: A, B, C, D и E состояли из хромосом с относительно стабильной формой. Две последние группы F и G включали хромосомы с лабильной формой вследствие различной структурной организации 18 и 19 пар хромосом в популяции кроветворных клеток костного мозга. В результате изменения длины плеч у хромосом наблюдали явление фенотипического их разнообразия и формирование разновидностей структурного полиморфизма у каждой особи. В этой связи имели тип I: 26 акроцентрических и 14 метацентрических, тип II: 24 акроцентрических и 16 метацентрических, тип III: 22 акроцентрических и 18 метацентрических хромосом и, кроме того, в каждом из них находилось по одной паре крупных субтелоцентрических аутосом (Чабала Л. И., 1986, 1987, 1988, 1991; Чабала Л. И., Машкин С. И., 1990; Чабала Л. И., Сливкин А. И., Чабала В. А., 2011).
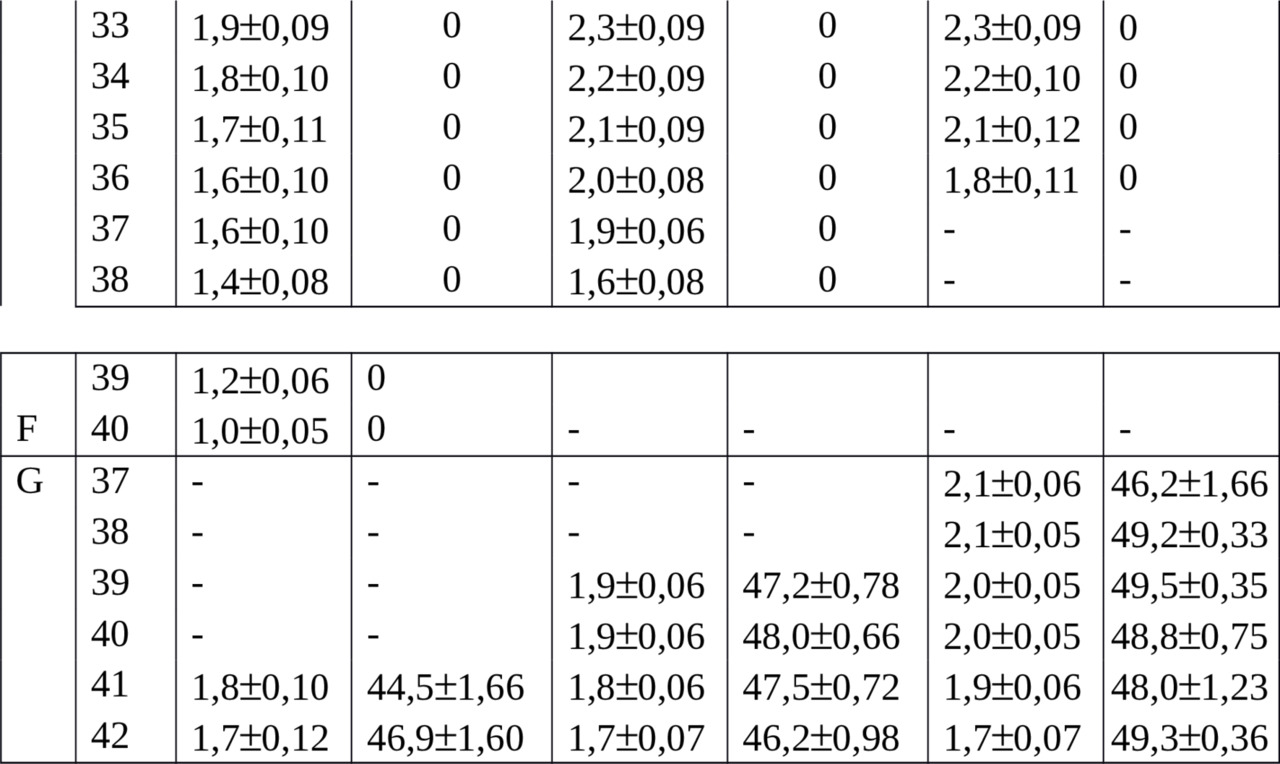
Мы провели морфометрический анализ 40 метафазных пластинок, из них было типа I — 9, типа II — 17 и типа III — 14 шт., которые были получены от двух самцов и после 2 — часового воздействия колхицина. Морфометрические параметры хромосом в группах трех типов были следующими (табл. 2).
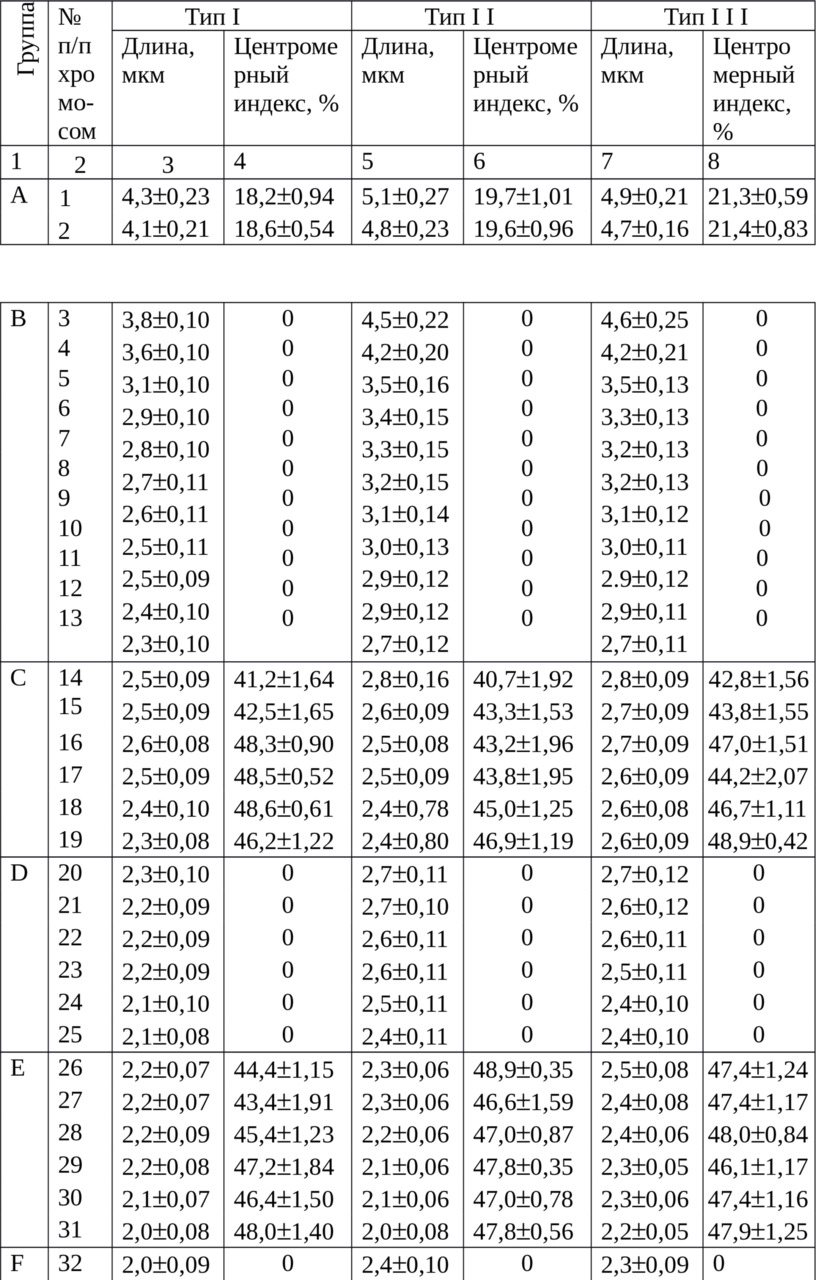
Средние морфометрические параметры хромосомных наборов
трех типов из популяции клеток костного мозга
Р> 0,999
Многие исследователи достоверным критерием однородности метафазных хромосом по степени спирализации считали близкую длину одной или нескольких пар хромосом (Павульсоне С. А., Иорданский А. Б., 1971; Орлов В. Н., Булатова Н. Ш., 1983). Этот принцип прослеживается и в нашей выборке. Линейные параметры последней 20-ой метацентрической пары аутосом, то есть хромосом 41 и 42, были близкими. У первой из них в типах I, II и III, соответственно, составили 1,8±0,10; 1,8±0,06 и 1,9±0,06, а у второй — 1,7±0,12; 1,7±0,07 и 1,7±0,7 мкм (Р> 0,999) и при центромерном индексе выше 44%. Это свидетельствует о близкой степени спирализации ДНК у хромосом на стадии метафазы в наборах трех типов.
В группе A гомологи субтелоцентрических хромосом различались между собой в разных типах по длине на 0,2—0,3 мкм, а по центромерному индексу — на 0,1—0,4%. Наименьшие хромосомы 4,3 и 4,1 мкм в среднем и с самым малым центромерным индексом 18,2 и 18,6% в среднем находили в типе I. В типах II и III эти показатели были несколько выше.
В группе B, то есть у 2 — 6 пар акроцентриков, линейные параметры наименьшие были также в типе I: от 3,8 до 2,3 мкм. В типе II они уменьшались от 4,5 до 2,7 мкм и в типе III — от 4,6 до 2,7 мкм в среднем. В этой группе больше сходства по длине было среди хромосом из типов II и III.
В группе С у 7- 9 пар метацентриков имеет место дальнейшее плавное уменьшение длины и в типе I с 2,5 до 2,3 мкм, в типе II — с 2,8 до 2,4 мкм и в типе III — с 2,8 до 2,6 мкм, центромерный индекс был выше 40%. При этом у хромосом №16 и 19 в типах I и II значения линейных параметров отличались незначительно при центромерном индексе выше 43%.
В группах D и E, объединивших средние по линейным параметрам хромосомы, но в первой из них акроцентрические, а во второй метацентрические, размеры также убывали. В типе I аутосомы были от 2,3 до 2,1 и от 2,2 до 2,0 мкм, в типе II — от 2,7 до 2,4 и от 2,3 до 2,0 мкм, в типе III — от 2,7 до 2,4 и от 2,5 до 2,2 мкм в среднем.
Центромерный индекс у хромосом группы Е был выше 43% в типе I, в типах II и III — выше 46%. При этом у метацентрических хромосом №№26 и 31 из типов I и II значения линейных параметров отличались незначительно или совпадали при центромерном индексе выше 44%.
В группах F и G, где расположены наименьшие акроцентрические и метацентрические хромосомы, наблюдали дальнейшее уменьшение линейных параметров, соответственно: в типе I от 2,0 до 1,0 и 1,8 — 1,7 мкм, в типе II — от 2,4 до 1,6 и от 1,9 до 1,7 мкм, в типе III — от 2,3 до 1,8 и от 2,1 до 1,7 мкм. в среднем. В типах II и III акроцентрические хромосомы по размерам мало отличались. У хромосом группы G центромерный индекс был во всех типах выше 44,5% в среднем и их длина была близкой.
У полиморфных хромосом линейные размеры находили наибольшими в типе III, где они метацентрические, и наименьшими в типе I, где они акроцентрические. Так, хромосомы №№39 и 40 имели линейные параметры в типе I, соответственно, 1,2 ± 0,06 и 1,0 ± 0,05 мкм, а в типе III гомологи были одинаковые и составили 2,0 ± 0,05 мкм.
Таким образом, среди трех типов наблюдали наименьшие линейные параметры у хромосом в типе I. Морфометрические исследования показали, что у субтелоцентрических и большинства акроцентрических хромосом в трех типах процесс спирализации проходит неодинаково и наиболее интенсивно в типе I, за счет чего формировались более мелкие хромосомы. У метацентрических хромосом различия между тремя типами были менее значительные. Эти особенности определяются индивидуальными свойствами хромосом и режимами упаковки ДНК в метафазных хромосомах из разных клеток. Ранее А. Б. Иорданский и соавторы (1974) также пришли к выводу, что каждая хромосома в процессе митоза имеет свой режим конденсации вследствие индивидуальных структурно-функциональных свойств.
Морфометрический анализ метафазных хромосом из популяции клеток костного мозга крыс также показал специфический режим конденсации по упаковке ДНК на уровне трех типов. Это связано с их подготовкой к дифференцировке в направлении лейкоцитов, мегакариоцитов и эритроцитов.
На идиограмме (см. рис. 3) видно, что при расположении хромосом в порядке уменьшения их длины и с выделением групп больших, средних, малых акроцентриков и метацентриков имеются отдельные исключения. В группе G метацентрики были несколько крупнее в сравнении с рядом расположенной пары акроцентриков и особенно в типе I. В этом же типе последняя пара хромосом имела линейные параметры несколько больше предпоследней пары из группы F. Центромерный индекс варьировал в трех типах незначительно. В основном визуально прослеживается уменьшение линейных параметров хромосом по группам. Наименьшие хромосомы были в типе I.
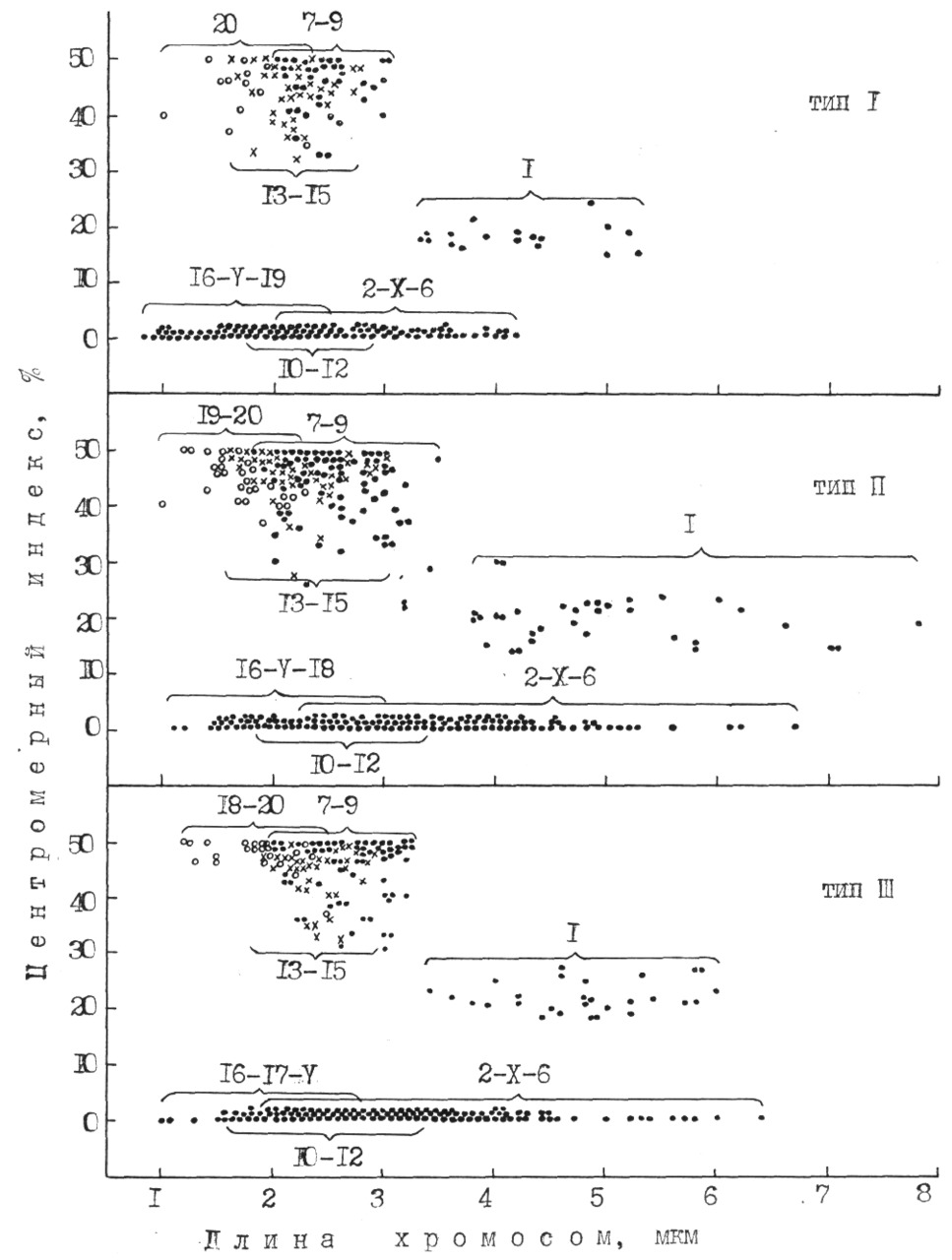
По средним данным морфометрии хромосом построены поликариограммы (рис. 4) в системе двух координат, где на одной из них отображали длину хромосом в мкм, а на другой — центромерный индекс в процентах.
метацентрические хромосомы; x — средние метацентрические хромосомы; o — малые метацентрические хромосомы
Рис. 4. Поликариограммы хромосомных наборов трех типов самцов крыс
В результате были наименьшие границы изменчивости линейных параметров хромосом из типа I и наибольшие — в типе II, тип III занимает промежуточное положение. Следовательно, у субтелоцентрических и акроцентрических хромосом в разных типах наборов процесс спирализации и упаковки ДНК проходит неодинаково и более интенсивно в типе I. За счет этого там образуются хромосомы с наименьшими линейными параметрами. В неадекватности линейных параметров по степени спирализации и упаковки ДНК одних и тех же хромосомных пар из разных типов проявляются их различные функционально-генетические, а затем и физиологические свойства в разных ростках кроветворных клеток. Через различную изменчивость морфологии хромосом в трех типах проявляются функциональные и генетические различия между ними.
Известно, что упаковка ДНК происходит специфически и с учетом активности генов (Храпунов С. Н., Драган А. И., Бердышев Г. Д., 1987). Следовательно, в популяции костного мозга неадекватность линейных параметров и различную организацию морфологических структур хромосом в разных типах наборов определяется направление дифференцировки и работа генов с учетом будущей специализации и образования лейкоцитов, эритроцитов и мегакариоцитов. Так проявляются индивидуальные функционально-генетические установки на дифференцировку разных типов специализированных клеток.
Таким образом, классификация хромосомных наборов из костного мозга с учетом их линейных параметров и морфоструктуры позволила выделить три типа хромосомных наборов, различающихся количеством акроцентрических и метацентрических хромосом.
Метафазная хромосома — это плотно упакованная нить ДНК, которая в стволовых клетках имеет одинаковый набор генов. При митозе набор генов в клетках не меняется, но в специализированных эритроцитах, лейкоцитах и мегакариоцитах изменяется соотношение неактивных и активных генов, кодирующих образование различных белков.
Эти изменения закладываются через упаковку ДНК на стадии интерфазы, когда определяется направление дифференцировки клеток в соответствии с потребностями организма и его физиологией, что затем сказывается на организации морфологической структуры метафазных хромосом в разных клетках.
Итак, в костном мозге происходит образование трех основных морфологических типов кроветворных клеток: лейкоцитов, эритроцитов и мегакариоцитов и направление к их дифференцировке осуществляется через образование трех типов хромосомных наборов.
3.2. Сравнение структурной организации хромосомных наборов из культуры крови и костного мозга
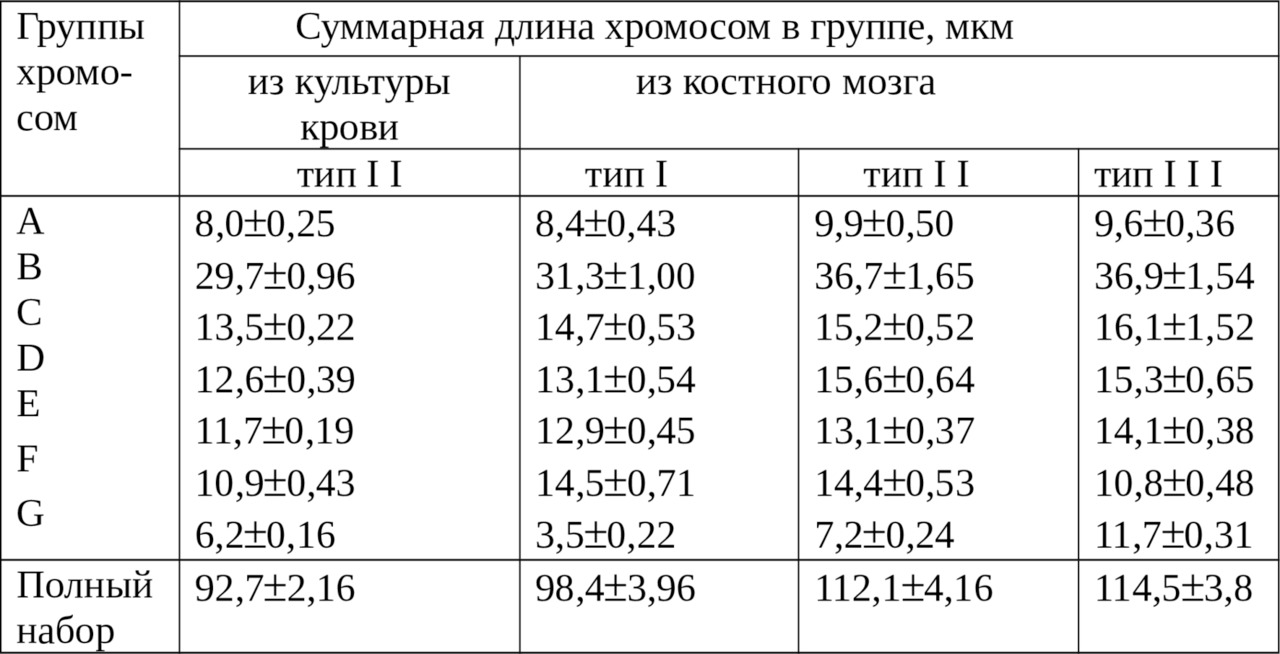
Для изучения структурной организации хромосом в лейкоцитах крови была поставлена культуры клеток крови от 4 самцов беспородных белых крыс. Визуально проанализировано 52 хромосомных набора, и все они имели структурную организацию по типу II (рис.5).
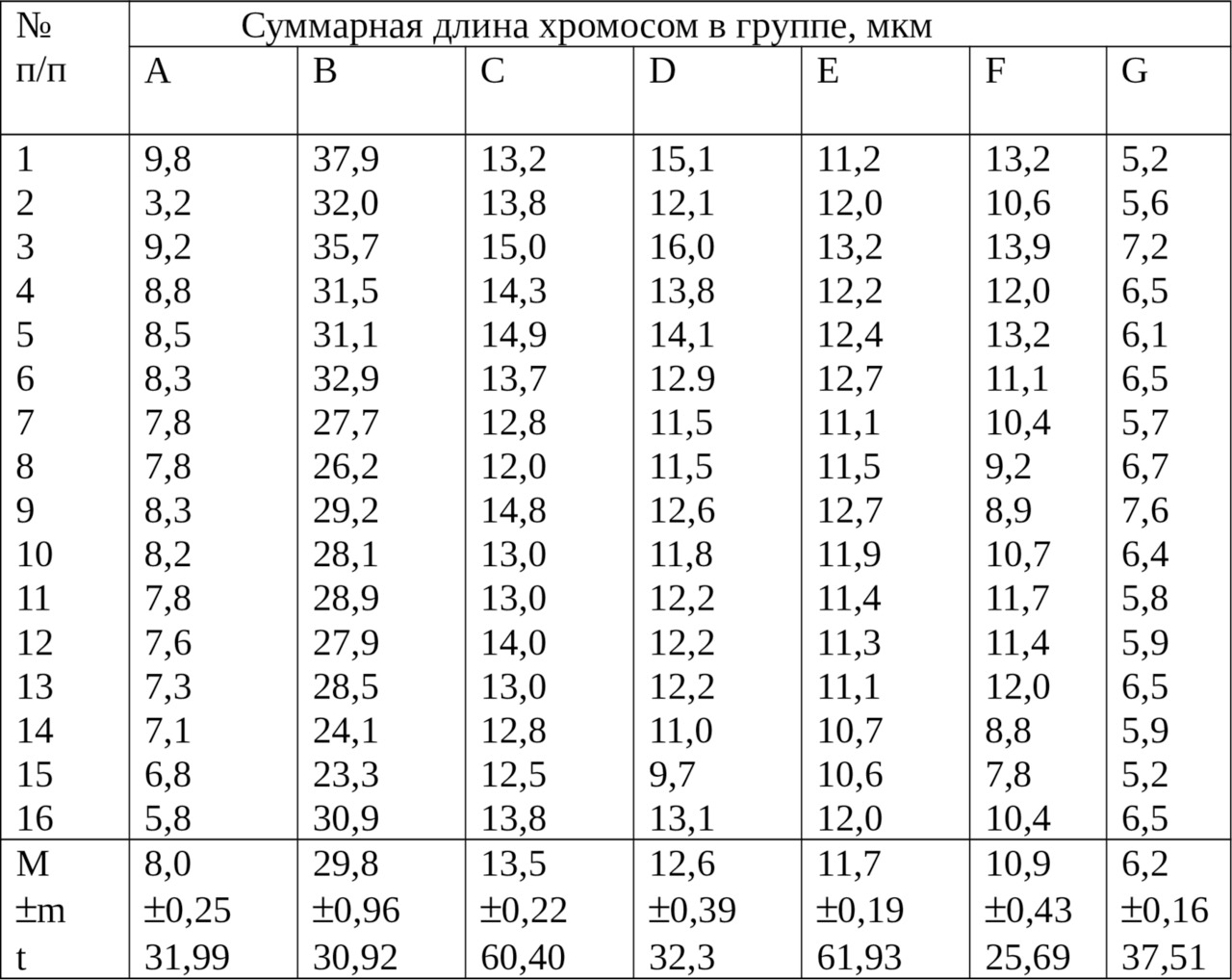
Для морфометрической идентификации использовали 16 метафазных пластинок. Оценку достоверности степени спирализации провели по средней суммарной длине хромосом в группах и критерию достоверности (табл. 3). Этот подход согласуется с мнением А. Р. Круминя (1989), который считает, что самым точным показателем степени спирализации может служить суммарная длина хромосомного набора, но такая работа трудоемка.
периферической крови белой крысы самца
В культуре крови, как известно, обладают способностью к делению лимфоциты (Бочков Н. П., 1971; Олиници К. Д.,1982), и нами там выявлен лишь один тип II структурной организации хромосом. В костном мозге, где образуются три ростка кроветворения (Абрамов М. Г.,1979, 1985), нами выделены три основных типа структурных организаций хромосом.
При сравнении морфометрических показателей хромосом из крови и костного мозга не обнаружено различий по центромерному индексу, но линейные параметры хромосом из крови были меньше. Длина в среднем у самой большой и наименьшей хромосомы из культуры крови была 4,2±0,12 и 1,1±0,05 мкм, а в этом типе из костного мозга — 5,1±0,37 и 1,6±0,08 мкм с достоверностью разности между ними соответственно при Р> 0,95 и P> 0,999.
Суммарная длина хромосом в группах из клеток культуры крови представлена в таблице 3.
Наименьшую вариабельность по суммарной длине наблюдали у метацентрических хромосом групп С, Е и G, у которых был наибольший критерий достоверности (t): 60,4; 61,9 и 37,5.
Суммарная длина хромосом в группах из культуры клеток крови
Сопоставление линейных параметров из культуры клеток и костного мозга показано в таблице 4. Если в костном мозге длина всех хромосом в наборе была наименьшей в типе I — 98,4±3,96 мкм и наибольшей в типе III — 114,5±3,78 мкм, то в клетках из культуры крови она составила лишь 92,7±2,16 мкм. Это было значительно меньше суммарной длины хромосом типа II из костного мозга, где равнялась 112,1±4,16 мкм.
Зафиксированные различия на стадии метафазы по структурной организации хромосом в наборах из культуры крови и костного мозга можно объяснить лишь различными условиями пролиферации.
Сопоставление линейных параметров хромосом
из культуры крови и костного мозга
Д. Конки и соавторы (1989) отмечали, что размножение и дифференцировка клеток требуют различных условий.
Процессы дифференцировки родоначальных кроветворных клеток в костном мозге, как известно, осуществляются при влиянии различных гормонов и других уровней регуляции с учетом потребностей организма (Моничев А. Н., 1984; Гаврилов О. К., Фанштейн Ф. Э., Турбина Н. С., 1987). В культуре крови отсутствуют сложные уровни регуляции, имеющиеся в организме, поэтому там образуется один тип хромосомных наборов — тип II. В костном мозге, где происходит кроветворение и дифференцировка клеток в разных направлениях при одном и том же генном наборе, что и в культуре крови, образуются три типа хромосомных наборов.
На стволовые клетки в организме оказывают влияние различные процессы контактных и дистанционных биохимических воздействий с учетом внутренней среды организма и его потребностей. Следовательно, этот сложный механизм взаимодействия обуславливает в костном мозге формирование трех типов хромосомных наборов.
3. 3. Идентификация трех типов хромосомных наборов при дифференциальных окрасках
На равномерно окрашенных хромосомных наборах из костного мозга четко прослеживается различие по числу акроцентрических и метацентрических морфоструктур, но гомологичные пары достоверно идентифицировать можно лишь некоторые.
С целью более четкой идентификации пар аутосом и выделения половых хромосом мы провели G-окраску с применением протеолитического фермента трипсина. При этом мы не получали всегда идентичной G-окраски половых хромосом и аутосом как в трех типах хромосомных наборов, так и в пределах типа. Сегментная проработка структуры хромосом во многом зависела от дозы и времени действия колхицина и фермента (рис. 6).
На фотографиях одного и того же набора типа II показано, что при малом воздействии фермента (рис. 6а) имеется некоторая сегментация у первой субтелоцентрической пары и отдельных акроцентрических хромосом, у метацентрических хромосом сегменты почти не выражены.
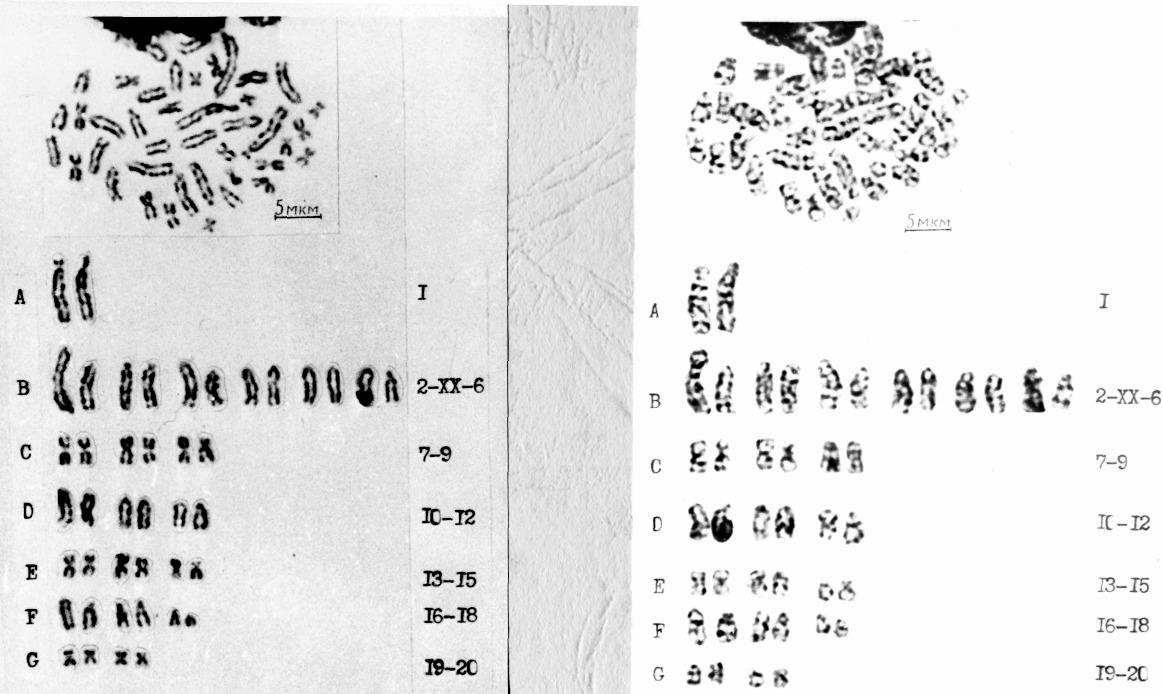
Рис. 6. Сравнение структуры хромосом одного набора
при первоначальном (а) и повторном воздействии трипсина (б)
При повторной обработке трипсином (рис. 6б) увеличивалось число сегментов, но морфологическая идентификация 12, 15, 17, 18 и 19 хромосомных пар проведена только с учетом первоначального вида, вследствие нарушений и изменений структур.
Итак, при обработке трипсином режим сегментации различных хромосом зависит от степени его воздействия, и может происходить такое нарушение морфологической структуры, что трудно распознать морфологическое строение. Нарушение структуры хромосом при этом окрашивании отмечали Г. Макгрегор, Дж. Варли (1986), М. Р. Ахвердян (1989).
Однако, некоторую воспроизводимость дифференциальной G-окраски наблюдали. В лучших случаях акроцентрические пары хромосом имели характерную окраску из темных и светлых полос, у метацентрических хромосом сегменты часто обособлялись в виде точек, хуже всего проявлялась окраска у мелких хромосом (рис.7).
В трех типах наборов, полученных от животного при воздействии колхицина 45 мин, Х-хромосома имела сходную акроцентрическую форму и окраску, но в типе I она была несколько мельче. Доминирующей ее особенностью было наличие двух темноокрашенных сегментов. Другие авторы (Дыбан А. П., Баранов В. С., 1978; Hungerford D.A., Nowell Т. C., 1963) эту хромосому описывали как наиболее темноокрашенную вследствие сливания семи гимза-положительных полос разной интенсивности.
Половая Y-хромосома по линейным параметрам и особенностям морфологии была часто близкой к 17 паре акроцентрических аутосом, и поэтому наименьшей акроцентрической по отношению к хромосомам набора она была лишь в типе III (cм. рис. 7в). Окраска ее в разных типах, как и линейные параметры, варьировали. В I типе Y-хромосома в большинстве случаев имела равномерную темную окраску, в типе II она часто отличалась наибольшими линейными параметрами и двумя темными полосами, в типе III также идентифицировали похожие полосы.
Неидентичность окраски Y-хромосомы также отмечали А. П. Дыбан, В. С. Баранов (1978). Они находили в большинстве случаев равномерную темную окраску, а у менее спирализованных хромосом обнаруживали более светлую дистальную часть. А Lewan (1974) выделил у этой хромосомы шесть полос в проксимальной части хромосомы.
Неидентичность G-окраски половой Y-хромосомы в трех типах хромосомных наборов, видимо, взаимосвязана с разной степенью ее спирализации и линейными параметрами.
У аутосом G-окраска также варьировала. У субтелоцентрических, акроцентрических и метацентрических хромосом не наблюдали в трех типах воспроизведение идентичной окраски. Вариабельность по структуре сегментации у прометафазных гомологичных хромосом ранее отмечали у крыс R. Satoh и соавторы (1989), у хромосом человека –А.Ф.Захаров (1977), Н. П. Кулешов (1989), что объясняли разной степенью их конденсации.
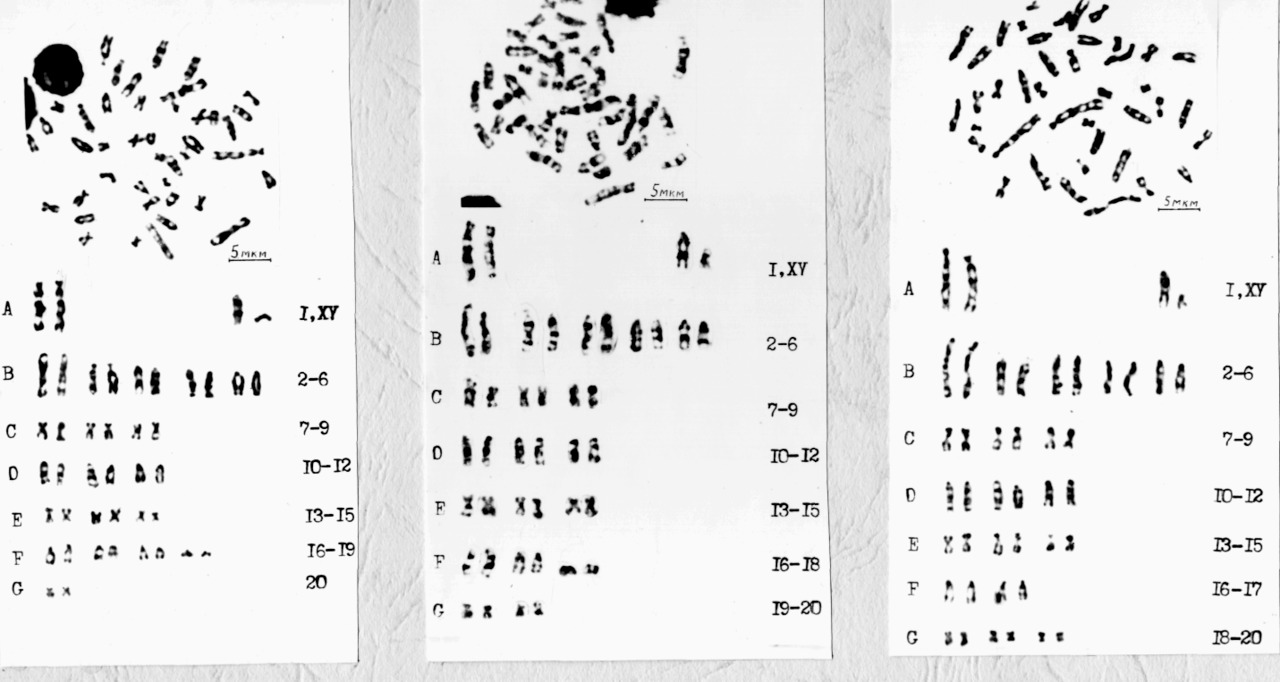
Рис. 7. G — окрашенные хромосомные наборы типов I (а), II (б) и III (в) из популяции клеток костного мозга самца белой крысы (воздействие колхицина 45 мин)
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.