
Бесплатный фрагмент - Сборник статей по организации водно-химического режима теплоэнергообъектов
Основы водно-химического режима паровых котлов низкого давления
В статье по возможности просто (как представляется автору) представлены основы водно-химического режима жаротрубных паровых котлов низкого давления.
Водно-химический режим (ВХР) парового котла — это эксплуатирующийся комплекс технологических решений, направленных на обеспечение безаварийной и эффективной работы парового котла.
На самом деле достичь эффективного режима работы парового котла довольно просто. Для начала главное не утонуть в неверной и малоэффективной (а иногда и вредной) информации, которой в настоящее время заполнено информационное пространство.
Для начала пару слов о воде. Вода обладает свойством входить в состояние равновесия с окружающей ее системой или с окружающими ее условиями. Т.е. вода в реке контактирует с воздухом, с землей, подземными водами, а также поверхностным стоком. В результате достигается некое равновесие между водой и окружающими ее условиями. В процессе достижения этого равновесия вода может растворять в себе различные вещества. К примеру, вода насыщается углекислотой из воздуха или от процессов окисления органики (гниения). В результате вода получает кислую реакцию и начинает растворять известняк. Растворяя известняк, вода насыщается бикарбонатом кальция при этом увеличивая значение рН. Поэтому в воде содержатся различные типы ионов и она при этом имеет сложный газовый состав. И все это находится в равновесии для данных окружающих условий. Если, к примеру, вы посчитаете индекс Ланжелье для полноводной реки, то окажется, что он всегда будет около нуля.
Теперь представьте, что данная вода попадает в котел. Окружающие условия меняются. Вода нагревается, начинает кипеть, из нее активно начинают удаляться все газы, включая углекислоту. В результате достижения нового равновесия для данных окружающих условий вода начинает выделять из себя ионы и органику в виде накипи и шлама. При этом, нагреваясь, увеличивается подвижность кислорода и, значит, увеличивается коррозионная активность.
Соответственно, задача водоподготовки — обеспечить подготовку воды таким образом, чтобы в условиях парового котла вода не вызывала коррозии оборудования и не выделяла накипь и при этом определяла высокую энергетическую эффективность работы котла.
Котлы разделяются по давлению пара. Для котлов высокого давления требования к воде очень высокие. Но за выполнениями этих требований следит целая команда специалистов. А как быть небольшому предприятию с паровым котлом низкого давления? Создавать химическую службу ради одного котла довольно затратно. Рынок аутсорсинга на этом направлении, по крайней мере в России, отсутствует.
Проблема усугубляется еще и тем, что требования к котлам низкого давления во многом схожи с котлами высокого давления. Явно прослеживается тенденция того, что требования для котлов низкого давления были просто переписаны с котлов высокого давления (за исключением требований к качеству пара).
В результате получаем очень высокие требования к организации ВХР котельной, но на практике для небольших предприятий неэнергетического профиля наблюдаем почти полное отсутствие такового.
При этом наблюдается следующий процесс. Около 80% котельных низкого давления вообще работают без водоподготовки или с «некой» водоподготовкой, когда, как говорится, лучше уж без нее. Причем иногда котел, работающий вообще без водоподготовки, может относительно неплохо эксплуатироваться, а с водоподготовкой выходит из строя. В конце концов при отсутствии надлежащей эксплуатации успешность работы котла зависит от источника водоснабжения и качества и доли возврата конденсата.
В этих условиях я хотел бы обозначить основные принципы, при которых паровой котел низкого давления может довольно успешно работать, при этом не требовать к себе «избыточного» внимания.
Прежде всего необходимо понять, что происходит с водой в паровом котле. В котле из воды начинает эффективно удаляться углекислота с паром. В результате в воде начинают появляться карбонаты. Поэтому из воды выделяется карбонат кальция в виде накипи. Этот процесс происходит в первую очередь. Если в воде присутствуют сульфаты, то возможно выпадение в осадок сульфата кальция (гипса), т.к. котловая вода упаривается и увеличивается концентрация сульфатов и остальных солей. Но выпадение гипса происходит довольно редко (только в случаях их большой концентрации в источнике водоснабжения в условиях отсутствия системы водоподготовки). Т.к. если в воде присутствует кальций, то большая его часть выпадает в осадок с карбонатами и на сульфаты его просто не хватает. Тем не менее в воде также содержится магний, который также будет выпадать в осадок с сульфатами и гидратами.
Выпадение гипса в котле возможно еще по причине дозирования в питательную воду сульфита натрия с целью связывания кислорода. В результате в воде увеличивается концентрация сульфатов и, если установка умягчения перестает работать и в воде появляется достаточное количество кальция, возможно выпадение как карбоната, так и сульфата кальция.
Поэтому самое главное, что необходимо сделать для подготовки воды — это произвести ее умягчение. В результате в воде появятся ионы натрия вместо кальция и магния. Ионы натрия не будут выпадать в осадок, и при удалении из воды углекислоты в воде будет получаться карбонат натрия (сода), а не карбонат кальция. В котле будет происходить гидролиз карбоната натрия с образованием гидрата (ОН). В результате рН воды в котле повысится. Это и есть самое главное преимущество предварительно умягченной воды.
Котловая вода в этом случае будет иметь высокое значение рН. Если в такую воду попадет кальций, он сразу будет переведен в шлам. Не в накипь, а именно в шлам. И его можно будет удалить с периодической продувкой. Если в такую воду попадет углекислота, она сразу будет переведена в бикарбонат и отогнана с паром. Т.е. котловая вода, образованная из умягченной питательной воды, является своего рода защитным буфером котла. Проскок солей жесткости она переводит в шлам, а углекислоту нейтрализует и удаляет с паром. В этом случае возможна только кислородная коррозия. Большим плюсом также является то, что если в котловой воде содержится гидрат, то кремнекислота полностью диссоциирует и не дает накипи либо выделяется в виде удаляемого шлама.
В результате можно записать следующие мероприятия для успешного ведения ВХР парового котла низкого давления.
1. Умягчение воды.
2. Максимальный возврат конденсата.
3. Деаэрирование и декарбонизация питательной воды.
4. Обратноосмотическое обессоливание.
5. Постоянный автоматический контроль значений рН и электропроводности котловой воды.
Рассмотрим каждый пункт подробнее.
1. Умягчение воды — это основной процесс водоподготовки, который должен быть реализован для парового котла низкого давления. Конечно, можно полностью обессолить воду, а затем дозировать в нее едкий натр. Но в условиях отсутствия надлежащего химического контроля — это равносильно «убийству» котла. Процесс умягчения воды для котлов низкого давления имеет еще одно очень большое преимущество, о котором будет рассказано в пятом пункте.
2. Возврат конденсата — это крайне важная составляющая успешного ВХР. В конденсат поступает много углекислоты от разложения бикарбонатов в котле. В результате в конденсатном тракте углекислота постепенно переходит в конденсат у уменьшает его рН. Как следствие начинает происходить коррозия конденсатного тракта и конденсат насыщается продуктами коррозии. Чем ниже температура конденсата, тем больше углекислоты в нем растворится и, соответственно, больше железа перейдет в конденсат. Железо будет вызывать повышенную мутность котловой воды со всеми вытекающими последствиями. Поэтому при проектировании системы возврата конденсата крайне важно избегать линий, где возможно застаивание и захолаживание конденсата. Конденсат необходимо возвращать в головку деаэратора. Преимущества этого в том, что, первое — смешиваясь с подпиточной водой, он ее нагревает и деаэрация проходит более эффективно, второе — в деаэраторной головке из конденсата отгоняется углекислота. Если конденсат возвращать непосредственно в деаэраторный бак, то углекислота вступит в реакцию с гидратом воды в деаэраторном баке. Значение рН питательной воды упадет, и потребуется больше пара на барботаж, чтобы обеспечить требуемый рН питательной воды после деаэратора.
3. Деаэрирование и декарбонизация питательной воды происходят в деаэраторе. При этом необходимо отметить разницу в процессах деаэрирования и декарбонизации. Деаэрирование эффективно происходит только в головке деаэратора. Т.е. для эффективного деаэрирования температура воды на последней (нижней) тарелке должна быть не менее 100 0С. Этого сложно достичь при отсутствии предварительного подогрева подпиточной (умягченной) воды. Поэтому если в головку поступает холодная умягченная вода, требуется большой расход пара для того, чтобы получить требуемое качество питательной воды по кислороду. Особенно в условиях переменной нагрузки, что свойственно для производственных котлов низкого давления, любой массообменный агрегат (в том числе и деаэратор) работает с очень низкой эффективностью.
Вроде бы очевидно, что необходимо организовывать предварительный подогрев умягченной воды перед деаэратором. Но то, что на бумаге выглядит как теплообменник с подводом пара и воды, на практике представляет из себя очень серьезную задачу.
Во-первых, умягченная вода является крайне коррозионной из-за смещения углекислотного баланса в сторону растворения. Поэтому при подогреве такой воды наблюдается то, что можно назвать взрывная коррозия. Поэтому допустимо использовать только нержавеющую сталь.
Во-вторых, организация работы теплообменника тоже требует очень серьезного подхода. Дело в том, что нагрев происходит паром. Подпитка деаэратора умягченной водой происходит непостоянно. Соответственно, когда расход воды через теплообменник прекращается, а регулятор пара не успевает его перекрыть, к примеру, пластинчатые теплообменники сразу разрушаются оттого, что застойная вода по водяной линии теплообменника сразу вскипает.
Все это требует очень серьезного подхода к решению, казалось бы, такой простой теплотехнической задачи.
В результате, как правило, для котлов низкого давления наблюдается значительное превышение кислорода в питательной воде. Но даже в этом случае коррозии подвержены прежде всего стальной экономайзер и питательный тракт парового котла. Попадая непосредственно в котел, кислород сразу уносится с паром. В случае, когда деаэрация отсутствует полностью, скорее всего, будет наблюдаться кислородная коррозия стального экономайзера, питательного тракта и, возможно, возвратных труб котла.
Декарбонизация питательной воды — это прежде всего удаление свободной углекислоты. Свободная углекислота довольно легко удаляется непосредственно из деаэраторного бака. Дело в том, что углекислота не может удалиться в так называемый ноль. При уменьшении ее концентрации в воде начинают появляться карбонаты и, соответственно, гидраты. Гидраты связывают свободную углекислоту в бикарбонат. В результате это позволяет избежать водородной (кислотной) коррозии питательного тракта и экономайзера котла. В любом случае в котле около 90% бикарбонатов перейдет в углекислоту, которая удалится с паром.
4. Обратноосмотическое обессоливание подпиточной воды не является обязательным требованием для работы паровых котлов низкого давления в случае большой доли возврата конденсата и (или) низкого солесодержания исходной воды. Тем не менее я крайне рекомендую использовать обратный осмос в совокупности с умягчением воды. В результате мы получаем глубокоумягченную воду с низким солесодержанием. В этом случае мы имеем небольшую продувку котла. Конденсат становится значительно менее агрессивным. Поэтому даже неграмотная организация системы возврата конденсата не является критичной. Отсутствие в воде органики не вызывает зашламление котла. Все это приводит к значительному повышению надежности работы всей котельной. В результате из-за отсутствия простоев котельной и, соответственно, всей технологической цепочки предприятие не несет убытки.
5. По котловой воде, как по крови человека, можно выяснить сразу почти все болезни. Если и не почти все, то хронические уж точно.
Основные отслеживаемые параметры котловой воды — это щелочность по фенолфталеину и метилоранжу и солесодержание. Анализ на щелочность требует наличие лаборанта и лаборатории. Измерение солесодержания котловой воды можно произвести обычным кондуктометром. По общей щелочности котловой воды и солесодержанию рассчитывают некую относительную щелочность котловой воды. Вероятно, здесь существует определенное недопонимание. Понятие относительной щелочности, т.е. отношение общей щелочности к солесодержанию пришло из ВХР котлов высокого давления. Для котлов высокого давления данный параметр важен тем, что питательная вода там полностью химически обессолена и в нее дозируется едкий натр для поднятия рН для избегания углекислотной коррозии. В результате если в воду дозируется больше едкого натра, чем требуется, это может привести к вскипанию и уносу котловой воды с паром, что критично для энергетических котлов. Для котлов низкого давления, где обессоливания воды не требуется, этот параметр абсолютно не информативен. Он вообще ни о чем не говорит и поэтому вреден, т.к. многие на него ориентируются.
Для котлов низкого давления важно значение рН котловой воды и ее электропроводность. Т.к. из-за отсутствия жестких требований к качеству пара для котлов низкого давления достаточно только умягчения воды. Дело в том, что в зависимости от состава исходной воды и кратности упаривания в котле, в случае полностью умягченной воды значение рН котловой воды будет только одно и оно будет абсолютно четко соответствовать одному значению электропроводности котловой воды. Т.е. мы можем построить график зависимости значения рН котловой воды от ее электропроводности для конкретного источника водоснабжения.
Соответственно, если значение рН котловой воды падает, но при этом значение электропроводности растет или остается таким же, это говорит о том, что в котел начинают поступать соли жесткости и требуется проверка системы умягчения.
Более подробно эта методика контроля описана в статье: Тихонов И. А., «Контроль водно-химического режима паровых котлов низкого давления с использованием значения рН котловой воды». Ссылка — https://tiwater.info/the-monitoring-of-the-water-chemical-mode-of-low-pressure-steam-boilers-using-the-ph-value-of-boiler-water/
Я понимаю, что данная методика является косвенной, но она может быть полностью автоматизирована. При этом контроль может осуществляться удаленно и непрерывно. В результате можно достаточно четко отследить все изменения в ВХР котла просто посмотрев на экран смартфона.
Учитывая особенности работы установки умягчения воды (если появляется проблема, то она начинает работать, периодически выдавая жесткую воду, что сразу будет фиксироваться в виде падения значения рН котловой воды), используя данную методику, можно хоть и косвенно, но легко понять, работает ли умягчение и требуется ли более четкий химический контроль для корректировки фильтроцикла установки умягчения. В большинстве случаев на первых порах работы котельной это позволяет понять, добавляет ли персонал соль в фидер. Бывает и такое, причем довольно часто.
Для удаленных объектов это просто незаменимо.
В заключение хочу отметить, что грамотный ВХР паровых котлов низкого давления — это прежде всего нахождение равновесия воды в зависимости от окружающих условий (условий в котле и питательном тракте) при использовании массообменных процессов (умягчение, осмос, термическая дегазация). Т.к. массообменные процессы не требуют постоянного контроля и успешно работают при относительно стабильных исходных условиях. А вот дозирование различных реагентов в качестве основного инструмента ведения ВХР крайне нежелательно. Если очень хочется, то можно использовать дозирование реагентов как корректирующих и (или) стабилизирующих в очень незначительных концентрациях. Но почти во всех случаях при отсутствии или ненадлежащей работе основной системы водоподготовки дозирование реагентов приведет к довольно негативным последствиям. Так, фосфаты и сульфаты можно дозировать только в глубокоумягченную воду. Органические реагенты могут просто зашламить котел. Сульфит натрия требует постоянного обновления раствора, т.к. расходуется на окисление кислорода воздуха. Дозирование аммиака исключает использование пара в пищевых производствах и т. д. И при этом все это требует серьезного контроля, что редко бывает организовано на небольших предприятиях неэнергетического профиля.
Оценка влияния углекислоты на Водно-химический режим паровых котельных
В статье рассматривается, как углекислотное равновесие воды влияет на организацию ВХР паровой котельной.
При проектировании и эксплуатации паровых котельных низкого давления существует ряд значительных трудностей в организации водно-химического режима (ВХР) их работы.
Водно-химический режим работы паровой котельной должен обеспечивать безаварийную и экономически эффективную эксплуатацию оборудования и трубопроводов котельной.
ВХР котельной заключается в поддержании определенного состава питательной, подпиточной, котловой воды, пара и конденсата, который не вызывает повреждения оборудования котельной либо его неэффективной эксплуатации.
Вода с растворенными в ней солями и газами представляет собой устойчивую термодинамическую систему, находящуюся в равновесии с внешними условиями. При изменении внешних условий, например, увеличении температуры воды, система пытается достичь нового равновесного состояния. При этом возможно выпадение солей в виде твердого вещества из воды или, наоборот, увеличение растворимости по какому-либо веществу или выделение растворенных газов и т. п.
Таким образом для обеспечения эффективного ведения ВХР паровой котельной необходимо исходную воду подготовить таким образом, чтобы получаемый в процессе работы состав котловой воды и конденсата не вызывал порчи оборудования.
До начала 2000-х годов основной технологией подготовки воды для паровых котельных низкого давления было глубокое Na-катионитовое умягчение исходной воды. Действительно, данная технология достаточно проста в эксплуатации, имеет низкую стоимость используемого оборудования. Качество получаемой воды во многом обеспечивает безаварийную работу парового котла и другого оборудования. К основным недостаткам данной технологии можно отнести большое количество высокоминерализированных сточных вод, образующихся в процессе регенерации установки умягчения, а также то, что данная технология не только не уменьшает общее солесодержание воды, но даже незначительно его увеличивает.
С первым недостатком фактически невозможно бороться. Количество соли сбрасываемой с установки умягчения равно количеству соли, замещенной на установке, умноженное примерно на 2. Это колоссальное количество соли при сбросе в канализацию должно быть растворено в воде с концентрацией не более 1000 мг/л. Таким образом, при солесодержании воды, поступающей на умягчение около 250 мг/л, количество сточной воды с концентрацией 1000 мг/л будет всего в два раза меньше от количества умягченной воды за фильтроцикл.
Другой способ утилизации стоков Na-катионитовой установки — это выпаривание. Что также является достаточно затратной и сложной в реализации технологией, что исключает его применение, особенно для котельных небольшой производительности.
Тем не менее, фактически не имея альтернативы, технология Na-катионитового умягчения воды повсеместно применяется уже более 100 лет.
В последние 15–20 лет в теплоэнергетике начали активно использовать технологию обратноосмотического обессоливания воды. Основной недостаток данной технологии — это высокая стоимость применяемого оборудования и, как считается, большое количество образующихся стоков. Хотя количество соли, сбрасываемой с этими стоками, примерно в два раза меньше, чем количество соли, образующейся при работе установок Na-катионитового умягчения воды. Данное обстоятельство требует внимательного рассмотрения, и этому будет посвящена отдельная статья.
Принципиальное отличие технологии обратного осмоса от умягчения состоит в том, что при обратном осмосе из воды выделяются все взвешенные и органические вещества, а также растворенные вещества в количестве примерно 96–99%.
Таким образом, обратный осмос значительно (почти полностью) уменьшает содержание растворенного вещества всех видов ионов, содержащихся в исходной воде, при том что Na-катионирование только замещает ионы кальция и магния на натрий.
В классическом понимании водно-химического режима паровых котельных значение солесодержания питательной воды влияет только на величину непрерывной продувки котла. Непрерывная продувка парового котла рассчитывается по формуле:

Аов — доля подпиточной воды;
Sов — сухой остаток обработанной воды, мг/кг;
Sкв — сухой остаток котловой воды, принимается по паспортным данным завода-изготовителя котла, мг/кг;
Чем больше доля возврата конденсата, т.е. меньше доля подпиточной воды, тем меньше процент непрерывной продувки котла. Допускается величина непрерывной продувки паровых котлов до 10% от паропроизводительности. Уменьшение непрерывной продувки котла значительно увеличивает экономию топливного газа. Таким образом, чем больше величина возврата обессоленного конденсата в котел, тем меньше величина непрерывной продувки. При значении непрерывной продувки менее 1% от нее отказываются и обеспечение нормативного солесодержания котловой воды производится только при помощи периодических продувок. При этом наблюдается значительная экономия топливного газа.
При отсутствии возврата конденсата в котел или при незначительном возврате конденсата использование обратноосмотического обессоливания подпиточной воды также позволяет отказаться от проведения непрерывной продувки котла.
Если с влиянием минерального состава воды имеется определенная ясность, то с влиянием диоксида углерода (СО2) на ВХР паровой котельной наблюдается определенное недопонимание. И как показывает практика, при проектировании и эксплуатации паровых котельных часто не учитывается влияние СО2, растворенного в исходной воде, на весь ВХР котельной.
В данной работе произведена попытка представить влияние диоксида углерода, растворенного в исходной воде, на ВХР котельной и приведены рекомендации по уменьшению негативного влияния углекислоты на оборудование и трубопроводы котельной.
При эксплуатации паровых котельных с неверным ВХР наиболее часто выходящее из строя оборудование относится к пароконденсатному тракту (конденсатоотводчики, регуляторы давления и т.п.). Также при неверном ВХР наиболее частым выходящим из строя оборудованием является стальной экономайзер парового котла.
Даже если при выходе данного оборудования из строя котельная остается в работе, то это влечет значительное уменьшение экономической эффективности эксплуатации котельной.
К примеру, установка дорогостоящих конденсатоотводчиков, имеющих длительный срок службы, полностью окупает себя качественным процессом отвода конденсата и длительным сроком службы. Но при неверном ВХР котельной, как показывает практика, даже самые дорогостоящие и качественные конденсатоотводчики и другое оборудование пароконденсатного тракта выходят из строя всего за полгода.
Вода может проявлять как коррозионные свойства, так и накипеобразующие по отношению к контактирующей поверхности. В процессе накипеобразования участвуют ионы жесткости, которые удаляются на этапе водоподготовки.
Элементы тепловой схемы, где вода находится при повышенном давлении и температуре: линия подпиточной воды с теплообменником перед деаэратором; деаэратор; питательная линия с насосом; экономайзер; паровой котел; пароконденсатный тракт с оборудованием.
В данных элементах тепловой схемы котельной может происходить как накипеобразование, так и коррозия. В условии отсутствия ионов жесткости в данной воде основной проблемой при эксплуатации котельной становится коррозия.
Данный тип коррозии относится к электрохимической коррозии и протекает с кислородной и водородной деполяризацией. Проще говоря, данная коррозия протекает при наличии в воде кислорода и ионов водорода.
Кислород содержится в подпиточной воде, и его количество определяется (для «чистой» воды) в зависимости от температуры воды. При нуле градусов в воде содержится 14 мг/л О2. Это справедливо для воды, имеющей достаточно длительный контакт с атмосферой и находящейся с ней в равновесии по кислороду. Артезианские воды, не имеющие длительного контакта с атмосферой и не подвергаемые аэрации, могут содержать значительно меньше кислорода.
Таким образом, подпиточная вода всегда содержит достаточное количество кислорода для протекания коррозионных процессов. Кислородная коррозия чрезвычайно быстро протекает при вскипании воды и конденсации пара в воду, которая находится в состоянии насыщения.
Коррозия с водородной деполяризацией протекает при наличии в воде иона водорода, иначе говоря, кислоты. При растворении в воде диоксида углерода образуется угольная кислота H2CO3, которая диссоциирует на ионы водорода H+ и бикарбоната HCO-3. Ион водорода и вызывает активные коррозионные процессы.
Следует отметить, что подвижность ионов водорода и молекулы кислорода в воде различается на порядок. Ион водорода гораздо более подвижен. Поэтому кислотная коррозия протекает значительно быстрее, чем кислородная и практически не зависит от гидродинамических условий. Необходимо сказать, что если имеются условия для протекания коррозии с кислородной и водородной деполяризацией одновременно, то общая скорость коррозии значительно больше, чем для коррозии только с кислородом или водородом.
При этом замечено, что вода, находящаяся в состоянии насыщения (кипения), проявляет активную коррозию именно с кислородной деполяризацией, т.к. кипящая вода способствует значительному увеличению подвижности кислорода. Водородная коррозия, наоборот, уменьшается с увеличением температуры воды. Данное обстоятельство характерно для вод типа конденсата. Автору известны случаи, когда трубопровод возврата конденсата с температурой 40 0С требовал полной замены раз в полгода. При этом трубопроводы конденсата, возвращаемого с температурой 100 0С и больше, не требовали такого частого ремонта, хотя содержание железа в конденсате было более 1 мг/л (довольно существенно). Вероятно, это связано с тем, что при увеличении температуры воды происходит постепенный переход угольной кислоты в газообразный диоксид углерода. При этом наибольший эффект выделения углекислоты из воды происходит при кипении воды.
Для удаления растворенных газов из воды в настоящее время используются две технологии. Термическая дегазация воды и химическая деаэрация и подщелачивание воды.
Строго говоря, удаление газов из воды происходит только при термической дегазации. При химической деаэрации и подщелачивании воды происходит только связывание растворенных газов.
Связывание кислорода происходит по реакциям:
1. При использовании сульфита натрия
2Na2SO3+O2 → 2Na2SO4 ⠀⠀ (2)
2. При использовании гидразингидрата
N2H4*H2O+O2 → 3H2O+N2 ⠀ (3)
Связывание углекислоты в бикарбонат-ион происходит по реакции:
NaOH+H2СO3 = NaHCO3+H2O ⠀ (4)
Поэтому химическая деаэрация и подщелачивание имеют ряд существенных недостатков:
1. При проведении химической деаэрации значительно увеличивается солесодержание питательной воды. При наличии в воде кислорода в количестве 8 мг/л количество бисульфита натрия, расходуемого для его связывания, будет равно 100 мг/л (с учетом неэффективного перемешивания). Соответственно, на 100 мг/л вырастает солесодержание питательной воды и также растет непрерывная продувка парового котла. Необходимо отметить, что при использовании гидразингидрата солесодержание воды не увеличивается, но сам реагент чрезвычайно токсичен (относится к первому классу опасности), пожароопасен и требует специфических условий хранения, что исключает его применения для паровых котельных, особенно работающих на пищевых производствах.
2. При проведении химической деаэрации в воде остаются сульфиты, что связано с их избыточным дозированием для гарантированного связывания кислорода. Как правило, производители котлов достаточно жестко регламентируют содержание сульфитов в котловой воде (5–10 мг/л), что представляет значительную сложность в организации процесса дозирования сульфита натрия в питательную воду. Сульфит-ион (SO3) является сильным восстановителем и значительно усиливает коррозионные процессы, протекающие в котле и пароконденсатном тракте путем разрушения пассивирующего слоя на поверхности металла.
3. Еще одним не всегда учитываемым моментом является то, что при дозировании сульфита натрия в воде образуется сульфат натрия Na2SO4, который, по сути, увеличивает содержание сульфат-иона в питательной воде, и при проскоке жесткости или постоянно повышенной жесткости в питательной воде в котле возможно образование нерастворимого сульфата кальция СaSO4 (гипса). Типичным примером может служить питание водогрейного котла с жесткостью 0,7 мг-экв/л (допускается для котлов с температурным графиком 95/70). В этом случае значительное увеличение сульфатов в подпиточной воде может привести к образованию гипса, что впоследствии будет требовать механической очистки котла. Второй пример — это некачественная работа системы водоподготовки парового котла. В паровой котельной наблюдался постоянный проскок по жесткости питательной воды и при этом в большом объеме дозировался сульфит натрия для связывания кислорода. Зная о постоянном проскоке солей жесткости, раз в год проводилась кислотная промывка парового котла. В год после введения в технологию подготовки воды химической деаэрации, при внутреннем осмотре котла после кислотной промывки, обнаружились нерастворенные белые отложения в значительном количестве. Анализ отложений показал, что это сульфат кальция. После этого было принято решение о прекращении дозирования сульфита натрия.
4. Подщелачивание питательной воды каустической содой всего лишь связывает угольную кислоту в бикарбонат (4), который в котле снова перейдет в угольную кислоту, которая испарится с паром и впоследствии перейдет в конденсат, вызывая понижение рН конденсата и значительно увеличивая его коррозионные свойства. Таким образом, подщелачивание питательной воды всего лишь позволяет избежать углекислотной коррозии питательного тракта парового котла, но при этом увеличивает коррозионные свойства конденсата.
Термическая дегазация воды позволяет не только удалить из воды кислород и углекислоту, но и значительно уменьшить коррозионные свойства возвращаемого конденсата.
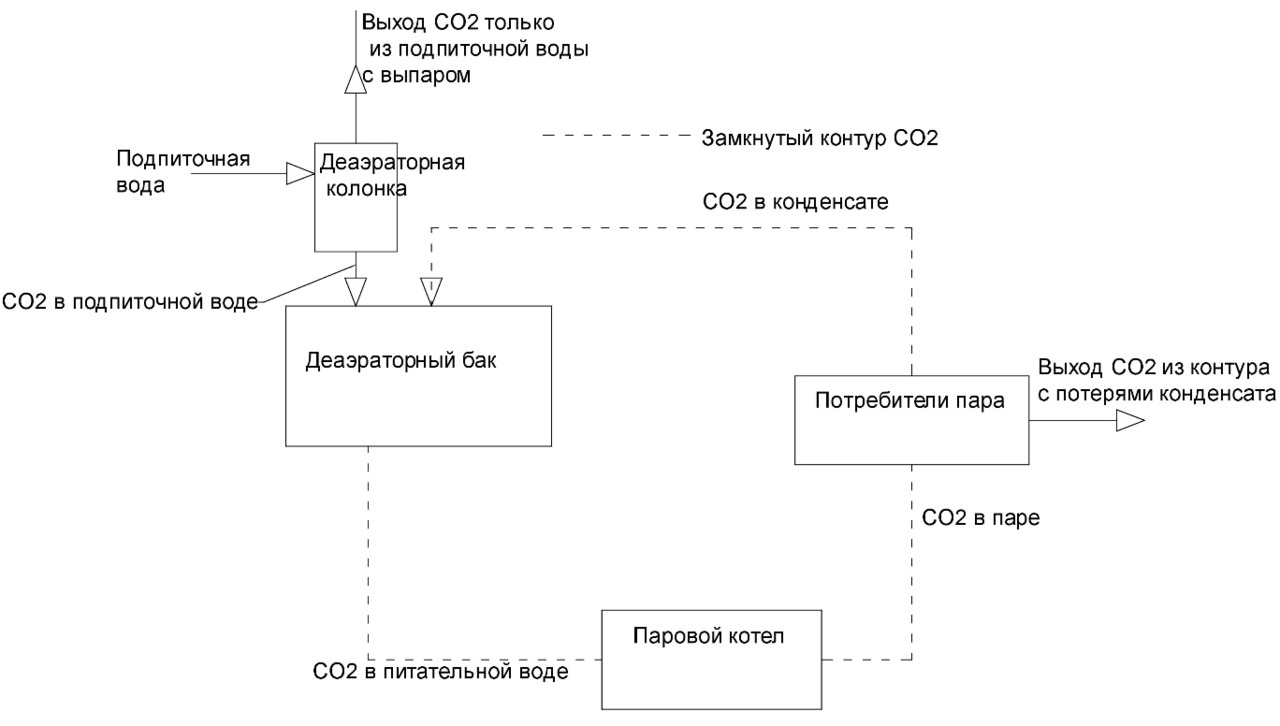
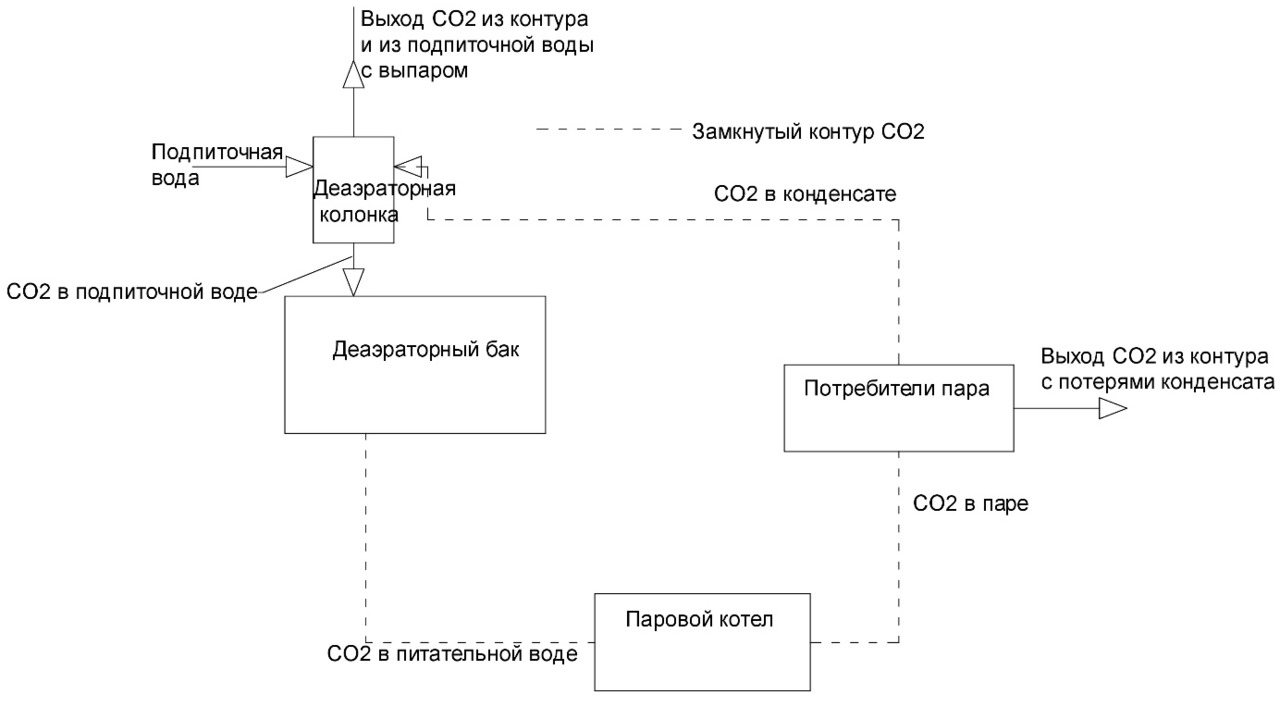
Составим материальный баланс по углекислоте тепловой схемы котельной (рис. 1, 2).
Перед составлением баланса по углекислоте необходимо обстоятельно разобраться с понятиями так называемой свободной, связанной и полусвязанной углекислоты, содержащейся в воде.
Проведем простой мысленный эксперимент. Имеется определенный объем воды. Вода условно чистая, содержит только молекулы H2O. Значение рН такой воды 7,0. Т.е. количество ионов водорода равно количеству ионов гидроксила. Допустим, что данная вода контактирует с твердым карбонатом кальция. Карбонат кальция растворим только в воде, имеющей кислую реакцию. Другими словами, в воде, имеющей большее количество ионов водорода по отношению к ионам гидроксила. Ионы водорода могут быть введены в воду как с сильными кислотами, такими как соляная кислота, так и слабыми, такими как угольная кислота. Существует принципиальное отличие между сильными и слабыми кислотами. Так, в сильных кислотах ион водорода, отвечающий за кислую реакцию, привносится или уже существует в воде с собственным анионом (Cl, SO4), то слабая угольная кислота, растворенная в воде, образуется из углекислого газа путем связывания гидроксил-иона молекулы воды в бикарбонат-ион, соответственно, с получением кислого остатка в виде иона водорода.
Запишем уравнение реакции растворения в воде твердого карбоната кальция (CaCO3) при использовании угольной кислоты, поступающей в воду из воздуха от различных процессов окисления органического углерода либо от геологических процессов:
CaCO3+H2CO3 = Ca (HCO3) 2⠀⠀ (5)
Протекает обратимая реакция, при которой твердый карбонат кальция (CaCO3) переходит в растворенную форму бикарбоната кальция (Ca (НCO3) 2). Угольная кислота в виде карбоната, ассоциированная с кальцием, и есть связанная форма углекислоты, эквивалентно равная половине бикарбоната кальция, растворенного в воде. Вторая половина бикарбоната кальция, образовавшаяся не из твердого бикарбоната кальция, а из угольной кислоты, называется полусвязанной углекислотой.
Свободная углекислота в воде находится в форме именно угольной кислоты (H2CO3), т.е. не связана напрямую ни с одним катионом в воде. Тем не менее именно свободная угольная кислота, являющаяся частью буферной углекислотной системы воды, и определяет текущее значение рН воды.
Вернемся к нашему эксперименту. Получается, что, пропуская через наш объем воды углекислый газ (СО2), в воде образуется свободная углекислота (H2CO3), которая, реагируя с карбонатом кальция (известняком) по уравнению (5), растворяет его с образованием бикарбоната кальция, причем половина бикарбонат-иона, выраженного в эквивалентных концентрациях, относится к связанной форме углекислоты, а вторая половина к полусвязанной (пришедшей из углекислого газа). Растворение известняка будет проходить до тех пор, пока через воду будет пропускаться углекислый газ. Причем увеличение содержания в растворе бикарбонат-иона будет требовать увеличения концентрации углекислого газа в воде для поддержания процесса растворения.
После окончания пропускания углекислого газа через воду система начнет приходить в новое равновесное состояние. Закончится растворение известняка и начнется постепенное выделение растворенной свободной углекислоты в окружающий воздух. В атмосфере Земли средняя концентрация углекислого газа составляет примерно 0,4 мг/л. Соответственно, в идеальных условиях концентрация углекислого газа в воде должна достичь такой же концентрации. Но в природе в открытых проточных водоемах концентрация свободной углекислоты составляет от 2 до 5 мг/л, что соответствует значению рН 7,7–7,9. Вероятно, это связано с определенными биологическими и геологическими процессами, обеспечивающими поступление углекислого газа в воду не из атмосферы.
Таким образом, при выделении углекислоты из воды в атмосферу реакция по уравнению (5) протекает в сторону образования твердого карбоната кальция. В конце концов достигается «конечное» равновесие и вода начинает обладать ионным составом, свойственным для геологических и биологических условий данной местности. В нашем эксперименте это контакт с известняком и атмосферным воздухом.
Понимая, что такое связанная, полусвязанная и свободная углекислота в воде, рассмотрим уравнение реакций, протекающих при термической деаэрации Na-катионитовой воды. Классический подход выделяет три стадии удаления всех видов углекислоты из воды:
1. Выделение свободной СО2 за счет кипения и отвода с паром. Данный процесс должен происходить (начинать и завершаться) в деаэрационной колонке. При условии начала кипения подпиточной воды на тарелках. Для этого должен быть обеспечен подогрев подпиточной воды перед деаэрационной колонкой. Чем выше подогрев подпиточной воды, тем раньше начинается кипение в деаэрационной колонке, тем эффективнее и полнее осуществляется отвод свободной углекислоты из подпиточной воды. В случае отсутствия кипения или позднего начала кипения подпиточной воды в деаэрационной колонке свободная углекислота может попасть в деаэраторный бак, где будет связана в бикарбонат натрия карбонатом натрия, образовавшегося там при разложении предыдущего бикарбоната натрия (по уравнению 6 процесс справа налево), и тем самым процесс выделения полусвязанной углекислоты значительно затормозится. Будет требоваться гораздо большее время пребывания воды в деаэраторном баке и гораздо больше пара придется подавать на барботаж воды.
2. На второй стадии происходит разрушение бикарбонат-иона за счет продолжающегося интенсивного отвода углекислоты из воды с образованием карбоната (6). Данный процесс происходит, как правило, в деаэраторном баке при интенсивном барботаже воды паром.
2NaHCO3 = Na2CO3+Н2CO3свобод = Na2CO3+CO2газ+ Н2О (6)
Полноту протекания данного процесса в деаэраторе можно оценить по значению рН воды после деаэратора. Значение рН воды после деаэратора будет определяться по отношению содержания карбонат-иона к гидрокарбонат-иону (уравнение Хендерсона-Хассельбальха для разложения бикарбоната HCO3=H+CO3)

К примеру, вода, содержащая 2 моля бикарбоната натрия (6), подвергается барботированию в деаэраторе. В результате отвода СО2 бикарбонат-ион переходит в карбонат-ион. В зависимости от интенсивности отвода СО2 на выходе из деаэратора в воде устанавливается равновесие между карбонатом и бикарбонатом, при этом происходит только разложение половины бикарбоната. Соответственно, в результате парового барботажа воды получаем содержание в ней 1 моля бикарбоната натрия, 0,5 моль карбоната натрия и 0,5 моль углекислого газа. Углекислый газ был отведен в атмосферу. Тогда в соответствии с (7) получаем:

Значение рН дегазированной воды после деаэратора получается 9,99. При этом в деаэраторе произведена отгонка только свободной углекислоты и разрушение и отгонка половины полусвязанной углекислоты (четвертая часть исходного бикарбоната).
Предположим, в деаэраторе разрушается не половина, а ¾ бикарбоната натрия. Тогда, получаем в результате отгонки углекислоты, остается одна четверть бикарботана, или 0,5 моля бикарбоната, и, соответственно, на 0,5 моля на карбонат, 0,5 моля на гидрат и 1 моль на углекислоту (которую отогнали в деаэраторе). В данном случае половину углекислоты удалили в деаэраторе от исходного количества бикарбоната. В данном примере в воде появляется гидрат в результате процесса гидролиза карбонатов. В данном случае уравнение (7) запишется следующим образом:
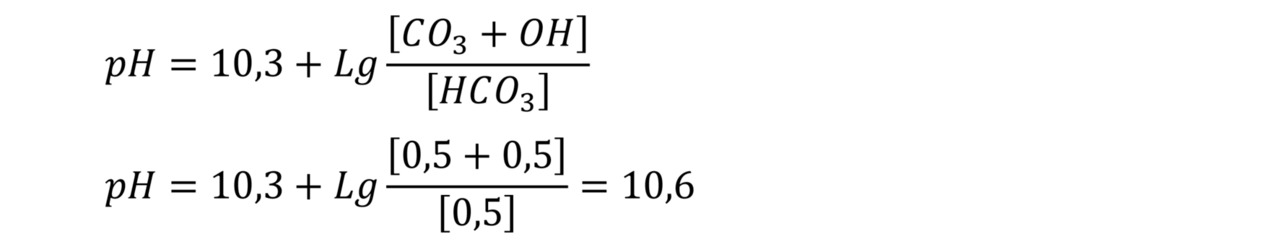
Процесс гидролиза бикарбонатов и карбонатов подробно рассмотрен в статье «Определение количества бикарбонатов, карбонатов и гидратов в воде в зависимости от значения рН воды».
Рассчитаем значение рН воды, которое необходимо получить на выходе из деаэратора, соответствующее равному (одинаковому) содержанию бикарбоната и карбоната, т.е. бикарбоната, карбоната и угольной кислоты будет равное количество — по 0,665 моля. 0,665*3= 2 моля исходного бикарбоната. Соответственно,

Значение рН=10,3 соответствует константе диссоциации бикарбоната по уравнению HCO3 <-> H+CO3. Т.е. количество бикарбоната равно количеству карбоната. Можно сказать, что при данном рН воды половина бикарбоната подпиточной воды разложилась в деаэраторе, но при этом отогналась только третья часть общей суммы всех форм диоксида углерода (8).
0,665NaHCO3= 0,665Na2CO3+0,665CO2газ+Н2О ⠀⠀ (8)
— Третья стадия — продолжение отвода углекислоты из воды при интенсивном кипении, за счет чего карбонат гидролизируется с образованием углекислого газа и высвобождением гидроксил-иона из молекулы воды (9). Данный процесс не требует отвода углекислоты из воды. Это обычная реакция гидролиза технической соды в воде. Поэтому, вероятно, неправильно говорить о разрушении связанной углекислоты (карбоната) за счет отвода газообразной углекислоты. Скорее надо говорить о гидролизе технической соды в воде. Данные условия обеспечиваются как в деаэраторе, так и тем более в котле. Можно сказать, что скорость протекания реакции (9) лимитируется остаточным содержанием бикарбоната в воде, а не скоростью отвода углекислого газа в (9). А уже концентрация бикарбоната зависит от эффективности отвода растворенной углекислоты (6).
Na2CO3+ H2O=2NaOH+ CO2газ ⠀⠀ (9)
Na2CO3+ H2O=NaOH+ NaHCO3 ⠀⠀ (10)
Считается, что чем выше температура и давление в котле, тем полнее происходит разложение карбонатов в котловой воде за счет условий, обеспечивающих чрезвычайно эффективный отвод углекислоты из воды. Полное разложение карбонатов получается в котлах при давлении 5 МПа [1]. Тем не менее автор считает, что разрушения карбонатов как такового нет. Происходит их гидролиз (9, 10). Соответственно, чем меньше бикарбоната в воде, тем полнее идет гидролиз карбонатов, и именно это определяет полноту разложения карбоната. Так, при работе парового котла на давлении 6 бар и подпитке котла обессоленной водой после обратного осмоса с щелочностью около 0,25 мг-экв/л в котловой воде фактически не обнаруживается бикарбонат и карбонат-ион. Только гидроксил (присутствует только фенолфталеиновая щелочность).
Обратите внимание, что после деаэратора при его нормальной работе вода имеет значение рН, как правило, около 8,5–10,0, что говорит об одновременном протекании в деаэраторе реакций (6) и (9, 10).
Таким образом, можно записать:
2NaHCO3=Na2CO3+Н2CO3=Na2CO3+CO2газ+Н2О =
2NaOH+CO2газ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ (11)
В результате в деаэраторе и деаэраторной колонке происходят следующие процессы. В воде ХВО, поступающей в деаэратор, как правило, содержится свободная углекислота, которая не позволяет осуществляться реакции (6), уравновешивая бикарбонат. Постепенно удаляя свободную углекислоту из воды, бикарбонат начинает переходить в карбонат. При этом карбонат гидролизируется в воде на гидроксид натрия и углекислый газ, который удаляется с паром. Гидроксид натрия повышает значение рН воды.
Итак, непосредственно в деаэраторе должна выделяться вся свободная углекислота и часть полусвязанной углекислоты. Как показано выше, при значении рН деаэрированной воды около 10 только половина полусвязанной углекислоты выделится в деаэраторе. Соответственно, оставшаяся часть перейдет в котел, где будет происходить выделение углекислоты в пар по одновременно протекающим реакциям (6) и (9, 10). В котле фактически полностью завершится переход бикарбонат-иона в карбонат (6) и, соответственно, образование гидроксида натрия из карбоната (9, 10). Полнота разложения бикарбонатов, а не как принято говорить карбонатов, в котле будет определяться величиной щелочности подпиточной воды, процентом возврата конденсата, давлением в котле.
Если предположить условия: что вся свободная углекислота выделится в деаэраторной колонке. Затем в деаэраторном баке выделится углекислота от разрушения половины полусвязанного бикарбоната; далее в котле выделится вторая половина полусвязанного бикарбоната, а также в деаэраторе и в котле будет происходить гидролиз карбоната натрия. То можно сказать, что в деаэраторе выделится количество углекислоты, равное четверти содержания бикарбонат-иона (щелочности) подпиточной воды, а в котле выделится количество углекислоты, численно равное трем четвертям значения щелочности подпиточной воды. Значение рН деаэрированной воды будет 9,99.
Запишем:
СО2пит=3/4*Щподп, ммоль/л ⠀⠀ (9)
где СО2пит — концентрация связанной и полусвязанной углекислоты в питательной воде;
Щподп — щелочность подпиточной воды, ммоль/л.
Запишем уравнение материального баланса по углекислоте для деаэратора (рис. 1).
(1-q) *CO2пит+q*СО2под=1*СО2пит ⠀⠀ (12)
где q — доля подпитки воды ХВО или доля потери конденсата;
СО2пит — концентрация углекислоты в питательной воде равна СО2пар.
Данная запись уравнения материального баланса углекислоты в деаэраторе предполагает, что концентрация углекислоты в паре равна концентрации углекислоты в питательной воде. Т.е. в котле происходит полное разложение бикарбонатов и карбонатов, и возврат конденсата осуществляется в деаэраторный бак (не деаэраторную колонку) (рис. 1).
Решив уравнение, получаем
СО2пит=СО2под=3/4*Щподп ⠀⠀ (13)
Получается, что в случае возврата конденсата без отгонки свободной углекислоты (в деаэраторный бак) содержание углекислоты в питательной воде не зависит от доли возврата конденсата. В производственной практике автора довольно часто встречаются подобные случаи. Даже при возврате 90% конденсата в котельную, при неправильной работе деаэратора конденсат содержит большое количество углекислоты и коррозионно агрессивен.
Т.е. если щелочность подпиточной воды 2,5 ммоль/л и доля подпитки составляет всего 10%, содержание углекислоты в конденсате составит ¾*2,5=0,93 ммоль/л или 0.93*44=41мг/л, что превышает допустимое количество углекислоты в паре (20 мг/л) в 2 раза. Это говорит о том, как важно отгонять углекислоту из конденсата при возврате его в деаэратор.
Если производится отгон углекислоты из конденсата. Конденсат возвращают в деаэраторную колонку (рис. 2), тогда
(1-q) * CO2конд + q * СО2под =1 * СО2пит
CO2конд = 0
СО2пит = q * СО2под ⠀⠀⠀⠀ ⠀⠀⠀⠀ ⠀⠀ ⠀⠀ (14)
Тогда для вышеприведенных условий
СО2пит=0,1*3/4*2,5=0,093 ммоль/л или 4,1 мг/л.
Для значения щелочности подпиточной воды 2,5 ммоль/л в случае «идеальной» работы деаэратора, т.е. значительный подогрев исходной воды 80 0С и более; использование пара на «зеркало», продувку деаэрационной колонки; использование пара на барботаж, при этом температуру воды в баке лучше поддерживать не менее 108 0С; время нахождения воды в деаэрационном баке не менее 1 часа. При данном режиме работы можно получить значение рН деаэрированной воды около 10,3 (из собственного опыта эксплуатации). При этом ранее было показано, что в деаэраторе отгоняется 1/3 часть угольной кислоты. Соответственно, концентрация углекислого газа в питательной воде и, соответственно, в паре составит:
— При отсутствии возврата конденсата:
СО2пит=1/3*2,5=0,83 ммоль/л или 36,7 мг/л.
Концентрация СО2 в паре близка к нормативу (до 20 мг/л)
— При возврате конденсата 50%:
СО2пит=1/3*0,5*2,5=0,417 ммоль/л или 18,3 мг/л.
— При любом проценте возврата конденсата без отгонки углекислоты в деаэраторной колонке:
СО2пит=1/3*2,5=0,83 ммоль/л или 36,7 мг/л.
Даже при «идеальной» работе деаэратора возврат конденсата без предварительной отгонки углекислоты в деаэраторной головке приводит к повышенному содержанию углекислоты в паре.
Приведенные выше примеры и расчеты предполагают полное разложение бикарбонатов и гидролиз карбонатов в котле. Тем не менее считается, что в реальных условиях, как уже было сказано, полное разложение не достигается. Для оценки степени разложения бикарбоната и гидролиза карбоната на работающем котле достаточно провести анализ на щелочность котловой воды по фенолфталеину и метилоранжу. Доля неразложившегося карбоната и бикарбоната в котле определяется долей метилоранжевой щелочности в общей щелочности котловой воды.
∂к =Щм. о/ (Щф/ф+ Щм. о) ⠀⠀ (15)
где ∂к — доля углекислоты, оставшаяся в виде бикарбоната и карбоната в котловой воде после отгонки части углекислоты;
Щм. о — щелочность по метилоранжу, моль/л;
Щф/ф — щелочность по фенолфталеину, моль/л.
Для пояснения рассмотрим несколько примеров.
Предположим, щелочность исходной воды составляет НСО3 = 10 ммоль/л. Производим отгонку углекислоты. Затем производим анализ воды на щелочность по фенолфталеину и метилоранжу. В результате получаем, что количество кислоты на титрование по фенолфталеину равно 1 мл, по метилоранжу 9 мл.
Запишем схему разложения бикарбоната (процесс разложения бикарбоната описан в статье «Определение количества бикарбонатов, карбонатов и гидратов в воде в зависимости от значения рН воды»):
8,0NaHCO3 ⇿ 1,0Na2CO3+1,0CO2газ+Н2О
Т.е. концентрация бикарбоната 8,0 ммоль/л, карбоната — 1 ммоль/л. Количество выделившегося углекислого газа составит 1,0 ммоль/л. Исходное количество бикарбоната было 10 ммоль/л.
Получаем:
∂к =Щм. о/ (Щф/ф+ Щм. о) =9/ (9+1) =0,9
0,9 — доля углекислоты, оставшаяся в виде бикарбоната и карбоната в воде.
Т.е. только 10% углекислоты было удалено, что соответствует схеме разложения бикарбоната. Исходного бикарбоната 10 ммоль/л, количество удаленного углекислого газа 1,0 ммоль/л.
Продолжаем отгон углекислоты из воды и получаем следующие показатели.
По результатам анализа: количество кислоты по фенолфталеину — 6 мл, по метилоранжу — 4 мл.
Запишем схему разложения бикарбоната:
2,0NaHCO3 ⇿ 2,0Na2CO3+2,0CO2газ+Н2О <-> 4NaOH+4CO2газ
Т.е. концентрация бикарбоната 2,0 ммоль/л, карбоната — 2,0 ммоль/л, гидрата — 4 ммоль/л. Количество выделившегося углекислого газа составит 2,0+4,0=6 ммоль/л.
Получаем:
∂к = Щм. о/ (Щф/ф+ Щм. о) =4/ (6+4) = 0,4
0,4 — доля углекислоты, оставшаяся в виде бикарбоната и карбоната в воде.
Т.е. только 60% углекислоты было удалено, что соответствует схеме разложения бикарбоната. Исходного бикарбоната 10 ммоль/л, количество удаленного углекислого газа 6,0 ммоль/л.
Пример из производственной практики: паровой котел. Давление пара 8 бар. Для подпитки используется Na-катионитовая вода с щелочностью — 2,0 ммоль/л. Деаэраторная головка отсутствует. Возврат конденсата непосредственно в деаэраторный бак в количестве 70% от паропроизводительности. Доля подпитки ХВО — 0,3. Температура в деаэраторном баке поддерживается при помощи барботажа на уровне 90–99 0С.
Получаемая при этом щелочность котловой воды
Щф/ф = 20,0 — 21,0 ммоль/л
Щм. о= 1,5 — 2,0 ммоль/л
тогда
∂к =1,5/ (20+1,5) =0,07, или в процентах 7%.
Т.е. количество оставшегося в котловой воде бикарбоната и карбоната составит 7% от количества бикарбоната и карбоната, поступивших в котел.
Таким образом, для данного рассматриваемого примера можно записать, что концентрация углекислоты в паре составит:
СО2пара = (1—0,07) * Щпит= 0,93*2,0 = 1,86 ммоль/л или 81,84 мг/л
Концентрация углекислоты в паре значительно превышает нормативную.
Если в данном примере установить деаэраторную колонку и производить отгонку углекислоты из конденсата при подаче его в бак, получим:
СО2пара = 0,3 * (1—0,07) * Щпит= 0,3 * 0,93 * 2,0 = 0,558 ммоль/л или 24,5 мг/л,
что фактически соответствует требованиям норматива.
В итоге можно записать следующую формулу для расчета концентрации углекислоты в паре при условии отгонки углекислоты из возвращаемого конденсата:
СО2пара = 44*q* (1-∂к) *Щпит= 44*q* (1-∂к) *∂д*Щподп, мг/л ⠀⠀ (16)
где
q — доля подпитки ХВО;
Щпит — щелочность питательной воды после деаэратора на котел, ммоль/л;
Щподп — щелочность подпиточной воды (на входе в деаэратор), ммоль/л;
Щпит = ∂д* Щподп, ммоль/л;
∂д — доля бикарбоната и карбоната, оставшихся в питательной воде (неразложившейся щелочности) после их частичного удаления в деаэраторе. Для работающих котлов определяется по формуле:
∂д= Щд. м.о / (Щд. ф/ф+ Щд. м.о) ⠀⠀ (17)
Щд. ф/ф, Щд. м.о — щелочность по фенолфталеину и метилоранжу деаэрированной (питательной) воды, ммоль/л.
Для предварительных расчетов при обеспечении «идеальных» условий работы деаэратора (подача пара на «зеркало» и на паровой барботаж емкости) можно принять величину этой доли, равной ∂д=0,65–0,85. При работе деаэратора без парового барботажа значение доли бикарбоната и карбоната, оставшихся в деаэрированной воде, равно 1 (∂д=1).
∂к — доля бикарбоната и карбоната, оставшихся в котловой воде. Рассчитывается по формуле (15). Для предварительных расчетов принимается в зависимости от условий работы котла, исходной щелочности и доли возврата конденсата. Можно принять, что ∂к = 0,05–0,2. Чем больше щелочность исходной воды, тем больше должна быть принята доля ∂к.
Формула для расчета концентрации углекислоты в паре при возврате конденсата непосредственно в деаэраторный бак:
СО2пара=44* (1-∂к) * Щпит= 44 * (1-∂к) * ∂д * Щподп, мг/л ⠀⠀ (18)
Выводы:
1. Водно-химический режим паровых котельных зависит прежде всего от содержания в воде трех форм диоксида углерода. Соотношение форм диоксида углерода в воде (свободная углекислота, бикарбонат, карбонат) определяет значение рН воды и, соответственно, ее способность к отложению солей или коррозионной агрессивности. Корректируя ионный состав воды, а также количество свободной углекислоты в воде, для паровых котлов низкого давления возможно ведение эффективного ВХР без применения дополнительных химических реагентов.
2. Для обеспечения дегазации питательной воды перед паровым котлом эффективно применять термическую дегазацию. Химическую дегазацию можно использовать в исключительных случаях для котельных небольшой производительности и с соответствующим экономическим обоснованием, учитывающим риски повышенной коррозионной активности конденсата, риски с возможным недостаточно полным связыванием кислорода в питательной воде, а также потери с повышенным расходом непрерывной продувки котла. Также химическая дегазация требует производства дополнительных анализов при контроле ВХР. Возможно использование химической дегазации с использованием обратноосмотических мембран (статья — «Дегазация воды с использованием обратноосмотических мембран»). Данная технология не имеет недостатков, присущих традиционной химической дегазации.
3. Термическая деаэрация (дегазация) является важнейшей частью тепловой схемы котельной. Поддержание неверного режима работы деаэратора влечет за собой значительные экономические убытки.
4. Важнейшим параметром качественной работы деаэратора является температура воды, поступающей на деаэрацию. При температуре воды более 85 0С вода быстро закипает на верхней тарелке деаэраторной колонки. Это условие определяет полноту отгонки кислорода и свободной углекислоты из воды. В случае отсутствия подогрева воды или при недостаточном подогреве деаэраторная колонка в верхней части работает не в режиме тепломасопередачи, а в режиме теплопередачи. В результате при недостаточной высоте колонки или подаче пара на зеркало кислород и свободная углекислота попадают в деаэраторный бак, при этом эффективность выделения кислорода значительно падает, а свободная углекислота частично связывается в бикарбонат. В этом случае для того, чтобы натрий-катионированная вода достигала значения рН хотя бы 8,5, будет требоваться большой расход пара на барботаж деаэраторного бака. В результате возникают большие потери с выпаром деаэратора.
5. Термическая деаэрация не обеспечивает необходимых условий для удаления связанной и полусвязанной углекислоты из воды. Поэтому данную стадию неверно рассматривать как существенно влияющую на значение концентрации углекислоты в паре и конденсате. Для уменьшения значения концентрации углекислоты в паре и конденсате необходимо использовать технологии водоподготовки, существенно уменьшающие содержание щелочности в подпиточной воде.
6. Паровой конденсат от потребителей пара необходимо возвращать в верхнюю часть деаэраторной колонки для отгонки свободной углекислоты, которая попадает в пар как продукт разложения бикарбонатов в котле.
7. Зная значение рН или фенолфталеиновую и метилоранжевую щелочность питательной воды после деаэратора можно определить, насколько эффективно работает деаэратор по разрушению и отгонке углекислоты из воды.
8. Интересный момент, в соответствии с требованиями НТД значение рН питательной воды для паровых котлов низкого давления должно находиться в диапазоне 8,5–10,5. Принято считать, что при надлежащей работе термического деаэратора в деаэраторе должна быть отогнана ровно половина суммы всех форм углекислоты в воде. Т.е. полностью завершится протекание реакции (6). При этом значение рН такой воды будет в большинстве случаев будет больше, чем 10,5!
Список использованных источников
1. Водоподготовка и водный режим энергообъектов низкого и среднего давления. Справочник. Ю. М. Кострикин, Н. А. Мещерский, 1990 г.
Особенности разработки и ведения водно-химического режима паровых котельных с использованием мембранных технологий
В статье рассмотрено, как организовать ВХР котельной с использованием технологии обратноосмотического обессоливания подпиточной воды.
Водно-химический режим (ВХР) паровых котельных должен обеспечивать эффективную и безаварийную эксплуатацию котельной. Фактически это достигается путем создания условий, исключающих возможные процессы накипеобразования или различные коррозионные повреждения оборудования и трубопроводов. Данные условия создаются при помощи систем водоподготовки, а также организации надлежащей работы парового котла и термического деаэратора.
Еще 20 лет назад основной технологией водоподготовки, используемой в паровых котельных низкого давления, была технология ионообмена. Так, технология Na-катионирования получила наиболее широкое применение благодаря простоте эксплуатации, низкой стоимости оборудования и доступности применяемых реагентов. При этом Na-катионитовая вода потенциально содержит большое количество щелочи и эффективно противодействует углекислотной коррозии при кипении, что благоприятно сказывается на работе паровых котлов. Тем не менее данная технология имеет ряд существенных недостатков. Это большое количество образующихся высокоминерализированных стоков, а также умягчение не уменьшает, а наоборот, немного увеличивает солесодержание воды. Также применяют технологии H-катионирования и OH-анионирования. Но данные технологии достаточно сложны в эксплуатации, требуют применения опасных реагентов, производят большое количество агрессивных сточных вод и возможность их применения можно рассматривать только в достаточно больших котельных с квалифицированным обслуживающим персоналом и собственной лабораторией. Забегая вперед, скажу, что, по моему мнению, на практике применение последних двух технологий в качестве главной ступени подготовки воды не оправдано и должно быть вытеснено технологией обратноосмотического обессоливания воды.
Чего нельзя сказать о технологии Na-катионирования. Как было сказано, Na-катионированная вода содержит потенциал по щелочи, но при этом имеет большое солесодержание и способствует образованию большого количества углекислоты в паре, получаемой из такой воды. Тем не менее до начала появления технологии обратноосмотического обессоливания считалось и многими считается до сих пор, что Na-катионирование воды для паровых котлов низкого давления является практически идеальной технологией. Такой подход требует смириться с некоторыми серьезными недостатками данной технологии, как чрезвычайно высокая коррозионная активность получаемого пара и конденсата и высокая величина непрерывной продувки парового котла. Последнее условие требует утилизации вторичного пара и охлаждение достаточно большого количества котловой воды, что значительно усложняет тепловую схему котельной. При этом надо быть готовым к высокой коррозионной активности конденсата и постоянно возникающим затратам по замене или ремонту оборудования и трубопроводов пароконденсатного тракта.
Здесь надо отметить, что автор рассматривает современную паровую котельную низкого давления как имеющую наиболее простую и надежную тепловую схему, имеющую почти полную автоматизацию, при этом обладающую высокой эффективностью и, соответственно, как можно более низкой стоимостью производимого пара (теплоты).
Я должен сказать, что каждая котельная индивидуальна, как отпечатки пальцев у человека. И эта индивидуальность определяется прежде всего составом исходной воды, а также технологическими особенностями использования пара и возвратом конденсата. То есть индивидуальность определяется физико-химическими изменениями, происходящими с водой в результате предварительной подготовки воды, кипения, условий конденсации, условий возврата конденсата и т. п. Так, котельные, работающие на одной и той же по составу и источнику воде, но при этом имеющие разные схемы возврата конденсата или отсутствие возврата конденсата, имеют разные показатели водно-химического режима и сталкиваются с разными проблемами в процессе эксплуатации. Это обстоятельство необходимо учитывать при попытке внедрения новых технологий водоподготовки в структуру ВХР котельной и не довольствоваться только соответствием подготовленной воды требованиям нормативных документов, разработанных в незапамятные времена, в которых не предполагалось использование подобных технологий. Итак, при внедрении новой технологии водоподготовки необходимо определить возможное влияние подготовленной воды на весь ВХР котельной, включая систему возврата конденсата.
Данная статья попробует определить место обратноосмотической технологии обессоливания воды в структуре ВХР паровой котельной, а также показать достоинства и недостатки эксплуатации подобного ВХР.
В последние 20 лет произошло активное развитие технологии обратноосмотического обессоливания воды. Это связано с изобретением рулонных мембранных элементов с тангенциальным фильтрованием воды. Данная технология имеет неоспоримые преимущества перед ионообменными технологиями, но также ряд недостатков. Прежде всего это большое количество образующихся сточных вод. Классический подход к работе подобных систем говорит, что для получения одного кубического метра обессоленной воды требуется сбросить в канализацию 0,4–0,5 м3 концентрата. В дополнение к этому, если водоподготовка парового котла состоит только из осмотической установки и исходная вода не содержит ионов Na+K, в этом случае, даже если соблюдается условие, что жесткость питательной воды не более 0,02 мг-экв/л, будет наблюдаться чрезвычайно высокая коррозия парового котла. Если не предпринять никаких корректирующих действий, котел потребует капремонта через очень короткое время. Подробнее механизм этого процесса будет рассмотрен ниже. Но можно сказать, что к недостаткам осмотических систем можно отнести также определенные сложности в понимании места этих систем в структуре ВХР котельной по сравнению с довольно тщательно изученной технологией Na-катионирования.
Рассмотрим ВХР паровой котельной низкого давления с использованием только Na-катионитовой подготовки подпиточной воды. Наиболее распространенный классический ВХР.
Основные показатели качества питательной воды для паровых котлов низкого давления:
• прозрачность, см;
• общая жесткость, мг-экв/л;
• значение рН, ед. рН;
• растворенный кислород, мг/л;
• общее железо, мг/л;
• кремний, мг/л;
• солесодержание, мг/л;
• общая щелочность, мг-экв/л.
Прозрачность воды — это показатель, количественно характеризующий содержание в воде взвешенных и органических веществ. Нормативный показатель по этому значению, как правило, достигается фильтрованием воды через зернистую загрузку.
Общая жесткость воды характеризует склонность воды к образованию твердого осадка (накипи). Поддержание нормативного показателя по общей жесткости питательной воды менее 0,02 мг-экв/л исключает образование в котле твердых отложений.
Значение рН — показатель, определяющий наличие в воде свободной углекислоты или наличие бикарбонатов, карбонатов или гидроксил-иона. Значение рН питательной воды должно быть более 8,5.
Растворенный кислород в питательной воде способствует протеканию коррозии, с кислородной деполяризацией, питательного тракта котла, самого котла и пароконденсатного тракта. Растворенного кислорода в питательной воде должно быть менее 50 мкг/л.
Общее железо в питательной воде должно быть ниже 0,5 мг/л. Железо не создает твердых отложений в котле, но при высоких значениях рН котловой воды коагулируется в котловой воде (особенно при наличии органики и высоком коэффициенте упаривания) и вызывает забитие измерительных электродов, уровнемерных стекол и линии непрерывной продувки в котле.
Содержание кремния в питательной воде паровых котлов низкого давления напрямую не регламентируется в отечественных НД, но указывается, что соотношение едкого натра к кремневой кислоте в котловой воде должно быть 1,5. Т.е. наличие гидроксил-иона в котловой воде (значение рН котловой воды более 10,5) поддерживает кремний в ионизированном состоянии и не позволяет образовываться твердым отложениям кремневой кислоты. Возможно только образование рассыпчатого талька.
Солесодержание воды и общая щелочность не имеют конкретных нормированных значений. Эти величины связаны между собой двумя показателями. Это относительная щелочность питательной воды и величина непрерывной продувки парового котла.
Некоторые производители котлов также в требованиях к питательной воде указывают, что значение связанной углекислоты в воде должно быть менее 25 мг/л. Это означает, что общая щелочность питательной воды должна быть не более 0,6 мг-экв/л.
Для примера рассмотрим ВХР парового котла низкого давления. В качестве источника водоснабжения вода из поверхностного источника.
Для соответствия требованиям исходную (подпиточную) воду необходимо предварительно профильтровать через зернистую загрузку. Современные загрузки могут обеспечивать рейтинг фильтрации до 20 мкм, это означает, что из воды будут удалены все частицы размером более 20 мкм. Таким образом, в воде останется вся органика, которая распадется в котле и может вызывать как накипь, так и вспенивание котловой воды. Тем не менее коагуляция воды не предусматривается для котлов низкого давления из-за сложности проведения данного процесса.
Затем осветленную (подпиточную) воду пропускают через Na-катионитовый фильтр. Проходя через катионит, в воде происходит замещение двухвалентных ионов Ca и Mg на одновалентный ион Na. Количество ионов в данном процессе не меняется, но ионы жесткости, вызывающие накипеобразование в котле, замещаются на ионы натрия. В этом процессе не меняется анионный состав воды. Соответственно, после установки Na-катионирования ионный состав воды будет состоять из бикарбоната натрия, хлорида натрия и сульфата натрия.
Значение рН воды сразу после Na-катионирования не меняется, т.к. не меняется соотношение между бикарбонат-ионом и свободной углекислотой.
Для того чтобы получить глубокоумягченную воду Na-катионирование воды осуществляют в две ступени.
Затем умягченную (подпиточную) воду направляют в колонку термического деаэратора. В колонке деаэратора производится отгонка кислорода и свободной углекислоты из подпиточной воды. Эффективность данного процесса фактически определяет эффективность всего ВХР котельной. Дело в том, что значение рН воды определяется соотношением различных форм угольной кислоты. В деаэраторной колонке происходит отгонка свободной углекислоты, но при этом остается бикарбонат-ион (связанная форма углекислоты). В результате соотношение между бикарбонат-ионом и свободной углекислотой увеличивается и значение рН воды растет и при надлежащей работе деаэраторной колонки достигает 8,4–8,5. Таким образом, в деаэрированной воде не должно быть не только кислорода, но и свободной углекислоты.
В случае возврата конденсата подпиточная вода смешивается с конденсатом в деаэраторной колонке. Данная вода является питательной водой для парового котла. Возвращаемый конденсат также должен соответствовать требованиям к питательной воде.
Питательная вода, попадая в котел, начинает упариваться. В результате отвода пара в котловой воде постоянно возрастает солесодержание. Часть котловой воды отводят через непрерывную и периодическую продувку, тем самым поддерживая солесодержание котловой воды на уровне не более 3000 мг/л. Существует требование, чтобы непрерывная продувка парового котла была не более 10% от его паропроизводительности. Это означает, что солесодержание питательной воды должно быть не более 300 мг/л. Если солесодержание подпиточной воды после натрия катионирования более 300 мг/л, то необходимо предусмотреть установку обессоливания в структуре системы водоподготовки. Если при смешении подпиточной воды с солесодержанием более 300 мг/л и конденсата получается питательная вода с солесодержание ниже 300 мг/л, условно такой водой можно питать паровой котел и не требуется уменьшать солесодержание подпиточной воды.
На самом деле такой ВХР является довольно неэффективным и аварийным, но используется повсеместно из-за простоты и дешевизны применяемых технологий.
Дело в том, что такой ВХР не учитывает такой показатель, как связанная углекислота. Связанная углекислота (бикарбонат-ион) в питательной воде в котле переходит в свободную углекислоту и выносится с паром, а затем переходит в конденсат. Углекислота в свободной форме в конденсате вызывает активную коррозию пароконденсатного тракта и оборудования. Возвращаемый конденсат содержит большое количество растворенного железа до 2 и более мг/л. Для котельных низкого давления, исходя из стоимости и сложности процесса, не предусматривается конденсатоочистка. Соответственно, железо из конденсата с питательной водой попадает в котел, где упаривается и выпадает в осадок. Эксплуатация котельной с таким режимом вызывает значительные сложности, вызванные постоянными выходами из строя измерительных электродов, уровнемерных стекол, засорением питательных и продувочных линий котла и т. п.
Связанная углекислота (бикарбонат-ион) должна быть учтена в требованиях к питательной воде и ее значение в питательной воде должно быть не более 0,6 мг-экв/л. Это обстоятельство требует либо большой доли возврата конденсата, либо применения технологий уменьшения щелочности в подпиточной воде. Для этого может применяться установка H-катионирования воды. Но практика показала, что в паровых котельных низкого давления эксплуатация подобных установок практически нереальна. Требуется тщательный контроль над подобными установками, и существует большая вероятность коррозионных повреждений котла и питательного тракта.
В итоге можно сказать, к достоинствам ВХР котельной с Na-катионированием можно отнести простоту и дешевизну водоподготовки, а к недостаткам образование большого количества сложноутилизируемых сточных вод, значительные потери тепла с продувками котла, значительную коррозию оборудования и трубопроводов пароконденсатного тракта.
Практически всех этих недостатков лишен ВХР котельной с использованием обратноосмотической технологии обессоливания воды. Данная технология позволяет обессолить подпиточную воду, не используя химического преобразования вещества воды. По сути, это физический метод обессоливания воды. Основной недостаток системы обратноосмотического обессоливания — это образование большого количества слабоминерализованных сточных вод. По сути, исходная вода при помощи полупроницаемой мембраны делится на два потока пермеат и концентрат. Пермеат — обессоленная вода, концентрат — вода с повышенным солесодержанием, сбрасываемая в канализацию. Процесс обессоливания воды идет таким образом, что в пермеате остаются соли в количестве не более 1–5% от исходного солесодержания воды. В результате солесодержание пермеата составляет в среднем от 5 до 20 мг/л и, что особенно важно, содержание бикарбонат-иона в пермеате составляет от 0,05 до 0,3 мг-экв/л.
Таким образом, обратный осмос обеспечивает при любых долях возврата конденсата практически отсутствие потерь тепла с непрерывной продувкой котла, а также минимальное содержание углекислоты в паре и конденсате.
Тем не менее необходимо разобраться, какие технологические особенности будут присутствовать в ВХР котельной при использовании систем обратного осмоса.
Первый опыт автора в эксплуатации обратного осмоса в паровой котельной был неудачен, но он показал, как правильно организовать технологическую схему водоподготовки в дальнейшем. Дело в том, что в процессе реконструкции паровой котельной с котлами ДЕ и ДКВр предполагалось заметить Na-катионирование воды на обратноосмотическое обессоливание воды. Замена была произведена, и через полгода паровой котел ДЕ 6,5–14 потребовал капремонта. Были обнаружены многочисленные дыры в трубном пучке котла. Для того чтобы понять, чем вызвана такая активная коррозия котла, необходимо разобраться, как себя ведет в воде свободная угольная кислота и кислород на каждом этапе водоподготовки.
Надо сказать, что в котельной отсутствовала деаэрация воды. Вода после обратноосмотического обессоливания направлялась в бак запаса воды с паровым барботажем. Температура воды в баке поддерживалась на уровне 75–80 0С для предупреждения запаривания питательных насосов. Таким образом, вся свободная углекислота и кислород в исходной воде попадали в бак запаса воды. В баке нет условий для эффективной отгонки этих газов, и они в количестве значительно больше нормативного попадали в котел. В котле происходила интенсивная углекислотная и кислородная коррозия. Но возникает вопрос, почему до установки обратного осмоса котел проработал на Na-катионировании 8 лет и не требовал ремонта в тех же условиях отсутствия надлежащей деаэрации. Дело в том, что Na-катионированная вода при отгонке из нее углекислого газа увеличивает свое значение рН (1). Чем интенсивнее отгонка углекислоты, тем выше значение рН за счет образования NaOH. Данное условие полностью исключает протекание углекислотной коррозии в котле и частично уменьшает протекание кислородной коррозии.
NaHCO3 ⇿ NaOH+CO2газ ⠀⠀ (1)
Как видно, бикарбонат натрия в котловой воде переходит в едкий натр и повышает рН котловой воды.
Если использовать для водоподготовки только систему обратноосмотического обессоливания, то формально значение жесткости пермеата может быть меньше, чем 0,02 мг-экв/л, но в такой воде будет практически отсутствовать бикарбонат натрия, будет присутствовать только бикарбонат кальция. При кипении такой воды значение рН котловой воды не будет выше 8,5. Гидроксил-ион не образовывается.
Ca (HCO3) 2 ⇿ CaCO3 (осадок) +H2CO3 ⠀⠀ (2)
Как видно, в котле бикарбонат кальция выпадает в осадок в виде карбоната кальция с образованием растворенной формы углекислоты. Происходит отгон углекислоты, но при этом значение рН котловой воды не поднимается выше 8,5–8,8. Когда в котел попадает питательная вода с низким значением рН, то происходит интенсивная углекислотная коррозия котла при высоких температурах. Т.к. в котле нет гидратов для того, чтобы связать углекислоту в бикарбонат (уравнение 1), поступающую с питательной водой.
Проще говоря, для надлежащего ВХР котельной необходимо, чтобы в питательной воде обязательно содержался бикарбонат натрия. Количество бикарбоната натрия (Щпит, мг-экв/л) должно соответствовать солесодержанию питательной воды (S, мг/л). Отношение бикарбоната к солесодержанию питательной воды называется относительной щелочностью питательной воды.
Щот= 40 * Щпит * 100/Sпит %⠀⠀ (3)
Если относительная щелочность меньше 5%, происходит активная углекислотная коррозия парового котла. Если относительная щелочность больше 50%, то может наблюдаться щелочная межкристаллическая коррозия котла.
Относительная щелочность питательной воды для описываемого случая с котлом ДЕ составляла 1,5%.
Можно сказать, что обратноосмотическое обессоливание воды в структуре ВХР паровых котельных низкого давления должно применяться совместно с Na-катионированием. Т.е. обратноосмотическое обессоливание не является полной заменой Na-катионированию для котлов низкого давления.
Работая по комбинированной схеме водоподготовки (обратный осмос + умягчение), значение относительной щелочности будет таким же, как и при работе только на умягчении. Примерно от 15 до 40%. Т.е. значение относительной щелочности будет оптимальным, и при этом вода имеет небольшое солесодержание, что значительно уменьшает количество продувки котла, увеличивает качество пара и конденсата.
Для котлов высокого давления, где требуется подпитка обессоленной водой, вполне применима технология двухступенчатого осмоса с последующей корректировкой пермеата.
Необходимо сделать небольшое отступление. Если в качестве исходной воды для котельной используется артезианская скважина, то в такой воде, скорее всего, будут содержаться натрий и калий наряду с кальцием и магнием. Это позволит использовать только обратный осмос для подготовки воды. При условии, если мембрана обеспечит нормативное содержание жесткости ниже 0,02 мг-экв/л. Но на практике сложно достигнуть такого низкого значения жесткости в одну ступень осмоса и необходимо использовать Na-катионирование хотя бы для доумягчения пермеата.
В своей практике я использовал обратноосмотическое обессоливание воды без Na-катионирования для небольшого парогенератора (0,5 т/час), работающего на артезианской воде. В связи с объективной невозможностью организации сложной системы водоподготовки и отсутствия обслуживающего персонала в парогенераторной решено было использовать только автоматизированную установку обратного осмоса. Вода имела солесодержание около 650 мг/л, жесткость около 7 мг-экв/л, рН — 7,8 и содержание кислорода около 3,5 мг/л. Возврат конденсата отсутствовал. Использование Na-катионирования в данном случае невозможно. В результате работы осмоса установился следующий ВХР парогенераторной. Осмотическая вода (пермеат) имела солесодержание 11 мг/л, жесткость около 0,05–0,06 мг-экв/л, значение рН 6,2–6,3. Т.к. деаэратор не предусматривался и его установка была объективно невозможна, я настоятельно рекомендовал добавлять в бак пермеата едкий натр. Это было некому делать, и, соответственно, это не делалось. Тем не менее через две недели работы парогенератора на осмотической воде из артезианской скважины значение рН котловой воды держалось на уровне 9,8–10,5. Питательные трубопроводы парогенератора и емкость пермеата выполнены из полимерного материала и не коррозировали. Первые несколько дней наблюдалось очень большое количество железа при продувке уровнемерных стекол, что говорило о значительной коррозии котла. Но как только значение рН котловой воды выросло до 10, активные коррозионные процессы прекратились. В настоящее время данный котел уже работает более 5 лет. При том что его предшественник, работающий без водоподготовки, примерно раз в месяц полностью забивался карбонатом кальция и требовал постоянного кипячения с лимонной кислотой, не говоря уже о колоссальном перерасходе газа. Тем не менее установившийся ВХР не является нормативным и есть большая вероятность сквозной коррозии жаровой трубы и выхода парогенератора из строя раньше установленного срока службы.
Необходимо рассмотреть еще один момент, связанный с работой обратноосмотических систем обессоливания. Это почему пермеат имеет низкое значение рН и как это отражается на ВХР котельной.
При фильтровании через полупроницаемую мембрану ионы, растворенные в воде, практически не переходят через мембрану, т.к. они находятся в гидратированном состоянии, т.е. имеют связь с молекулами воды. В результате диаметр гидратированного иона получается больше диаметра поры в мембране, с учетом связанного слоя воды на поверхности мембраны гидратированный ион не переносится через мембрану и остается в концентрате. Растворенные в воде газы свободно проходят через мембрану, т.к. они не имеют заряда и не подвержены гидратированию водой. Размер молекулы газа меньше размера поры в мембране. Таким образом, в пермеате содержится тоже количество углекислого газа, что и в исходной воде, а количество бикарбонат-иона существенно меньше. Порядка 1–5% от исходного количества бикарбоната. В физическом смысле можно сказать, что бикарбонат-ион — это щелочной остаток от растворения угольной кислоты. Соответственно, убирая щелочную составляющую за счет фильтрации, но оставляя кислотную (углекислый газ проходит через мембрану), значение рН фильтрата существенно падает. Это хорошо показывается уравнением Хендерсона-Хассельбальха для диссоциации угольной кислоты H2CO3 = H+НCO3

К примеру, если содержание бикарбоната в исходной воде 2,0 ммоль/л, в пермеате 0,12 ммоль/л, содержание углекислоты в исходной воде 10 мг/л (0,227 ммоль/л), то значение рН можно рассчитать по формуле (1)
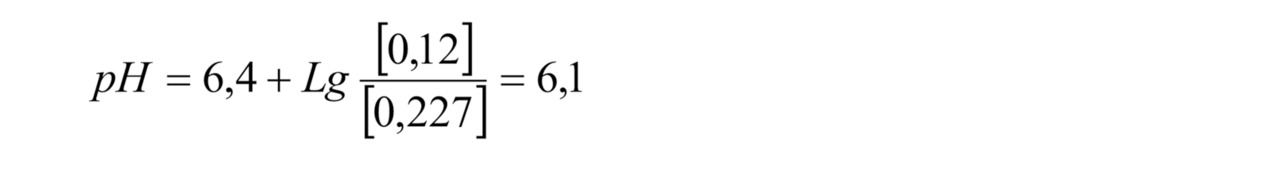
При этом значение рН исходной воды равно
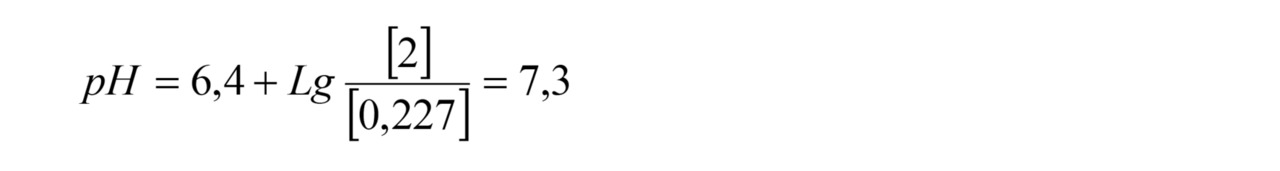
Как видим, за счет уменьшения содержания бикарбоната и неизменного содержания угольной кислоты пермеат имеет низкое значение рН. При этом общее количество связанной угольной кислоты в виде бикарбонат-иона уменьшилось с 2 ммоль/л до 0,12 ммоль/л. Это значит, что в паре и конденсате будет содержаться примерно на 70–80 мг/л углекислоты меньше. Что и является важным преимуществом работы осмотических систем в схеме ВХР котельных.
Остается только избежать углекислотной коррозии питательного тракта парового котла. Для этого осмотическую воду необходимо направлять в колонку деаэратора на отгонку углекислоты и кислорода. При этом термический деаэратор должен работать надлежащим образом, а не просто как бак запаса воды.
Если значение рН деаэрированной воды менее 8,4–8,5, необходимо выяснить причины этого, а не начинать дозировать едкий натр в деаэрированную воду. Едкий натр свяжет свободную углекислоту в бикарбонат, который в котле перейдет в углекислоту и уйдет с паром. Причинами низкого значения рН деаэрированной воды могут быть:
— недостаточный нагрев подпиточной воды перед деаэраторной колонкой;
— недостаточный расход пара на зеркало;
— недостаточный расход пара на барботаж;
— возврат конденсата не в деаэраторную колонку, а в деаэраторный бак.
Зная особенности работы обратноосмотических систем обессоливания воды, можно предложить 2 принципиальные схемы их применения в структуре ВХР паровых котельных низкого давления.
В первом варианте исходная вода, проходя фильтр осветления, поступает на установку Na-катионирования, затем умягченная вода поступает на обратноосмотическое обессоливание. После осмоса пермеат поступает в термический деаэратор (рис. 1).
Во втором варианте исходная вода, проходя фильтр осветления, сразу направляется на обратноосмотическое обессоливание, затем пермеат подается на установку Na-катионирования. После умягчения вода поступает в термический деаэратор (рис. 2). В этом варианте требуется дополнительная емкость и насосная станция.
В обоих вариантах получаемый состав подпиточной воды полностью соответствует требованиям НД и позволяет вести ВХР с минимальным содержанием углекислоты в конденсате и очень низкими потерями тепла с продувкой котла.
Тем не менее эти два варианта принципиально отличаются с точки зрения организации работы системы обратного осмоса.
В первом варианте происходит предварительное умягчение воды. Из воды извлекаются ионы-накипеобразователи. Соответственно, практически полностью исключается образование отложений карбоната кальция на мембране. Это условие позволяет значительно уменьшить количество концентрата сбрасываемого с установки обратного осмоса. Количество концентрата может составлять всего 10% от количества исходной воды. При этом необходимо обеспечить отсутствие в исходной воде веществ коагулянтов. Так, содержание железа в исходной воде должно быть не более 0,05 мг/л. Основной недостаток первого варианта — это большой расход соли на регенерацию установки умягчения.
Во втором варианте исходная вода, как правило, находящаяся в состоянии углекислотного равновесия, в мембране начнет концентрироваться, что сразу увеличит концентрацию бикарбоната кальция без увеличения концентрации углекислого газа. Соответственно, начнет формироваться твердый осадок карбоната кальция на мембране. Это обстоятельство требует применения ингибиторов осадкообразования. Стоит сказать, что качественные ингибиторы стоят достаточно дорого. При этом сброс концентрата в любом случае будет составлять не менее 25% от количества исходной воды. Главное достоинство второго варианта — это минимальные издержки на соль при работе установки умягчения в качестве корректирующей стадии. Второй вариант также применим, в случае если исходная вода имеет большую жесткость и относительно небольшую щелочность. В этом случае возникнут большие затраты, связанные с умягчением. Более эффективно использовать дозирование соляной кислоты для разрушения бикарбоната перед осмосом. Это обеспечит отсутствие отложений на мембране. В этом случае необходимо будет предусмотреть стадию декарбонизации пермеата. Возможно использование для этих целей мембранного контактора.
Эффективность первого варианта можно повысить, используя для регенерации установки умягчения не дорогую таблетированную соль, а техническую соль (галит). Это требует простого технического решения по предварительному фильтрованию полученного насыщенного раствора соли (Статья — «Использование технической соли (минерал Галит) в технологии регенерации современных автоматических Na-катионитовых фильтров»). В этом случае стоимость технической соли будет соизмерима со стоимостью ингибитора осадкообразования. Более того, схема по первому варианту гораздо более вариативна и имеет ряд существенных преимуществ, о которых будет рассказано в отдельной статье. Необходимо учесть, что при подаче подпиточной воды непосредственно в деаэратор после осмоса возможно возникновение избыточного противодавления в подпиточной линии перед деаэратором (до 2 бар). В этих условиях для сохранения производительности установки обессоливания по пермеату необходимо предусмотреть запас по давлению воды на входе в установку обессоливания. Выбрать более мощный насос для компенсации противодавления и сохранения производительности по пермеату.
В любом случае, как уже было сказано, ВХР каждой котельной довольно индивидуальный, и в каждом конкретном случае необходим тщательный анализ всех факторов и выбор наиболее оптимального варианта. При этом использование обратноосмотического обессоливания совместно с Na-катионированием в различных вариантах сочетания представляется наиболее применимой современной технологией водоподготовки в структуре ВХР паровой котельной низкого давления.
Выводы:
1. Использование обратноосмотической технологии обессоливания воды в структуре ВХР паровых котельных позволяет обеспечить эффективную и безаварийную эксплуатацию котельной, и такой ВХР имеет ряд существенных преимуществ по сравнению с использованием только технологии Na-катионирования.
2. Обратноосмотическая технология обессоливания воды в структуре ВХР паровых котельных низкого давления не является конкурентом технологии Na-катионирования. Данные технологии должны работать вместе для обеспечения максимальной эффективности друг друга и всего ВХР котельной.
3. Обратноосмотический ВХР котельной некорректно сравнивать с Na-катионитовым ВХР. Технология Na-катионирования не обеспечивает ряд важных параметров ведения ВХР.
4. Ненадлежащее ведение процесса термической деаэрации и декарбонизации подпиточной воды при применении мембранных технологий может быть причиной коррозионных повреждений элементов питательного тракта парового котла, а также быть причиной повышенного содержания железа в котловой воде.
5. Использование щелочных реагентов для повышения значения рН питательной воды, вероятнее всего, говорит о ненадлежащей работе термического деаэратора.
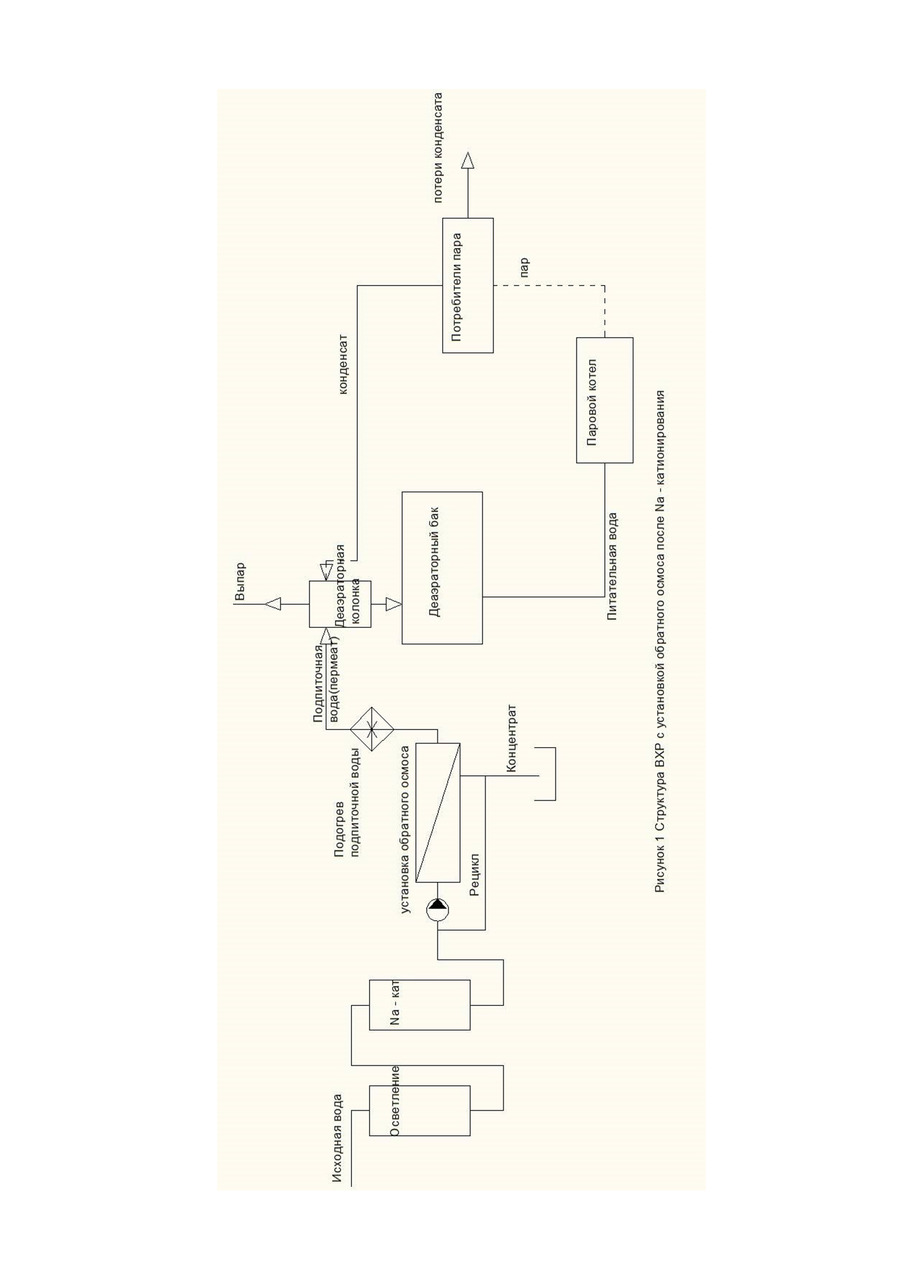
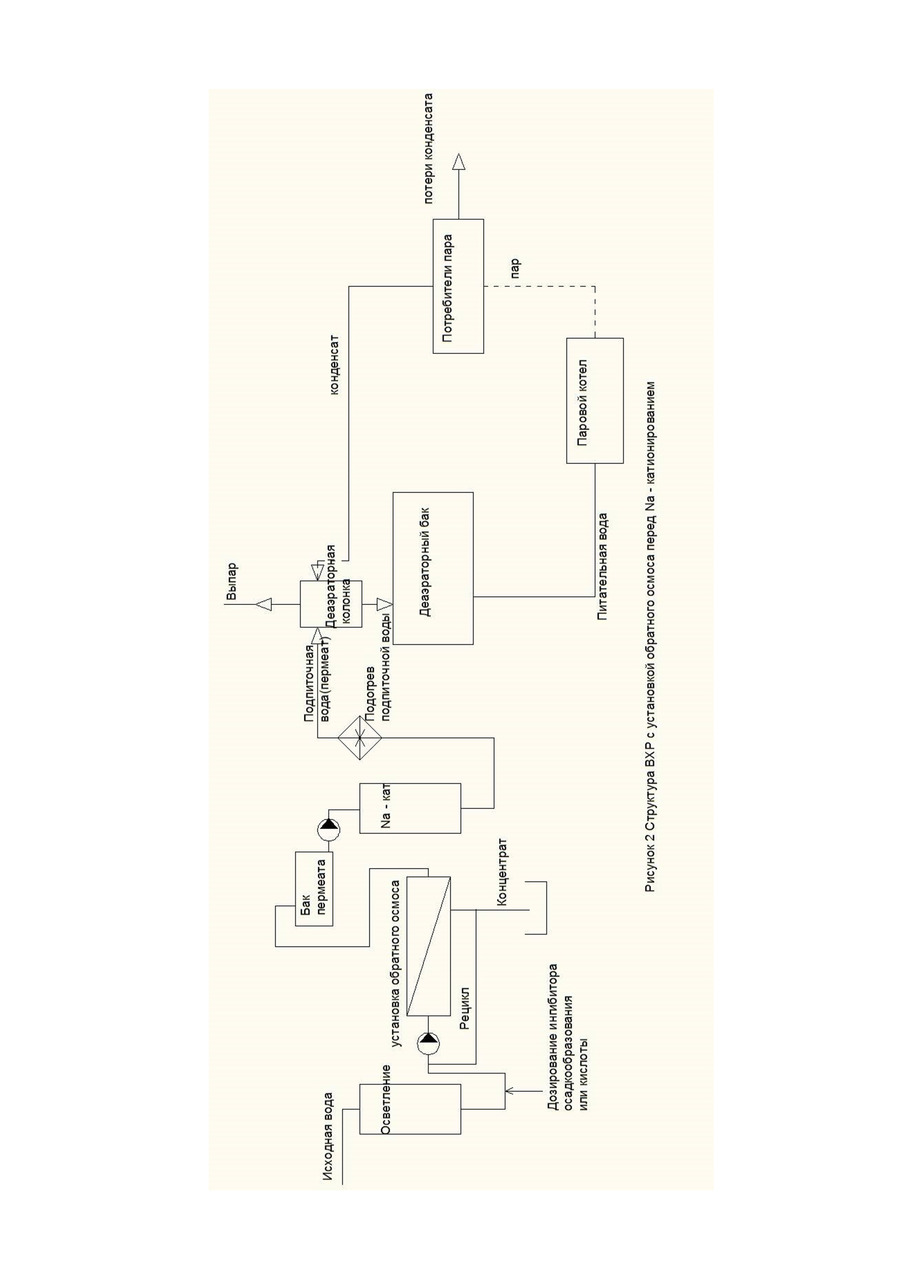
Использование технической соли (минерал Галит) в технологии регенерации современных автоматических Na-катионитовых фильтров
В статье рассмотрена схема применения галита для регенерации автоматических установок Na-катионирования вместо дорогой таблетированной соли.
Расход соли для регенерации Na-катионитовых фильтров является одной из самых затратных статей при эксплуатации водоподготовительного оборудования.
Современные системы умягчения являются полностью автоматизированными. Оператору необходимо только досыпать соль в фидер (бак-солерастворитель) по мере ее расходования. Современные клапаны автоматического управления потоков в системах умягчения представляют собой сложное техническое устройство со множеством переходов, отверстий, сужающих устройств, инжекторов, плунжеров и т. д. Использование в таких устройствах растворов из неочищенной технической соли (галита) может привести к засорению устройства и выходу его из строя.
Производители клапанов управления потоками рекомендуют использовать для регенерации катионита таблетированную соль. Таблетированная соль — это соль, приготовленная выварочным способом для максимальной очистки. Раствор, полученный из такой соли, прозрачен, и на дне фидера не образуется нерастворяюшийся осадок. Содержание NaCl в таблетированной соли должно составлять не менее 99,0%. Для регенерации катионита систем умягчения содержание хлористого натрия в соли должно быть не менее 97%.
Основной недостаток таблетированной соли — это ее стоимость. В настоящее время при оптовых закупках 1 кг таблетированной соли стоит от 18 рублей. В качестве более дешевого аналога можно рассмотреть минеральный концентрат галит (техническая соль) высшей категории, который содержит 97–98% NaCl.
До появления на российском рынке таблетированной соли галит использовался повсеместно для целей водоподготовки. Стоимость 1 тонны галита высшего сорта составляет в среднем 4000 рублей, т.е. 1 кг галита стоит 4 рубля. Галит дешевле таблетированной соли в среднем в 4,5 раза. Возникает закономерный вопрос о возможности использования галита в современных системах умягчения воды, которые оснащены автоматическими клапанами управления потоками.
При растворении технической соли непосредственно в фидере (баке-солерастворителе) образуется большое количество загрязнений, изначально содержащихся в соли. Наблюдается образование устойчивой пленки на внутренней поверхности фидера и в солезаборной шахте. Образуется большое количество взвешенных веществ, нерастворимый осадок. Все это приводит к выходу из строя клапанов управления потоками. Также это негативно влияет на ионообменные качества катионита.
Учитывая данные обстоятельства, была разработана схема применения технической соли (галита «высший сорт») в автоматических установках умягчения воды. Для целей водоподготовки применим только высший сорт галита с содержанием NaCl более 97%.
На рис. 1 представлена принципиальная схема использования технической соли в автоматической установке умягчения воды, состоящей из автоматического клапана управления потоками (CLACK, FLECK), стеклопластикового корпуса с катионитом, фидера с солезаборным устройством. Данная установка является стандартной для подавляющего большинства современных систем умягчения воды средней и малой производительности.
Принцип работы:
Исходная жесткая вода поступает в клапан управления и перенаправляется на фильтрацию через катионит в корпус фильтра сверху вниз. После истощения катионита по ионам натрия требуется его регенерация. Регенерация катионита осуществляется рабочим раствором поваренной соли концентрацией 8–10%. Рабочий раствор соли получается путем смешения насыщенного раствора соли и исходной воды. Смешивание потоков происходит в клапане управления, и далее уже рабочий раствор поступает в фильтр. Насыщенный раствор имеет концентрацию около 26%. Рабочий раствор 8–10%. Насыщенный раствор приготавливается предварительно в фидере (баке-солерастворителе). Оператор засыпает таблетированную соль в фидер. Вода поступает в фидер автоматически в течение четко установленного времени после каждой автоматической регенерации установки. Количество воды, поступившее в фидер, является очень важным показателем, во многом определяющим эффективность расходования соли на регенерацию катионита.
Объем воды в фидере определяется двумя условиями:
1. Временем заполнения бака.
2. Аварийным поплавковым клапаном, регулирующим максимальный уровень воды в фидере.
Оба условия не всегда четко позволяют обеспечить количество насыщенного раствора соли в фидере для оптимального ведения процесса регенерации. К примеру, на 1 литр катионита, как правило, для воды средней жесткости требуется 120 г поваренной соли. Если в фильтре засыпано 100 литров катионита, то для регенерации потребуется 12 кг соли или 40 литров насыщенного 25% раствора. Производители водоподготовительного оборудования указывают на то, что объем нерастворившейся соли в фидере должен быть чуть выше уровня воды. Стоит помнить, что нерастворившаяся соль занимает существенный объем в фидере и количество поступившей в фидер воды в автоматическом режиме может быть недостаточно для получения необходимого количества насыщенного раствора. Увеличение времени поступления воды в фидер в данном случае не исправит ситуацию, т.к. поплавковый клапан перекроет линию подачи воды при повышении объема воды до максимального уровня, при том что большая часть внутреннего объема фидера занята нерастворившейся таблетированной солью.
В любом случае такай способ получения насыщенного раствора соли не позволяет полностью контролировать ведение процесса умягчения воды при оптимальных параметрах по потреблению соли. Требуется длительная отстройка процесса дозасыпки соли и времени набора воды в фидер. Эффективность данного процесса можно отследить только спустя некоторое время при определении удельного потребления соли на 1 м3 получаемой умягченной воды по результатам ведения учета за расходами соли и воды.
В соответствии со схемой на рисунке 1 насыщенный раствор технической соли приготавливается в отдельной емкости объемом значительно большим, чем объем фидера. Объема полученного насыщенного раствора соли должно хватать на несколько регенераций. «Грязный» насыщенный раствор поступает с помощью насоса на фильтр осветления. Насос необходимо оборудовать обратным клапаном и реле давлением, а также угловым сетчатым фильтром на входе. Фильтр осветления представляет собой стеклопластиковый корпус типоразмеров 8–32 с ручным клапаном управления потоками. Фильтр загружен высокоэффективной осветляющей загрузкой Filter AG. Расход воды через фильтр должен быть не более 0,4 м3/час. После осветления насыщенный раствор поступает в фидер. Уровень заполнения фидера раствором контролируется поплавковым клапаном. Таким образом, в фидер можно набрать четкое количество насыщенного раствора, необходимое для регенерации катионита. При увеличении перепада давления на фильтре осветления выше 0,5 бар необходимо провести взрыхление и отмывку фильтра в дренаж. Для этого к подводящей линии насыщенного раствора необходимо подключить трубопровод с исходной водой.
Автоматизация процесса заключается в установке микропереключателя в автоматический клапан управления умягчением. Микропереключатель должен включаться (замыкать контакт) при автоматическом выходе установки умягчения в регенерацию. При замыкании контакта должен включаться (перекрываться) соленоидный клапан (нормально открытый). Тем самым перекрывая подачу насыщенного раствора в фидер. В процессе регенерации насыщенный раствор инжектируется из фидера и, смешиваясь с исходной водой, поступает на регенерацию катионита. Поплавковый клапан в солезаборном устройстве по мере уменьшения насыщенного раствора в фидере открывается, но закрытый соленоидный клапан не дает раствору после фильтра осветления поступать в фидер. Таким образом, на регенерацию катионита тратится точно отмеренное количество раствора. После завершения регенерации клапан управления в автоматическом режиме начнет заполнять фидер исходной водой. Необходимо выключить или сделать минимальной эту стадию (прим. 1 мин). После завершения регенерации и стадии «заполнение фидера водой» микропереключатель разомкнется и соленоидный клапан откроется. Начнет происходить заполнение фидера насыщенным раствором из емкости. Фидер заполнится насыщенным раствором до срабатывания поплавкового клапана солезаборного устройства. Цикл завершен.
Данная схема является простой в эксплуатации и не дорогой. При использовании в котельных производительностью по умягченной воде 1,5 м3/час дополнительно приобретенное оборудование окупается менее чем за полгода за счет экономии на более дешевой технической соли. При большей производительности срок окупаемости еще меньше.
Пример расчета экономического эффекта от использования технической соли в системах умягчения воды вместо таблетированной соли.
Исходные данные
Паровая котельная с установленной системой умягчения воды производительностью 1,5 м3/час. Суточное количество умягченной воды — 36 м3.
Исходная вода — питьевой водопровод г. Саратова. Общая жесткость исходной воды — 4,0 мг-экв/л (0Ж).
При такой жесткости исходной воды удельный расход соли на 1 м3 исходной воды составит 0,45 кг. Т.е. суточный расход соли составит 0,45*36=16,2 кг.
Затраты в сутки на таблетированную соль — 16,2*18=291,6 руб/сут.
Затраты в сутки на техническую соль — 16,2*4=64,8 руб/сут.
18 — стоимость 1 кг таблетированной соли, руб.
4 — стоимость 1 кг технической соли, руб.
Экономия при применении технической соли составит 291,6–64,8=226,8 руб/сут.
Стоимость дополнительно устанавливаемого оборудования для использования технической соли:
1. Емкость насыщенного раствора (1000 л) пластиковая — 10 000 руб.
2. Насос с реле давления и обратным клапаном — 4000 руб.
3. Фильтр осветления с ручным управлением — 12000 руб.
4. Соленоидный клапан (н.о.) ½ “ — 3000 руб.
5. Трубопроводы, КиП и Монтажные работы — 11000 руб.
Итого: 40 000 руб.
Срок окупаемости 40000/226,8= 176 суток
Вывод: использование технической соли вместо таблетированной в котельных с производительностью по умягченной воде более 1,0 м3/час является оправданным и создающим значительный экономический эффект за счет использования более дешевой соли. Оборудование, применяемое при модернизации стандартной схемы, окупается менее чем за год. Режимная наладка установки умягчения при использовании предлагаемой схемы становится более эффективной в процессе регулирования расхода соли для регенерации катионита, что позволит избежать необоснованного перерасхода соли.
Дегазация воды с использованием обратноосмотических мембран
В статье рассмотрено, как одновременно с обратноосмотическим обессоливанием воды можно произвести ее дегазацию.
Содержание растворенных агрессивных газов СО2 и О2 в воде является причиной коррозии оборудования и трубопроводов. При повышении температуры воды подвижность молекул кислорода увеличивается и коррозионная агрессивность воды растет.
Проблему удаления кислорода и диоксида углерода из воды решают преимущественно двумя способами. Это термическая и химическая дегазация (деаэрация).
При термической дегазации происходит удаление растворенных газов из воды в деаэрационной колонке. Вода в состоянии насыщения растекается по тарелкам деаэрационной колонки тонкой пленкой. При этом часть воды выпаривается, унося с собой растворенные газы, которые выделяются с поверхности воды при ее кипении. Чем больше поверхность испарения воды и чем выше температура насыщения, тем эффективнее происходит дегазация воды.
При химической дегазации удаления газов не происходит. Происходит только их связывание в неорганические соединения.
При использовании сульфита натрия
2Na2SO3+O2 → 2Na2SO4 ⠀⠀ (1)
При использовании гидразингидрата
N2H4*H2O+O2 → 3H2O+N2 ⠀⠀ (2)
Связывание углекислого газа в бикарбонат-ион (подщелачивание) происходит по реакции:
NaOH+H2СO3 = NaHCO3+H2O ⠀⠀ (3)
Химическая деаэрация и подщелачивание имеет ряд существенных недостатков:
1. При проведении химической деаэрации значительно (для поверхностных вод до 50 и более процентов) увеличивается солесодержание питательной воды и, соответственно, растет непрерывная продувка парового котла. Для связывания 1 мг кислорода тратится 10 мг сульфита натрия. Необходимо отметить, что при использовании гидразингидрата солесодержание воды не увеличивается, но сам реагент чрезвычайно токсичен (относится к первому классу опасности), пожароопасен и требует специфических условий хранения, что исключает его применение для паровых котельных, особенно работающих на пищевых производствах.
2. При проведении химической деаэрации в воде остаются сульфиты (SO3), что связано с их избыточным дозированием для гарантированного связывания кислорода. Как правило, производители котлов достаточно жестко регламентируют содержание сульфитов в котловой воде (5–10 мг/л), что представляет значительную сложность в организации процесса дозирования сульфита натрия в питательную воду. Сульфит-ион (SO3) является сильным восстановителем и значительно усиливает коррозионные процессы, протекающие в котле и пароконденсатном тракте путем разрушения пассивирующего слоя на поверхности металла. Контакт сульфит-иона, находящегося в паре, с продуктом недопустим. Сульфит натрия относится к веществам 3-го класса опасности. Сульфит натрия наиболее применим для связывания незначительного остаточного содержания кислорода в питательной воде после термического деаэратора.
3. Еще одним не всегда учитываемым моментом является то, что при дозировании сульфита натрия в воде образуется сульфат натрия Na2SO4, который, по сути, увеличивает содержание сульфат-иона в питательной воде, и при проскоке жесткости или постоянно повышенной жесткости в питательной воде в котле возможно образование нерастворимого сульфата кальция СaSO4 (гипса). Сульфат кальция образует на испарительных поверхностях плотные отложения (накипь), которые значительно увеличивают термическое сопротивление и приводят к перегреву металла труб и значительному перерасходу топочного газа. Более того, гипс практически невозможно удалить с поверхности труб химической мойкой котла ингибированной соляной кислотой.
4. Подщелачивание питательной воды каустической содой всего лишь связывает угольную кислоту в бикарбонат натрия (уравнение 3), который в котле снова перейдет в угольную кислоту, которая выделится в виде углекислого газа в пар при кипении воды и впоследствии перейдет в конденсат, вызывая понижение значения рН конденсата и значительно увеличивая его коррозионные свойства. Таким образом, подщелачивание питательной воды позволяет избежать углекислотной коррозии питательного и котлового тракта парового котла, но при этом увеличивает коррозионную агрессивность конденсата.
Термическая дегазация для паровых котельных в настоящее время является наиболее приемлемым вариантом. Деаэратор является также накопительным баком питательной воды, куда поступает подпиточная вода и конденсат. За счет небольшого избыточного давления не происходит повторного загрязнения воды агрессивными газами из атмосферы.
Тем не менее термическая дегазация требует целого ряда сложных технических решений при проектировании и обладает значительной стоимостью основного и вспомогательного оборудования. Так, необходимо обеспечить подогрев подпиточной воды перед деаэратором не менее 80 оС, что представляет значительную техническую сложность, особенно при переменном расходе подпиточной воды. При резком снижении расхода подпиточной воды в деаэратор за счет инерционности регулятора пара на теплообменник подпиточной воды температура подпиточной воды после теплообменника резко увеличивается и наблюдается закипание воды в трубопроводе от теплообменника до деаэратора. При этом в данном трубопроводе начинается выделение кислорода из воды и интенсивная кислородная коррозия. Для исключения повреждения данного трубопровода целесообразно его выполнять из нержавеющей стали.
Руководства по проектированию предписывают обеспечить долю выпара в деаэраторе, равную 2 кг на 1 тонну деаэрированной воды. На практике для получения кислорода в деаэрированной воде менее 50 мкг/л расход выпара может быть увеличен более чем в 10 раз. Кроме того, часто вызывает затруднение автоматизация деаэратора. Так как необходимо одновременно поддерживать заданное давление в деаэраторе, температуру воды в деаэраторе и уровень воды в деаэрационном баке. При резком изменении расхода питательной воды происходит понижение уровня воды в баке деаэратора, и для его поддержания увеличивается расход подпиточной воды в деаэратор выше паспортного значения. При этом качество деаэрации снижается.
Таким образом, для небольших паровых и особенно водогрейных котельных организация термической деаэрации является чрезвычайно дорогостоящим мероприятием, как по капитальным, так и по эксплуатационным затратам. Более того, для водогрейных котельных используются вакуумные деаэраторы, конструкция которых ненадежна и не обеспечивает необходимое качество воды.
Как правило, на практике для котельных производительностью менее 3,0–6,0 т/ч по пару, даже если термический деаэратор установлен, то он не обеспечивает требуемой дегазации питательной воды и деаэратор по факту работает как накопительный бак питательной воды.
Для более эффективной дегазации питательной воды в котельных целесообразно применение мембранной дегазации воды.
Известно, что мембранную дегазацию воды можно осуществлять при помощи гидрофобных мембран, или так называемых мембранных контакторов.
В настоящее время для дегазации воды во многих отраслях промышленности используются гидрофобные мембранные контакторы. Это поливолоконные структуры с большой поверхностью. Через эту поверхность осуществляется массоперенос газа из жидкости в поток инертного газа или вакуум. Инертный газ находится внутри волокон. Вода протекает снаружи волокна. Сами волокна сделаны из гидрофобного материала. Волокно не впитывает (не пропускает воду), однако незаряженные молекулы газа могут свободно проходить через микропористую структуру волокна при наличии разницы концентраций газа внутри и снаружи волокон.
Дегазация при использовании мембранных контакторов достаточно эффективна для удаления диоксида углерода из воды, т.к. в качестве инертного газа может использоваться атмосферный воздух. Но для удаления кислорода из воды необходимо использовать азот высокой степени очистки с вакуумом. Это обстоятельство требует применять в котельной дополнительное дорогое и энергозатратное оборудование. При этом нормативного значения по кислороду не будет достигнуто и есть необходимость в дозировании сульфита натрия для связывания остаточного кислорода. Следует учесть, что значение рН воды достаточно сложно получить выше 8,5 сразу после мембранного контактора. Это обстоятельство вызывает необходимость в дозировании каустической соды в питательную воду, что впоследствии приведет к высокому содержанию углекислоты в конденсате.
Однако если на предприятии имеется система централизованного получения азота, данная схема мембранной дегазации может быть вполне конкурентоспособна с термической деаэрацией.
Предлагается для дегазации воды использовать традиционные полимерные обратноосмотические мембраны, используемые повсеместно для обессоливания воды. Данные мембраны являются гидрофильными и не могут препятствовать прохождению через них воды. При этом ионы солей металлов, растворенные в воде, через гидрофильные мембраны практически не проходят. Селективность современных обратноосмотических мембранных элементов для очистки воды составляет от 99,0 до 99,7%. Практически все соли задерживаются.
Растворенные в воде газы проходят через полимерные обратноосмотические мембраны. Соответственно, для того чтобы удалить из воды газы, необходимо газы перед мембраной перевести в неорганические соединения, растворенные в воде.
Для растворенного диоксида углерода необходимо в воду перед установкой обратноосмотического обессоливания дозировать раствор каустической соды NaOH.
NaOH+H2O+ CO2=NaHCO3+H2O
В результате диоксид углерода связывается в бикарбонат натрия, который удаляется на мембране в потоке концентрата.
Для связывания кислорода необходимо дозировать раствор бисульфита натрия (1). Получающийся сульфат натрия также будет удаляться с концентратом.
В результате на выходе из установки обратноосмотического обессоливания получается обессоленная вода без растворенных агрессивных газов.
Данный метод дегазации принципиально отличается от чисто химической дегазации. В данном методе газы связываются и удаляются из воды. При химической деаэрации только связываются. Тем самым солесодержание воды не увеличивается и, что очень важно, не увеличивается количество бикарбонат и сульфат-иона в питательной воде.
Основные преимущества мембранной дегазации гидрофильными мембранами:
1. Дегазация проходит с одновременным обессоливанием питательной воды.
2. Растворенные газы не связываются, а удаляются из воды, что в совокупности с незначительной величиной щелочности подпиточной воды после осмоса позволяет получить минимальное значение углекислоты в паровом конденсате, тем самым обеспечивается надежная и эффективная работа оборудования пароконденсатного тракта.
3. По сравнению с химической дегазацией в осмотической (питательной) воде практически отсутствует сульфит-ион SO3, по которому имеется ограничение по содержанию в котловой воде.
4. Для получения гарантированного связывания кислорода можно дозировать значительно большее количество сульфита натрия в воду перед обратноосмотической установкой.
5. Дозирование сульфита натрия позволит также связать свободный хлор в воде, поступающей на мембрану. Таким образом, в установке предварительной подготовки воды перед осмосом возможно использование хлора для проведения и увеличения эффективности процессов коагуляции, обезжелезивания, обеззараживания и т. п.
6. При одновременном обессоливании и дегазации подпиточной воды исключается непрерывная продувка паровых котлов, что приводит к снижению потерь воды и тепла и повышению КПД котельной, а также к значительному снижению загрязненных стоков из котлов и, соответственно, всей котельной.
У данного метода имеются недостатки:
1. В данной технологии дегазации обратноосмотическими мембранами высок риск вторичного загрязнения воды кислородом. Т.е. воду необходимо направлять либо сразу на подпитку котла без накопительной емкости, либо в накопительный бак с паровым барботажем и температурой воды не менее 100 оС.
2. Появляются затраты на сульфит натрия и каустическую соду по сравнению с термической дегазацией.
Предложенный способ дегазации воды осуществляют следующим образом (рисунок 1).
Способ дегазации воды содержит следующие технологические стадии. Вода проходит стадию осветления на установке непрерывного осветления воды (1) и поступает на установку системы непрерывного Na-катионитового умягчения воды (2). Целесообразно, чтобы было установлено не менее 2 фильтров, которые позволяют работать системе в непрерывном режиме. Жесткость умягченной воды должна быть в пределах 0,02–0,1 мг-экв/л. Величина жесткости умягченной воды будет определяться исходя из количества раствора едкого натра, дозируемого в умягченную воду после установки умягчения (2). Чем выше жесткость умягченной воды и больше расход едкого натра, тем выше вероятность образования твердого осадка карбоната кальция на мембране.
После установки умягчения (2) в воду при помощи установки дозирования (3) дозируется раствор едкого натра. Количество едкого натра выбирают не более 10–15% количества свободной углекислоты в воде. Происходит связывание свободной углекислоты в бикарбонат-ион (уравнение 3).
Значение рН воды возрастает до 8,2–8,5. Затем в воду при помощи установки (4) дозируется раствор сульфита натрия. При этом количество сульфита натрия выбирают либо эквивалентно равным количеству растворенного в воде кислорода, либо не менее чем на 10–30% больше количества растворенного в воде кислорода.
Затем вода, проходя через фильтр тонкой очистки (5), поступает на установку обратноосмотического обессоливания воды (6). На установке обратноосмотического обессоливания (6) происходит разделение исходной воды на два потока: пермеат (обессоленная вода) и концентрат (вода, насыщенная солями и сбрасываемая в канализацию). Работа данной установки организована так, что большая часть концентрата возвращается на вход установки обессоливания (6). Таким образом, получается рециркуляция части потока концентрата (рецикл).
Поступающий в воду при помощи установки дозирования (4) сульфит натрия реагирует с растворенным кислородом. В результате получается сульфат натрия (уравнение 1).
Данная реакция протекает достаточно быстро в горячей воде или в воде со значением рН более 8,5. Вода, поступающая на установку обессоливания (6), имеет температуру от 2 до 40 °С. Тем не менее недостаточно быстрое протекание реакции (уравнение 1) компенсируется эффективным перемешиванием сульфита натрия в воде в фильтре тонкой очистки (5) и в самом обратноосмотическом мембранном элементе. Так, большая часть сульфита натрия, не связавшая кислород перед и внутри обратноосмотического элемента, возвращается на вход обратноосмотического элемента с потоком рециклом. Тем самым обеспечивается достаточно полное протекание реакции (уравнение 1) до и внутри обратноосмотического элемента.
Обратноосмотический мембранный элемент пропускает растворенные в воде газы, но практически не пропускает растворенные в воде ионы. Таким образом, углекислый газ, связанный в бикарбонат едким натром, не проходит через мембрану, а сбрасывается в виде бикарбонат-иона в канализацию. Тот же принцип работает при связывании растворенного в воде кислорода. В результате протекания реакции (уравнение 1) растворенный в воде кислород связывается сульфитом натрия в сульфат натрия и затем сбрасывается с потоком концентрата в канализацию.
Таким образом, на обратноосмотической установке (6) проходит процесс одновременного обессоливания и дегазации воды, что является принципиально новым подходом в работе подобных устройств.
Обессоленная и дегазированная вода направляется потребителю. Важно не допустить вторичного загрязнения воды кислородом и углекислым газом атмосферного воздуха. Для этого рекомендуется использовать мембранный гидроаккумуляторный бак (7) перед насосом-повысителем давления (8). Насос-повыситель давления (8) нужен в случае, если требуется давление пермеата выше, чем 1,0–2,0 бар.
При работе системы как системы водоподготовки паровых и водогрейных котлов подготовленную воду необходимо направлять либо сразу в котел, либо в накопительный высокотемпературный бак (9), в котором поддерживается температура воды не менее 100 °С.
Одновременное обессоливание и дегазация воды на обратноосмотической установке позволяет значительно сократить потери тепла, связанные с продувкой котла, а также работой термического деаэратора. При этом значительно уменьшается коррозионная агрессивность возвращаемого конденсата, упрощается технология дегазации воды и, соответственно, количество и состав оборудования, а также значительно уменьшается стоимость всей системы водоподготовки. Система легко автоматизируется и не требует постоянного контроля.
Предложенная схема достаточно вариативна. Если требуется удалить из воды только кислород, то можно отказаться от использования установки умягчения перед обратным осмосом и исключить из схемы дозирование раствора едкого натра перед обратноосмотической установкой.
В заключение можно сказать, что дегазация обратным осмосом подпиточной воды паровых и водогрейных котлов вполне может быть применима для автоматизированных котельных без обслуживающего персонала тепловой мощностью до 200 МВт.
На данную технологию подготовки воды подана и зарегистрирована заявка на патент, регистрационный №2018138802 (дата регистрации — 05.11.2018).
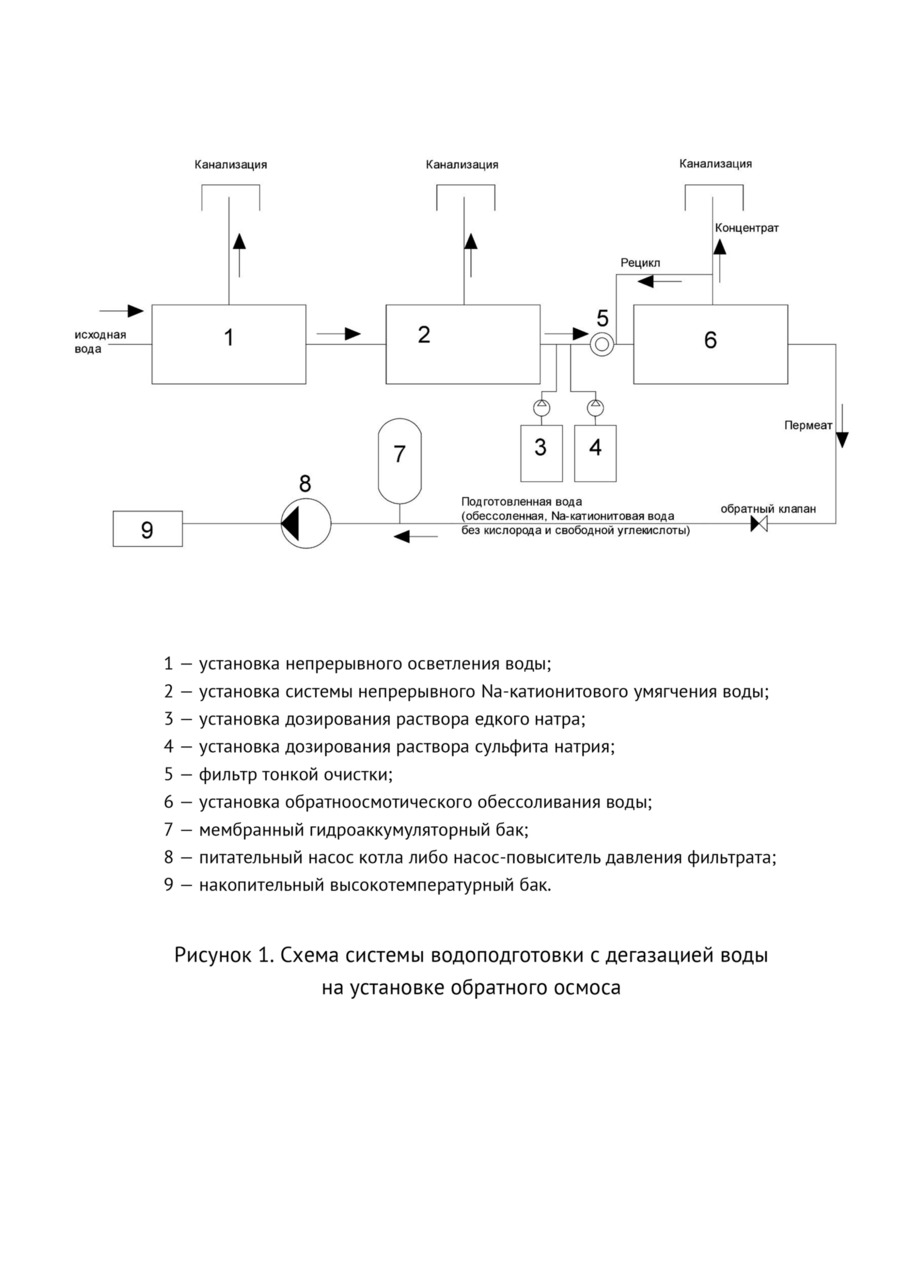
К вопросу о процессе шламо- и накипеобразования в паровом котле
В статье рассмотрены условия, при которых карбонат кальция выделяется из воды в виде шлама или накипи.
Работая много лет с водно-химическими режимами паровых котлов низкого и среднего давления, я заметил, что даже если питательная вода не соответствует всем требованиям заводов изготовителей котлов, это не всегда приводит к выходу котла из строя (повреждение нагревательных поверхностей котла коррозией или перегрев из-за отложений солей). Возможно ухудшение экономических показателей работы котла, увеличение продувки, более частая замена уровнемерных стекол, частая прочистка датчиков и т. д. Но котлы могут проработать при недостаточном качестве питательной воды по крайней мере не менее установленного срока службы. Такое часто случается на производствах, где в силу специфики выпускаемой продукции к котельной относятся недостаточно внимательно и не осуществляют надлежащей эксплуатации и лабораторного контроля. Тем не менее котлы на одних производствах прорабатывают свой срок службы и даже больше, а на других довольно быстро выходят из строя. При этом качество питательной воды и в том и в другом случае оставляет желать лучшего. Давайте попробуем разобраться и понять, в каких случаях и какие параметры имеют критическое значение для работы парового котла, а какие параметры даже при их превышении позволяют эксплуатировать оборудование.
Во-первых, следует отметить, что при разработке технологии водоподготовки для паровой котельной необходимо обеспечить соответствие всех параметров питательной воды парового котла в соответствии с требованиями завода-изготовителя. Тем не менее я часто сталкиваюсь с ситуацией, где имеется определенное недопонимание по поводу величины остаточной жесткости питательной воды.
Для котлов низкого и среднего давления величина жесткости питательной воды (в соответствии с требованиями заводов-изготовителей) должна быть не больше 0,02 мг-экв/л (0,01 ммоль/л). Необходимо учитывать, что в паровом котле происходит упаривание воды. Соответственно, если жесткость питательной воды 0,02 мг-экв/л, то в случае, когда коэффициент упаривания котловой воды равен 10, жесткость котловой воды будет равна 0,02*10=0,2 мг-экв/л. Данное значение жесткости достаточное для того, чтобы кальций образовывал твердые частички карбоната кальция, а магний образовывал частицы гидроксида магния при наличии в воде бикарбоната и при условии отгонки из воды углекислоты с паром.
Тем не менее при питании паровых котлов питательной водой с такой жесткостью в котлах не образуется накипь.
При упаривании из котловой воды удаляется углекислота вместе с паром и, соответственно, бикарбонат-ион переходит в карбонат, который в свою очередь гидролизируется с образованием гидрата. В результате в котловой воде увеличивается количество гидрата, что можно определить по фенолфталеиновой щелочности котловой воды. Максимальная щелочность котловой воды допускается до 26 мг-экв/л. Как правило, большая часть данной щелочности есть гидратная (ОН). Т.е. в котловой воде имеется большое количество гидрата. Если в такую воду подать питательную воду с повышенной жесткостью, то моментально начнется протекание следующих реакций:
Ca (HCO3) + NaOH → CaCO3 ↓+ Na HCO3 + H2O ⠀⠀ (1)
Mg (HCO3) 2 +2NaOH → Mg (OH) 2 ↓ +2NaHCO3⠀⠀ (2)
Как мы можем видеть, в реакции (1) гидрат натрия связывает водород бикарбоната в воду, при этом бикарбонат становится карбонатом и выпадает в осадок в виде карбоната кальция. Остающийся в котловой воде бикарбонат натрия после удаления углекислоты с паром вновь становится гидратом натрия.
Реакция (1) протекает достаточно быстро даже в воде при низкой температуре, не говоря уже о мгновенном протекании при температуре воды в котле.
Можно провести простой эксперимент. Набрать 1 литр водопроводной воды с жесткостью 4 мг-экв/л и щелочностью 2,5 мг-экв/л и добавить туда 0,5 грамм NaOH. При интенсивном перемешивании воды образование взвеси в воде начнется через несколько секунд. Через несколько минут вся карбонатная жесткость воды будет находиться в состоянии взвеси. При этом осаживаться данная взвесь будет довольно долго. В воде в растворенном виде останется только некарбонатная жесткость. Движущая сила процесса по реакции (1) тем больше, чем больше гидрата уже содержится в воде или добавляется к воде. При этом для образования взвеси карбонатной жесткости не требуются даже изначальные центры кристаллизации (наличие взвешенных веществ в воде и т.п.). Т.е. чем выше значение рН воды, тем быстрее из нее выделяются соли карбонатной жесткости. Этот процесс имеет простой физический смысл. Если воду насыщать углекислотой, то в такой воде будет происходить растворение карбоната кальция с образованием бикарбоната кальция, и, соответственно, если из воды отгонять углекислоту, то бикарбонат кальция будет обратно переходить в твердый карбонат кальция.
Можно сказать, что при наличии в котловой воде большого количества гидрата натрия поступающий с питательной водой бикарбонат кальция и магния переходит в шлам в котловой воде, а не на поверхностях нагрева котла.
В случае отсутствия в котле щелочной среды или недостаточного количества гидрата натрия соли карбонатной жесткости будут откладываться на поверхностях нагрева котла, в зоне наибольших температур и, соответственно, интенсивного отведения углекислоты с испаряющейся водой.
В моей практике встречались случаи работы жаротрубных паровых котлов (8 бар) при жесткости питательной воды более 3,5 мг-экв/л. При этом вся жесткость исходной воды была около 7 мг-экв/л. Происходило умягчение только половины жесткости питательной воды из-за поломки установки умягчения. В этом случае значение рН котловой воды падало с 12,3 до 11,5. Т.е. концентрация гидрата в котловой воде падала с 20 ммоль/л до 3,2 ммоль/л. При этом котловая вода выглядела как известняковое молоко и через 2 недели работы в таком режиме на одном из котлов забилось пробоотборное устройство. Фенолфталеиновая и метилоранжевая щелочности котловой воды, измеренные при работе котлов на полностью умягченной воде и при частичном умягчении воды, показывают принципиально разные значения. Если при нормативной работе щелочность по фенолфталеину была Ф= 18–22 ммоль/л, по метилоранжу М= 1,8–2,5 ммоль/л, то при работе с большей жесткостью Ф=10 ммоль/л, М=10 ммоль/л. Очевидно, что большая часть гидрата котловой воды, получаемая из бикарбоната натрия умягченной питательной воды, расходуется на процесс шламообразования по реакциям (1, 2).
При производстве анализа на щелочность по М постепенное уменьшение рН пробы котловой воды в процессе дозирования соляной кислоты растворяет шлам карбоната кальция по формуле:
CaCO3 +2HCl → CaCl2 + H2C03 ⠀⠀ (3)
Этот процесс увеличивает значение щелочности по метилоранжу, хотя в котловой воде количество растворенного карбоната натрия будет находиться на уровне не более 2 ммоль/л. Соответственно, 8 ммоль/л — это то количество карбоната, которое выпадает в виде шлама с кальцием и магнием.
Что же произошло с котлами?!
Котлы работали в таком режиме около 3 недель. После ремонта установки водоподготовки был произведен внутренний осмотр котла. И в результате осмотра было принято решение не проводить внеочередную химическую мойку котлов. Состояние поверхностей нагрева котла было вполне удовлетворительно. Фактически, кроме необходимости промывки пробоотборного устройства, серьезных проблем не возникло. Практически все соли жесткости удалялись из котла в виде шлама с непрерывной и периодической продувкой (количество которых было значительно увеличено). В данном случае количества гидрата в котловой воде хватило для предупреждения образования плотной накипи на поверхностях нагрева котлов.
Следует отметить, что для водотрубных котлов при таком активном шламообразовании, скорее всего, забьются конвективные и экранные трубы, что приведет к их перегреву и разрушению.
Еще один пример из практики. В паровой котельной с 2 жаротрубными котлами (11 бар) вышла из строя установка умягчения воды вследствие попадания в нее пара. Пар попал в пластиковые баллоны водоподготовки через теплообменник подогрева химочищенной воды перед деаэратором. Редукции пара не было и т.к. в теплообменник пар поступал даже при отсутствии расхода воды, теплообменник со временем был перегрет и пар с давлением 11 бар передавил химочищенную воду.
В результате установка умягчения полностью вышла из строя. Котел питался водой с жесткостью 2,0 мг-экв/л и щелочностью 1,0 ммоль/л (с учетом возврата конденсата). Щелочность котловой воды составила: Ф=0,2–0,5, М=7,5–8,5. Как можно видеть, в котле фактически отсутствовал гидрат, и незначительная щелочность по фенолфталеину была образована только за счет примерно 15–20 мг/л натрия, содержащегося в исходной воде источника водоснабжения.
В таких условиях я предположил, что котел не проработает и двух недель. Вода по продувочной линии шла довольно прозрачная. Практически все соли жесткости оседали на поверхностях нагрева в условиях отсутствия достаточного количества гидрата в котловой воде.
Тем не менее котлы проработали три месяца. За это время была заменена установка умягчения, несмотря на мои предупреждения сделать это как можно быстрее. Затем был произведен осмотр котлов. В результате обнаружилось почти полное забитие котлов солями жесткости. При этом внизу котла имелись твердые образования, по форме которых было видно, как они были образованы и с какой части жаровой трубы отвалились в процессе кипения воды. Не могу сказать сколько бы котел еще продержался, но ситуация была сверхкритическая. Котлы химически промывали около недели.
Эти два случая принципиально показывают развитие процессов образования твердой фазы солей карбонатной жесткости в котловой воде в зависимости от рН. Можно сделать вывод, что наличие в котловой воде гидрата принципиально меняет картину выделения солей жесткости.
Использование фосфатов для связывания солей жесткости котловой воды в гидроксилапатит довольно рискованно, особенно в случае недостаточного контроля за жесткостью питательной воды. Гидроксилапатит образуется только в присутствии в воде гидрата. При отсутствии гидрата, но при наличии солей жесткости они связываются в фосфорит. В отличие от гидроксилапатита, который является шламом и выводится с продувкой, фосфорит образует твердые отложения. В случае дозирования фосфатов в недостаточно умягченную воду перед деаэратором уже в деаэраторе возможны отложения фосфорита, которые можно будет удалить только трудоемким механическим способом.
Случай из моей практики. Установка водоподготовки паровой котельной должна была состоять из обратноосмотического обессоливания и второй ступени умягчения. В результате неправильной наладки осмос вышел из строя, и котельная около двух лет работала только на одной ступени умягчения. При этом жесткость исходной воды была 11 мг-экв/л. Жесткость питательной воды составляла в среднем 0,15 мг-экв/л после всего одной ступени умягчения. При этом наладочная организация настояла на дозировании фосфатов в воду перед деаэратором. После двух лет работы меня пригласили сделать аудит этой котельной. В результате я выяснил, что примерно 1 раз в квартал приходилось останавливать котельную из-за того, что переставала поступать вода из деаэратора. В деаэраторе образовывался фосфорит, который отдалбливали и удаляли вручную. При этом также питательные насосы после деаэратора выходили из строя. Требовался либо их ремонт, либо замена. Как шутку можно сказать, что на данной котельной использовалась новая перспективная технология водоподготовки на основе осаждения солей жесткости, где в качестве отстойника использовался деаэратор. Если исключить дозирование фосфата, то с жесткостью 0,15 мг-экв/л жаротрубный котел в данном случае вполне мог работать. Дело в том, что коэффициент упаривания котловой воды в данном случае был всего 4 из-за высокого солесодержания питательной воды и отсутствия возврата конденсата. В результате солей жесткости в котловой воде было бы всего 0,15*4=0,6 мг-экв/л. Это увеличило бы метилоранжевую щелочность котловой воды на 0,6 мг-экв/л, которая определялась бы только при низких значениях рН пробы. Это шлам, который выводится с продувками котла.
Необходимо отметить еще один момент. Известно, что нормируется только жесткость питательной воды. Предположим, что в паровой котельной существует большая доля возврата обессоленного конденсата, около 90%. В этом случае, как правило, устанавливают только одну ступень умягчения. В результате жесткость после одной ступени умягчения можно получить в среднем 0,1–0,07 мг-экв/л (при разумном расходе соли на регенерацию). После смешения умягченной воды и конденсата жесткость питательной воды получится около 0,01 мг-экв/л, что более чем соответствует требованиям. Но в данном случае солесодержание питательной воды определенно будет иметь довольно маленькое значение, и, соответственно, коэффициент упаривания котловой воды может иметь очень большие значения. В своей практике максимальный коэффициент упаривания, который я устанавливал, был 60. Дело в том, что при значении коэффициента от 55 котловая вода начинает значительно мутнеть, даже если питательная вода проходит осмос, а в конденсате практически не содержится железа. С точки зрения теории мне сложно объяснить этот момент, но практика показывает именно этот порог значения. Вероятно, вещества, находящиеся даже в незначительном количестве в питательной воде, после упаривания в 60 раз вызывают помутнение воды. Если питательную воду с жесткостью 0,01 мг-экв/л упарить в 60 раз, то жесткость котловой воды достигнет 0.01*60=0,6 мг-экв/л. Это значение равно значению жесткости котловой воды для случая питания котла водой с жесткостью 0,15 мг-экв/л и коэффициентом упаривания 4. При этом с точки зрения правил, в первом случае явное нарушение по солям жесткости в питательной воде, а во втором требования правил соблюдены.
Подводя промежуточный итог, необходимо сказать, что для котлов низкого и среднего давления важна не только величина жесткости питательной воды, но и щелочности, а точнее важно их соотношение в питательной воде. Щелочности должно быть в несколько раз больше остаточной жесткости.
Как правило, данное условие всегда соблюдается, т.к. в природных водах щелочность занимает от 50 до 80% от анионного состава воды. Но в случае использования осмоса для подготовки подпиточной воды щелочность, как и жесткость, будут удалены на мембране. При этом остаточная жесткость должна быть замещена на натрий на установке умягчения. Таким образом, жесткости в такой воде практически не будет, и даже небольшого количества щелочности хватит для образования достаточного количества гидрата в котловой воде. Но здесь есть опасность в случае возврата загрязненного конденсата. Даже небольшого количества солей карбонатной жесткости в конденсате будет достаточно для связывания гидрата в бикарбонат и выпадения в осадок. А в случае уменьшения рН котловой воды, даже небольшое, на первый взгляд, количество солей жесткости выпадет в осадок в виде накипи на теплопередающих поверхностях котла и значительно увеличит риск подшламовой коррозии и перерасход топочного газа из-за увеличения термического сопротивления теплопередающей поверхности.
В заключение необходимо упомянуть об отложениях в котле сульфатов и солей кремниевой кислоты. В котле возможно образование сульфата кальция. На практике в котлах, использующих поверхностные воды, как правило, сульфатных отложений не образуется. Сульфатные отложения будут образовываться, только если кальция больше, чем бикарбоната в питательной воде. Т.е. питательная вода практически не должна умягчаться, и концентрация кальция должна быть больше концентрации бикарбонатов. Что для поверхностных источников встречается крайне редко. Поэтому, как правило, сульфатные отложения образуются в котлах без водоподготовки, работающих на подземных водах, или если в воду неконтролируемо дозируется сульфат натрия для целей химической деаэрации.
Образование солей кремниевой кислоты в котле возможно в случае наличия в питательной воде солей жесткости и высокого коэффициента упаривания котловой воды. При этом если в котловой воде имеется гидрат, то будет образовываться не твердая накипь силиката магния, а рассыпчатый тальк. Считается, что для образования талька достаточно, чтобы в котловой воде гидрата было в полтора раза больше, чем солей кремниевой кислоты. Тем не менее силикатные накипи чрезвычайно сложно удаляются, и необходимо четко придерживаться требований завода-изготовителя котла по допустимым концентрациям кремния в питательной и котловой воде.
Выводы:
1. Величина рН котловой воды является важнейшим контролируемым параметром ВХР котельной. Для предотвращения осадкообразования для жаротрубных котлов значение рН котловой воды должно находиться в интервале от 11,5 до 12,3.
2. Использование различных реагентов для целей водоподготовки следует рассматривать только для корректирующего воздействия на ВХР котла и не подменять ими основных систем водоподготовки (осмос, умягчение и т.п.).
3. Для многих предприятий неэнергетического профиля, как правило, котельной отводится недостаточно внимания, и многие котельные работают даже без элементарного лабораторного контроля. В данном случае паровые котлы низкого давления, как правило, выходят из строя значительно раньше срока службы. Для осуществления элементарного контроля необходимо измерять рН и электропроводность котловой воды. Если на котле стоит автоматическая продувка, то электропроводность измеряется автоматически. В случае если рН котловой воды выше 11,5 и при этом котловая вода прозрачная, это принципиально говорит об отсутствии активных процессов шламообразования в котле. При этом если рН котловой воды от 8,5 до 9,5 и вода прозрачная, в большинстве случаев это говорит об активном накипеобразовании в котле и требует принятия экстренных мер. В любом случае необходим визуальный контроль котловой воды на прозрачность. Если в случае образования взвеси в котловой воде или падении значения рН котловой воды при сохранении значения электропроводности нет возможности вызвать специалистов, то для определения источника попадания солей жесткости в котел можно провести элементарный анализ. Добавить в пробу воды около 1 грамма каустической соды (если нет, то кальцинированной соды). При добавлении каустической соды к пробе воды с повышенной жесткостью при перемешивании будет происходить довольно интенсивное образование хлопьев. Чем выше жесткость воды, тем быстрее и больше образуется хлопьев, взвешенных в воде. При добавлении каустической соды будут образовываться хлопья из карбонатной жесткости. При добавлении соды все соли жесткости будут участвовать в хлопьеобразовании. Необходимо проверить подпиточную воду и конденсат. Причиной поступления солей жесткости будет являться либо плохая работа установки умягчения, либо некачественный конденсат. В любом случае, возможно, это поможет добиться эксплуатационным персоналом в дальнейшем привлечения специализированной организации для проведения качественной наладки ВХР котельной и организации автоматизированного контроля ВХР.
Расчет универсального индекса насыщения воды карбонатом кальция
В статье приводится методика расчета значения рН, которое соответствует насыщению воды по карбонату кальция, и проводится сравнение данного значения рН со значением рН, полученным по расчету индекса Ланжелье и индекса Стиффа и Девиса.
Коррозия и накипеобразование являются основными проблемами при эксплуатации оборудования и трубопроводов систем водоснабжения и водоподготовки. Выделение из воды твердой фазы карбоната кальция является серьезной проблемой, но при отсутствии условий для выделения карбоната кальция складываются условия для протекания коррозионных процессов, что в большинстве случаев является более серьезной проблемой, чем накипь, т.к. коррозия со временем потребует замены оборудования и трубопроводов.
В физическом смысле в воде протекают следующие процессы. Если вода склонна к выделению твердой фазы карбоната кальция, то это значит, что в воде достигается значение концентрации ионов кальция [Са2+] и карбоната [СО32-] выше значения произведения растворимости для карбоната кальция [ПРСаСО3]. Очевидно, что данные условия подразумевают отсутствие свободной углекислоты в воде. Если бы свободная углекислота присутствовала, то вода имела бы склонность к растворению твердого карбоната кальция, а не к его выделению. Соответственно, при условиях выделения из воды карбоната кальция в воде будет отсутствовать условие для протекания коррозии с водородным деполяризатором, т.к. вся растворенная углекислота обеспечивает равновесное состояние существования растворенного карбоната кальция. При этом возможна коррозия с кислородной деполяризацией, но выпадение карбоната кальция значительно тормозит процесс коррозии на анодном участке гальванопары, и, соответственно, вся скорость процесса коррозии значительно уменьшается.
Очевидно, что незначительная склонность воды к выделению твердого карбоната кальция для систем водоснабжения из стальных труб позволяет значительно уменьшить скорость коррозии. Но есть процессы, где даже незначительная склонность воды к выделению твердого карбоната кальция является крайне нежелательной. К примеру, обратноосмотическое обессоливание воды. В случае если в воде не содержится органики и вода безопасна по микробиологическим показателям (артезианская вода), то поддержание условий, при которых отсутствует возможность выпадения твердого карбоната кальция из воды, позволит вести процесс обратноосмотического обессоливания воды вообще без химических моек (по крайней мере для технических целей).
Необходимо задаться вопросом, может ли в воде существовать карбонат в виде иона, а не твердого карбоната кальция при условии, что количество ионов кальция в воде больше или эквивалентно равно количеству карбонат-иона. Наличие в воде карбонат-иона, вероятно, связано с гидратационными свойствами воды и с ионной силой ионного состава воды, т.е. ее солесодержанием. Давайте представим, что происходит с карбонатной системой воды. Если изначально воду, не содержащую каких-либо ионов насытить углекислым газом (СО2), то часть газа растворится в воде с образованием иона водорода (Н+) и бикарбоната (НСО3-).
СО2+Н2О = H++ НСО3- ⠀ (1)
Константа диссоциации уравнения (1) равна 4,45* 10—7.
Соответственно, можно рассчитать значение рН воды, если в ней содержится только углекислота.
рН = lg ((4,45*10—7*Ссо2) 1/2)
Ссо2 — концентрация углекислого газа, моль/л.
Пример:
В воде содержится 0,1 ммоль/л углекислоты или 4,4 мг/л.
Получаем:
рН = lg ((4,45*10—7*Ссо2) 1/2) =5,17
Или в пересчете на концентрацию иона водорода:
Н=1/105,17=0,00676 ммоль/л.
Соответственно, процент диссоциации углекислоты в воде составил:
(0,00676/0,1) *100=6,76%
Если в воде содержится 1,0 ммоль/л углекислоты или 44 мг/л, то получаем:
рН = 4,67;
Н = 0,02137 ммоль/л.
Процент диссоциации углекислоты на водород-ион и бикарбонат составил:
(0,02137/1) *100=2,13%
Как видно, при увеличении концентрации углекислоты в воде уменьшается процент ее диссоциации на ионы.
В результате насыщения воды углекислотой в воде образуются «лишние», не связанные в молекулу воды ионы водорода, и, соответственно, если в такую воду добавить твердый карбонат кальция, то начнется процесс растворения карбоната кальция с образованием ионов кальция и бикарбоната (уравнение 2).
СаСО3+2Н++2НСО3-=Са2++ (НСО3) 2- ⠀ (2)
Как видно, в процессе участвуют 2 моля углекислоты и один моль карбоната кальция. В результате «лишний» водород углекислоты связывается в бикарбонат и получает название полусвязанной углекислоты. Т.е. данный ион водорода не может участвовать в коррозии стали в качестве деполяризатора.
Процесс (2) является равновесным и может протекать в обе стороны при изменении концентрации входящих в уравнение (2) ионов. Так, при отгонке углекислоты (нагревание воды) процесс потечет в левую сторону и из воды будет выделяться твердый карбонат кальция.
Очевидно, что существование карбоната в воде возможно только в виде твердого вещества в составе карбоната кальция, если учесть, что изначально в такой воде растворяли только карбонат кальция. Тем не менее в такой воде наблюдается существование именно карбонат-иона, и его концентрацию можно определить при помощи произведения растворимости карбоната кальция. При этом концентрации получаются чрезвычайно низкие. Вероятно, можно предположить, что после растворения карбоната кальция в воде образуются ионы и, соответственно, увеличивается интенсивность электромагнитного поля, образованного ионами (ионная сила), что и позволяет существовать незначительному количеству карбоната в виде ионов при уменьшении концентрации углекислоты в воде ниже равновесной. При этом необходимо учитывать гидратирующие свойства воды. Именно уменьшением влияния гидратации воды (уменьшение вязкости воды) можно объяснить уменьшение значения ПРСаСО3 с увеличением температуры воды.
Если пренебречь активностью ионов кальция и карбоната, то исходя из ПРСаСО3=4,44*10—9 [1] при равенстве концентраций кальция и карбоната, в воде при 25 0С будет находиться только 4 мг/л карбоната.
Используя условие, что в воде существует карбонат-ион, можно рассчитать значение рН такой воды используя следующее уравнение:
рН=10,328+lg (CO3/НСО3) ⠀ (3)
где
10,328 — отрицательный логарифм константы диссоциации углекислоты по второй стадии;
СО3, НСО3 — концентрация карбоната и бикарбоната в моль/л.
Необходимо понимать, что требуется определить значение рН воды, когда она находится в состоянии углекислотного равновесия, т.е. насыщена по карбонату кальция, и дальнейшее увеличение концентрации карбоната кальция и (или) уменьшение концентрации углекислоты приведет к началу процесса образования твердой фазы карбоната кальция. И наоборот, уменьшение концентрации карбоната кальция и (или) увеличение концентрации углекислоты приведет к началу процесса коррозии с водородной деполяризацией.
Данное значение рН воды в определении индекса насыщения Ланжелье определяется как рНs. Если текущий рН воды меньше рНs, то, очевидно, в такой воде существует свободная углекислота и вода коррозионно-агрессивна. Если текущий рН воды больше рНs, то такая вода склонна к отложению твердого карбоната кальция, т. к. ПРСаСО3 при таком текущем рН больше, чем 4,4*10—9.
В результате весь вопрос сводится к определению рНs воды, при котором количество кальция и карбоната соответствует ПРСаСО3=4,4*10—9.
Для расчета рНs автор предлагает следующую методику:
1. Определяется концентрация карбонат-иона исходя из произведения растворимости карбоната кальция.
Произведение растворимости с учетом коэффициентов активности ионов определяется следующим образом:
ПРСаСО3 = Сса*fса*Ссо3*fсо3
где
Сса, Ссо3 — концентрации кальция и карбоната в моль/л;
fса, fсо3 — коэффициенты активности кальция и карбоната. Определяются по рисунку 1.
Учитывая, что кальций и карбонат двухвалентные ионы, допускаем, что fса = fсо3, соответственно:
ПРСаСО3 = Сса* Ссо3*f2
Тогда
Ссо3= ПРСаСО3/ (Сса* f2) ⠀ (4)
2. Затем рассчитывается рНs по уравнению (3) с учетом коэффициентов активностей.
рНs=10,328+lg ((Ссо3* fсо3) / (Снсо3*fнсо3)) ⠀ (5)
Снсо3 — концентрация бикарбоната в воде, моль/л;
fнсо3 — коэффициент активности бикарбоната. Определяется по рисунку 1.
Для проверки данной методики автором был произведен расчет рНs по данной методике и по расчету индекса Ланжелье с использованием программы R.O.S.A. 9.0, а также с использованием номограммы представленной в [2].
Результаты расчетов представлены в таблице 1.
Таблица 1 содержит следующие данные.
В 1-й строке представлен расчет значения рНs по трем методикам для следующего состава воды: Са — 1,25 ммоль/л; НСО3 — 2,5 ммоль/л. На основании этих значений рассчитано солесодержание (S), ионная сила (I) и определены коэффициенты активности для ионов по рисунку 1. В строке 2 в воду добавляется хлорид натрия (NaCl) — 10 ммоль/л. Соответственно, увеличиваются солесодержание, ионная сила и уменьшаются коэффициенты активности. В строке 3 в воду добавляют 500 ммоль/л (NaCl), и солесодержание воды становится 29,5 г/л. В этом случае значение рНs, рассчитанное по индексу Ланжелье, дает неверные значения и R.O.S.A. предлагает использовать индекс Стиффа и Девиса. Значение рНs, рассчитанное в соответствии с индексом Стиффа и Девиса, представлено в знаменателе в столбце «R.O.S.A. 9.0», и, соответственно, в числителе того же столбца представлены значения рНs, рассчитанные по индексу Ланжелье.
В строках 4, 5, 6 рассчитывается индекс насыщения для Са — 5 ммоль/л, НСО3 — 10 ммоль/л с добавлением хлорида натрия в тех же количествах, как в строках 2, 3.
В строках 7, 8, 9, 10 рассчитывается индекс насыщения для Са — 10 ммоль/л, НСО3 — 20 ммоль/л с добавление хлорида натрия. Только в строке 9 производится расчет с добавлением 100 ммоль/л NaCl.
Для каждой методики произведен расчет значения рНs для 3 температур воды: 15, 25, 35 0C.
Результаты расчета, представленные в таблице 1, охватывают довольно большой диапазон концентраций бикарбоната кальция и общего солесодержания.
В расчете значения рНs по уравнению (5) использовались следующие допущения:
1. Коэффициенты активности для кальция и карбоната принимаются одинаковыми. Также не учитывается влияние температуры на коэффициент активности ионов в связи с ее незначительным влиянием.
2. Данные для ПРcaco3 взяты из [1] для температур 25, 50, 150, 200 0С. Значения ПР для 15 0С и 35 0С получены автором самостоятельно, предполагая, что их зависимость соответствует зависимости растворимости карбоната кальция от температуры.
ПРСаСО3=5,6*10—9 при температуре 15 0С;
ПРСаСО3=4,4*10—9 при температуре 25 0С;
ПРСаСО3=3,2*10—9 при температуре 35 0С;
3. Расчет значения рНs при использовании номограммы (третий столбец) ограничен солесодержанием воды в 15 г/л и НСО3 не более 10 ммоль/л.
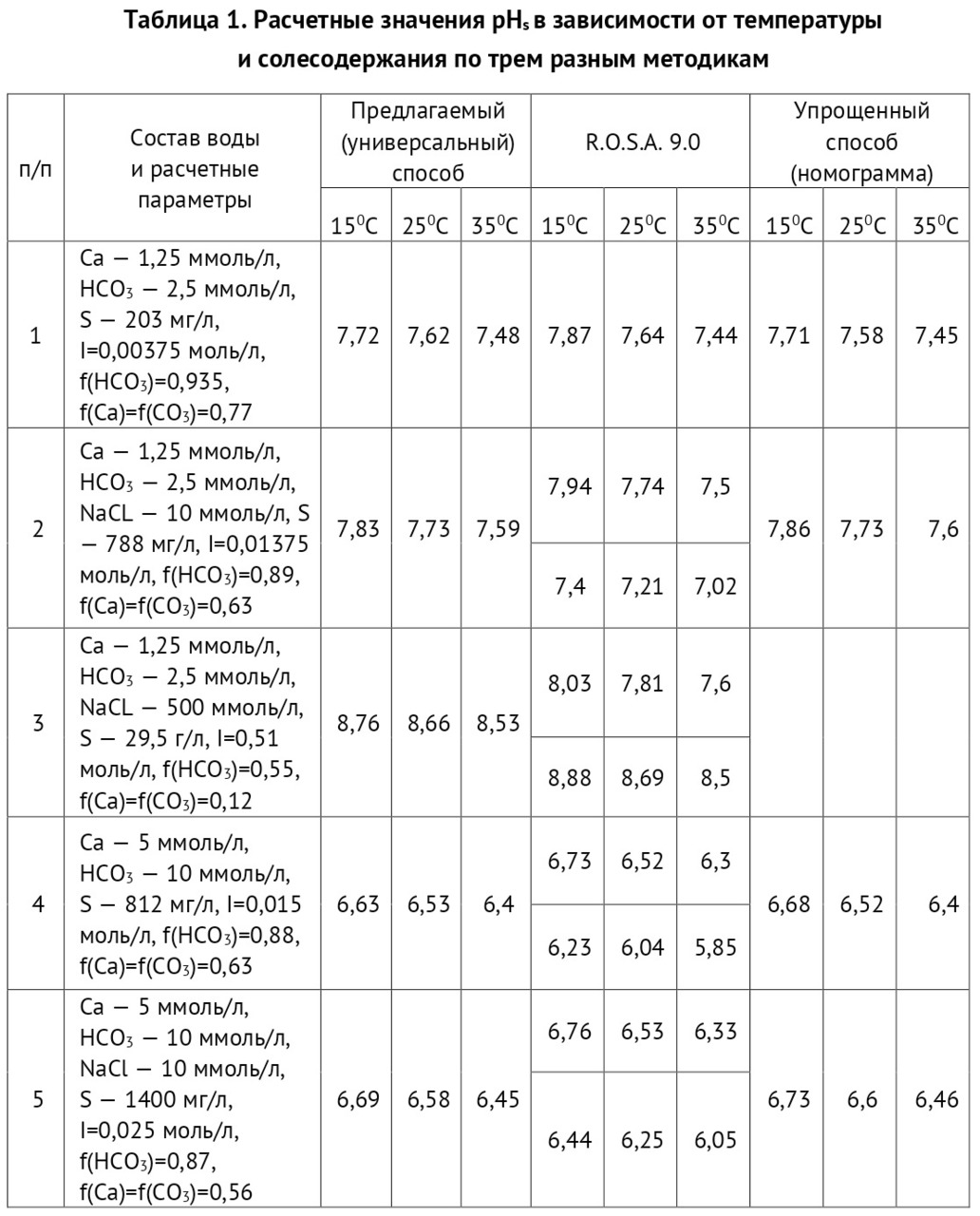
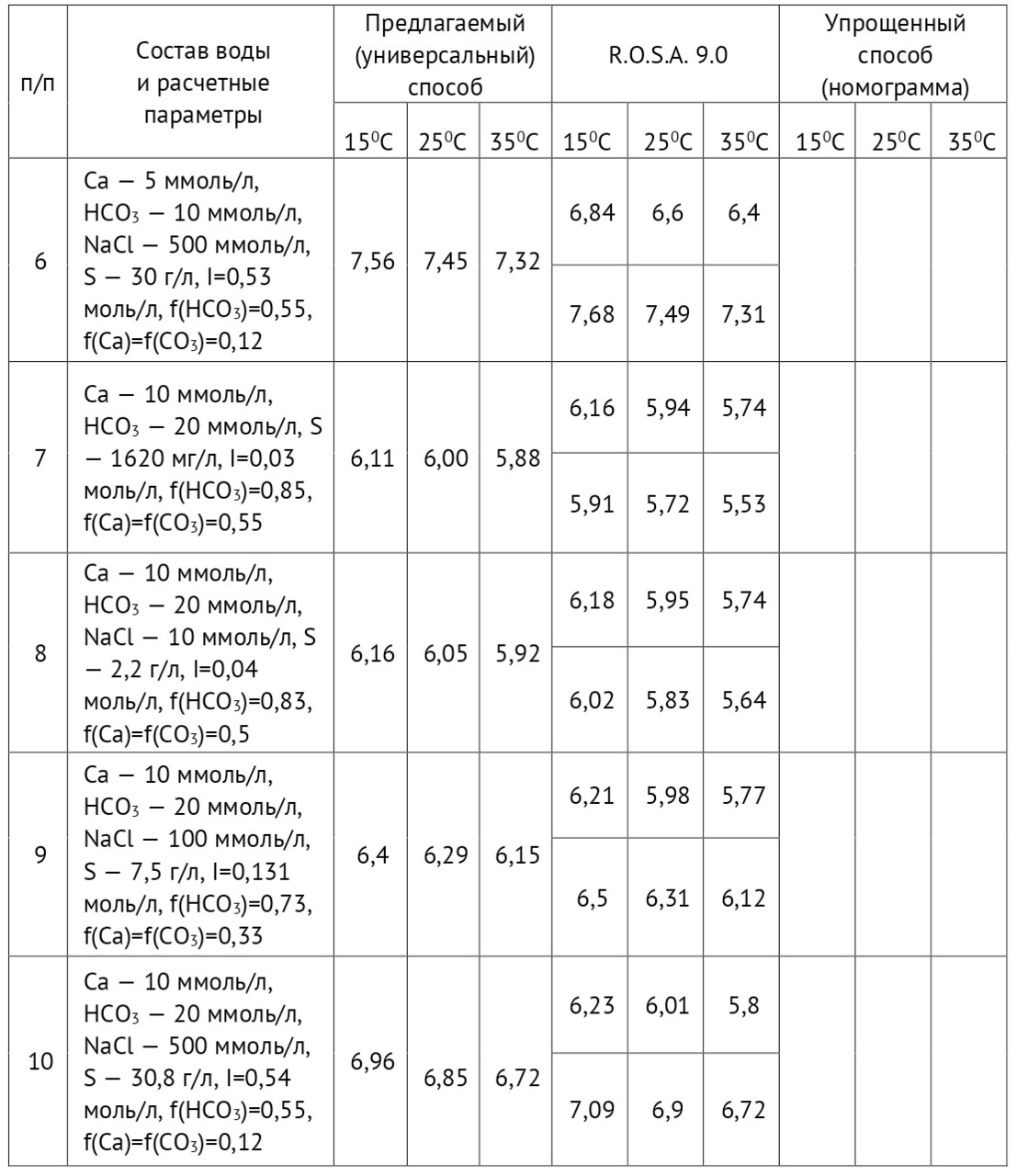
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.