
Бесплатный фрагмент - Прецизионная иммунотерапия рака и других злокачественных опухолей



Предисловие
В предисловии к данной книге мне хотелось бы поделиться с читателем своими мыслями на счет иммунотерапии рака. Уже более 40 лет я занимаюсь проблемами онкологии и не видел ни одного случая, когда онкологический больной смог бы излечиться от рака самостоятельно. Считается, что система врожденного иммунитета, сформированная у человека в процессе эволюции, является достаточно совершенной, полифункциональной и многоуровневой, и она способна адекватно и быстро защитить организм человека от воздействия вирусов, бактерий и образования опухолей. Однако, если в отношении бактерий и вирусов, в большинстве случаев, иммунная система находится «на высоте», то в борьбе с развитием опухоли иммунитет во многих случаях малоэффективен, хотя и остается самым перспективным противоопухолевым инструментом.
Несмотря на все научные прорывы в иммунобиологии рака и достижения современной онкологии, смертность от рака в мире неуклонно растет и достигает по разным данным от 10 до 14 млн. человек в год в разные периоды. Почему иммунная система человека, столь совершенная в обезвреживании инфекционных агентов, при опухолях «дает сбой» и становится уязвимой? Это вечная дилемма мировой онкологии: способен ли организм онкологического больного сам излечиться от рака мобилизацией собственных ресурсов иммунитета или нет? С одной стороны, оставить больного один на один с раком в надежде на то, что его собственная иммунная система справится с болезнью сама, представляется кощунственным и бесчеловечным. Больной обязательно погибнет, и этот исход предрешен. С другой стороны, современные методы онкохирургии, химиотерапии и радиотерапии в большинстве случаев не позволяют полностью излечить больного от злокачественного новообразования, а лишь приводят организм к уровню минимальной остаточной болезни. Далее, все надежды опираются на совершенный и уникальный защитный механизм, сформированный врожденным и адаптивным иммунитетом человека. Этот механизм, как правило, блестяще справляется с функцией элиминации трансформированных и опухолевых клеток до болезни. Однако, единожды «пропустив» развитие опухоли, иммунитет больного в большинстве случаев не способен «догнать» и «блокировать» этот процесс, несмотря на нормальные показатели иммунного статуса, и на активную инфильтрацию опухолевой ткани иммунокомпетентными клетками. Мы неоднократно обращали внимание на такой парадоксальный научный факт, что у больного с огромной опухолью показатели иммунного статуса могут быть идеальными. Этот факт указывает на то, что иммунная система не видит угрозы со стороны опухоли, что и становится основной причиной её роста и метастазирования.
Сегодня показано, что системные механизмы канцерогенеза блокируют противоопухолевые механизмы иммунных клеток больного, проявляясь в частных молекулярно-биологических механизмах уклонения опухоли от иммунного надзора. Поэтому классические механизмы и модели современной иммунологии, полученные при лечении целого ряда инфекционных и вирусных заболеваний, при раке абсолютно не работают. Этот факт объясняется, прежде всего, тем, что к подавляющему большинству опухоль-ассоциированных антигенов существует врожденная иммунная толерантность. Соответственно, иммунологии рака, в том виде, как она традиционно понимается с позиций классической инфекционной иммунологии, не существует вовсе. В ней нет первичного иммунного ответа на патологические онкоантигены, нет вторичного иммунного ответа, нет накопления эффекторов (антител, клеток натуральных киллеров, цитотоксических Т-лимфоцитов, макрофагов и т.д.), которые ведут к элиминации патогена (в нашем случае раковых клеток) и выздоровлению организма. Тогда почему же мы так много говорим об иммунологии злокачественных опухолей? Почему мы не можем до сих пор активировать иммунный ресурс организма на борьбу с раковыми заболеваниями? По-видимому, в этом реализуется давняя мечта онкологов найти специфический подход к удалению злокачественных клеток из организма ракового пациента. Несмотря на то, что позади большой полувековой путь изучения Т-клеточного иммунитета в терапии опухолей, существенного прогресса в лечении рака этими технологиями достигнуто так и не было. Несомненно, современные исследования, направленные на снятие иммунной толерантности посредством выключения PD1/PD-L1,2 механизма и других иммуносупрессорных механизмов, а также прямые воздействия на опухолевые клетки, с использованием целой батареи моноклональных антител, дали определенные позитивные результаты и привели к появлению целого класса онкоиммунологических и противоопухолевых молекулярно-нацеленных (таргетных) препаратов. Но эффективность этих инновационных онкоиммунных и таргетных препаратов ограничена, так как опухолевые клетки достаточно быстро к ним приспосабливаются и через 3—6 месяцев успешно нарабатывают механизмы защиты от них. Тем не менее, основные достижения клинической онкоиммунологии проявились в формировании «иммунологического окна возможностей» в лечении рака (J-.F.Rossi, 2017), и они позволяют сформировать новые системные подходы к иммунотерапии рака. Иммунобиология рака во многом противоречит базовым канонам инфекционной иммунологии. Это абсолютно самостоятельная наука, которая требует принципиально нового научно-методологического подхода и нового инструментария. Здесь нет абсолютной специфичности, присущей адаптивным иммунным реакциям. Здесь включаются свои механизмы врожденного иммунитета. «Безумная» активация иммунной системы, приводящая к потере ориентации «свое-чужое», малоперспективна в онкологии. Нужно искать другие подходы, новые альтернативные решения. То, что в инфекционной иммунологии решается за счет генетических программ, заложенных в геном клетки эукариот, для рака не предусмотрено природой. В организме человека и млекопитающих не заложено жесткого системного программного обеспечения организации противоопухолевой иммунной защиты. Подобную многоуровневую защиту можно попытаться создать искусственно, опираясь на фундаментальные закономерности функционирования иммунной системы. И подобная попытка предпринята в этой монографии, где мы уделяем большее внимание гуморальному иммунитету и, особенно врожденному его компоненту. В действительности, врожденные пентамерные IgM антитела к опухоль-ассоциированным гликанам способны индуцировать гибель раковых клеток особым механизмом апоптоза — липоптозом. Этот инструмент надо научиться правильно использовать, не только в иммунотерапии рака, но и для профилактики его развития.
Выход на рынок огромного количества онкологических иммунных препаратов на основе современных моноклональных антител доказал, что применение иммунотерапии в лечении рака научно обоснованно и оправдано. Но сегодня, на рынке современных противоопухолевых таргетных и онкоиммунных препаратов, цена таргетных противоопухолевых онкоииммунных препаратов начинается от нескольких десятков тысяч долларов США на курс лечения и заканчивается в суммах эквивалентных почти миллиону долларов США. Большинство этих препаратов разрешено Минздравом России к клиническому применению в России, но пока широкого применения эти препараты не нашли из-за их высокой стоимости и ограниченной эффективности. Поэтому поиск альтернативы с использованием клеточных подходов приветствуются в онкологии. Есть обоснованная надежда, что основной научный прорыв в современной онкологии будет совершен именно в области клеточной онкоиммунологии.
Я хочу пожелать авторам этой книги продолжить столь интересные научные изыскания в области онкоиммунологии и иммунотерапии рака, а также создании новых отечественных противоопухолевых клеточных препаратов и биомедицинских клеточных продуктов. Я убежден в эффективности и безопасности специфических иммунологических подходов к терапии рака и желаю читателям отказаться от догм и канонизированных представлений об иммунотерапии рака. Поиск новаторских путей диагностики и терапии рака, несомненно, пролегает через онкоиммунологию (иммунодиагностику, процессы иммунологического стадирования и иммунологической оценки эффективности болезни и т.д.) и иммунотерапия должна стать совершенным инструментарием онколога в лечении этого тяжелого недуга.
Главный онколог Министерства здравоохранения Российской Федерации Директор ФГБУ «Национальный медицинский исследовательский научный центр онкологии им. Н. Н. Блохина» Минздрава России
Введение
В настоящее время об иммунотерапии рака и других злокачественных новообразований написано достаточно много научных статей, авторских и коллективных монографий и научно-популярной литературы ведущими специалистами в области онкологии и иммунологии, как в нашей стране, так и за рубежом. Поэтому автор очередной научной монографии на эту тему, особенно идущей в разрез традиционным представлениям об иммунотерапии рака, во многом рискует, так как он должен понимать, что подвергнется массивной критике, как со стороны консервативных онкологов, так и со стороны классических иммунологов. И эта критика будет очень жесткой и малоприятной. Это связано с тем, что информация об иммунотерапии рака нарастает лавинообразно, и при этом, она не очень системная и недостаточно структурированная.
На запрос «cancer immunotherapy» Google выдает 8 080 000 результатов. Соответственно, профессионалов в этой области достаточно много и они обладают большим объемом знаний и технологий. Предполагаем, что каждый из этих специалистов из числа онкологов, онкоиммунологов и «чистых» иммунологов, убежден, что иммунотерапии рака и других злокачественных новообразований (ЗНО) — самая «изученная территория» в современной онкологии и иммунологии, и любая высказанная новая гипотеза или концепция, не совпадающая с общепризнанными подходами и стратегиями, будет обозначена как научный нигилизм или научная ересь.
Особенно наглядно это демонстрируется, когда решает высказаться не классический онколог, а организатор медицины и по совместительству профессор в области биомедицинских приборов и технологий. Но я подумал: «А почему бы и нет?» Ведь я — не новичок в области онкологической науки, автор ряда рецензированных монографий по онкологии и онкопротеомике, большого количества глав в зарубежных руководствах по онкологии, автор более 130 статей в российских онкологических журналах и в зарубежных высокорейтинговых научных онкологических журналах. Если я и раньше не боялся насмешек и нападок по этому поводу, то сейчас, тем более не стоит думать о том, «кто и что скажет и, тем более, подумает». Поэтому было принято решение, что пришло время и надо высказать свою альтернативную точку зрения на иммунотерапию рака, тем более, что она не очень-то совпадает с взглядами основных корифеев современной онкологии и онкоиммунологии. От чего она становится еще более интересной и неожиданной.
Иногда пристальный взгляд опытного клинициста и организатора здравоохранения и ученого, не отягощенного специальными онкологическими знаниями в профессии, являются как бы взглядом со стороны. Возможно, этот взгляд, может увидеть и подметить больше, чем споры и дискуссии блестящих ученых и профессионалов онкологов и онкоиммунологов, «погруженных в свою проблему с головой» и «растворившихся» в ней полностью. В большинстве случаев, «замыленный» взгляд профессионала, не видит очевидного и банального. То есть того, что, как правило, лежит на самой поверхности. Помните русскую пословицу — «в чужом глазу соринку видит, а в своем — бревна не замечает»? И это не от того, что кто-то умнее или глупее: дело лишь в том, что очевидное и естественное не всегда является предметом пристального анализа для ученого, занимающегося фундаментальной или прикладной наукой, и это очевидное, настолько «на виду», что на него не обращают серьезного внимания большие ученые и профессионалы. Любой ученый-онколог и (или) онкоиммунолог «копает» так глубоко и фундаментально, что фокус его интересов находится, как правило, на молекулярно-биологическом уровне онкогенеза, на путях внутриклеточной сигнальной трансдукции опухолевой клетки. Он, преимущественно, направлен на изучение целей и мишеней терапии при исследовании экспрессии генов опухолевой клетки и поиске генетических поломок при раке и ЗНО и т. д. Считается, что все в онкологии, так и онкоиммунологии, уже детально очерчено и хорошо изучено. Все уже было ранее описано, нашими великими предшественниками-онкологами и иммунологами, а ответ на все нерешенные вопросы современной онкологии будет найден именно на уровне молекулярно-биологических характеристик болезни или даже ниже, на уровне атомов и элементарных частиц, что сегодня обеспечивается современными возможностями нанотехнологий, клеточных, геномных и постгеномных технологий.
И это абсолютно верно и научно обоснованно. Все основные фундаментальные знания, в онкологии и иммунологии, были накоплены еще в конце прошлого и позапрошлого века, однако, современные онкоиммунологические подходы очень серьезно отличаются от существовавших подходов еще 30-40-летней давности. Поэтому, мы попытались доказать в своей книге, что современная иммунотерапия рака и злокачественных опухолей, в том виде, в каком она сегодня существует, теоретически сильно устарела и научно-методологически нуждается в ревизии с учетом системных позиций и новых научных фактов современной биологии рака, так как основной точкой своего приложения она видит исключительно собственную иммунную систему пациента.
Мы полагаем, что стимуляция и активация клеток собственной иммунной системы ракового больного, как фактор терапии и выздоровления от рака — одно из величайших научных заблуждений мировой онкологии и современной онкоиммунологии. Онкологи и онкоиммунологи смотрят на проблему иммунотерапии рака так же, как они смотрят на иммунотерапию инфекционных и вирусных заболеваний, где иммунология доказала свою эффективность и научную состоятельность. Принцип аналогий не является научным способом доказательства в науке вообще, и в медицине в частности, но аналогии способны наглядно и убедительно показать системную ошибку во взглядах и заблуждениях специалистов. В нашем случае, мы говорим об общей системной и методологической ошибке онкологов и онкоиммунологов в решении проблемы иммунотерапии рака и других ЗНО. Одна из таких аналогий, позволяющая объяснить неэффективность современной иммунотерапии рака и других злокачественных опухолей в клинике, заключается в сравнении современных стратегий иммунотерапии рака с запусками баллистических ракет типа «земля-воздух» для уничтожения вражеских летательных объектов. Ракеты данного класса были созданы для уничтожения определенных летательных аппаратов вероятного противника. Мы обнаруживаем цель, совершаем ракетные стрельбы и залпами выпускаем огромное количество ракет, но к нашему удивлению видим, что наши ракеты не попадают в цель. Мы утверждаем, что выявленные нами цели, успешно «уклоняются» от наших ракет и даже понимаем, как им это удается сделать. Однако мы не пытаемся решить проблему попадания в цель путем применения ракет нового поколения с усовершенствованными системами целенаведения и навигации, не пытаемся создать более высокоточное оружие, а решаем проблему путем наращивания количества ракет старого образца и увеличением мощности их заряда. То есть, мы исходно не учитываем, что у этих ракет остается неэффективная система навигации и целенаведения и они технически и практически не способны выполнить поставленную перед ними задачу. Аналогичная ситуация с иммунотерапией рака. Если опухолевые клетки способны уклониться от собственных киллерных клеток иммунной системы онкологического больного, используя системные и (или) частные молекулярно-биологические механизмы выживания в организме ракового больного, то увеличение количества этих клеток и активация их функций будут малоэффективны и научно не обоснованы.
Читая статьи ведущих онкологов и онкоиммунологов об иммунотерапии рака, мы ловим себя на мысли о том, что современная иммунотерапия подходит к лечению рака абсолютно стандартно, как и к любой другой иммунологической болезни, а противоопухолевые препараты создаются так же, как для лечения от инфекционных агентов и вирусных заболеваний. Очевидно, что в иммунотерапии рака нельзя создать уникальную «волшебную пулю» в виде инновационного онкоиммунного препарата или эксклюзивную противоопухолевую вакцину, способную излечить от рака всех онкобольных. Это еще одна методологическая ошибка современных онкологов и иммунологов. Примером этому служит системность и многовекторность иммунного ответа организма, сформированного и запрограммированного в организме человека при инфекционных заболеваниях. При раке и ЗНО такого запрограммированного ответа в геноме человека не существует. Именно поэтому, у тех млекопитающих, у которых такие генетические программы существуют, канцерогенезу противостоит системное противоопухолевое реагирование клеток микроокружения или генерализованный иммунный противоопухолевый ответ, проявляющийся системной экспрессией противоопухолевых молекул генома клеток этих животных. Ученые выяснили, что у слонов в геноме клеток имеются по 20 копий подавляющего опухоли гена TP53, который не позволяет осуществляться процессу повреждение ДНК, вызывающего рак. Дополнительные копии увеличивают чувствительность к процессу повреждения ДНК, который заставляет клетки быстро совершать суицид при повреждении или опухолевой трансформации. https://www.nature.com/news/how-elephants-avoid-cancer-1.18534), а вот у шимпанзе этот механизм пока не понятен, так как имеется более 1500 отличий ДНК их генома от человеческого. Например, у таких грызунов как голые землекопы формирование определенного пласта ОК приводит к тому, что соседние с ОК здоровые клетки микроокружения начинают секретировать бета-интерферон, который элиминирует все ОК. Именно отсутствие системообразующей генетической программы противоопухолевой защиты от онкоантигенов в клетках и есть основная причина рака и ключ к самозащите от рака у живых существ. Michael Zimmerman и его коллега Rosalie David обследовали сотни мумий в безуспешных попытках найти следы злокачественных опухолей у древних людей (David AR, Zimmerman MR., 2010). В течение 10-ти лет, они методично изучали сотни мумий древнего Египта и Южной Америки возрастом около 3 тысяч лет и не нашли у них явных признаков опухолей. Лишь у одной египетской мумии, вроде бы, обнаружился рак толстой кишки, хотя это могла быть доброкачественная опухоль. В литературных источниках, включая древнейшие письменные свидетельства, нет намеков на заболевание, которое спустя тысячелетия, стало чуть ли не самой массовой причиной смертности населения на Земле. Мы вернемся еще к обсуждению этих фактов, по ходу изложения материала, но очевидно, что рак и ЗНО являются болезнями современной цивилизации, связанными с изменением экологии и отрицательным воздействием человека на окружающую среду.
Современные онкологи ставят именно эти причины во главу угла этой проблемы роста злокачественных опухолей. Однако создается впечатление о том, что современные иммунологи и онкологи думают «штампами» и «клише», существующими в иммунологии со времен Луи Пастера. А это, в отношении рака, ошибочно и не верно. Рак требует особого подхода и нового понимания и переосмысления методологии проводимой иммунотерапии. Мы предполагаем, что именно это и есть основная системная ошибка, не обеспечивающая эффективность иммунотерапии рака. Мы попытаемся в этой книге объяснить, почему до настоящего времени иммунотерапия рака, абсолютно обоснованно, считается большинством маститых онкологов экспериментальным лечением и не относится к конвенциональным методам лечения онкологических заболеваний, хотя существует более 70 лет, а также, почему иммунологи не могут на уровне доказательной медицины обосновать необходимость и обязательность иммунотерапии в комплексном лечении рака.
Обобщая вышесказанное, можно сделать вывод о том, что иммунная система онкологического больного «не видит» и «не слышит» клеток опухоли и не важны причины этой молекулярно-биологической «глухоты» и «слепоты» клеток надзорного аппарата иммунитета. В каждом случае они могут быть разными. Стимуляция и активация отсутствующей функции иммунокомпетентных клеток и основных существующих звеньев иммунитета у онкологического больного не способны преодолеть порог «невосприимчивости» иммунной системой опухолевой клетки (ОК), как патологической, так и трансформированной клетке. Нужны принципиально новые не линейные, не традиционные, а правильнее — ассиметричные подходы к разработке и созданию технологий иммунотерапии рака. Профессор Jean-Fracois Rossi из Университета Монпелье (Франция) говорит о необходимости создания «прецизионной (высокоточной, точно-ориентированной) иммунотерапии рака» и иммунологическом «окне возможностей» в его лечении (J.-F. Rossi, 2017). Методология этого французского ученого нам очень понятна, она является продвинутым и современным методологическим подходом к лечению рака. Но о какой высокой точности иммунотерапии можно говорить, когда «сбит прицел» у используемого оружия, и опухолевые клетки способны ускользать от киллерных иммунных клеток. J.-F.Rossi видит решение в создание генетически модифицированных клеток и это, отчасти, правильно, с методологических и теоретических позиций, но далеко не совершенно с позиций клиники и биоэтики. Эти технологии еще долго будут вызывать сомнения в их целесообразности, даже при доказанной эффективности. Последствия применения генетических подходов еще непредсказуемы для будущих поколений и могут быть как чудесными, так и ужасающими.
Нужна новая парадигма лечения рака с использованием новой философии иммунотерапии и переосмысления известных научных фактов биологии рака. Подобной парадигмой иммунотерапии рака может стать ремоделирование собственной новой противоопухолевой функции у онкологического больного искусственным путем. Ведь обратите внимание, при раке и ЗНО страдает только противоопухолевый компонент иммунитета, а противогрибковая, противовирусная, противобактериальная и другие функции и составляющие иммунитета практически не страдают. Решением проблемы может стать искусственне создание временной копии эффективной противоопухолевой защиты с использованием лекарственных препаратов, неманипулированных аллогенных и (или) транскриптом-модифицированных (генно-модифицированных) аутологичных клеточных систем человека. То есть, мы предположили, что не нужно заменять все функции иммунной системы у онкологического больного (как например, путем трансплантации совместимых гемопоэтических клеток костного мозга), а необходимо создать временные рабочие иммунологические копии иммунных клеток, способных выполнять противоопухолевые функции, в виде локальных кластеров онкоиммунитета, способных каскадно (на разных уровнях) осуществлять эффективный надзор и контроль над ОК и ограничивать их количество в организме пациента. В вычислительной технике создание резервных копий называется эмулированием функции, поэтому мы говорим, что эта стратегия ремоделирования противоопухолевой функции у онкологических пациентов может называться стратегией эмулирования противоопухолевой функции.
Сегодня общепризнанно у онкологов, что рак это заболевание ядра тканеспецифической стволовой клетки (СК) (Заридзе Д. Г.,2004). Канцерогенез формирует из здоровой тканеспецифичной СК мутантную и патологическую ОСК. Это было убедительно продемонстрировано в работах ведущих американских ученых еще в 2001 году (Reya T, Morrison S.J.,Clark M.F., Weissman I. L.,2001) в статье «Stem cells, cancer and cancer stem cells», опубликованной в журнале Nature в №414. Рак — это уникальный способ выживания и существования в организме пациента ОСК и её потомков, всесторонне обеспеченный клетками всего организма (Давыдов М. И.,2010). Раковые клетки — паразиты, которые выживут даже в самых неблагоприятных условиях микроокружения и внешней среды, и при благоприятных условиях они всегда дадут потомство и, соответственно, манифестируют рецидивом остаточной болезни (А.С.Брюховецкий, 2014).
В этой монографии мы хотели бы поделиться с учеными и практическими врачами своими теоретическими гипотезами и многолетним опытом наблюдения специализированного противоопухолевого лечения и иммунотерапии крайне тяжелого контингента онкологических больных, которым в конвенциональном лечении было отказано. По крайней мере, нам есть, что сказать, и мы уверены, что читатель сам сможет решить, правы мы или нет. И судить нас будут наши читатели (коллеги, пациенты, ученые, студенты и т.д.) по сложившемуся у них впечатлению от прочитанного материала в этой книге, и время, которое «всегда и всё расставляет на свои места».
Наши научные представления об иммунотерапии рака и других опухолей менялись постепенно под воздействием объективных обстоятельств, с появлением новых научных фактов о биологии рака и увеличением длительности работы в стенах специализированных онкологических медицинских учреждений, где мы трудимся до настоящего времени. Вот уже более 17 лет автор этой книги возглавляет частную онкологическую клинику, территориально расположенную на базе Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина Министерства Здравоохранения России (ФГБУ НМИЦО им. Н. Н. Блохина Минздрава России). Так, в споре и дискуссиях с онкологами ФГБУ НМИЦ онкологии им. Н. Н. Блохина и онкологами собственной клиники, рождались наши общие воззрения на эти различные онкологические болезни и формировались научные взгляды. На самом деле, когда твое основное рабочее место расположено на территории самого крупного в стране национального ракового центра, то ты поневоле контактируешь с ведущими специалистами-онкологами страны и прислушиваешься к их мнению и разным точкам зрения на частные и узловые проблемы онкологии. При организации частной онкологической клиники планировалось заниматься только нейроонкологическими пациентами, поскольку основной вектор исследований и практической работы стационара был неврологический и нейрохирургический, но поневоле, из-за территориального положения мы столкнулись «лицом к лицу» со всей современной онкологией, законодателями правил отечественной онкологии страны и крайне тяжелыми раковыми больными. Надо признать, что наш Национальный центр онкологии это одна из самых сильных медицинских научных школ в России. Опыт 17-ти летнего взаимодействия с основными подразделениями онкологической службы и ведущей профессурой этого учреждения и конечно, Главным онкологом Минздрава России академиком РАН профессором М. И. Давыдовым и его заместителями (академиком РАН Личиницером М. Р., академиком РАН Алиевым М. Д.), заместителями директоров институтов академиком РАН Поляковым В. Г. и профессором Менткевичем Г. Л. научил нас очень многому. Моя военная «научная спесь» профессора, доктора медицинских наук, главного специалиста Военно-морского флота России и полковника медицинской службы очень быстро слетела при постоянной работе и контакте с этим элитарным контингентом ученых и врачей. Работа со специалистами ФГБУ НМИЦО им. Н. Н. Блохина Минздрава России научила быть крайне осторожным в диагностике рака и выборе тактики лечения. Стала быстро понятна существующая в онкологии пословица о том, что «рак — это обезьяна всех болезней» и то, что существует тысячи масок, под которыми он манифестирует в клинике. Но то, как работают многие специалисты этого научного заведения, заставляло испытывать определенный пиетет к этим высоким профессионалам. Это действительно элита отечественной медицины, и нельзя не признавать этого.
Вся мировая и отечественная онкология представляет собой очень стройную систему стандартов и клинических протоколов, опирающуюся на международные рандомизированные исследования, жесткие критерии выживаемости и установки об оценке эффективности. С одной стороны, быть может, именно жесточайший консерватизм самой онкологической науки, её канонизированность, догматичность и конкретное рамочное мышление ведущих ученых-онкологов и клиницистов мешает им думать свободно и нетривиально. С другой стороны, именно эти особенности клинического мышления врачей-онкологов позволяют добиваться системного и программного выполнения существующих протоколов и нередко получать требуемый результат. А хорошая научная школа, учебная и диагностическая база российских онкологов позволяют рассматривать отечественную онкологию как одну из самых конкурентоспособных научных медицинских дисциплин на рынке мировых медицинских услуг. При этом существующий миф о том, что в России медицинское оборудование в онкологических центрах и онкологических больницах уступает зарубежным раковым центрам, абсолютно не имеет под собой никакой основы и является скорее информационным «вбросом» недоброжелателей. Так было, может, лет 10—15 назад. Сегодня по оснащению современным специализированным медицинским оборудованием ФГБУ НМИЦО им. Н. Н. Блохина Минздрава России не уступает лучшим мировым раковым клиникам и научным онкологическим центрам, а по ряду параметров даже опережает многие из них.
Однако у каждого человека первые впечатления от работы с контингентом раковым больных всегда специфичны, и для нас они были крайне удручающими и депрессивными. Быть может, это было связано с тем, что основной контингент пациентов, которые госпитализировались в частную онкологическую клинику, представлял собой преимущественно крайне тяжелых хосписных раковых больных, которым уже были выполнены почти все стандартные конвенциональные противоопухолевые методы лечения и дни их жизни были сочтены. Мы полагали, что, возможно, все перспективные и «сохранные» онкологические больные находились «под курацией» у специалистов-онкологов ФГБУ НМИЦ онкологии им. Н. Н. Блохина, и до нас просто не доходили. Этот вывод был сделан, исходя из факта мировой статистики лечения онкологических больных, согласно которому более 20% больных полностью излечиваются от онкологического заболевания. По статистике, пятилетняя выживаемость онкологических больных составляет во Франции 57,9%, в США — 62% среди мужчин и 63,5% среди женщин. В России она не достигает и 43%. Это самый низкий показатель в Европе, что, в частности, связывают с запоздалой диагностикой и лечением устаревшими препаратами. Однако в настоящее время это не так. Сегодня все самые передовые технологии в онкологии есть в ФГБУ НМИЦ онкологии им. Н. Н. Блохина Минздрава России, и, возможно, это статистика регионов, а не головных национальных специализированных исследовательских центров страны.
Таким образом, основным контингентом онкологических пациентов, на основе которых была написана эта книга, были пациенты частного онкологического стационара, и это были крайне тяжелые онкологические больные, входящие в те самые оставшиеся 57% онкобольных, у которых лечение было малоэффективно. В нашей онкологической клинике средняя продолжительность общения с онкологическим пациентом составила 1—2 года. Это очень тяжело. Несомненно, при возможности мы широко применяли хирургические циторедуктивные операции, наши больные получали очередные линии химиотерапии и многомесячные сеансы лучевой терапии, но большого прогресса именно у этих пациентов не было. И это не национальная проблема, а проблема всемирная. Мы принимали в нашей клинике онкологических больных, прошедших самое современное конвенциональное противоопухолевое лечение за рубежом (в Германии, в Швейцарии, в США, Израиле и т.д.), но, как и в случае лечения в отечестве, существенного прогресса они не отметили. Бесперспективность собственного труда очень угнетала и приводила в уныние. Параллельно мы занимались лечением также малоперспективных (с точки зрения конвенциональной неврологии и нейрохирургии) спинальных больных (тетраплегиков и параплегиков) со всего мира, и полученные успехи в результате терапевтического применения биомедицинских технологий на основе стволовых клеток (СК) у этих больных были просто фантастическими, что резко контрастировало с общей беспросветностью, тотальной тоской и полной не эффективностью лечения прогрессии/рецидивов тяжелых онкологических пациентов.
При этом, следует признать и еще раз подчеркнуть, что современная онкология это самая «продвинутая» и очень стандартизированная и наукоемкая медицинская дисциплина, в которой все определено международными протоколами (лечение лимфомы и лейкозы — Чикагский протокол, лечение лимфогрануломатоза — Бостонский протокол и т.д.). И, действительно, сегодня успехи в лечении гематоонкологических заболеваний впечатляющие, а вот прогресса в лечении солидных опухолей и нейроонкологических заболеваний нет. За последние 100 лет медиана выживаемости раковых больных с метастазами в головной и спинной мозг не изменилась даже на месяц и составляет 6—8 месяцев; медиана выживаемости больных с мультиформной глиобластомой варьируется от 8 до 12 месяцев в течение века. Неизлечимость большинства раковых больных, по определению, предполагает, что диагноз рака «это окончательный приговор без права на помилование» и «ничего сделать больше нельзя». Остается только паллиативная терапия и хоспис. Наверное это действительно реальный выход и способ социальной и морально-этической защиты общества, родственников и врачей-онкологов от профессиональной несостоятельности, а также беспомощности перед раком и другими злокачественными опухолями. Но иммунологи убеждены, что это не так, что именно иммунотерапия может предложить решение проблемы борьбы с рецидивами/прогрессированием рака. И с этим трудно не согласится. Но к иммунотерапии рака каждый из моих врачей клиники пришел своим путем, и мы попытаемся ниже обосновать, почему мы стали заниматься именно этой терапией.
Много лет я пытался анализировать клиническую ситуацию в онкологии, понять причины недостаточной эффективности терапии рака, и в настоящей книге впервые осмелился изложить свою альтернативную точку зрения. Ранее в научной монографии «Клеточные технологии в нейроонкологии. Циторегуляторная терапия глиальных опухолей головного мозга», вышедшей свет в 2013 году я уже представлял свои взгляды на развитие рака и других ЗНО. Это была большая экспериментальная научно-исследовательская работа на клеточных культурах и экспериментальных животных, которая позволила увидеть массу нюансов современной онкологии и биологии рака и выработать свое собственное понимание проблемы рака. Сегодня нами сформулировано новое понимание проблемы формирования и динамики развития рака и злокачественных новообразований (ЗНО), которое позволило посмотреть на проблему биологии рака не как на проблему неизлечимого фатального заболевания, а как на проблему нерегулируемого и неуправляемого количества ОК, являющихся потомками ОСК. Была предложена циторегуляторная парадигма перевода смертельного онкологического заболевания в хроническое и не смертельное, путем установления контроля над количеством ОК и регуляции эффекторных функций ОСК (пролиферации, миграции, деления и репродукции). Одним из естественных инструментов контроля количества ОК, в организме онкологического больного человека стали тканеспецифичные стволовые клетки (СК) и клетки-предшественники (КП).
Сама глобальная идея современных онкологов о полном излечении раковых больных сегодня нам представляется методологически ошибочной и не верной. Это связано с тем, что в норме у каждого человека существует около 500 000 (5х105) ОК, которые образуются в организме здорового человека в результате физиологической регенерации и мутагенной нагрузки, связанной с ограниченными сроками жизни большинства клеток. Например, клеточный цикл гемопоэтической стволовой клетки (ГСК) 360 дней, лейкоциты живут 100- 120 дней, эритроциты 90—100 дней и т. д. Поэтому постоянное клеточное обновление может сопровождаться мутагенезом и сбоями в репродукции. Контроль и надзор клеток иммунной системы человека, во главе иерархии которых находится ГСК, контролируется иммуннокомпетентными клетками (ИКК) врожденного иммунитета так, чтобы количество ОК было не больше 105. Традиционные научные представления об этом процессе выглядят следующим образом. Когда происходит системный сбой во врожденной иммунной защите, то количество ОК в организме человека повышается до 109, и это клинически проявляется предраковыми заболеваниями. На этом этапе в борьбу с раковыми клетками вступает адаптивный иммунитет, поскольку достигается необходимый пороговый уровень антигенного воздействия. В случае неэффективности адаптивного иммунитета количества ОК в организме становится больше чем 109 и диагностируется рак. Хирургия при онкологических заболеваниях способна сократить количество клеток до уровня 109 ОК. Химиотерапия и лучевая терапия уничтожают ОК путем цитостатического и цитотоксического воздействия в диапазоне 107—109 ОК. С уровня 107 ОК и ниже работает только врожденный иммунитет и ГСК. Мы к этому аспекту вернемся ниже, при обсуждении системных механизмов уклонения ОК и ОСК от киллеров иммунной системы. Здесь же, во вступлении, хотим отметить только тот факт, что современная конвенциональная противоопухолевая терапия рака завершается после хирургии, лучевой терапии и химиотерапии. То есть, на уровне, когда количество ОК не превышает 107, самая продвинутая противоопухолевая терапия заканчивается. Дальше нет стандартов лечения! Но своя иммунная система, скомпрометированная как заболеванием, так и его лечением, уже не способна контролировать ОК, и именно поэтому их количество стремительно увеличивается, манифестируя прогрессией/рецидивом опухоли. Поэтому ни теоретически, ни практически невозможно решить проблему противоопухолевого лечения и профилактики рака без восстановления реального иммунного контроля над ОК в организме.
Последние успехи современной иммунотерапии рака подвигли основных корифеев отечественной онкологии признать целесообразность и обоснованность иммунотерапевтических методов в лечении рака. В марте 2017 году главный онколог Минздрава страны директор ФГБУ РОНЦ им Н.Н.Блохина Минздрава России академик РАН профессор д. м. н. М.И. Давыдов выступил с программной статьей в национальных СМИ, в которой указал на доминирующую роль иммунотерапии в мировой онкологии. С аналогичной серией публикаций выступил заместитель директора по науке ФГБУ РОНЦ им. Н.Н.Блохина Минздрава России академик РАН профессор д. м. н. Личиницер М. Р. Он также в ряде научных статей и публикаций в СМИ и Интернете, в 2016 году призвал к более широкому внедрению иммунотерапии в современную онкологию. Что произошло? Почему эти очень консервативные топ-менеджеры отечественной государственной онкологии вдруг решили признать заслуги иммунотерапии в лечении раковых больных, которую они категорически отвергали все последние годы. Ответ достаточно прост и очевиден. С одной стороны, Всемирная организация здравоохранения (ВОЗ) признала в своем докладе в 2015 году, что применение молекулярнонацеленных (таргетных) фармацевтических иммуноонкологических препаратов у онкологических больных в развитых странах позволило продлить их жизнь на 15—20 лет. И от этого неоспоримого научного факта деться никуда нельзя. С другой стороны, за последние годы эти препараты стали доступными для практического здравоохранения. Большинство этих препаратов уже официально разрешены к клиническому применению в Российской Федерации, однако их стоимость исключительно высока.
Таким образом, вопрос о целесообразности онкоиммунотерапии в сегодняшней онкологии уже не обсуждается. Иммунотерапия важна, нужна и очевидна. Но её место в терапии рака должно быть жестко определено и регламентировано. Заслугой ряда крупных фармацевтических компаний «Большой Фармы» является организации многоцентровых клинических испытаний онкоиммунных препаратов, создания обучающих программ для врачей по онкоиммунологии и получение одобрения у регуляторных органов США, Европейского Союза и Российской Федерации. Несмотря на то, что тема иммунотерапии рака, с нашей точки зрения, во многом дискуссионная и неоднозначная, нами было решено не отходить от стандартного представления имеющегося материала, и в изложении основных разделов монографии, было решено придерживаться академического принципа написания научной книги.
В первой главе книги мы решили представить нашему читателю современные взгляды ученых на проблему рака и других злокачественных новообразований (ЗНО), современные представления о канцерогенезе, а также провести критический анализ состояния проблемы эффективности терапии рака. Мы не стали повторять в этой книге теории происхождения рака и обсуждать теории опухолевых стволовых клеток. Эти исследования подробно и основательно описаны в наших предыдущих монографиях 2013—2014 года, и пытливый читатель всегда с ними может ознакомиться. В этой книге предпринята попытка обобщить самые последние взгляды исследователей на роль «дормантных» или спящих опухолевых клеток в возникновении рака, а также новые терапии рака и других ЗНО. Также в этой книге не ставилась цель составить информационную конкуренцию существующим онкологическим руководствам по описанию механизмов канцерогенеза и лечения рака, в ней предпринята попытка дать наиболее системообразующие понятия этой проблемы и отразить основные вехи формирования современного онкологического мировоззрения и современных научных представлений о раке. Насколько это у нас получилось, оценит сам читатель.
Во в 2-ой главе монографии представлено современное понимание противоопухолевого устройства и принципов работы иммунной системы человека, а также изложены основные известные молекулярно-биологические механизмы противоопухолевой защиты, имеющейся у человека. В основном, это глава для студентов медицинских вузов и для пациентов. Она позволит ввести неосведомленного читателя в мир современной иммунологии. Когда-то Альберт Энштейн, произнес свою крылатую фразу: «Как много мы знаем, и как мало мы понимаем». И, действительно, объем наших знаний об иммунитете человека огромен, но полного понимания механизмов его работы у нас нет. Особенно это касается противоопухолевого иммунитета человека, в частности, как особой и специфической защитной функции человека. Поэтому было решено напомнить об основных эшелонах противоопухолевой защиты в системе врожденного и приобретенного иммунитета человека. В этой главе, также, не ставилась задача максимально подробного изложения всех фундаментальных аспектов этой проблемы, так как они очень неплохо изложены в современных руководствах для врачей по иммунологии и целом ряде онкологических руководств для врачей. Здесь хотелось лишь только напомнить читателю основные закономерности, присущие врожденному и приобретенному иммунитету, опираясь на которые, мы обосновываем свои взгляды на будущее онкоиммунологии.
В 3-й главе было решено более детально обсудить системные закономерности и частные молекулярно-биологические механизмы уклонения ОК и ОСК от иммунного надзора. Здесь, мы посчитали целесообразным высказать свои соображения относительно системных механизмов «ускользания» ОК от иммунологического надзора. Это не обычный взгляд врача на онкологическую проблему, а попытка взглянуть на онкологическую проблему неэффективности терапии опухолей через призму математической теории систем и теории управления. Мы не стали использовать формулы для большей убедительности, так как убеждены, что большая часть врачей на них даже не обратит внимание. Мы попытались, через системные отношения теории управления, показать проблему и системные пути её решения. Интересным представляется разбор частных фундаментальных механизмов уклонения ОК от уничтожения натуральными киллерами (NК-клетками), Т-лимфоцитами. Понимание этих механизмов позволяет по-новому взглянуть на проблему неэффективности иммунотерапии и предложить альтернативные иммунотерапевтические подходы.
В 4-й главе монографии представлен небольшой исторический экскурс в разработку разных способов иммунотерапии рака и ЗНО. Несомненно, что данная глава не претендует на исчерпывающее представление информации по всем историческим вехам иммунотерапии опухолей, но она дает представление о том, как зарождалась и развивалась иммунотерапия злокачественных опухолей. Из неё также становится очевидным, что всё иммунные препараты, которые использовались для иммунотерапии рака (иммуностимуляторы, противоопухолевые вакцины, иммуномомодуляторы и т.д.), были изначально разработаны для активации и стимуляции собственного иммунитета, как способ активации собственных иммунных ресурсов организма. Интересно, что вся известная история мировой иммунологии идет от философии мобилизации собственных ресурсов иммунной системы пациента для борьбы с болезнью. Поэтому, как нам кажется, предлагаемая нами в книге прецизионная ИТ рака принципиально отличается от современных стандартов иммунотерапии опухолей и является ассиметричным и нестандартным иммунотерапевтическим подходом, который основывается на формировании временного и параллельно существующего искусственного аллогенного или транскриптом- (геном- или протеом-) модифицированного противоопухолевого клеточно-гуморального кластера иммунитета, дополняющего иммунную систему пациента. Основной целью предлагаемой прецизионной иммунотерапии рака и других ЗНО представляется не стимуляция собственного иммунитета для борьбы с опухолевым заболеванием, как это было общепризнанно, а создание искусственным путем новой противоопухолевой функции врожденного и приобретенного иммунитета у онкологического больного при сохранности и коррекции его собственного иммунитета. Решение поставленной нами проблемы реализуется путем целого каскада молекулярно-биологических манипуляций с аллогенными и аутологичными иммуннокомпетентными клетками человека: 1) молекулярно-генетического подбора пары донора и реципиента для повышения противоопухолевой активности донорских аллогенных NK-клеток; 2) системное обогащение организма NKТ-клетками, NK-клетками и ɣδ Т-клетками; 3) стимуляция адаптивных противоопухолевых иммунных реакций донорских лимфоцитов; 4) применение протеом-основанных модифицированных персонифицированных молекулярнонацеленных (таргетных) клеточных препаратов и т. д. И эта новая история иммунотерапии рака пишется уже сегодня, просто мы этого пока не видим. Но за рубежом более 5 лет около 15 исследовательских групп работают с применением клеточных систем врожденного иммунитета: аллогенные НК-клетки применяются при лечении солидных опухолей и гемабластозов, активно рассматриваются вопросы применения аллогенных костно-мозговых прогениторных и иммунокомпетентных клеток, а также естественных антител в лечении разных опухолевых заболеваний.
В 5-й главе дается анализ основных известных современных видов иммунотерапии рака, которые существуют в клинике. Мы не ставили задачу критиковать эти методы или отрицать эти подходы. Мы просто представляем их и делаем ревизию основного противоопухолевого арсенала зарубежных и отечественных препаратов. Обсуждается современная стратегия специфической и не специфической иммунотерапии, активная и пассивная иммунотерапия. Сочетания в клинике активной и пассивной иммунотерапии представлены в форме комбинированной иммунотерапии.
Особняком стоит адоптивная иммунотерапия, и мы хотим более подробно обсудить этот методологический подход. При всем многообразии существующих стратегий и подходов к иммунотерапии опухолей, достаточно очевидно, что ни один из существующих подходов не является оптимальным и достаточным.
Роль и место иммунотерапии в комплексном противоопухолевом лечении представлены в 6-й главе. В ней анализируются общие закономерности различных стадий рака в зависимости от количества опухолевых клеток (ОК) в организме пациента, а также возможности по элиминации ОК при циторедуктивном хирургическом лечении, химиотерапии (ХТ) и лучевой терапии (ЛТ). Обосновывается учет количественных параметров ОК при проведении иммунотерапии. Проведенный анализ 17-ти летней деятельности врачей-онкологов частной клиники с 2002 по 2019 год в лечении более 10 тысяч онкобольных показал, что к нам попадали преимущественно крайне тяжелые онкологические пациенты с массивной генерализацией опухолевого процесса, множественными метастазами (в кости, внутренние органы, головной и спинной мозг и т.д.) и тяжелой раковой интоксикацией, которым было отказано в дальнейшем специфическом противоопухолевом лечении, и у которых ресурс лечебных конвенциональных мероприятий (хирургии, химиотерапии, лучевой терапии), как правило, был ограничен или вообще исчерпан из-за тяжелых осложнений и побочных эффектов специализированного противоракового лечения. Агрессивная и интервенционная дезинтоксикационная терапия (гемодиафильтрация, гемодиализ, гемосорбция, плазмоферез, «искусственная печень» и т.д.), правильно подобранная нутриативная (питательная) поддержка, электролитная и метаболическая терапия и хороший медицинский уход, позволяли стабилизировать этих больных и значительно улучшить их клиническое состояние и качество жизни. Все это время мы широко использовали у этого контингента больных современные стратегии (специфической и неспецифической, активной и пассивной, адоптивной) иммунотерапии (ИТ) рака с применением противоопухолевых дендритных вакцин (ПОДВ), внутривенное и подкожное введение цитотоксических лейкоцитов (ЦТЛ), проведение цитокинотерапии, а также терапии иммуномодуляторами, и убедились в их недостаточной эффективности. Анализ иммунного и интерферонового статуса у 75,2% этих больных на фоне ИТ показал, что при прогрессировании или рецидиве неопластического процесса их иммунная система не отвечала адекватной противоопухолевой иммунной реакцией и их ОК легко уклонялись от иммунного надзора и контроля. Мы пришли к выводу, что современные методы ИТ рака и других ЗНО, преимущественно направленные на стимуляцию и активацию функций собственных иммунокомпетентных клеток, требуют ревизии и пересмотра. Они способны значительно активировать и стимулировать эффекторные функции клеток иммунной системы, ответственные за элиминацию и уничтожение ОК, но достоверного эффекта уменьшения количества ОК в организме ракового больного отмечено не было. Все выявленные изменения ИТ были зарегистрированы на уровне плацебо-эффекта (не более 15—20%) и статистической погрешности. Несмотря на то, что у нас были отмечены единичные очень позитивные результаты ИТ рака и небольшое увеличение медианы выживаемости пациентов, мы пришли к выводу о недостаточной убедительности и недоказанной эффективности изолированного применения каждого из этих иммунотерапевтических методов отдельно.
Эффективность иммунотерапии при различных типах рака и других злокачественных опухолях и целесообразность использования стратегии прецизионной ИТ рака обсуждается в 7-ой главе книги. Причиной низкой эффективности проводимой современной ИТ рака нам представляется методологическая ошибочность существующих технологий, нацеленных на активацию отдельных клеток собственной иммунной системы пациента, которая уже дала «непоправимый сбой» в своей работе. Проиллюстрируем это на еще одной аналогии. Если больной плохо слышит, в связи с органической или морфофункциональной патологией слухового аппарата, то проблема не решится быстрей, если вы будете кричать ему на ухо в мегафон. Проще установить слуховой протез и разговаривать с ним обычным голосом. Также и с иммунной системой у ракового больного — необходимо не только активировать её клетки (ЛАК-клетки, ЦИК-клетки и т.д.), но и искусственно осуществить протезирование противоопухолевой активности за счет иммунокомпетентных клеток здорового человека. Набор этих клеток достаточно известен: натуральные киллеры (NК-клетки), γδТ-лимфоциты, В1-лимфоциты, дендритные клетки (ДК), цитотоксические лимфоциты (ЦТЛ) и тканеспецифические (гемопоэтические, мезенхимальные, нейральные и др.) стволовые клетки (СК).
Начиная с 8 главы, в монографии представлена фундаментальная часть наших исследований, направленная на изучение роли стволовых клеток в иммунологии рака, молекулярно-биологических особенностей гемопоэтической стволовой (ГСК) клетки у различных онкологических пациентов и здоровых доноров. В этой главе обсуждается роль и значение ГСК и НСК в формировании первичного и вторичного иммунного ответа на опухолевые антигены на модели глиобластомы, механизмы формирования опухолевых СК (ОСК). В этом разделе книги анализируются также молекулярно-биологические характеристики ГСК у больных с различными онкологическими заболеваниями, а также обсуждаются установленные нами онкоспецифические особенности экспрессии маркеров мембранной поверхности ГСК человека в оценке толерантности иммунной системы к опухолевым антигенам и их возможную роль в ранней диагностике рака. В этой главе была впервые сформулирована гипотеза иммунной недостаточности организма у онкологического больного и вводятся новые понятия острой и хронической иммунной недостаточности, основанные на изменениях молекулярно-биологических характеристик мембранной поверхности ГСК.
В 9-ой главе монографии описаны основные фундаментальные молекулярно-биологические механизмы формирования онкокоспецифических особенностей клеточной поверхности ГСК у онкологических пациентов. Эта глава также основана на наших собственных экспериментальных и научно-теоретических исследованиях, которые ранее уже были представлены в различных рецензируемых отечественных и зарубежных научных журналах. Здесь же была предпринята попытка систематизировать и обобщить наши многочисленные данные в виде стройной системы авторского научного мировоззрения на эту проблему. Для сравнения с ГСК онкологических больных были представлены инновационные и ранее не опубликованные данные о молекулярно-биологических изменениях мембранного ландшафта ГСК у больных с боковым амиотрофическим склерозом и системной атрофией головного мозга и мозжечка.
В 10-ой главе книги мы публикуем свой авторский способ ранней диагностики рака у человека, основанный на многочисленных данных о профилировании экспрессии маркеров мембранной поверхности ГСК и ГПК у большой когорты (400 взрослых и детей) онкологических больных. Эту работу мы выполнили совместно с д. б. н. Л.Ю. Гривцовой. Выявление определенного, онкоспецифического профиля мембранных белковых маркеров ГСК и ГКП у человека, позволяет говорить о возможности ранней диагностики рака, а точнее ранней диагностике иммунной недостаточности, на фоне которой может развиться рак даже тогда, когда еще количество ОК не превышает допустимого количества (105ОК) и не сформировалась тканеспецифическая принадлежность трансформированных или неопластических клеток. Несомненно, это предположение требует детальной проверки и обсуждения, но сам научный факт существования онкоспецифического профиля нормализованной сигнальной интенсивности белков мембранной поверхности ГСК и ГКП у онкологических больных крайне интересен и важен для дальнейшего исследования.
В 11-ой главе представлены наши собственные данные по изучению роли ГСК в иммунном ответе на ОК. Это работа была выполнена нами совместно со Школой биомедицины Дальневосточного Федерального Университета (отв. исполнитель д. м. н. Брюховецкий И. С.). Нами были проанализированы результаты межклеточного in vitro взаимодействия между ГСК и ГПК и опухолевыми клетками рака легких, рака молочной железы и мультиформной глиобластомы. Были показаны фундаментальные механизмы горизонтального и вертикального переноса белковой информации между взаимодействующими клеточными системами ОК и ГСК.
В 12-й главе анализируется функциональный молекулярно-биологический потенциал ГСК и ГКП in vivo, то есть в условиях экспериментального применения суспензии клеточных систем ГСК и ГКП у экспериментальных животных с модельными опухолями — глиобластомами. Это работа была выполнена по гранту Федеральной Целевой программы и очень хорошо проиллюстрирована данными экспериментальных исследований. Думаю, она будет очень интересна для большинства ученых и практических онкологов и нейроонкологов.
В 13-й главе представлен совместный труд с руководителем лаборатории онкопротеомики ФГБУ НМИЦО им Н.Н.Блохина профессором д. б. н. Шевченко Валерием Евгеньевичем и руководителем клеточной лаборатории Санкт-Петербургского института ядерной физики (Курчатовский центр) к.б. н. М.В. Филатовым, посвященный межклеточному информационному обмену экзосомами опухолевых клеток и иммунокомпетентных клеток крови как возможному способу формирования иммунотолерантности у онкологических больных. Мы изучили содержание белков в экзосомах ОК и экзосомах клеток крови здоровых пациентов и убедительно продемонстрировали, что межклеточный обмен экзосомами между ОК и здоровыми клетками является фундаментальной основой информационного переноса онкоспецифических белков в здоровые клетки иммунной системы, в том числе и ГСК.
В 14-й главе публикуется предложенная нами стратегия искусственного эмулирования (копирования, ремоделирования) противоопухолевой функции иммунной системы. Инновационная стратегия этой прецизионной иммунотерапии (прИТ) рака была реализована нами путем формирования у больного временного эквивалента искусственной противоопухолевой функции иммунитета (ИПОФИ). Термин «эмулирование» взят нами из вычислительной техники и означает копирование определенной функции с одной операционной системы и инсталляция её в другую (поврежденную) операционную систему. Нам представляется, что этот термин очень наглядно и по существу отражает суть предлагаемой биотехнологии прецизионной ИТ опухолей. То есть, наряду с существованием собственного иммунитета у больного создаются новые модули донорского здорового противоопухолевого иммунитета. Фундаментальной основой создания модулей ИПОФИ является временное искусственное формирование в пострадавших от опухоли органах и тканях больного клеточно-гуморальных «костно-мозговых иммуннокомпетентных кластеров» (КМИК), содержащих аллогенные NК-клетки, аллогенные Т-лимфоциты, аутологичные ЦТЛ, а также разработанный и запатентованный (Патент РФ №2535972 RU) аутологичный протеом-основанный персонифицированный молекулярнонацеленный (таргетный к пути интегринов и фокальной адгезии ОК и ОСК) клеточный препарат с транскриптом-модифицированными аутологичными гемопоэтическими стволовыми клетками (ГСК). Противоопухолевые КМИК из трансплантированных иммунокомпетентных клеточных систем и экзосом поддерживаются периодическими программными трансфузиями аллогенных и аутологичных клеточных препаратов, которые имеют разные сроки функционирования (от 60 до 120 дней), требуют программной замены и предназначены для элиминации ОК, путем иммунной реакции «трансплантат против опухоли» (РТПО) и профилактики рецидивов.
В 15-ой главе было решено остановиться на научно-практических аспектах реализации методологии клинического применения стратегии искусственного эмулирования противоопухолевой функции иммунной системы в прецизионной ИТ рака и других злокачественных опухолей. Эта глава раскрывает методологию расчета общего количества ОК и ОСК в организме пациента, используемую нами в клинике, расчет необходимого количества иммунокомпетентных клеток для прецизионной иммунотерапии (NK-клеток, Т-лимфоцитов, дендритных клеток (ДК) и цитотоксических лимфоцитов (ЦТЛ) и тканеспецифических (гемопоэтических, мезенхимальных, нейральных и др.) СК. Наши расчеты потребности иммунокомпетентных клеток для прецизионной ИТ не претендуют по точности на аксиому. Эти рекомендации по использованию иммунных клеток, были выработаны нами при применении этой стратегии в клинике. Более того, мы убедились в эффективности применения медикаментозного расширения при использовании биомедицинских клеточных препаратов и продуктов в ИТ опухолей и рекомендуем их к широкому применению в клинике для повышения клинического эффекта проводимой ИТ.
Глава 16-я монографии посвящена обсуждению используемых нами клеточных препаратов для реализации предложенной стратегии искусственного эмулирования противоопухолевой функции иммунной системы в лечении рака и других злокачественных опухолей. Все клеточные препараты готовились ex vivo, то есть биоматериал (периферическая кровь, лейкоконцентрат мобилизованных мононуклеаров костного мозга) изымался у донора или пациента и готовился в культуральных лабораториях GMP- уровня in vitro. Для эффективного цитолитического использования аллогенных NК- и NKT-клеток против ОК, был использован подбор гаплоидентичного биоматериала реципиента к близкородственному донору, основываясь на несовпадении его клеток крови по HLA 1-го типа к КИР-рецепторам НК клеток донора. Профилактика иммунных «реакций трансплантат против хозяина» (РТПХ), вследствие применения аллогенных лимфоцитов осуществлялась программным внутривенным введением иммунотолерантных доз аллогенных Т-лимфоцитов, а также применением биоматериала гаплоидентичных (близкородственных) доноров совместимых по HLA 2 типа. Применение индивидуальных противоопухолевых дендритных вакцин (ПОДВ) и цитотоксических лимфоцитов (ЦТЛ), изготовленных из собственных клеток пациента, препарата аллогенных аллореактивных NК-клеток, подобранного с учетом молекулярно-биологических характеристик крови донора и реципиента, а также персонифицированных противоопухолевых таргетных клеточных препаратов, существенно дополнило существующий арсенал клеточных продуктов, которые могут быть использованы для лечения пациентов, когда ресурсы хирургии, ХТ и ЛТ в лечении рака у конкретного больного были исчерпаны. Инструктивное действие аллогенных и модифицированных аутологичных иммунокомпетентных противоопухолевых клеточных систем на иммуннокомпетентые клетки самого пациента, в соответствии с законами системной биологии, способны мобилизовать собственные резервы иммунной системы больного и настраивает её на противодействие развитию рака.
В 17-й главе анализируется эффективность и безопасность ограниченных клинических исследований по созданию технологии искусственного эмулирования противоопухолевой функции иммунной системы в лечении рака и других злокачественных опухолей. Наши клинические исследования были направлены на разработку и создание инновационных противоопухолевых биотерапевтических технологий и биомедицинских клеточных продуктов (БМКП), способных обеспечить предотвращение рецидива опухоли и профилактику метастазирования различных солидных злокачественных новообразований (ЗНО). В основу этой работы были положены уникальные экспериментальные и клинические исследования рабочей группы отечественных онкологов, проводившиеся нами совместно с ФГБУ НМИЦО им. Н. Н. Блохина в 1982—1993 г. под руководством академика РАН проф. Н. Н. Трапезникова. Используя принцип частичной гистосовместимости и аллореактивности клеток костного мозга (КМ) донора и реципиента, российские ученые изучали и эксплуатировали в терапевтических целях иммунологический феномен «реакция трансплантат против опухоли» (РТПО) и «реакция трансплантата против хозяина» (РТПХ), возникающий после аллогенной (чужеродной или близкородственной) трансплантации КМ (алло-ТКМ) у разных групп онкобольных. Была достигнута эффективность полного выздоровления у 41% пациентов с солидными опухолями, а в 56% случаев отмечена длительная ремиссия заболевания с отсутствием метастазирования опухоли в течение 4—10 лет. Пионерские исследования и новаторские результаты лечения различных ЗНО российских ученых были незаслуженно забыты в период «развала» СССР, социально-экономических потрясений и деградации национальной науки в 90-х годах ХХ века, и из-за безвременного ухода из жизни их руководителя академика РАМН и РАН проф. Н. Н. Трапезникова. В настоящее время, по указанию главного онколога страны академика РАН проф. М.И.Давыдова, стараниями его учеников и последователей (проф. Тупицын Н. Н., Гривцова Л. Ю. и т.д.), эти исследования были возобновлены на очередном витке научно-технического прогресса и фундаментальных знаний об иммунологии и биологии рака. В представленных клинических исследованиях с новых молекулярно-биологических позиций современной онкологии рассматривается не столько аллоТКМ, сколько аллогенная иммунотерапия (аллоИТ). В этой главе представлена технология не «полной замены» клеток иммунной системы пациента, как при аллоТКМ после высокодозной ХТ (ВДХТ), а «частичная замена» клеток иммунного контроля и надзора (NK-клетки, NKТ-клетки, В1 клетки и γδ Т-клетки) реципиента на аналогичные аллореактивные донорские клетки. В соответствии с изменением параметров иммунного и интерферонового статуса нами были использованы цитокинотерапия, адоптивная иммунотерапия, противоопухолевые дендритные вакцины, препараты цитотоксических лимфоцитов, иммуномодуляторы и иммуносупрессоры и т. д. Предложенная аллоИТ — реальная альтернативна противоопухолевой терапии в случаях невозможности проведения ХТ и ЛТ у онкологических больных с высоким риском прогрессирования/рецидива и (или) профилактики метастазов рака и ЗНО.
В «Заключении» книги подводятся итоги представленного материала и обсуждаются перспективы будущих технологий иммунотерапии рака и других новообразований. В данном разделе этой книги мы не претендуем на исчерпывающие представления будущих инновационных технологий иммунотерапии рака, а остановимся только на основных тенденциях этого лечения в будущем. Будут представлены наши собственные соображения на этот счет, а также найденные нами в научной литературе прогнозы развития иммунотерапии рака. Также, в заключение монографии, будет подведен итог существующего положения иммунотерапии рака в современной онкологии, обобщен наш собственный экспериментальный и клинический опыт применения клеточных иммунотерапевтических препаратов в лечении рака. А также в «Заключении» будут даны рекомендации к применению иммунотерапии в лечении рака и ЗНО.
Автор хотел бы поблагодарить за совместную работу над этой книгой сотрудников Клиники восстановительной интервенционной неврологии и терапии «НейроВита» без которых издание этой книги было бы просто не возможно. Автор выражает искреннюю благодарность заведующей онкологическим отделением клиники А. Т. Коколишвили, заведующему реабилитационным отделением Коваленко Н. И., которые принимали личное участие в проведении иммунотерапии различным онкологическим больным. Также авторы благодарят главного онколога Минздрава России — директора ФГБУ Национальный медицинский исследовательский центр онкологии им Н. Н. Блохина Минздрава России академика РАН профессора Давыдова М. И. за поддержку этих исследований, а также руководителя лаборатории иммунологии гемопоэза НИИ клинической онкологии ФГБУ НМИЦО им Н.Н.Блохина Минздрава России профессора, д.м.н., Н. Н. Тупицына и ведущего научного сотрудника этой же лаборатории, д.б.н., Гривцову Л. Ю. за совместную и очень интересную работу в области онкоиммунологии. Автор благодарит за методологическую и практическую помощь в иммунологических исследованиях старшего научного сотрудника НИИДиЭТ опухолей ФГБУ НМИЦ онкологии им. Н. Н. Блохина к. б. н. Чкадуа Г. З. за его критические оценки, замечания и объяснение сложных иммунологических парадоксов исключительно просто, доступно и понятно. Огромную методологическую помощь в понимании проблемы иммунотерапии рака нам оказала онкоиммунолог Лаборатории клинической иммунологии ФГБУ НМИЦО им. Н.Н.Блохина Минздрава России к. м. н. Борунова А. А., за что авторы выражает ей глубокую благодарность и признательность. Автор выражает благодарность за сотрудничество специалистам отделения трансплантации костного мозга НИИ клинической онкологии ФГБУ НМИЦО им. Н.Н.Блохина Минздрава России и лично руководителю этого отделения профессору к. м. н. Мелковой К. Н., а также сотрудникам Банка костного мозга НМИЦО им. Н.Н.Блохина Минздрава России к. м. н. Д.М.Мхеидзе и к. м. н. Гришиной В. В. Надеемся, что эта книга будет интересна самому широкому кругу врачей, студентов и аспирантов медицинских университетов, а также онкологических пациентов и их родственников.
Автор
Глава 1. Современные научные представления о раке и других злокачественных новообразованиях
Ежегодно на земном шаре раком и злокачественными новообразованиями (ЗНО) заболевают 14 миллионов человек, и умирает 8,2—9 миллионов людей (Stewart B.W, Wild C.P.,2014; O.Lim et al.,2015). Согласно данным Международного агентства по изучению рака (International Agency for Research on Cancer), ежегодно онкологическая патология диагностируется более, чем у 12 млн. человек во всем мире, а порядка 8 млн. жителей планеты ежегодно умирают от рака. По данным Всемирной организации здравоохранения (ВОЗ) за 2017 год смертность от рака занимает второе место в ряду основных причин смертности населения в мире, уступая лишь сердечно-сосудистым заболеваниям. Однако, по мнению Главного онколога Минздрава России директора ФГБУ Национальный медицинский исследовательский центр онкологии (НМИЦО) им Н. Н. Блохина Минздрава России академика РАН проф. М. И. Давыдова, рак стоит на первом месте среди причин смертности населения в России (Давыдов М. И.,2017). Он убежден, что большое число случаев рака и других онкологических заболеваний в регионах (в первую очередь на селе), не диагностируется, а статистика смертей от сердечно-сосудистых заболеваний, доминирует из-за частых смертей вследствие чрезмерного пьянства и алкоголизма. По данным ВОЗ (2016), во всем мире наибольшее количество мужчин умирает от 5 видов онкологических заболеваний: рак легкого, рак желудка, рак печени, рак ободочной и прямой кишки, рак пищевода. В свою очередь, наибольшая смертность среди женщин отмечается от рака молочной железы, рака легкого, рака желудка, рака прямой и ободочной кишки, рака шейки матки.
В 2014 г. в России было выявлено 566 970 новых случаев злокачественного новообразования (54,2% у женщин, 45,8% у мужчин), что на 21,1% больше по сравнению с 2004 г (468 029). В конце 2014 года, в территориальных онкологических учреждениях России состояли на учете 3 291 035 больных (3 098 855 в 2013 г.). Совокупный показатель распространенности рака составил 2 252,4 на 100 000 населения. Согласно данным Росгосcтата, смертность от злокачественных новообразований в 2014 составляла 290 182 человек — 198.7 случаев на 100 000 населения. В 2015 году было зарегистрировано 293 499 случаев гибели пациентов от злокачественных новообразований, что составило 200,6 случаев на 100 000 населения. По данным Росстата, «в 2016 году по сравнению с 2011 годом показатель пятилетней выживаемости увеличился с 51,3% до 53,3%, одногодичная летальность снизилась с 27,4% до 23,2%». Других критериев оценки ситуации с онкологической заболеваемостью в РФ действующая система статистики не предусматривает.
По данным Минздрава России, представленным в ноябре 2017 года, рак занимает второе место в структуре смертности россиян (15,6%). В 2016 году от онкологических заболеваний скончались 299 тысяч человек. Всего в России зарегистрировано более 3,5 млн. пациентов, страдающих онкологическими заболеваниями. Заболеваемость раком среди детей составляет 3,5 тысячи в год. Другие данные в ноябре 2016 года приводил главный внештатный специалист по детской онкологии и гематологии Министерства здравоохранения РФ директор НМИЦ ДОГ им. Дмитрия Рогачева Минздрава России профессор академик РАН А. Г. Румянцев. По его данным, этот показатель выше и достигает 5 тысяч в год. При этом, как отметил А. Г. Румянцев, в России выздоравливают порядка 75—80% детей с онкологической патологией.
Среди онкологов существует распространенная точка зрения, что каждый человек способен «дожить до своего рака». Это «крылатое» выражение означает, что основная тенденция увеличения общей продолжительности жизни населения в мире способствует повышению вероятности заболеть раком каждому человеку с увеличением его возраста. Несмотря на то, что рак может развиться у человека в любом возрасте (даже внутриутробно), после 50 лет его вероятность увеличивается с арифметической прогрессией, а после 70 лет прогрессия вероятности заболеть раком становится геометрической.
Однако, несмотря на столь пессимистичные статистические данные о раке и других злокачественных опухолях, есть и позитивные сдвиги в современной онкологии. Так, основные научные достижения в современной онкологии за последние пять лет (с 2013 года по 2018 год), можно сформулировать рядом важных научно-практических и технологических прорывов:
• Разработка, создание и массовое применение в терапии рака и других злокачественных опухолей молекулярнонацеленных (таргетных) противоопухолевых фармацевтических препаратов;
— Появление и легализация в онкологии инновационного класса онкоиммунных лекарственных средств для лечения опухолей, на основе моноклональных антител и природных веществ;
• Появление и одобрение FDA USA биотехнологий редактирования генома клеток эукариот системой CRISPR/Сas9, системой активаторов транскрипции TALEN или нуклеазами цинковых пальцев (ZFN);
• Применение системы CRISPR/Сas9 позволило отключить Oct4, один из ключевых генов, связанных со стволовыми клетками, и раскрыть его роль в развитии эмбриона и опухолей;
• Первое в мире официальное клиническое применение генно-инженерных способов клеточной терапии рака генно-модифицированными CAR-Т лимфоцитами;
• Применение и одобрение FDA USA персонифицированной протеом-основанной терапии рака в виде противоопухолевых вакцин и препаратов на основе цитотоксических лимфоцитов (ЦТЛ);
• Применение молекулярно-генетически подобранных аллогенных NK-клеток для лечения солидных раков и гемабластозов;
• Появление уникальной технологии прецизионной (точно-ориентированной) лекарственно-клеточной иммунотерапии рака;
• Разработка и одобрение FDA USA первого клеточного продукта из пуповинной крови «ГЕМАКОРД» для лечения онкологических больных после химио- и лучевой терапии;
• Разработка и одобрение FDA USA стереотаксической хирургии в нейроонкологии фокусированным ультразвуком под контролем МРТ
О некоторых из них и других инновационных достижениях современной онкологии мы поговорим ниже в этой главе. Общепризнанно, что ранняя диагностика рака способствует наибольшей эффективности его терапии и увеличению выживаемости онкологических больных (Давыдов М. И.,2016). С одной стороны это верно, так как диагностика рака на начальных этапах заболевания позволяет достаточно полно удалить основную массу новообразования хирургическим путем (Давыдов М. И., с соавт.,2015), но это мало касается наиболее злокачественных неоплазий, которые начинают бурное метастазирование, не превышая размера горошины. С другой стороны, основным достижением современной мировой онкологической науки считается разработка и создание противоопухолевых молекулярнонацеленных (таргетных) фармацевтических препаратов, внедрение которых в современные протоколы лечения рака и ЗНО в высокоразвитых экономических странах Европы и Америки привело к увеличению продолжительности жизни населения этих стран на 15—20 лет (Ю. Уварова,.2010). Этот прорыв стал возможен из-за нового понимания биологии рака и фундаментальной роли иммунной системы человека в развитии и формировании рака и ЗНО и появлении целого класса фармакологических молекулярнонацеленных (таргетных) и иммуноонкологических препаратов нового поколения.
За последние два десятилетия ХХI века кардинально изменились базовые научные представления о происхождении рака и его биологии. В руководстве для врачей «Канцерогенез», выпущенном еще в 2004 году в свет специалистами НИИ канцерогенеза ФГБУ «Российского онкологического научного центра им. Н. Н. Блохина Минздрава России (сегодня ФГБУ НМИЦО им Н. Н. Блохина Минздрава России), впервые было официально заявлено, что «рак это генетическое заболевание ядра стволовой клетки» (Д.Г.Заридзе, 2004). В основу этих утверждений были положены многочисленные публикации в отечественной и зарубежной печати, подтверждающие научный факт существования опухолевых стволовых клеток (ОСК), впервые представленный в концепции развития рака группой американских ученых под руководством профессора I. L. Weissman (Reya T, Morrison S.J.,Clark M.F., Weissman I. L.) в статье «Stem cells, cancer and cancer stem cells», опубликованной в журнале «Nature» №414 в 2001 году. Несмотря на то, что последние 15 лет всё еще продолжаются академические научные споры ученых и практических онкологов о том, «что первично — опухолевая клетка (ОК) или ОСК?», «может ли ОСК образоваться из любой тканеспецифичной СК?» или «может ли ОСК формироваться путем дедифференцировки из обычной клетки с поврежденным геномом?», сегодня очевидно, что сам факт того, что рак и другие злокачественные опухоли формируется из ОСК, уже не вызывает сомнений и возражений у ученых всего мира. Проблема рака и других ЗНО, с этих позиций, является проблемой бесконтрольного и неуправляемого роста количества ОК, из ОСК в организме пациента и потери надзора за трансформированными клетками собственной иммунной сиcтемы пациента.
Фундаментальные научные представления о раке в настоящее время претерпели определенные изменения, в частности на сегодняшний день известно, что канцерогены (неблагоприятные факторы внешней среды и микроокружения) системно воздействуют не только и не столько на отдельные тканеспецифические клетки организма, сколько повреждают преимущественно тканеспецифические стволовые клетки (СК) и приводят к возникновению в них анеуплоидий (дополнительных хромосом или отсутствие хромосом). Повреждения (мутации) генома в тканеспецифической СК ведут к неустойчивости её кариотипа (P. Duesburg et al, 2011). Анеуплодии приводят к неустойчивости хромосом у потомков этой опухолевой СК (ОСК), то есть, во всех опухолевых клетках (ОК) организма, что абсолютно согласуется с классическими представлениями о морфологии ОК (Theodor Boveri,1914). Хромосомная нестабильность в клетке приводит к появлению мутаций в онкогенах и генах-онкосупрессорах в ОСК (Reya T, Morrison S.J.,Clark M.F., Weissman I. L.,2001). Накопление мутаций в генах приводят к нестабильности генов (F. Urh et al., 2005). Появление случайных мутаций в ОСК приводит к генерации дефектных белков (L.A. Loeb, 1976). Наши собственные исследования по протеомному картированию и профилированию нормализованной сигнальной интенсивности белков в ОСК при различных онкологических заболеваниях показали (Брюховецкий А.С,2014), что их белковый состав или протеом ОСК на 35—65% состоит из онкоспецифических белков (ОСБ), то есть белков, не встречаемых в норме у человека. Это белки «не человеческого вида», то есть не вида «homo sapiens», а мутантные «чужеродные» ОСБ, которые формируют количественные и качественные онкоспецифические патологические изменения в хромосомах ядра СК в виде анеуплодий (Брюховецкий А. С., 2014). В то же время стало известно, что возможна обратимость трансформации ОК при дифференцировке в нормальные клетки из-за нестабильности дефектных белков (Васильев Ю.М,1986). Появление анеуплодий и изменений хромосомного видового баланса ядра ОСК и ОК при раке стало причиной создания новой теории происхождения рака, представленной американским ученым Pеter Duesberg с соавт. (2011), в основе которой лежит фундаментальный тезис о том, что «канцерогенез это одна из форм видообразования» в эволюции. Свои доказательства Duesberg с соавт. (2011) основывает на демонстрации изменения модифицированных кариотипов в ОК при различных типах рака. Можно скептически отнестись к данным исследованиям, как это сделали множество исследователей, но наши собственные исследования (Брюховецкий А. С.,2013, Брюховецкий А. С. с соавт.,2015, Брюховецкий И. С., 2017), направленные на сравнение результатов протеомного картирования и профилирования ОСК и ОК и здоровых тканеспецифических СК организма человека, полностью подтвердили исследования P. Duesberg и его команды (2011), по части формирования в результате канцерогенеза нового фенотипа тканей, содержащего белки, не характерные для протеома здоровых тканей данного вида организма. Характерной особенностью этих протеомных модификаций, вследствие определенных геномных трансформаций, происходящих в ОСК и ОК под воздействием процессов канцерогенеза, является изменение не столько геномной (она минимальна), сколько эпигеномной (транскриптомной и протеомной) структуры ядра и других компартаментов этих клеточных систем, изменяя их видоспецифичный фенотип на опухолевый. Канцерогенез кардинально изменяет функционирование большинства внутриклеточных путей сигнальной трансдукции (ВКПСТ) в пострадавшей ОСК и ОК, модифицирует их и делает их малоуправляемыми для основных регуляторных клеточных и гуморальных систем иммунитета и собственных тканеспецифических СК.
Нарушение внутриклеточного сигналинга в ОК и ОСК является самым очевидным нарушением в функционировании ОК, и об этом написано огромное количество научных работ и научных обзоров литературы. Поэтому, мы не будем в этой главе останавливаться на перечислении всех пострадавших при канцерогенезе внутриклеточных путей сигнальной трансдукции (ВКПСТ) в ОСК и в ОК, так как эти изменения хорошо описаны в большинстве руководств для врачей онкологов и специализированных руководствах по молекулярной биологии рака, а остановимся на другой особенности молекулярно-биологического повреждения ОК и ОСК, которая была выявлена нами в процессе собственных исследований при многоуровневом сравнительном протеомном картировании и профилировании белков ОСК и ОК и нативных тканеспецифических СК (Брюховецкий А. С., 2014; Bryukhovetskiy A.S. et al.,2015). Большинство современных мировых научных исследований сосредоточены на изучении ОСБ в ОК и ОСК с целью сделать их основными целями и мишенями для таргетной (молекулярнонацеленной) терапии рака (Личиницер М. Р., 2016, Горбунова В. А. с соавт.,2017). Несомненно, эти изменения очень важно понимать и использовать в создании инновационных противораковых лекарственных средств, но в каждом конкретном случае рака они крайне специфичны и вариабельны в процессе персонального канцерогенного неопластического перерождения клеток и тканей. Мы же задались вопросом о том, что осталось не измененным (не пострадавшим в результате канцерогенеза) в протеомной структуре ОСК и ОК при завершении процесса канцерогенеза и формировании определенной, фенотипически завершенной клеточной линии ОСК при различных видах рака. К нашему удивлению, при целом ряде злокачественных онкологических заболеваний (раке молочной железы, раке легких, мультиформной глиобластоме и др.) оказались не пострадавшими всего 10 путей внутриклеточной сигнальной трансдукции, а все остальные ВКПСТ, в той или иной мере, были трансформированы опухолевым процессом.
Акцепторные белки этих неопластически измененных ВКПСТ в ОК и ОСК были замещены на онкоспецифические белки, которые становятся малодоступными для регуляции известными белками-лигандами, найденными нами в международных базах данных белок-белковых взаимодействий (Брюховецкий А. С., 2014).
Таблица 1.
Внутриклеточные сигнальные пути в опухолевых стволовых клетках рака молочной железы, рака легкого и мультиформной глиобластомы, не пострадавшие в процессе канцерогенеза
Список внутриклеточных путей сигнальной трансдукции, не пострадавших в результате канцерогенеза в ОК и ОСК различных опухолей представлен в таблице 1. Таким образом, небольшое количество внутриклеточных сигнальных путей в ОСК и ОК остались не вовлечены в процесс канцерогенеза, и они могут быть основными объектами целенаправленного регуляторного и управляющего воздействия на них, и белки этих путей могут быть основными целями и мишенями в регуляторной терапии рака.
Почему эти новые знания о биологии рака так важны для терапии злокачественных опухолей? Потому, что стандартная методология поиска мишеней и целей таргетной терапии среди известных онкоспецифических белков (ОСБ) в ОК и ОСК не позволяет добиться длительного и стойкого подавления патологических эффекторных функций (пролиферации, миграции, репродукции, метастазирования и т.д.) этих клеток. Попытка полного и окончательного уничтожения ОСК таргетными фармацевтическими препаратами, абсолютно очевидно, потерпела фиаско. Она показала преходящий (временный) эффект этого научно-методологического подхода в терапии опухолей и продемонстрировала не достаточную терапевтическую эффективность прямого блокирующего воздействия самых различных моноклональных антител (МКАТ) на онкоспецифические белки ВКПСТ в этих клетках. МКАТ, разработанные различными фармацевтическими компаниями «Большой Фармы», эффективны в течении 3—4 месяцев, а в дальнейшем ОСК и ОК приспосабливаются к ним, и эффективность терапии снижается.
Оказалось, что убить ОСК физически достаточно трудно, а зачастую вообще, практически не возможно. ОСК выживает в самых неблагоприятных условиях микроокружения и экстремального внешнего воздействия. ОСК человека — один из уникальных способов выживания поврежденных или «мутантных» клеток эукариот в природе, совершенный способ преодоления и переживания неблагополучия биологической клеточной системой в неблагоприятных условиях окружающей среды. Она идентична споре растения или цисте у бактерий, и в этой форме существования живая ОСК способна перенести самые экстремальные воздействия, сохранив основные свойства своего генома для продолжения своего биологического вида. При улучшении условий она очень быстро сможет восстановиться и дать потомство. По-видимому, именно сохранность и функциональность при канцерогенезе путей фокальной адгезии и пути интегринов в ОК и ОСК обеспечивает ей высокий уровень репродуктивных функций, миграции и патотропизма (Bryukhovetskiy A.S. et al.,2016).
ОСК как конечные мишени (цели) в противораковой терапии совсем недавно были описаны в работе A.Shabbir, Esfandiar T., Farassati F. (2018). С научных позиций группы этих авторов, концепция опухолевых стволовых клеток в настоящее время представляет значительный интерес по причине высокой значимости и выводов для нашего понимания биологии опухоли, а также развития новейших противораковых терапевтических средств. Опухоли, впрочем, как это происходит и в здоровых органах, содержат в себе плюрипотентные клетки, способные генерировать свой собственный тип, а также клетки, способные продолжать дальнейшую дифференциацию. Считается, что ОСК являются высоко резистентными к цитотоксическим воздействиям режимов традиционной противораковой терапии (Polyak K.,Hahn W.C., 2006), что приводит к возникновению и развитию невосприимчивого (рефракторного) статуса у опухолей (Polyak K., Hahn W.C., 2006; Aquirre- Ghiso J.A.,2007). Следовательно, ОСК могут рассматриваться как основные драйверы опухолевой целостности и функциональности. Этот факт напоминает роль и значение, которые играют здоровые стволовые клетки (СК) при развитии тканей и органов. Терапевтические меры, призванные элиминировать дифференцированные раковые клетки, оставляя (сохраняя) при этом ОСК, вследствие этих причин, обречены на неудачу из-за резистентности ОСК и их способности репопулировать опухоли (Fujiki H.,Sueoka E., 2017). Данное явление, в действительности, рутинным образом наблюдается в клинической практике. Клиническая ответная реакция на режим химиотерапии с течением времени понижается, по мере того, как опухоль вступает в рефракторную (невосприимчивую) фазу, которая индуцируется за счет обогащения ОСК в популяции опухолевых клеток. Данное явление даже наблюдается в клетках, окультуренных у больных на ранних стадиях заболевания, как, например, при колоректальном раке (SW480, ATCC CCL-228), и рецидивы злокачественных признаков приводят к широко распространенному метастазированию (SW620, ATCC CCL-227). Такой показатель, как SW260, согласно данным, полученным группой A.Shabbir, Esfandiar T., Farassati F. (2018), демонстрирует существенно более высокий процент клеток, позитивных к CD133 — маркеру ОСК.
Современные методы по выявлению ОСК включают в себя поверхностные маркеры, такие, как CD24, CD34, CD44, CD44, CD90, CD133, ABCB5, и EpCAM, каждый из которых был показан, как способный указывать на субпопуляции (группы в популяциях) ОСК в целом ряде злокачественных новообразований (Aponte P.M., 2017). Кроме того, функциональные пробы, такие, как обнаружение фенотипа сторонней популяции с помощью метода исключения Hoechst 33342, способность прорастания в качестве блуждающих сфер в среде, свободной от сыворотки, а также ALDH активность, тоже были задействованы для выявления и изолирования ОСК.
С терапевтической точки зрения, две основные стратегии для таргетирования ОСК были заявлены до сего времени. Первая стратегия основывается на распознавании характеристик клеточного сигналинга опухолевых стволовых клеток. В основном виде, определенные про-онкогенные клеточные сигнальные пути обнаруживаются, как являющиеся сверхактивными в раковых стволовых клетках на более высоких уровнях, чем дифференцированные раковые клетки или незлокачественные клетки. Сверх-активация подобных путей способствует формированию фенотипических признаков раковых стволовых клеток, как, например, сопротивляемость апоптозу и усиленная инвазивность. К примерам подобных путей можно отнести JAK/STAT, Wnt/B-catenin, Hedgehog, Notch, и пути TGF-B (Takebe N.,Miele L.,Harris P.J et al.,2015, Jung H.J.,2017). Пути сигналинга RalA были показаны группой A.Shabbir et al. (2018), как являющиеся сверх-активизированными в ряде злокачественных онкологических заболеваний человека, таких как, например, рак печени, рак легких, медуллобластома, злокачественные опухоли выстилки периферического нерва, и рак яичников (Ginn K.F., Fangman B.,Terai et al., 2016; Wang K.,Terai K., Peng W et al., 2013; Male H., Patel V.,Jacob M.A. et al., 2012; Ezzeldin M.,Borrego-Diaz, Taha M. et al., 2014; Borrego-Diaz E., Terrai K.,Lialite K et al.,2012; Bodempudi V.,Yamoutpoor F., Pan W. et al., 2009). В соответствии с данными, полученными A.Shabbir et al. (2018), в то время как уровни RalA экспрессии являются сопоставимыми с уровнями, наблюдаемыми в ОСК и дифференцированных раковых клетках, экспрессия RalAGTP (активная форма RalA) происходит на более высоких уровнях в ОСК. В общем виде, ни один из выше обозначенных путей клеточного сигналинга, не является специфичным к ОСК; следовательно, стратегии на основе их ингибирования могут оказывать воздействие на другие клетки.
К ряду других мишеней с предпочтительной экспрессией в ОСК можно отнести поверхностные маркеры, как, например, CD44, CD90, CD33, и CD133 (Mallard B.W.,Tiralongo J., 2017; Jang J.W., Song Y.,Kim J et al.,2017), помпа АТФ-связывающих кассетных транспортеров и множественной лекарственной устойчивости (Ding X.W. Wu J.H.,Jiang C.P.,2010), и маркеры микроокружения (как CXCL12/CXCR4 и VEGF/VEGFR) (Wang X.,Cao Y.,Zhang S.et al., 2017).
Вторая же стратегия основывается на применении онколитических вирусов для таргетирования ОСК. Онколитические вирусы представляют собой перспективный класс компетентных по репликации вирусов, которые во многих случаях выходят на передовой уровень онкологии посредством клинических испытаний, и один из заявленных вирусов уже получил одобрение Администрации США по лекарственными препаратам и пищевым продуктам (FDA USA) для терапии меланомы (Fukuhara H.,Ino Y.,Todo T.,2016; Lawler S.E.,Speranza M.C.,Cho C.F., Chiocca E.A., 2017; Borrego-Diaz E., Mathew R.,Hawkinson D., 2012). Предполагается, что ряд подобных вирусов способен уничтожать ОСК. Группа ученых Shabbir A., Esfandiar T., Farassati F. (2018) занялась разработкой и оценкой мутированных версий вируса herpes simplex-1, которые могут нацеливаться на ОСК. Работа команды A.Shabbir, Esfandiar T., Farassati F. (2018) крайне важна, так как их данные показали, что таргетирование подобной неосновной популяции может эффективно ингибировать рост опухолевых клеток in vitro и вызывать существенную регрессию в установленных моделях гетеротопических и ортотопических опухолях на животных. Дальнейшие исследования по таргетированию ОСК могут привести к разработке высокоэффективных противораковых средств с минимальным количеством побочных эффектов.
С позиций современной онкологии и новых знаний о молекулярной биологии рака и других злокачественных опухолей научное определение термина «рак» или «злокачественное новообразование» (ЗНО) можно сформулировать следующим образом: рак и другие ЗНО это онкологические заболевания человека, обусловленные минимальным генетическим повреждением и накоплением критического количества (4—5 мутаций) анеуплодий в ядре тканеспецифичной стволовой клетки (СК) человека в результате неблагоприятного (канцерогенного) воздействия на неё клеток микроокружения и факторов внешней среды, которое приводит к формированию ОСК с неопластическим фенотипом из ОСБ, неконтролируемыми эффекторными функциями (пролиферации, деления, миграции, репродукции и т.д.) и способностью к уклонению от регуляторного надзора и контроля клеток собственной иммунной системы человека.
Уклонение ОСК и её потомков от надзорных киллерных клеток собственной иммунной системы человека является центровым механизмом канцерогенеза и приводит к потере системного контроля иммунитета над общим количеством ОК в организме, что сопровождается бурным опухолевым ростом, гипоксией и нарушением функции вовлеченного в неопластических процесс органа или ткани. В данном механизме заболевания представлены и эксплуатируются все основные молекулярно-биологические характеристики рака, которыми оперирует современная онкология. На механизмах уклонения ОК от контроля специализированных киллерных клеток иммунной системы мы остановимся ниже в следующих главах. Но именно недостаточность надзора иммунной системы за «оборотом» ОК в организме человека и считается краеугольной причиной опухолевого роста и возникновения неконтролируемого количества ОК в организме онкологического пациента.
Вообще, наличие ОК и допустимое количество ОК в организме здорового человека является предметом научной дискуссии. По мнению известного американского онколога W.R. Shapiro (1982), в норме, у каждого здорового человека, имеется около 500 000 (5х105) ОК. Их появление обусловлено естественными сбоями и ошибками в процессах физиологической регенерации и естественного самообновления клеток организма человека в саногенезе. Однако собственная иммунная система способна и должна контролировать это количество ОК в организме человека, и рак не развивается, когда у больного сохранны молекулярно-биологические механизмы врожденного и приобретенного противоопухолевого иммунитета а тканеспецифические стволовые клетки способны контролировать ОСК. Установлено, что иммунная система способна самостоятельно распознать и элиминировать опухоль, когда количество клеток в ней не превышает 5х105 клеток (W.R. Shapiro, 1982). При аутопсии людей умерших от несчастных случаев, травмы не совместимой с жизнью или от острой сердечной недостаточности у них находили бессимптомные злокачественные опухоли в виде осункованных объемов значительно большего количества ОК, но генерализации опухоли и метастазирования при этом не отмечалось (Олюшин В. Е. с соавт.,2012). Таким образом, проблема рака и других ЗНО это проблема количественного контроля и надзора клеток иммунной системы в организме больного человека над ОК и ОСК.
Как утверждает W.R.Shapiro (1982), когда количество ОК не превышает более 1х109 (<1 миллиарда), то это состояние диагностируется как «предрак», а когда количество ОК становится больше 1х109, то диагностируется рак. В то же время показано, что после радикальной хирургической операции в организме онкологического пациента остается 1—5 х109 ОК (Арчаков А. И.,2014). Радио- и химиотерапия позволяет в лучшем случае уменьшить количество ОК в организме до 1х107 (Shapiro W.R., 1982, Черных Е. Р. с соавт,2010). Таким образом, что бы ожидать выздоровления, нужно еще, как минимум, на 2 порядка уменьшить количество ОК в организме (Черных Е. Р., Ступак В. В., Центнер М. И. с соавт.,2004). Однако, как утверждает Давыдов М. И. (2017), «однажды пропустив рак, иммунная система пациента вряд ли сможет его догнать…» и начать снова контролировать количество ОК.
Другими словами, современные циторедуктивные хирургические методы лечения опухолей способны удалить количество ОК только до 109, так как ниже этого количества глаз человека не способен различить опухоль даже с использованием микрохирургической техники и флюоресцентных методов интраоперационной диагностики ОК. Химиотерапия (ХТ) и лучевая терапия (ЛТ) опухолей работают в диапазоне от 1х109 до 1х107 ОК на уровне цитостатического и цитотоксического воздействия на ОК. Поэтому при чувствительности опухоли к ХТ и ЛТ проведение дополнительных линий ХТ и ЛТ не целесообразно и научно не обосновано. При количестве ОК от 1 х107 до 1х105 должна работать собственная иммунная система, а точнее её клеточное и гуморальное звено. Поэтому стимулирование иммунной системы иммунопрепаратами и другие современные методы неспецифической и специфической, активной и пассивной адоптивной иммунотерапии (ИТ) рака способны регулировать работу иммунной системы именно в этом диапазоне ОК. Очевидно, что ИТ рака должна являться непосредственным продолжением любой конвенциональной противоопухолевой терапии, направленной на снижение общего количества ОК в организме больного и служить её логичным завершением. Не проведение ИТ онкологическим пациентам обрекает их на высокую вероятность прогрессирования и рецидива заболевания, как только будут вновь сформированы благоприятные условия для выживания ОСК и спящих ОК.
К сожалению, когда в результате проведенного стандартного противоопухолевого лечения (хирургии, ХТ, ЛТ) количество ОК становится ниже 105 клеток, контроль над количеством ОК может быть обеспечен только механизмами клеточной регуляции системами врожденного иммунитета, обеспечивающими жесткий контроль над функциями ОСК и элиминации оставшихся ОК. Можно ли «спротезировать» эти регуляторные иммунные воздействия клеточных систем врожденного иммунитета современными онкоиммунными лекарственными препаратами и добиться достаточной элиминации ОК? Скорее всего, да. Однако, очевидно, что эти попытки искусственного иммунного надзора не способны обеспечить системный контроль над эффекторными функциями ОСК (пролиферацией, миграцией, митозами, метастазированием и т.д.), а также осуществить полное уничтожение оставшихся (резидуальных) ОК в организме больного. Поэтому спонтанное выздоровление или излечение от рака после комплексного противоопухолевого лечения не реально и не возможно, так как в организме больного не мобилизуются фундаментальные механизмы противоопухолевого саногенеза, изучение и понимание которых, может позволить создать новые протоколы иммунокоррекции механизмов врожденного иммунитета (Личиницер М. Р.,2016).
Стоит отметить, что, несмотря на достижения современной науки, по-прежнему актуальным и неразрешенным остается вопрос комбинирования различных подходов с иммунотерапией опухоли и традиционных методов лечения в рамках единой программы для онкологических пациентов. Благодаря данным фундаментальных исследований в онкологии в настоящее время в медицинской среде сформировалось целостное видение особой роли, которую способна играть иммунная система в терапии онкологического процесса. С одной стороны, стимуляция ответа опухолеспецифических иммунокомпетентных клеток способна пресекать, либо существенно ограничивать процесс роста и распространения раковых клеток в организме, однако, с другой стороны, также известно о негативном влиянии микроокружения опухоли, которое напрямую задействует иммунные клетки в патологический процесс и благодаря секреции ряда факторов поляризует иммунокомпетентные клетки в толерантные подтипы, усугубляя злокачественный процесс в организме больного. Это способствует появлению большого количества химио- и радиорезистентных и иммунологически не чувствительных ОК и ОСК, находящихся в «спящем» состоянии.
Исследование «спящего» состояния раковых клеток и изучение их роли в механизмах и последствиях рецидивов и метастазирования рака и других злокачественных новообразований является наиболее важным фундаментальным аспектом изучения биологии рака последнего времени. Проблема заключается в том, что метастазирование болезни и ее рецидивы, появляющиеся спустя несколько лет (даже несколько десятилетий) после хирургической ремиссии у многих больных, перенесших онкологические заболевания, и это воспринимается и обозначается учеными как «спячка» опухоли (tumor dormancy). Однако достоверные знания относительно данного явления до настоящего времени остаются крайне ограниченными. Значительное количество проделанных работ и научных обзоров (Х.Gao et al.2017) суммировали три основные потенциальные модели, которые могут послужить объяснением подобного процесса, и к ним можно отнести ангиогенную спячку, иммунологическую спячку, и клеточную спячку. Очень важно для биологии рака обсудить только что приоткрытые механизмы, лежащие в основе спячки раковых клеток.
Основное внимание в области «спящих» ОК в большинстве работ уделяется взаимовлиянию, происходящему между «спящими» или дормантными раковыми клетками и их микросредой. Кроме того, важно понимать потенциальные механизмы реактивации подобных спящих клеток в определенных анатомических участках организма человека, в том числе в лимфоузлах и костном мозге. Также в подобных процессах важно понимать молекулярный механизм клеточной спячки при раке и других ЗНО.
Как мы уже отмечали выше, рецидивы опухоли и метастазирование при некоторых видах онкогенеза могут возникать спустя годы и даже десятилетия после проведенного лечения, причиняя огромный вред пациентам, и именно они несут ответственность за подавляющее большинство смертельных случаев, связанных с онкогенезом. Неспособность предотвратить и устранять метастазирование ОК, согласно большинству литературных обзоров, представляет собой наиболее существенную трудность, с которой сталкиваются современные врачи-онкологи (Х.Gao et al.2017). Последнее время, обширный временной период, при котором больные остаются бессимптомными до образования метастазов и рецидива, представляет собой период клинических наблюдений, известный как состояние покоя опухоли (опухолевая спячка). Подобное явление в настоящее время попало под пристальное внимание ученых онкологов всего мира. Состояние покоя опухоли впервые было определено R. Willis (Willis R.A. 1934), и затем R. Hadfield (1954) заново охарактеризовал это явление как временную митотическую и ростовую задержку. Митотическая задержка в точности соотносится с дремлющим состоянием клеток, что предполагает факт существования G0-G1 фазы задержки клеточного цикла в каких-либо конкретных раковых клетках (Goss PE, Chambers AF., 2010). Задержка роста ОК означает дремлющую канцерогенную массу, в которой компоненты раковых клеток сохраняются в постоянном количестве за счет баланса между делением клеток и их апоптозом. Помимо того, современные научные источники дают основания для предположения, что сохранение постоянной численности ОК может происходить как вследствие ангиогенной, так и/или иммунологической спячки ОК (Aguirre-Ghiso JA., 2007; Rakhra K, Bachireddy P, Zabuawala T, et al.,2010; Kareva I.,2016). Широко известен тот факт, что остаточные раковые клетки непрерывно сталкиваются с различными сдерживающими рост состояниями во время распространения и туморогенного прогрессирования, как, например, гипоксией, истощением и воздействием химиотерапии (Osisami M, Keller ET.,2013; Rankin EB, Giaccia AJ.,2016). Эти раковые клетки могут секретировать ряд факторов в целях модулирования своих сигнальных путей, имеющих отношение к росту, через механизм взаимовлияния между остаточными раковыми клетками и их микросредой, что приводит к состоянию покоя или пролиферации. Остаточные раковые клетки могут уклоняться от иммунологического надзора и летального воздействия химиотерапии при тяжелых состояниях выживания за счет задержки роста. Тем не менее, они могут покинуть состояние покоя (спячки) и пролиферировать снова в отдаленных органах.
За прошедшие 2 десятилетия, постоянно получаемые научные результаты пролили свет на источники, фенотипы, свойства, хостинг-ниши (ниши хозяина), и сигнальные пути диссеминированных туморогенных клеток (ДТК), которые прогнозируют выживаемость, состояние покоя, и реактивацию минимального остаточного заболевания. Большой объем исследований был выполнен для того, чтобы установить ДТК в качестве избирательных маркеров и инструмента мониторинга, позволяющего идентифицировать раннюю стадию онкогенеза, благодаря их все более возрастающему определению как причины метастатического рецидива. ДТК преимущественно обнаруживаются в костном мозге. Большая часть ДТК продолжает оставаться в состоянии покоя. Подгруппа ДТК, циркулирующая в крови, получила обозначение циркулирующие туморогенные клетки (ЦТК) или циркулирующие ОК (ЦОК), и некоторые выводы указывают на то, что ДТК могут обладать фенотипом, схожим со стволовыми клетками, получившим обозначение ОСК. Наличие ДТК и ЦОК неоднократно отмечалось у бессимптомных больных с меланомой, раком груди, головы и шеи, и другими ЗНО (Wu XL, Tu Q, Faure G, 2010; Hansel G, Schonlebe J, Haroske G, et al.,2010; Lianidou ES, Markou A, Strati A.,2015). Однако по-прежнему неясно, каким образом ДТК и ЦОК сохраняют долгосрочную выживаемость и реактивируют, чтобы сформировать микро-метастазы в отдаленных органах. Недавно, были выявлены основополагающие механизмы ДТК при состоянии покоя опухоли. В данной главе нами уделяется внимание преимущественно механизмам, ответственным за управление покоем раковых клеток, и обсуждается то, каким образом ДТК и их ниша совместно модулируют состояние покоя опухоли при метастатическом прогрессировании онкогенеза. Важно то, что все более возрастающий объем исследований механизмов туморогенной спячки может привнести новые перспективы и надежды для нео-адьювантной химиотерапии и прецизионной медицины, которые оказались бы полезны для пациентов в будущем.
Опухолевые клетки, связанные с состоянием покоя можно подразделить на диссеминированные туморогенные клетки (ДТК), циркулирующие туморогенные клетки (ЦТК или ЦОК) и тумор-локализованные опухолевые стволовые клетки (ТЛ ОСК). Состояние покоя (спячка) опухоли является важнейшим этапом развития, как первичной опухоли, так и метастатической болезни. Хорошо известен факт выживания и сохранения некоторого количества ОСК и ОК на фоне внешне успешно проведенного лечения. Кроме того, ОК и ОСК даже могут они поселяться в отдаленных органах на ранней стадии рака и, в конечном итоге, содействовать рецидивам заболевания (Eyles J, Puaux AL, Wang X, et al.,2010). В 1980-90-х годах были опубликованы новаторские исследования групп Schlimok et al., согласно которым ДТК могут быть рутинно обнаружены в костном мозге больных с разными видами онкогенеза (Schlimok G, Funke I, Hozmann B, et al.,1987) и Riethmuller и Johnson (Riethmuller G., Johnson JP. 1992). Более того, полученные в настоящее время результаты поддерживают предположение о том, что определенные ДТК сохраняют спящее состояние в течение продолжительных периодов времени, что характеризуется нехваткой пролиферирующих маркеров (Ki-67, PCNA), наряду с нехваткой TUNEL метода, что и может лежать в основе устойчивости к обычной химио-радиотерапии (Lohr JG, Adalsteinsson VA, Cibulskis K, et al., 2014, Magbanua MJ, Das R, Polavarapu P, Park JW.,2015). Кроме того, новые маркеры, в том числе NR2F1, DEC2, и p27, недавно позволили выдвинуть предположение о дремлющих ДТК (Fluegen G, Avivar-Valderas A, Wang Y, et al., 2017).
ДТК при различных эпителиальных канцерогенезах, включая рак груди, простаты, толстой кишки, головы и шеи, и другие виды рака, часто укрываются в костном мозге путем хоуминга (Pantel K, Brakenhoff RH, Brandt B., 2008). Также, значительное количество данных позволяет предположить, что ниша костного мозга является пермиссивной (разрешающей) для выживания и сохранения дремлющих ДТК. Однако наблюдается определенная разница между ранними ДТК и поздними ДТК. Поздние ДТК являются очевидно более туморогенными по сравнению с ранними ДТК. В целом, ДТК можно получить путем аспирации костного мозга. Но подобный метод не является универсальным в клинической практике из-за инвазивности. До сих пор, идентификация дремлющих ДТК преимущественно базируется на двух главных методах, к которым относятся иммунологические пробы с использованием моноклональных антител, направленных против гистогенных белков (GFP флюоресценция), и молекулярные пробы на основе полимеразной цепной реакции (ПЦР), которые задействуют тканеспецифические транскрипты (количественная ПЦР).
ЦОК обычно также участвуют в процессе метастатического рецидива и прогрессирования. Выявление ЦОК в периферической крови — рутинная программа, позволяющая идентифицировать пациентов с канцерогенным метастазированием и неблагоприятным прогнозом при раке груди, простаты и прямой кишки (Zhang L, Riethdorf S, Wu G, et al.,2012; Zhang L, Riethdorf S, Wu G, et al., 2013; Zhang T, Armstrong A.J.,2016). Несмотря на их выявление при раке головы и шеи, ЦОК пока еще не получили широкого признания ввиду ограничений, связанных с малыми когортами больных, а также по причине слабого понимания воздействия этих клеток. По этой же причине ЦОК не очень широко применяются в рутинной клинической практике больным (Kulasinghe A, Perry C, Jovanovic L.et al.,2015, Nichols A.C., Lowes L.E., Szeto C.C., et al.,2012). Существуют сведения, что ДТК обладают большей ценностью, по сравнению с ЦОК, с точки зрения разъяснения явления туморогенной спячки. Однако ЦОК легче выявить в периферической крови, и этот метод предположительно влечет меньше вреда для пациентов, по сравнению с выявлением ДТК. Удобство и доступность последовательного анализа периферической крови для выявления ЦОК обладают чрезвычайным потенциалом. Обнаружение и обогащение ЦОК основываются на экспрессии EpCAMs (молекул адгезии эпителиальных клеток), и цитокератинов. Для неинвазивного мониторинга ЦОК в образцах онкологических пациентов, а также для изолирования единичных клеток для высокоточного геномного анализа применяется система CellSearch ®System (Campton D.E., Ramirez A.B., Nordberg J.J. et al.,2015). Небольшие количества ЦОК в периферической крови приведут к развитию передовых технологий и сверхчувствительных методов, которые могли бы улучшить клиническое использование клеток данного вида.
Множество исследователей выявили опухолевые стволовые клетки (ОСК) в ряде солидных опухолях, в том числе раке головы и шеи, простаты, груди, меланоме, толстой кишки и поджелудочной железы (Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al.,2007; Schatton T, Murphy GF, Frank NY, et al.,2008; Adikrisna R, Tanaka S, Muramatsu S, et al.,2012; Moghbeli M, Moghbeli F, Forghanifard MM, Abbaszadegan MR.,2014; Chen X, Li X, Zhao B, et al.,2015) в очень небольшом количестве — 1—2%. ОСК не только играют ключевую роль в инициации онкогенеза и поддержании опухолевого объема, но и свидетельствуют о более агрессивном развитии и неблагоприятном прогнозе (Dionne LK, Driver ER, Wang XJ., 2015). К специфичным маркерам ОСК солидных опухолей преимущественно относятся CD44, CD133, ALDH, и EpCAM (Cohen SJ, Punt CJ, Iannotti N, et al., 2008; Yu M, Ting DT, Stott SL, et al.,2012; Tam WL, Weinberg RA.,2013). Кроме того, CD10 определяется как потенциальный маркер ОСК при плоскоклеточной карциноме головы и шеи (Fukusumi T, Ishii H, Konno M, et al.,2014). Все возрастающий объем данных указывает на то, что подвид ДТК и ЦОК подвергается эпителиально-мезенхимному переходу (EMT), и приобретает стволово-подобный фенотип. Также, этот фенотип ассоциируется с повышенной способностью к миграции и инвазии, и с устойчивостью к аноикозу и апоптозу. Известно, что при плоскоклеточной карциноме головы и шеи, рецептор эпидермального фактора роста (EGFR), рецептор нейротрофина В, и интерлейкин-1В участвуют в эпителиально-мезенхимном переходе (EMT) и присутствуют в популяции ОСК (John MA, Dohadwala M, Luo J, et al.,2009;Kupferman ME, Jiffar T, EI-Naggar A, et al., 2010; Zuo JH, Zhu W, Li MY, et al.,2011). Однако большинство из этих раковых клеток представляются неспособными к прохождению обратного процесса, состоящего в мезенхимально-эпителиальном переходе (MET), способствующего метастазированию (Kang Y, Pantel K.,2013). Команда Chaffer и Weinberg (Chaffer CL, Weinberg RA., 2011) обнаружили, что ОСК обладают чрезвычайно сильным опухоле-инициирующим потенциалом, но временной задержкой роста внутри опухоли. Спячка (состояние покоя) и реактивация ОСК тесно взаимосвязаны с эпигенетическим перепрограммированием этих раковых стволовых клеток (Mascré G, Dekoninck S, Drogat B, et al.,2011; Naik PP, Das DN, Panda PK, et al.,2016). Подвид miRNA смог продемонстрировать свою ответственность за самообновление и дифференциацию ОСК в различных типах канцерогенеза (Chakraborty C, Chin KY, Das S.,2016). При раке ОСК выделяют miR-424, let-7a, miR-6836, и miR-6873 в меньших количествах, чем miR-147b и miR-7152 (Yata K, Beder LB, Tamagawa S, et al.,2015). Известно, что miRNA-34a способна подавлять EMT, активность альдегид-дегидрогеназы, степень инвазивности, и клоногенность ОСК (Sun Z, Hu W, Xu J, Kaufmann AM, Albers AE, 2015, Jia L, Tian Y, Chen Y, Zhang G., 2018) Однако, потенциальные пути, вовлеченные в данные процессы, не были детально описаны, и необходимы дальнейшие будущие исследования. Удивляет тот факт, что продуцирование ОСК при различных раках можно контролировать при помощи стресс-вызванного атавистического перепрограммирования (stress-triggered atavistic reprogramming, STAR), и даже течение злокачественной опухоли может быть сильно обусловлена STAR (Masuda M, Wakasaki T, Toh S.,2016).
Особого обсуждения требуют молекулярные механизмы, лежащие в основе состояния покоя раковых клеток. Состояние покоя раковых клеток можно считать состоянием, являющимся результатом функционирования остаточных ОК, которые испытывают недостаток в пролиферативных и апоптозных маркерах, и которые сохраняются в дремлющим виде без признаков непрерывного роста. В данной главе мы упоминаем лишь некоторые молекулярные механизмы раковых клеток, имеющие отношение к состоянию покоя, а также ряд взаимозависимостей, наблюдаемых между раковыми клетками и их микросредой.
А. Внутриклеточные сигналы. Пути митоген-активированной протеин киназы (Mitogen-activated protein kinase, MAPK). Семейство MAPK (также известное, как путь Ras-Raf-MEK-ERK) имеет первостепенное значение при превращении внеклеточных стимулов в широкий спектр клеточных ответных реакций, и его функции в развитии онкогенеза сложны. Некоторые результаты позволяют предположить, что p38 MAPK сигналинг по сути является палкой о двух концах, так как наделен и хорошими, и плохими аспектами применительно к росту раковых клеток. Р38a негативно регулирует прогрессирование клеточного цикла, такого, как p38y, тогда как p38b индуцирует пролиферацию клеток при плоскоклеточной карциноме (Oeztuerk-Winder F, Ventura JJ.,2011). Более того, ученые под руководством Sosa et al. (Sosa MS, Avivar-Valderas A, Bragado P.et al,2011) сообщают о сниженном (ERK MAPK/p38 MAPK) соотношении сигналинга в спящих HEp3 клетках при карциноме головы и шеи. Затем, этот факт подтвердился для меланомы, фибросаркомы, рака груди, простаты и яичников, где полученные результаты показали, что около 90% линий дремлющих клеток выделяли схожий уровень ERK MAPK/p38 MAPK. Было показано, что изменение в ERK MAPK/p38 MAPK регулируется комплексом uPA-uPAR (активатор плазминогена урокиназного типа соединяется с uPA рецептором) во внеклеточном матриксе (Xue A, Xue M, Jackson C, Smith RC., 2009; Barkan D, Green JE, Chambers AF.,2010; Mazar AP, Ahn RW, O’Halloran TV.,2011; Chery L, Lam HM, Coleman I, et al.,2014). Активированный путь p38 MAPK индуцирует вхождение ДТК в зону задержки роста через активирующий p53 и p16 сигналинг и снижение экспрессии циклин D1 (Sosa MS, Avivar-Valderas A, Bragado P.et al,2011). В общем, баланс равновесия между ERK MAPK и p38 MAPK тесно связан с состоянием покоя раковых клеток, и соотношение ERK MAPK/p38 MAPK может представлять собой ключевой определяющий фактор, ответственный за состояние покоя опухоли. Соответственно, ингибитор p38 следует использовать с осторожностью, так как он несет потенциальный риск для некоторых групп онкологических больных, учитывая, что p38a/b ингибирование после хирургического вмешательства может увеличивать нагрузку, оказываемую ДТК в костном мозге, печени, и селезенке (Bragado P, Estrada Y, Parikh F, et al.,2013).
Третий основной путь MAPK представляет собой Jun N-терминальную киназу (Jun N-terminal kinase, JNK), которая осуществляет функцию, обратную функции p38 MAPK сигналинга, поскольку JNK индуцирует пролиферацию и туморогенез раковых клеток (Sui X, Kong N, Ye L, et al.,2014). Однако большое количество проведенных опытов свидетельствует о противоречивом сценарии, который заключается в том, что для задержки роста необходима активная JNK, и она индуцирует спящее состояние при раке груди (Lotan T, Hickson J, Souris J, et al.,2008). Кроме того, недавно было показано, что митоген-активированная протеин киназа киназа4 (MKK4) может индуцировать временную задержку роста в раковых клетках (Lotan T, Hickson J, Souris J, et al.,2008; Knopeke MT, Ritschdorff ET, Clark R, et al.,2009).
Путь PI3K-AKT-m TOR является еще одним хорошо изученным сигнальным путем в управлении клеточного цикла. Группа ученых под руководством Jo H. описала регулирующую систему, выделяемую раковыми клетками, опосредованную путем PI3K-AKT-m TOR при стрессе дефицита питательных веществ, и показала, что пониженный PI3K-AKT сигналинг может привести к состоянию сна и аутофагии (Jo H, Jia Y, Subramanian KK, et al.,2008). В дальнейшем, подобное явление было подтверждено на спящих клетках плоскоклеточной карциномы (Schewe DM, Aguirre-Ghiso JA.,2008). Индуцируемая глюкокортикоидом лейциновая «молния» (Glucocorticoid-induced leucine zipper, GILZ) представляет собой важную восходящую мишень, расположенную против хода транскрипции PI3K/AKT сигнального пути, и AKT может быть снижен при помощи подавления и репрессии GILZ в дремлющих раковых клетках. Что касается FOXO3A (одного ключевого субстрата, относящегося к пути PI3K/AKT), то он вследствие этого уменьшается, а p21 увеличивается и, в конечном итоге, раковые клетки удерживают дремлющее состояние (Touil Y, Segard P, Ostyn P, et al.,2016). Ингибирование AKT может запускать процесс аутофосфорилирования EGFR, что также может привести к задержке роста раковых клетках (Humtsoe J.O., Kramer RH.,2014).
Б. Внеклеточные сигналы. Семейство трансформирующего ростового фактора-B (TGF-B). Семейство TGF-B является многосоставной цитокиновой сетью, которая модулирует целый ряд жизнеспособных свойств клеток, включая их пролиферацию, морфогенез, миграцию, продуцирование внеклеточного матрикса, секрецию цитокинов, и апоптоз. Исследования, проведенные в последние 2 десятилетия показали, что TGF-b семейство связан с процессами эпителиально-мезенхимного перехода, ангиогенезом и с дремлющим состоянием раковых клеток. Недавно было выдвинуто предположение, что латентный TGF-b-связующий белок 2 (LTBP-2) стимулирует спящего состояние, соответственно, ограничивает метастатический рост и ограничивает пролиферацию при назофарингеальной карциноме и плоскоклеточном раке пищевода. Но, он также может усиливать адгезию (соединение) и миграцию раковых клеток при меланоме. Таким образом, функция LTBP-2 соотносится с конкретными типами опухолей и их окружающей средой (Chen H, Ko JM, Wong VC, et al. 2012). Известно, что TGF-b1 может подавлять прогрессирование опухоли в предраковых состояниях и на ранних стадиях канцерогенеза, но он может стимулировать рост опухоли в распространенных опухолевых образованиях (Zhu H, Luo H, Shen Z, Hu X, Sun L, Zhu X.,2016). Недавно ряд исследователей показали, что TGF-b3 ускоряет рост, миграцию, и инвазию рака головы и шеи за счет индукции матриксно-специфичного белка периостин (POSTN) (Qin X, Yan M, Zhang J, et al.,2016). Однако, повышенная экспрессия TGF-b2 в пределах ниши политрансретиноевой кислоты (atRA) может индуцировать дремлющий фенотип через p38 MAPK-зависимый путь (Sosa MS, Parikh F, Maia AG, et al.,2015). Кроме того, спящее состояние раковых клеток, обсуловленное TGF-b2, также нуждается в AXL и GAS6 (Yumoto K, Eber MR, Wang J, et al., 2016). Когда в метастатическом участке повышается экспрессия Coco (антагонист TGF-b лигандов), раковые клетки избегают дремлющего состояния (Gao H, Chakraborty G, Lee-Lim AP, et al.,2012). По этой причине был сделан вывод о том, что TGF-b семейство воздействует на прогрессирование опухоли парадоксальным образом.
Группа ученых Wendt et al. (Wendt M.K., Taylor M.A., Schiemann B.J., Schiemann W.P.,2011) показала, что мульти-функциональность TGF-b во многом отражает его способность управлять уровнями экспрессии эпителиального кадгерина, являющегося отличительным признаком полностью дифференцированного эпителия, что находит свое отражение в процессе EMT. Тем не менее, основополагающие механизмы скрываются за многосоставными взаимосвязями между разнообразными цитокинами. Так, например, исследование Denys et al. (Denys H, Derycke L, Hendrix A, et al.,2008) доказала на модели канцерогенеза толстой кишки, что раковые клетки оставаются в спящем состоянии и не пролиферируют в экстракте базальной мембраны, которая в основном состоит из различных факторов роста и других компонентов (Barkan D, Kleinman H, Simmons J.L, et al., 2008).
Костные морфогенетические белки (Bone morphogenetic proteins, BMPs). Костный морфогенетический белок 7 (BMP7) является разветвлением семейства TGF-b, его выделяют обычные стромальные клетки костного мозга. Он выполняет разнообразные функции, в том числе формирование структур эмбрионального паттеринга и органогенеза, а также тканевое перемоделирование и восстановление, в особенности скелетной ткани. Ранее, было показано, что BMP7 индуцирует низкий уровень ERK MAPK/p38 MAPK сигнального соотношения в дремлющих HEp3 (Sosa MS, Avivar-Valderas A, Bragado P et al.,2011). Кроме того, недавно было выявлено, что BMP7 может индуцировать спящее состояние ОСК за счет активации p38 MAPK, р21, и N-myc гена 1, регулируемого ниже по потоку (N-myc downstream-regulated gene1, NDRG 1), способом, зависимым от рецептора 2 BMP (BMPR 2-dependent manner). Нокдаун BMPR2 приводит к ингибированию активации BMP7, и обнаружилось, что BMPR2 экспрессия имеет обратную взаимосвязь с рецидивом канцерогенеза и костным метастазированием (Kobayashi A, Okuda H, Xing F, et al.,2011). По этой причине, представляется возможным существование спящего состояния в раковых клетках, обусловленное и зависимое от BMPR2 и индуцируемое BMP7. Группа Buijs et al. (Buijs J.T., Henriquez N.V., van Overveld P.G. et al.,2007) разработала гипотезу об антагонистической роли, которую играет BMP7 в Smad-опосредованных воздействиях, оказываемых TGF-b, и предположила, что BMP7 может выступать в качестве перспективной мишени для ингибирования локального прогрессирования канцерогенеза и метастазирования ОК в кости. Однако BMP7 также может индуцировать мезенхимно-эпителиальный переход — процесс, доказавший свое критическое значение для прогнозирования прорастания раковых клеток в макро-метастазы. Следовательно, BMP7 способен усиливать рост раковых клеток при прогрессирующих стадиях метастазирования (Na YR, Seok SH, Kim DJ, et al.,2009). Fang et al. в своем исследовании (Fang WT, Fan CC, Li SM, et al., 2014) обнаружили, что снижение экспрессии BMP4 за счет повышенной концентрации SOX2 может способствовать росту раковых клеток. Помимо того, сайленсинг (отключение) SOX2 может выступать в роли посредника для спящего состояния раковых клеток, и этот процесс сопровождается повышением экспрессии BMP4.
Ниша стромальных клеток, происходящих из костного мозга (BM-derived stromal cell niche). Понятие о нише гемопоэтических стволовых клетках (ниша ГСК,) впервые было предложено исследователем Schofield (Schofield R.,1978). Гемопоэтические стволовые клетки (ГСК) преимущественно располагаются в костном мозге, и ниша ГСК является благодатной почвой для выживания и развития диссеминированных туморогенных клеток. Серьезная работа, проделанная Schiozawa еt al. (Shiozawa Y., Pedersen E.A., Havens A.M., et al.,2011) показала, что ДТК могут быть нацелены на ГСК и смещать их, а также устанавливать пре-метастатическую нишу в пределах этого нового дома. Происходящие из кровеносных сосудов сигналы могут модулировать дремлющий фенотип ДТК в некоторых моделях опухолей. Так, например, оказалось, что протеин-1 васкулярной клеточной адгезии (vascular cell adhesion protein-1, VCAM-1) способен прогнозировать метастатическое прогрессирование за счет своего взаимодействия с интегрином -a4B1, выделяемым в остеокластах (Lu X., Mu E., Wei Y., et al.,2011). Очевидно, что ниша ГСК не только способствует выживанию ДТК, но и может являться опасным элементом для реактивации ДТК. Предполагается, что atRA представлены в изобилии в костном мозге и периваскулярной нише, и могут регулировать процесс обновления ГСК (Ghiaur G, Yegnasubramanian S, Perkins B, et al.,2013). В этой связи, существует единое мнение, что atRA вносят объединенный вклад в состояние покоя раковых клеток с вовлечением TGF-b2 и BMP7 в костном мозге (Linde N., Fluegen G., Aguirre-Ghiso J.A.,2016). Обработка T-HEp3 клеток с применением atRA приводила к индукции повышенной экспрессии NR2F1-RARa-SOX9 сигналирования и TGF-b2, что, в конце концов, заставляло раковые клетки принимать форму состояния покоя (Sosa M.S., Parikh F., Maia A.G., et al.,2015).
Остеобласты и остеокласты в костном мозге могут секретировать многие связанные с внеклеточным матриксом факторы, для того, чтобы управлять состоянием покоя и реактивации метастазирования. Недавно выполненные работы показали, что клетка рака простаты выделяет рецептор аннексина 2, который может соединяться с аннексином 2, выделяемым остеобластами. Кроме того, подобное соединение может индуцировать экспрессию AXL, Sky, и Mer, и в конечном итоге, индуцировать спячку раковых клеток через AXL-GAS6 сигнальный путь. Было доказано, что превращение отдельных единичных ДТК клеток в спящую раковую клетку регулируется AXL-GAS6 сигнальным путем, в то время как раковые клетки, быстро прорастающие в среде костного мозга, могут выделять меньшее количество GAS6 (Shiozawa Y., Pedersen E.A., Patel L.R., et al.,2010; Jung Y., Shiozawa Y., Wang J., et al.,2012; Jung Y., Decker A.M., Wang J., et al.,2016). Однако, группа Cackowski et al. (Cackowski F.C., Eber M.R., Rhee J., et al.,2017) провела дальнейшее изучение Mer тирозин киназы (Mer tyrosine kinase, MERTK), в ДТК рака простаты, и выявила, что нокдаун MERTK индуцирует низкое пропорциональное соотношение ERK MAPK/p38 MAPK, повышенную экспрессию NR2F1 и p27, а также блокировку (арест) G0-G1. По сравнению с AXL, у Tyro3 (подсемейство AXL), повышена экспрессия в более пролиферативных раковых клетках первичной опухоли, а высокие концентрации Tyro3 рассматриваются как маркер неблагоприятного прогноза при раке простаты (Taichman R.S., Patel L.R., Bedenis R., et al.,2013). Кроме того, Fra-1, который разделяет 50% корреляционного соотношения ко-экспрессии с AXL, производит высокую долю экспрессии во многих видах рака. Но сверх-экспрессия Fra-1 может непосредственным образом лишать ОСК состояния покоя, тем самым стимулируя химиочувствительность раковых клеток (Lu D., Chen S., Tan X., et al.,2012). Более того, группа Kim et al (Kim J.K., Jung Y., Wang J., et al.,2013) обнаружила, что соединение с остеобластами может вызывать экспрессию TANK-соединительной киназы 1 (TBK 1) в ДТК, что ингибирует mTOR и, в конечном итоге, приводит к блокировке клеточного цикла.
Эксперименты in vivo позволили выявить, что дремлющие раковые клетки обычно располагаются вблизи от периваскулярной ниши. Помимо того, низкие концентрации POSTN и TGF-b1 могут способствовать тому, чтобы ДТК оставались в дремлющем состоянии (Ghajar C.M., Peinado H., Mori H. et al.,2013). Предположительно, мезенхимные стволовые/стромальные клетки (МСК) вначале сталкиваются с ДТК в пределах костного мозга, так как они анатомически расположены в аблюминальной поверхности центральной сосудистой сети (Corselli M., Chin C.J., Parekh C., et al.,2013). Работы, выполненные группой Bliss et al (Bliss S.A., Sinha G., Sandiford O.A., et al.,2016) показали, что ДТК могут приказывать МСК выпускать экзосомы, наделенные какими-либо конкретными микроРНК (miRNAs), такими, как miR222/223 и miR23b, что приводит к цикличной спячке некоторых ДТК (Ono M., Kosala N., Tominaga N., et al.,2014). Любопытен факт, что каннибализм МСК в костном мозге с недавних пор может представлять собой уникальных механизм, поддерживающий и сохраняющий спящее состояние раковых клеток, используя переход ингибиторных микроРНК клеточного цикла через щелевые контакты и/или экзосомы (Lim P.K., Bliss S.A., Patel S.A., et al.,2011; Bartosh T.J., Ullah M., Zeitouni S., et al.,2016). Следовательно, МСК могут быть перспективным «инструментом» модулирования спящего состояния раковых клеток внутри костного мозга.
Гипоксия и состояние покоя раковых клеток. Гипоксия часто происходит в солидных опухолях человека, и её окружающая среда ассоциируется с неблагоприятной выживаемостью и повышенной метастатической активностью, а также отеком опухоли у больных с различными онкопроцессами, включая мультиформную глиобластому, а также раки головы-шеи, простаты, шейки матки, груди, и т. д. (van den Beucken T., Koch E., Chu K., et al.,2014; Hoskin P.J., 2015 Gilkes D.M., 2016). В условиях низких концентраций давления кислорода, раковые клетки обладают предрасположенностью к приобретению инвазивных свойств и распространению в отдаленные участки за счет гипоксии-ассоциированной транскрипционной активации, в том числе гипоксия-индуцируемого фактора (HIF), транскрипционных регуляторов, mTOR комплекса 1, аутофагии, стрессовых реакций эндоплазматического ретикулума, и т. д. (Qiu B., Simon M.C.,2015; Johnson R.W., Schipani E, Giaccia A.J.,2016). Также, появляется все больше предположений о том, что гипоксия ответственна за терапевтическую сопротивляемость как к химиотерапии, так и лучевой терапии, поскольку в подобной микросреде раковые клетки могут оставаться длительное время в состоянии спячки или блокировки роста. Так, например, белок forkhead box M1 (FOXM1), который появляется в качестве регулятора клеточной окислительно-восстановительной реакции и ответной реакции на облучение, был обнаружен в гораздо меньших концентрациях в дремлющих раковых клетках, чем в пролиферирующих раковых клетках (Eckers J.C., Kalen A.L., Sarsour E.H., et al.,2014). Эти результаты помогают понять базовый механизм, посредством которого раковые клетки входят в состояние покоя или реактивируются за счет гипоксической среды (Bragado P., Sosa M.S., Keely P. et al,2012). Группа A. Msaki et al (Msaki A., Pasto A., Curtarello M., et al.,2016) обнаружила, что HIF-1a в поздних ДТК рака молочной железы производил сильную экспрессию, и ученые предположили, что HIF-1a благоприятствовал усилению туморогенных качеств ДТК. Интересно, что есть сообщения о том, что обусловленная гипоксия может вызывать экспрессию эндогенного LOXL2, а затем стимулировать EMT в спящих MCF-7 клетках, заставляя эти клетки выделять фенотипы, схожие с раковыми стволовыми клетками, и, в конце концов, переходить из спящего состояния к метастатическому прорастанию (Weidenfeld K., Schif-Zuck S., Abu-Tayeh H. et al.,2016). Предположительно, гипоксия индуцирует активность аутофагии в том виде, который обуславливается действием HIF-1a, и данный процесс может приводить к состоянию временной спячки на ранней стадии канцерогенеза или к терапия-индуцируемой микросреде при раке (Zhang H, Bosch-Marce M, Shimoda LA, et al.,2008; Gammon L, Biddle A, Heywood HK, et al.,2013 Gammon L, Mackenzie IC.,2016). Рецептор фактора ингибирования лейкемии (LIF), лиганд LIF, принадлежащий к IL-6 семейству про-воспалительных цитокинов, недавно был признан подавляющим фактором (супрессора) отдаленного метастазирования рака и промоутера дремлющих раковых клеток (Chen D., Sun Y., Wei Y., et al.,2012; Iorns E., Ward T.M., Dean S., et al.,2012; Johnson R.W., Finger E.C., Olcina M.M., et al.,2016). Гипоксия может индуцировать свободный выход из спящего состояния у ДТК в костном мозге, и их ре-активацию посредством снижения экспрессии LIFR: STAT3:SOCS3 сигнального пути (Johnson R.W., Finger E.C., Olcina M.M., et al.,2016). Кроме того, гипоксия может повышать uPAR экспрессию, что запускает диссеминацию раковых клеток, их инвазию, EMT, и исход из состояния покоя с помощью сигнального пути ERK MAPK/p38 MAPK (Gonias S.L., Hu J.,2015).
При другом сценарии, однако, гипоксия, по-видимому, приводит к супрессии инвазии и прогрессирования рака, индуцируя состояние спячки у раковых клеток. Так, например, член 1 А семейства гипоксия-индуцируемого генного домена (hypoxia-inducible gene domain family member 1A, HIGD1 A), может стимулировать выживание и спящее состояние в виде, который независим от действия HIF (Ameri K, Maltepe E.,2015; Ameri K, Jahangiri A, Rajah AM, et al.,2015). Исследования подтвердили, что тяжелая форма гипоксии также может вызывать действие протеин фосфатазы 2А (protein phosphatase 2A, PP2A), которое опосредует ингибирование роста, и PP2A находится в положительной корреляции с экспрессией HIF-1 (Hofstetter C.P., Burkhardt J.K., Shin B.J., et al.,2012). Более того, было показано, как гипоксия повышает экспрессию маркеров спящего состояния, в том числе NR2F1 и DEC2 (Sosa M.S., Parikh F., Maia A.G., et al.,2015). В этой связи, необходимы дальнейшие исследования, чтобы проверить, может ли гипоксия стимулировать или ингибировать спящее состояние ДТК.
Региональное метастазирование в лимфоузлы и отдаленное метастазирование являются двумя основными моделями метастазирования у больных эпителиальным онкогенезом. Помимо того, считается, что метастазы в лимфоузлы представляют собой наиболее распространенное и неблагоприятное явление у больных плоскоклеточной карциномой головы и шеи, что снижает выживаемость на 50% (Arosio AD, Pignataro L, Gaini RM, Garavello W.,2017). Известно, что туморо-индуцируемый лимфатический ангиогенез участвует в росте опухоли и метастазировании, не только в первичном участке, но и в лимфоузлах, и отдаленных участках (Achen M.G., Stacker S.A., 2008; Sleeman J.P., Thiele W., 2009). Группа Beasley et al (Beasley N.J., Prevo R., Banerji S., et al.,2002) представила данные о том, что активное лимфатическое формирование происходило в более инвазивных опухолях, а высокая концентрация внутри-туморальных лимфатических сосудов существенным образом соотносилась с метастазированием шейных лимфоузлов. Аналогично этому, отмечается, что опухолевый лимфатический ангиогенез инициирует лимфатическое метастазирование (Okada Y., 2010). Значительный объем полученных данных позволяет сделать вывод о том, что туморогенные клетки, проникшие и укрывающиеся в костном мозге больных раком груди и раком головы-шеи, сохранялись в состоянии покоя (Schlimok G., Funke I., Hozmann B. et al.,1987). Несмотря на наличие очевидных различий в биологии между этими двумя видами раковых клеток, схожие показатели микро-метастазирования (30%-40%) были выявлены в костном мозге больных раком груди и плоскоклеточной карциномой головы и шеи. Соответственно, возникает резонный вопрос о вероятности существования некоторых дремлющих раковых клеток, заселяющих лимфоузлы больных раком, которые могут быть ответственны за лимфатический ангиогенез, метастазирование лимфоузлов, и даже за отдаленное метастазирование. Кроме того, наличие скрытых (латентных) лимфоузлов при раке может также объясняться подобным развитием событий.
Мобилизация дендритных клеток костного мозга (ДККМ) и их рекрутинговое направление в метастатические ниши, осуществляемое факторами опухоли, представляют собой потенциальные механизмы метастазирования в лимфоузлы и тумороиндуцированного лимфатического ангиогенеза, которые можно заметить при клиническом наблюдении после периодов спячки. Например, VEGF-A (фактор роста сосудистого эндотелия-А) не просто напрямую мобилизует ДККМ, но и косвенно рекрутирует их в метастатические участки через индукцию экспрессии провоспалительных цитокинов S100A8 и S100A9. Кроме того, этот процесс, в свою очередь, вызывает экспрессию белков сыворотки амилоида А (Hiratsuka S, Watanabe A, Sakurai Y, et al.,2008; Achyut BR, Shankar A, Iskander A.S. et al.,2015). Факторы VEGF-C и VEGF-D являются еще двумя членами семейства VEGF, которые также инициируют пролиферацию локальных лимфатических сосудов. Подобный тумороиндуцируемый лимфатический ангиогенез затем может быть вызван внутри- или перитуморально, даже на расстоянии, используя отдаленные дренирующие лимфатические системы (Sleeman J., Schmid A., Thiele W., 2009). Однако остается неочевидным, могут ли опухолевые факторы, приводить к реактивации дремлющих раковых клеток в лимфоузлах раковых больных.
Лимфоузлы часто насыщены воспалительной микросредой по причине их анатомического расположения, и недавний доклад группы De Cock et al (De Cock J.M., Shibue T., Dongre A. et al.,2017) объяснил потенциальное воздействие воспаления на спящие ДТК. Ученые заметили, что выход из спящего состояния ОК обусловлен Zeb 1, который является ключевым регулятором EMT, так что существует большая вероятность того, что другие воспалительные стимулы могут схожим образом способствовать выходу из дремлющего состояния.
ОСК также могут способствовать туморо-индуцируемому лимфатическому ангиогенезу с помощью прямой трансдифференциации в лимфатические эндотелиальные клетки и выработки различных лимфатических ангиогенных факторов. Понимание основополагающих механизмов спящего состояния раковых клеток в дренирующих лимфоузлах и отдаленного метастазирования улучшит прогнозирование и выживаемость больных раком и другими ЗНО. Деактивация ДТК в лимфоузлах, инициация спящего состояния с помощью таргетирования опухолевых факторов, представляет собой перспективную нео-адьювантную химиотерапию, которая может стать одним из разделов прецизионной иммунотерапии.
Состояние покоя опухоли и связанные с ним раковые клетки в настоящее время привлекли пристальное внимание ученых онкологов вследствие их свойств, способствующих метастазированию и рецидивам. Работы, обсуждаемые ранее, в основном изучали молекулярные механизмы дремлющих раковых клеток, и предоставили часть каркаса идей, позволяющего понять процесс опухолевой спячки. Раковые клетки, имеющие отношение к состоянию покоя, являются источниками и причиной метастазирования и рецидива, и к ним относятся ДТК, ЦТК, и ОСК. Кроме того, объем собранных доказательств позволяет сделать вывод, что подавляющее большинство из них может входить в состояние сна — временно или постоянно. Удивляет тот факт, что Фторурацил (fluorouracil) — наиболее часто применяемый препарат для лечения рака — оказался фактором, повышающим бремя и груз дремлющих раковых клеток и обогащающий популяцию ОСК, а эти клетки, в свою очередь, имеют отношение к устойчивости к химиотерапии (Kleffel S., Schatton T.,2013; Dai Y., Wang L., Tang J., et al., 2017). Также, было показано, что гормональная терапия стимулирует производство опухолевых стволовых клеток при люминальном раке груди (Sansone P., Ceccarelli C., Berishaj M. et al.,2016). Поэтому, существует необходимость подтверждения воздействия определенных видов лекарственной терапии.
В данной главе обсуждались внутриклеточные, внеклеточные, и происходящие из костного мозга факторы, которые сопричастны с системой регуляции спячки, и суммировался целый ряд потенциальных терапевтических мишеней. Также, обсуждались взаимодействия между раковыми клетками и их нишей. Кроме того, выдвигались предположения относительно ключевого взаимовлияния, происходящего между метастазированием лимфоузлов и состоянием покоя опухоли. Механизмы, лежащие в основе спячки раковых клеток, смогут предложить новый взгляд на сложную биологию рецидивов и метастазов, где будут учитываться важные выводы в отношении клинического лечения онкологических больных — либо искоренять дремлющие раковые клетки, либо оставлять их. Более того, поддержание состояния покоя раковых клеток может быть недостаточно, но оно также необходимо и для подавления их выживания. Так, например, сочетание Src ингибитора и ERK MEK ингибитора рекомендуется для предотвращения рецидива рака груди (El Touny L.H., Vieira A., Mendoza A., Khanna C et al.,2014). Тем не менее, некоторые работы также предлагают пробуждать спящие раковые клетки до состояния клеточного цикла и, в конечном итоге, устранять их в большем количестве. Например, при плоскоклеточном раке головы-шеи, LB1, являющийся ингибитором PP2A, может усиливать цитотоксическую чувствительность к лучевой или химиотерапии в дремлющих раковых клетках посредством их стимулирования от состояния спячки до клеточного цикла (Zhu DW, Yuan YX, Qiao JK, et al.,2015). Нокдаун TBK1 также снижает количество спящих раковых клеток и уменьшать лекарственную устойчивость. Это позволяет идентифицировать важнейших игроков и более восприимчивые молекулы, управляющие покоем раковых клеток и которые, в конце концов, смогут принять форму новейших терапевтических мишеней. В этой связи, представляется перспективным ожидать, что состояние покоя раковых клеток может стать «Троянским конем» терапии рака в целом, и иммунотерапии рака в частности. Однако для этого нужна новая стратегия отечественной онкологии, которая будет учитывать последние достижения геномики рака (секвенирование генома и транскриптомику), опираться на современные протеомные и метаболомные исследования ОК и теоретические концепции раковой стволовой клетки, теорию дермантных ОК и другие теории канцерогенеза.
Глава 2. Иммунная система человека: ресурсы и возможности противоопухолевой защиты
2.1. Врожденный и приобретенный иммунитет
В этой главе монографии будет целесообразно и необходимо напомнить о современных научных взглядах на устройство иммунной системы и существующих представлениях об основных клеточных и гуморальных звеньях иммунной системы у человека, а также обсудить роль и значение этих звеньев иммунитета в защите от возникновения злокачественных опухолей и рака в организме человека. Эти традиционные представления об устройстве и фундаментальных звеньях иммунной системы человека очень важны для дальнейшего понимания предлагаемых нами клеточных и гуморальных изменений и инноваций, которые мы планируем внести в иммунную систему онкологического пациента для повышения её противоопухолевой функции. Поэтому мы напомним, уже известные и вроде бы очень понятные, но в то же время такие сложные научные понятия как «врожденный» и «приобретенный» иммунитет человека. Также необходимо поговорить о существующих подсистемах врожденного и приобретенного иммунитета человека и оценить их возможности и ресурсы в формировании противоопухолевой защиты здоровых клеток органов и тканей организма человека в свете накопленных данных за последнее десятилетие.
Очевидно, что на протяжении многих миллионов лет существования жизни на Земле природа и эволюция создавала сложную, но достаточно надежную систему защиты млекопитающих и человека, получившую название иммунной системы (Галактионов В. Г., 1998; H.Schreiber.,2003). Основной задачей этой сложной иммунобиологической системы было и является до настоящего времени создание и поддержание условий для того, чтобы конкретный организм человека не погиб, а смог выжить под воздействием агрессивных и повреждающих экстремальных факторов внешней среды или эндогенных поражающих воздействий (H.Schreiber.,2003, Ахматова Н. К., Киселевский М. В.,2008). Это значит, что под контролем иммунной системы человека находится функционирование почти всех органов и систем организма (Lamb L.S. Jr., Lopez R.D.,2005). Но существуют и определенные иммунопривилегированные органы и ткани, где защитные возможности иммунной системы целенаправленно ограничены: головной и спинной мозг, органы репродукции (яички у мужчин, яичники у женщин, семенники), глаза и т. д. (Малашхия Ю. А.,1986; Чехонин В. П., Гурина О. И., Дмитриева Т. Б.,2007). Создание иммунопривилегированных тканей и органов в организме человека реализовано определенными гемато-тканевыми барьерами, как например, гемато-энцефалический барьер в центральной нервной системе (ЦНС) (Бредбери M., 1983; Малашхия Ю. А.,1986; Чехонин В. П. с соавт,2014), куда доступ гуморальных факторов и большей части эффекторных клеток иммунной системы резко ограничен или полностью запрещен для сохранения видового генотипа, видо- и органоспецифичности тканей этих органных структур организма и их надежного функционирования (Галактионов В. Г., 1998; Феофанова Н. А., Орловская И. А., Козлов В. А., 2009). Однако, это скорее исключение, чем правило. Прежде всего, природе и эволюции было важно, чтобы организм не погибал от инфекционных заболеваний, эпидемий, которые уносили тысячи, а иногда и миллионы жизней людей и которые развивались под влиянием патогенных экзогенных инфекционных возбудителей и вирусов, либо эндогенных, тех, которые населяют организм и относятся к так называемым сапрофитам (H.Schreiber.,2003; Киселевский М.В,2014, Давыдов М. И.,2017).
Общую систему иммунитета можно разделить на два больших отдела, совместное функционирование которых, создает очень мощную, имеющую несколько звеньев, защиту: врожденный неспецифический (естественный) иммунитет (неспецифические факторы естественной резистентности) и приобретенный специфический (адаптивный) иммунитет (Humphries C.,2013, Тупицын Н.Н, Гривцова Л. Ю.,2016). При возникновении необходимости защитить организм человека, например при попадании в него инфекционного возбудителя, в первую очередь на его защиту вступают факторы врожденного (естественного) иммунитета (H.Schreiber.,2003; Д. Г. Заридзе,2004; Ахматова Н. К., Киселевский М. В.,2008), которые в дальнейшем формируют иммунный ответ с использованием адаптивных иммунных механизмов.
Гуморальный компонент иммунитета. Важным звеном врожденного (естественного) иммунитета является гуморальный компонент. Что же входит в понятие гуморального компонента врожденного неспецифического (естественного) иммунитета? Как представлено в Интернете на одном из специализированных сайтов (http://www.eurolab.ua/encyclopedia/immunology-and-allergy/47652/), определение врожденного иммунитета включает в себя, прежде всего, механические барьеры и физиологические факторы, которые препятствуют проникновению инфекционных агентов в организм человека. К ним относятся неповрежденная кожа, различные секреты, покрывающие эпителиальные клетки и предотвращающие контакт между разнообразными патогенами и организмом. К факторам естественной резистентности можно отнести слюну, слезы, мочу, мокроту и другие жидкие среды организма, которые способствуют выведению микробов (Ярилин А. А.,2010). Сюда же относятся и слущивающиеся с поверхности кожи клетки эпителия, ворсинки эпителиальных клеток дыхательных путей и т. д. (Ахматова Н. К., Киселевский М. В.,2008)
К неспецифическим факторам резистентности можно отнести такие физиологические функции, как чихание, рвота, понос, которые также способствуют выведению патогенных агентов из организма. Сюда же следует отнести такие физиологические факторы, как температура тела, концентрация кислорода, гормональный баланс. Этот последний фактор имеет большое значение для иммунного ответа. Например, увеличение продукции кортикостероидов в организме человека подавляет воспалительные процессы и снижает резистентность организма к инфекции. Известно, например, что при аутоиммунных заболеваниях или кризах отторжения пересаженных органов под влиянием лечения большими дозами кортикостероидов у пациентов развивается повышенная чувствительность к инфекционным агентам (Шумаков В. И., 2010; Schreiber Н.,2003; Vesely M.D., Kershaw M.H., Schreiber R.D., Smyth M.J.,2011).
Давно известно, что нормальная или интактная сыворотка крови способна убивать и лизировать многие грамотрицательные бактерии. Это объясняют в первую очередь присутствием в сыворотке так называемых естественных антител. Эти естественные антитела, связываясь с попадающими в организм микробами, способствуют активации системы комплемента и разрушению таких микробов. Известно, что стенка (мембрана) бактериальной клетки состоит из двух слоев. Наружный слой содержит липополисахариды, а внутренний — пептидо-гликаны. Антитела и комплемент (за счет его эстеразной активности) разрушают липополисахаридный слой бактериальной клетки-мишени, после чего с помощью лизоцима, который присутствует в сыворотке крови, разрушается пептидогликановый слой (Галактионов В. Г.,1998).
Важным гуморальным (сывороточным) фактором врожденного (естественного) иммунитета является пропердин — белок, который отличается от естественных антител и комплемента. Он активирует систему комплемента по альтернативному пути. Следующим фактором врожденного иммунитета служит бета-лизин — антибактериальный белок, который высвобождается из тромбоцитов при их разрушении. Он является активным первичным защитным фактором против грамположительных бактерий (Ярилин А. А.,2010).
Важную роль в антимикробном врожденном гуморальном иммунитете играют интерфероны — белки, которые продуцируются вирус-инфицированными клетками и защищают другие клетки данной области от инфицирования вирусом. Вырабатывающиеся в пораженной клетке интерфероны индуцируют у клеток-соседей продукцию антивирусных белков, которые воздействуют на транскрипцию вирусной м-РНК (матричной), подавляя, таким образом, репликацию вируса. Различают три типа интерферонов: альфа-интерферон, который секретируется лейкоцитами и индуцируется вирусами или синтетическими полинуклеотидами; бета-интерферон, секретируемый фибробластами и продуцируемый под влиянием вирусов или синтетических полинуклеотидов; гамма-интерферон, или иммунный, который секретируется Т-лимфоцитами (хелперами 1-го типа) после стимуляции специфическим антигеном.
Еще одним фактором, который определяет антимикробную гуморальную активность, является лактоферрин. Это белок, обладающий способностью связывать железо, необходимое для метаболизма бактериальной клетки. Подобным образом «работает» и трансферрин — сывороточный бета-глобулин, который содержится в фагоцитах. В слюне и материнском (грудном) молоке имеется также лактопероксидаза, механизм действия которой подобен миелопероксидазе, являющейся микробиоцидным агентом. И, наконец, лизоцим (мурамидаза), который имеется не только в клетках, но и в жидких средах организма — слезах, слюне, назальном секрете и др., и, как известно, обладает большой активностью по отношению к различным бактериям (Ярилин А. А.,2010)..
Далее можно выделить химические и биохимические реакции, подавляющие инфекцию в организме. К факторам неспецифической защиты с таким действием относятся продукты жизнедеятельности сальных желез, содержащие антимикробные факторы в виде жирных кислот; фермент лизоцим, который содержится в различных секретах организма и обладает способностью разрушать грамположительные бактерии; низкая кислотность некоторых физиологических секретов, препятствующих колонизации организма различными микроорганизмами. Например, кислая рН мочи, влагалищного секрета, желудочного сока поддерживает способность противостоять патогенным микроорганизмам (Ахматова Н. К., Киселевский М. В.,2008; Ярилин А. А.,2010; H.Schreiber.,2003).
Клеточный компонент иммунитета. Важным звеном врожденного (естественного) иммунитета является также клеточный компонент. Этот компонент состоит из целого комплекса различных иммунокомпетентных клеточных систем, о которых мы поговорим ниже.
Гемопоэтическая стволовая клетка — родоначальница клеточного иммунитета. Во главе всей клеточной иерархии врожденного иммунитета стоит гемопоэтическая стволовая клетка (ГСК) (Феофанова Н. А., Орловская И. А., Козлов В. А., 2009; Ярилин А. А., 2010, H.Schreiber.,2003; Tupitsin N.N., Yaryghin V.N., Grivtsova L. Yu. et al.,2006; Eaves, C.J.,2015). Это общая родоначальная клетка всех клеток крови, которая является полипотентной стволовой клеткой (СК) крови. Она способна к дифференцировке, может дать начало роста любым форменным элементам крови и способна к длительному самоподдержанию (Thomas E.D., 2000,2005; Blume K.G., E.D. Thompson,2000; Tupitsin N.N., Yaryghin V.N., Grivtsova L. Yu. et al.,2006; Benz C.,Copley M.R., Kent D.G.et al.2012; Владимирская Е.Б.Румянцев А.Г.,2002;Пальцев М. А.,Иванов И. П.,Скверин С. Е.,2003; Брюховецкий А. С. с соавт.,2015). Этот процесс называется кроветворением или гемопоэзом (Тупицын Н. Н.,2016; Гривцова Л. Ю.,2017). Каждая стволовая кроветворная клетка (СКК) или ГСК при своем делении превращается в две дочерние клетки, одна из которых включается в процесс пролиферации, а вторая идет на продолжение класса полипотентных клеток (Гривцова Л. Ю.,2016). Дифференцировка ГСК происходит под влиянием гуморальных факторов (Тупицын Н. Н.,Гривцова Л. Ю.,2017; Eaves, C.J.,2015). В результате развития и дифференцировки разные клетки приобретают морфологические и функциональные особенности. В результате деления ГСК образуется миелоидный предшественник и лимфоидная стволовая клетка (Benz C.,Copley M.R., Kent D.G.et al.2012; Феофанова Н. А., Орловская И. А., Козлов В. А., 2009; Гривцова Л. Ю.,2016; Тупицын Н. Н.,2017). Дальнейшая дифференцировка клеток крови из ГСК в процессе гемопоэза формирует все известные клетки крови, и часть из них, составляют элементы иммунной системы (Blume, K.G., E.D. Thompson,2000;Tupitsin N.N., Yaryghin V.N., Grivtsova L. Yu. et al.,2006; Тупицын Н. Н.,2017).
Следующим компонентом клеточной системы врожденного иммунитета является гетерогенная клеточная составляющая или клеточное звено, которое включает мононуклеарные фагоциты (моноциты, тканевые макрофаги), гранулоциты — нейтрофилы, эозинофилы, базофилы (периферической крови и тканевые, или тучные клетки), а также киллерные клетки — естественные (натуральные) киллерные (NК-клетки), просто киллерные (К-) и лимфокин-активированные киллерные клетки (ЛАК-клетки) (Ахматова Н. К., Киселевский М. В.,2008; Киселевский М. В.,2014; Тупицын Н. Н., Гривцова Л. Ю., 2016; Тупицын Н. Н.,2017).
Мононуклеарные фагоциты. Клетки системы мононуклеарных фагоцитов (моноцитарно-макрофагальной системы) выполняют в организме двоякую функцию. С одной стороны, они участвуют в непосредственной защите организма от чужеродных веществ, главным образом за счет фагоцитоза и антител зависимого уничтожения (киллинга). Эти функции моноцитов и тканевых макрофагов реализуются в рамках врожденного неспецифического иммунитета. С другой стороны, клетки моноцитарно-макрофагальной системы способны взаимодействовать с лимфоидными, «включая» и «регулируя» механизмы специфического адаптивного иммунитета (С.E.Grossi,2000; J-.F.Rossi,2017). Эти функции моноцитарно-макрофагальные клетки выполняют за счет способности представлять чужеродный антигенный материал Т-лимфоцитам для распознавания и продуцировать цитокины (Селедцов В. И. с соавт.,2013; Тупицын Н. Н.,2017; J.-F.Rossi, 2017; Schreiber H.,2003).
Ахматова Н. К., Киселевский М. В. (2008) считают, что функции моноцитов в организме следующие: 1. Фагоцитарная защита против микробной инфекции. По сравнению с нейтрофилами особенность фагоцитоза моноцитов заключается в том, что моноциты наиболее активно фагоцитируют в кислой среде, т.е. принимают эстафету от нейтрофилов, обеспечивая защиту при хронизации процесса, когда в очаге воспаления накапливаются недоокисленные продукты обмена; 2. Участвуют в формировании иммунного ответа: а) участвуют в передаче «обоймы антигенов» от Т-лимфоцитов В-лимфоцитам; б) фагоцитируют излишки антигена; в) секретируют отдельные компоненты системы комплемента (С2-С5), интерферон и лизоцим; 3. Усиливают регенерацию тканей (секретируют интерлейкин, стимулирующий пролиферацию остеобластов, лимфоцитов, фибробластов и эндотелиальных клеток). 4. Обеспечивают противоопухолевую защиту тем, что секретируют кахектин, который: а) обладает цитостатическими и цитотоксическими эффектами по отношению к опухолевым клеткам; б) воздействует на терморегуляторные центры гипоталамуса, повышая температуру тела (гипертермия также неблагоприятна для ОК). 5. Участвуют в регуляции гемопоэза (секретируют эритропоэтин). Этой же точки зрения на функции мононуклеаров периферической крови (ПК) придерживаются и другие крупные отечественные иммунологи (Галактионов В. Г.,1998, Ярилин А. А., 2010; Сухих Г. Т. с соавт.,2017; Тупицын Н. Н.,2017; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018).
Моноциты ПК и тканевые макрофаги происходят из полипотентной СК. Попав в кровяное русло, моноциты в течение 2—3 суток расселяются в ткани, где они превращаются в тканевые макрофаги. Моноциты-макрофаги (2—10%) это элементы системы фагоцитирующих мононуклеаров (Фуофанова Н. А.,Топоркова Л. Б. Тихонова М.А с соавт.,2006; Ахматова Н. К., Киселевский М. В.,2008). Моноциты имеют диаметр от 20 до 50 микрон, объемное почковидное ядро, сдвинутое к периферии клетки, и цитоплазму серо-голубого цвета. В крови моноциты пребывают от 1,5 до 5 суток, продолжительность жизни их в тканях — не менее 3-х недель (Гривцова Л. Ю. с соавт., 2014, Н. Н. Тупицын,2017). При эволюции моноцита в макрофаг увеличивается диаметр клетки, число лизосом и количество содержащихся в них ферментов (Гривцова Л. Ю.,2016). Для моноцитов характерен как аэробный, так и анаэробный гликолиз, что позволяет им выполнять специфические функции в анаэробных условиях (например, в полости абсцесса, заполненной гноем) (Киселевский М. В. с соавт., 2015).
Тканевые макрофаги, являющиеся производными моноцитов, в дальнейшем становятся тканеспецифичными макрофагами: плевральными и перитонеальными макрофагами, звездчатыми ретикулоэндотелиоцитами (купферовские клетки) печени, альвеолярными макрофагами, интердигитарными клетками лимфатических узлов, макрофагами вилочковой железы (тимические), костно-мозговыми макрофагами, остеокластами, синовиальными клетками (тип А), глиальными макрофагами (микроглиоцитами) мозга, мезангиальными клетками почек, поддерживающими клетками (клетки Sertoli) яичка, дендритными клетками лимфатических узлов и селезенки, клетки Лангерганса кожи и слизистых оболочек (Чучалин А. Г.,1989; Койко Р, Сайншайн Д,, Бенджамини Э., 2008; Ярилин А. А., 2010).
Подсчитано, что суточная порция моноцитов, покидающих кровяное русло, в тканях распределяется следующим образом: 56,4% — печень; 14,9% — легкие; 7,6% — брюшная полость; 21,1% — другие ткани. Длительность жизни тканевых макрофагов от 40 до 60 суток. Одной из основных особенностей тканевых макрофагов является наличие гранул-лизосом диаметром 0,25—0,5 мкм, в которых содержатся следующие ферменты: кислые гидролазы, кислая фосфатаза, альфа-нафтилэстераза, кислая и другие эстеразы, липаза, катепсины, эластаза, лизоцим, миелопероксидаза, коллагеназа, а также катионные белки и лактоферрин (С.E.Grossi,2000). На своей поверхности тканевые макрофаги выделяют различные рецепторы, которые принимают участие в процессах адгезии, эндоцитоза, восприятия регуляторных воздействий, а также в межклеточном взаимодействии (Чучалин А. Г.,1989; Койко Р, Сайншайн Д, Бенджамини Э., 2008; Ярилин А. А.,2010). В настоящее время доказано наличие на макрофагах рецепторов к Fc-фрагменту иммуноглобулинов классов А, М, Е и разным субклассам им-муноглобулина G, различным лимфокинам, гормонам и регуляторным пептидам, а также ко многим компонентам комплемента — СЗ, Clq, C4b, C5b, C5a. На мембране зрелых макрофагов выявлены различные дифференцировочные антигены, тканеспецифические антигены, а также галактоз-специфические лектины, участвующие в фагоцитозе поврежденных собственных клеток (Чучалин А. Г.,1989; Феофанова Н. А., Топоркова Л. Б., Орловская И. А., 2009; Киселевский М. В. с соавт.,2012, Барышников А. Г. с соавт.,2015; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018).
Тканевые макрофаги обладают локомоторными функциями — миграцией и хемотаксисом (Койко Р, Сайншайн Д, Бенджамини Э., 2008; Ярилин А. А., 2010). В отличие от ненаправленной миграции, хемотаксис макрофагов является целенаправленным, а ориентиром, определяющим направление движения, служит хемотаксическое вещество — хемоаттрактант (Барышников А. Г. с соавт.,2011). К хемоаттрактантам относят фрагменты системы комплемента, глобулины сыворотки крови, лимфокины, а также продукты деградации фибрина, коллагена и различных клеток. В процессе миграции тканевых макрофагов в очаг воспаления, последовательное подключение различных хемоаттрактантов обеспечивает перманентность поступления новых макрофагов из сосудистого русла (Адельман Д., Лолор Г., Фишер Т., 2000 Койко Р, Сайншайн Д, Бенджамини Э., 2008; Бурместер Г.-Р., Пецутто А.,2014). Факторы, ингибирующие миграцию тканевых макрофагов, задерживают клетки в очаге воспаления. К этим факторам относятся интерферон, гиалуроновая кислота, активатор плазминогена, ингибиторы трипсиноподобных протеиназ и другие (Чучалин А. Г.,1989; Койко Р, Сайншайн Д, Бенджамини Э., 2008; Schreiber RD, Old LJ, Smyth MJ.,2011). Саморегуляторный механизм воспаления заключается в том, что одновременно с хемотаксическим привлечением макрофагов в очаг воспаления и их иммобилизацией начинается накопление ингибиторов хемотаксиса и миграции макрофагов (Орловская И. А., Топоркова Л. Б., Феофанова Н. А., Невинский Г. А., Козлов В. А., 2005; Койко Р, Сайншайн Д, Бенджамини Э., 2008; Феофанова Н. А., Топоркова Л. Б., Орловская И. А., 2009 Гривцова Л. Ю., Тупицын Н. Н.,2017; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018).
Весьма важной в регуляции гомеостаза является секреторная функция макрофагов (Бурместер Г.-Р., Пецутто А.,2014). К секреторным продуктам макрофагов относятся ферменты (нейтральные протеазы и кислые гидролазы), компоненты комплемента, ингибиторы ферментов, реактогенные метаболиты кислорода, биоактивные липиды (простагландины, лейкотриены, факторы хемотаксиса для лейкоцитов) (Чучалин А. Г.,1989; Адельман Д., Лолор Г., Фишер Т.,2000; Койко Р, Сайншайн Д, Бенджамини Э., 2008; Феофанова Н. А., Топоркова Л. Б., Орловская И. А., 2009). Одной из основных функций тканевых макрофагов и, одновременно, чрезвычайно важным механизмом врожденного иммунитета является фагоцитоз — процесс поглощения чужеродного материала, его разрушение и выведение из организма. Клетками, ответственными за эту функцию, являются моноциты и нейтрофилы. Точнее, они являются главными клетками, осуществляющими процесс фагоцитоза (Humphries C.,2013; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018).
Процесс завершенного фагоцитоза включает несколько этапов (Чучалин А. Г.,1989; Ярилин А. А.,2010): 1) активацию фагоцитирующей клетки; 2) хемотаксис, т.е. ее продвижение по направлению к объекту, который вызвал ее активацию; 3) прикрепление к данному объекту (адгезия); 4) собственно заглатывание этого объекта; 5) переваривание, или процессинг, поглощенного объекта. При отсутствии последнего этапа фагоцитоз нарушается и носит название незавершенного. При этом фагоцитированные микроорганизмы выживают и могут длительно оставаться во вторичных лизосомах. После достаточно тесного прикрепления (адгезии) фагоцитирующей клетки к клетке-мишени, она поглощает объект фагоцитоза. При этом образуется так называемая фагосома, или фагоцитарная вакуоль, которая формируется за счет мембраны фагоцитирующей клетки вокруг поглощаемой частицы. Такая фагосома продвигается внутри цитоплазмы клетки по направлению к лизосоме, и мембраны этих двух вакуолей сливаются в одну вакуоль — фаголизосому. После образования фаголизосомы начинается процесс переваривания поглощенного чужеродного материала. Содержимое лизосомальных гранул весьма важно для разрушения поглощенного материала и уничтожения микроорганизмов (Койко Р, Сайншайн Д, Бенджамини Э., 2008; С.E.Grossi,2000).
Лизосомальные гранулы бывают двух типов: а) первичные, которые содержат много гидролитических ферментов, миелопероксидазу, лизоцим и катионные белки; б) вторичные (специфические), которых больше, чем первичных и которые содержат щелочную фосфатазу, лактоферрин и лизоцим. Содержимое первичных и вторичных гранул при разрушении клеток-фагоцитов может попадать в интерстициальное (межуточное) пространство (Хаитов Р. М.,2013; Burnet FM.,1970; Humphries C.,2013).. Этот процесс называется экзоцитозом, он характеризуется повреждением тканей и воспалением. Вещества, содержащиеся в лизосомальных гранулах, могут разрушать чужеродные вещества двумя механизмами. Первый из них — кислороднезависимый механизм — включает гидролитические ферменты — протеиназы, катионные белки, лизоцим, который является мукопептидазой, способной разрушать пептидогликаны бактериальной клетки, и лактоферрин — белок, который активно связывает железо, необходимое для размножения бактерий. Второй–кислородзависимый механизм разрушения микроорганизмов — осуществляется при участии миелопероксидазы, которая катализирует развитие токсического воздействия на различные микроорганизмы перекисями водорода; а также перекиси водорода, супероксидного аниона, синглетного кислорода и гидроксильных радикалов, атомарного хлора (Чучалин А. Г.,1989; Барышников А. Г. с оавт.2007; Хаитов Р. М.,2013; Киселевский М. В.,2014; Бурместер Г.-Р., Пецутто А.,2014).
Кроме внутриклеточного разрушения поглощенных микроорганизмов, фагоцитирующие клетки, прежде всего тканевые макрофаги, способны секретировать большое количество цитокинов — биологически активных веществ, обладающих регуляторными и защитными свойствами (Репин В. С., Сухих ГТ.,2005; Хаитов Р. М.,2013; Бурместер Г.-Р., Пецутто А.,2014). Прежде всего, к ним нужно отнести факторы, влияющие на клеточную дифференцировку и пролиферацию, например, гранулоцитарно-моноцитарный колоние-стимулирующий фактор. Далее следуют различные цитотоксические факторы, прежде всего, опухоль-некротизирующий, или фактор некроза опухолей (ФНО). Следующий важнейший фактор — интерлейкин-1 (ИЛ-1) синтезируется макрофагами и относится к факторам, которые имеют принципиально важное значение в развитии как специфических, так и неспецифических иммунных реакций. (Бурместер Г.-Р., Пецутто А.,2014; С.E.Grossi,2000). Далее к числу биологически активных веществ, обладающих защитным действием, относятся компоненты комплемента. И, наконец, такой фактор, как альфа-интерферон, который также важен как для поддержания неспецифических факторов защиты, так и для развития специфического иммунного ответа. Здесь же следует отметить, что цитокины (про- и анти- воспалительные), которые продуцируют макрофаги при встрече с чужеродными агентами, играют важную роль в поддержании резистентности организма (Ярилин А. А.,2010; Хаитов Р. М.,2013; Бурместер Г.-Р., Пецутто А.,2014).
Метаболические изменения, которые развиваются в клетке, вовлеченной в процесс фагоцитоза, получили название «респираторного взрыва» (Чучалин А. Г.,1989; Бурместер Г.-Р., Пецутто А.,2014). Он характеризуется следующими моментами: увеличением потребления кислорода, стимуляцией гексозомонофосфатного шунта, увеличением продукции перекиси водорода, супероксидного аниона и синглетного кислорода. Супероксидный анион является чрезвычайно токсичным для бактерий и тканей, однако он очень нестабилен и под влиянием супероксиддисмутазы быстро превращается в перекись водорода, которая все еще продолжает быть токсичной по отношению к бактериям. Сама же перекись водорода разрушается под действием фермента каталазы. Вещества, реализующие кислородзависимый механизм разрушения микроорганизмов, могут действовать как сами по себе, так и синергически, образуя в конечном итоге гипохлорид, который является одним из наиболее сильных антимикробных агентов (Чучалин А. Г.,1989; Хаитов Р. М.,2013; С.E.Grossi,2000).
Процесс фагоцитоза можно наблюдать, например, со стороны нейтрофилов, даже в том случае, если они будут находиться в физиологическом растворе. Однако если фагоцитирующие клетки поместить в сыворотку или плазму крови, то процесс фагоцитоза естественно усилится. Такое усиление получило название опсонизации, а вещества, которые усиливают фагоцитоз — опсонинов. Какие же вещества могут быть опсонинами и усиливать процесс фагоцитоза? Прежде всего, это активированный 3-й компонент комплемента — СЗв. Фагоцитирующие клетки, в частности нейтрофилы и макрофаги, имеют на своей поверхности рецептор к СЗв. Таким образом, если бактерии или какие-то чужеродные частицы имеют на своей поверхности комплемент, в частности активированный СЗв, то это способствует более тесному взаимодействию фагоцитов с такими микроорганизмами или таким материалом (Ярилин А. А.,2010; Хаитов Р. М.,2013). Сильными опсонинами являются также иммуноглобулины. Известно, что фагоцитирующие клетки имеют на своей поверхности рецептор к Fc-фрагменту IgG. Таким образом, взаимодействие микробов с иммуноглобулинами будет способствовать развитию так называемого опсонизирующего эффекта, после чего фагоцитирующим клеткам легче будет связываться через Fc-рецептор с такими подготовленными для поглощения чужеродными частицами. Наиболее селективными в этом процессе являются IgGl и IgG3. Определенный вклад в опсонизацию микробов вносит IgA. (Ярилин А. А.,2010, Киселевский М. В.,2012; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018).
Еще одним веществом, которое усиливает фагоцитоз за счет опсонизации, является фибронектин — гликопротеин, который связывается с микроорганизмами, и к которому на поверхности нейтрофилов и макрофагов имеется рецептор, за счет чего происходит связывание микроорганизмов, обработанных фибронектином. Способностью осуществлять опсониноподобный эффект обладают также лейкотриены и тафтсин, представляющий собой продукт расщепления молекулы IgG, обладающий способностью стимулировать хемотаксис и фагоцитарную активность. В литературе много внимания уделяется маннозосвязывающему белку и его роли в активации комплемента, опсонизации микроорганизмов и усилении процессов фагоцитоза. Эффекторные функции макрофагов не ограничиваются фагоцитозом и секрецией биологически активных веществ, а включают еще и способность оказывать повреждающее действие на различные клетки-мишени в клеточно-опосредованных реакциях иммунитета (спонтанной и антитело-зависимой цитотоксичности) (Ярилин А. А.,2010, Киселевский М. В.,2014; Бурместер Г.-Р., Пецутто А.,2014; H.Schreiber, 2003).
Результаты изучения иммунорегуляторной функции макрофага показывают, что возможности этой клетки не исчерпываются ролью «клетки-мусорщика» и «клетки тревоги», а включают ряд важных функций, благодаря которым макрофаг занимает ключевые позиции во всех формах иммунного ответа (в продукции антител, индукции клеточных иммунных реакций, формировании иммунологической памяти и иммунологической толерантности) и вполне оправдывает название «клетки-диспетчера» (И. С. Фрейдлин, 1986). В настоящее время общепризнано, что, захватывая антиген, макрофаг расщепляет и перерабатывает его, а затем представляет иммуногенный фрагмент антигена в виде пептида на своей поверхности вместе с молекулами главного комплекса гистосовместимости класса II. Только при таких условиях антиген будет распознан Т-лимфоцитами. Процесс переработки антигена макрофагами и другими антиген-представляющими клетками получил название процессинга (H.Schreiber, 2003; Ярилин А. А.,2010).
Дендритные клетки (ДК или DC). В настоящее время огромное внимание привлекают к себе так называемые дендритные клетки (Banchereau J, Steinman RM,1998; С.E.Grossi,2000;Олюшин В. Н. с соавт,2012; Бурместер Г.-Р., Пецутто А.,2014). Они относятся к клеткам врожденного иммунитета и по своей функции являются профессиональными антиген-презентирующими клетками (Филатов М. В., 2012; Бурместер Г.-Р., Пецутто А.,2014). Эти специализированные фагоцитирующие клетки присутствуют в крови и в большинстве тканей, являются долгоживущими, по сравнению с другими клетками белой крови, обладают высокой антиген-перерабатывающей способностью (Banchereau J., Steinman R.M., 1998; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018), длительно сохраняют антигенную информацию и способны презентировать антиген для распознавания Т-лимфоцитам (Олюшин В. Е. с соавт.,2012; Pizzurro G.A., Barrio M.M., 2015). К ним относятся внутриэпителиальные макрофагоциты (клетки Лангерганса) кожи, интердигитальные клетки лимфатических узлов, тимуса, лимфатических фолликулов (узелков) слизистых оболочек (Бурместер Г.-Р., Пецутто А.,2014; С.E.Grossi,2000). Большинство из них происходят из миелоидных стволовых клеток, так же как и макрофаги, мигрируют из костного мозга в периферические ткани, где основная их роль заключается в контроле за локальным присутствием патогенов (Бурместер Г.-Р., Пецутто А.,2014; Гривцова Л. Ю.,2017). Затем эти тканевые резидентные клетки мигрируют через лимфу в регионарный лимфатический узел, где они взаимодействуют с циркулирующими «наивными» Т-лимфоцитами (Kantoff P.W., Higano C.S., Shore N.D. et al.,2010). Последние попадают в лимфатический узел из крови через специализированные кровяные сосуды — высокие эндотелиальные венулы. Моноциты крови также могут дифференцироваться в ДК и, таким образом, усиливать популяцию антиген-презентирующих клеток. Кроме миелоидных ДК, есть еще ДК лимфоидного происхождения, которые способны продуцировать альфа-интерферон (αИНФ) в значительных количествах (Ахматова Н. К., Киселевский М. В.,2008; Tarte K., Fiol G., Rossi J.F., Klein B.,2000; Казмирчук В. Е., Ковальчук Л. В., Мальцев Д. В.,2012; Anguille S., Smits E.L., Lion E. et al.,2014; Pizzurro G.A., Barrio M.M., 2015).
Описаны две стадии созревания миелоидных и лимфоидных ДК на протяжении их жизни: незрелой и зрелой ДК. Для каждой стадии созревания характерна своя функция и свой набор рецепторов. Незрелая ДК создана для захвата антигена, его переработки и миграции в региональный лимфатический узел. В процессе созревания ДК теряет способность захватывать и перерабатывать антиген, но приобретает способность презентировать антиген для распознавания наивным CD4+ и CD8+ — Т-лимфоцитам (Казмирчук В. Е., Ковальчук Л. В., Мальцев Д. В.,2012; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018; Wimmers F., Schreibelt G., Sköld A.E., Figdor C.G., De Vries I.J.,2014; Pizzurro G.A., Barrio M.M., 2015).
Незрелые ДК (так же, как и другие клетки врожденного иммунитета) распознают антиген (прежде всего инфекционной природы) за счет наличия на их поверхности рецепторов, которые получили название Toll-like рецепторы, и они способны распознавать простые молекулы и молекулярные совокупности, выделяющиеся любым инфекционным агентом: так называемые «pathogen-associated molecular patterns» молекулярные паттерны, связанные с патогеном. Распознавание этих структур активирует фагоцитарную активность дендритной клетки, которая захватывает антиген и перерабатывает его. Кроме того, ДК способна захватить антиген с помощью рецептор-независимого механизма, который называется макропиноцитоз. Перерабатывая антиген, ДК продуцирует целый набор цитокинов: ИЛ-1, ОНФα, αИНФ, βИНФ, ИЛ-12 и др. (Филатов М. В.,2012) Поверхность незрелой дендритной клетки фактически не выделяет молекулы главного комплекса гистосовместимости (ГКГ) и костимуляционные молекулы (Dubensky T.W. Jr, Reed S.G.,2010; Pizzurro G.A., Barrio M.M., 2015).
По мере созревания ДК изменяется ее функция: она теряет способность захватывать, фиксировать и перерабатывать антиген, но приобретает способность к антигенной презентации и активации Т-лимфоцитов. Для этого на ее поверхности появляются молекулы ГКГ І и ІІ классов, а также ко-стимуляционные молекулы CD80 и CD86 (С.E.Grossi,2000; Казмирчук В. Е., Ковальчук Л. В., Мальцев Д. В.,2012; Тупицын Н. Н., Гривцова Л. Ю.,2017). Таким образом, созревая, ДК превращаются в высоко эффективные антиген-презентирующие клетки, способные активировать антиген-специфические Т-лимфоциты в лимфатических узлах, которые, в свою очередь, играют ключевую роль в развитии противоинфекционного, противоопухолевого и поствакцинального иммунитета. Таким образом, дендритные клетки (а в широком смысле — все антиген-презентирующие клетки) и выделяемые ими цитокины, являются связующим звеном между врожденным (неспецифическим) и приобретенным (специфическим) иммунным ответом организма (Филатов М. В.,2012; Олюшин В. Е.с соавт.,2012; Казмирчук В. Е., Ковальчук Л. В., Мальцев Д. В.,2012).
Гранулоциты. Наряду с моноцитами и тканевыми макрофагами, в реализации клеточных реакций врожденного иммунитета принимают участие гранулоциты. Эти клетки играют первостепенную роль в процессах иммунного воспаления, повреждения тканей, а также фагоцитоза. Гранулоциты — это полиморфноядерные лейкоциты, циркулирующие в крови и возникающие, как и моноцитарно-макрофагальные клетки, из миелоидной стволовой клетки в костном мозге. Различают три типа гранулоцитов — нейтрофильные, эозинофильные и базофильные (С.E.Grossi,2000).
Нейтрофильные гранулоциты (нейтрофилы) составляют наибольшую часть популяции полиморфноядерных лейкоцитов. Основные функции нейтрофилов — хемотаксис, фагоцитоз и секреция. Для выполнения этих функций имеются многочисленные ферменты, локализованные в специфических гранулах. Под влиянием фагоцитированных частиц или клеток, аггрегированных иммуноглобулинов, иммунных комплексов, компонентов комплемента, лектинов и других митогенов происходит активация нейтрофилов. Активированные нейтрофилы являются продуцентами ферментов и активных форм кислорода, ответственных за непосредственное повреждение тканей при иммунных воспалительных процессах (С.E.Grossi,2000). Участие нейтрофилов в патогенезе острого воспаления обусловлено следующими основными причинами: 1) богатым набором цитотоксических факторов; 2) высокой чувствительностью ко всевозможным локальным изменениям гомеостаза; 3) способностью, накапливаясь в очагах поражения, инициировать цепную реакцию с выделением цитотоксических веществ и созданием локального перевеса в балансе эффектор-ингибитор; 4) появлением при секреции нейтрофилов биологически активных веществ, активирующих предшественники медиаторов воспаления (эндогенные флогогены) (Киселевский М. В.,2014; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018). Так, выделившиеся в окружающее пространство из нейтрофильных гранул нейтральные протеазы способны активировать калликреин-кининовую, свертывающую и противосвертывающую системы крови, а также оказывать непосредственное повреждающее воздействие на структурные белки окружающих тканей. Нейтрофилы также принимают участие в реализации иммунокомплексного повреждения тканей и в антителозависимых цитотоксических реакциях (Ярилин А. А., 1999, 2010; Киселевский М.В,2014,2016).
Эозинофильные гранулоциты (эозинофилы) помогают организму избавиться от крупных паразитов типа гельминтов, которые физически не могут быть фагоцитированы. Эти клетки крови, как и нейтрофилы, относятся к полиморфноядерным лейкоцитам, но отличаются от них тем, что содержат в цитоплазме специальные гранулы. Способность гранул интенсивно окрашиваться кислыми красителями придает эозинофилам характерный вид при микроскопии. Гранулы состоят из ядра и матрикса. В ядре содержится основной белок эозинофилов, а в матриксе — катионные белки и пероксидаза. Кроме того, в гранулах содержатся также арилсульфатаза В, фосфолипаза D и гистаминаза, обладающие противоаллергической активностью. Активированные эозинофилы выделяют в большом количестве лейкотриен С4. Период полужизни эозинофилов в крови человека составляет около 5 ч. Кроме того, на поверхности эозинофилов имеются рецепторы к Fc-фрагменту иммуноглобулинов классов G и Е, а также к активированному СЗb, при связывании с которым в этих клетках активируется кислородзависимый метаболизм с выработкой активных метаболитов кислорода. Поскольку большинство гельминтов активируют систему комплемента по альтернативному пути с образованием СЗb, это позволяет эозинофилам прикрепляться к поверхности паразитов за счет своего рецептора к СЗb. Активируясь, таким образом, эозинофилы высвобождают описанные выше защитные факторы и повреждают внедрившийся в организм гельминтов. Эозинофилы обладают способностью к хемотаксису, фагоцитозу и продукции активных форм кислорода (Ахматова Н. К., Киселевский М. В., 2008; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018).
Следующими важными представителями врожденного иммунитета являются базофильные гранулоциты (базофилы) периферической крови и тканевые базофилы (тучные клетки). Они имеют много общего, по мнению некоторых авторов, относятся к одной клеточной системе, и происходят из стволовой клетки костного мозга. Базофилы циркулируют в крови, где они составляют 0,1—1% лейкоцитов. Тканевые базофилы расположены преимущественно в слизистых оболочках и соединительной ткани, особенно вблизи сосудов. Наибольшее их количество находится в коже и ткани легких. Между тканевыми базофилами (тучными клетками) и базофилами периферической крови существует тесная функциональная связь. Замечено, что при снижении количества клеток одного типа число клеток другого типа увеличивается. Базофилы обоих типов являются основным депо гистамина, который содержится в них в специальных гранулах в комплексе с гепарином. Кроме гистамина и гепарина, в базофильных гранулоцитах и тканевых базофилах содержатся серотонин, медленно реагирующее вещество при анафилаксии и факторы хемотаксиса нейтрофилов. Оба типа клеток обладают способностью к хемотаксису и фагоцитозу. Основной характерной особенностью этих клеток является наличие на их поверхности высокоаффинных рецепторов для Fc-фрагмента IgE. Вырабатывающиеся в организме молекулы IgE, связываются с этими рецепторами и, при последующем попадании в организм специфического антигена, вступают с ним во взаимодействие. Эта реакция антиген — антитело, происходящая на мембране базофилов обоих типов, приводит к их активации и высвобождению активных компонентов гранул во внеклеточную среду (реакция дегрануляции). (Ахматова Н. К., Киселевский М. В.,2008) Так запускается один из мощнейших защитных механизмов — реакция гиперчувствительности немедленного типа (J.Brostoff,2000; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018). В результате дегрануляции тканевых базофилов нарушается сосудисто-тканевая проницаемость с выходом из сосудистого русла через образовавшиеся в микрососудах «поры» форменных (клеточных) элементов и жидкой части крови, что приводит к появлению отека, гиперемии кожи, а также к возникновению зуда и боли. Есть данные, что тканевые базофилы способствуют стимуляции или торможению процессов свертывания крови, фибринолизу, запуску калликреин-кининовой системы, а также активации тромбоцитов за счет продукции специфического фактора (С.E.Grossi,2000).
Фактор, активирующий тромбоциты, относится к группе медиаторов аллергических реакций немедленного типа (J.Brostoff,2000). Наиболее изученным свойством этого фактора, продуцируемого, помимо базофилов, нейтрофилами, эозинофилами, макрофагами и эндотелиальными клетками сосудов легких, является его способность вызывать агрегацию тромбоцитов с последующим высвобождением из них серотонина. Кроме этого фактора, агрегации тромбоцитов могут содействовать метаболиты арахидоновой кислоты, в частности тромбоксан В2. Активация и аккумуляция тромбоцитов являются существенными компонентами аллергических реакций и процессов иммунного воспаления.
В-лимфоциты. Общее количество В-лимфоцитов в организме человека от общего базового клеточного набора крови составляет 15 -20% белых клеток. Они считаются одними из самых важных клеток иммунитета (Ярилин А. А., 1999, 2010;Киселевский М.В,2014,2016). Им достаточно один раз встретится с чужеродным агентом (бактерия, гистамин, грибок, вирус и т.д.), чтобы навсегда запомнить и его, и способ борьбы с ним, что делает реакцию иммунитета в будущем более быстрой и точной. Благодаря функции приспособления В-лимфоцитов появляется иммунная устойчивость на всю жизнь, а также повышается эффективность прививания (www.diagnos.ru/procedures/analysis/lym). Название этих лимфоцитов — В-лимфоциты (от фабрициевой сумки птиц — «bursa»). У птиц центральным лимфоидным органам является «бурса» (сумка Фабрициуса), а у человека к ним относят вилочковую железу (тимус). У человека роль «сумки» также выполняют лимфоидные органы (пейеровы бляшки кишечника, аппендикс, лимфоузлы, селезенка и т.д.). Образуясь в красном костном мозге и там же обретя антиген (Aг) — специфичность, В-лимфоциты расселяются по лимфоидным органам. При последующей Aг стимуляции В-лимфоциты превращаются в два класса клеток: 1. В-клетки иммунной памяти; 2. Плазматические клетки, способные продуцировать специфические антитела к конкретному Aг. В-клетки обеспечивают гуморальный иммунный ответ. В-клетка генетически запрограммирована на синтез поверхностного рецептора, специфичного к одному определенному антигену. Встретив и распознав этот антиген, эти клетки размножаются и дифференцируются в плазматические клетки, которые образуют и выделяют в растворимой форме большое количество таких рецепторных молекул, которые называются антителами (Ат). Эти Ат представляют собой крупные гликопротеоиды и содержатся в крови и тканевой жидкости. Благодаря своей идентичности Ат взаимодействуют с тем Аг, который первоначально активировал В-клетки (Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018; I.M. Roitt, 2000). В костном мозге поддерживается пул кроветворных стволовых клеток, являющихся источником образования всех клеток крови, в том числе и лимфоцитов. Подавляющее большинство костномозговых лимфоцитов относится к бурсазависимым или В-лимфоцитам, обеспечивающим развитие иммунных или аллергических реакций гуморального типа (Петров Р. В.,1982, 1999; Плейфер Дж,1998). В костном мозге под влиянием микроокружения стромальных костномозговых клеток осуществляется дифференцировка большей части В-лимфоцитов, относящихся к В2- субпопуляции клеток. В1-субпопуляция лимфоцитов еще в эмбриональном периоде покидает костный мозг. Физиологическая регенерация В1-лимфоцитов в течение жизни человека поддерживается преимущественно в брюшной и плевральной полостях. В1- и В2-субпопуляции лимфоцитов отличаются по своей функциональной значимости и экспонируемым на поверхности мембраны маркерам. В процессе дифференцировки В2-лимфоцитов на их мембране экспонируются рецепторы иммуноглобулиновой природы, причем незрелые В2-лимфоциты экспрессируют IgМ и небольшое количество молекул главного комплекса гистосовместимости класса II, часть из которых представляет собой так называемые Iа- белки или Ia-антигены. По мере созревания В2-лимфоцитов на их поверхности выделяются молекулы иммуноглобулинов всех 5-ти классов, а также увеличивается плотность Ia-антигенов. В то же время появляются рецепторы для различных компонентов комплемента и другие маркерные молекулы, в частности, СD19, СD21, СD23, СD35. Антиген-чувствительными рецепторами В-лимфоцитов являются мембраносвязанный мономер IgМ, а возможно, и IgD. Степень зрелости В-лимфоцитов определяется наличием на их мембране следующих рецепторов: антигенспецифических рецепторов иммуноглобулиновой природы, рецепторов к Fc-фрагменту Ig, рецепторов к комплементу, рецепторов к поликлональным В-активаторам, липополисахаридам и монопротеазам. В2-лимфоциты являются предшественниками клеток- плазмоцитов, обеспечивающих синтез иммуноглобулинов в ответ на антигенную стимуляцию (Ярилин А. А., 2010). Необходимым условием их трансформации в клетки-продуценты антител является их взаимодействие с Т-лимфоцитами-хелперами. В связи с этим очевидно, что В2-лимфоциты ответственны за развитие гуморального ответа на тимусзависимые антигены (Ярилин А. А., 1999). В настоящее время определена структура рецепторов В1-лимфоцитов, включающих помимо иммуноглобулина еще 4 полипептидные цепи, расположенные попарно с каждой стороны молекулы иммуноглобулина, обозначаемые как Ig-М и Ig-G. Назначение этих пептидных компонентов заключается в проведении сигнала о связывании антигена иммуноглобулиновой частью рецептора в глубь клетки. Как указывалось выше, дифференцировка и поддержание жизненного пула В1-лимфоцитов осуществляются за пределами костного мозга в основном в плевральной и брюшной полостях. В1-лимфоциты обеспечивают синтез антител только класса IgМ без взаимодействия с Т-хелперами. Особенностью иммуноглобулинов, продуцируемых В1-лимфоцитами, является их широкая перекрестная реактивность в ответ на воздействие бактериальных антигенов полисахаридной структуры. Не доказана возможность реакции В1-лимфоцитов на антигены белковой природы. Характерно наличие на поверхности В1-лимфоцитов маркерной молекулы CD5, поэтому указанную субпопуляцию В-лимфоцитов нередко именуют CD5-лимфоциты. В2-лимфоциты после созревания в костном мозге поступают в системный кровоток, а затем заселяют периферические лимфоидные органы (селезенку, лимфатические узлы, лимфоидную ткань кишечника, миндалин и других органов).
Как известно, в периферической крови в условиях нормы содержатся от 20 до 40% лимфоцитов, причем, среди лимфоцитов периферической крови на долю В-лимфоцитов приходится лишь 20—30%; 50—65% составляют Т-лимфоциты и около 10% лимфоцитов не имеют рецепторов, свойственных Т- и В-лимфоцитам; их называют «нуль-лимфоциты». Незначительная часть лимфоцитов периферической крови имеет на своей поверхности маркеры Т- и В-лимфоцитов (D клетки). В лимфатических узлах В-лимфоциты располагаются в тимуснезависимых зонах фолликулов, составляя лишь 35% всех лимфоцитов. В-лимфоциты находятся в кортикальной зоне в покоящемся состоянии и образуют так называемые первичные фолликулы. На фоне антигенной стимуляции они формируют вторичные фолликулы. Важным компонентом системы иммунопоэза является селезенка, в которой содержание В-лимфоцитов достигает 65%, что обеспечивает быстрое накопление антител-продуцирующих плазматических клеток на фоне антигенной стимуляции. При внутривенном введении антигена антитела образуются преимущественно в селезенке. Лимфоидные образования червеобразного отростка, а также групповые лимфатические фолликулы — пейеровы бляшки — участвуют в синтезе антител класса IgA, тем самым обеспечивая иммунитет слизистых. В миндалинах глоточного кольца имеются Т- и В-лимфоциты, обеспечивающие клеточный и гуморальный механизмы защиты, в частности, синтез антител класса IgA и IgG. В связи с этим тонзиллэктомия, проведенная в раннем возрасте, снижает противоинфекционную защиту глоточного кольца (Ярилин А. А., 1999,2010). Более подробно роль субпопуляции В1-лимфоцитов в формировании иммунного противоопухолевого ответа будет обсуждаться в 14 главе.
Естественные киллерные клетки или натуральные киллеры (NК-клетки). Еще одну группу клеточных факторов, имеющих большое значение в механизме естественного иммунитета, составляют киллерные клетки. К ним относятся естественные киллерные (NК-клетки, NK/T-лимфоциты), просто киллерные (К-клетки) и лимфокин-активированные киллерные (ЛАК-клетки). Термин Natural killer (NK) с английского переводится как «естественные (природные) убийцы», что максимально точно соответствует назначению этих агентов. Только 5% базовых лимфоцитов перерождаются в NK-лимфоциты. Этот подвид полностью отвечает за устранение собственных клеток, если в них образуются маркеры поражений вирусами или раком. Подробнее можно ознакомиться с этим процессом на http://diagnos.ru/procedures/ analysis/lym. Общей особенностью NК- и К-клеток является способность лизировать клетки-мишени без предварительной сенсибилизации, что отличает их от цитотоксических Т-лимфоцитов-киллеров. Морфологически естественные киллерные клетки большого размера, с азурофильной зернистостью и низкой плотностью, на основании чего их относят к большим гранулярным лимфоцитам (БГЛ) (Гривцова Л. Ю.,2016; Тупицын Н. Н. Гривцова Л. Ю.,2017; Хаитов Р. М., Атауллаханов Р. И., Шульженко А. Е.,2018 I.M.Roitt,2000; H. Sprit, D.Artis, M.Colonna et al., 2013; E.Montaldo et al.,2014).
Клетками-мишенями для NК-клеток являются практически все ядросодержащие клетки, однако наибольшую активность NК-клетки проявляют по отношению к опухолевым и пораженным вирусом клеткам. Так как для разрушения клеток-мишеней NК-клеткам не требуется участия антител и присутствия комплемента, то этот тип цитолиза получил название спонтанной клеточно-опосредованной цитотоксичности (СКOЦТ). NК-клетки экспрессируют на своей поверхности рецепторы к интерферону и интерлейкину-2 (ИЛ-2).
По мнению большинства исследователей, роль NК-клеток в организме заключается в защите от развития опухолей, инфекционных заболеваний, что, по сути, является функцией иммунного надзора (Шенфельд, П. Л. Мерони, Л. П. Чурилов,2017; Porrata, L.F., M.R. Litzow, A. Tefferi et al.,2002). До недавнего времени много внимания уделялось центральной роли Т-лимфоцитов в иммунном надзоре, особенно при развитии опухолевого процесса. Однако со временем было установлено, что участием лишь Т-клеток в реализации иммунного ответа нельзя объяснить устойчивость некоторых индивидов к развитию опухолей, а также инфекционных заболеваний, вызываемых многими микробными агентами. При анализе процессов, необходимых для развития Т-клеточной защиты, как единственно возможной, становится очевидным, что одних только Т-клеток явно недостаточно. Поэтому многие ученые совершенно справедливо предполагали существование широко реагирующей системы, которая в состоянии практически немедленно отвечать на посторонние раздражители и частично контролировать их до тех пор, пока им в ответ не включится более адекватно и специфически отвечающая иммунная система. (H. Sprit D.Artis, M.Colonna et al., 2013; E.Montaldo et al.,2014). Естественный клеточный аппарат, состоящий из NК-клеток, макрофагоцитов и полинуклеаров, наиболее соответствует системе, которая может играть важную роль в первичной иммунной защите. Активность каждого типа этих клеток зависит от разнообразия опухолевых клеток-мишеней, микробных и вирусных агентов, а также от конкретных условий той или иной ситуации (Шенфельд, П. Л. Мерони, Л. П. Чурилов,2017; I.M.Roitt, 2000).
У человека NК-клетки появляются на очень раннем периоде онтогенеза — на 8-й неделе гестации, опережая в этом Т- и В-клетки. В циркулирующей крови пул NК-клеток составляет от 5 до 20%. Они имеются в селезенке, легком, печени, костном мозге и лимфатических узлах, в небольшом количестве их находят в тимусе, в лимфоидной ткани желудка и кишечника (Гривцова Л. Ю.,2017). При развитии вирусной инфекции NК-клетки мигрируют в пораженную ткань из костного мозга под влиянием интерферона І типа. Самое большое количество NК-клеток обнаруживается в децидуальной ткани, и все они материнского происхождения. NК-клетки происходят из гемопоэтической стволовой клетки, и созревание их происходит в костном мозге. Уже на раннем этапе созревания NК-клетка имеет рецепторы для цитокинов ИЛ-2 и ИЛ-15, необходимых для ее созревания и активации (I.M.Roitt,2000; H. Sprit D.Artis, M.Colonna et al., 2013; E.Montaldo et al.,2014). Зрелая NК-клетка отличается от других лимфоцитов наличием на ее поверхности молекул CD56 и CD16 и отсутствием CD3. CD56 представляет собой молекулу межклеточной адгезии из супер-семейства иммуноглобулинов; CD16 является Fc-рецептором для иммуноглобулина G (FcyRIII). По количеству CD56 и CD16 молекул на поверхности NК-клеток последние делят на две фенотипически и функционально различные популяции (A.Moretta et al.,2011, E Montaldo,P.Vacca et al.,2011;A Cerwenka,L.L.Laner,2016). Одна из них, большая (до 90%), имеет слабую выраженность экспрессии молекулы CD56, но очень хорошо экспрессирует молекулу CD16. Эта популяция получила фенотип CD56+/-CD16+; меньшая же часть NК-клеток (до 10%) хорошо экспрессирует CD56, но не имеет молекулы CD16; ее фенотип — CD56+CD16-(I.M.Roitt,2000)..
Эти фенотипически различающиеся популяции NК-клеток имеют и разные физиологические функции: CD56+CD16- клетки являются иммунорегуляторными и продуцируют такие цитокины, как гамма-интерферон (γИНФ), опухольнекротизирующий фактор — альфа (αОНФ), гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF). CD56+/-CD16+ клетки представляют собой непосредственно эффекторные цитотоксические клетки. Отсутствие на NК-клетках молекулы CD3 является решающим, поскольку некоторые CD3+ Т-лимфоциты имеют на своей поверхности CD56 и CD16 (так называемые NК/Т-лимфоциты) (H. Sprit, D.Artis, M.Colonna et al., 2013; E.Montaldo et al.,2014).
NK-клетки — это врожденные лимфоидные клетки (ILC), которые играют решающую роль в защите от вирусов и от опухолевой трансформации (H. Sprit D.Artis, M.Colonna et al., 2013; E.Montaldo et al.,2014; E.Vivier, Raulet D.H., A.Moretta et al.,2011, E. Montaldo,P.Vacca, C.Vitale et al.,2011; A Cerwenka,L.L.Laner,2016). Ввиду их возможного участия в раке (но также и при вирусных инфекциях), эти клетки интенсивно изучались, так что молекулярные механизмы, регулирующие их противоопухолевую цитолитическую активность, были широко определены. Благодаря использованию широкого спектра поверхностных рецепторов, способных доставлять или запускать ингибирующие сигналы, NK-клетки могут контролировать окружающие клетки, проверяя их возможные фенотипические изменения и настраивая соответствующий цитолитический ответ. У людей эти рецепторы в основном представлены следующими: HLA-специфические ингибиторные рецепторы, инсулино-подобные рецепторы киллеров (KIR), и CD94: NKG2A-рецепторы, которые предотвращают NK-клетки от атак нормальных аутологичных клеток (H. Sprit, D.Artis, M.Colonna et al., 2013), и) ряд активирующих рецепторов (включая NKG2D, DNAM-1 и природные цитотоксические рецепторы (NCRs): NKp46, NKp30 и NKp44), которые распознают лиганды, экспрессируемые на поверхности трансформированных и/или вирусноинфицированных клеток (E.Montaldo et al.,2014) и которые могут активировать NK-клетки для уничтожения аномальных клеток (E.Vivier, Raulet D.H., A.Moretta et al.,2011; I.Moretta, C.Bottino,D.Pende et al.,2004). Большинство вышеупомянутых рецепторов также вовлечены в контроль дополнительных функций, оказываемых NK-клетками, начиная от высвобождения цитокинов и хемокинов (а именно, IFN-, TNF-, GM-CSF, MIP1-α и RANTES) (E.Vivier, Raulet D.H., A.Moretta et al.,2011; C. Fauriat et al., 2010) к регуляторным взаимодействиям с различными типами иммунных клеток, включая дендритные клетки (DC), макрофаги, моноциты, гранулоциты и Т-клетки (E.Vivier, Raulet D.H., A.Moretta et al.,2011; A.Moretta, E Marcenaro S.Sivori et al.,2005; F.Bellora, R Castriconi, A.Dondero et al.,2014). Кроме того, NK-клетки наделяются дополнительными разнообразными рецепторами, которые позволяют им реагировать на разнообразные стимулы. Таким образом, NK-клетки могут по-разному потенцировать свои функции в ответ на несколько связанных с патогенами молекулярных моделей. Используя разные TLR (то есть TLR2, TLR3, TLR7 и TLR9) (S.Sivori, M. Falco, M.Della Chiesa et al., 2004; S Sivori, S.Carlomagno, S.Pesce et al.,2014), они могут значительно увеличить продукцию цитокинов и/или их цитолитические свойства в ответ на различные цитокины, включая IL-2, IL-15, IL-12, IL-18 и IFNs α/β (E.Vivier, Raulet D.H., A.Moretta et al.,2011; V.F.Cooper, N.F.Fehniger, M. A.Caligiuri (2001). И, наконец, они могут отклоняться в ответ на различные хемотаксические раздражители. Две главные функции NK-клеток (цитотоксичность и производство IFN-γ), по-видимому, отличаются в распределенных среди определенных подмножеств NK-клеток в периферийной крови (ПК) и лимфатических узлах (ЛУ). Так называемые «терминально дифференцированные» CD56 Dim CD16Яркие NK-клетки периферической крови, экспрессирующие молекулы CD57 и KIR проявляют высокий цитотоксический потенциал и ограниченную способность секретировать ИФН-γ при стимуляции цитокинов. CD56 Dim CD16 Яркий CD57 — KIR-NKG2A + ПК NK-клетки выполняют обе функции на промежуточных уровнях. Наконец, меньше дифференцированные CD56Яркий CD16 Dim negCD57 -KIR-NKG2A ++ NK-клетки, которые преимущественно локализуются в лимфатических узлах и плохо представленные в ПК, показывают низкую цитотоксичность и высокий уровень IFN-γ высвобождения при стимуляции цитокинов (Гривцова Л. Ю.,2017,2016; Шенфельд, П. Л. Мерони, Л. П. Чурилов,2017).
Примечательно, что было также предложено, чтобы NK-клетки могли адаптировать свой цитолитический потенциал к структуре лигандов NK-рецепторов (NKR-Ls) стабильно выраженных в среде. Таким образом, хроническое воздействие к активационным лигандам или к аномально низким уровням молекул MHC l (то есть ингибирующие лиганды) будут давать NK-клеткам плохо реагировать. С другой стороны, воздействие адекватных уровней MHC-I увеличивало реакционную способность NК-клеток и что бы дифференцированные клетки KIR + NK становились полностью компетентными (T. Pradeu et al.,2013). Это краткое описание биологии NK-клеток показывает, что эти клетки далеки от простых цитолитических эффекторов, способных на убийство различных мишеней опухолевых клеток; Скорее, они представляют собой разнородную популяцию, способную выполнять различные функции и точно настроить свою деятельность в различных экологических контекстах. Такая возникающая сложность делает эксплуатацию NK-клеток для эффективной иммунотерапии гораздо сложнее, чем первоначально предполагалось, особенно в контексте твердых опухолей. Действительно, хотя различные модели на животных и последующее наблюдение и исследования подтверждают, что NK-клетки могут обследовать и осуществлять контроль над клетками-повстанцами в виде опухолей (Казмирчук В. Е., Ковальчук Л. В., Мальцев Д. В.,2012; S.Kim, K. Iizuka, H.l.Aguila et al.,2000; T.Lakshmikanth et al.,2009, K.Imai, S.Matsuyama, S. Miyake et al.,2000), выполнять простую роль NK-клеток в контроле твердых опухолей еще далеки от определения. В этом контексте конкретное микроокружение, связанное с опухолью, развивается вместе с прогрессированием злокачественности и может играть определенную роль. С одной стороны, возрастающая сложность структуры опухоли и опухолевое микроокружение может сильно влиять на поведение NK-клеток и ограничить инфильтрацию NK-клеток опухолевой массы; с другой стороны, NK-клетки, которые успешно достигают (или развиваются внутри) участка опухоли могут взаимодействовать с различными клеточными популяциями и влияют на прогрессирование опухоли. В последние несколько лет широко изучалось подавляющее воздействие микроокружения опухоли на NK-клетки (A.Stojanovic, A. Cerwenka,2011; M.Vitalle,C.Cantonei,G.Petra et al.,2014). Было изучено количество растворимых факторов (R.Gastriconi et al.,2013; M.Della Chiesa et al.,2006 E.Shlecker,N.Fiegler, A. Arnold et al.,2014; R Gastriconi, C.Cantoni, M.D.Chiesa et al., 2003), также различные, связанные с опухолью, регуляторные подавляющие иммунные клетки (B. Hoechst, N. Voigtlaender, I. Ormandi et al.,2009, V.F.Sprinzl,F.Reisenger, A. Puschnik et al.,2013). Было показано, что связанные с опухолью фибробласты (тумор-ассоциированные фибробласты — TAFs) и ОК существенно изменяют экспрессию и/или функцию некоторых рецепторов NK-клеток и влияют на способность NK-клеток достигать, распознавать и убивать ОК в опухолевом участке (M.Balsamo, E.Scordamaglia, G. Pieta et al.,2009; G. Pietra et al.,2012, C.Pasero,G.W.Gravis,M.Guerin et al., 2016). При этом, возможный эффект от прогрессирования провоспалительных процессов в NK-клетках исследован. В этом контексте недавние данные, указывают на то, что NK-клетки способны изменять иммуногенность склерозированных клеток (J.F.Rossi,2017). Структура опухолевой ткани довольно сложна и охватывает гипоксические ниши, васкуляризированные зоны, некротические зоны и поверхностное поражение. Напротив, несколько опухолевых клеток могут приобретать менее дифференцированный прометастатический фенотип через переходный процесс, который в опухолях эпителиального происхождения упоминается как эпителиально-мезенхимный переход (ЭМП) (или ЭМП-липопроцессин меланомы) (J.P.Thiery, H.Acloque, R.Y. JHuang et al.,2009; K. Polyak, R.A.Weinberg,2009,K.Kemper et al.,2014). Таким образом, позиционирование NK-клеток в опухоли и их возможное кондиционирование в гипоксической среде представляют собой важные дополнительные условия, чтобы рассмотреть роль NK-клеток в прогрессировании опухоли (M.Balsamo et al.,2013). В этом контексте High Mobility Group Box-1 (HMGB1) может представлять связь между NK-клетками и опухолевыми клетками (R. Kang et al.,2013). Действительно, недавние исследования представили доказательства о роли HMGB1 в индукции ЭМП (L.Zhu,X.Li,Y.Chen et al.,2015), в то время как другие итальянские исследователи (C.Cantoni L.-Huergo-Zapico,M.Parodi et al.,2015) недавно показали, что HMGB1 активно высвобождается во время взаимодействия с NK-клетками меланомной клетки и может способствовать восстановлению NK-клеток.
В этой главе мы анализируем текущую информацию, предлагающую возможную роль NK-клеток для инфильтрирования и эволюции опухолевых клеток в сторону более злокачественных стадий. В этом контексте мы также обсудим US HMGB1 как вспомогательные ключевые компоненты NK-клеток для обеспечения пластичности опухолевых клеток. NК-клетки распознают и элиминируют клетки-мишени, на которых отсутствуют или изменены маркеры, характерные для здоровых клеток организма. Известно, что такое происходит, прежде всего, с клетками, мутировавшими или пораженными вирусом. Доказано, что поведение NК-клеток по отношению к клеткам-мишеням связано с наличием на поверхности NК-клеток двух типов рецепторов — активирующих и ингибирующих их цитотоксическую активность в процессе контакта с клеткой-мишенью и установления факта наличия или отсутствия на ней маркера здоровой клетки. Таким маркером на клетке-мишени являются молекулы главного комплекса гистосовместимости (ГКГ) І класса, которые, как известно, в норме экспрессируются на поверхности всех клеток организма (Зверев В.В, Хаитов Р. М., 2014).
Различают два вида ингибирующих рецепторов (киллинг-ингибирующие рецепторы — КИР), функция которых зависит от молекулы ГКГ І класса: 1) рецепторы семейства иммуноглобулинов; 2) лектиновые рецепторы. Рецепторы семейства иммуноглобулинов распознают определенные участки в некоторых молекулах ГКГ І класса и при их наличии включается механизм подавления цитотоксичности NК-клеток. Из лектиновых наиболее изучен рецептор CD94, известный у мышей как Ly-49, который распознает свой набор молекул ГКГ І класса и имеет свой механизм ингибирования литической активности NК-клеток. Рецептор CD94 ковалентно связан с белком NKG2, который отвечает за передачу сигнала внутрь клетки (I.M.Roitt,2000).
Рецепторы, активирующие киллинговый эффект NК-клеток (киллинг-активирующие рецепторы — КАР) также имеются как среди рецепторов семейства иммуноглобулинов, так и среди лектиновых рецепторов. NК-клетки подобно CD8+ Т-лимфоцитам-киллерам разрушают клетки-мишени, секретируя в них перфорин и гранзимы; кроме того, NК-клетки экспрессируют Fas-лиганд и ОНФ (мембранный или растворимый), с помощью которых NК-клетка также может лизировать клетку-мишень. Однако в отличие от CD8+ Т-лимфоцита-киллера NК-клетка для осуществления киллинг-эффекта не требует пролиферации, транскрипции или синтеза белка (т.е. не тратит время на созревание) (H. Sprit D.Artis, M.Colonna et al., 2013; E.Montaldo et al.,2014).
Считается, что активация NК-клеток происходит под влиянием цитокинов, которые продуцируются активированными макрофагами и дендритными клетками, — а/ (3 ИНФ, ИЛ-12, ИЛ-2, ИЛ-15, ИЛ-18, ОНФ). Также принято считать, что активация NК-клеток дендритными клетками предполагает их контакт между собой. Известно, что после встречи с антигеном незрелые дендритные клетки созревают и активируют покоящиеся NК-клетки. На поздних стадиях иммунного ответа активированные NК-клетки способствуют гибели дендритных клеток и прекращению презентации ими антигена Т-клеткам. Активированная NК-клетка начинает продуцировать ɣИНФ и ОНФа, необходимые для реализации защитной функции врожденного иммунитета против внутриклеточных бактерий (например, листерии), паразитов (например, токсоплазмы) и вирусов (например, цитомегаловируса). Кроме того, ɣИНФ способствует, в свою очередь, поддержанию антимикробной активности макрофагов. Важную роль в реализации киллингового эффекта имеют молекулы CD2 и LFA1 на NК-клетке. При контакте с клеткой-мишенью происходит связывание этих двух молекул с молекулами LFA3 и ICAM-1 соответственно и удержание двух клеток в тесном контакте друг с другом. В это время NК-клетка с помощью своих КИР и КАР распознает, экспрессирует ли клетка-мишень соответствующую молекулу ГКГ I класса. Если нет, то NК-клетка активируется и включается механизм киллинга; если да, то NК-клетка ингибируется и клетка-мишень остается в живых. Цитотоксический эффект NК-клеток не подвержен рестрикции в рамках ГКГ. К факторам, которые угнетают килинговую активность NК-клеток, относятся простагландин Е2, ИЛ-4, трансформирующий фактор роста бета (TGF-β) и кортизол (I.M.Roitt,2000).
NК/Т-лимфоциты. В последние годы открыта еще одна субпопуляция киллерных клеток, играющая важную роль в механизмах врожденного неспецифического иммунитета — NК/Т-лимфоциты. Особенность этой клетки состоит в том, что она имеет наряду с маркерами NК-клетки — CD16; CD56; NK1.1-антиген, еще и маркер Т-лимфоцита — особый антиген-распознающий рецептор, сформированный природным путем для распознавания липидных антигенов, которые презентируются молекулой CD1d на поверхности дендритной клетки (в частности гликолипид-α-галактозилцерамид). Важность популяции NК/Т-лимфоцитов состоит в том, что после активации они не только развивают киллерную функцию, но и передают сигнал для Тх1 и Тх2 типа, заставляя их продуцировать цитокины, т. е. проявляют регулирующую функцию, включая механизмы специфического (адаптивного) иммунитета. Сегодня показана важная роль NК/Т-лимфоцитов в усилении и регуляции иммунного ответа, включая протективный иммунитет против бактерий, паразитов, вирусов, противоопухолевый иммунитет, поддержание толерантности и препятствие развитию аутоиммунной патологии.
Важным свойством NК/Т-лимфоцитов является резистентность к апоптозу, что позволяет им выживать после активации и поддерживать численность клеток на нормальном уровне. Считают, что антиапоптотические свойства NК/Т-лимфоцитов обусловлены их регуляторной ролью. Высказывается мнение, что NК/Т-лимфоциты являются промежуточным звеном между врожденным и приобретенным иммунитетом, регулируя их взаимодействие за счет быстрой индукции выработки цитокинов Т-хелперами 1-го и 2-го типов (Тупицын Н. Н.,Гривцова Л. Ю.,2016).
Следующими клетками, участвующими в реализации механизмов врожденного (естественного) иммунитета являются просто киллерные — К-клетки. Они несут на своей поверхности рецепторы к Fc-фрагменту IgG и способны к антителозависимой клеточно-опосредованной цитотоксичности. Открытию этих киллерных лимфоцитов предшествовали наблюдения Е. Moller (1965), доказавшего, что клетки-мишени в присутствии минимальных количеств специфических антител против собственных антигенных детерминант могут разрушаться несенсибилизированными лимфоцитами без добавления комплемента. Этот феномен получил название антителозависимой клеточно-опосредованной цитотоксичности (АЗКОЦТ) и является своеобразным отражением связи между гуморальным и клеточным звеньями иммунной системы, в которой гуморальные антитела выступают в роли «наводчиков» клеток-эффекторов на клетки-мишени, несущие чужеродные антигены. Помимо К-клеток, в реакциях АЗКОЦТ в качестве клеток-эффекторов могут выступать моноциты и макрофаги, нейтрофилы, NК-клетки, а также эозинофилы. Участие К-клеток в реакциях АЗКОЦТ сводится к разрушению клеток-мишеней, адсорбировавших на своей поверхности IgG. Взаимодействие между связанными с клетками-мишенями иммуноглобулинами и Fc-рецептором К-клеток служит пусковым механизмом цитолитического процесса. К-клеточный механизм обладает очень высокой чувствительностью. В оптимальных условиях достаточно несколько сотен молекул антител на клетку-мишень, чтобы вызвать лизис. Одна К-клетка способна последовательно разрушить несколько клеток-мишеней (I.M.Roitt,2000).
В последнее время получены данные, согласно которым К-клетки принимают участие в развитии ряда аутоиммунных заболеваний — системной красной волчанки, гломерулонефрита, хронического гепатита. К-клетки больных хроническим гепатитом обладают способностью уничтожать изолированные гепатоциты. Установлена важная роль К-клеток при сальмонеллезе, дизентерии, онкологических заболеваниях и в реакции отторжения трансплантата. Эти данные легли в основу выделения особого типа иммунологических реакций, опосредованных антителами и К-клетками.
Лимфокин-активированные киллерные клетки — ЛАК-клетки. И, наконец, в механизмах врожденного (естественного) иммунитета участвуют лимфокинактивированные киллерные — ЛАК-клетки (Rosenberg S,A.,1998,2011). К ним относятся обычные лимфоциты, которые были активированы под влиянием ИЛ-2 и приобрели способность осуществлять киллинговый эффект. Т-лимфоциты обеспечивают клеточный иммунный ответ. Это Тимус-зависимые клетки, т.к. дифференцируются под прямым влиянием тимуса. На протяжении жизни красный костный мозг поставляет незрелые Т-лимфоциты в кровь и оттуда в тимус, где клетки приобретают поверхностные рецепторы к Aг. После этого лимфоциты выходят в кровь и заселяют периферические лимфоидные органы. При контакте с Aг клетки пролиферируют в эффекторные Т-лимфоциты (Rosenberg S,A.,1998,2011; Киселевский М. В.,2014).
Виды эффекторных Т-лимфоцитов: а) Т-киллеры — цитотоксический эффект, разрушают чужеродные клетки; б) Т-хелперы — клетки-помощники, стимулируют дифференцировку В-лимфоцитов; в) Т-супрессоры — подавляют иммунный ответ на определенные Aг. г) Т-клетки-амплифайеры — усиливают и расширяют пролиферацию Т-киллеров. д) Т-клетки иммунной памяти — хранят информацию о всех Aг-воздействиях, циркулируя в организме без деления до 10 лет. От общего количества лимфоцитов на долю Т-лимфоцитов приходится 60—80%. Т-лимфоциты не ведут оседлый образ жизни, непрерывно перемещаясь между кровью и лимфой. Разновидностью клеточного является трансплантационный иммунитет, т.е. реакция отторжения пересаженного органа или ткани — функция Т-лимфоцитов.
К недостаткам врожденного (естественного) иммунитета можно отнести следующие обстоятельства: 1) при попадании в организм чужеродного агента ему противостоят сразу все факторы врожденного иммунитета, что порой неадекватно и дает много побочных эффектов; 2) факторы врожденного иммунитета не обладают способностью приспосабливаться к особенностям возбудителя, распознавать его и поэтому нет тонкой специфики при реагировании; 3) не остается иммунологической памяти. Именно эта специфика работы естественного иммунитета создает определенные сложности в его реализации при взаимодействии его компонентов с траснформированными и опухолевыми клетками (ОК). Более подробно мы остановимся на этом в следующем подразделе этой главы.
2.2.Взаимодействие клеток врожденного иммунитета и опухолевых клеток
NК- клетки и процесс туморогенеза. Нормальный рост и гибель клеток –строго контролируемые процессы, которые обеспечивают поддержание тканевого гомеостаза в организме. Возникновение случайных мутаций, влияющих на ключевые гены-супрессоры, онкогены и гены, участвующие в ДНК-ремонте, может изменить гомеостатический статус так, что разовьется неконтролируемый рост клеток, их бессмертие и, наконец, будет дано начало развитию опухоли. В солидных опухолях специфическое микроокружение может усиливать генетическую и эпигенетическую нестабильность развивающихся опухолевых клеток (ОК), а также свидетельствовать в пользу накопления мутаций и прогрессирования к проинвазивному и прометастатическому фенотипу ОК. Эпигенетические изменения могут способствовать развитию фенотипической и функциональной пластичности ОК (J.P.Thiery, H.Acloque R.Y.J.Huang et al.,2009; C.E.Meacham & S.J.Morrison, 2013). Приобретение пластичности связывается с мощностью ОК, которая определяет способность клетки оставить первичную опухоль, распространиться на отдаленные органы через кровоток или лимфатическую систему, и создать метастазы (J.H. Tsai J.,Yang,2013).
При раке эпителиального происхождения, ОК должны потерять свои эпителиальные характеристики (полярность, клеточную адгезию и т. д.) и приобрести мезенхимальные признаки, которые разрешат им отрываться от основного места и вторгаться в соседние и отдаленные ткани. Приобретение иммиграционных и инвазивных свойств, а также возвращение к эпителиальному фенотипу для установления микрометастазов, подразумевает обширное клеточное перепрограммирование, которое заимствует молекулярные пути в скрытой программы развития, известной как эпителиально-мезенхимальный переход/мезенхимально-эпителиальный переход (ЭМП/МЭП) (J.P.Thiery,H.Acloque R.Y.J.Huang et al.,2009).
ЭМП и его возможные связи с системой иммунитета. Индукция ЭМП представляется скорее тканеспецифической и управляется сложными сетями TGF-, Wnt-, сигнальных каскадов, вызванных Notch- и рецепторами роста факторов роста, которые являются основными индукторами ЭМП. Не случайно, большинство из этих путей сверхактивны при карциномах и были связаны с приобретением инвазивного фенотипа (J.H. Tsai J.,Yang,2013; J.P.Thiery, J., 2009). Кроме того, многочисленные исследования продемонстрировали, что неблагоприятные клеточные условия, такие как гипоксия или некоторые компоненты внеклеточного матрикса (то есть коллаген и гиалуроновая кислота), также могут индуцировать ЭМП в некоторых типах рака (E. Pirilia N.S Ramamurthy,T.Sorsa et al.,2003; G.Glanelli C.Bergamini E.Fransvea et al.,2005; K.Cheng, G. Xie, J.P. 2007). Несмотря на их сложность, пути, индуцирующие ЭМП имеют общую конечную точку при активации короткого списка из ЭМП-индуцирующих транскрипционных факторов (TФ) (включая Snail, Slug, цинковый палец E-box binding homeobox 1 (ZEB1), Twist, Goosecoid и FOXC2) и МЭП-индуцирующие микроРНК (MiR200 и miR34), которые управляют переключателем фенотипа (B.De Craene, G.Berx,2013). Следствием активации всех этих ТФ является транскрипционная репрессия клеточных белков, таких как E-cadherin, claudins и ZO-1, вызывая потерю целостности эпителия, а также активация программ, связанных с инвазией опухоли (A.Cano, M.A.Perez-Moreno, I.Rodrigo et al.,2000; J.Comijn, G.Berx, P.Vermassen et al., 2001; K.M.Hajra et al., 2002; V.Bolos et al., 2003; J. Yang et al., 2004). Вместо этого некодирующие микроРНК, MicroRNA200 (miR200) и miR205, используют MЭП-процесс, ингибирующий репрессоры экспрессии E-cadherin, ZEB1 и ZEB2 и, таким образом, поддерживая фенотип эпителиальной клетки (P.A. Gregory,A.G.Bert, E.I.Paterson et al.,2008; N.R.Christoffersen et al.,2007). Важно отметить, что последние достижения в характеристике пластичности ОК и переключению фенотипа на эпителиальные и неэпителиальные опухоли (например, меланомы) свидетельствуют о том, что ЭМП-МЭП может быть частью более широкого, сложного переходного периода явлений, при котором ОК могут колебаться от дифференцированных, пролиферативных, слабо инвазивных, чувствительных к лекарственным препаратам фенотипам к недифференцированному, плохо пролиферативному, проинвазивному, устойчивому к лекарственным средствам фенотипу (K.S Hoek O.M.Eichhoff, N.C.Schlegel et al.,2008; M.Saez-Ayala,M.F.Montenegro,L.Sancez-del-Campo et al., 2013; S.Huang et al.,2012; E.Z.Li, A.S.Dhilon, R.I.Anderson et al.,2015).
Таким образом, пластичность опухолевой клетки и ее регулирование, по-видимому, являются узловой точкой в прогрессировании и распространении опухоли; Следовательно, таргетинг этого явления может иметь решающее значение для иммунной системы, чтобы контролировать судьбу опухоли. Иммунные клетки могут играть двойную роль в канцерогенезе (E.Z.Li, A.S.Dhilon, R.I.Anderson et al.,2015; G.P.Dunn L.J.Old, R.D.Schreiber, 2004). Хотя мощный противоопухолевый иммунный ответ часто возникает для контроля первых шагов злокачественной трансформации (M.J.Smith,2008, M.J.Smith, N.Y.Crowe, D.I. Goldfrey,2001, M.Girardy D.E.Oppenheim C.R.Steele et al.,2012), на более поздних стадиях опухоли, трансформированные клетки могут не только противодействовать иммунной функции, но также использовать иммунный отклик как союзника в прогрессии опухоли (D. Hanahan, L.M. Coussens, 2012). В этом контексте, недавние исследования показали, что ЭМП может быть локально связан с наличием гранулоцитов, T-regs, M2 макрофагов или MDSC, указывая роль различных типов иммунных клеток в ЭМП-индукции (C.Y. Liu, J.-Y. Xu X.Y.Shi et al.,2013; D.Marvel & D.I.Gabrilovich, 2015; K. Oguna, HOshima, M.Aoki et al., 2008C. Kudo-Saito, H.Shirako, T. Takeuchi et al., 2009; C.Mayer, S. Darb-Esfahani, A.Meyer et al.,2016). Эти исследования также показывают, что ЭМП может преимущественно вызывать или быть вызван подавляющими (супрессорными) иммунными клетками. Более того, ЭМП может непосредственно определять мезенхимально-подобные иммуномодулирующие особенности опухолевых клеток (M. Riccardi et al.,2015). Наконец, ЭМП могут повысить иммуногенность раковых клеток, способствуя их побегу из опосредуемой Т-клетками атаки (immunoediting) (G.P.Dunn et al,2004; M.Kmieciak et al.,2006; K.L.Knutson, H.Li, B.Stone et al., 2006). Связь между иммунизацией и продвижением ЭМП была исследована на сингенных иммунокомпетентных мышах, с трансплантированными им эпителиальными раками, экспрессирующими нейрононген (M.Kmirciak et al.,2007). Как и ожидалось, иммунный надзор привел к макроскопическому удалению опухоли, которое, однако, была не завершено. Действительно, рецидив опухоли произошел, и новые поражения были обогащены нейро-отрицательными злокачественными клетками с мезенхимальным фенотипом. Учитывая потенциальный противоопухолевый и антиметастатический эффект, важным и все еще открытым остается вопрос о том, как NK-клетки могут функционально взаимодействовать с клетками при проведении ЭМП, насколько релевантно это потенциальное взаимодействие, и может ли оно выполнять функцию контроля за оборотом ОК в организме пациента.
NK-клетки и ЭМП. Взаимное влияние ЭМП и NK-клеток изучается около 10 лет, и ответов нет еще до сих пор. Только в нескольких исследованиях рассматривается вопрос о потенциальных изменениях опухолевой иммуногенности при ЭМП и ее влияние на NK клеточно-опосредованные реакции. В недавнем исследовании, L’opez-Soto и коллеги описали значительное повышение активности NKG2D-активирующих лигандов в раковых клетках толстой кишки, подвергающиеся ЭМП, а также замечательное подавление экспрессии HLA-I. Они предположили, чтобы ЭМП может повысить иммуногенность раковых клеток в направлении NK-клеток и способствуют очистке опухоли в NKG2D-зависимым способом. Они также показали, что экспрессия MICA/B белков (основных лигандов для рецептора NKG2D) было очень низкое в развитых опухолях in vivo с инвазивными свойствами. Одновременно большее присутствие NKG2D + цитотоксических инфильтрирующих опухоли лимфоцитов (TILs) наблюдались в эти образцах.
Роль NK-клеток в модуляции фенотипа опухолевой клетки может быть особенно значительной в контексте опухолевых клеток, которые выделяют очень низкие уровни HLA-I и не могут эффективно стимулировать Т-клетки. У клеток нейробластомы часто отмечается низкая или отрицательная поверхностная экспрессия HLA-I (N-KVCheung, M.A. Dier, 2013; C.Bottino et al., 2014). В этом случае, адаптивная иммунная устойчивость/иммунизация могут быть управляемыми NK-клетками, а не Т-клетками. Однако, несмотря на отсутствие экспрессии HLA-I, нейробласты, выделенные из костного мозга, показали, что аспираты костного мозга достаточно устойчивы к элиминации, опосредованной NК-клетками. Это сопротивление было связано с отсутствием лигандов для активации рецепторов (то есть PVR, распознается по DNAM-1) или с высокой экспрессией B7-H3, лиганда для еще неизвестного ингибирующего NK-рецептора (C.Bottino et al.,2014). Таким образом, эти метастатические нейробласты вряд ли могут стимулировать как T, так и NK клетки, что может привести к отсутствию продукции IFN-γ. Эта ситуация может объяснить недавно выявленный факт, что такие агрессивные нейробласты не конститутивно экспрессируют PD-L1 (A.Dondero, F.Pastorino, M.Della Chesa,2016). Недавно было показано, что, действительно, метастатические нейробласты могут приобрести PD-L1 (и HLA-I) в ответ на IFN-γ. Также необходимо принимать во внимание, что фактическая оценка возможного воздействия NK-клеток на фенотип опухолевой клетки и пластичность не может не учитывать эффективное расположение инфильтрата NK в опухолевой ткани.
Инфильтрация NK-клеток в твердых опухолях. Изучение инфильтрата NK-клеток в твердых опухолях стало возможным лишь недавно, благодаря появлению новых иммуногистохимических реагентов для специфического детектирования NK-клеток и наличие еще более эффективных подходов к выделению и/или анализу специфических популяций лимфоцитов из тканей. Инфильтрат NK-клеток оценивали в нескольких типах солидных опухолей, включая меланомы (M.Balsamo et al.,2012; S. Burke et al.,2010), желудочно-кишечные стромальные опухоли (GIST) (S.Rusakiewicz,M.Semeraro,M.Sarabri et al., 2013), колоректальный рак M.H.Sandel et al.,2016), рак почек(R.Remark et al.,2013), рак легких (G.Esendagli, K.Bruderek, T. Golgmann et al.,2005) и рак молочной железы (E.Mamessier,A.Sylvain, M.L. Tibult et al.,2011). В некоторых случаях роль инфильтрирования NK-клеток в контроле свидетельствовала о прогрессировании опухоли. Два исследования почечно-клеточной карциномы и гастроинтестинальной стромальной опухоли выявили корреляцию между уровнями инфильтрата NK-клетками и лучшим прогнозом (R.Remark et al.,2013). Еще одно интересное исследование по GIST показывает, что число NKp46 + TILs обратно коррелирует с наличием метастазов при постановке диагноза и указывает, что разные изоформы активирующего рецептора NKp30 могут ассоциироваться с уменьшением или с продолжительной выживаемостью пациентов (N.E.Delahaye, S. Rusacewicz, I.Martins et al.,2011). Али и его коллеги также недавно показали, что опухолевая инфильтрация лимфатических узлов (ЛУ) у пациентов с меланомой обогащены цитотоксическими CD56 DimCD57 + KIR + NK клетками (вместо плохо цитотоксических CD56яркие NK-клетки, которые обычно расположены в ЛУ) (T.H.Ali, S. Pisanti, E.Ciaglia et al.,2014). В этом контексте следует, что цитотоксическая активность пула клеток NK может значительно варьировать среди индивидуумов, и что низкая активность клеток NK в ПК были связаны в прошлом с повышенным риском для многих раков (K.Imai et al.,2000; D.R.Straer et al.,1984). С другой стороны, несколько данных, имеющихся в литературе, ставят под сомнение реальное воздействие NK-клеток на прогрессию опухоли. Некоторые исследования указывают на дефицитную или умеренную NK-клеточную инфильтрацию при меланомах, раках толстой кишки и опухолевых тканях микроматрикса (M.Balsamo et al., 2012; G.Sconocchia, R Arriga, L.Tornilo, 2012). Кроме того, фенотип и функция прорастающих опухоль NK-клеток показали плохое обогащение цитотоксического CD56Яркий NK клеток (в тканях опухоли легкого и молочной железы) или присутствии исправленного функционала CD56Тусклый NK-клеток в различных типах опухолей. Наконец, независимые исследования по колоректальному раку, меланоме и гастроинтестинальной стромальной опухоли показали, что NK-клетки в основном располагаются в строме, а не в прямом контакте с опухолевыми клетками (A.Stoyanovich & A. Cervenka,2011). В целом, эти противоречивые данные указывают на все еще открытые вопросы о том, как вербуют и мигрируют ОК к NK-клеткам, в частности, и как регулируется ЭМП в опухолевой ткани. В целом процесс миграции будет зависеть от того, какие клетки и клетки внеклеточного матрикса (ВКM) взаимодействуют, от модуляции компонентов ВКM, наличия специфических хемокинов, а также модель хемокиновых рецепторов выраженных различными типами NK-клеток (P.A.Albertsson et al.,2003). Модели хемокиновых рецепторов наиболее изученных ПБ подмножества NK-клеток (т. е. CD56 Яркие клетки и составные группа CD56 Dim клеток) были приблизительно определены, хотя некоторые опубликованные исследования расходятся во мнении относительно экспрессии некоторых специфических рецепторов. Такие расхождения могут зависеть от чувствительности антител, используемых для проточного цитометрического анализа или от использования различных клеток и методов изоляции (которые могут изменять хемокиновый рецептор для распознавания специфическим реагентом) (J.J.Campbell, S. Qin, D. Unutmas et al.,2001; M.Inngjerdingen et al.,2001). Хорошо установленные данные показывают, что CD56 DimCD16+ клетки экспрессируют CXCR1, ChemR23 и CX3CR1 на высоких уровнях и способны реагировать на CXCL8 и CX3CL1 (G. Bernardini et al.,2012). Соответственно, эти клетки могут пересекать эндотелий и достигать воспаленных тканей или опухолевой массы.
Следовательно, состав и локализация инфильтрата NK-клеток будет сильно варьироваться в зависимости от типа цитокинов и хемокинов, имеющихся в опухоли. Было показано, что у мышей, использующих NK, чувствительные к опухолевым клеткам, IFN-ɣ может вызывать высвобождение CXCL9—10 путем инфильтрации опухоли иммунными клетками, сто приводит к рекрутированию клеток CXCR3 + NK-клеток (M. Wendel et al.,2008). В другом исследовании на мышах было показано, что хемоаттрактант молекулы чемерина может способствовать набору NK клеток в трансплантируемой меланоме B16 (F.Vianello et al.,2006). Интересно, что у человека экспрессия гена, кодирующего чемерин, была снижена в нескольких типах опухоли (R.A.Pachinskiet al.,2012).
В недавнем исследовании, сравнивающем NK клетки ПК от здоровых доноров и пациентов с нейробластомой было показано, CD56 Dim NK-клетки проявляют значительно уменьшенную экспрессию хемокинового рецептора CX3CR1, вовлеченного в процесс клеточной экстравазации. В другом исследовании Халама и коллеги показали недостаточную инфильтрацию NK-клеток в колоректальном раке, несмотря на высокие уровни привлечения NK-клеточных хемокинов внутри опухоли. Эти данные показывают, что управляемые опухолью механизмы эвакуации могут влиять на жизнеспособность в нише опухоли NK-клетки или препятствовать рекрутированию NK-клеток в опухолевом участке, и также предполагают, что хемокины как дополнительные молекулы хемоаттрактанта могут быть необходимы для вербовки. С этой точки зрения оценивалась роль HMGB1 как хемоаттрактанта для NK-клеток в опухолях. Фактически, этот плейотропный эффект недавно вступил в действие в различных аспектах биологии опухолей и не в последнюю очередь в ЭМП.
HMGB1, иммунные клетки и опухолевые клетки. HMGB1 является широко экспрессированным белком, главным образом, локализованным в клеточном ядре и участвующем в ремоделировании и транскрипции хроматина (J. O. Thomas and A. A. Travers, 2001). Однако после активации клеток различными физиопатологическими стимулами, этот белок может подвергаться посттрансляционной модификации, которая способствует его транслокации в цитозоль и его выходу за пределы клетки, через неклассическую секрецию, которая требует LAMP1-позитивных лизосом (H. Lee, N. Shin, M. Song et al.,2010). HMGB1 также может подвергаться пассивному высвобождению из поврежденных или некротических клеток, и ведет себя как связанная с повреждением молекулярная модель (DAMP), способная активировать и усиливать воспалительные и иммунные реакции (H. S. Hreggvidsdottir, T. Ё Ostberg, H. WЁahЁamaa et al.,2009; A. Didangelos, M. Puglia, M. Iberl et al.,2016). Аутофагия –необходимая индукция для этого белка, что необходимо для поступления HMGB1 от умирающих клеток, позволяя предположить, что манипуляция аутофагией во время лечения рака может влиять на иммуногенность умирающих опухолевых клеток (J. Thorburn, A. E. Frankel, and A. Thorburn,,2009). Более того, HMGB1 идентифицируется как цитокин-высвобождающий фактор, который стимулирует продукцию TNF-α, IL-1β, IL-6 и IL-8 от макрофагов и нейтрофилов (M. T. Lotze, H. J. Zeh, A. Rubartelli et al., 2007). На сигнальные свойства HMGB1 оказывают влияние окислительно-восстановительное состояние его цистеиновых остатков, локализованное в позициях 23, 45 и 106 (H. Yang, P. LundbЁack, L. Ottosson et al., 2012). В этом отношении ингибирующий HMGB1 взаимодействует с CXCL12 и гетерокомплекс ведет себя как хемоаттрактант для мышиных макрофагов и фибробластов, и для моноцитов человека путем взаимодействия CXCR4 (E. Venereau, M. Casalgrandi, M. Schiraldi et al.,2012; M. Schiraldi, A. Raucci, L. M. Mu˜noz et al.,2012). Более того, HMGB1 также может индуцировать хемотаксис незрелых ДК, происходящих из моноцитов человека с помощью RAGE (D. Yang, Q. Chen, H. Yang, et al.,2007). Напротив, частичное и обратимое окисление HMGB1 (C23-C45 дисульфида связывание) требуется для активации TLR4-опосредованного производства цитокинов из макрофагов (H. Yang, H. S. Hreggvidsdottir, K. Palmblad et al.,2010). Вместо этого HMGB1, выделяемый апоптотическими клетками характеризуется необратимым окислением C106 до сульфоновой кислоты с помощью ROS. В этом состоянии окисления HMGB1 не обладает цитокин-индуцирующей активностью, индуцирует толерантность РС, а также способствует гибели клеток после химиотерапевтических средств (H. Kazama, J.-E. Ricci, J. M. Herndon, G. Hoppe,2008). Наконец, полностью окисленная форма HMGB1 также описана, но ее функции еще не оценены. В дополнение к редокс-статусу, несколько посттрансляционных модификаций могут иметь отношение к функции HMGB1. В настоящий момент, идентифицированные модификации молекул HMGB1, экспортируемые из врожденных иммунных клеток, состоят из гиперацетилирования (T. Bonaldi, F. Talamo, P. Scaffidi et al.,2003; B. Lu, D. J. Antoine, K. Kwan et al.,2014), поли-АДФ-рибозилирования (K. Davis, S. Banerjee, A. Friggeri, et al.,2012) и фосфорилирования по CAMK IV и PKC (X. Zhang, D. Wheeler, Y. Tang et al., 2008). Воздействие этих молекул на изменения отношения HMGB1 к его различным рецепторам и их роль в клеточных ответах в солидных опухолях пока не изучена. Наконец, следует также учитывать, что HMGB1 может быть связан с различными растворимыми молекулами, такими как IL-1β, LPS, Pam (3) Csk (4) и вышеупомянутыми CXCL12, которые усиливают иммуностимулирующую активность (H. WЁahЁamaa, H. Schierbeck, H. S. Hreggvidsdottir et al.,2011). Из-за молекулярной пластичности HMGB1, как самостоятельно, так и в комплексе с другими молекулами, может взаимодействовать с несколькими рецепторами, включая RAGE, IL-1R, TLR2, TLR4, CXCR4, NMDA-R и TIM-3 (H. WЁahЁamaa, H. Schierbeck, H. S. Hreggvidsdottir et al.,2011; H. S. Hreggvidsdґottir, A. M. Lundberg, A.-C. Aveberger et al.,2012; G. Li, X. Liang, and M. T. Lotze,2013). Ряд стимулов могут вызвать HMGB1 из клеток врожденной иммунной системы. В частности, активный экспорт HMGB1 индуцируется моноцитами, макрофагами и DC, активируемыми PAMP, DAMP или цитокинами. Кроме того, также NK-клетки могут активно высвобождать HMGB1 в контексте перекрестного обсуждения NK: ДК или на участие различных активирующих NK-клеточных рецепторов, включая те, которые в основном участвуют в распознавании опухолевых клеток (H. Wang, O. Bloom, M. Zhang et al.,1999; S. Qin, H. Wang, R. Yuan et al.,2006; M. Parodi, M. Pedrazzi, C. Cantoni et al.,2015). С другой стороны, нейтрофилы в основном проходят пассивное высвобождение HMGB1 после повреждения/некроза клеток (I. Ito, J. Fukazawa, and M. Yoshida,2007). Кроме того, врожденные иммунные клетки, эндотелиальные клетки и фибробласты также могут активно высвобождать HMGB1 после воздействия мочевой кислоты и ЛПС, соответственно (K. Feghali, K. Iwasaki, K. Tanaka et al.,2009; M. M. Rabadi, M.-C. Kuo, T. Ghaly et al., 2012). Следует также отметить, что несколько врожденных иммунных клеток являются мишенями HMGB1. В частности, на незрелых ДК моноцитов, HMGB1 активирует специфические маркеры созревания (CD80, CD83, CD86, и HLA-I), усиливает продукцию цитокинов (IL-6, CXCL8, IL-12 p70 и TNF-α), переключает их хемокины.
Чувствительность HMGB1 от чувствительных к CCL5 и к CCL21 индуцирует способность клеток стимулировать пролиферацию аллогенных клеток. Кроме того, HMGB1 выделяется из первичных опухолей, может достигнуть регионального ЛУ и ослабить их антиметастатические свойства путем снижения количества резидентных макрофагов (Y.Moriwaka, Y. Luo, H. Ohmori et al.,2010). В зависимости от его концентрации, HMGB1 может индуцировать или ингибировать хемотаксис нейтрофилов в результате взаимодействия оf RAGE, TLR2 и TLR4 (F. Berthelot, L. Fattoum, S. Casulli,2012). Существенная роль HMGB1 как критического модулятора врожденного иммунитета в опухолях in vivo, свидетельствует о том, что имеется HMGB1-дефицит. Опухоли проявляют нарушенную способность к набору клеток врожденного иммунитета, включая макрофаги, нейтрофилы и NK-клетки для последующей алкилирующей терапии опухолевой ткани (J. L. Guerriero, D. Ditsworth, J. M. Catanzaro et al.,2011). Новый механизм, предложенный для рекрутинга NK –клеток на участке опухоли представлен на рисунке 1.
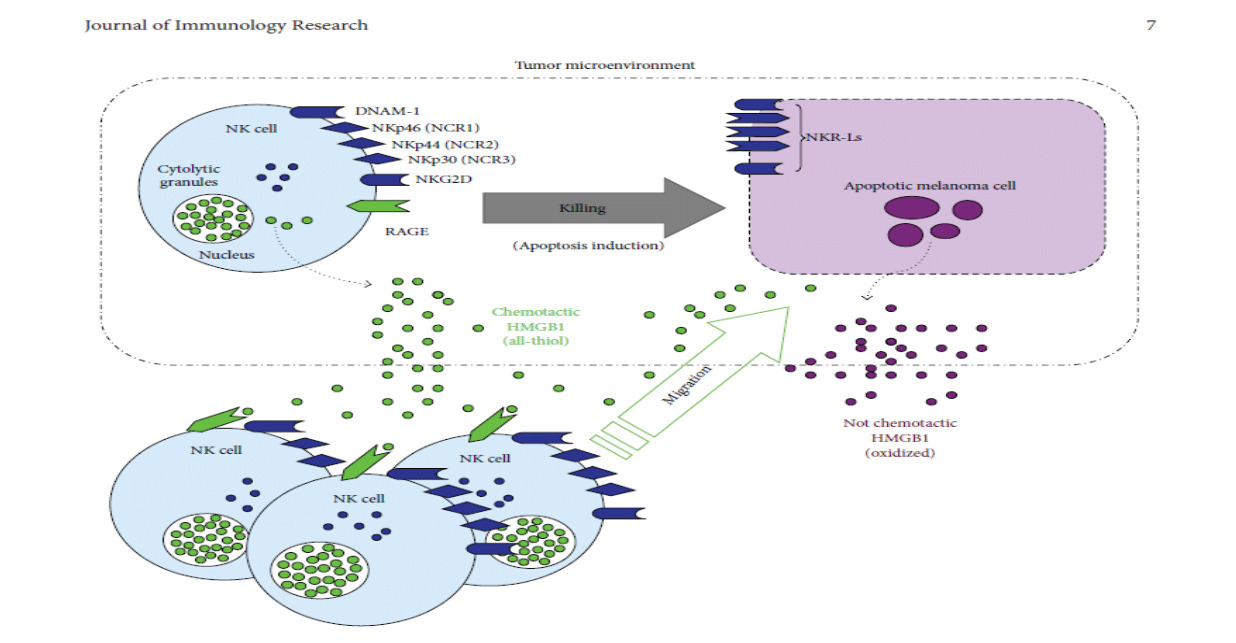
Рисунок 1. Новый механизм, предложенный для рекрутинга NK-клеток на участке опухоли меланомы. NK-клетки узнают клетки меланомы через взаимодействие NK-активирующих рецепторов с их лигандами (NKR-Ls), экспрессируемыми на опухолевой клетке (обе изображены темно-синим цветом). Полученная активация NK-клеток приводит к гибели меланомы (через перфорин/гранзим В и индукцию апоптоза) и к активному высвобождению хемотаксической формы HMGB1 (зеленые круги).Убитые (апоптотические) клетки пассивно высвобождают HMGB1 в виде окисленной молекулы. Однако эта HMGB1 форма не обладает хемотаксическими свойствами (пурпурные круги) Полученный NK-восстановленный (т.е. all-thiol) HMGB1 может действовать как хемоаттрактант для активированных NK клеток через взаимодействие RAGE (изображено зеленым), тем самым способствуя их рекрутированию в микроокружение опухоли (цит. из J.Immunology Research)
Внутриклеточное количество HMGB1 значительно увеличивается в ряде опухолей человека, таких как рак легких, рак мочевого пузыря, колоректального рака, рак головы и шеи, предстательной железы, гепатоцеллюлярный, рак желудка и меланома. Это наблюдение позволяет предположить, что опухолевые клетки могут высвобождать большие количества HMGB1 либо при утечке через мембрану, либо путем активного высвобождения в воспалительных или гипоксических состояниях, которые часто наблюдаются в солидных опухолях и ассоциируются с повышением прометастатического поведения (W. Yan, Y. Chang, X. Liang et al.,2012). Внеклеточный HMGB1 может играть дальнейшие роли в раке через активацию эндотелиальных клеток. В частности, форма all-thiol обладает проангиогенной активностью, которая поддерживает рост опухоли (S. Mitola, M. Belleri, C. Urbinati et al.,2006; J. R. van Beijnum, P. Nowak-Sliwinska, E. van Den Boezem et al.,2013). Гетерогенные реакции, наблюдаемые в различных условиях, могут зависеть от местной концентрации различных окислительно-восстановительных форм белка, от типа клеточных рецепторов вовлеченных HMGB1, и о наличии специфических растворимых HMGB1-связывающих молекул. Таким образом, HMGB1 как опухолевые, так и иммунные клетки могут накапливаться в микроокружении опухоли и поддерживать воспаление, участвовать в высвобождении цитокинов, пролиферации клеток и рекрутировании иммунных клеток. Полная характеристика этих эффектов и оценка их важности в контексте опухоли, их разработка (или контроль) может иметь решающее значение для идентификации новых контрольных точек в организме хозяина: взаимодействие с опухолью и определение эффективных терапевтических целей. В этом контексте C.Cantoni, L.Huergo-Zapico, M. Parodi et al. (2016) недавно описали новый механизм, с помощью которого HMGB1 может сильно влиять на присутствие и эффективность NK -клеток на участке опухоли.
Роль HMGB1 в NK-клеточно-опухолевом взаимодействии. Недавно роль HMGB1 рассматривалась в контексте врожденного иммунного ответа против опухолей, исследуя функции этого белка во взаимодействии с NK-клетками: меланомных клеток и в последующей NK-опосредованной гибели опухолевых клеток. Было показано, что во время взаимодействия с клетками меланомы, NK-клетки могут высвобождать форму HMGB1 с хемотаксической активностью, в то время как убитые клетки меланомы пассивно выделяют окисленную, не хемотаксическую форму HMGB1 (Рисунок 2). Хемотаксический HMGB1 может притягивать активированные NK-клетки через сцепление с RAGE, который, действительно, выделяется на поверхности NK-клеток. Интересно, что после длительного воздействия HMGB1, NK-клетки не улучшают их хемотаксические свойства; скорее, они демонстрируют повышенную подвижность клеток, что сопровождается выраженными изменениями в нескольких белках, участвующих в регуляции цитоскелетной сети (M. Parodi, M. Pedrazzi, C. Cantoni et al.,2015). По всей видимости, это новый механизм, посредством которого HMGB1 может поддерживать противоопухолевое свойство NK-клеток. Действительно, HMGB1 первоначально может играть решающую роль в рекрутировании NК-клеток в сайт NK: взаимодействие опухолевых клеток; затем он улучшает способность патрулирования NK-клеток, достигших опухоли, повышая их подвижность. Наличие HMGB1 в контексте NK: клеточное взаимодействие также может играть роль в развитии опухоли. Недавние наблюдения показывают, что HMGB1 является мощным водителем ЭМП в колоректальной карциноме посредством активации пути RAGE/улитка/NF-κB и MMP-7 (L. Zhu, X. Li, Y. Chen, J. Fang, andZ.Ge,2015). Было показано, что NK-клетки, часто появляются прежде инвазии опухоли там, где, вероятно, и произойдет процесс ЭМП. Таким образом, в этой ситуации HMGB1 может решить проблему дополнительных NK-клеток в этом районе, которые, в свою очередь, высвобождают далее HMGB1, таким образом, способствуя ЭМП. Следует отметить, что NK-клетки также экспрессируют TIM-3, который, как было показано, распознает HMGB1 (M. Pedrazzi, M. Averna, B. Sparatore et al.,2012). Кроме того, HMGB1 также может влиять на функцию NK-клеток и потенцировать активность NMDA-рецептора (M. Pedrazzi, M. Averna, B. Sparatore et al.,2012). В самом деле, активация этого канала белка в NK-клетках человека, T-лимфоцитах и нейтрофилах, как было показано, увеличивает производство РОС (A. A. Boldyrev, E. A. Bryushkova, and E. A. Vladychenskaya,2012). Эти рецепторы, по-видимому, не могут модулировать HMGB1-опосредованный NK-хемотаксис, но их возможный хемотаксис не исключает участие в дополнительных функциях.
В то время как в нескольких отчетах показана неэффективность NK-клеток в контроле роста опухоли и инвазии, роль NK-клеток в профилактике метастазов была описана при различных типах рака и у опухолей, инфильтрированных большим количеством NK-клеток, прогноз был более благоприятным. Таким образом, неудивительно, что в последние годы эти клинические испытания показали результаты с хорошей перспективой. Поэтому было бы непопулярно спрашивать о их потенциальной роли в прогрессировании опухоли. Тем не менее, во время противоопухолевых иммунных ответов NK-клетки могут представлять источник IFN-γ, который потенциально способствует адаптивному иммунной устойчивости опухолевых клеток и TNF-α, известного индуктор ЭМП. Кроме того, NK-клетки могут часто располагаться в строме, на границе с инвазивным фронтом опухоли, где, действительно происходит ЭМП (то есть, это переходный фенотип опухолевых клеток). Таким образом, очевидно, что NK-клетки, несмотря на их потенциальную способность контролировать метастазы, также могут играть нежелательную роль при пластической хирургии. Этот спорный вопрос должен быть прояснен. Как NK-клетки рекрутируются, мигрируют в пределах опухоли и влияют на ЭМП, а также каково новое понимание предполагаемой роли HMGB1, в обеспечении новых важных элементов для максимизации еще неисследованного потенциала NK-клеток в терапии солидных опухолей пока не очень ясно. Однако, не смотря на все потенциальные возможности NК-клеток и других клеток врожденного и приобретенного иммунитета в уничтожении ОК, трансформированные неопластическим процессом солидные клетки способны уклоняться от элиминации.
Очень наглядную схему взаимодействия опухолевых клеток и клеток иммунной системы представили специалисты в онкоиммунологии C.A. Janeway (2004) (рисунок 2).
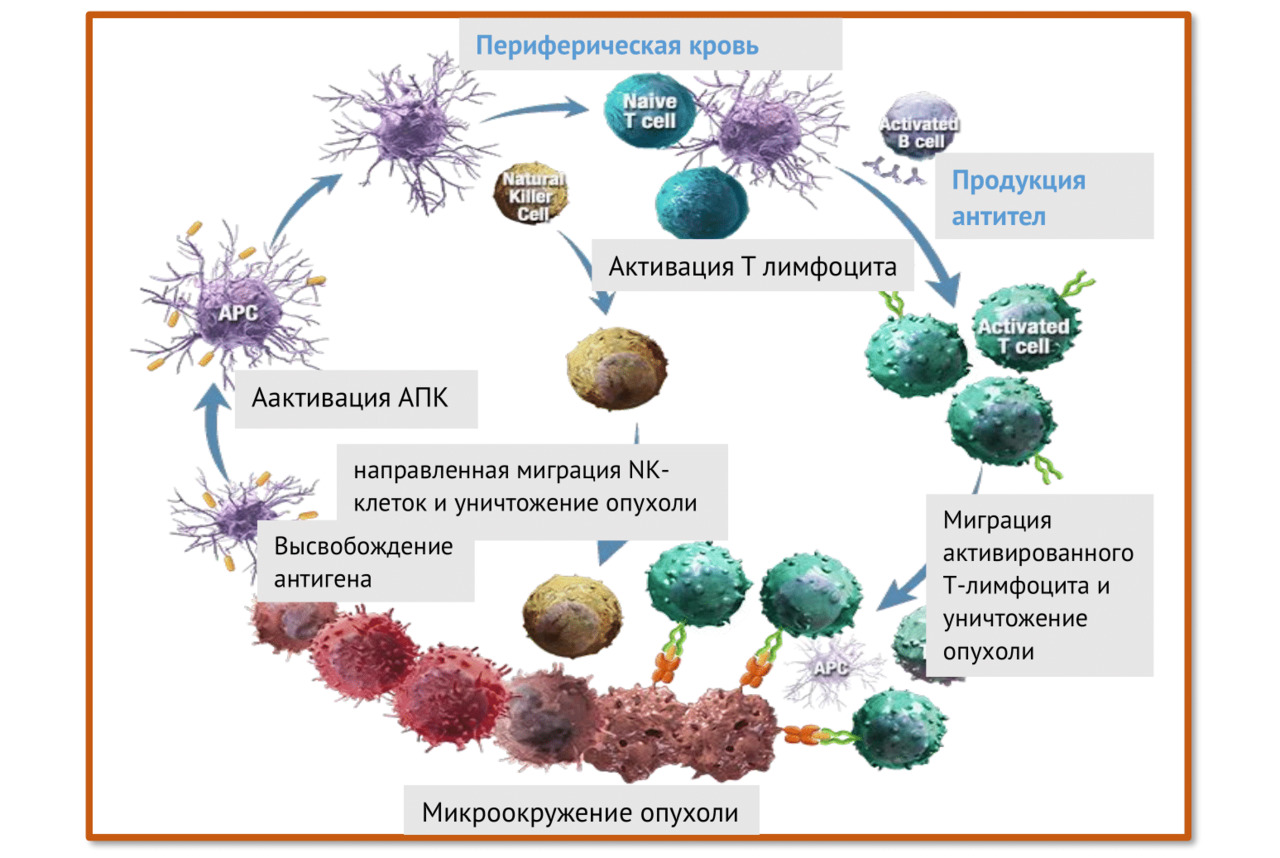
Рисунок 2. Многочисленные сложные механизмы, которыми иммунная система распознает и уничтожает рак. (цит. по Janeway CA, et al. Immunobiology: The Immune System in Health and Disease. 6th ed. New York, NY: Garland Science; 2004; Padmanabhan RR, et al. J Leuk Biol. 1988;43:509–519; Kim R, et al. Immunology. 2007;121:1–14; Vivier E, et al. Science. 2011;331:44–49; Dunn GP, et al. Nat Immunol. 2002;3:991–998, адаптация рисунка проф. В. А. Горбунова,2018).
На этих феноменах и иммунных механизмах мы остановимся в следующей главе.
Глава 3. Системные и частные молекулярно-биологические механизмы уклонения опухолевых клеток от иммунного надзора
Патогенетические механизмы уклонения ОК и ОСК от иммунного надзора и ускользания от регуляторного контроля клеток врожденного и приобретенного иммунитета в организме онкологического больного можно условно разделить на два фундаментальных типа: общие системные и частные молекулярно-биологические механизмы. Общие механизмы уклонения ОК от клеток иммунной системы онкологического больного обусловлены системными закономерностями клеточных взаимодействий и взаимоотношений между системой ОК, клеточной системой иммунитета пациента и клеточной системой ткани определенного органа, в которой, собственно, и разворачивается онкологический процесс. Частные механизмы уклонения ОК от иммунного надзора связаны с конкретными условиями и локальными взаимодействиями ОК с клетками иммунной системы и с молекулярно-биологическими характеристиками киллерных иммунных клеток и особенностями параметров комплекса гистосовместимости ОК (Новиков В. И., Власов А. А.,2006).
Как утверждает ряд отечественных и зарубежных онкологов (Давыдов М. И., 2017, Личиницер М. Р.,2016, Бережная Н. М., 2015, J.F Rossi, 2017), сегодня доказано, что, во-первых, опухоль может развиваться в условиях абсолютно неизмененной иммунологической системы, во-вторых, даже на последних стадиях опухолевого процесса могут активироваться функции ряда клеток системы иммунитета, и, в-третьих, факт возможности иммуностимуляции роста опухоли бесспорен. Таким образом, современную иммунологию опухолей характеризуют переосмысление и переоценка некоторых ранее незыблемых научных утверждений, и приход к убеждению, что онкологические заболевания не являются иммунопатологией, в отличие от аутоиммунных и аллергических заболеваний, при которых нарушения в системе иммунитета являются главной причиной развития заболевания. При опухолевом процессе изменения со стороны иммунологической системы во многих случаях обусловлены влиянием уже возникшей и развивающейся опухоли, то есть являются вторичными (Бережная Н. М., 2015) и/или связаны со специфическим противоопухолевым лечением (ЛТ и ХТ). Очевидно, что в организме человека не существует запрограммированного в геноме иммунокомпетентных клеток иммунного ответа на рост опухоли и появление опухолевых антигенов, как это бывает при инфекционных заболеваниях. Поэтому иммунный ответ формируется в результате непосредственного взаимодействия клеток иммунной системы и ОК, и каждый раз он индивидуален.
В настоящее время еще не до конца определены все процессы, которые обеспечивают «ускользание» опухоли от иммунологического контроля и надзора. Результаты исследований последних лет подтверждают, что взаимодействие опухолевых и иммунокомпетентных клеток, а также его результативность в большой степени зависят от биологических свойств ОК, которые, к сожалению, часто определяют исход этого процесса. Не случайно появилось такое понятие, как «стратегия опухолевой клетки» (Бережная. М.Н.,2015), включающее множество известных и не известных возможностей ОК, которые она мобилизует для продолжения своего роста. ОК способна реализовать свою «стратегию» на всех этапах взаимодействия, начиная с распознавания. И есть все основания говорить о большом разнообразии механизмов ее «ускользания» от иммунологического контроля, хотя многое в этом вопросе еще предстоит выяснить (Кадагидзе З. Г.,2017).
В настоящее время изучены основные системные и частные молекулярно-биологические механизмы уклонения ОСК и её потомков от иммунологического надзора, что во многом объясняет, почему до настоящего времени так и не создано эффективного лекарства от рака и не разработано эффективных методов полного излечения онкологических больных. Иллюстрацией системного механизма уклонения ОСК и её потомков от надзора иммунной системы может быть следующий пример из математической теории систем. Известно, что управляющим в любом системном процессе (онтогенез, эмбриогенез, полет в космос, движение транспортной колонны и т.д.) является самая медленная фаза. Рассмотрим роль управляющего фактора на модели транспортной колонны автомобилей. Что является системообразующим в движущейся по дороге колонне автомашин (трактор, автобус, гоночный автомобиль, мотоцикл и т.д.)? Очевидно, что это скорость самого медленного движущегося транспортного средства — трактора! Скорость самого медленного средства является системообразующим фактором для существования автоколонны. Каждый химик знает, что в любых биохимических процессах регулирующей также является самая медленная фаза и скорость происходящих процессов в химической системе.
В организме онкологического больного локально биохимически и системно взаимодействуют между собой три основные клеточные системы: 1. Иммунная система человека, во главе иерархии которой стоит гемопоэтическая СК (ГСК), и все клетки иммунной системы являются потомками этой ГСК (1-я система), 2 Система клеток органа или ткани, вовлеченных в неопластический процесс, где во главе иерархии стоит тканеспецифическая СК (нейральная СК, мезенхимальная СК и т.д.) (2-я система); 3. Система ОК, во главе иерархии которой стоит ОСК, и все ОК являются прямыми потомками ОСК (3-я система). Рассмотрим их системные взаимоотношения на примере мультиформной глиобластомы, развившейся в головном мозге человека. Клеточный цикл ГСК человека — самый медленный из всех клеток крови и составляет 360 дней, а время образования первого гемопоэтического предшественника от ГСК составляет 21—22 дня. Клеточный цикл развития нервной ткани составляет 100—120 лет, а время формирования первого предшественника из нейральной СК составляет 20—21 день. Клеточный цикл мультиформной глиобластомы составляет всего 36 дней, но время формирования первого предшественника (ОК) от ОСК (глиомасферы) составляет 28 дней. То есть, в соответствие с математической теорией систем (Ю.И.Неймарк,1989) при непосредственном взаимодействии этих систем на уровне СК и клеток-предшественников в организме больного все клетки 1-й и 2-ой системы встанут в подсистему к третьей системе, где на уровне предшественников выявляется самая медленная фаза, и именно она станет управляющей. То есть, все здоровые клетки иммунной системы, и все здоровые клетки нервной ткани головного мозга пациента, станут в подсистему к опухолевым клеткам и будут всячески содействовать выживанию ОК и долголетию существования опухоли. Поэтому, даже теоретически стимуляция и активация клеток иммунной системы у опухолевого больного не может нарушить системные механизмы клеточного баланса и уклонения ОК от уничтожения клетками иммунной системы в этих взаимодействующих системах. В данном случае системные закономерности клеточных систем позволяют понять природу научно установленного факта уклонения или ускользания ОК и ОСК от клеток иммунной системы и тканеспецифических клеток пострадавшего от неопластического процесса органа. Другими словами, все частные молекулярно-биологические случаи ускользания и уклонения ОК от иммунного контроля и надзора обусловлены зависимыми системными закономерностями межклеточных отношений опухоли с иммунной системной и клеточными системами организма, вовлеченными в неопластический процесс органа или органов и систем.
В частном случае, молекулярно-биологическое уклонение ОК от иммунного надзора выглядит, например, так (Рисунок 3): роль охранника организма и убийцы чужеродных клеток (вирусов, бактерий, опухолевых клеток) выполняют в иммунной системе NК-клетки (натуральные киллеры). Это клетки врожденного иммунитета и они имеют на своей поверхности киллерные инсулиноподобные рецепторы (КИР-рецепторы), которые должны по молекулярному репертуару совпадать с HLA-рецепторами 1 и 2 типа комплекса гистосовместимости любой клетки этого организма. В случае если они не совпадают у встреченной ими клетки, NК клетки уничтожают патологические клетки. В случае рака или ЗНО, ОК начинают усиленно секретировать белки HLA-G рецептора, который в норме есть почти на всех клетках организма. Высокая экспрессия HLA-G рецептора сигнализирует КИР рецепторам на NК клетках команду о временной неблагополучии в ней и NК –клетка в ответ снижает экспрессию своих КИР рецепторов и соответственно уменьшает активность NК клетки в отношении ОК и они не уничтожают ОК (Amiot L et al.,2011). Ничего нет более постоянного, чем что-то временное! Поэтому количество ОК в организме резко увеличивается.
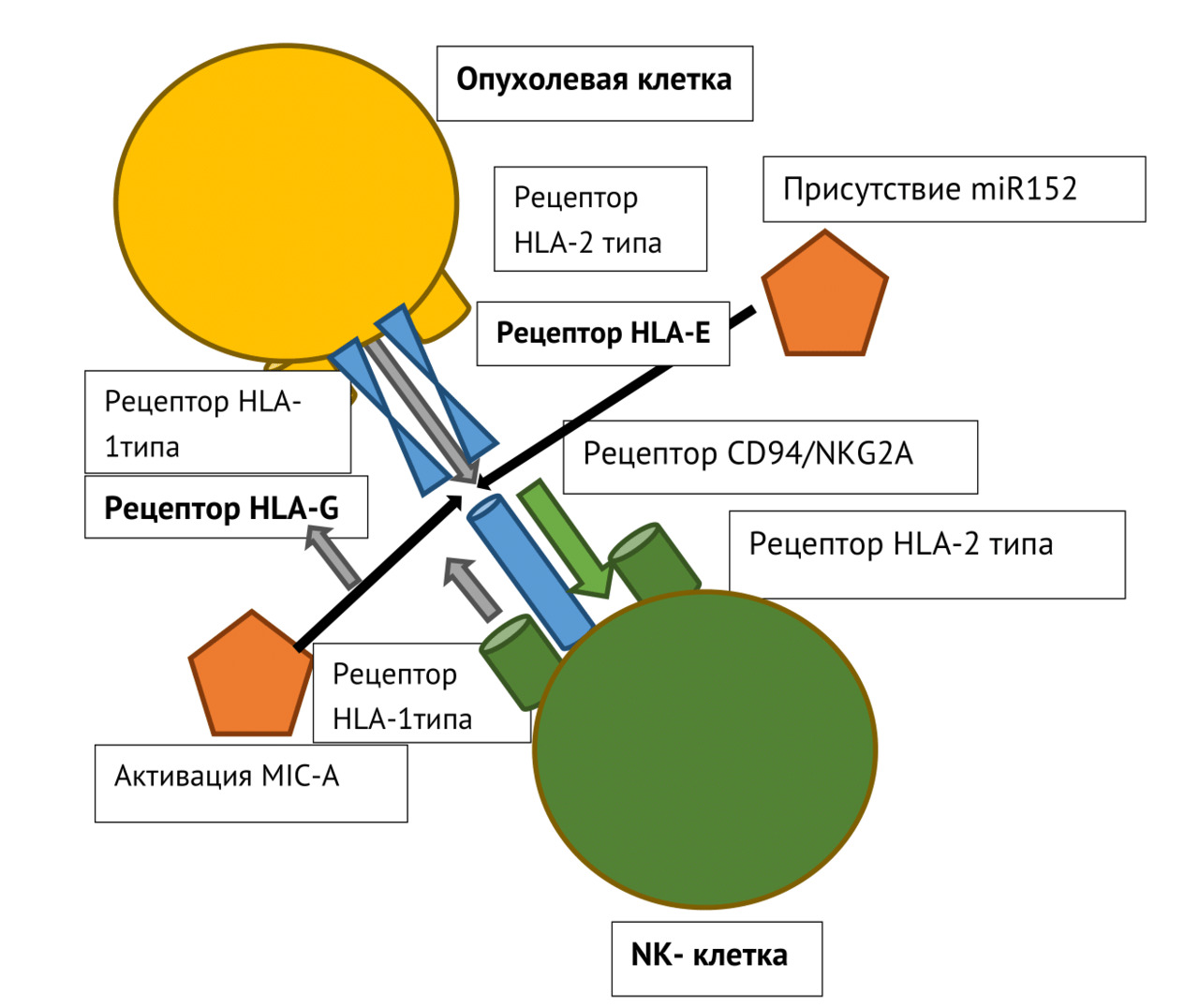
Рисунок 3. Межклеточные взаимоотношения опухолевой клетки (ОК) и НК-клеток крови. Один из механизмов уклонения ОК от киллерных клеток иммунной системы хозяина: на ОК отмечается высокая экспрессия рецепторов HLA-G, и она способствует уклонению опухоли от иммунного воздействия (цитолитического) воздействия НК клеток. Высокая экспрессия HLA-G сигнализирует НК клетке «не ешь меня, я временно нездорова» и КИР-рецепторы на НК клетках уменьшает свою экспрессию и не убивает ОК. В присутствии микроРНК miR152 экспрессия HLA-G угнетается и на фоне низкой экспрессии этого рецептора ОК становятся видимы и чувствительны к собственным НК и особенно к аллореактивным НК-клеткам.
Аналогичная ситуация происходит с ОК при встрече с Т-клетками собственной крови, имеющими аденозинэргические рецепторы, основной задачей которых также является защита тканей от избыточного повреждения клетками иммунной системы. Возникающая, в этих обстоятельствах, гипоксия приводит увеличению концентрации внеклеточного аденозина, который через A2AR рецепторы, запускает сигнал, тормозящий эффекторные функции Т-лимфоцитов. Эти Т-лимфоциты имеют более низкий цитотоксический эффект и сниженный уровень секретируемого ими гамма-интерферона.
Такая реакция ограничивает интенсивность воспалительных процессов и предотвращает повреждение нормальных тканей. Однако этот механизм позволяет ОК избежать противоопухолевого Т-клеточного иммунного ответа. Хроническая гипоксия в опухолевых тканях демонстрирует возрастающий градиент концентрации аденозина от периферии к центру. Повышенная концентрация аденозина может приводить к внутриопухолевой иммуносупрессии. Лекарственные препараты, которые блокируют гипоксия-аденозинэргический сигнальный путь, могут преодолевать иммуносупрессию и повышать воспалительную реакцию.
Существует и другая точка зрения на молекулярно-биологические механизмы ускользания клеток от иммуннного надзора. M.W. Teng, J.Galon, W.H.Fredman & M.J.Smyth (2015) пришли к выводу, что взаимодействие иммунной системы и опухоли рассматривается как процесс иммунноредактирования, состоящий из трех фаз: фаза «элиминации», фаза «равновесия» и фаза «ускользания». В период фазы элиминации врожденный и адаптивный иммунитет разрушают возникающие клетки опухоли задолго до клинического проявления болезни. В фазе равновесия некоторые ОК не разрушаются, и этап элиминации может перейти в фазу равновесия, в период которой иммунологические механизмы сдерживают дальнейшее развитие опухоли. Если опухоль «ускользает» от иммуннологического распознавания и разрушения, она прогрессирует из фазы равновесия в фазу «ускользания» и становится клинически очевидной.
Vesely MD, et al. (2011) в журнале «The Annual Review of Immunology» сформулировали эти же научные представления в виде схемы и представили как научную концепцию «иммунного редактирования» (рисунок 4).
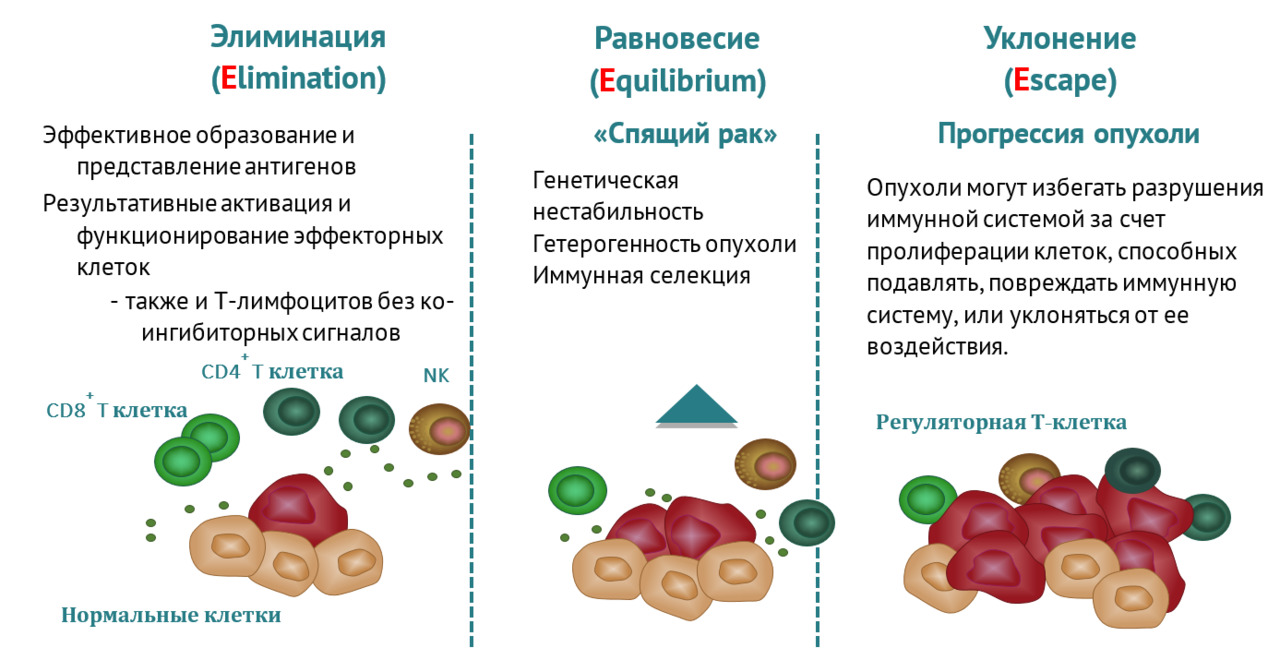
Рисунок 4. Концепция «иммунного редактирования»: роль иммунной системы в развитии и прогрессии рака (перевод и адаптация проф. Горбуновой В. А.,2018)
З.Г.Кадагидзе (2017) считает, что в настоящее время механизмы ускользания опухолевой клетки от иммунологического надзора надо разделять на три категории;
(А) редукция иммунного распознавания и стимуляции иммунных клеток в результате снижения или потери экспрессии сильноиммуногенных антигенов, или нарушения механизмов презентации антигенов, или отсутствия костимулирующих молекул.
(B) усиление активности механизмов резистентности к цитотоксическим эффекторам иммунитета (например, STAT3), или повышение экспрессии генов, ответственных за выживаемость и продукцию факторов роста (например, Bcl -2, Her-2/neu);
(С) Создание иммуносупрессивного микроокружения опухоли через:
(а) продукцию цитокинов (VEGF, TGF-β) и метаболических факторов (аденозин, PDE2),
(b) индукцию/ привлечение клеток-супрессоров (регуляторных Т-клеток и миелоидных супрессорных клеток);
(с) индукцию адаптивной иммунной резистентности путем взаимодействия соответствующих белков-лигандов с ингибиторными рецепторами (CTLA-4, PD-1, Tim-3 и другие) клеток эффекторов противоопухолевого иммунитета.
Помимо хорошо известных механизмов «ускользания» ОК от иммунного надзора, существует еще и другая сторона этого процесса в гомеостазе организма. Иммунная система способна сама значительно способствовать опухолевому росту и прогрессированию неопластического процесса. Различные популяции иммунокомпетентных клеток врожденного и приобретенного иммунитета, участвующих в иммунном ответе (NK-клетки, T-лимфоциты, NKT-клетки, макрофаги, дендритные клетки) являются гетерогенными (разнородными) и часть их наряду с иммуносупрессивным и подавляющим действием на ОК, способны к иммуностимуляции пролиферативных процессов и активации и поддержанию опухолевого роста неопластических клеточных систем. Давно известна популяция CD4+ Т-лимфоцитов, имеющих постоянную высокую экспрессию высокоаффинного рецептора IL-2 (CD 25) (Sakaguchii S., Sakaguchi N., Asano M. al.,1995) в функционировании которых важнейшую роль играет транскрипционный фактор FOXP3. Регуляторные СD4+CD25+ FOXP3 T-клетки (Трег) участвуют в обеспечении иммунологической аутотолерантности и негативном контроле как патологических, так и физиологических иммунных реакций. Они могут оказывать супрессивное воздействие на различные иммунокомпетентные клетки, включая CD8+ и CD4+Т-лимфоциты (Shevach E.M., 2009). Для подавления функции Т-клеток-эффекторов Трег используют различные механизмы. При многих формах злокачественных опухолей повышение количества Трег в опухолевом узле и ПК коррелирует с прогрессированием заболевания (З.Г.Кадагидзе, 2017).Однако при некоторых вариантах опухолей повышенное количество Трег в опухоли может являться благоприятным признаком и ассоциироваться с увеличением общей выживаемости и продолжительности безрецидивного периода (Terabe M.,Berzofsky J.A., 2008).
Связь между иммунокомпетентными клетками врожденного и приобретенного иммунитета осуществляют NKT-клетки, которые являются уникальными из-за своей способности продуцировать огромное количество различных цитокинов (TH1,TH2,TH3 и/или TH17). Сегодня эти клетки делят на клетки двух типов: NKT 1-го типа и NKT 2-го типа. Обе эти клеточные популяции имеют значение при раке и не учитывать их значение нельзя, так как они могут, как усиливать, так и подавлять противоопухолевый иммунный ответ. Считается, что супрессорную активность проявляют преимущественно NKT 2-го типа (Terabe M.,Berzofsky J.A., 2008). В лаборатории профессора З. Г. Кадагидзе (2017) было обнаружено неблагоприятное прогностическое значение СD3+CD8+CD16+NKT-клеток периферической крови у больных, страдающих генерализованной меланомой кожи, получавших лечение дендритно-клеточной вакциной. Повышение до лечения количества этих клеток коррелировало с повышением эффекта иммунотерапии и нарастало при рецидиве заболевания. Исследователи считают, что по-видимому, повышение количества NKT-клеток может быть как благоприятным, так и неблагоприятным признаком различных видах нозологий рака и зависеть от распространенности заболевания (З.Г.Кадагидзе, Черткова А. И., Заботина Т. Н. с соавт.,2014).
Основными клетками-эффекторами противоопухолевого иммунитета являются CD8+Т-лимфоциты. В то же время известно несколько популяций регуляторных СD8+ Т-клеток, способных повлиять на пролиферативную и цитотоксическую активность Т-клеток эффекторов. Определенный эффект представляют популяция CD8+CD28 — Т-лимфоцитов, которые в различных клинических исследованиях характеризуется в основном как супрессорная (Кадагидзе З. Г.,2017). G. Filaci, Fenoglio D., M.Fravega et al. (2007) показали, что только CD8+CD28 — Т-лимфоцитов, выделенные из опухоли, из ПК и из метастатических ЛУ у больных с различными типами рака и ЗНО, обладали супрессорной активностью. При этом ни у одного из 50-ти здоровых доноров эти клетки не обладали супрессорной активностью.
В последнее время значительно число исследований посвящено миелоидным супрессорным клеткам (МСК), которые вносят значительный вклад в «ускользание» опухоли от иммунологического надзора (Кадагидзе З. Г.,2017, Гривцова Л. Ю.,Тупицын Н. Н.,2017). Повышенные уровни МСК обнаруживаются почти при всех вариантах злокачественных опухолей. Во многих случаях они коррелируют с клинической стадией рака. Накапливается много данных о том, что МСК являются важным прогностическим фактором при иммунотерапии и даже предиктивным маркером клинического ответа на системную химиотерапию при многих солидных опухолях (Diaz –Montero C.M.,Finke J., Montero A.J., 2014; Бережная. М.Н.,2015).
Одним из важнейших механизмов «ускользания» опухоли от иммунологического надзора является нарушение регуляции взаимодействия активационных и ингибиторных сигналов с соответствующих ко-стимуляционных (CD28, CD 137, OX40 и другие) и ко-ингибиторных (CTLA-4, PD-1 и других) рецепторов, модулирующих процесс Т-клеточной активации. Хроническая антигенная стимуляция, часто наблюдаемая при раке, приводит к устойчивой экспрессии ко-ингибиторных рецепторов, таких CTLA-4 и PD-1 на антиген-специфических лимфоцитах (Kim P.S., Ahmed R, 2010).
В настоящее время получен ряд моноклональных антител (МКАТ) воздействующих на молекулы регулирующие иммунный ответ, так называемые контрольные точки иммунитета, что приводит к стимуляции противоопухолевого иммунного ответа (Kyi C, Postow M.A.,2014; Abdel-Wahab N, Shah M, Suarez-Almazor ME.,2016). Например, МКАТ Ипилумумаб и Тремелимумаб направлены против молекулы CTLA-4, взаимодействие которой с соответствующими лигандами (CD80/CD86) на АПК, подавляет активацию Т- клеток. Блокируя сигнал с CTLA-4, эти МКАТ продлевают активацию Т-клеток-эффекторов и восстанавливают их пролиферацию и функциональную активность (Postow M.A.,Harding J., Wolchok J.D., 2012; Abdel-Wahab N., Shah M., Suarez-Almazor M.E.,2016).
Рецептор PD-1 (B7-H1,CD 274) экспрессируется на активированных Т- и В-клетках, моноцитах и регуляторных Т-клетках. Взаимодействие с PD-1 c лигандом PD-L1 играют центральную роль в модуляции активности Т-клеток в периферических тканях (Keir M.E. et al.,2008). АнтиPD-1 МКАТ Ниволумаб и Пембролизумаб, блокируя это взаимодействие, восстанавливает количество и функцию опухолеспецифических CD8+Т-клеток-эффекторов и отменяет супрессорную функцию регуляторных Т-клеток (Postow M.A.,Harding J., Wolchok J.D., 2012).
Таким образом, взаимодействие иммунной системы со злокачественной опухолью представляет собой тонкий баланс между процессами иммунной активации и иммунной супрессии. (Teng M.W. et al.,2015). В последние два десятилетия, ингибиторные механизмы, способствующие, опухолевому росту были объектом интенсивных исследований, направленных на их преодоление или блокаду с целью разработки новых вариантов иммунотерапии рака (Кадагидзе З. Г.,2017). Эти соображения выводят методологию и технологию иммунотерапии рака на новый уровень развития и реализации. О существующих подходах в истории иммунотерапии и существующей современной иммунотерапии мы обсудим в следующих главах.
Глава 4. История иммунотерапии рака и других злокачественных опухолей
Описывая истоки зарождения иммунотерапии рака в мировом здравоохранении от основ иммунологии до новых видов терапии онкологических больных немецкий онкоиммунолог Нans-Georg Rammensee в коллективной монографии «Сancer Immunotherapy Meets Oncology», вышедшей в Швейцарии в 2014 году, под редакцией проф.C.M.Britten et al., приоритет в создании онкоиммунологии и иммунотерапии рака отдает Paul Ehrlich (1909). Он считает, что Paul Ehrlich первый обратил внимание на факторы борьбы иммунной системы с раком и очень романтично описывает процесс формирования основ иммунологии рака. Он пишет, что Пол Эрлих (Paul Ehrlich, 1909) был, несомненно, очарован только, что обнаруженными на тот момент, адаптивными иммунными рецепторными молекулами, способными проводить разграничение между разнообразными инфекционными агентами, а также пластичностью иммунной системы при выборе таких рецепторов и при создании многих их копий по «требованию» иммунитета. Выстраивая «ein Gedankengebaude» (нем.), чтобы разъяснить выводы, сделанные Emil von Behring и Shibasaburo Kitasato (1890), он не только ввел термин «Antikorper» (нем. — антитело), необходимый для описания таких адаптивных рецепторов, но и изучал проблемы и вопросы, связанные с их развитием внутри организма мыши или человека, т.е., то, каким образом, аутореактивные антитела могли бы быть обойдены.
Н.-G. Rammensee (2018) cчитает, что вероятно, в рамках данного контекста Paul Ehrlich выдвинул теорию о том, что антитела и, соответственно, иммунная система, должны уметь каким-то способом распознавать и атаковать раковые клетки, что привело к его знаменитому постулату от 1909 г. об иммунном надзоре рака (P. Ehrlich 1909): «у нас была бы намного более частая численность онкогенеза при отсутствии иммунной системы, которая постоянно преследует и уничтожает вновь развивающиеся раковые клетки».
Независимо от Paul Ehrlich, и ранее, два хирурга, Wilhelm Busch (1866) в Бонне (Hartmann 2008), и William B. Coley (1893) в Нью-Йорке (W.B.Coley, 1891), сообщили о положительной корреляции, наблюдаемой между инфекцией (инфицированием) и регрессией опухоли, что было ранним указанием на TLR лиганды и цитокины. Schnürer, Franz (1908) в своей работе Jahrbuch der Zeit- und Kulturgeschichte считают, что именно Wilhelm Busch принадлежит приоритет в иммунотерапии. Согласно другой точке зрения считается, что история иммунотерапии рака и злокачественных опухолей начинается с 1891 года, именно тогда, когда доктор W.B. Coley в Memorial Sloan-Kettering Cancer Center (США, Нью-Йорк) впервые предпринял попытки лечения больных раком вытяжками из культур стрептококка. В результате, у некоторых больных рост опухолей подавлялся, другие же погибали от кахексии, не связанной с онкологическим заболеванием. Биограф Уильяма Коли Стивен Холл утверждает, что отправной точкой возникновения интереса Коли к терапии рака послужил случай, произошедший в конце лета 1890 года. 17-летняя девочка Элизабет Дэшилл, которую Коли и его сотрудники стали называть Бесси, пришла к нему на прием по поводу травмы руки и возникшей в месте повреждения припухлости. Вначале это выглядело как относительно небольшое повреждение, но девочка жаловалась на возраставшую боль и уже посетила многочисленных докторов, так и не получив поставленного диагноза. Первоначальный диагноз, который сформулировал Коли, был инфицирование. Однако он все же решил взять образцы на биопсию и полученные результаты выявили, что Бесси в действительности страдала от саркомы. В период, предшествующий появлению лучевой и химиотерапии, единственное доступное лечение сводилось к ампутации, выполнявшейся с целью предотвращения распространения онкогенеза. Тем не менее, после ампутации, Коли обнаружил, что заболевание уже дало метастазы в легкие и печень. В своей книге «Коммоция в крови: жизнь, смерть, и иммунная система», С. Холл таким образом описывает этот момент: «23 января 1891, менее чем через 6 месяцев после первого визита к Коли и того, что можно описать как душераздирающий и болезненный период, Бесси умерла в присутствии Коли рядом с ней».
Уход Бесси так подействовал на доктора, что он стал еще более активно заниматься канцерогенезом. Хотя рак был все еще плохо изученным заболеванием на тот период времени, тем не менее, Коли изучал труды Дарвина, и один из выводов от чтения его трудов заключался в том, чтобы в ситуации, при которой имеет место биологическое исключение из правила, …«задать себе вопрос, почему это случилось?» Таким образом, Коли начал исчерпывающий поиск в архивах New York Hospital, штудируя десятки и десятки старых записей в надежде найти информацию, которая могла бы помочь приобрести лучшее понимание природы онкогенеза. Его настойчивость была вознаграждена, когда он обнаружил медицинскую историю иммигранта из Германии по имени Фред Штейн.
В 1883, Фред Штейн был госпитализирован в Госпиталь Нью-Йорка по поводу опухоли на шее. Были предприняты многочисленные попытки по ее устранению, но, тем не менее, она заново появлялась спустя непродолжительное время после удаления. В результате подобного хирургического лечения, у Штейна развилась инфекция, и организм был обречен на инфицирование Streptococcus pyogenes. Поскольку это было за 45 лет до того, как Александр Флеминг создал пенициллин, лечащие доктора пришли к мнению, что исход заболевания был предопределен, и пациент вскоре умрет, но Штейн выжил; в действительности, его опухоль растворилась, и в конечном итоге, он был выписан. И спустя почти десятилетие, Коли решил выяснить, жив ли еще Штейн.
Путешествие Коли, чтобы найти Штейна похоже на «розыскные мероприятия частного детектива». В тот период времени, большинство выходцев из Германии селились в съемных квартирах Нижнего Ист-Сайда в Манхэттене. Проходя через каждую дверь, Коли наводил справки о мужчине по имени Фред Штейн (с распространенной немецкой фамилией), у которого был заметный отличительный шрам на шее. Через несколько недель поисков, Коли удалось найти его живым и без признаков опухолевого процесса. Именно тогда Коли предположил, что инфицирование Streptococcus прекратило и обратило вспять развитие рака, и теперь ему стало интересно, сможет ли он добиться схожих результатов, намеренно вводя онкологическим пациентам эту бактерию.
До появления форм информированного согласия и институциональных наблюдательных экспертных советов, клинические исследования часто проводились «под флагом» предоставления медицинской помощи. Коли решил, что вначале он будет проверять свою теорию на наиболее тяжелобольных пациентах. Его первый больной был иммигрант из Италии, чьи медицинские записи зарегистрированы под именем Зола. Пациент страдал раком горла, из-за чего он не мог говорить и есть, у него было затруднено дыхание. Коли начал экспериментальное лечение с небольших разрезов, куда он втирал Streptococcus pyogenes. Через месяцы попыток вызвать системную ответную реакцию, Коли смог достать более вирулентный штамм бактерии и ввел его непосредственно в опухоль больного, в результате чего у пациента развилось крайне тяжелое состояние. Некоторое время Коли думал, что он превысил дозу и бактерия приведет к летальному исходу, но в течение 24ч, опухоль стала растворяться и рассасываться, и, в конце концов, Зола полностью излечился. Именно тогда и возникло предположение о губительном воздействии на опухоль каких-то иммунных факторов, появляющихся в ответ на введение бактериальных вытяжек (А. М. Земсков, В. М. Земсков, В. А. Черешнев, 2013; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018).
Теория Коли была встречена с воодушевлением во многих медицинских кругах Европы и США, но, тем не менее, не все согласились с выводами этой теории. Консервативная медицинская община США, придерживающаяся устаревших и старорежимных подходов, была настроена крайне скептически, приводя в качестве доводов непредсказуемые последствия лечения, главным образом очень высокую температуру у пациентов, уже ослабленных канцерогенезом. Кроме того, когда лечение заканчивалось успехом, механизм его действия оставался непонятым и неизвестным. Так как эти события происходили за многие десятилетия, прежде чем были получены сведения о функционировании иммунной системы, на эти вопросы не смог бы ответить даже сам Коли. Невозможность пролить свет на эти вопросы, интенсивные усилия и обширные затраты, связанные с приготовлением вакцины, а также внедрение лучевой терапии в 1900 годах в своем сочетании привели к тому, что теория Коли о стимуляции иммунной системой с целью противодействия онкогенезу исчезла из терапевтических опций.
Дополнительной причиной недостаточной популярности теории Коли явилась ее ограниченная эффективность применительно к широкому спектру видов рака: она была главным образом эффективна при саркоме, представляющей только небольшую долю из всех видов онкогенеза. Все же, пожалуй, самым затруднительным препятствием можно назвать период, в котором Коли совершил свое открытие. Медицинская наука в те годы уделяла очень незначительное внимание способности человеческого организма к самоизлечению, полагая вместо этого, что требуются внешнее воздействие для того, чтобы случилось восстановление, и эта догма сохранялась в онкологии вплоть до 1980-х годов. Не далее, как в 2001, многие врачи-онкологи придерживались скептического мнения об эффективности иммунологических средств в лечении рака, даже учитывая нынешние возможности медицины управлять лихорадкой и возрастающее количество данных о том, что высокая температура может вызывать гибель опухолевых клеток.
Несмотря на то, что сегодня ученые обладают более ясным пониманием повышения температуры и ее способности стимулировать иммунную систему, точный механизм действия токсинов, применяемых Коли, продолжает оставаться неизвестным; тем не менее, большинство экспертов едины во мнении, что то, что происходило, сейчас известно как цитокиновая реакция. Так как Коли использовал высоко патогенные бактерии и вводил их непосредственно в неоперабельные опухоли, нельзя исключать возможность того, что сами микробы могли быть вовлечены в противостояние канцерогенезу. Пример этого можно увидеть в бактерии Salmonella, о которой известно, что она обладает способностью колонизировать и элиминировать твердые опухоли. В 2017 году, исследователи из Отдела Экспериментальных Терапевтических Средств Исследовательского Института Бекмана в городе Надежды (city of Hope) в Калифорнии, в статье под заголовком «Применение Salmonella для лечения твердых опухолей» обнаружили, что тифимуриум (Typhimurium), происходящий из Salmonella enterica, не только обладал противоопухолевым воздействием, но и представлял собой потенциальный вектор доставки, способный переносить другие материалы в область опухоли. В 2012, исследователи из отделения Молекулярной Онкологии и Иммунотерапии в городе Росток, Германия, проводили системный анализ тумороцидных, а также иммуностимулирующих воздействий исторического препарата на основе токсина Коли, представляющего собой вакцину на основе термо-инактивированного Streptococcus pyogenes и Serratia marcescens. Противоопухолевые эффекты на фоне локальной терапии по преимуществу сопровождались стимуляцией врожденных (природных) иммунных механизмов, подразумевая таким образом, что молекулы, пребывавшие все еще в активном состоянии в термо-инактивированной микробной смеси, были ответственны за подобное воздействие. Номер журнала Science за декабрь 2013 посвятил свою обложку «Иммунотерапии рака», называя это явление «….прорывом года», тогда как в действительности это прорывное открытие произошло примерно на 100 лет раньше.
История иммунотерапии рака это история научной династии американских ученых, увлеченных своей великой миссией. Вслед за кончиной Коли в 1936 году, его дочь Хелен Коли Наутс приступила к написанию биографии своего отца и продолжила его исследования по иммунотерапии рака. Именно во время своей работы она обнаружила около 1000 файлов пациентов, которых лечил ее отец и которые получали «Токсины Коли». Хелен потратила годы на изучение и анализ данных, придя к выводу о том, что у ее отца был очень высокий коэффициент успешных случаев при лечении определенных опухолей; на самом деле, многие результаты превосходили современные виды терапии. Однако все ее попытки привлечь внимание научного сообщества не были услышаны.
В 1953, при помощи небольшого гранта, Хелен Коли Наутс основала Институт по Исследованию Рака (Cancer Research Institute, CRI), задачи и цели которого состояли в «… понимании иммунной системы и ее связи с канцерогенезом». Наибольшим препятствием к принятию и признанию работ Коли было Американское Общество борьбы с раковыми заболеваниями. С 1965 до 1975, данное научное сообщество внесло доктора и его методы в черный список «Недоказанных методов лечения рака». И только благодаря самоотверженной деятельности Хелен Коли Ноутс и — что очень важно — исследователю Lloyd J. Old из Sloan Kettering Institute удалось убрать «токсины Коли» из этого черного списка. Это обстоятельство создало условия для дальнейших исследований иммунотерапии канцерогенеза, не умаляемых обвинениями в шарлатанстве. В 1998, доктор Bruce Buetler, MD и его коллеги из Scripps Institute в городе Ла-Хойя, Калифорния, продемонстрировали, что бактериальный токсин липополисахарид может активировать клетки иммунной системы, толл-подобные рецепторы (toll-like receptors, TLRs). Они, в свою очередь, эффективны в уничтожении раковых клеток и опухолей (30). Подобные результаты подтвердили теории, предложенные доктором Коли, воздавая ему заслуженное признание. Наследие Коли продолжается и по сию пору благодаря финансированию Институтом по Изучению Рака (CRI) исследований в области иммунотерапии; и многие из более 25 методов иммунотерапии рака, предлагаемые сегодня на рынке медицинских услуг, были разработаны исследователями (некоторые из которых проходили постдокторантскую практику в Институте по Исследованию Рака), которым были предоставлены первоначальные гранты от Хелен Коли Ноутс и ее института (CRI) на осуществление исследовательской деятельности.
В 1962 году O`Malley с соавторами в опытах на мышах доказали, что геморрагические некрозы в опухолях после введения бактериального липополисахарида (ЛПС) обусловлены действием не самого ЛПС, а какого-то промежуточного фактора, который появляется в сыворотке крови в ответ на инъекцию ЛПС. Эта сыворотка обладала способностью убивать опухолевые клетки при введении другим мышам, которые не получали инъекций ЛПС. И, наконец, в 1975 году, опять же в Memorial Sloan-Kettering Cancer Institute, E. Carswell с соавторами открыли и описали медиатор, обладающий цитотоксическим действием на различные опухолевые клетки, появляющийся в крови мышей в ответ на введение ЛПС от Bacillus Calmette-Guerin и назвали его «Tumor necrosis factor» — фактором некроза опухоли (А.М.Попович, 2010; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018),.
В последующее столетие был проделан огромный объем исследований, стремящихся найти проявления подобного противоракового иммунитета, большинство из которых не привели ни к чему или к открытиям, которые представлялись, как не имевшие прямого отношения к онкогенезу. Один из таких знаменитых случаев связан с открытием антигенов гистологической совместимости (G. Klein 1986), последовавшим за обнаружением того, что пересаженные мышиные опухоли могли быть отторгнуты мышами-реципиентами, впрочем, также, как и здоровые ткани от других мышей, так как на то время мыши не были достаточно инбредны.
Первые надежды на противораковую иммунотерапию были вызваны обнаружением первых цитокинов — интерферонов, открытых в 1950 годах учеными Alick Isaaes и Jean Lindenmann (1957), и позже, в середине 1970 годов, когда исследователи Georges Kohler and Cesar Milstein (1975) изобрели метод, позволявший создавать моноклональные антитела по требованию, то есть только тогда, когда это было необходимо.
Первая успешная иммунотерапия рака, однако, представляла собой особый вид адоптивного Т-клеточного переноса (трансфера) — инфузии донорских лимфоцитов в условиях трансплантации костного мозга. Этот подход являлся результатом развития трансплантации костного мозга реципиентам, которые перед этим проходили облучение; метод представлял собой лечение лейкемии, и осуществлялся лабораторией Edward Donnall Thomas совместно с Rainer Storb в Сиэтле, который обнаружил, что разрушительная реакция трансплантат против хозяина (ТПХ), регулярно встречающаяся у больных людей или у аутбредных (неродственных) собак, но не в популяциях инбредных мышей, оказала благотворное воздействие, поскольку она выступала в качестве эффективного средства против лейкемии (Weiden et al, 1979). Данное наблюдение можно приписать действию донорских лейкоцитов, его описал в конце 1980 годов исследователь Hans-Jochem Kolb (1990), который в то время систематически разрабатывал использование инфузии донорских лейкоцитов для лечения рецидивов лейкемии.
Прошло почти 50 лет, прежде чем ученые Richmond Prehn и Joan Main смогли показать, что как минимум methylcholanthrene — индуцированные опухоли отторгаются в результате иммунной ответной реакции на моделях опухоли у изогенных (сингенных) мышей (Prehn and Main, 1957). Вскоре после этого, в 1960, George Klein и коллеги обнаружили, что отторжение опухоли также применимо и к аутологичным опухолям (G. Klein et al, 1960). Последующие десятилетия привнесли с собой череду взлетов и падений в восприятии концепции значимости противоракового иммунитета среди научного сообщества. Серьезный удар по теории противоракового иммунологического надзора был нанесен со стороны модели на бестимусной (атимической) «голой» мыши, которая не выявила более высокую распространенность спонтанного канцерогенеза по сравнению с полностью иммунокомпетентными мышами, как сообщалось в докладе Osiasis Stutman в 1974, опять исследовавшим модель химически индуцированной опухоли (О.Stutman 1974). Другой удар по представлению о противораковом иммунитете был вызван экспериментом исследователя Prehn в 1972, который продемонстрировал, что в противоположность выводу P. Ehrlich, иммунная ответная реакция могла также усиливать, нежели чем ингибировать опухолевый рост (Prehn 1972). Этот эксперимент, на самом деле, помог вспомнить более старые данные от 1962, полученные группой L. Old (Boyse et al., 1962). Данное собрание подобных проявлений сейчас может быть положено на полку под названием «опухоль-стимулирующее воспаление (Hanahan and Weinberg, 2011).
В течение всех этих лет, относительно небольшая когорта исследователей все же придерживалась мнения, что в данной теории должен заключаться некий смысл, и не прекращала инвестировать в опыты по раскрытию механизмов и таргетных структур, ответственных за противораковый иммунитет, продолжая изучать как антитела, так и Т-клеточные ответные реакции. Некоторые из ключевых ученых, занимающиеся противораковым иммунитетом (Robert North,1982 и Thierry Boon et al., 1988; Lloyd Old et al., 2005,) продолжали глубоко и фундаментально изучать эту область онкологии и показали большое методологическое воздействие на мировоззрение целого поколения врачей- онкологов. Потребовалось время вплоть до 1980гг, когда молекулярным образом был идентифицирован в мышах первый невирусный опухолевый антиген, распознаваемый T- клетками, благодаря содействию Университета Mainz (Thomas Wolfel) (De Plaen et al, 1988). В действительности, оказалось, что это был мутированный антиген, и совместно с группой Boon (Boon group), ученым удалось идентифицировать и количественно подсчитать мутированный пептид, присутствующий на MHC (ГКГС) молекулах опухолевых клеток (Wallny et al, 1992). Первый Т-клеточный эпитоп человека, представляющий собой антиген опухоли, был заявлен группой Boon в 1991 (van der Bruggen et al, 1991), и при необходимом содействии со стороны Университета Майнца (Alexander Knuth). Опухоле-ассоциированные антигены, спонтанно распознаваемые антителами, изучались ранее учеными Lloyd Old и Edward Boyse на мышах (L. Old and E.Boyse 1964), затем были расширены группой Old до работы с сывороткой больных (Pfreundschuh et al, 1978), а в 1990 годах привели к показателям высокой производительности (выработки) при помощи метода SEREX, впервые разработанного Ugur Sahin, Ozlem Tureci, и Michael Pfreundschuh (U.Sahin et al, 1997; O. Tureci et al 1997).
Со времен работы Paul Ehrlich, потребовалось целое столетие, чтобы научиться понимать функции основных молекул и молекулярно-биологические механизмы, которая наша иммунная система использует для своих повседневных задач по противодействию инфекциям. Мы все еще далеки от того, чтобы охватить всё, но известное на сегодняшний день количество информации является достаточным для того, чтобы управлять иммунной системой, таким образом, чтобы она могла атаковать и уничтожать раковые клетки. В настоящее время, некоторые из подобных попыток демонстрируют свою эффективность. После того, как ученые ознакомились со структурами и функциями антител, Т-клеточными рецепторами, MHC (ГКГС) молекулами и их лигандами, цитокинами и их рецепторами, клетками врожденной иммунной системы, в том числе их рецепторами и лигандами, популяциями Т-клеток, а также их ко-рецепторами и ингибиторными рецепторами, появился более детальный взгляд на сложные взаимодействия между иммунологическими механизмами, атакующими опухоли, и мерами противодействия, которые задействуют опухоли в целях своей защиты от подобных атак, что было сформулировано Bob Schreiber как концепция «иммуно-редактирования» (Schreiber et al, 2011).
Сам принцип иммунотерапевтического методологического подхода к лечению тяжелых инфекционных и вирусных заболеваний путем создания высокоспецифичных вакцин доказал свою научную состоятельность и правомерность в клинической иммунологии (Новиков В. И., Власов А. А.,2006; А. М. Земсков, В. М. Земсков, В. А. Черешнев, 2013; В. В. Зверев, Р. М. Хаитов, 2014). Попытки применять иммунологический подход, показавший свою эффективность в инфекционной иммунологии, к терапии опухолей предпринимались с конца 19-го века.
Сама идея применения иммунотерапии для лечения опухолей была основана на научных представлениях ученых о вирусной природе опухолей (В. В. Зверев, Р. М. Хаитов, 2014). Еще в начале XX века о вирусной природе злокачественных опухолей высказывались И. И. Мечников и Н. Ф. Гамалея. В 50-е годы ХХ века Л. А. Зильбер создал вирусогенетическую концепцию опухолей. Его работы по иммунологии опухолей привели к исследованию опухолевых антигенов и, в конце концов, — к открытию специфического печеночного альфа-фетопротеина, что позволило разработать ценную диагностическую реакцию на выявление рака печени. В апреле 1981 года Национальный Институт по Изучению Рака (США) начал широкомасштабную научную программу по исследованию биологических методов в лечении рака. В течение 10 лет работы над этой программой ученые института разработали 3-х ступенчатую методику оценки эффективности методов биотерапии рака. На основании этой методики, была подробно изучена эффективность существующих на тот момент времени способов биотерапии рака (интерферонов альфа, бета, гамма, ИЛ-1, ИЛ-2, ФНО, КСФ, ЛАК и ТИЛ терапии, моноклональных антител, ростовых факторов) и определены основные направления для создания новых методов лечения этого заболевания (Киселевский М. В. с соавт.,2016; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018).
Особого обсуждения в контексте истории ИТ рака требует исторический аспект применения трансплантации аллогенного костного мозга как формы иммунотерапии солидных опухолей. История подобного методологического подхода начинается с 80 годов прошлого века в Российском онкологическом научном центре (РОНЦ) им. Н. Н. Блохина Минздрава России. Несомненно, существующий позитивный и негативный опыт пионеров отечественной онкологии в ТКМ от аллогенных доноров в лечении солидных опухолей, проводимых в 80-х — 90-х годах группой ученых РОНЦ им. Н.Н.Блохина с его бывшим директором академиком РАМН и РАН профессором Н. Н. Трапезниковым (1980- 1998), позволяет с определенной долей оптимизма смотреть на возможную эффективность данной технологии лечения у онкологических больных. Современный уровень иммунологической диагностики 21-го века и новые возможности по молекулярно-биологическому подбору аллогенных доноров и пациентов, инновационные возможности иммунотипирования донора и пациента с учетом цитофлюорометрического изучения маркеров клеточной поверхности клеток костного мозга и молекулярная диагностика KIR (killer immunoglobuline-like receptor) -рецепторов, открывают принципиально новые горизонты для очередного витка этих перспективных исследований. Професcор гематологии и онкологии J-.F.Rossi из Университета Монпелье (Франция) определяет этот исторический путь как путь от ТКМ к прецизионной иммунотерапии (J-.F.Rossi J-.F.Rossi,2017). Он считает, что новую эру собственно иммунотерапии рака открыли именно аллогенные ТКМ у различных онкологических больных. И хотя история иммунотерапевтических подходов к терапии рака существует давно и способов ИТ было предложено множество, все они были направлены на стимуляцию собственного иммунитета больного (Киселевский М. В.,2014) и поэтому были недостаточно обоснованы и малоэффективны.
Существует народная мудрость, что «новое это хорошо забытое старое, но на очередном витке технического прогресса». Научные исследования под руководством академика РАН и РАМН Н.Н.Трапезникова были хорошо проработаны в эксперименте на животных на модели ТКМ при метастазах саркомы в легкие у сирийских хомячков (Г. И. Дейчман, Л. М. Кашкина, Т. Е. Ключарева с соавт.,1982) и при трансплантации костного мозга (ТКМ) у больных с саркомой с метастазами в легкие (П. Т. Есартия, Г. И. Дейчман, Н. Н. Трапезников,1993). Опыт этих исследований бесценный, но он, к сожалению, был забыт в связи с уходом из жизни его основных идеологов и последующими бурными социальными и экономическими пертурбациями в общественной жизни российского государства.
В эксперименте на животных с модельными опухолями (саркомы) пионеры- исследователи показали влияние клеток костного мозга, селезенки и перитонеального экссудата (ПЭ) на метастазирование ОК в легких сирийских хомяков, (Дейчман Г. И. с соавт., 1982). Исследователи провели ряд уникальных экспериментов с лабораторными животными, в том числе с сингенными, где источником биоматериала для трансплантации был аллогенный костный мозг (аллоКМ), перитонеальный экссудат (ПЭ) и клетки ткани селезенки (время введения, кратность введения — однократно, но раздельно, количество клеток: ОК — 5—6.5 х104; Соотношение клеток КМ к ОК было как 340:1 170:1 85:1). Результат эксперимента был показан в снижении частоты возникновения метастазов (р <0.001) при трансплантации КМ и ПЭ, но это не относится к клеткам селезенки. Продемонстрировано, что чем больше клеток КМ и ПЭ, тем лучше. У части животных было отмечено полное подавление роста метастазов.
Анализируя результаты этих работ через 30 лет, становится очевидным подавление спонтанных и экспериментальных метастазов в легочной ткани с помощью нормальных клеток аллогенного КМ и ПЭ, но механизм неясен. Возможно, что это прямое цитотоксическое действие макрофагов на ОК, а может быть это системное решение проблемы реставрированной иммунной системой. То есть, может быть это ответ не только и не столько на ОК, как на всю систему иммунитета. Авторы использовали сингенных животных и, может, в этом была причина удачи. Было применено одинаковое количество и соотношение ОК к клеткам КМ и ПЭ, отмечена различная частота возникновения метастазов. Не определены существенные индивидуальные различия между животными. Был показан разный уровень резистентности к опухоли у нормальных животных в популяции. Очевидно, что при аллогенной ТКМ в каждом конкретном случае включался индивидуальный механизм действия эффекторных клеток КМ и ПЭ для подавления роста метастазов. Это необходимо учитывать в клинике и персонализировать терапию для каждого больного с индивидуальным циклом лечения. Также у исследователей не были определены различия в составе введенных клеток КМ и ПЭ (Мелкова К. Н.,2015, Мелкова К. Н., Тупицын Н. Н.,2016).
В клинических работах пионеров-онкологов ФГБУ НМИЦ онкологии им. Н. Н. Блохина Минздрава России (далее НМИЦ онкологии) была доказана практическая возможность подавления развития легочных метастазов у радикально оперированных больных с остеогенной саркомой с помощью однократной трансфузии нормального неманипулированного аллогенного костного мозга. Ограниченные клинические исследования в НМИЦ онкологии проводились с 1984 г по 1992 год у больных с остеогенной саркомой без метастазов (24 человека), при размере опухоли от 8 до 11 см, возраст 8—44 года, пол 16 муж/8 жен, медиана наблюдения — 3 года, исторический контроль 41 чел. Источником ткани был аллогенный неманипулированный КМ, в котором количество ядросодержащих клеток (ЯСК) составляло 12—22 х109 (в 1 литре). Кратность введения — однократно. Время введения — накануне радикальной операции. Результат впечатляющий — выжили 13 чел. (56%) без метастазов, то есть, без рецидивов. Снижение частоты возникновения метастазов в период 6—12 мес. и, особенно, 12—20 мес. после операции (Мелкова К. Н.,2015, Мелкова К. Н., Тупицын Н. Н.,2016)..
Эти работы ставят целый ряд серьезных вопросов и вызовов перед современными исследователями этой проблемы. Эффективность аллогенной ТКМ для профилактики метастазов очевидна, эта технология абсолютно конкурентна и является альтернативой современной ХТ/ЛТ. Источником для полной реставрации иммунной системы стал неманипулированный КМ и другие неманипулированные источники в виде ПЭ. Несомненно, встают вопросы безопасности (потенциальные осложнения) как для донора, так и для пациента. Обращает внимание техническая осуществимость, доступность донорского материала, воспроизводимость методики в разных клиниках и доступная цена. Несомненно, пациенты и доноры требуют более углубленного и тщательно обследования и госпитализации. Создание «особых» условий пребывания и наблюдения за пациентом также требует принципиально нового подхода, так как 1 литр КМ — это значительный объем трансфузии.
Отдельного обсуждения требуют резидуальные клетки опухоли, оставшиеся после аллоИТ и РТПО. При аллоИТ (КМ после кондиционирования) РТПО происходит за счет донорского КМ. При профилактике метастазов солидных опухолей возникновение РТПО происходило за счет перелитых эффекторных клеток (NK-клеток и T-клеток) и их полноценного взаимодействия (прямое действие). Следует особо отметить, что приживление КМ в этом случае не нужно и опасно. Все взаимодействующие звенья должны быть перелиты одномоментно в нужном соотношении (неманипулированный КМ). Необходимо исключить риски возникновения реакции трансплантат против хозяина (РТПХ). Необходимо учитывать время жизни эффекторных клеток (наиболее коротко живущего звена иммунитета). Может ли происходить стимуляция резервов собственной иммунной системы остается под большим вопросом.
История иммунотерапии рака также была основана на целом ряде инновационных научных фактов (рисунок 5). Онкологи заметили, что многие опухоли характеризуются слабым иммунным ответом и выраженным иммуносупрессивным действием, механизмы формирования которого до конца еще не исследованы. Состояние иммунодепрессии расценивали как важный патогенетический фактор неблагоприятного течения злокачественных опухолей, а перспективы их лечения связывали с разработкой и внедрением в практику методов иммунотерапии (В. В. Зверев, Р. М. Хаитов, 2014; Тупицын Н. Н.,2016).
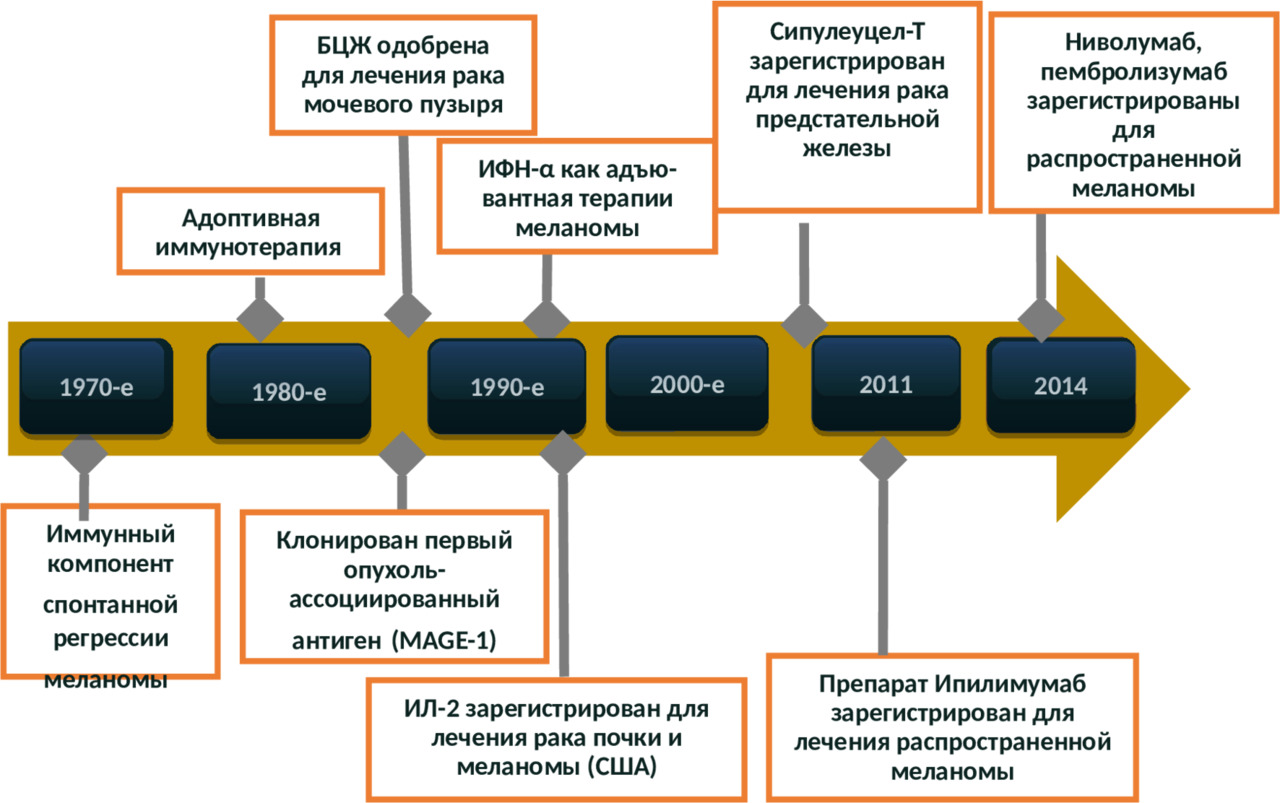
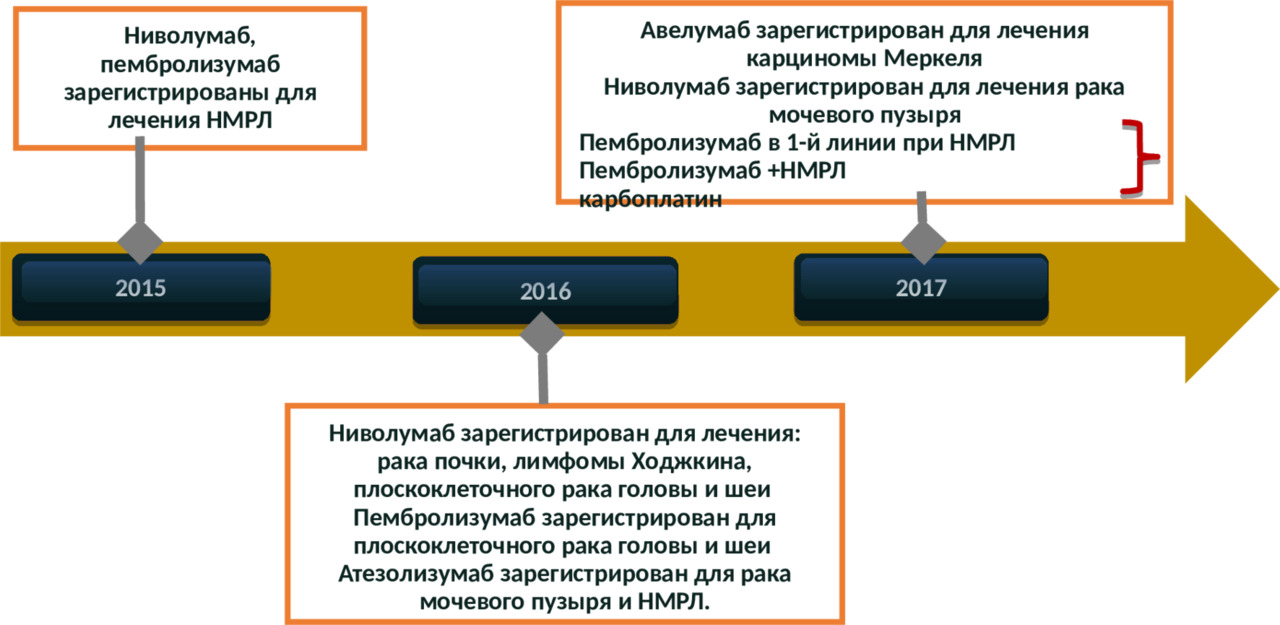
Рисунок 5. Исторические вехи иммунотерапии рака (1. БЦЖ = бацилла Кальметта-Герена 2. Рисунок является адаптированным вариантом данных ряда исследователей Kirkwood JM, Ca J Clin. 2012;62:309–335; George S, et al. JNCCN. 2011;9:1011–1018; Garbe C, et al. The Oncologist. 2011;16:2–24; Cheever MA, et al. Clin Cancer Res. 2011;17:3520–3526; Kantoff PW, et al. N Engl J Med. 2010;363:411–422; Mansh M. Yale J Biol Med. 2011;84:381–389; Hodi FS, et al. N Engl J Med. 2010;363:711–723; Aldousari S, et al. CUAJ. 2010;4:56–64. Адаптацию рисунка и русскую версию выполнила проф. Горбунова В. А.)
Основными положениями иммунологии опухолей, которые создали теоретические предпосылки для возникновения иммунотерапии как раздела онкологии, являются следующие: 1) клетки опухолей экспрессируют на поверхностной мембране антигены, отличающиеся от нормальных; 2) при экспериментальном канцерогенезе и предраковых заболеваниях человека наблюдается функциональная недостаточность иммунной системы; 3) клинически выявляемый рост новообразований происходит при нарушении состояния иммунной системы, которое усугубляется противоопухолевым лечением; 4) более высокая реактивность иммунной системы до и после лечения коррелирует с лучшим прогнозом (В. В. Зверев, Р. М. Хаитов, 2014; Барышников А. Г. с соавт., 2015).
Показано, что иммунотерапия эффективна для ОК, но она не воздействует на опухолевые СК (ОСК) опухоли, так на поверхностной мембране ОСК нет презентации специфических раковых антигенов. В настоящее время общепризнано в свете концепции раковой стволовой клетки, что опухоль начинается с ОСК, которая делится симметричным делением (на две ОСК или две ОСК- прогениторные клетки) или асимметричным делением (на ОСК и опухолевую прогениторую клетку) (Брюховецкий А. С. с соавт.,2015; Брюховецкий И. С.,2017). По современным представлениям ОСК это аутологичная стволовая клетка (СК), получившая в процессе своей жизнедеятельности и функционирования критический набор мутаций генов и анеуплоидий, в результате которых у нее сформировалась неустойчивость генома (кариотипа), она вышла из под контроля регуляторных механизмов иммунной системы и регионарных противоопухолевых систем, стала неуправляемо пролиферировать и делиться, а также приобрела характеристики бессмертной клеточной системы. Потомки ОСК имеют различную степень дифференцировки и характеризуются более быстрым и частым делением клеток, по сравнению с их нормальными аналогами. Раковые клетки приобретают генетические мутации, которые наделяют их анормальными характеристиками. Эти мутации воздействуют на способность иммунной системы распознавать раковые клетки как анормальные. Для них характерно отсутствие регуляции роста, зависимой от факторов роста. Раковые клетки приобретают способности к росту в суспензии, имеют высокий индекс митозов, характеризуются бессмертием, резистентностью к апоптозу, потерей «гена — супрессора опухоли». И, конечно же, на поверхностной мембране раковых клеток различной стадии дифференцированности имеет место презентация раковых антигенов, которые могут быть выявлены специфическими онкомаркерами (Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко, 2018).
Возникает вопрос: как раковые клетки и ОСК вторгаются в иммунную систему? Ответ на этот вопрос сегодня однозначен и понятен. Раковые клетки растут быстрее, чем обычные клетки, имеют сниженную экспрессию антигенов и соответственно сниженную иммуногенность, выделяют иммуносупрессорные факторы, снижающие отклик хозяина, ингибируют апоптоз, могут быстро давать метастазы в другие органы и ткани. Соответственно иммунная система реагирует на интервенцию раковых клеток активацией и напряжением всех своих компонентов. Напряжение иммунной системы проявляется клеточным ответом (активация лейкоцитов), тканевым ответом (иммунная реакция кожи, реакция первичных лимфоидных органов: костный мозг, тимус, активацией вторичных лимфоидных органов: печень, селезенка, лимфоузлы …), а также выделяемыми молекулами (цитокины, факторы роста) разных клеток, антителами (иммунноглобулинами) вырабатываемыми В-клетками. В итоге, клеточный иммунитет проявляется специфической цитотоксичностью Т-клеток, NK-клеток, макрофагов, которые опосредуют цитотоксичность, выделяя цитокины, а гуморальный иммунитет реагирует на опухоль образованием антиопухолевых антител В-клеток (Козлов В. А., Селедцов В. И.,2004; Койко Р, Сайншайн Д, Бенджамини Э.,2008; Брюховецкий И. С., Дюйзен И. В., Шевченко В. Е. и др,2016; Achyut BR, Shankar A, Iskander AS, et al.,2015).
Вся история иммунотерапии опухолей показывает, что современная иммунотерапия (ИТ) традиционно пыталась усилить иммунный ответ организма пациента: активацией NK- клеток (якобы усиливается контроль за раковыми клетками), активацией макрофагов (усиливается врожденная цитотоксичность), иммунизацией B-клеток (выработка антиопухолевых антител), активацией T-клеток (усиливается специфическая цитотоксичность Т-клеток) (Adikrisna R, Tanaka S, Muramatsu S, et al.,2012; Bryukhovetskiy A., V.E. Shevchenko, S. V. Kovalev et al., 2014) Однако, этот методологический подход эффективно работает только при инфекционных и вирусных заболеваниях. Его эффективность при опухолях неоднозначна и не достоверна (Ali K., Soond D.R., Pineiro R. et al.,2014). Именно поэтому, ИТ рака в онкологии не стала конвенциональным методом лечения опухолей (Bryukhovetskiy I. Bryukhovetskiy A., 2014). В следующей главе мы рассмотрим все известные способы иммунотерапии опухолей, применявшиеся в клинике и попытаемся понять, почему они так долго не показывали своей эффективности в клинической онкологической практике.
Глава 5. Современные виды иммунотерапии рака и других неоплазий
Как утверждают специалисты международного фармацевтического концерна Brystol Mayers (2016) в своем рекламном буклете «Онкоиммунология», в современной онкологии реальным, научно обоснованным и зачастую альтернативным ресурсом помощи онкобольным была и остается онкологическая иммунология. Они сумели показать и доказать своими образовательными программами для онкологов и онкоиммунологов, что ИТ опухолей это самое перспективное направление в современной онкофармакологической индустрии, а также смогли убедить в этом большинство ведущих научных руководителей консервативных онкологических школ по всему миру Они не первые вывели на мировой рынок таргетные противоопухолевые препараты, созданные на основе моноклональных антител (МКАТ), но они первыми преодолели критический рубеж в терапевтической психологии современных онкологов о необходимости использования в лечении раковых больных онкоиммунных препаратов и показали, что коммерческой стоимости современного противоопухолевого препарата нет пределов. Сегодня их онкоиммунный препарат (например, онкоиммунный препарат «Опдиво») в объеме, достаточном на курс лечения и разрешенном к клиническому применению при метастической меланоме, немелкоклеточном раке легкого и раке почки, в большинстве экономически развитых стран и, в том числе и России, стоит около полумиллиона долларов США и выше. И хотя ИТ не входит в стандарты лечения опухолей, так как она все еще является «экспериментальным методом» терапии опухолей, её потенциальные возможности еще окончательно не раскрыты как в клиническом плане для онкологов, так и финансовом аспекте для производителей лекарственных средств. При этом большая часть современных зарубежных онкоиммунных препаратов уже вошла в Перечень жизнеобеспечивающих лекарственных средств в Российской Федерации.
Роль и место иммунотерапии рака в современных протоколах комплексного лечения онкологических больных пока не достаточно определены и четко обозначены. По-видимому, современная ИТ рака не должна использоваться как основное «тяжелое вооружение» в битве с «армией ОК». Иммуннокомпетентные клеточные продукты и моноклональные таргетные препараты это иммунный «спецназ особого назначения» и выставлять их против огромной «армии ОК» глупо и не правильно. Представления о том, что иммунные клетки, обладая специальными цитотоксическими свойствами, способны заменить собой химиотерапию, ЛТ и хирургию значительно преувеличены. На самом деле, это абсолютно неверное и ошибочное представление о возможностях и ресурсах современной ИТ в онкологии. Несмотря на то, что за последние 15—20 лет ИТ рака и ЗНО сделала качественный рывок в создании инновационных противоопухолевых медицинских технологий и онкоиммуно-логических препаратов, преимущественно на основе МКАТ, получены официальные разрешения регуляторных органов большинства экономически развитых стран и России к их клиническому применению, пока не существует алгоритмов единого системного технологического противоопухолевого решения, способного полностью излечить онкологического больного. Не существует стройной программы использования онкоиммунных препаратов при раке и определенной стратегии их применения. Есть курсовые приемы и не системное использование разрешенных онкоиммунных препаратов, которые применяются для лечения различных нозологических видов рака и других ЗНО. Ниже мы попытаемся представить существующий ландшафт современных иммунологических препаратов в онкологии.
Начнем с определений самого понятия иммунотерапии в онкологической практике. В Интернете (http://www.lechenie-raka.ru/tradicionnaja/ tradicionnye-metody-lechenija-opuholej/26-immunote-rapiya.html) мы нашли несколько различных определений и разновидностей современных понятий иммунотерапии (ИТ) рака. Так, одним вариантом ИТ является иммунокоррекция — исправление дефектного функционирования иммунной системы. Иммунокоррекция достигается применением методов заместительной или иммуномодулирующей (стимулирующей или депрессивной) терапии, а также иммунореконструкции. Заместительная ИТ рака предполагает восполнение недостающих эффекторов иммунитета главным образом за счет антител, содержащихся в лечебных препаратах типа иммуноглобулина (гамма-глобулина), плазмы, иммунных сывороток. Применение для заместительной ИТ опухолей жизнеспособных донорских иммунокомпетентных клеток имеет пока крайне ограниченные показания и служит в основном для восстановления повреждений иммунной системы после лучевой и химиотерапии опухолей. Иммуномодулирующая терапия направлена на воздействие на нарушенный или нормальный иммунитет через регуляторные механизмы. Её осуществляют с помощью иммуномодуляторов — препаратов, способных в зависимости от дозы и способа применения стимулировать или угнетать иммунитет либо активировать одни элементы иммунной системы и подавлять другие. Препараты, которые в диапазоне обычно назначаемых доз и схем стабильно проявляют депрессивный эффект, называют иммунодепрессантами, а препараты, обладающие стимулирующим эффектом — иммуностимуляторами (стимуляторами иммуногенеза).
Иммунореконструкция это вид ИТ, при котором осуществляется воссоздание пострадавшего иммунитета, как правило, путем трансплантации живых полипотентных гемопоэтических стволовых клеток (ГСК) костного мозга (КМ) или эмбриональной печени, реже центральных органов иммуногенеза, например вилочковой железы (Рабсон А., Ройт А., Делвз П.,2006; Ярилин А. А.,2010; Чехонин В. П., Баклаушев В. П., Кузнецов Д. А.,2010; Хаитов Р. М.,2013; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018).
В коллективной монографии специалистов НИИ пульмонологии ФМБА России «Иммунология в пульмонологии», написанной под руководством академика РАМН проф. А.Г Чучалина (1989) существующие виды ИТ подразделяется на иммунокоррекцию гормонами и медиаторами иммунной системы (тимические гормональные факторы, миелопептиды, цитокины типа интерферона, факторов переноса, интерлейкина, факторов взаимодействия лейкоцит-макрофаг), иммунную инженерию (трансплантация органов и тканей иммунной системы: костный мозг, клетки эмбриональной печени комплекс тимус-грудина и др., введение гамма-глобулинов и или иммуноглобулинов отдельных классов; сорбционные методы: гемосорбция, аффинная сорбция, иммуносорбция); фармакологическая коррекция (иммуностимуляторы естественного происхождения: вакцины, эндотоксины и др., синтетические препараты; левомизол или декарис, диуцифон, полианионы, изопренозин, циклоспорин А и др.) и иммуномодуляцию. Однако это деление ИТ больше соответствует методам лечения инфекционных, вирусных и аутоиммунных заболеваний, чем ИТ опухолей (Хаитов Р. М.,2013; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018).
Хорошо известна существующая активная неспецифическая ИТ рака и ЗНО, предполагающая стимуляцию иммунной системы пациента, путем применения целого набора фармацевтических иммунопрепаратов (левамизоль, зимозан, тимоген, тимолин, Т-активин), которые широкое используются между курсами полихимиотерапии и ЛТ. Наш собственный опыт применения этих препаратов для профилактики осложнений ЛТ и ХТ подтверждает эффективность этого метода лечения в 56% случаев. Пассивная неспецифическая ИТ является важным методом иммунокоррекции онкологических больных, которая предполагает применение МКАТ к ряду определенных видов опухолевых антигенов. Мишенью МКАТ являются специфические онкоантигены, опухолевые клетки, а также факторы роста или рецепторы, выделяющиеся на опухолевых клетках (Ахматова Н. К., Киселевский М. В.,2008;Филатов М,В.,2012; Олюшин В. Е. с соавт..2012; Braza MS, Klein B.,2013).
Современные иммунотерапевтические стратегии лечения рака включают как неспецифический, так и антигенспецифический варианты проведения ИТ. К первому варианту относится применение цитокинов типа интерферонов, интерлейкина-2, фактора некроза опухоли (ФНО), полиадъювантов, а также лимфокин-активированных киллерных (ЛАК) клеток (Черных Е. Р. с соавт.,2004; Киселевский М. В.,2011,2014; Хаитов Р. М.,2013; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018). Ко второму варианту относят различные протоколы адоптивной ИТ, в форме иммунизации опухолевыми антигенами (противоопухолевые дендритные вакцины) (Олюшин В. Е. с соавт.,2012), а также использование антигенспецифических цитотоксических Т-клеток, полученных при активации лимфоцитов ex vivo в присутствии опухолевых антигенов (А. Г. Барышников с соавт.,2015, Г.З.Чкадуа с соавт.,2015; В. В. Зверев, Р. М. Хаитов, 2014). При этом, учитывая зависимость противоопухолевого ответа от многих факторов, включая исходное состояние иммунитета, возможность проникновения эффекторных клеток через тканевые барьеры (например, гематоэнцефалический барьер при опухолях мозга) и их способность преодолевать супрессию со стороны ОК, предполагается, что комбинация различных подходов может существенно повысить эффективность проводимой ИТ (Черных Е. Р., Ступак В. В., Центнер М. И. с соавт.,2004). Основная цель этих ИТ-подходов — усиление иммунного ответа организма и преодоление иммуносупрессии, вызванной ОК (Хаитов Р. М.,2013; Киселевский М. В.,2014; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018). Однако, сама методология комбинированной терапии рака и других ЗНО скорее должна быть не только и не столько сочетанием различных методов ИТ, а сколько инструментом создания определенных комплексных стратегий терапии злокачественных онкологических заболеваний, обеспеченных комбинацией различных биотехнологических подходов ИТ.
Идея комбинированного иммунологического воздействия ИТ на опухоль не нова и уже неоднократно эксплуатировалась в современных лечебных протоколах иммунотерапии рака и ЗНО (Хаитов Р. М.,2013; Киселевский М. В.,2014; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018). Особенно широко она применялась в зарубежных клинических протоколах при лечении меланомы, рака легких и в работах отечественной школы иммунологов академика РАН проф. В. А. Козлова из Новосибирского института иммунологии РАН (Черных Е. Р. с соавт,2004—2016; Селедцов В. И. с соавт, 1998—2010). Комбинированная ИТ предлагает многовекторное и многоцелевое воздействие на различные звенья пострадавшей от опухоли иммунной системы онкологического пациента с использованием интерферонотерапии (препарат «Лейкинферон»), цитокинотерапии («Ронколейкин»), использование противоопухолевых дендритных вакцин, адоптивную ИТ с применением препаратов цитотоксических лимфоцитов (ЦТЛ) и ЛАК — иммунотерапию, а на заключительном этапе использовали аутологичные цитокины, полученные при культивировании собственных лимфоцитов больного в присутствии опухолевых антигенов и в присутствии IL-2 c целью поддержания противоопухолевой активности сенсибилизированных Т-клеток (Киселевский М. В.,2014). Современные подходы комбинированной ИТ предполагают применение более новых иммуномодулирующих (галавит), цитокиновых (РифНот) и интерфероновых противоопухолевых фармпрепаратов (Ингарон, и т.д.). Это, несомненно, правильная методологическая позиция, и она дает определенные клинические результаты в виде увеличения выживаемости онкологических пациентов и улучшения качества их жизни. Но этот методологический подход, основанный на комбинированном воздействии на иммунную систему, имеет преимущественно количественную оценочную характеристику одновременного максимального охвата воздействия на максимально возможное количество пострадавших звеньев иммунной системы онкологического больного с целью их стабилизации и компенсации. Однако ожидаемый результат в виде улучшения и нормализации параметров иммунного и интерферонового статуса у онкологического больного в результате ИТ не будет являться реальным отражением восстановления у него адекватного противоопухолевого ответа иммунной системы на наличие большого количества ОК.
Реальные возможности онкоиммунологии более емкие и многогранные и не ограничены стимуляцией или подавлением иммунитета у онкологического больного (Хаитов Р. М.,2013; Киселевский М. В.,2014; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018). Следует признать, что все достижения современной онкологии в области молекулярнонацеленной (таргетной) противоопухолевой терапии основаны именно на иммунологических аспектах блокирования механизма уклонения ОК и ОСК от надзора и контроля клеток иммунной системы пациента. В результате способности уклонения ОСК и её потомков (ОК различной степени дифференцировки) от иммунологического надзора и уничтожения собственной иммунной системой начинается бесконтрольный опухолевый рост, увеличение числа ОК и генерализация пролиферативного неопластического процесса путем метастазирования ОК (Dionne L.K., Driver E.R., Wang X.J.,2015).
Все последние разработки лекарственной таргетной противоопухолевой иммунотерапии «Большой Фармы» лежат в области блокирования молекулярных внутриклеточных путей сигнальной трансдукции (ВКПСТ) ОК и ОСК путем создания инновационных фармакологических препаратов, моделирующих таргетное регуляторное воздействие на мишени в ОК различными молекулами, имитирующими воздействие клеток иммунной системы (Dionne L.K., Driver E.R., Wang X.J.,2015; Gonias SL, Hu J.,2015). Они «имитируют» сигналы уничтожения киллерными иммунными клетками ОК, уклоняющихся из под иммунного надзора: различные типы моноклональных антител (МКАТ), блокирующие акцепторные белки (мишени) на путях ВКПСТ в ОК, противоопухолевые интерфероновые иммуномодуляторы, натуральные или синтетические сигнальные молекулы для иммунорегуляции (фактор некроза опухоли-ФНО, интерфероны, микроРНК, короткие интерференционные РНК, ДНК) и т. д. Современные противоопухолевые иммунопрепараты («Ингарон» — гамма интерферон, «РефНот» — ФНО) стали абсолютно самостоятельными средствами специального противоопухолевого иммунотерапевтического лечения (Шмелев В.А,2010, Лечиницер М. Р.,2015).
Современный зарубежный тренд проведения ИТ рака не исключает применения противоопухолевых вакцин и, более того, основной регулятор FDA CША даже официально разрешил клиническое применение вакцин при раке предстательной железы. И не беда, что при стоимости вакцины около 96 тыс. долларов США на курс, она лишь на несколько недель увеличивает продолжительность жизни пациента — это огромное достижение в реальном признании ИТ рака и других ЗНО, как официального противоопухолевого инструмента в лечении рака и ЗНО. Признание роли противоопухолевых вакцин FDA США, являющейся основным мировым регулятором в области легализации лекарственных препаратов, открывает большие перспективы их клинического применения в будущем по всему миру.
В таблице 2 представлены основные известные виды современной иммунотерапии рака и других злокачественных опухолей, сформулированные ведущим отечественным онкоиммунологом профессором М. В. Киселевским (цит. по Киселевскому М. В.,2014). Как видно из этой таблицы она не включает в себя подходов иммунореконструкции и иммуноинженерии. Как утверждает М. В. Киселевский (2002) эффект ИТ опухолей зависит от основных антигенных различий опухолевых и нормальных клеток. Преимущество иммунотерапии заключается в возможности подавления пролиферации опухолевых клеток без подавления пролиферации нормальных. К опухолям, в отношении которых уже доказана эффективность иммунотерапии, относятся: 1) меланома; 2) рак почки; 3) неходжкинская лимфома; 4) волосатоклеточный лейкоз; 5) рак прямой кишки; 6) рак яичника; 7) глиома и глиобластома; 8) саркома мягких тканей.
Активная специфическая иммунотерапия опухолей основывается на способности иммунной системы воздействовать на рост опухоли. Целью такой терапии является усиление иммунного ответа организма на опухоль. Показано, что иммунная система «умеет» отличать опухолевые клетки организма от нормальных и избирательно убивать клетки опухоли. Задача онколога, по мнению большинства онкоиммунологов, провести активацию собственной иммунной системы для её эффективной работы против опухоли (Хаитов Р. М.,2013; Киселевский М. В.,2014; Р. М. Хаитов, Р. И. Атауллаханов, А. Е. Шульженко,2018) и тогда есть шансы победить рак.
Таблица 2.
Основные виды современной иммунотерапии опухолей
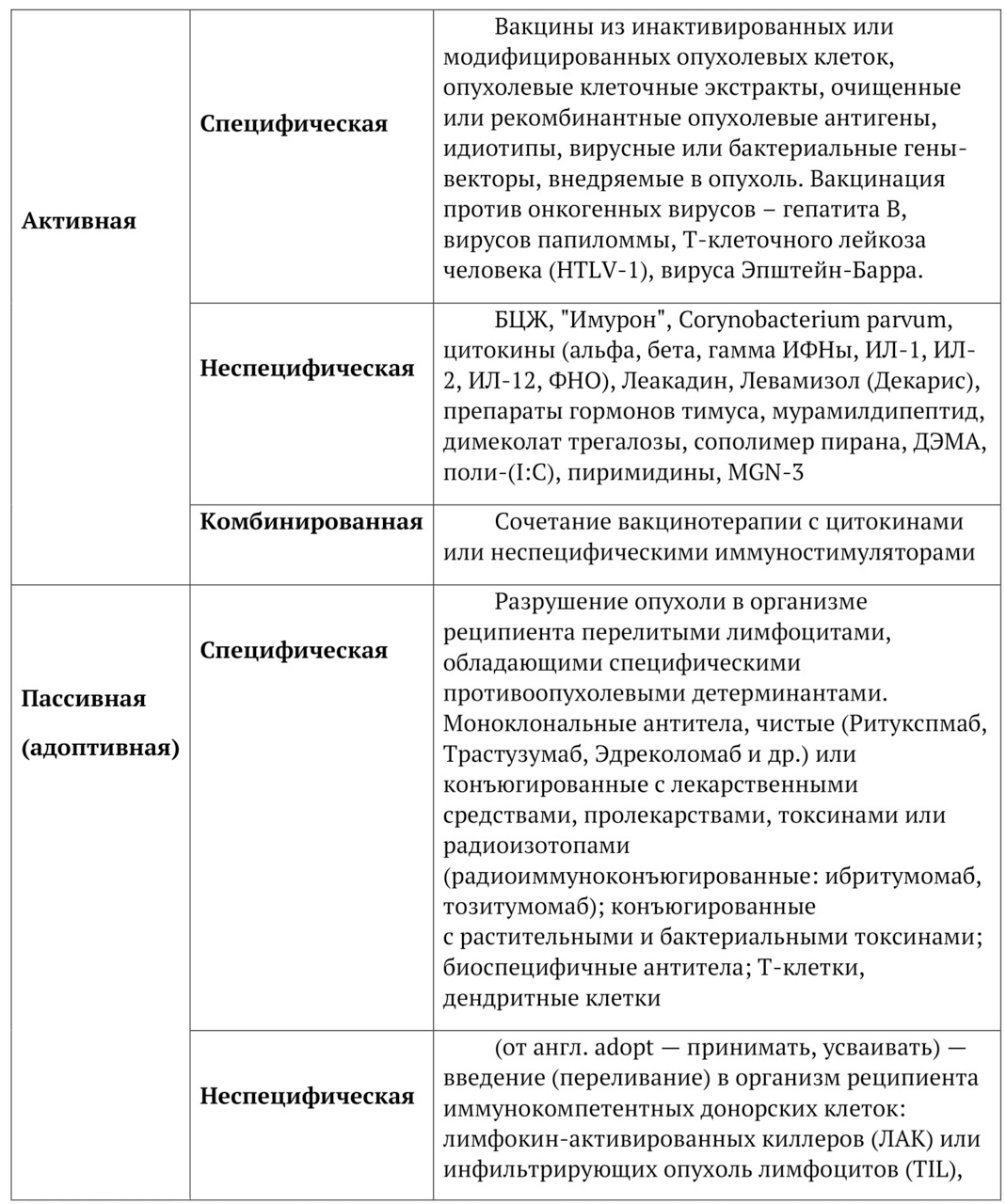

Идентификация опухолеассоциированных Внутри активной ИТ существует три основных подхода: первый — это стимуляция Т-лимфоцитов, второй (менее распространенный) — это стимуляция нормальных киллеров (NK -клеток), третий — манипуляции с дендритными клетками. Последние методы в основном определяются как вакцинотерапия опухолей. В литературе, посвященной вопросам иммунотерапии опухолей, часто можно встретить термин «противораковая вакцина». К сожалению, в некоторых случаях авторами это понятие используется ошибочно или некорректно (М. Н. Бережная, 2015). Вакцинация — способ создания активного иммунитета с помощью вакцин. Необходимое условие при этом — способность к правильной иммунной реакции у пациента на вакцину (отсутствие иммунодефицита, правильное распознавание и презентация клетками иммунной системы антигена). Другой термин — «иммунизация» — имеет более широкое понятие, подразумевает возможность создания не только активного, но и пассивного иммунитета. Это может быть достигнуто различными способами, в том числе путем введения в организм готовых факторов иммунной защиты (антител, иммунокомпетентных клеток и др.) (В. В. Зверев, Р. М. Хаитов, 2014). Пассивная иммунизация часто проводится на фоне имеющегося у пациента иммунодефицита.
В случае клеточных вакцин опухолевые клетки берутся непосредственно у пациента и выращиваются в специальных условиях. Затем эти клетки используют в лечебных целях, предварительно убедившись, что они больше не размножаются и не содержат никакого материала, способного инфицировать пациента. При введении клеточной вакцины у пациента генерируется иммунный ответ против опухолевых антигенов. Существует два типа клеточных противоопухолевых вакцин. 1. Аутологичные клеточные вакцины содержат собственные клетки пациента, культивируемые с опухолевыми антигенами, полученными из опухолевых клеток (предварительно инактивированные ионизирующим облучением, механическим фрагментированием, выделением экзосом и т.д.). 2. Аллогенные клеточные вакцины изготовлены из целых инактивированных опухолевых клеток другого пациента или представляют собой комбинацию из клеток нескольких пациентов. Существует еще и целый спектр ксеногенных противоопухолевых вакцин, о которых мы поговорим ниже.
Антигенные вакцины не содержат в своем составе целых клеток, а только антигены опухолевых клеток. Одна опухоль может быть представлена широким спектром антигенов. Некоторые антигены представлены у всех опухолей определенного типа, а некоторые антигены уникальны и могут быть обнаружены только у данного пациента. Существует много путей включить антиген в состав антигенной вакцины. Белки или фрагменты белков опухолевых клеток непосредственно вводятся в организм в качестве вакцины. В организм вводится генетический материал, кодирующий эти протеины (ДНК- и РНК-вакцины). В качестве «средства доставки» антигена в организм пациента может быть использован вирус. Вирусы, используемые подобным образом, называют «вирусными векторами» и не обладают никакими инфекционными свойствами. Эти вирусы в лабораторных условиях инфицируют клетки организма человека и становятся носителями на своей поверхности опухолевых антигенов. Вирус способен инфицировать только небольшое количество клеток организма — достаточное для генерации иммунного ответа, но недостаточное для того, чтобы вызвать заболевание.
С помощью методов генной инженерии можно также использовать вирусы для выработки цитокинов или встраивать протеины в поверхность вируса, что способствует активации иммунокомпетентных клеток. Таким образом, модифицированные вирусы можно вводить в организм пациента самостоятельно или в комбинации с вакциной для усиления генерации иммунного ответа.
Иногда в качестве антигенов в вакцине используют антитела. Пациенту вводят антитела к опухолевым антигенам, затем В-лимфоциты вырабатывают антитела к этим антителам, которые также распознают опухолевые клетки. Это так называемые «антиидиотипические вакцины», отличающиеся от пассивного лечения антителами.
АПК-вакцины изготовлены на основе антигенпрезентирующих клеток, которые обладают наибольшей способностью активировать Т-лимфоциты для уничтожения опухолевых клеток. Чаще всего используются дендритные клетки. Противоопухолевые вакцины содержат в своем составе дендритные клетки, которые либо подвержены первичному воздействию антигена, либо растут в его присутствии. Дендритные клетки (или другие АПК), подверженные воздействию антигена, несут опухолевые антигены на своей поверхности и при попадании в организм готовы активировать размножение Т-лимфоцитов и уничтожение ими опухолевых клеток.
Клиническое применение противоопухолевых вакцин — разновидность иммунотерапии, которая пока является преимущественно экспериментальной. ИТ опухолей вакцинами в основном определяется как методика вакцинотерапии опухолей. В связи с этим к противоопухолевым вакцинам относятся только те методы иммунотерапии, которые приводят к созданию у пациента специфического активного противоопухолевого иммунитета или противовирусного иммунитета к онкогенным вирусам (http://www.anticancer.net/reviews/immunotherapy.php). Противоопухолевая вакцинация — это способ создания активного специфического противоопухолевого иммунитета в организме с помощью вакцины, содержащей иммуногенные антигены (В. В. Зверев, Р. М. Хаитов, 2014). Противоопухолевые вакцины могут включать в свой состав целые опухолевые клетки либо только их антигены. В зависимости от их состава и, следовательно, механизма формирования иммунного ответа противоопухолевые вакцины классифицируются следующим образом: 1. Вакцины на основе целых клеток: а) аутологичные; б) аллогенные. 2. Антигенные вакцины: а) белки или фрагменты белков опухолевых клеток; б) ДНК и РНК-содержащие вакцины; в) рекомбинантные вирусы; г) антиидиотипические вакцины. 3. Вакцины на основе дендритных клеток. 4. Вакцины, полученные на основе культивирования дендритных клеток с экзосомами, выделенными из плазмы, спиномозговой жидкости, опухолевого эксудата (из плевральной жидкости, асцитической жидкости и т.д.), а также из культуральной жидкости в которой культивировались линии опухолевых клеток. Эти экзосомы из ОК называют декзосомами (Филатов М. В.,2012).
Для приготовления клеточных вакцин опухолевые клетки берутся непосредственно у пациента и выращиваются в специальных условиях. Затем эти клетки используют в лечебных целях, предварительно убедившись, что они больше не размножаются и не содержат никакого материала, способного инфицировать пациента. Если у больного нет собственной опухоли для приготовления вакцины, исследователи используют в этих целях опухолевую ткань из официального банка клеточных культур. Биоматериал опухолевой ткани подбирается на основании гистологии, цитологического заключения и иммуногистохимических и молекулярно-биологических результатов изучения опухоли самого пациента. При введении клеточной вакцины у пациента генерируется искусственный иммунный ответ против опухолевых антигенов (Олюшин В. Е. ссоавт.,,2012).
В настоящее время проводятся клинические испытания множества вакцин против различных злокачественных опухолей. 8 апреля 2008 года биотехнологическая компания Antigenics сообщила о государственной регистрации в Российской Федерации препарата Oncophage® (витеспен, HSPPC-96) для лечения пациентов с раком почки с риском рецидивирования. Вакцина представляет собой белок теплового шока, выделенный из опухоли определенного пациента и направленный именно против нее. Препарат Oncophage проходил испытания в качестве вакцины для профилактики рецидивов рака почек, точнее от гипернефромы. Исследование показало, что у пациентов с раком почки, у которых вероятность рецидива была минимальна, «Oncophage» удлинил период ремиссии на 45%, в среднем на 1,8 года по сравнению с контрольной группой, сообщает Antigenics.
Противоопухолевая вакцина Onyvax (антиидиотипическая вакцина на основе моноклональных антител 105AD7) с 25 апреля 2002 года по настоящее время проходит клинические испытания (лечение поздних стадий колоректальной аденокарциномы) в одной из больниц Лондона (St. George’s Hospital, London, UK). Вакцину назначают внутрикожно одновременно с вакциной BCG или внутримышечно одновременно с адъювантом — гидроксидом алюминия.
Cancer VAX — (поливалентная вакцина против меланомы) — с 17 февраля 2000 года используется совместно с хирургическим лечением при лечении 3-й стадии меланомы в трех медицинских центрах Австралии, во Франции (Pitie-Salpetriere, Paris), в Израиле и в 25 центрах США. Для усиления клеточного иммунного ответа эту вакцину назначают совместно с вакциной BCG.
С 1 марта 2001 года в Университете штата Техас (University of Texas, USA) для лечения пациентов с II — IV стадиями раковых опухолей желудочно-кишечного тракта (пищевода, желудка, поджелудочной железы, толстой кишки), содержащих клетки с канцероэмбрионическим антигеном (carcinoembryonic antigen — CEA) на их мембранах, используются пептидные фрагменты этого антигена из семи аминокислот (пептид канцероэмбрионического антигена 1—6D). Совместно с этим пептидом назначают GM-CSF (NLM Identifier http://clinicaltrials.gov/show/NCT00012246).
Со 2 апреля 2001 года в Нью-Йорке, США (Herbert Irving Comprehensive Cancer Center, New York) применяется пептидная вакцина NY-ESO-1, которую вводят внутрикожно при II — IV стадиях сарком мягких тканей, если данная опухоль экспрессирует антигены NY-ESO-1, LAGE NY-ESO-1 или LAGE. Совместно с этой вакциной подкожно вводят гранулоцитарный-макрофагальный колониестимулирующий фактор (ГМ-КСФ). ГМ-КСФ вводят в течение 5 дней, начав курс за 2 дня до назначения вакцины (NLM Identifier http://clinicaltrials.gov/show/NCT00027911).
С 8 ноября 2001 года в Калифорнии, США (Hoag Memorial Hospital Presbyterian, Newport Beach, California) для лечения пациентов с рецидивами рака почек III — IV стадии применяют аутологичные дендритные и опухолевые клетки, а также рекомбинантный гранулоцит-макрофаг колониестимулирующий фактор (NLM Identifier http://clinicaltrials.gov/show/NCT00014131).
С 9 ноября 2001 года в Чикаго, США (University of Chicago Cancer Research Center, USA) для лечения метастатического гормонрезистентного рака простаты применяют вакцину, разработанную на основе простатоспецифического мембранного. Кроме того, для подавления ангиогенеза в метастазах вводят IL-12 (NLM Identifier http://clinicaltrials.gov/show/NCT00015977).
Вакцина ALVAC-CEA/B7.1представляет собой дезактивированный штамм вируса, антигенная структура которого во многом повторяет антигены, выделяемые колоректальными опухолями. Препарат проходит клинические испытания при лечении метастатического колоректального рака в нескольких крупных медицинских центрах Северной Америки (в Лос-Анжелесе, Нью-Йорке, Вашингтоне, Филадельфии, Чикаго и Онтарио). ALVAC-CEA/B7.1 назначается сразу же после установления диагноза вместе с химиотерапией, и уже получены первые обнадеживающие результаты без каких-либо побочных эффектов.
Вакцина VG-1000 действует против защитных механизмов злокачественных клеток. Эта вакцина наиболее эффективна в лечении карцином и меланом, а также с успехом применяется при некоторых видах сарком и лейкемии. Условием применения вакцины является отсутствие угнетения системы иммунитета вследствие предшествующей химиотерапии или лучевой терапии. VG-1000 может быть рекомендован в качестве препарата первой линии для пациентов с недавно диагностированным раком, а также для предотвращения рецидивирования рака. Этот метод лечения в настоящее время применяется в двух клиниках Северной Америки: во Фрипорте (Багамы) — The Immuno-Augmentative Clinic, Freeport, Grand Bahamas, а также в Тихуане (Мексика) — CHIPSA’s — Center for Integrative Medicine in Tijuana, Baja California, Mexico.
Исследователи из Нью-Йорка считают, что кратчайший путь к разработке новой вакцины против рака — использование особого класса протеинов, так называемых белков теплового шока (Heat Shock Proteins: New Avenue To Cancer Vaccines).
В Мерилэнде (США) в настоящее время проводится вторая фаза клинических испытаний вакцины «TRICOM» для оценки эффективности лечения поздних стадий рака простаты с метастазами в кости. Название «Tricom» — сокращение для комбинации из трех взаимостимулируюших друг друга молекул, которые усиливают Т-клеточный ответ (B7—1, ICAM и LFA-3). Первая фаза клинических испытаний вакцины у пациентов со злокачественными новообразованиями (все раковые опухоли экспрессировали карциноэмбрионический антиген — CEA) продемонстрировала безопасность препарата и его эффективность.
На особом месте стоят ксеногенные противоопухолевые вакцины. Профессор иммунологии В. И. Селедцов с соавт., (2015) считают, что во взрослом здоровом организме человека присутствуют дифференцировочные тестикулярные антигены, которые экспрессируются только в клетках яичка. Вместе с тем, эти антигены являются маркерами опухолей разного генеза. Исследователи предлагают использовать ксеногенные тестикулярные антигены для профилактики и лечения злокачественных заболеваний посредством прерывания иммунной толерантности к опухоли. Эффективность этой технологии авторами была ранее убедительно продемонстрирована в научных исследованиях (A. Stathopoulos, 2007; Seledtsov V.I. Shishkov A.A., Seledtsova G.V.,2011; V.I. Seledtsov, A.G. Goncharov, G.V. Seledtsova, 2015; Salmaninejad A, Zamani MR, Pourvahedi M. et al.,2016). Возможность разработки эффективных препаратов с селективным противоопухолевым действием представляется весьма проблематичной, поскольку жизнедеятельность опухолевых и нормальных клеток обеспечивается сходными биохимическими процессами. Вместе с тем, опухолевая клетка отличается от нормальной клетки своим поверхностным рельефом, который формируется потенциально иммуногенными структурами (антигенами). Твердо установлено, что индуцируемые этими структурами иммунные реакции способны вызывать деструкцию опухолевых клеток и что реактивность иммунной системы может определять исход заболевания (Селедцов В.И, Селедцова Г. В.,2010). Все опухолеассоциированные антигены (ОАА) могут быть разделены на две группы. Первая включает в себя вирусные и мутантные антигены. Эти антигены трудно выявляемы и являются высокоспецифичными (уникальными) для каждой опухоли. Вторая группа включает в себя дифференцировочные антигены, которые экспрессируются как на опухолевых, так и на нормальных клетках. Несколько особняком в ряду таких дифференцировочных антигенов стоят тестикулярные антигены (продукты MAGEA1, MAGE-A3, MAGE-A4, NY-ESO-1, PRAME, CT83, SSX2 и др). Показано, что тестикулярные антигены высоко экспрессируются в опухолях различного происхождения (печень, молочная железа поджелудочная железа, кишка, легкие и др.) и практически не экспрессируются нормальными клетками, за исключением клеток яичка и плаценты (Strioga et al., 2014; Gjerstorff et al., 2015; Salmaninejad et al., 2016). По сути, эти антигены являются универсальными, высокоспецифичными опухолевыми маркерами и наиболее подходящими не только для терапевтической, но и профилактической противоопухолевой вакцинации. Дифференцировочные антигены, в том числе и тестикулярные, являются эволюционно консервативными молекулами. Следствием этого является высокая степень гомологии между дифференцировочными антигенами человека и животных. Однако небольшие межвидовые структурные отличия этих антигенов можно выгодно использовать при разработке технологии получения противоопухолевых вакцин. Представление антиген-презентирующими клетками ксеногенных антигенов, как «измененное свое», способно прерывать иммунологическую толерантность, исходно имеющуюся в организме по отношению к аутологичным гомологам.
Эффективность такого подхода к прерыванию иммунной толерантности к опухоли командой профессора Селедцова В. И. была продемонстрирована в многочисленных экспериментальных исследованиях (обзоры Strioga et al., 2014; Seledtsov et.al., 2015). Также показано, что в достижении противоопухолевого эффекта полиантигенная вакцинация имеет важные преимущества над моно- или олигоантигенной вакцинацией, поскольку может более эффективно препятствовать ростовой селекции опухолевых клеток, не экспрессирующих тот или иной вакцинальный антиген (Селедцов В. И., Селедцова Г. В., 2010; Seledtsov et al. 2010). Группа профессора В. И. Селедцова совместно с зарубежными коллегами разработали технологию получения прототипа противоопухолевой вакцины на основе тестикулярных антигенов барана. Согласно, предварительным данным, ксеногенные тестикулярные антигены способны индуцировать иммунные реакции, направленные против рака простаты, рака легкого, рака молочной железы и рака поджелудочной железы (Seledtsov et. al., 2016 WO 2016046651 A1). Прототип вакцины представляет собой лиофилизированный порошок, который не требует особых условий хранения и транспортировки. Препарат не теряет иммуногенных свойств, по крайней мере, в течение 1 года и может быть стандартизован в полном соответствии с международными требованиями. Мы так подробно остановились на этой вакцине, так как считаем, что это одна из самых перспективных отечественных разработок российских онкоиммунологов.
Обобщая вышесказанное, следует отметить, что наиболее перспективным направлением иммунотерапии рака и других ЗНО является иммунизация пациента опухолевыми антигенами, создание противоопухолевых вакцин на основе дендритных аутоклеток, а также использование антигенспецифических цитотоксических Т-лимфоцитов, полученных при активации лимфоцитов ex vivo в присутствие опухолевых антигенов. Для активации специфического противоопухолевого иммунитета в последнее время созданы методы получения автовакцин на основе дендритных клеток (ДК). ДК обладают высокой способностью презентировать Т-киллерам специфические опухолевые антигены, и делать их иммунными по отношению к клеткам опухоли. ДК генерируются из периферических стволовых клеток или клеток костного мозга посредством культивирования с колоние -стимулирующими факторами (ГМ-КСФ, ИЛ-4 и др.). ДК инкубируются с опухолевыми антигенами, вводятся в организм больного и активируют in vitro специфический противоопухолевый иммунитет. Эта процедура позволяет повысить распознавание опухолевых клеток, характеризующихся низкой иммуногеностью, цитотоксическими Т-лимфоцитами. Клинические испытания этой вакцины проводятся у больных с распространенными формами злокачественных новообразований традиционно считающихся чувствительными к иммунотерапии (меланома, рак почки и колоректальный рак, глиобластома). Вместе с тем вакцинотерапия может быть использована и при раке яичников. Очевидно, что наиболее оптимально ее применение после радикальной операции и стандартной химиотерапии, т. е. после максимального удаления опухоли. Кроме того, хирургическое вмешательство позволит получить необходимое количество ткани, антигены которой будут презентированы дендритными клетками (Киселевский М. В.,2010).
На сайте http://www.tumor.su/leshenie/immunother.html было показано, что различные иммунные агенты могут воздействовать на опухоль посредством одного или более механизмов, а именно: 1. Стимулировать противоопухолевый иммунный ответ, увеличивая количество эффекторных клеток (например, лимфокинов); 2. Выступать в качестве эффектора или медиатора; 3. Подавлять иммунодепрессивный эффект опухоли на организм; 4. Влиять на опухолевые клетки так, чтобы повышалась их иммуногенность и вероятность повреждения за счет иммунологических реакций; 5. Увеличивать устойчивость организма к цитотоксической или лучевой терапии. Поэтому многоцелевое комбинированное воздействие на различные звенья иммунной системы считается большинством иммунологов научно-обоснованным и правильным (Черных Е. Р. с соавт.,2015).
Очень перспективным многоцелевым и комплексным направлением применения иммунотерапии в онкологии считаются работы в области направленного использования иммунной «реакции трансплантат против опухоли». Э. И. Подольцева, (2003) в своей статье «Реакция „трансплантат против опухоли“ — перспективный метод иммунотерапии злокачественных новообразований» (http:// www. practical — oncology.ru/arh015/07.pdf) показала, что современная ИТ может оказаться разумной альтернативой для больных, резистентных к химиотерапии. Мы полностью разделяем научную позицию этого исследователя и хотели бы более подробно остановиться на этом методологическом подходе.
Несмотря на определенные успехи в лечении злокачественных новообразований различными режимами стандартной химиотерапии, их излечение до настоящего времени остается проблемой. Наращивание доз цитостатических препаратов до субмаксимальных с целью полной эрадикации остаточных клеток опухолевого клона потребовало введения в клиническую практику метода трансплантации аллогенных или аутологичных гемопоэтических стволовых клеток (ТГСК). Традиционно считалось, что высокодозная химиотерапия является основным компонентом в процедуре ТГСК, и трансплантация совместимых ГСК выполняется для заместительной терапии пациентов, получивших летальные дозы химиопрепаратов. Однако в последующем, через многие годы наблюдения, было установлено, что у части пациентов все равно возникал рецидив, причем частота рецидивов была выше у больных с аутологичной или сингенной (от однояйцевых близнецов) ТГСК по сравнению с аллогенной ТГСК. Наименьшая частота рецидивов отмечалась у пациентов с аллогенной трансплантацией, имевших проявления реакции «трансплантат против хозяина» (РТПХ).
Данный научный факт позволил предположить наличие у таких больных иммуноопосредованного эффекта «трансплантат против лейкемии» (ТПЛ), играющего ведущую роль в элиминации остаточных злокачественных клеток, «переживших» химио- или лучевую терапию. В дальнейшем это позволило сформулировать концепцию индукции эффекта «трансплантат против лейкемии» или «трансплантат против опухоли» (ТПО) инфузией донорских лимфоцитов после ТГСК. Вероятность того, что аллогенные лимфоциты при ТГСК могут элиминировать лейкозные клетки, благодаря иммуноопосредованному эффекту, ТПЛ предполагалась на основании полученных результатов экспериментальной и клинической ТГСК. Прямая корреляция между острой и хронической РТПХ и снижением частоты рецидивов лейкозов в клинической практике была впервые описана P. Weiden и соавт. (1998). Эффект «ТПО», аналогичный эффекту ТПЛ, также был описан сначала в эксперименте у мышей со спонтанной саркомой, а затем и в клинике у пациентов с раком молочной железы. Роль иммуноопосредованного эффекта ТПЛ в течение ТГСК в дальнейшем была подтверждена наблюдениями, согласно которым, рецидивы, возникшие на фоне иммуносупрессивной терапии циклоспорином A (ЦСА), купировались при ее отмене. Было установлено также, что возникновение рецидивов уменьшалось у пациентов, получавших сниженные дозы ЦСА. Все эти данные свидетельствуют о том, что при аллогенной ТГСК иммунокомпетентные донорские Т-лимфоциты могут реагировать против остаточных опухолевых клеток. Таким образом, преимущество ТГСК перед стандартной химиотерапией заключается в комбинированном эффекте миелоаблативной дозы химио- или радиотерапии в пред-трансплантационном периоде и в способности иммунокомпетентных аллогенных донорских Т-лимфоцитов элиминировать остаточные опухолевые клетки в результате эффекта ТПЛ или ТПО. Исходя из этого, возникло предположение, что инфузии донорских аллогенных лимфоцитов в посттрансплантационном периоде можно использовать для лечения или профилактики рецидивов у пациентов с высоким риском прогрессирования, как аллогенную ИТ (аллоИТ). Первая успешная инфузия донорских лимфоцитов (ИДЛ) была выполнена у двухлетнего ребенка с острым пре-В лимфобластным лейкозом в Иерусалиме в 1986 г. В последующем этот метод лечения рецидивов после ТГСК стал применяться во многих клиниках мира у пациентов с острым лимфобластным (ОЛЛ) и миелобластным (ОМЛ) лейкозами, с хроническим миелолейкозом (ХМЛ), миелодиспластическим синдромом (МДС). Основываясь на экспериментальных данных аллоИТ, полученных на мышах, для лечения рецидивов в некоторых клиниках стали также использовать ИДЛ, активированные рекомбинантным интерлейкином-2 (рИЛ_2).
Учитывая данные об эффективности лечения ИДЛ как аллоИТ у пациентов с «минимальной остаточной болезнью», в настоящее время настоятельно рекомендуется у пациентов высокого риска рецидива после трансплантации проводить частый регулярный мониторинг химеризма (маркеров ДНК донора и реципиента). Наряду с Т-лимфоцитами другие типы клеток также вовлечены в индукцию и реализацию эффекта ТПЛ. NК-клетки, моноциты, макрофаги оказывают противоопухолевый эффект, независимый от экспрессии антигенов гистосовместимости. В то же время известно, что многие опухолевые клетки, в частности метастатические, не экспрессируют молекулы главного комплекса гистосовместимости.
Как следует из результатов исследований, выполненных на мышах и в клинике, аллореактивные NК-клетки могут быть хорошими индукторами эффектов ТПЛ и ТПО без активации РТПХ. Таким образом, в настоящее время имеются экспериментальные и клинические данные, свидетельствующие о возможности полной эрадикации опухолевых клеток в посттрансплантационном периоде ИДЛ как при злокачественных заболеваниях системы крови, так и при солидных опухолях. При этом в аллоИТ злокачественных заболеваний системы крови важная роль принадлежит аллореактивным Т-лимфоцитам.
Обобщая все вышеизложенное, можно все существующие современные подходы ИТ разделить на ряд существующих стратегий ИТ. Одной из этих стратегией современной ИТ является аллогенная трансплантация (AллоT), а другой аллогенная ИТ (аллоИТ). Технология AллoT считается одним из первых терапевтических подходов для онкологии и регенеративной медицины. Историю возникновения аллоТ- технологии мы презентовали в 4-й главе. В течение более чем пятидесяти лет аллoT широко изучалась, и серьезные проблемы были связаны с поиском доступных доноров и ограничением токсичности, главным образом из-за РТПХ, но сбалансированной РТПО, направленным на их отделение (Hodgkinson KM, Kiernan J, Shih A.W. et al., 2017).
Таким образом, различные опыты, направленные на уменьшение незначительных различий HLA с использованием двух доноров или истощающих Т-клеток, были связаны с более высокой частотой рецидивов. Это демонстрирует важность Т-клеток и усиление их репертуара после AллoT. Таким образом, происхождение доноров было расширено с помощью сопоставленных несвязанных доноров, ведущих к широкой национальной и международной организации «Пуповинная кровь» (UCB). Этот биоматериал был введен в качестве нового источника, альтернативного костному мозгу, особенно из-за возможности использовать несколько образцов USB у взрослых для преодоления ограничения по клеточной дозе, иммунологической наивности и дополнительной донорской лимфоцитарной инфузии, открывающей путь для использования неиммунологических клеток в контексте регенеративной медицины (Berglund S, Magalhaes I, Gaballa A. et al., 2017).
Совсем недавно протокол HLA-HI аллoT был специально доработан, чтобы ограничить трудности для подбора доноров и уменьшить существующие затраты в организации донорского подбора. Основной проблемой HLA-HI аллoT является большая двунаправленная аллореактивность, связанная с высокими уровнями отторжения и РТПХ. Успехи в методах трансплантации и в профилактике РТПХ приводят к снижению риска, как отторжения, так и РТПХ, и это сделало этот источник стволовых клеток (СК) жизнеспособной альтернативой, особенно для пациентов, у которых отсутствует HLA-подобный донор (Ringden O, Labopin M, Ciceri M et al. 2015). Сложность различных режимов лечения и различные состояния заболевания затрудняют интерпретацию ретроспективного анализа. Тем не менее, в этом ретроспективном анализе HLA-HI аллoT имела сопоставимые результаты, чем другие типы аллoT, особенно для острого миелоидного лейкоза (AML) (Fabricius WA, Ramanathan M. 2016).
Одной из основных возможностей использования сопутствующего донора является сбор и создание дополнительных специализированных клеточных продуктов от одного и того же доступного донора. Таким образом, сбор представляет собой платформу для совместной инфузии или посттрансплантационной клеточной терапии, включая Tregs и обычные Т-клетки, аллореактивные Т-клетки, истощеннные αβ CD19+ T-клетки, немодифицированные DLI, инфузию γ/δ донорских Т-клеток, инфузию Т-клеток CAR, эксфорированные ex vivo NK-лимфоциты или NKT-клетки (Kongtim P, Lee DA, Cooper L.J.N. et al., 2015; J.-F.Rossi, 2017).
Воспроизведение aллoТ-эффекта с аутологичной трансплантацией (аутоT) так же рассматривается как самостоятельная стратегия ИТ или иммунная инженерия. АутоТ комбинированная с высокодозной химиотерапией, проводилась посредством аутологичных клеток костного мозга периферической крови, обычно полученных после их мобилизации в периферической крови (ПК). Гемопоэтическая репопуляция была связана с подавлением иммунитета, за которым следует всплеск цитокинов, обычно наблюдаемый между пятнадцатым и двадцать первым днем после инфузии клеток КМ ПК (Condomines M, Veyrune JL, Larroque M. et al., 2010). Этот конкретный период после трансплантации представляет собой «окно возможностей» для повторного введения активированных и амплифицированных клеточных препаратов как аутологичного, так и аллогенного происхождения. Ниже мы вернемся к феномену «окна возможностей» при аллоИТ.
Глава 6. Роль и место иммунотерапии в комплексном противоопухолевом лечении
Неуклонное прогрессирование заболевания у онкологического больного и длительное противоопухолевое лечение зачастую приводят к «тупиковой» клинической ситуации, когда весь современный «арсенал» конвенциального противоопухолевого (циторедуктивного, цитостатического и цитотоксического) лечения рака уже полностью исчерпан, и современная клиническая онкологическая наука уже не может предложить никакого иного лечения данному больному, кроме как паллиативную помощь и хоспис. Отдельные пациенты смиряются с подобной ситуацией и покорно ждут исхода болезни, другие продолжают активно искать выход из создавшегося положения, обращаясь в ведущие столичные и зарубежные онкологические клиники, в поисках инновационных способов хирургической резекции опухоли, применения новых экспериментальных противо-опухолевых фармацевтических таргетных препаратов для ХТ и продвинутых методов ЛТ или стереотаксической радиохирургии. Часть этих больных едет за рубеж и получает в США, Израиле или Европе активную и пассивную экспериментальную ИТ опухолей, а также различные варианты современной адоптивной ИТ, направленной на стимуляцию собственных ресурсов иммунной системы больного. Однако существенного результата эта терапия в большинстве случаев не приносит. Другие онкологические больные от безысходности обращаются к народным целителям, травникам, шаманам и даже к шарлатанам, использующим различные виды колдовства и магии.
На первый взгляд всё абсолютно верно и закономерно. Надо признавать очевидное, что человек не всесилен и смертен! Победить рак сегодня мы не можем!!! И громкие заявления мировых лидеров о том, что «…Давайте сделаем Америку страной, где излечивают от рака» (B. Obama, 2016), на самом деле являются лишь популистскими высказываниями и политической риторикой. Современная онкологическая наука в этих случаях бессильна и надо смириться с безвыходностью ситуации, признать и принять факт того, что в рак не излечим, в данном конкретном случае все мобилизационные ресурсы организма и онкологических лечебных учреждений исчерпаны и надеяться, вроде бы, не на что. Однако, это не совсем так. Правильнее было бы сказать, что это в целом ряде случаев может быть совсем не так!
Современная онкологическая наука показала и доказала, что при правильной эксплуатации современных достижений прецизионной (высокоточной) медицины вообще, и онкологической иммунологии в частности, есть реальная возможность существенно продлить жизнь онкологическому больному путем проведения специализированной противоопухолевой ИТ, которая в ряде случаев может стать реальной альтернативой конвенциональным (хирургическим, химиотерапевтическим и радиологическим) методам лечения. Классическим примером эффективности современной прецизионной ИТ рака стало чудесное излечение от злокачественного новообразования 90-летнего экс-президента США Джимми Картера. Сегодня Джимми Картер главный пропагандист эффективности иммунотерапии рака в США и в Израиле. И таких примеров чудесного исцеления от злокачественных неоплазий вследствие ИТ рака сегодня очень много в социальных сетях и рекламных роликах ведущих фармацевтических компаний. Преимущественно эти достижения и научные факты излечения от отдельных видов рака относят к высокой эффективности новых противоопухолевых онкоиммунных и таргетных фармацевтических препаратов, способных к работе даже в случаях массивной генерализации опухолевого процесса и наличия отдаленных метастазов опухоли.
Несмотря на значительные достижения современной онкологии, выживаемость больных со злокачественными опухолями остается крайне низкой. Медиана выживаемости онкологических пациентов с возвратными и рефрактерными злокачественными опухолями зависит от степени пролиферативности неопластического процесса и находится на уровне 2-3-х лет, а при наличии метастазов составляет 6—8 месяцев (Комов Д. В., 2014). Лишь при небольшом количестве отдельных возвратных форм рака выживаемость онкологических пациентов составляет более 5 лет (Давыдов М. И.,2015). Медиана выживаемости больных с мультиформной глиобластомой (МГБ) за последние 100 лет не изменилась и составляет 8—12 месяцев. При этом стоимость высокотехнологического нейроонкологического лечения МГБ выросла за последние 10 лет более, чем в 100 раз.
К сожалению, существующий стандарт современной онкологической помощи, как в экономически развитых странах Европы и США, так и в России, ограничен определенным набором штампов, способов и методик общепризнанного (конвенционального) противоопухолевого лечения ракового больного. На первом этапе он включает первичную радикальную хирургическую резекцию опухоли, затем ХТ 1 и 2-й линии и ЛТ (ионизирующее облучение, не превышающее 60 Грей). На втором этапе стандарта (при возникновении рецидива/прогрессии опухоли) проводится повторная хирургическая резекция (по показаниям и если возможно), 3-я и 4-я линия ХТ. На этом этапе возможно использование других циторедуктивных методик: протонная радиотерапия, гипертермия, радиоизотопная терапия, фотодинамическая терапия, фокусированный ультразвук и др. Если после лечения отмечается продолженный рост опухоли и дальнейшее прогрессирование болезни (рецидив рака или ЗНО) — стандарта нет. В этих случаях у онкологического больного практически исчерпан ресурс конвенционального противоопухолевого лечения и это, в рамках медицинского стандарта, означает, что ему уже нельзя больше ничем помочь. Его удел — только паллиативная терапия и хоспис, то есть полный отказ от дальнейшего специализированного противоопухолевого лечения и переход на симптоматическое лечение.
Однако, существующий медицинский стандарт в онкологии это еще не окончательный приговор и это далеко не весь арсенал потенциальных возможностей современной медицины. Именно иммунотерапия может стать реальной альтернативой научно-обоснованного противоопухолевого лечения онкопациентов, у которых исчерпан запас конвенциональных стандартных методов (ХТ, ЛТ, хирургия) лечения. Так, сегодня в арсенале онкологов появились новые онкоиммунные препараты на основе моноклональных антител (МКАТ), способных подавить рост даже метастической опухоли. Именно достижения онкоиммунологии сегодня стали двигателем научного прогресса в современной онкологической науке.
Понимание роли и места иммунной системы при опухолевых заболеваниях стало результатом стремительного развития одного из наиболее сложных разделов современной онкологии — иммунологии злокачественного роста. Эти научные подходы сформировались в конце 50-х-начале 60-х годов прошлого столетия, благодаря усилиям отечественных и зарубежных исследователей, в частности А. А. Богомольца, Л. А. Зильбера, R. Prehn, Е. Foley, G. Кlein и других. Однако четких установок и протоколов о том «когда?» и «как долго?», а также «сколько и в каких дозах?» необходимо использовать иммунотерапию в комплексном лечении рака и других ЗНО, так и не существует до настоящего времени (Бережная М. Н., 2015; Тупицын Н. Н., 2016; Маркина И. Г., Тупицын Н. Н., Михайлова И. Н. с соавт.,2017).
Как было отмечено выше, применяемые противоопухолевые методы лечения, среди которых основными, наряду с хирургическими, являются химиотерапия, отдельно или в сочетании с лучевой и радиотерапией, часто бывают недостаточно эффективны. В последнее время в структуру разрешенного противоопухолевого лечения были включены новые медицинские технологии циторедукции опухоли: фотодинамическая терапия, протонная терапия, гипертермическая терапия, применение радиоизотопных препаратов и фокусированный ультразвуковые абляции. Кроме того, все эти воздействия сами по себе вызывают иммуносупрессию, следствием которой являются подавление костномозгового кроветворения и инфекционные осложнения, а также развитие дисбиоза и дисбактериоза кишечника. В итоге, иммунная система, возможно, уже напряженная и ослабленная в результате развития опухоли, подвергается еще одному, дополнительному удару, подавляющему ее активность и способность к защите. Отсюда следует, что успешное излечение от опухоли может зависеть от баланса между противоопухолевой эффективностью химиотерапевтических комплексов и потенциалом иммунной системы, достаточным (или недостаточным) для того, чтобы справиться с оставшимся после стандартного лечения количеством ОК (Маркина И. Г.,Тупицын Н. Н., Михайлова И. Н. с соавт.,2017). Поэтому одной из основных областей применения иммунотерапии в структуре комплексного лечения рака долгое время являлось использование иммуностимулирующих и иммуномодулирующих препаратов для иммунологического сопровождения курсов ЛТ и ХТ, то есть, для профилактики инфекционных и гнойно-септических осложнений цитостатической и цитотоксической противоопухолевой терапии. В связи с этой проблемой было предложено несколько дополнительных или альтернативных способов лечения опухолей, большинство из которых направлено на усиление противоопухолевой активности иммунной системы самого пациента. Это далеко не новое направление в современной онкологии, получило название стимуляционной ИТ опухолей. Существующая ИТ различных злокачественных опухолей не является облигатной (обязательной), скорее она носит факультативный характер, хотя уже давно ИТ доказала необходимость и целесообразность своего клинического применения в структуре комплексной терапии рака и других онкологических заболеваний, однако широкого клинического применения она пока к сожалению не приобрела. Более того, большинство онкологов продолжают называть ИТ экспериментальным противоопухолевым лечением (Олюшин В. Е. с оавт.,2012; Фалалеева Н. А.,2017; Давыдов М. И.,2016).
Стремительное развитие в последние 5—7 лет онкоиммунологии привело к накоплению большого числа разнообразных фактов и наблюдений, касающихся различных сторон течения опухолевого процесса и тех изменений, которые происходят на клеточном, субклеточном и молекулярном уровнях в организме онкологического больного (Лечиницер М. Р.,2016). Однако, многие полученные клинические данные, на первый взгляд, представляются противоречивыми, и это позволяет думать о необходимости проведения глубокого анализа и систематизации накопленного фактического материала (Тюляндин С. А., 2017). В настоящее время, по мнению Бережной М. Н. (2015), в онкоиммунологии определилось несколько активно разрабатываемых направлений, которые определяют роль ИТ рака в целом и демонстрируют её место в системе комплексного противоопухолевого лечения пациента:
1. Идентификация опухолеассоциированных специфических (продукты мутантных генов) и неспецифических (продукты нормальных генов) опухолевых антигенов;
2. Изучение закономерностей распознавания опухолевых пептидов антигенраспознающими клетками параллельно с исследованием внутриклеточных механизмов процесса представления антигенов;
3. Исследование механизмов реализации цитотоксического действия различных эффекторных клеток, особенностей цитокиновой регуляции клеток системы иммунитета, влияния цитокинов на опухолевые клетки и их взаимодействие с клетками системы иммунитета;
4. Выяснение механизмов ускользания опухоли из-под иммунологического контроля и причин иммуностимуляции роста опухолей, их супрессирующего влияния на клетки системы иммунитета;
5. Поиск информативных методов иммунологических исследований в качестве критериев оценки состояния онкологических больных и эффективности иммунотерапии;
6. Разработка новых подходов к иммунотерапии больных со злокачественными новообразованиями на основе результатов фундаментальных исследований.
В настоящее время достигнуты определенные успехи в изучении различных аспектов процесса распознавания опухолевых антигенов. Это направление ИТ-исследований включает идентификацию антигенов и генов, которые их кодируют, изучение закономерностей распознавания опухолевых пептидов антиген-распознающими и взаимодействия с антиген-презентирующими клетками, а также выяснение молекулярных механизмов процессинга антигенов. Однако как в прошлом, так и в настоящем, исследователи сталкиваются с серьезными трудностями. Эти трудности обусловлены многими причинами и, в первую очередь, отсутствием или низким уровнем экспрессии антигенов опухолевой клеткой, слабой способностью многих опухолевых клеток секретировать опухолевые пептиды и, как следствие этого — отсутствие их в крови и биологических жидкостях организма; наличие в злокачественно трансформированных клетках различных антигенных эпитопов, присущих, в том числе, и нормальным клеткам; нестабильность антигенной структуры опухолевой клетки на различных этапах опухолевого роста; различия в антигенном составе первичных и метастазирующих опухолей (Тупицын Н. Н.,2012). Особый акцент необходимо сделать на том, что не все антигены опухолевых клеток способны индуцировать противоопухолевую защиту, а некоторые из них могут вызывать стимуляцию роста опухоли или иммунологическую толерантность (Бережная М. Н., 2015; Кадагидзе З. Г.,2017, Гривцова Л. Ю.,2017).
Другой точкой приложения ИТ опухолей стала борьба с возможными иммунными реакциями организма, возникающими в ответ на агрессивное противоопухолевое лечение. Основная роль ИТ рака основана на том, что эксплуатируется тот научный факт, что многие опухоли характеризуются слабым иммунным ответом и выраженным иммуносупрессивным действием, механизмы формирования которого до конца еще не исследованы. Состояние иммунодепрессии расценивается как важный патогенетический фактор неблагоприятного течения злокачественных опухолей, а перспективы их лечения связывают с разработкой и внедрением в практику методов ИТ. Основными положениями иммунологии злокачественных опухолей, которые создали теоретические предпосылки для ИТ, по мнению ряда онкоиммунологов (Бережная. М.Н.,2015; Тупицын Н. Н., 2016; Кадагидзе З. Г.,2017) являются следующие:
1) клетки опухолей экспрессируют на поверхностной мембране антигены, отличающиеся от нормальных;
2) при экспериментальном канцерогенезе и предраковых заболеваниях человека наблюдается недостаточность иммунной системы;
3) клинически выявляемый рост ЗНО происходит при нарушении состояния иммунной системы, которое усугубляется противоопухолевым лечением;
4) более высокая реактивность иммунной системы до и после лечения коррелирует с лучшим прогнозом.
В настоящее время взаимодействие иммунной системы и опухоли рассматривается как процесс иммуноредактирования, состоящий из трех фаз: элиминации, равновесия и «ускользания» (Кадагидзе З. Г.,2017). В период элиминации врожденный и адаптивный иммунитет разрушают возникающие клетки опухоли задолго до клинического проявления болезни. В фазе равновесия некоторые ОК не разрушаются, и этап элиминации может перейти в фазу равновесия, в период которой иммунологические механизмы сдерживают дальнейшее развитие опухоли. Если опухоль ускользает от иммунологического распознавания и разрушения, она прогрессирует из фазы равновесия в фазу «ускользания» и становится клинически очевидной (Teng M.W., Galon G., Fridman W.H.,Smith M.J.,2015; Кадагидзе З. Г.,2017) и манифестирует целым рядом клинических синдромов и симптомокомплексов (Нечипоренко В. В., Лыткин В. М.,2016).
Доказано, что не смотря на то, что ИТ эффективна для большинства ОК, она практически не воздействует на ОСК опухоли, так как на поверхностной мембране ОСК не представлены основные специфические раковые антигены (Шевченко В. Е., Брюховецкий И. С.,2016). В свете концепции опухолевой стволовой клетки общепризнано, что опухоль начинается с ОСК, которая делится симметричным делением (на две ОСК или две ОСК- прогениторные клетки) или асимметричным делением (на ОСК и ОСК-прогениторую клетку). По современным представлениям ОСК это аутологичная СК, получившая в процессе своей жизнедеятельности и функционирования, критический набор мутаций генов и анеуплоидий, в результате которых у нее сформировалась неустойчивость генома (кариотипа), она вышла из под контроля регуляторных механизмов иммунной системы и регионарных противоопухолевых систем, стала неуправляемо пролиферировать и делиться, а также приобрела характеристики бессмертной клеточной системы. Потомки ОСК имеют различную степень дифференцировки и характеризуются более быстрым и частым делением клеток, по сравнению с их нормальными аналогами. Раковые клетки приобретают генетические мутации, которые наделяют их анормальными характеристиками. Эти мутации воздействуют на способность иммунной системы распознавать раковые клетки как анормальные. Для них характерно отсутствие регуляции роста, зависимой от факторов роста. Раковые клетки приобретают способности к росту в суспензии, имеют высокий индекс митозов, характеризуются бессмертием, резистентностью к апоптозу, потерей «гена — супрессора опухоли». И, конечно же, на поверхностной мембране раковых клеток различной стадии дифференцированности имеет место презентация раковых антигенов, которые могут быть выявлены специфическими онкомаркерами.
Возникает вопрос: как ОК и ОСК вторгаются в иммунную систему, и почему она не элиминирует эти клетки на этапе раннего развития? Ответ на этот вопрос сегодня однозначен. Опухолевые клетки растут быстрее, чем обычные клетки, имеют сниженную экспрессию антигенов и, соответственно, сниженную иммунногенность, выделяют иммунносупрессорные факторы, снижающие отклик хозяина, ингибируют апоптоз и могут быстро давать метастазы в другие органы и ткани. Соответственно, иммунная система реагирует на интервенцию раковых клеток активацией и напряжением всех своих компонентов. Напряжение иммунной системы проявляется клеточным ответом (активация лейкоцитов), тканевым ответом (иммунная реакция кожи, реакция первичных лимфоидных органов: костный мозг, тимус, активацией вторичных лимфоидных органов (печень, селезенка, лимфоузлы), а также выделяемыми молекулами (цитокины, факторы роста) разных клеток, антителами (иммуноглобулины), вырабатываемыми В-клетками.
В итоге, клеточный иммунитет проявляется специфической цитотоксичностью Т-клеток, NK-клеток, макрофагов и опосредует цитотоксичность, выделяя цитокины, а гуморальный иммунитет реагирует на опухоль образованием антиопухолевых антител В-клеток. В 3 главе мы уже обсуждали фундаментальные системные и частные молекулярно-биологические механизмы уклонения этих ОК от цитотоксического воздействия врожденных эффекторных клеток иммунной системы, поэтому в этой главе мы обсудим, где же, в этой связи, может быть научно-обоснованное место ИТ в протоколах комплексного лечения злокачественных опухолей, и какие цели должна преследовать ИТ рака в противоопухолевом лечении. Насколько научно-обоснована иммуностимуляция и иммунодепрессия как разновидность ИТ рака.
Во-первых, напомним, что вся существующая современная ИТ в большинстве случаев пытается усилить собственный иммунный ответ организма пациента: активацией NK- клеток (усиливает контроль над раком), активацией макрофагов (усиливает цитотоксичность), иммунизацией B-клеток (выработка антиопухолевых антител), активацией T-клеток (усиливает специфическую цитотоксичность Т-клеток). Во-вторых, показано, что различные иммунные агенты могут воздействовать на опухоль посредством одного или более механизмов, а именно: 1. Стимулировать противоопухолевый иммунный ответ, увеличивая количество эффекторных клеток (например, лимфокинов); 2. Выступать в качестве эффектора или медиатора; 3. Подавлять иммунодепрессивный эффект опухоли на организм; 4. Влиять на опухолевые клетки так, чтобы повышалась их иммуногенность и вероятность повреждения за счет иммунологических реакций; 5. Увеличивать устойчивость организма к цитотоксической ХТ или лучевой терапии (В. В. Зверев, Р. М. Хаитов,2014; Хаитов, Р.М., Атауллаханов, А. Е. Шульженко,2018). В третьих, как утверждает один из ведущих отечественных онкоиммунологов профессор д. м. н. М.В. Киселевский (2002), работающий в лаборатории иммунитета НИИ экспериментальной диагностики и терапии опухолей ФГБУ «Национальный медицинский исследовательский центр онкологии им Н.Н.Блохина Минздрава России эффект ИТ зависит от основных антигенных различий опухолевых и нормальных клеток. Преимущество ИТ рака и других ЗНО заключается в возможности подавления пролиферации опухолевых клеток без подавления пролиферации нормальных.
Оказалось, что иммунная система «умеет» отличать опухолевые клетки организма от нормальных и избирательно убивать клетки опухоли. М. В. Киселевский (2015) убежден, что задача онколога — провести активацию иммунной системы для её эффективной работы против опухоли. Однако представляется, что этот преимущественно «инфекционный» иммунологический подход отчасти может сработать, если в биологической основе канцерогенеза конкретного рака лежит вирусный генез заболевания. Во всех же остальных случаях, стимуляция собственных клеток иммунной системы будет неэффективна. Стимуляция собственного иммунитета не нанесет существенного вреда онкологическому больному, хотя и истощает его ресурсную и энергетическую базу, но и не окажет существенного результата в уменьшении количества опухолевых клеток.
Как мы отмечали ранее, среди иммунологов есть точка зрения, что медикаментозное расширение ХТ и ЛТ стимулирующими иммунными препаратами способствует уменьшению количества осложнений после проведения этих тяжелых медицинских протоколов противоопухолевого лечения (Горбунова В. А.с соавт., 2015). Мы применяли ряд стимуляционных иммунных препаратов (преимущественно левомизол) для сопроводительной терапии ХТ и ЛТ, но убедительно статистически значимого эффекта не отметили. Хотя больные и их родственники субъективно отмечали более легкое прохождение курсов ХТ и ЛТ. Поэтому, если больному субъективно становится лучше при проведении ХТ и ЛТ на фоне применения иммунных препаратов, то ему отказывать в этом приеме нецелесообразно.
Как было отмечено выше, внутри активной ИТ существует три основных подхода: первый — это стимуляция собственных Т-лимфоцитов, второй (менее распространенный) — это стимуляция собственных нормальных киллеров (NK cells), третий — манипуляции с дендритными клетками. Спектр идентифицируемых опухолевых антигенов, опухолеспецифических и неспецифических, постоянно расширяется параллельно с идентификацией кодирующих их генов. Наиболее изучены антигены меланомы, число которых в настоящее время насчитывает уже более 30. Благодаря идентификации опухолевых антигенов стало возможным изучение не только клеточных, но и молекулярных механизмов (в том числе на уровне генов) развития первого и важнейшего этапа иммунного ответа — процесса распознавания. Исследователи пришли к выводу, что способность к индукции иммунного ответа у опухолей различна и определяется их биологическими свойствами. Информация об особенностях экспрессии опухолевых антигенов клетками той или иной опухоли во многом может стать залогом эффективной ИТ рака (Бережная. М.Н.,2015):
Процесс распознавания антигенов опухоли и экспрессия антигенов главного комплекса гистосовместимости (ГКГ) как опухолевых клеток, так и лимфоцитов, непосредственно связаны. Это объясняется строгой закономерностью, согласно которой распознавание антигенов любой природы, в том числе и опухолевых, происходит лишь в том случае, если клетка-мишень и лимфоциты экспрессируют идентичные антигены главного комплекса гистосовместимости. Другими словами, даже если злокачественно трансформированной клеткой экспрессируются опухолевые антигены, но аналогичные антигены ГКГ не экспрессируются лимфоцитами, то иммунный ответ не формируется. Таким образом, изучение особенностей экспрессии антигенов ГКГ различными опухолевыми клетками так же важно, как и изучение экспрессии опухолевых антигенов. Современные знания об этом свидетельствуют, во-первых, о различиях в частоте экспрессии антигенов клетками различных опухолей, а во-вторых, о том, что уже на стадии предопухолевых состояний нередко снижается экспрессия этих антигенов I класса ГКГ. Имеются наблюдения о существовании достоверной отрицательной корреляции между снижением экспрессии антигенов I класса ГКГ и опухолевой прогрессией при многих опухолях (рак кишечника, молочной железы, шейки матки, ротовой полости и гортани, мочевого пузыря, меланома). Резкое снижение экспрессии антигенов I класса часто совпадает с ранним метастазированием, что особенно типично для клеток меланомы, которые, как правило, характеризуются дефицитом экспрессии антигенов I класса ГКГ. Из сказанного следует, что уже на первых этапах «встречи» опухолевых и иммунокомпетентных клеток отсутствие иммунного ответа может быть связано с особенностями опухолевой клетки, которая «диктует» свои условия развитию событий.
В настоящее время, уточнены представления о механизмах распознавания опухолевых антигенов антиген-распознающими клетками. В реализации этого механизма равное значение имеют функциональная активность антиген-презентирующих (дендритные клетки, В-лимфоциты, макрофаги) и антиген-распознающих клеток (различные субпопуляции Т-лимфоцитов), а также биологические особенности опухолевой клетки. Итогом фундаментальных исследований в этом направлении является установление бесспорного факта, согласно которому отсутствие распознавания создает оптимальные условия для ухода опухоли из-под иммунологического контроля с последующей инвазией окружающих тканей, сосудов и метастазированием (N.N.Tupitsin,2016).
До сих пор мы говорили об успехах современной онкологии и возможностях и перспективах ИТ рака. Состояние современного уровня иммунологических исследований в онкологической клинике можно отнести к ее неудачам. Почему онкоиммунологические исследования не займут своего должного места в существующих протоколах противоопухолевого лечения? При ответе на этот вопрос следует сделать разграничения, которые связаны с различиями в возможностях иммунологических исследований у нас и за рубежом. Да, действительно, современная онкоиммунология располагает филигранными методами исследований, требующими сложнейшего оборудования и дорогостоящих реактивов. Но даже эти методы имеют определенный лимит своей информативности. В наших же условиях иммунологические исследования ограничены сравнительно небольшим количеством традиционных методов, которые не обеспечивают необходимого уровня информации для оценки течения злокачественного процесса и эффективности терапии. Можно сказать, что это типичный путь развития фундаментальной науки, и как утверждает профессор М. Н. Бережная (2015), что со временем фундаментальная онкоиммунология даст клинике надежные иммунологические методы исследования, которые будут иметь широкий диапазон применения.
Оценивая ситуацию, сложившуюся в настоящее время в онкологии, хотелось бы обратить внимание на следующие обстоятельства. Во-первых, изменения в системе иммунитета при злокачественном росте требуют применения таких методов исследований, которые отражают функциональное состояние клеток, формирующих противоопухолевую защиту. Автоматический перенос данных первичного иммунологического скрининга (количество клеток того или иного фенотипа, уровень иммуноглобулинов разных изотипов, комплемента, показателей фагоцитоза и другие) в онкологическую клинику без проведенных дополнительных исследований нельзя считать корректным. Во-вторых, поскольку одной из особенностей опухолевого процесса являются гетерогенные изменения в системе иммунитета, то на каждом этапе развития новообразования необходимо использовать соответствующие методы иммунологического исследования. В-третьих, нельзя не учитывать достижений фундаментальной иммунологии. Если сегодня мы не всегда располагаем соответствующими методами, то должны хотя бы понимать суть происходящих процессов. При наличии подобного понимания, даже располагая ограниченными методическими возможностями, можно сделать правильные выводы, полезные для клиники.
В настоящее время известно, что каждая из субпопуляций лимфоцитов может выполнять в конкретных условиях различные функции (Гривцова Л. Ю.,2017). Например, СD4+-лимфоциты могут проявлять себя как супрессоры (выделена субпопуляция с супрессорной активностью — CD4+CD25+), а CD8+-лимфоциты — как хелперы. Часто на основании определения количества СD8+-лимфоцитов делаются необоснованные заключения о выраженности супрессорной активности этой субпопуляции лимфоцитов — критерий, который следует оценивать только с использованием адекватного и вполне доступного методического подхода. Согласно современным данным, установлено, что ориентация на количественное определение тех или иных клеток отражает лишь ничтожно малую часть информации, на которой должна базироваться оценка состояния этих клеток, что в равной степени относится практически ко всем популяциям лимфоцитов (CD4+- и CD8+-лимфоциты, естественные киллеры и другие). Например, очень часто на основании методов изучения маркеров естественных киллеров делается необоснованное заключение об их функциональной активности (N.N.Тupitsin, Grivtsova L. Yu.,2016).
Количественное определение тех или иных клеток в анализе крови на иммунный статус пациента необоснованно используется для рекомендаций по иммунотерапии. Такой подход вообще следует рассматривать как антинаучный. В такой же мере необходимо избегать обобщающих выводов, имея в виду твердо установленный факт: иммунологические изменения у больных с одними формами опухолей отличаются от изменений при других новообразованиях, что связано с различной антигенной структурой отдельных опухолей и разнообразием их возможностей влиять на систему иммунитета (Борунова А.А,2016; N.N.Тupitsin, Grivtsova L. Yu.,2016). Информативность даже самых современных методов иммунологических исследований в плане оценки потенциальных возможностей организма противостоять опухолевому процессу во многом снижается, если речь идет о больном, у которого опухоль не удалена. Это объясняется тем, что мы не знаем, то ли плохо работает система иммунитета, и поэтому нет иммунного ответа на опухоль, то ли опухолевая клетка не подает ей сигнала, на который она должна реагировать (Кадагидзе З. Г.с соавт.,2016, L.Yu.Grivtsova, N.N.Tupitsin,2016). Вместе с тем, значение результатов методов иммунологического исследования существенно возрастает после хирургического вмешательства с последующей химио- и радиотерапией. Иммунологическая система, как известно, проявляет особую чувствительность к отрицательным последствиям указанной терапии (Борунова А.А,2016), и в этих условиях коррекция состояния клеток системы иммунитета становится важной, а традиционные методы иммунологического исследования могут быть использованы для общей оценки иммунного гомеостаза и обоснования необходимости соответствующей терапии (Бережная М. Н.,2015; L.Yu.Grivtsova, N.N.Tupitsin,2016).
Оценивая всю сложность иммунологических и информационных взаимоотношений клеток иммунной системы человека и клеток опухоли, становится очевидным, что разбираться необходимо индивидуально в каждом конкретном случае онкологического заболевания, и совсем не обязателен тот факт, что мы сможем понять всю систему хитросплетений этих сложных отношений. Но как в практической клинической работе онколога и иммунолога понять роль и место ИТ рака? Как понять когда необходимо применять ИТ, а когда отказаться от неё? Как определиться в столь сложном спектре имеющихся иммунологических препаратов?
В предыдущих главах было отмечено, что современная проблема рака и других ЗНО это проблема не регулируемого и не контролируемого роста и увеличения количества ОК в организме пациента. Напомним, что в норме у каждого здорового человека есть 500 000 ОК (105). Поэтому создать ситуацию когда в организме пациента физически отсутствуют ОК теоретически и практически не возможно. Иммунная система контролирует это количество путем иммунного надзора, не позволяя ему превысить этот предел. Если иммунная система не способна контролировать опухолевый рост, то процесс канцерогенеза становится не управляемым. При количестве ОК, превышающем более 109 (миллиарда ОК) диагностируется рак, а в случаях, когда количество ОК не превышает этого предела, мы говорим о предраковых состояниях. Соответственно, существуют и определенные ограничения в терапевтических возможностях каждого метода противоопухолевого лечения. Хирургия способна уменьшить количество ОК до уровня 109. Диапазон действия ХТ и ЛТ составляет 107—109 ОK (Черных Е. Р. с соавт., 2014). Поэтому когда количество ОК не визуализируется глазом и медицинскими приборами роль регулятора количества ОК должна выполнять именно собственная иммунная система организма. То есть, с уровня ОК ниже 107, именно иммунная система и должна осуществлять контроль за количеством ОК в организме больного. Но именно на этом этапе стандартный протокол лечения онкологического больного заканчивается, когда его иммунная система не способна самостоятельно контролировать и регулировать количество ОК в организме и организм больного остается «один на один» с опухолевым процессом. Очевидно, что в этот период иммунная система онкологических больных, не зависимо от гистогенеза злокачественной опухоли, нуждается в реальной помощи, так как её противоопухолевая функция недостаточна или практически отсутствует.
В чем может и/или должна заключаться эта помощь? Как было отмечено ранее, активация и стимуляция собственных сил и резервов иммунитета малоэффективна, да и бесполезна. ОК в любом случае смогут уклониться и «ускользнуть» от собственных киллерных эффекторов, независимо от их количества и активности. Несомненно, что решение должно быть простым и понятным. Мы подумали, что наверняка, подобные решения уже были ранее реализованы в других областях науки и техники. Можно взять за основу методологические и технологические подходы, которыми подобные проблемы решают математики и физики. Оказалось, что в науке и технике это достаточно часто встречающаяся проблема «утраты или нарушения функции у системы» в исследованиях по теории управления, теории автоматов, теории авторулевого, теории автоколебаний и теории систем. Ведь очень часто мы решаем проблемы в технике, находя примеры и аналогии в живых системах. Тогда почему бы не попытаться поискать аналогии решения проблемы в технике и в информационных технологиях, чем, собственно, и оперирует теория систем и теория управления. Решение подобной проблемы еще в 70-х годах прошлого века было очень красиво реализовано в системном программировании электронно-вычислительных машин (ЭВМ), когда еще использовались большие вычислительные машины, и системные инженеры-программисты писали программы машинными кодами на языке Assembler. В мире вычислительной и компьютерной техники есть один распространенный технологический приём для восстановления нарушенной функции у пострадавшего компьютера. Подход заключается к восстановлению утраченной функции путем эмуляция или копирования функции одной вычислительной системы на другую аналогичную информационную вычислительную систему, и этим обеспечивается реставрация утраченной функции на пострадавшем компьютере, без разрушения нарушенной. Поэтому мы решили, что существующий в технике научно-методологический подход эмуляции функции, активно применяющийся в сфере информационных технологий, может быть реализован не только в промышленных информационных системах, но и в живых системах, которые также могут претендовать на звание очень сложных информационных биотехнологических систем.
При повреждении программного обеспечения, ответственного за выполнение определенной функции у большой ЭВМ, системные программисты никогда не пытались удалить все программное обеспечение этой функции или разрушить существующее общее системное программное обеспечение и написать новое. Вместо этого, они параллельно встраивали копию этой поврежденной функции, снятой из другой исправной машины в существующую системную программу и отлаживали её взаимодействие с другими модулями программы. Копирование функции одной системы программного обеспечения с исправной ЭВМ с последующим переносом и копированием её на другую систему программного обеспечения поврежденной ЭВМ называлось эмуляцией и позволяло восстановить работу неисправной ЭВМ. Главной задачей системного программиста, в этом случае, была корректная инсталляция части новой программы и точное встраивание и отладка взаимодействия скопированного с другой системы «куска» рабочей программы, обеспечивающего выполнение нарушенной функции, в существующее программное обеспечение ЭВМ.
Попытаемся, с определенной долей условности, перенести научно-технологический подход копирования (эмуляции) функции в вычислительной технике на живые системы. В нашем случае есть две биологические системы: иммунная система онкологического пациента и иммунная система здорового донора. Можно попытаться решить проблему копирования противоопухолевой функции иммунной системы здорового близкородственного (гаплоидентичного) организма онкологического пациента путем инсталляции этой функции у пациента трансфузией ему клеточных систем и инфузией ряда гуморальных факторов врожденного и приобретенного иммунитета здорового донора. Таким способом, можно обеспечить «протезирование» существующей противоопухолевой недостаточности систем врожденного и приобретенного иммунитета онкологического больного эволюционным, а не революционным путем, т.е. не повреждая и не разрушая его собственную иммунную систему высокодозной ХТ или ЛТ. Очевидно, что копирование работоспособных противоопухолевых функций иммунной системы здорового донора у онкологического пациента может быть реализовано, как путем молекулярно-генетического подбора неманипулированных иммунокомпетентных клеток донора, так и путем генной, транскриптомной и (или) пептидной инженерной модификации иммунокомпетентных клеток самого онкологического пациента в заданном направлении. Эмуляцию противоопухолевой функции можно попытаться дополнить базовыми гуморальными компонентами иммунной системы здорового донора, ответственными за противоопухолевые функции иммунитета, а также применением искусственных фармакологических гуморальных компонентов (факторы роста, МКАТ, ФНО и т.д.). Аутологичная трансплантация клеток костного мозга онкологическому пациенту создает ему абсолютный аналог его собственной иммунной системы, уже имеющую дефектную противоопухолевую функцию. Поэтому, даже абсолютно успешная трансплантация собственных ГСК онкологическому больному после высокодозной химиотерапии не может быть эффективной для реставрации противоопухолевых свойств скомпроментированной иммунной системы у онкологического пациента. Она разрушит сохранные функции противобактериальной, антивирусной, антимикотической и антипаразитарной защиты иммунной системы, абсолютно не гарантируя полного восстановления противоопухолевой функции иммунитета. Применение аллогенной (даже близкородственной) трансплантации костного мозга нарушит все другие функции иммунной системы и создаст высокий риск развития РТПХ. Поэтому протезирование противоопухолевых свойств иммунной системы может быть реализовано путем применения аллогенных иммунокомпетентных клеток и (или) иммунокомпетентных клеток с измененным эпигеномом. Аллогенные и манипулированные аутологичные иммунокомпетентные клетки донора должны быть аллореактивными, то есть способными преодолеть любые возможности уклонении ОК от клеток врожденного иммунитета: NК-клеток, макрофагов и Т-лимфоцитов и т. д. Очевидно, что собственная иммунная система пациента, по определению, не способна презентовать опухолевые антигены на дендритных клетках, а также формировать эффективные цитотоксические лимфоциты. Следовательно, необходимо также протезировать эти функции презентации опухолевых антигенов на дендритных клетках пациента искусственным путем, т.е. создать искусственный пул ДК и эффекторных цитотоксических лимфоцитов. То есть, у каждого онкологического больного должны быть воссозданы основные функции эффекторной клеточной системы врожденного и приобретенного иммунитета. Сегодня технологии позволяют достаточно быстро (за 10—14 дней) вырастить цитотоксические лимфоциты из собственных мононуклеарных клеток периферической крови пациента, так как для них может быть решена проблема достаточной презентации опухолевых антигенов на собственных дендритных клетках. При необходимости количество и представленность индивидуальных опухолевых антигенов может быть значительно увеличены на аутологичных дендритных клетках (ДК) путем электропорации (воздействия электрическим током на ДК) в период нахождения их в клеточной культуре с механически или химически убитыми или обезвреженными радиацией опухолевыми антигенами, полученными из ткани опухоли самого пациента или из опухоли другого пациента, идентичной опухоли пациента по иммуногистохимическому составу.
Таким образом, после завершения основных курсов стандартной ХТ и ЛТ и полного восстановления параметров крови (не менее 14 дней) всем онкологическим больным должна проводиться, в обязательном порядке, аллогенная или протеом-модифицированная аутологичная прецизионная (высокоточная) эмуляционная иммунотерапия, направленная на ремоделирование иммунитета и искусственное протезирование противоопухолевых функций врожденного и приобретенного иммунитета.
Таким образом, основная роль, место и стратегия применения прецизионной ИТ должна сводится к определенному алгоритму терапевтических действий:
1. Прецизионная ИТ рака и других ЗНО не должна подменять собой цитотоксические, циторедуктивные и цитостатические возможности конвенциональных методов лечения (ХТ, ЛТ, радиохирургии, хирургии), а должна всегда стоять только за ними;
2. Прецизионная ИТ рака должна проводится только тогда, когда количество опухолевых клеток в организме ракового больного менее 107 и не визуализируется стандартными методами лучевой диагностики (УЗИ, КТ, МРТ), но может быть верифицировано методами ПЭТ/КТ;
3. В случае значительной распространенности онкологического процесса у больного и невозможности применения стандартных противоопухолевых хирургических и терапевтических практик для снижения общего количества ОК менее 107, могут сначала применяться таргетные и онкоиммунные лекарственные препараты, обеспечивающие необходимое снижение ОК в организме, и только затем прецизионная ИТ рака.
4. ИТ рака и других ЗНО должна стать обязательным компонентом любого противоопухолевого лечения у ракового больного и проводиться всегда после завершения стандартных противоопухолевых практик (хирургии, ЛТ, ХТ), но не ранее, чем через 2 недели (14 дней) после их завершения;
5. ИТ рака и других ЗНО должна решать конкретные терапевтические цели: «зачистки» и элиминации из организма онкологического пациента оставшихся ОК (до уровня 105ОК), профилактические цели — предупреждения рецидива/прогрессирования неопластического процесса и метастазирования, регуляторные цели — удержания болезни в состоянии МОБ — минимальной остаточной болезни;
6. ИТ рака и других ЗНО должна проводится под постоянным (1 раз в 2 недели) контролем развернутого иммунного статуса пациента
7. Если после проведения стандартного противоопухолевого лечения у ракового больного отмечаются структурные нарушения клеточно-гуморальных звеньев его иммунитета, то сначала необходимо их скорректировать иммунными препаратами и компонентами донорской крови (Эр-массы, тромбоциты и т.д.) и только затем применять интервенционных методов прецизионной ИТ;
8. ИТ рака и других ЗНО должна эмулировать (копировать) противоопухолевую функцию иммунитета искусственным путем, ремоделируя, но не разрушая, иммунную систему онкологического пациента в нужном направлении с использованием иммунных лекарственных препаратов, имитирующих гуморальные факторы иммунитета (цитокины, факторы роста, гормоны и т.д.) и биомедицинских клеточных продуктов, созданных на основе иммунокомпетентных клеток донора и самого пациента и протезирующих клеточные системы врожденного и приобретенного иммунитета;
9. Применение неманипулированных иммунокомпетентных клеток самого пациента для ИТ рака не целесообразно, не эффективно и не правомерно;
10. При проведении прецизионной лекарственно-клеточной ИТ «лекарственное расширение» должно проводиться только разрешенными фармацевтическими иммуномодулирующими, иммуностимулирующими и иммунокорректирующими средствами, а «клеточное замещение» — только иммунокомпетентными клетками, содержащимися в стандартных аллогенных и комбинированных биомедицинских клеточных продуктах.
Глава 7. Прецизионная иммунотерапия рака и других опухолей
Сейчас мир вступает в фазу четвертой промышленной революции, когда серьезнейшей силой в развитии общества, фактически свойством вещей, становится Интернет и цифровые технологии. Они перестают быть только средством коммуникации, а пронизывают всю структуру общества и научных исследований. Происходит серьезное изменение и переформатирование многих процессов, начиная с ментальных и заключая технологическими. При этом медицина — одна из ключевых отраслей, которые затронет четвертая промышленная революция. Сможет ли Россия найти свое место на глобальном рынке медицинских инноваций или останется в зоне технологического уклада середины XX века? Это и есть один из главных вызовов на сегодня. В чем сильно наше здравоохранение, где самое большое отставание, и какие меры нужны для прорыва и выхода в число ведущих научно-медицинских держав — эти вопросы требуют решения уже сегодня (А. Фирсов,2017). В этой главе мы решили обсудить проблему прецизионной (высокоточной или точно-ориентированной) иммунотерапии (ИТ) злокачественных опухолей, как одного из самых продвинутых направлений мирового здравоохранения, и посмотреть на изучаемую нами проблему ИТ рака с современных позиций прецизионной медицины.
Сама постановка проблемы высокоточного клинического метода лечения для современной медицины в целом не нова и характерна для настоящего времени в целом. Проблемы прецизионной медицины сегодня стали столь актуальны, что в Интернете на запрос о «прецизионной медицины» было найдено 69 млн. результатов поиска. В области прецизионной медицины проводятся десятки научных конференций и международных конгрессов. Прецизионная медицина (обозначаемая также как персонализированная медицина, стратификационная медицина) — это общепринятый термин, означающий медицинскую модель, при которой принятие решений, использование методов лечения и выбор лекарственных продуктов должны быть приспособлены к конкретному пациенту (Flores M, Glusman M, et al., 2013).
Очень наглядно и емко сущность прецизионной медицины представлена на сайте международной компании Janssen Global (http://www.janssen.com/ru/precision-medicine-janssen-diagnostics/overview). Cпециалисты компании Janssen Global утверждают, что в ближайшем будущем все больше пациентов будут получать прецизионное лечение. Назначаемое лечение станет не только строго специфичным для уникальных индивидуальных потребностей человека, но и
• Прогностическим: узнавая больше о природе болезней и о нашей биологии, будут найдены биомаркеры, которые помогают выявить людей с предрасположенностью к определенным заболеваниям. Со временем медицинские прогнозы будут становиться более точными и будет можно с большой вероятностью предугадывать, у кого возникнет то или иное заболевание, и какими будут вероятные результаты его лечения.
• Превентивным: будут прогнозироваться болезни, и предупреждение их развития станет намного более реальной перспективой. Такой подход позволяет создать совершенно иную модель здравоохранения, которая основана на раннем врачебном вмешательстве и новых терапевтических подходах, направленных на предотвращение развития болезней. Выявление людей с предрасположенностью к тем или иным заболеваниям — будет ли это в ближайшем будущем или через десятки лет — окажет огромный положительный эффект на медицинскую практику.
• Персонализированным: совершенствуя понимание биологии и природы болезней, будут применяться уникальные способы лечения и управления заболеваниями, индивидуально разработанные для каждого конкретного пациента, тем самым добиваясь лучших результатов лечения. Такое индивидуально подобранное лечение также должно снизить количество побочных эффектов. Долговременный диагностический мониторинг результатов лечения в режиме реального времени поможет внедрить модель полностью персонализированного здравоохранения.
• Основанным на широком участии: новые технологии позволят общаться и обмениваться данными через социальные сети и онлайн-сообщества. Эта тенденция уже сегодня набирает обороты. Будут созданы новые инструменты и платформы, которые позволят людям получать доступ к информации об их заболеваниях и делиться ею с другими людьми, оказавшимися в подобной ситуации. Эти инструменты также научат людей лучше понимать те факторы образа жизни и поведения, которые помогают бороться с болезнью и сохранять здоровье.
Прецизионная иммунотерапия рака, как раз и есть тот новый инструмент и биотехнологическая платформа терапии рака и других ЗНО (Flores M, Glusman M, et al., 2013). Это и есть новая модель ИТ опухолей, острая потребность которой ощущается как обществом, так и всем врачебным сообществом. Ремоделирование иммунной системы онкологического больного под задачи прецизионной иммунотерапевтической модели и есть основная цель создания данной биотехнологической платформы. Однако начнем мы это обсуждение с существующих парадоксов точности лечебных методов в современной медицине вообще, и в иммунотерапии рака, в частности.
Как утверждал Гиппократ, «заветной мечтой медицины является постоянное стремление стать точной наукой, а не искусством». Поэтому «искусство врачевания» во все времена нуждалось в точности расчета доз лекарственных препаратов, четкого времени и сроков их применения, а также в строгости и корректности формулировок и определений применяемых способов лечения. О точности медицины в настоящее время существуют разные точки зрения. С одной стороны есть пословица, что «медицина по точности занимает второе место после богословия». Необязательность и даже отсутствие необходимости высокой точности в исполнении строгих регламентов, норм и стандартов в диагностике и терапии заболеваний в современной медицине давно стало нормой. Приблизительность и «околонаучность», в целом ряде существующих методологических подходов современной медицины, пришли в неё преимущественно из народной (нетрадиционной) медицины (мануальная терапия –терапия руками, апитерапия-лечение пчёлами, фитотерапия — лечение травами, гирудотерапия — лечение пиявками, иглоукалывание-лечение иглами и т.д.), методы которой достаточно широко применяются и до настоящего времени в клинической практике мирового здравоохранения.
С другой стороны, современная медицина вообще и онкология в частности, действительно является высокоточной и высокотехнологичной медицинской отраслью экономики по большинству параметров и характеристик, приборной оснащенности и информатизированности медицинских учреждений. В 21-м веке медицинское приборостроение и медицинская диагностика в онкологии перешли на инновационные информационные технологии VI технологического уклада и относятся к разряду самых высокоточных научных дисциплин и цифровых технологий в мире, способных обнаружить повреждение в тканях и органах в объеме от нескольких микрон до нескольких сантиметров. Медицина нашего времени оснащена самыми современными информационными и диагностическими системами и компьютеризированными аппаратами и широко оперирует пикселями, мегабайтами и гигабитами диагностической информации. Особенно это касается, в первую очередь, методов лучевой диагностики типа компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), позитронно-эмиссионной томографии (ПЭТ) и ультразвуковой диагностики (УЗИ), а также лучевой терапии (ЛТ), которая широко использует стереотаксические радиохирургические комплексы типа Gamma-Knife, Cyber-Knife, Novartis и т. д. Эти компьютеризированные диагностические и терапевтические (радиохирургические) медицинские комплексы способны творить чудеса прицельной диагностики и безоперационного удаления небольших опухолей и метастазов, без вскрытия кожных покровов и даже костей черепа. А современные стереотаксические компьютеризированные комплексы фокусированного ультразвука на базе МРТ-томографов позволяют проводить локальную абляцию любого участка ткани организма человека исключительно точно. Однако в представлениях большинства обывателей и медицинских профессионалов современная «медицина» продолжает оставаться достаточно «неточной» и «приблизительной» наукой.
Это связано с неравномерным развитием различных лечебно-диагностических методов в современной медицине. Бурная компьютеризация и информатизация диагностических направлений в медицине привела к значительным отставаниям от них большинства лечебных фармацевтических методов, технологий восстановления и реабилитации и целого ряда хирургических способов лечения. Иллюстрацией подобных тенденций и современных трендов в медицине является следующий пример: обнаружив с помощью современной лучевой компьютерной диагностики (КТ, МРТ) зону или микрозону ишемической патологии в мозге в объеме нескольких миллиметров, врачи, специалисты в лучевой диагностике дадут исчерпывающие характеристики выявленного патологического очага по плотности, размеру, объему и клеточности, а врачи-лечебники вне зависимости от всех выявленных морфологичесих параметров уложат больного в кровать и назначат церебропротекторы (церебролизин), сосудистые и ноотропные препарты в соответствии с существующими стандартами оказания медицинской помощи прошлого века. Даже ультрасовременная интервенционная тромболитическая терапия ишемии мозга становится очень неспецифичной и до банальности условной, когда происходит процесс перехода от интервенционной продвинутой диагностики к реальной терапии. Аналогичная ситуация складывается и с диагностикой и терапией множественных очагов опухоли мозга, когда, например, обнаружив десятки мелких метастатических опухолевых узлов в головном мозге больному отказывают во всех способах хирургии (нейрохирургии, радиохирургии, фокусированном ультразвуке), а предложенные методы конвенциональной противоопухолевой терапии (химиотерапия и радиотерапия), как правило, уже будут не эффективны и неприемлемыми, в соответствии с существующими стандартами лечения ЗНО. Итогом суперсовременного диагностического обследования онкологического больного становится отказ от лечения и рекомендация направления в хоспис.
Несомненно следует признать, что при всем богатстве выбора современных информационных и компьютерных диагностических технологий в медицине, большинство методов существующей терапии онкологических заболеваний, и в том числе и ИТ рака, и других ЗНО, продолжают оставаться приблизительными и неточными методами лечения до настоящего времени. Например, в экспериментальном применении ЛАК — терапии в качестве ИТ рака, исследователи-онкоиммунологи, так и не определились с её эффективностью и оптимальной терапевтической дозой активированных лимфоцитов и временем, необходимым для лечения онкологических пациентов с использованием этой технологии до полной элиминацией ОК (Киселевский М. В., 2015). Все отдано на откуп профессионализму лечащего врача. Но и врач-профессионал принимает решение интуитивно и субъективно, а также очень надеется на свой личный опыт и свои знания. А когда это касается ультрасовременных таргетных онкоиммунологических препаратов, то время и дозы терапии рака этими молекулярнонацеленными и достаточно высокоточными препаратами из МКАТ и микроРНК определены в инструкциях по их применению на все то же «усмотрение лечащего врача». Что может усмотреть три четверти практических онкологов в молекулярнонацеленной терапии, если они не владеют даже базовыми основами клинической молекулярной биологии рака?
До настоящего времени в ИТ рака аллогенными NK-клетками нет четкого понимания потребности количества NК-клеток для терапии опухолей, не создано жестких формализованных инструкций их клинического применения, а также не определен объем необходимого количества цитотоксических лимфоцитов (ЦТЛ) требуемых для лечения опухолевой резидуальной остаточной болезни у пациента после завершения основных курсов химио- и лучевой терапии рака. Следует отметить, что именно от неопределенности дозы и отсутствия жесткого временного регламента для приема иммунных препаратов возможно во многом зависит клиническая неэффективность всей существующей ИТ опухолей. Возможно, что неэффективность ИТ связана также и с глобальным непониманием проблемы, роли, места и объема проводимой ИТ в комплексе противоопухолевого лечения врачами-онкологами. А может быть, именно реальная неэффективность ИТ рака не позволяет четко определить время и дозы иммуноактивных препаратов для проведения ИТ.
Из множества испробованных подходов ИТ опухолей, с позиций современных научных представлений, самыми перспективными и практически значимыми оказались: 1) подходы, направленные на получение индивидуализированных противоопухолевых вакцин, создаваемых на основе идентифицированных опухолевых антигенов из массы опухоли больного путем клинического применения дендритных клеток, нагруженных этими опухолевыми антигенами, 2) использование цитотоксических лимфоцитов, активированных интерлейкинами в присутствии ДК с презентирующими на их поверхности опухолевыми антигенами, и 3) сочетанные (комбинированные) методы ИТ в виде дендритных вакцин и ЦТЛ. Так, при мультиформной глиобластоме (МГБ), применение противоопухолевых вакцин (более 3-х курсов) и ЦТЛ в комплексном лечении МГБ позволило увеличить выживаемость пациентов до 33 месяцев (В.Е.Олюшин с соавт.,2012; Филатов М. В. с соавт.,2012), при медиане стандартного лечения МГБ без ИТ только 6—12 месяцев. При этом, дозы противоопухолевых вакцин, например для терапии глиобластомы, так же не определены окончательно и требуют уточнения и коррекции (Олюшин В. Е. с соавт.,2012).
Сегодня стало очевидно, что эффективность противоопухолевых вакцин может быть обеспечена при воссоздании «индивидуального портрета» опухоли, что дает возможность формирования прицельного усиленного искусственного иммунного ответа против ее онкоантигенов. Создание персонифицированных и индивидуализированных по иммуногистофенотипу опухоли противоопухолевых вакцин и ЦТЛ стало первым шагом к повышению точности и предиктивности противоопухолевой ИТ.
Другим шагом и новым фундаментальным направлением высокотехнологичной прицельной и высокоточной ИТ является разработка и создание комбинации молекулярнонацеленных онкоиммунных препаратов для лечения ЗНО в комбинации с молекулярнонацеленными (таргетными) химиотерапевтическими препаратами. Первые появились значительно позднее таргетных химиотерапевтических препаратов, но их место в современной противоопухолевой терапии более значимо и более фундаментально. Основная современная зарубежная фармакологическая индустрия противоопухолевых средств сегодня ориентирована как на ИТ, так и на таргетную терапию ОК. Разработка и создание современных противоопухолевых препаратов преимущественно направлено на молекулярнонаправленное воздействие на цели и мишени в ОК, имитируя лекарственными средствами «цитотоксическое» или «регуляторное» воздействие отдельных молекул той или иной эффекторной клетки микроокружения ОК или иммунной системы на ОК пациента. Мишенями для таргетных и онкоиммунопрепаратов являются самые различные молекулы онкоспецифических белков в ОК. Обращает на себя внимание то, что таргетные противоопухолевые фармакологические препараты, имитируют или «подражают» молекулярнонацеленным элиминационным или регуляторным межклеточным воздействиям клеток микроокружения в опухоли, а онкоиммунные препараты «подражают» молекулярным воздействиям различных эффекторных киллерных клеток иммунной системы. Другими словами, химиотерапевтические таргетные препараты осуществляют непосредственное регуляторное воздействие на мишени и цели внутри клетки, а таргетные онкоиммунные препараты имитируют противоопухолевые действия определенных молекул эффекторных клеток иммунной системы человека преимущественно на поверхности ОК. Но в целом, все варианты таргетного воздействия, как химиотерапевтического, так и онкоиммунного влияния молекул этих препаратов на ОК — это нацеленные цитотоксические воздействия разных искусственно созданных молекул на различные структуры и элементы ОК. В норме большинства молекул МКАТ и биологически активных веществ, применяемых для таргетного лечения опухолей в организме человека нет. Лиганды в виде молекул МКАТ и молекулярные комплексы, синтезируемые из биологически активных веществ, получаемых из водорослей, морских и экзотических животных являются достаточно агрессивными для многих акцепторных белков в клетках человека. Поэтому, несмотря на их высокую точность воздействия на цели в ОК, они не являются безопасными и для других клеток организма человека. Представления об их полной безвредности для онкологического пациента не обоснованы. Спектр возможных и малокурабельных осложнений от их клинического применения способен перекрыть все их достоинства и стать основной причиной смерти онкологического пациента.
Несомненно, что в современной фармакологической индустрии создание таких новых таргетных иммуноонкологических препаратов основано на глубоком изучении и молекулярном анализе пострадавших в канцерогенезе путей внутриклеточной сигнальной трансдукции (ПВКСТ) в ОК при разных нозологиях рака и ЗНО. Поэтому фарминдустрия постоянно направлена на выявление новых целей (акцепторных белков) на мембране ОК и ОСК или белков в структуре ПВКСТ, воздействие на которые позволит блокировать или активировать конкретные ПВКСТ с целью запустить или остановить определенные эффекторные функции этих клеток (апоптоз, пролиферация, митоз, инвазивность и т.д.). Высокоточное попадание молекул белков-лигандов, а также лигандов в виде молекул моноклональных антител (МКАТ) или микроРНК, как базовых элементов таргетного иммунного препарата, в акцепторные белки-мишени ПВКСТ, расположенные на мембране ОК позволяет максимально эффективно управлять эффекторными функциями ОК и достигать выраженного, но достаточно кратковременного (1 или 2 недели) клинического эффекта лечения неопластической болезни. Большинство современных противоопухолевых фармакологических таргетных препаратов основано на конкретных молекулах МКАТ, запатентованных и выведенных на рынок ведущими мировыми фармакологическими компаниями и глобальными фармакологическими корпорациями. Поэтому использование онкоиммунных препаратов в онкологической клинической практике требует постоянного их введения для поддержания рабочей концентрации в организме ракового больного.
Разобраться в хитросплетениях показаний и обоснованности назначений современной таргетной онкоиммунной терапии и химиотерапевтической молекулярнонацеленной (таргетной) терапии рака и других ЗНО очень не просто. Это связано с тем, что онкоиммунные противоопухолевые таргетные препараты и химиотерапевтические противоопухолевые, молекулярнонацеленные на пути внутриклеточной сигнальной трансдукции (таргетные), фармацевтические препараты действуют на разные цели и мишени в ОК, но в то же время имеют общий цитотоксический механизм противоопухолевого действия. Онкоиммунные таргетные препараты моделируют межклеточный цитотоксический эффект иммунокомпетентных клеток человека, а таргетные противоопухолевые препараты моделируют системные и локальные биологические эффекты эффекторных функций внутриклеточной цитотоксической регуляции и клеточного управления. Существует ряд методологических и экспериментальных подходов к выбору мишеней в ОК для таргетной ХТ злокачественных опухолей у человека. Проиллюстрируем основные известные мишени ХТ в ОК на примере одной из самых фатальных опухолей диагностируемых у человека — мультиформной глиобластомы (МГБ) головного мозга (ГМ). В фундаментальном руководстве по нейроонкологии «Principles of Neuro-Oncology», вышедшем в 2005г. в США под редакцией David Schiff и Brian Patrick O’Neill и переизданном в 2014 году, впервые были представлены основные принципы применения и практические подходы к лекарственной таргетной терапии опухолей мозга, исходя из основных стандартных, так и новых представлений о генезе опухоли в свете последних открытий в области молекулярной генетики, исследований путей трансдукции сигнала, которыми в основе своей управляется рост злокачественных глиом и МГБ. Основными мишенями для современной лекарственной терапии опухолей сегодня рассматриваются: 1. Рецепторы факторов роста клеточной поверхности и направленное воздействие (таргетинг) на рецепторы фактора роста; 2. Нейтрализация антител к EGFR; 3. Фармакологические ингибиторы EGFR и ингибиторы рецептора фактора роста тромбоцитов; 4. Применение внутриклеточных компонентов вторичного мессенджера; 5. Воздействие на Ras ингибиторами фарнезилтранферазы; 6. Ингибиторы протеинкиназы С; 7. Препараты, напрямую воздействующие на ДНК или же процесс ее репликации; 8. Алкилирующие вещества; 9. Ингибиторы клеточного цикла; 10. Фармакологическая терапия, воздействующая на контрольной точке G1/S клеточного цикла; 11. Генная терапия, направленная на укрепление барьера G1/S; 12. Протеиназы и интегрины как медиаторы инвазивности опухоли; 13. Эффекторные молекулы целенаправленного воздействия на протеинкиназы, интегрины, медиаторы ангиогенеза; 14. Способы повышения эффективности таргетинга препаратов в опухоль; 15.Доставка в опухоль большего количества препарата: вещества, повышающего проницаемость гематоэнцефалического барьера; 16. Химиотерапия, проводимая непосредственно в паренхиму головного мозга: интерстициальная терапия; 17. Лучшее распределение лекарственного вещества по мозгу: конвекционный подход; 18. Функциональный таргетинг лекарственного средства в опухолевую клетку.
Расширение познаний в области молекулярной биологии злокачественных опухолей позволило уже сегодня создать новые вещества, ориентированные на основные известные и новые мишени в ОК и ОСК. Высокоточное попадание молекул онкоиммунных таргетных фармакологических средств в виде моноклональных антител (МКАТ) или микроРНК (мРНК), обеспечивает высокоточное поражение цели в виде акцепторных мембранных белков ПВКСТ на поверхности ОК, позволяет максимально эффективно управлять эффекторными функциями ОК и достигать выраженного клинического эффекта цитотоксического подавления неопластического процесса ЗНО. Большинство современных противоопухолевых онкоиммунных таргетных препаратов основано на конкретных молекулах МКАТ и микроРНК, запатентованных и выведенных на рынок ведущими мировыми фармакологическими компаниями и глобальными фармакологическими корпорациями.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
