
Бесплатный фрагмент - Окислительно-восстановительные реакции в органической химии
Подготовка к ЕГЭ
Предисловие
Приступая к работе над этим пособием, я руководствовалась необходимостью внести ясность в понимание сложных для учащихся окислительно — восстановительных реакций в органической химии. Типы и содержание заданий, представленные в данной книге, соотнесены с актуальными на момент сдачи в печать этого небольшого пособия с демонстрационным вариантом и спецификацией ЕГЭ, а также с пособиями, выпущенными ФИПИ. Материал, изложенный ниже, основан, в первую очередь, на наиболее часто встречающихся окислительно-восстановительных реакций в заданиях второй части (вопрос 38) КИМ.
Уравнения, рассмотренные мною, записаны с электронным балансом, рассмотрены с точки зрения окисления- восстановления.
Эта книга предназначена для активного обучения и подготовки к выполнению заданий повышенной сложности, написана с целью оказать помощь как ученикам, так и учителям.
ЖЕЛАЮ УДАЧИ!
Окислители в органической химии
Для окисления веществ в органической химии используют многие соединения (соединения переходных металлов, кислород, озон, перекиси, соединения серы, селена, галогенов, азота и многие другие). В данной работе я уделила внимание, в первую очередь, таким окислителям, как перманганат калия и бихромат аммония.
При окислении органических веществ хром (VI) в любой среде восстанавливается до хрома (III), однако, окисление в щелочной среде в органической химии не находит практического применения.
Перманганат калия в разных средах проявляет себя как сильный окислитель, но его сила увеличивается в кислой среде.
Гидроксид меди (II) обычно используется для окисления альдегидов. Реакция проводится при нагревании, при этом гидроксид меди (II) ярко голубого цвета превращается сначала в гидроксид меди (I) желтого цвета, который затем разлагается до красного оксида меди (I). В качестве окислителя альдегидов также применяют аммиачный раствор гидроксида серебра реакция серебряного зеркала.
Классы органических веществ и окисление

Часть 1. Окисление алканов
В ЕГЭ пишем — алканы не окисляются!!!
При обычных условиях (комнатной температуре) алканы не окисляются даже сильными окислителями, например такими, как перманганат и дихромат калия. При нагревании до 2000 С в присутствии катализатора (чаще всего соединений марганца) происходит окисление и,в зависимости от условий, образуются спирты, кетоны, альдегиды, карбоновые кислоты. В реакцию вступают наиболее реакционноспособные вторичные или третичные связи С-Н.
СН3- СН (СН3) -СН3кат, О2→ СН3- (СН3) С (ОН) -СН3 (2-метил-пропанол-2)
СН3- СН2-СН2-СН3кат, О2→ Н2О + СН3- СО-СН2-СН3 (бутанон-2)
R- СН2-СН2- Rкат, О2→ R- СООН + R1- СООН
5С10Н14 +24KMn+7O4 +36H2SO4 →
→ 5С6Н5С+3ООН+10CO2+12K2SO4 +24 Mn+2SO4 +56 H2O
При неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту:
СН3- СН2-СН2-СН3 +3О2 кат, О2→ 2СН3- СООН +2Н2О
Горение алканов приводит к образованию СО2 и Н2О и сопровождается выделением большого количества теплоты (экзотермическая реакция).
Например: СН4 +2О2 → СО2 +2Н2О +880 кДж
Высшие алканы (n> 25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12-С18
Кислорода, содержащегося в воздухе, может оказаться недостаточно при горении высших алканов для их полного окисления до СО2. Тогда образуются продукты частичного окисления: СО или С и вода. Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Примечание:
первичные атомы углерода имеют степень окисления -3;
вторичные атомы углерода имеют степень окисления -2;
третичные атомы углерода имеют степень окисления -1;
четвертичные атомы углерода имеют степень окисления -0;
Часть 2. Окисление алкенов
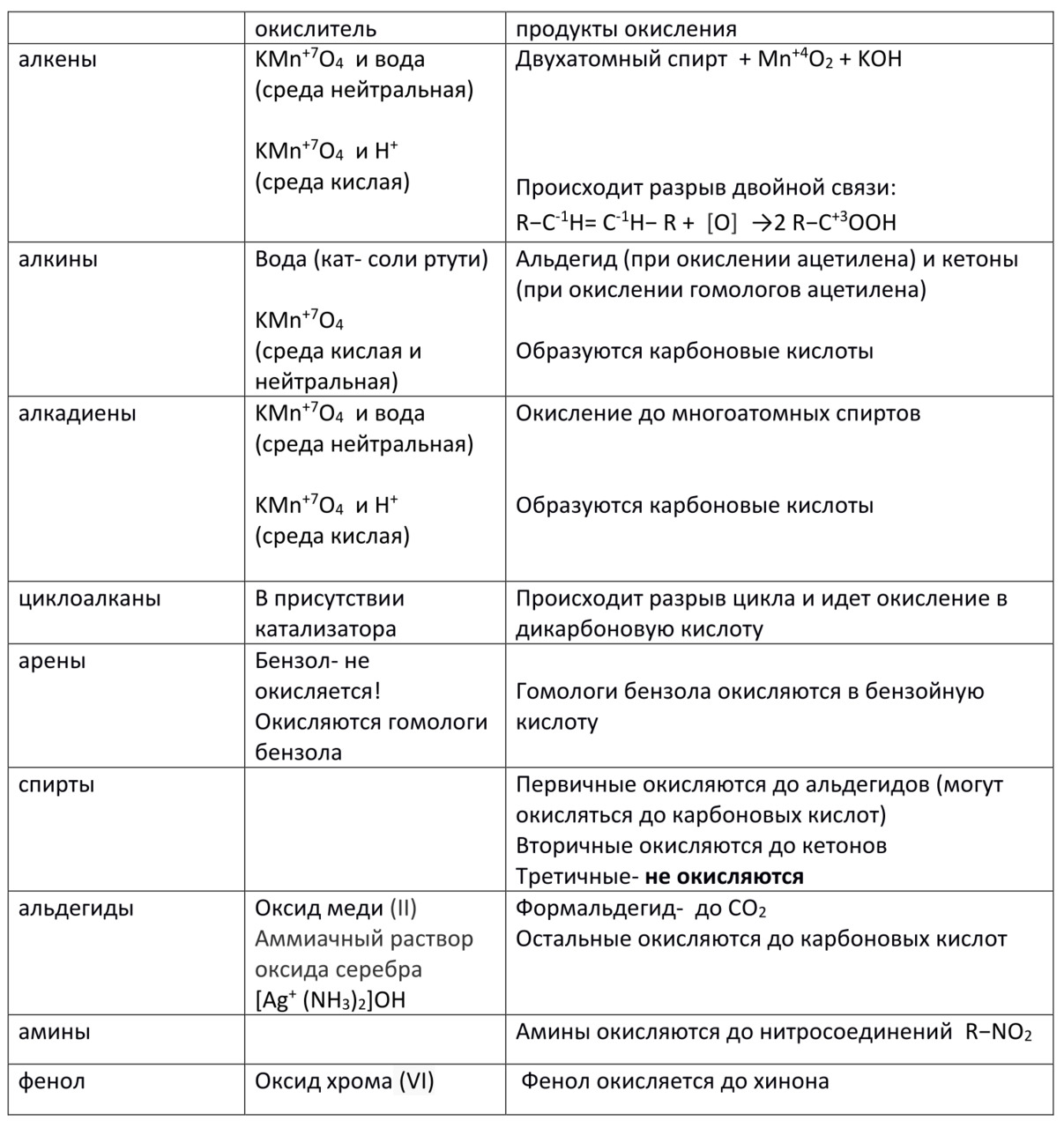
1. При мягком окислении (нейтральная или слабощелочная среда) алкены превращаются в двухатомные спирты. Восстановителями служат атомы углерода, между которыми двойная связь.
Реакции протекают следующим образом:
Этен
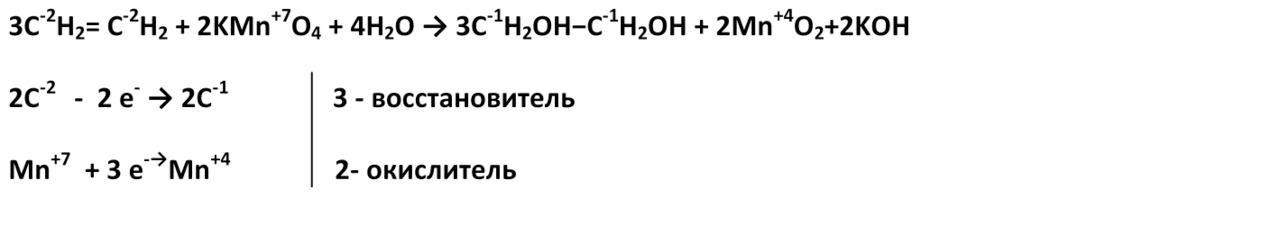
Окисление пероксидом водорода
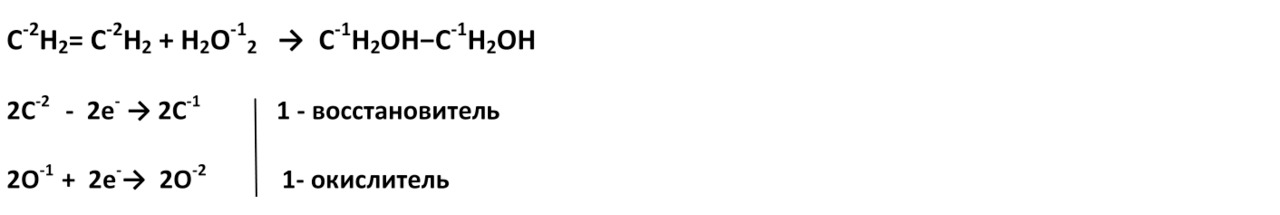
Пропен
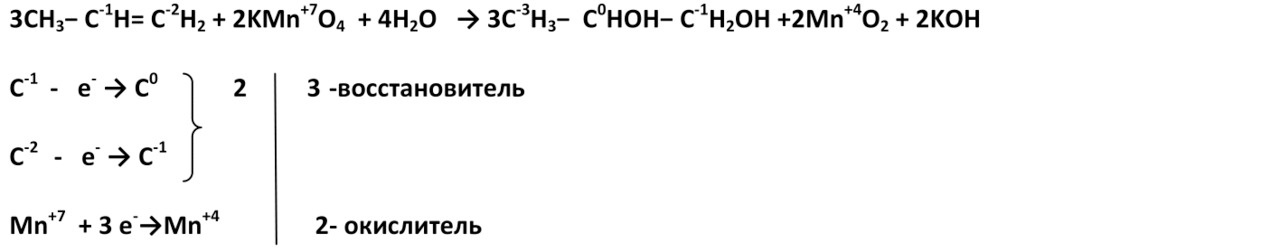
2,3-диметилбутен-2
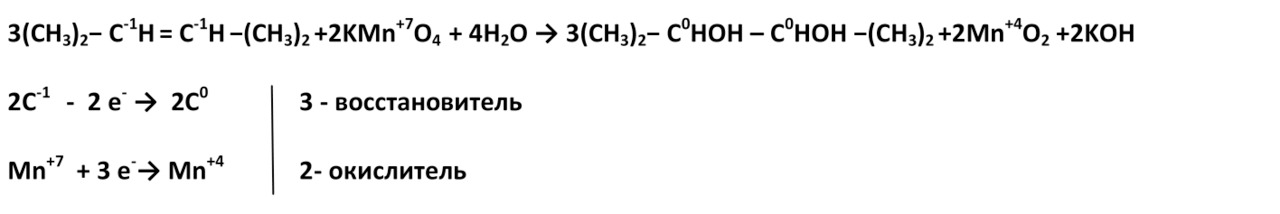
Окисление циклогексена
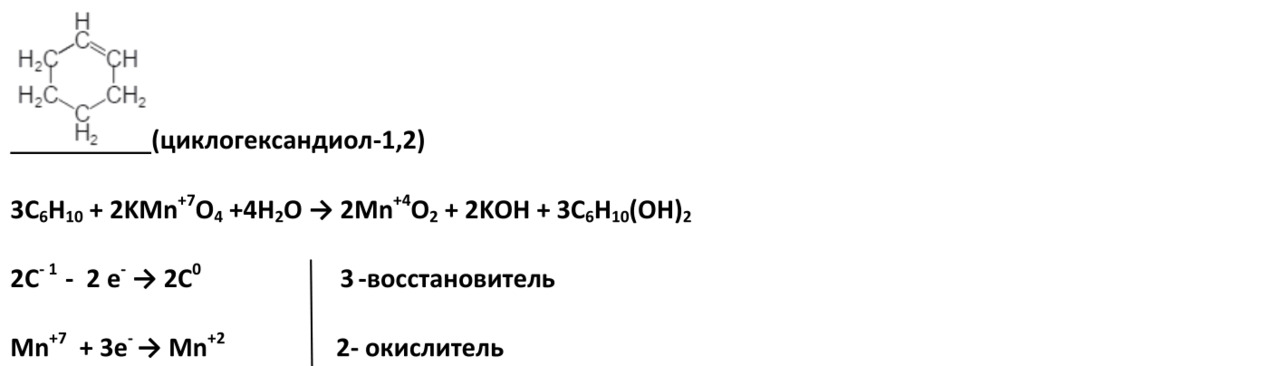
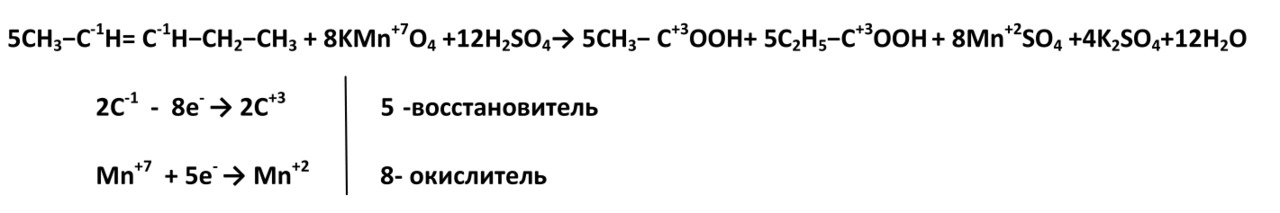
2. В жестких условиях (кислая среда) при окислении разрывается углеродная цепь по двойной связи, при этом образуются две кислоты или кислота и углекислый газ.
Пропен
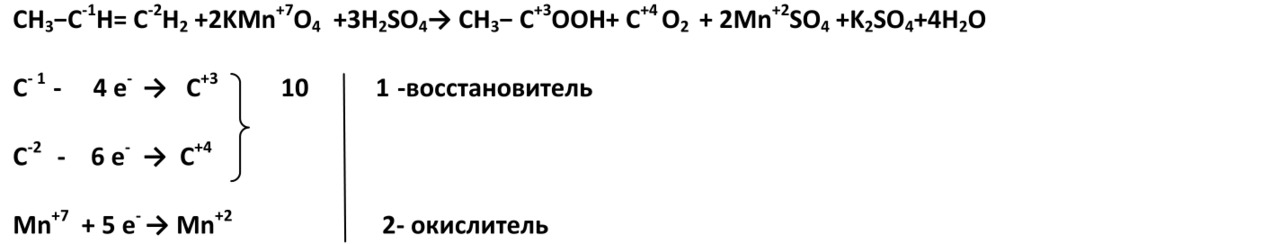
2-метил-пропен
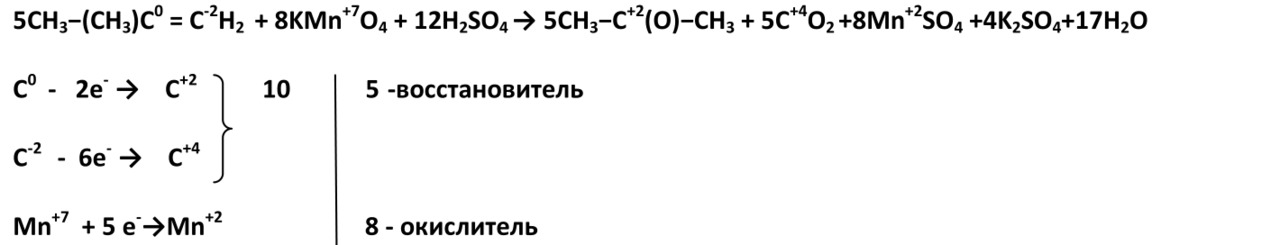
(Пентен-2)
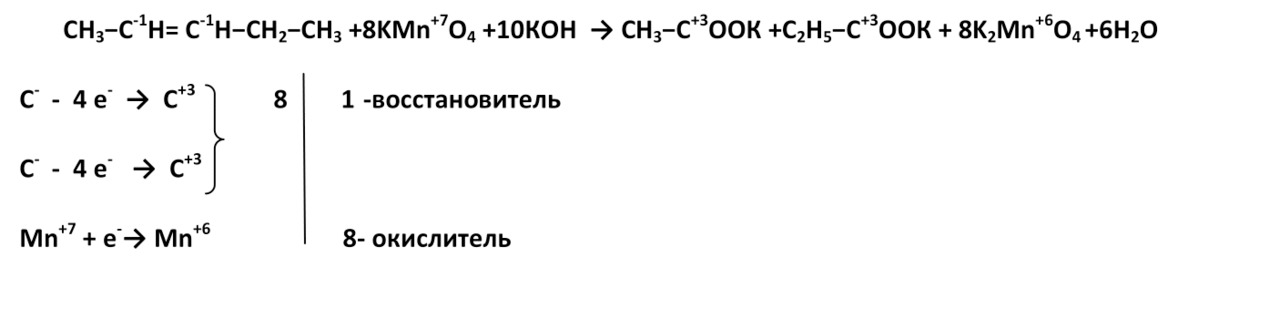
3. В жестких условиях (сильнощелочная среда) при окислении также разрывается углеродная цепь по двойной связи, при этом образуются соль карбоновой кислоты и карбонат.
Пропен
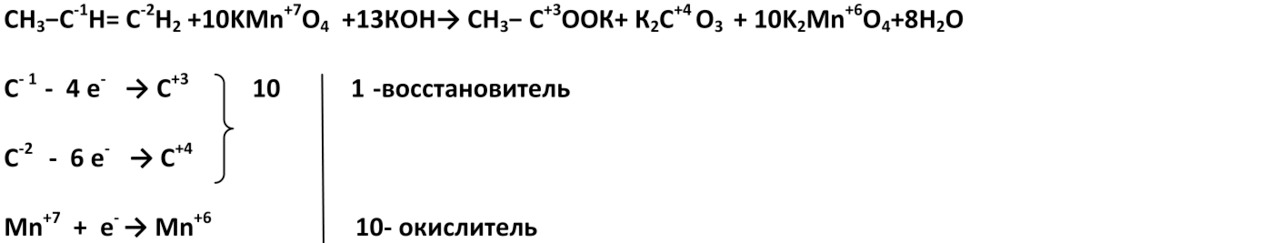
(Пентен-2)
Часть 3. Окисление алкинов
Алкины окисляются в более жестких условиях, чем алкены, при окислении разрывается углеродная цепь по тройной связи, при этом образуются кислоты и углекислый газ. Продукты реакции зависят от условий проведения реакций и природы окислителя. Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их непредельность. Происходит при этом мягкое окисление без разрыва сигма С-С связи. Так получается щавелевая кислота.
1. Нейтральная среда
Этин
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
