
Бесплатный фрагмент - Мерцающий артефакт в ультразвуковой медицинской диагностике
Монография
ПРЕДИСЛОВИЕ
Представляемая вниманию читателя книга Д. В. Леонова, Н. С. Кульберга и А. И. Громова посвящена интересному и весьма полезному для практики методу ультразвукового обнаружения твердотельных включений в тканях организма, таких как почечные камни и кальцинаты. В ультразвуковой диагностике часто возникают особенности изображений, не имеющие отношения к реальным анатомическим структурам или процессам. Они называются артефактами. Среди них отдельного внимания заслуживает артефакт мерцания, возникающий при ультразвуковом исследовании (УЗИ) в доплеровском режиме.
Исследование артефакта мерцания началось более четверти века назад, однако механизмы его возникновения долгое время оставались непонятными. Выяснение первопричин загадочных эффектов всегда возбуждает живой интерес, и благодаря одному из авторов этой книги мне выпал шанс поближе познакомиться с данной загадкой. История была такая: примерно в 2005 году со мной по телефону связался А. И. Громов, на тот момент заведующий отделением ультразвуковой диагностики Центрального военного клинического госпиталя имени П. В. Мандрыка. Александр Игоревич рассказал о загадочном артефакте, который он обнаружил при трансректальном ультразвуковом исследовании предстательной железы: в доплеровском режиме твердотельные включения, если они там присутствовали, иногда почему-то сопровождались мерцающими пятнами, напоминающими разноцветную переливающуюся мозаику. Поскольку это был доплеровский режим, то появление цвета вроде бы свидетельствовало о движении, а мерцание — о том, что движение это было хаотическим. А. И. Громов в соавторстве с А. Ю. Васильевым описали этот необычный цветовой артефакт в 1997 году в статье Военно-медицинского журнала [1]. Чуть позже выяснилось, что за год до первой журнальной публикации А. И. Громова такой эффект уже был замечен и описан зарубежными авторами [2]. Но Александр Игоревич, не зная об этом, продолжал активно изучать обнаруженный им артефакт мерцания. Возникновение мерцания во многих случаях позволяло обнаружить камни, которые в обычном B-режиме были не видны. Полученные результаты оказались настолько впечатляющими, что, когда в 2002 году А. И. Громов и Б. И. Зыкин представили их для публикации в журнале «Эхография» [3], главный редактор даже предложил назвать артефакт мерцания «эффектом Громова-Зыкина».
Должен признаться, что описанный А. И. Громовым артефакт меня очень заинтриговал, и я пригласил Александра Игоревича на физфак МГУ. То, что он мне рассказал при нашей первой встрече, показалось довольно запутанным: не все камни мерцали, степень проявления артефакта по какой-то причине зависела от химического состава камня и от степени его шероховатости. К тому времени в литературе уже появились объяснения, которые были умозрительными, поскольку все используемые тогда коммерческие УЗИ-сканеры являлись закрытыми системами, и менять в них что-то было невозможно, кроме амплитуды импульсов и частоты.
Одно объяснение исследуемого артефакта было таким: мерцание — это шум электроники в виде дрожания сигнала (jitter), вызванный тем, что отраженные от камня сигналы были настолько сильны, что насыщали диоды в приемном тракте, из-за чего возникали флуктуации. Другие авторы утверждали, что причиной возникновения артефакта являются нестационарные спеклы, образующиеся из-за шероховатости рассеивателей. Почему нестационарные — понять было трудно, однако такое объяснение коррелировало с тем, что более шероховатые камни мерцали сильнее. Все эти объяснения казались неубедительными. Я решил, что все быстро объясню тем, что доплеровские импульсы оказывают радиационное давление на камни, и те начинают двигаться пульсирующим образом, возможно, слегка поворачиваясь. Такой механизм казался вполне реальным, поскольку в доплеровском режиме посылается пачка из 10–15 импульсов довольно высокой амплитуды. К тому времени у меня уже был опыт конечно-разностного моделирования распространения акустических импульсов в присутствии почечных камней. С использованием данного подхода было рассчитано рассеянное поле, а по нему вычислен тензор радиационных напряжений на поверхности, окружающей камень. Интегрируя тензор, я рассчитал радиационную силу, а из нее — скорость смещения камня. На это исследование ушло несколько лет, были сделаны доклады на конференциях, в том числе в соавторстве с А. И. Громовым [4]. Результат оказался, по большому счету, отрицательным: миллиметровые и меньшие по размеру камни могли в принципе смещаться так, чтобы наблюдаемый доплеровский сдвиг возникал, но более крупные камни точно не могли приводить к мерцанию из-за движения под действием радиационной силы. Загадка так и оставалась не до конца разгаданной.
После этого в исследованиях артефакта мерцания наступило затишье на несколько лет. Однако появилась открытая система УЗИ «Верасоникс», в которой можно иметь доступ ко всем «сырым», исходным эхосигналам и излучать различные сигналы. Компания с одноименным названием базирутся в Сиэтле, и поэтому мои коллеги из Вашингтонского университета (University of Washington) одними из первых приобрели такую систему. Поскольку радиационная сила не смогла объяснить загадочный эффект мерцания, следующими в моем «списке подозреваемых» были пузыри. Но многие из моих коллег, кому я рассказывал про необычный артефакт, выражали сомнения: «какие пузыри в почке, это же диагностические импульсы, механический индекс находится в пределах докавитационых уровней» и т. п. В это время в американской лаборатории, с которой я сотрудничал, появился новый аспирант (W. Lu), и ему была поставлена задача проверки возможных механизмов артефакта мерцания с использованием «Верасоникса». Сначала мы придумали, как можно проверить механизм дрожания (jitter) в электронном канале. Поскольку система «Верасоникс» — открытая, мы записали сигнал напряжения на выходе из диагностического датчика перед тем, как он попадал в электронный тракт системы УЗИ. После этого мы синтезировали точно такой же сигнал на генераторе сигналов и сформировали ансамбль в виде периодической последовательности, состоящей из нескольких идентичных импульсов.
Как работает система УЗИ в доплеровском режиме? Посылается ансамбль одинаковых импульсов с жестко установленным периодом следования, и регистрируется соответствующий ансамбль эхосигналов. Если эхосигналы в ансамбле одинаковы, и период их следования не отличается от исходного, то рассеиватель неподвижен. Если же сигналы отличаются, например, они сдвигаются во времени, то есть движение, скорость которого вычисляется по анализу сигналов. Если движения нет, но эхоимпульсы различны, то причиной могут быть флуктуации в электронном тракте. Мы подали на вход электронного тракта ансамбль из одинаковых сигналов точно такой же амплитуды, как при визуализации реальных почечных камней, и оказалось, что после прохождения электронного тракта они остались абсолютно одинаковыми. Тем самым этот эксперимент показал, что объяснение, приписывающее причину артефакта нестабильному поведению электронного тракта, было ошибочным.
А как тогда доказать, что пузыри могут быть причиной? Визуально ничего не видно, даже под микроскопом и с использованием скоростной камеры. Пузырьковый механизм может быть таким: в расщелинах микронного и субмикронного размера на поверхности камня расположены зародыши пузырей. Это похоже на то, что первым описал Е. Н. Харви [5] в связи с объяснением механизма стабилизации кавитационных зародышей на малых частичках. Однако идея переносить эту возможность на камни, облучаемые диагностическими импульсами «безопасного уровня», никого до этого не посещала. Первое, что мы сделали — посмотрели на неодинаковость эхоимпульсов в доплеровском ансамбле. Они действительно оказались разными. Отличие было слабое, но регистрируемое, и имело флуктуирующий характер, т.е. пузырьки все же могли это объяснить. Чтобы развеять наши сомнения, мы сконструировали камеру повышенного давления, куда помещался почечный камень. Одна из стенок камеры была сделана из толстого звукопрозрачного пластика, так что можно было получать УЗ-изображения, помещая УЗ-датчик снаружи. Благодаря этому нам удалось довольно четко показать, что камни мерцали при нормальном давлении и переставали мерцать при повышении давления выше уровня, соответствующего отрицательному давлению фазы разрежения в доплеровском импульсе. Поскольку ничто, кроме пузырей, не могло так «выключаться» при повышении статического давления, то пузырьковый механизм возникновения артефакта мерцания был доказан.
После этого мы опубликовали несколько работ, направленных на дальнейшее развитие и использование этого механизма. В частности, в моей статье в соавторстве с Т. Д. Хохловой на основе пузырькового механизма артефакта мерцания был предложен сверхчувствительный метод регистрации пузырьков. В статье с еще одной аспиранткой Вашингтонского университета (J. C. Simon) нам удалось доказать наличие зародышей микропузырьков на поверхности камня путем подачи на камень импульсов разрежения от литотриптера. Скоростная видеокамера показала, как из неровностей поверхности вырастали пузырьки несмотря на то, что камень находился в хорошо дегазированной воде. Также стало ясным, почему химический состав камня может влиять на артефакт мерцания — причина была в том, что газообразование зависит от химии поверхности. Пузырьковый механизм объясняет и усиления артефакта при наличии шероховатостей, т.к. неровности поверхности являются местами, в которых стабилизируются зародыши кавитации.
Энтузиазм и уверенность опытного врача-клинициста А. И. Громова в практической важности использования артефакта мерцания вдохновили и Д. В. Леонова, и Н. С. Кульберга. В результате их многолетних исследований появилась настоящая книга, которая безусловно будет полезна практикующим врачам, использующим УЗИ, разработчикам ультразвуковой техники и студентам, изучающим применение ультразвука в медицине.
Доктор физико-математических наук,
профессор физического факультета МГУ имени М. В. Ломоносова
О. А. Сапожников
ОБ АВТОРАХ И РЕЦЕНЗЕНТАХ
Авторы:
Д. В. Леонов — кандидат технических наук, старший научный сотрудник ГБУЗ «НПКЦ ДиТ ДЗМ», НИУ «МЭИ»
Н. С. Кульберг — кандидат физико-математических наук, старший научный сотрудник ФИЦ ИУ РАН
А. И. Громов — доктор медицинских наук, профессор ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России
Рецензенты:
Н. Н. Ветшева — доктор медицинских наук, заместитель заведующего учебным центром ГБУЗ «НПКЦ ДиТ ДЗМ»
Г. К. Григорьев — кандидат медицинских наук, врач ультразвуковой диагностики Медико-оздоровительного центра МГТС
И. Ю. Демин — кандидат физико-математических наук, доцент ННГУ им. Н. И. Лобачевского
Л. В. Осипов– доктор технических наук, профессор МГТУ им. Н. Э. Баумана, генеральный директор ООО «ПКФ „ИзоМед“»
В. И. Сурков — кандидат технических наук, доцент НИУ «МЭИ»
ОБОЗНАЧЕНИЯ, СОКРАЩЕНИЯ, ОПРЕДЕЛЕНИЯ
Aliasing — наложение спектров, искажение информации о скорости и направлении кровотока в доплеровских режимах.
B-mode — основной режим двумерного сканирования (от англ. brightness).
B-gain — усиление сигналов формирования серошкального изображения.
Blooming artifact — окрашивание стенок сосудов и близлежащих тканей в режимах картирования, ложное расширение области кровотока.
B-mode — серошкальный режим.
Carrier frequency — несущая частота излучаемого сигнала.
C-gain — усиление доплеровских сигналов на карте кровотока.
Color-write priority — регулировка порогового значения маски прозрачности, испольлзуемой для наложения карты кровотока на серошкальное изображение.
Focus — глубина расположения фокуса передатчика.
Frame averaging — межкадровое усреднение.
PRF — частота повторения импульсов в пачке (pulse repetition frequency).
Sensitivity — чувствительность.
Smoothing — сглаживание.
Twinkling artifact — мерцающий артефакт.
Wall filter — фильтр колебаний стенок сосудов.
АРУ — автоматическая регулировка усиления.
МШУ — малошумящий усилитель.
ПУ — программируемый усилитель.
СКО — среднеквадратичное отклонение.
ТМВ — твердые минеральные включения.
УЗИ — ультразвуковое исследование.
ЦДК — цветовое доплеровское картирование (CFM).
ЭДК — энергетическое доплеровское картирование.
ВВЕДЕНИЕ
Ультразвуковая (УЗ) диагностика [6–9] является одним из основных видов диагностики заболеваний внутренних органов, мягких тканей и кровеносных сосудов. К ее достоинствам относятся высокая диагностическая эффективность, возможность получения УЗ-изображений в реальном масштабе времени, отсутствие вредной лучевой нагрузки на пациентов и врачей, возможность одновременно с получением УЗ-изображений оценивать скорость кровотока в кровеносных сосудах, возможность получения наглядных трехмерных изображений, относительно низкая стоимость ультразвуковых медицинских диагностических устройств и УЗ-обследований, минимальные требования к оборудованию помещений и др.
Медицинские УЗ диагностические приборы (сканеры) начали появляться и быстро развиваться с конца Второй мировой войны одновременно с началом интенсивного развития радиолокации и гидролокации. От эхоимпульсных одноканальных УЗ-приборов с аналоговой обработкой эхосигналов постепенно переходили к многоканальным с цифровой обработкой. Медицинские области использования этих приборов постоянно расширялись, и в настоящее время они охватывают все внутренние органы.
Современные УЗ-приборы — сложные аппаратно-программные комплексы. Данное направление бурно развивается: разрабатываются новые алгоритмы обработки эхосигналов, улучшается качество УЗ-изображений, создаются новые медицинские методики, появляется все больше фирм, выпускающих УЗ-сканеры с возможностью 4D-визуализации (4D-визуализация — это 3D-визуализация в реальном масштабе времени), снижается стоимость [10–18]. По мере развития микроэлектроники используется новая элементная база, увеличивается количество каналов обработки эхосигналов, совершенствуются существующие алгоритмы их обработки. Ежегодно регистрируются сотни патентов, публикуется большое количество научных статей, издаются новые монографии.
Каждый врач ежедневно сталкивается с необходимостью определить, насколько точно сонограмма передает характеристики исследуемых органов. Особенно усложняют понимание так называемые артефакты визуализации [19]. Их появление вызвано различными причинами: например, переотражением или преломлением ультразвуковой волны, значительной неоднородностью среды по затуханию, неверным выбором параметров сигнала и пр.
Понимание характерных признаков и физической сути артефактов ультразвуковой медицинской визуализации очень важно для правильной интерпретации результатов исследования и исключения диагностических ошибок. Разработчики относятся к артефактам, как правило, как к явлениям нежелательным и стараются он них избавиться. В частности, доплеровские артефакты могут существенно осложнить восприятие отображения сосудистого русла в режиме цветового и энергетического картирования кровотока (ЦДК и ЭДК) и привести к неверной оценке потоковых характеристик [19].
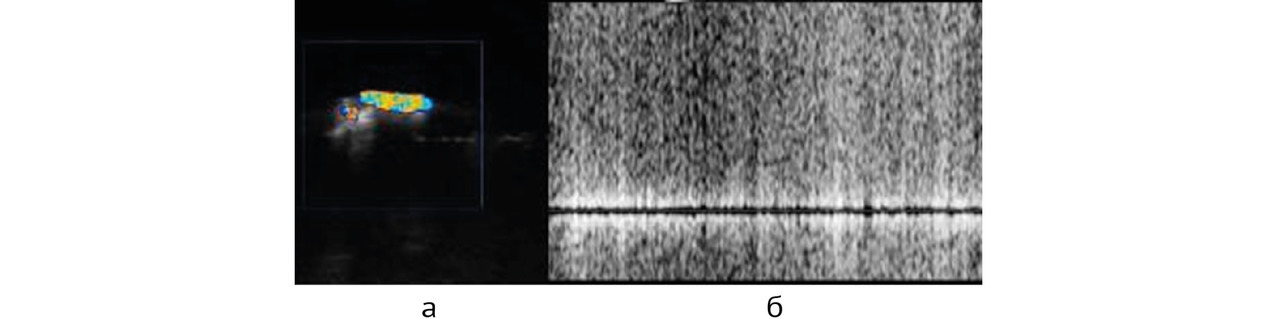
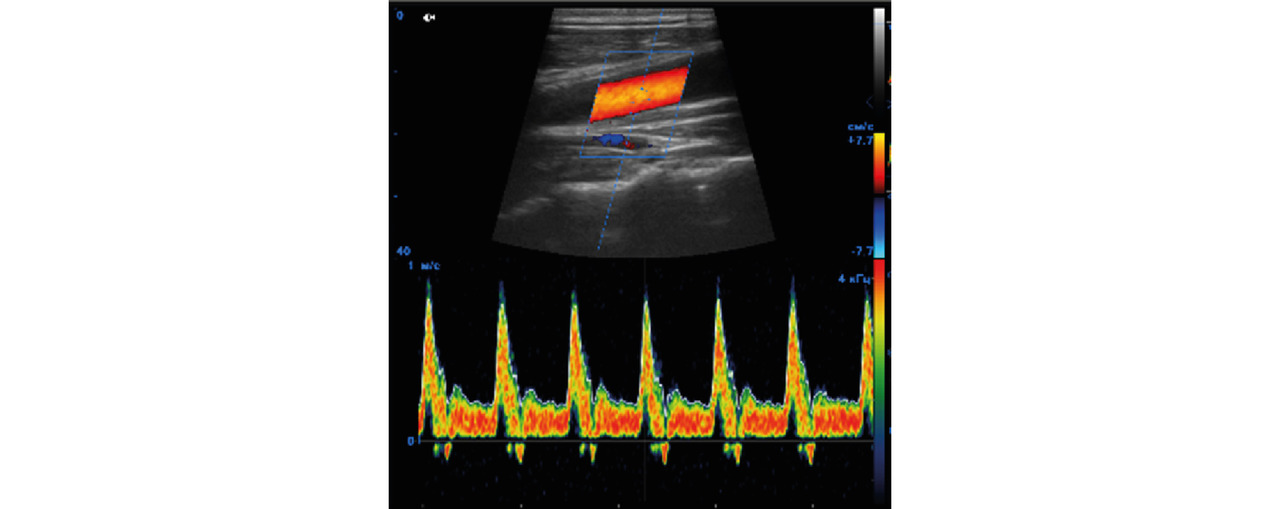
Но в некоторых случаях артефакты могут быть использованы в качестве дополнительного диагностического признака [20], в частности, именно это следует сказать про доплеровский мерцающий артефакт (англ. twinkling artifact) [21–29]. В режимах, связанных с цветовым картированием кровотока, он выглядит как скопление быстроменяющихся окрашенных пикселей (рис. 1 а), появляющееся в тех местах, где движение крови заведомо отсутствует. В спектральных режимах мерцающий артефакт приводит к возникновению широкого «белого» спектра (рис. 1 б); громкоговорители прибора при этом воспроизводят шум большой интенсивности.
Чаще всего данное явление наблюдается на почечных камнях, инородных телах (металлические скрепки, стенты и т.п.) и некоторых иных структурах [22, 30–37]. Все эти объекты значительно отличаются между собой по химическому составу, плотности, эхогенности и другим признакам. Общим для всех них является механическая жесткость, значительно большая, чем у окружающих их мягких тканей. Поэтому в данной работе они будут называться твердыми включениями.
Возможное использование мерцающего артефакта в целях диагностики требует от врача наличия определенных навыков: необходимо знать основные признаки и отличительные особенности артефакта, а также уметь настроить прибор для его наилучшей визуализации, причем для достижения оптимального результата следует не только статически анализировать доплеровскую картину, но и прогнозировать возможную реакцию артефакта на изменение настроек прибора. В заключительной части монографии приводятся практические рекомендации, с помощью которых можно достигнуть наилучшей визуализации мерцающего артефакта вне зависимости от модели ультразвукового аппарата.
Для правильной интерпретации диагностических изображений особенно важно понимать физические причины наблюдаемых явлений. Чтобы объяснить мерцающий артефакт, за четверть века, прошедшую с момента первого наблюдения, было предложено несколько разных, совсем не схожих между собою, гипотез. Разные гипотезы предполагают различные способы настройки прибора, позволяющие добиться как наилучшего проявления артефакта, так и его подавления. Встречающиеся в литературе противоречивые сведения могут вызвать затруднения у врача, породить недоверие к этому диагностическому признаку и тем самым снизить качество диагностики.
С целью прояснить ситуацию авторы в ходе подготовки рукописи провели самостоятельное лабораторное исследование по выявлению причин мерцающего артефакта [23, 30]. Исследовались первичные («сырые») радиочастотные сигналы из приемного доплеровского тракта ультразвукового аппарата. В результате удалось подтвердить два разных физических явления, приводящих к возникновению мерцающего артефакта. Оба этих явления дают сходную картину в режимах ЦДК и ЭДК, однако проявляются при различных условиях эксперимента. Для исследования мерцающего артефакта авторы использовали фантомы — искусственные объекты, моделирующие биологические ткани и органы. В отличие от реальных органов фантомы позволяли контролировать параметры среды распространения и характеристики исследуемых объектов.
Монография подготовлена в рамках научно-исследовательской работы «Совершенствование медико-технологических и клинических методов ультразвуковой диагностики» (№ ЕГИСУ: АААА-А20-120071090054-9) в соответствии с Программой Департамента здравоохранения города Москвы «Научное обеспечение столичного здравоохранения» на 2020—2022 годы.
Раздел I. УЛЬТРАЗВУКОВЫЕ МЕДИЦИНСКИЕ ДИАГНОСТИЧЕСКИЕ УСТРОЙСТВА
1.1. Основные узлы сканера
Для понимания сути мерцающего артефакта важно получить представление о принципе работы как всего ультразвукового медицинского диагностического устройства на системном уровне, так и о назначении, особенностях функционирования основных узлов сканера, а также об этапах обработки сигнала внутри прибора.
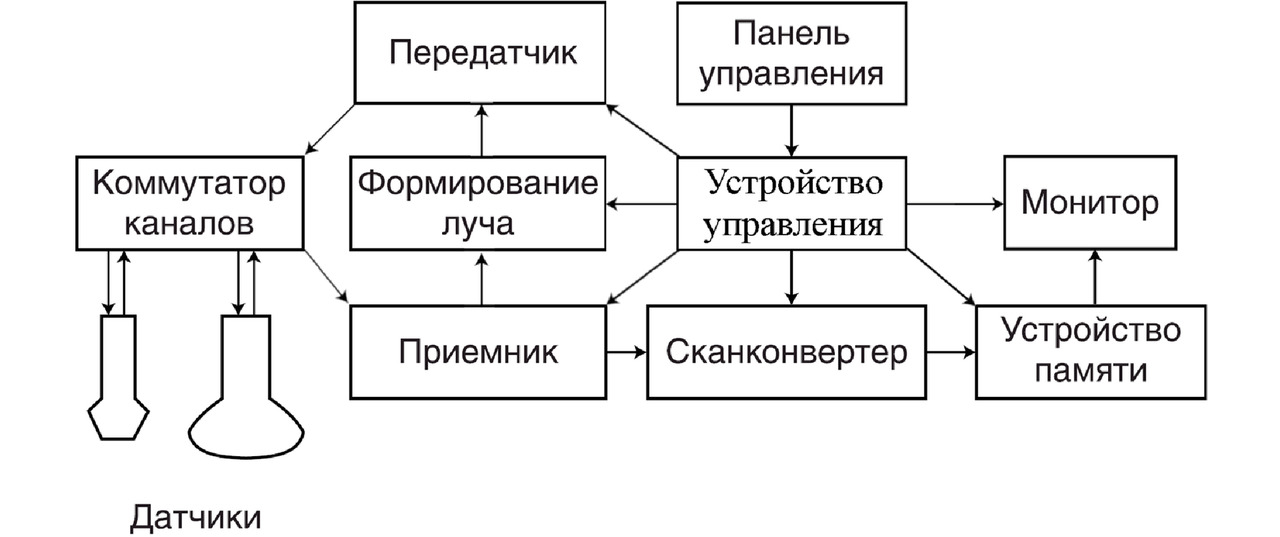
Как видно из схемы на рис. 2, на входе прибора стоит коммутатор, к которому подключаются датчики через специальные разъемы. Коммутатор обеспечивает переключение датчиков по командам с панели управления. Кроме того, он перемещает УЗ-луч в датчиках линейного и конвексного типов. Команды о необходимости такого перемещения поступают из устройства управления, которое также координирует работу формирователя луча, передатчика, приемника, сконконвертера, устройства памяти и монитора.
Применик и передатчик являются многоканальными устройствами, основная функция которых заключается в усилении сигналов по каждому из каналов. Они соединяются с формирователем луча, поканально расставляющем задержки для корректной фокусировки. В приемнике также выполняется квадратурная обработка, благодаря ей в дальнейшем можно рассчитать амплитуду и фазу принятого сигнала.
С приемника сигналы идут на сканконвертер, в котором осуществляется преобразование координат для наиболее наглядного представления данных на экране прибора. При использовании линейного датчика данные на экране представляются в декартовой системе кооридант, а данные с конвексного или секторного датчика преобразуются в полярные координаты. Кроме того, сканконвертер осуществляет интерполяцию данных на изображении так, чтобы оно воспринималось слитно, без пустот. Такие ситуации наиболее заметны при конвексном и фазированном сканировании на средних и больших глубинах, когда лучи расходятся достаточно далеко друг от друга. Пустым элементам приписываются амплитуды, вычисленные на основе известных амплитуд в соседних элементах с помощью алгоритмов интерполяции.
С выхода сканконвертера информация, подготовленная для отображения, поступает в цифровое устройство памяти, где записывается в том темпе, с которым происходит сканирование. С выхода устройства памяти информация считывается в темпе, необходимом для получения изображения на мониторе. Пользователь управляет работой прибора с помощью ручек, кнопок и сенсорного экрана, расположенных на панели управления.
Современные ультразвуковые сканеры (пример на рис. 3) содержат устройства ввода, монитор, динамики для спектрального доплеровского режима, разъем для датчиков. Могут присутствовать термопринтер, вход электрокардиографа, кассетные или дисковые приводы и пр. Многие современные сканеры рассчитаны на транспортировку в пределах больницы или поликлиники, хотя существуют также портативные сканеры, которые внешне похожи на ноутбук, и ультрапортативные устройства, пригодные для ношения в кармане [15]. На рис. 4 представлена схема с указанием основных узлов ультразвукового медицинского диагностического устройства, более детальная, чем та, что изображена на рис. 2. Далее рассмотрим каждый из основных узлов подробнее.
1.1.1. Датчики
Существуют различные типы датчиков (рис. 3), их выбор зависит от интересующего органа. Так, линейные датчики чаще всего используются для исследования поверхностных структур, конвексные — брюшной области, а секторные — сердца через межреберное пространство.
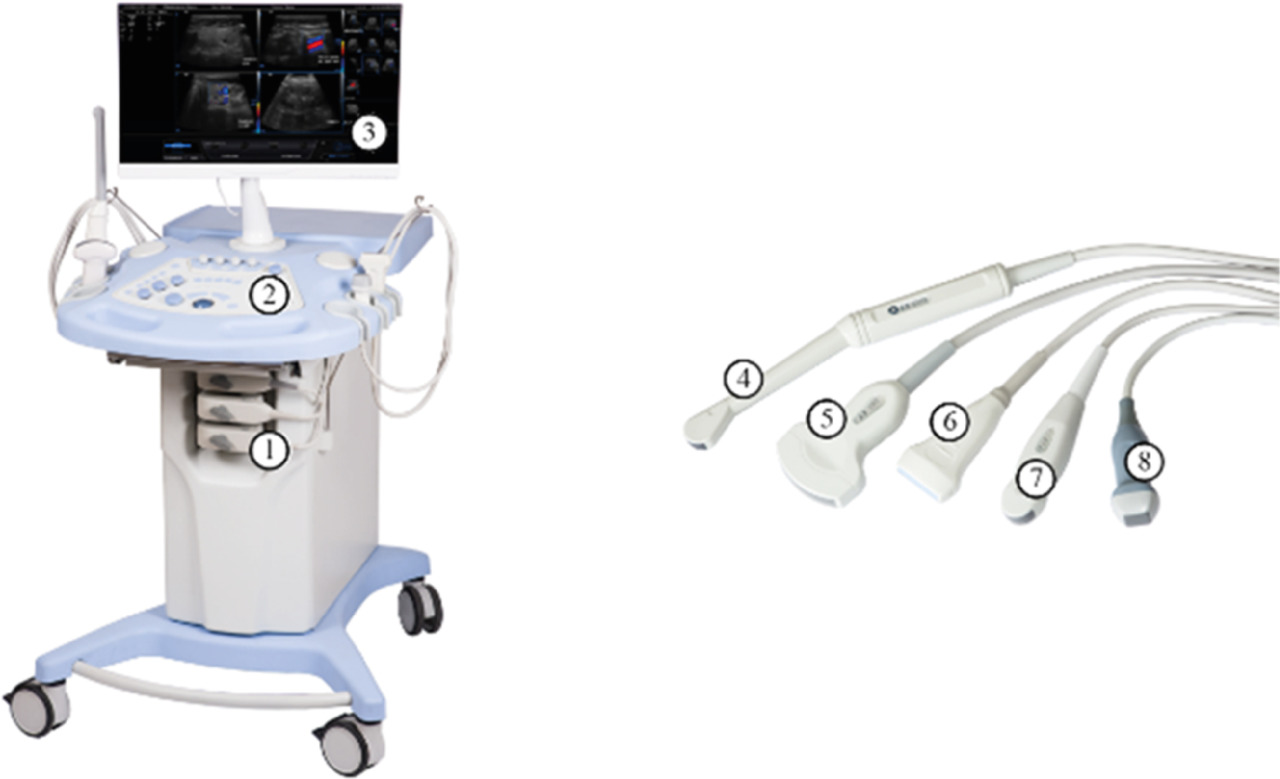
Также существуют внутриполостные датчики, предназначенные для исследования органов малого таза. Любой датчик состоит из набора пьезоэлементов, во время излучения преобразующих электрический сигнал в акустическое давление и обратно при приеме. Путем контроля возбуждения пьезоэлементов осуществляются фокусировка и борьба с боковыми лепестками диаграммы направленности [11, 39]. Датчик соединяется с прибором через кабель, число проводов в котором пропорционально числу элементов датчика. Кабель является источником значительного шума при приеме [40], поэтому его делают недлинным. Рост диаметра и массы кабеля с повышением числа элементов датчика является одной из причин, ограничивающих 3D-УЗИ.
1.1.2. Модуль приемопередачи
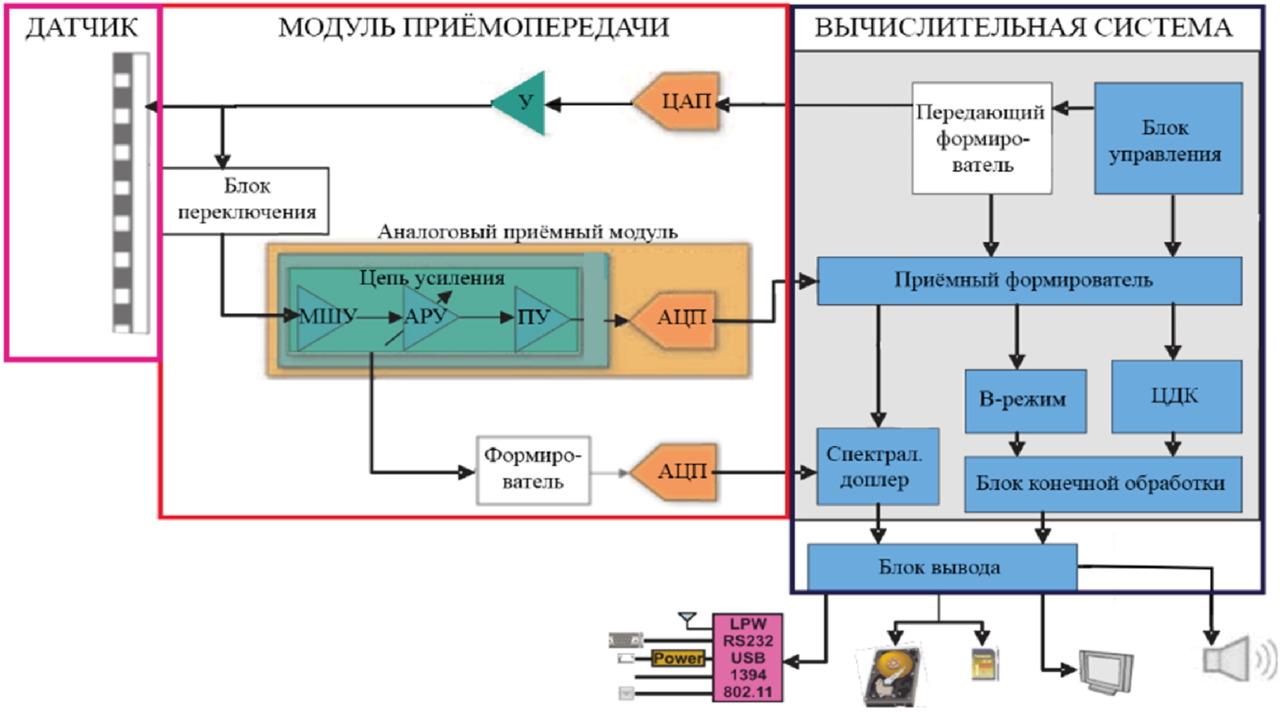
При поверхностном обследовании датчики работают на частотах от 1 до 15 МГц и на бóльших частотах — при обследовании внутри сосудов. С увеличением частоты растет разрешающая способность, но увеличивается и затухание примерно на 1дБ/см/МГц. Так, на частоте 10 МГц при отражении на глубине 5 см принятый сигнал будет отличаться от излученного на 5🞩2🞩10=100 дБ. С учетом мгновенного динамического диапазона в 60 дБ, определяемого логарифмом отношения регистрируемого сигнала без учета дисперсионных свойств среды распространения к величине шума, требуемый полный диапазон составит 160 дБ. Аналого-цифровые преобразователи с таким диапазоном не встречаются, поэтому на входе приемного тракта (рис. 4) ставятся малошумящий усилитель (МШУ) и блок частотно-временной автоматической регулировки усиления (АРУ) для уменьшения динамического диапазона путем компенсации дисперсионного затухания [41, 42].
Также в приемном тракте на рис. 4 присутствует программируемый усилитель (ПУ), коэффициентом усиления которого можно управлять при помощи регуляторов на панели прибора. В доплеровском режиме при обработке непрерывной волны применение временной компенсации невозможно из-за отсутствия разрешения по глубине, поэтому здесь используют аналоговый формирователь сигнала [43, 44]. В аналоговом формирователе выполняется демодуляция доплеровских частот, в результате чего создается комплексный сигнал, затем сигналы со всех каналов складываются в малошумящем сумматоре, при этом к каждому аналоговому каналу применяются до 16 переключаемых задержек. После сумматора сигнал поступает на полосовой фильтр, а затем оцифровывается.
1.1.3. Вычислительная система
1.1.3.1. Общие сведения
Вычислительная часть строится с использованием персонального компьютера и программируемых логических интегральных схем, специализированных интегральных схем, цифровых сигнальных процессоров или их комбинации. В передающем канале через формирователь сигнала задается форма излучаемого импульса и происходит расстановка задержек для фокусировки. На рис. 5 иллюстрируется расстановка задержек: большая кривизна (слева) смещает фокус ближе к датчику, а меньшая (справа) отдаляет его. Вместо того, чтобы возбуждаться одновременно, при фокусировке внешние элементы датчика возбуждаются несколько раньше, чем внутренние элементы. Это создает искривленный фронт волны, фокусирующийся в точке, определяемой задержками между элементами датчика. В фокусе луч наиболее узок, его ширина определяется по формуле:
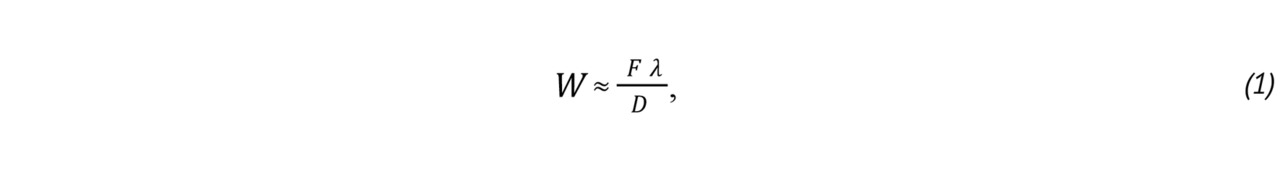
где F — расстояние от апертуры до фокальной позиции, λ — длина волны, D — ширина апертуры. С удалением от фокальной позиции луч расширяется, что означает ухудшение разрешающей способности. Для получения изображения наилучшего качества было бы правильным фокусироваться в каждую точку, но на это уходит слишком много времени, поэтому, как правило, используется одна или две фокальные глубины.
При излучении используется прямоугольная (рис. 6а) или гауссова огибающая с амплитудой порядка 100 вольт и длительностью в доли микросекунды для В-режима и единицы микросекунд для цветового доплеровского картирования. В приемном канале в формирователе выполняется пространственно-временная обработка, заключающаяся в согласованной фильтрации и когерентном сложении отсчетов сигнала, и квадратурная обработка.
1.1.3.2. Согласованная фильтрация
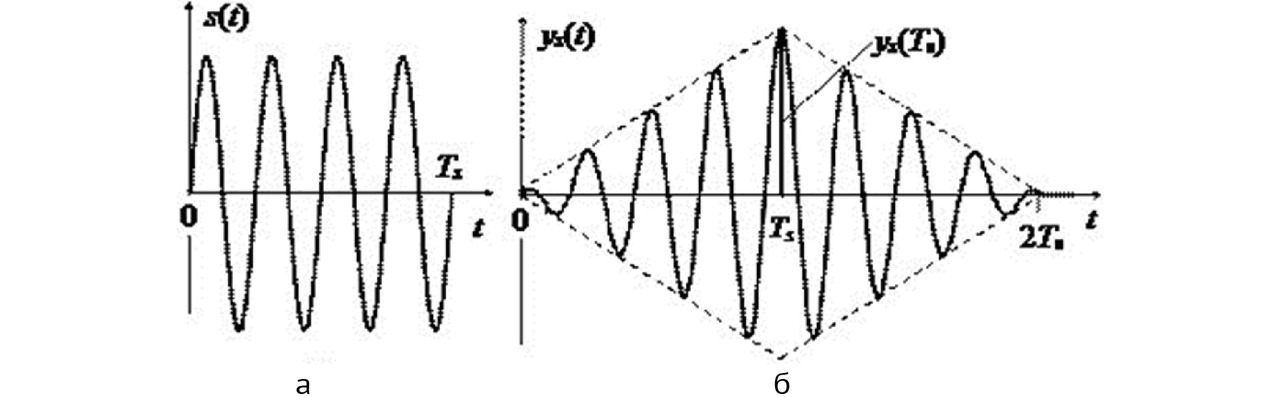
Согласованная фильтрация предназначена для выделения сигналов известной формы на фоне шумов. Она состоит в расчете свертки между входным сигналом и импульсной характеристикой фильтра, по форме соответствующей излученному сигналу. Сигналы на входе и выходе согласованного фильтра показаны на рис. 6, причем для дальнейшей обработки используется не весь сигнал с выхода фильтра, а только пиковое значение, взятое в момент времени, равный удвоенной длительности излученного сигнала.
1.1.3.3. Когерентное сложение
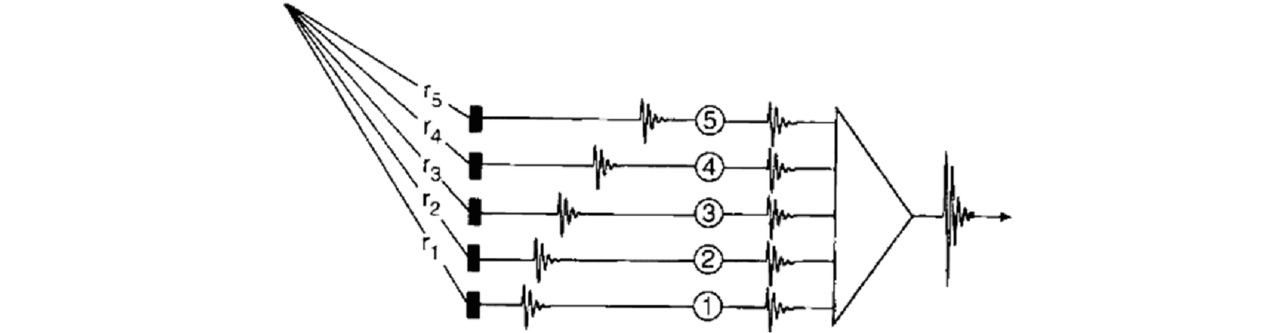
Когерентное сложение позволяет выделить сигнал на фоне шума. Оно проиллюстрировано на рис. 7. Из точки фокуса сигнал приходит быстрее на элементы датчика, расстояние до которых меньше. В приемном тракте сигнал проходит через элементы задержки, компенсирующие запаздывание эхосигнала, поэтому на вход сумматора сигналы поступают одновременно, выполняется когерентное сложение, и на выходе сумматора формируется импульс большей амплитуды. А шумы при этом не могут сложиться в сумматоре когерентно, поэтому в результате операции когерентного сложения увеличивается уровень сигнала по отношению к шуму.
1.1.3.4. Квадратурная обработка
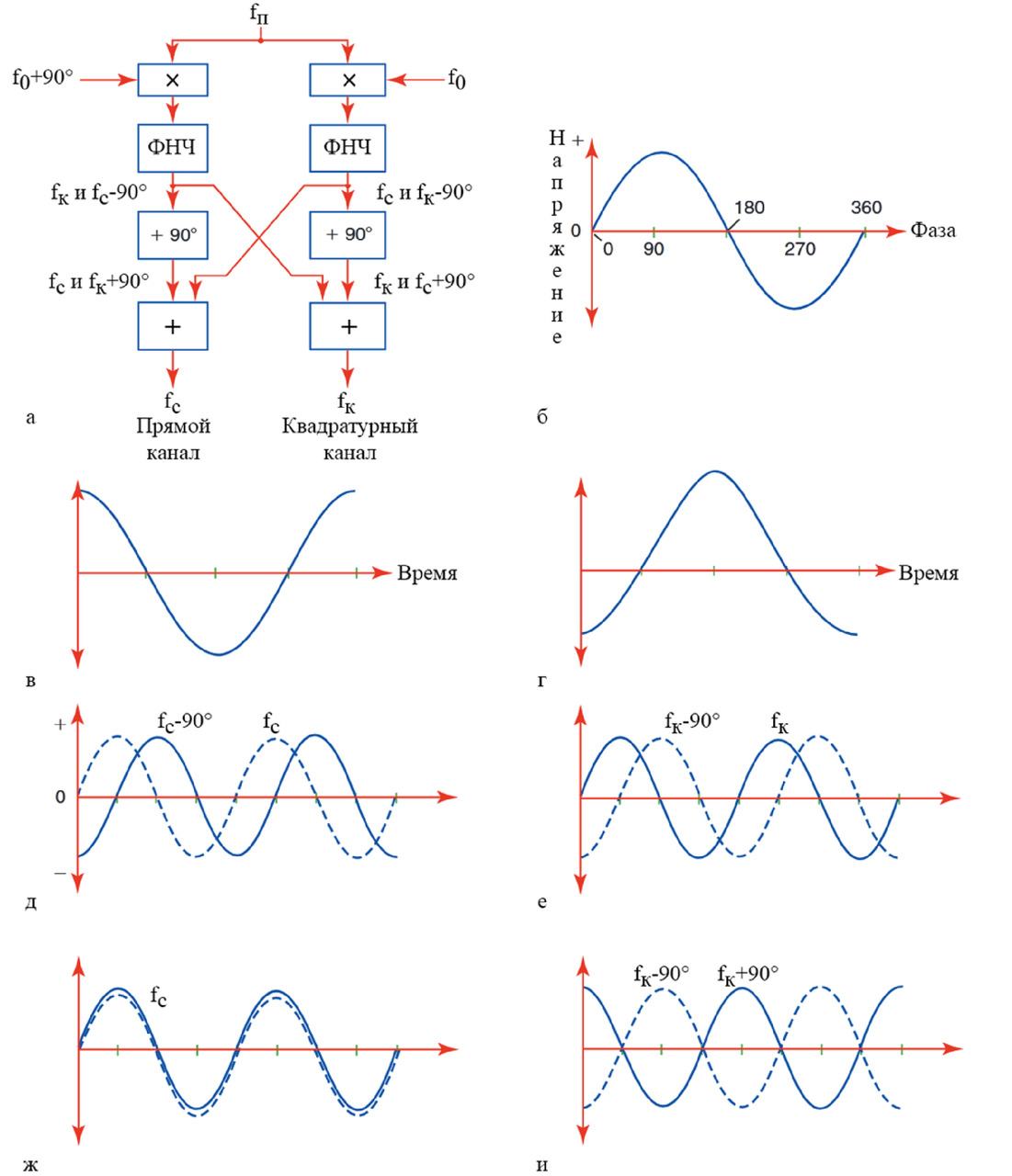
Квадратурный детектор, как поясняется схемой и изображением сигналов на рис. 8, обнаруживает в принятом сигнале fп положительные fс и отрицательные fк доплеровские сдвиги и разделяет их на отдельные каналы для передачи на дисплей и динамик. Эти каналы обозначены как прямой (также называемый синфазным) и квадратурный на схеме детектора. Отраженный сигнал смешивается с опорным сигналом от генератора f0 в двух умножителях, при этом фаза опорного сигнала в прямом канале смещена на 90°, как показано на рис. 8 в (опорный сигнал прямого) и г (квадратурного канала). Отмечаем, что если опорные сигналы сложить, то результирующий сигнал будет нулевым: два сигнала равны и противоположны, поэтому при суммировании они компенсируют друг друга.
Сумма частот fп + f0 отфильтровывается, что дает доплеровский сдвиг fд, который равен fп — f0. Если источник доплеровского сдвига перемещается в сторону датчика, то доплеровский сдвиг будет положительным fс. И, напротив, если же источник направлен от датчика, то сдвиг будет отрицательным fк. Из-за разности фаз опорного сигнала в прямом и квадратурном канале (f0 +90° по сравнению с f0) сигналы на выходе фильтра нижних частот отличаются так, что положительные сдвиги в прямом канале отстают от тех, что находятся в квадратурном канале, на 90°, как проиллюстрировано на рис. 8 д и е. На рис. 8 д–ж сплошные кривые относятся к прямому каналу, тогда как штриховые кривые относятся к квадратурному.
Как видно из рис. 8 д, сигнал с положительным доплеровским сдвигом fс на выходе фильтра прямого канала отстает от такового в квадратурном канале на 90°, а рис. 8 е показывает, что сигнал с отрицательным доплеровским сдвигом fк на выходе квадратурного канала отстает от такового в прямом канале также на 90°. Как видно из рис. 8 ж, сигнал с положительным доплеровским сдвигом на входе сумматора прямого канала находится в фазе, обеспечивающей fс на выходе, из рис. 8 и следует, что сигнал с отрицательным доплеровским сдвигом на входе сумматора прямого канала смещен по фазе на 180°, это приводит к нулевому выходу квадратурного канала fк.
Cигнал с отрицательным сдвигом в квадратурном канале отстает от такового в прямом канале на 90°(рис. 8 е). Затем еще один сдвиг фазы на 90° приводит к разделению сигналов с положительным и отрицательным сдвигами на отдельные каналы — прямой и квадратурный (рис. 8 а), при этом сдвинутый по фазе сигнал с положительным доплеровским сдвигом в прямом канале теперь совпадает по фазе с несдвинутым в квадратурном канале (рис. 8 ж), тогда как сигнал с отрицательным сдвигом смещен по фазе на 180°(рис. 8 и). При сложении сигналы с отрицательными сдвигами компенсируются (рис. 8 в и г), это означает, что на выходе прямого канала будет сигнал с положительным сдвигом. Однако аналогичный процесс в квадратурном канале дает сигналы с отрицательными сдвигами в качестве выходных данных.
Дальнейшая обработка зависит от режима: в В-режиме выполняется расчет огибающей и ее логарифмическое сжатие для представления на экране, а подробности обработки в режиме ЦДК описаны в соответствующем подразделе. В спектральном доплеровском режиме рассчитывается оконное преобразование Фурье, причем длина окна обычно составляет 512 и более отсчетов [45].
1.1.3.5. Представление информации об эхогенности
В современных сканерах возможно представление данных об эхогенности в различных режимах (рис. 9): одномерный А-режим (от англ. amplitude), двумерный В-режим (brightness), трехмерный режим (3D). Одномерный режим используется со специальным одноэлементным датчиком, применяется, например, в офтальмологии в тех случаях, когда оптические методы неинформативны. В одномерном режиме, приложив датчик к телу пациента, можно получить информацию о слоях тканей в зоне визуализации по направлению излучения датчика, при этом изображение подобно наблюдаемому на экране осциллографа, т.е. по горизонтальной оси откладывается время или глубина, а по вертикальной — амплитуда принятого сигнала. Если такие кривые получить для различных направлений, записать их в двумерный массив с координатами, соответствующими глубине и углу, а амплитуду пересчитать в интенсивность и отображать яркостью, то упрощенно можно сказать, что получится сонограмма В-режима. Теперь, если получить несколько сонограмм для различных углов, сохранить их в трехмерный массив и определенным образом визуализировать, например, показать только точки, соответствующие одинаковой интенсивности принятого сигнала, то получится 3D-УЗИ. Сейчас 3D-режим применяется преимущественно при исследовании беременных женщин и в кардиологии.
1.1.3.6. Эффект Доплера
Основой доплеровских методов является эффект Доплера (рис. 10), который состоит в том, что частота колебаний звуковых волн, излучаемых источником (передатчиком) звука, и частота этих же звуковых волн, принимаемых приемником звука, отличаются, если приемник и передатчик движутся друг относительно друга. Тот же эффект наблюдается, если в приемник поступают сигналы источника звука после отражения от подвижного объекта [6]. Этот последний случай имеет место при отражении УЗ-сигналов от движущихся биологических структур (например, элементов крови, стенок сосуда, тканей миокарда).

Если излучаемый датчиком сигнал имеет частоту f0, то частота принимаемого сигнала fП не отличается от величины f0, когда эхосигналы поступают от неподвижных отражателей. Однако, если эхосигналы поступают от движущихся отражателей, например, от эритроцитов крови, то частота fП отличается от f0. Разность между принятой и излученной частотами называют доплеровским сдвигом и вычисляют следующим образом:
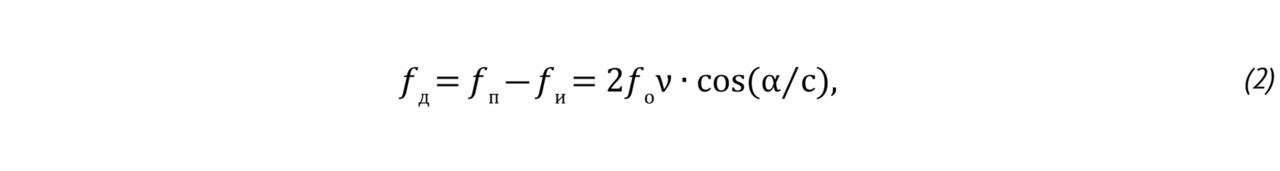
где c — скорость звука, ν — скорость кровотока, α — угол между направлением кровотока и осью луча, формируемого датчиком.
Выражение для доплеровского сдвига частоты fД получено в предположении, что ν <<c, т.е. скорость движения биологических структур существенно меньше скорости звука, что всегда выполняется на практике. На основании приведенного соотношения можно рассчитать скорость движения отражателей, т.к. нам известна величина f0, величину с мы полагаем известной (для мягких тканей она принимается равной 1540 м/с), величину угла α можно оценить, а доплеровский сдвиг частоты прибор может измерить.
Когда отражатель движется к датчику, доплеровский сдвиг частоты положителен. Если отражатель движется в противоположную от датчика сторону со скоростью, то доплеровский сдвиг частоты отрицателен. Угол α называется доплеровским углом. Величина его влияет на величину измеряемой доплеровской частоты. Eсли кровоток направлен прямо к датчику, угол α = 0° и cosα = 1. Доплеровская частота будет в этом случае максимальной. Если ультразвуковой луч перпендикулярен по отношению к направлению кровотока, т.е. α = 90°, то cosα = 0. В этом случае величина доплеровского сдвига частоты равна нулю, и скорость кровотока определить невозможно.
В общем случае движение отражающих структур может происходить в произвольном направлении относительно датчика (рис. 11). Таким образом, измеряя доплеровский сдвиг частоты, мы определяем проекцию скорости ν на линию, соединяющую отражатель с датчиком. На практике, для получения корректного результата ультразвуковой луч датчика обычно направляется под углом от 30° до 60° к направлению оси сосуда.
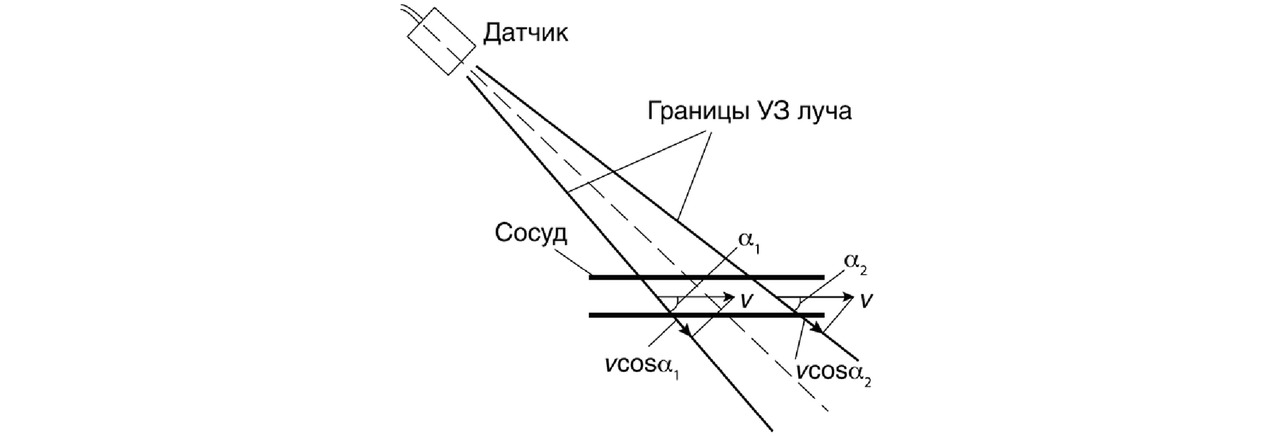
Таким образом, доплеровский сдвиг частоты fД однозначно связан с величиной оцениваемой скорости движения ν при данном значении угла α. Причем величина угла α, вообще говоря, не известна, но во многих случаях может быть определена. Например, с помощью обычного УЗ-сканирования можно определить по В-эхограмме ориентацию сосуда и, следовательно, угол α между направлением кровотока и направлением на доплеровский датчик.
На рис. 11 видно, что даже в пределах узкого луча доплеровский угол несколько различается в зависимости от того, где находится отражающая структура, что может вносить некоторую погрешность в измерение скорости. Но обычно врачу не требуется точно определять скорость ν, а достаточно лишь приближенно оценивать ее проекцию и изменение во времени.
1.1.3.7. Непрерывно-волновой и импульсно-волновой доплеровские режимы
Непрерывно-волновая спектральная доплерография применяется для количественной оценки кровотока в сосудах с высокоскоростными потоками. Данный режим используется с секторно-фазированным датчиком. При постоянно-волновом исследовании один кристаллический элемент (или половина многоэлементного датчика) посылает без перерыва низковольтные сигналы, другой (другая половина) принимает их. Таким образом, исследуется кровоток вдоль всего ультразвукового луча. Главное достоинство этого метода в том, что с его помощью может быть измерена любая скорость кровотока, а главным недостатком является то, что невозможно точно локализировать исследуемый кровоток.
Импульсная спектральная доплерография основана на периодическом излучении серии высоковольтных (~100 вольт) импульсов УЗ-волн, которые, отражаясь от клеток, последовательно принимаются тем же датчиком. При действии данного режима фиксируются сигналы, которые были отражены с определенного установленного расстояния от датчика. Таким образом, можно рассматривать различные точки кровотока.
На рис. 12 показана сонограмма, полученная при использовании импульсного доплеровского режима. Синяя наклонная линия и строб в средней части изображения указывают расположение области, из которой была получена информация. По вертикали на нижнем графике откладывается скорость потока, по горизонтали — время. Все потоки, которые в исследуемой точке движутся к датчику, располагаются на графике выше оси абсцисс, в противном случае потоки отображаются ниже оси.
1.2. Особенности традиционной обработки сигналов в подканале цветового доплеровского картирования кровотока ультразвукового устройства
1.2.1. Введение
Монография посвящена мерцающему артефакту, возникающему именно в доплеровских режимах, которые, как как было показано выше, позволяют получить информацию о наличии, направлении, скорости и характере движения тканей и кровотока. Из них, пожалуй, наибольшее распространение получил режим цветового доплеровского картирования (ЦДК), поскольку он является незаменимым средством при диагностике заболеваний сердца и сосудов [46–50]. В режиме ЦДК формируется двумерная карта кровотока, которая накладывается на серошкальное анатомическое изображение в реальном времени. Она позволяет судить не только о временном, но и о пространственном распределении кровотока. Но в отличие от спектральных режимов, дающих информацию о мгновенных значениях кровотока, ЦДК информирует о средней скорости, мощности и турбулентности кровотока. Во многих клинических случаях, ориентируясь только на эти показатели, можно обнаружить болезнь, однако для более глубокого ее анализа ЦДК используют в совокупности со спектральным доплеровским режимом, позволяющим более точно оценить динамику кровотока [49].
В отличие от других доплеровских режимов, при реализации ЦДК критически важным является требование к скорости обработки данных в вычислительной системе ультразвукового медицинского диагностического устройства. Вследствие этого при реализации алгоритмов обработки приходится идти на компромиссы, приводящие к снижению показателей качества изображения в режиме ЦДК. К сожалению, вероятно, из-за коммерческих соображений в серийных УЗ-сканерах, использующих аппробированные (классические) алгоритмы, обычно отсутствует возможность для исследователей экспериментировать с новыми алгоритмами [51]. Например, во многих случаях скорость движения ткани близка к скорости кровотока, здесь классические алгоритмы фильтрации неизбежно приводят к ошибке определения параметров кровотока, поэтому требуется совершенствование существующих алгоритмов обработки сигнала [52]. Известны гипотезы, в которых утверждается о возможности разработки особого режима обработки эхосигналов на основее ЦДК, позволяющего обнаруживать микрокальцинаты, являющиеся предвестниками рака и других отклонений [53]. Но в других публикациях [54] отмечается, что мерцающий артефакт в стандартных доплеровских режимах при использовании современных сканеров плохо подходит для диагностики микрокальцинатов.
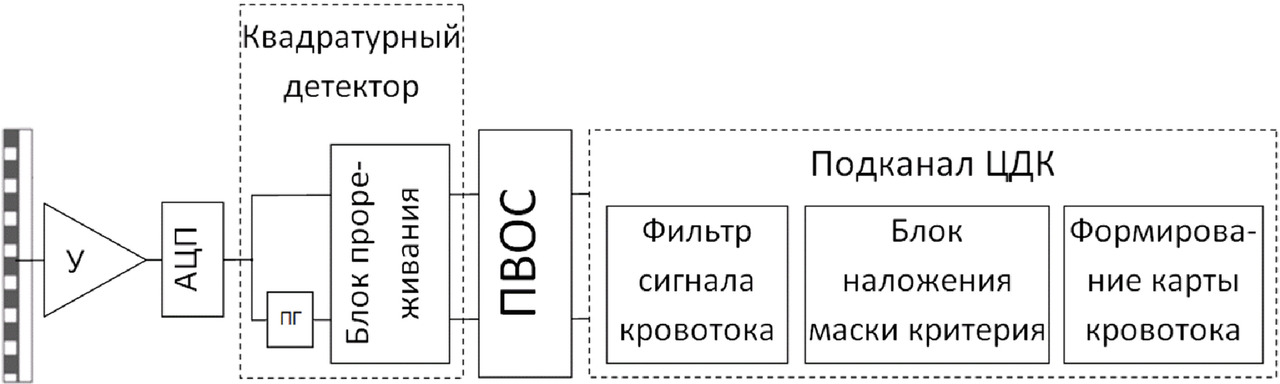
Для проверки этих противоречивых утверждений была разработана программа обработки доплеровских данных в режиме ЦДК, в которую вошли как стандартные алгоритмы обработки доплеровских сигналов, так и авторские. При этом в программе реализуются основные этапы обработки сигнала в режиме ЦДК: фильтрация, расчет параметров кровотока, маскирование, цветовое кодирование и наложение карты на В-изображение. Исходными данными для программы являлись первичные («сырые») данные, поступающие из тракта предварительной обработки прибора «Сономед-500».
В отличие от распространенной программы комплексного моделирования Field II [55, 56] программа, разработанная авторами, реализует только обработку сигнала в режиме ЦДК. Она написана на языке С++ и не содержит закрытого кода, что позволяет экспериментировать с различными алгоритмами на любом из этапов обработки сигнала, представленных на рис. 13. Далее рассмотрим назначение и суть каждого этапа.
1.2.2. Традиционная модель входных данных
При формировании одного кадра в доплеровском режиме облучение объекта повторяется несколько раз. Количество повторов K меняется от 3–17 при ЦДК до нескольких сотен в спектральном режиме. Фактически строится серия из K-изображений, отражающих меняющееся состояние исследуемой области с некоторой разницей во времени. Для этого по каждому лучу сканирования формируется пачка из K-акустических импульсов на частоте ω0, следующих с интервалом TPRF=2π/ωPRF. При поступлении в тракт приема соответствующие эхо-сигналы усиливаются, оцифровываются и подвергаются преобразованию Гильберта для формирования аналитического сигнала. В результате, доплеровские данные могут быть представлены в виде четырехмерного массива комплексных чисел. Совокупность K-комплексных амплитуд в каждой точке исследуемой области представляет собой ансамбль x = [x0, x1,…, xK-1] T.
Традиционно [20, 57] комплексный доплеровский сигнал описывается следующим выражением:
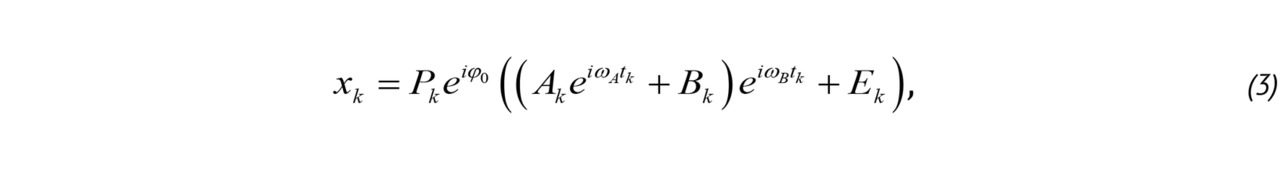
где k — номера импульса в доплеровской пачке Pk, — действительная амплитуда сканирующего импульса в моменты времени tk. Этот импульс можно приближенно считать гауссовым, его длительность в доплеровском режиме равна нескольким периодам колебаний на частоте ω0;
— Ak комплексная амплитуда сигналов, отраженных от кровотока;
— ωA = 2vA/c 🞩 ω0 — доплеровский сдвиг частоты, обусловленный движением крови со скоростью vA, c, — скорость звука tk = kTPRF, — промежуток времени между нулевым и k-м импульсом в пачке, k = 0,1,… K -1;
— Bk комплексная амплитуда сигналов от малоподвижных тканей, которая, как правило, на 20–30 дБ превосходит амплитуду сигналов от кровотока;
— ωB = 2vB/c 🞩 ω0 — доплеровский сдвиг частоты, обусловленный движением тканей и колебаниями датчика. Предполагается, что скорость этого движения vB <<vA;
— Ek комплексная компонента, характеризующая тепловой шум и шумы квантования и дискретизации в тракте приема и первичной обработки сигнала. Ее амплитуда на 10–15 дБ меньше амплитуды сигнала от кровотока;
— φ0 начальная фаза последовательности, этот параметр не влияет на последующие рассуждения и в дальнейшем будет опускаться.
Таким образом, обрабатываемые данные канала ЦДК представимы в виде четырехмерной матрицы, одно из измерений которой соответствует номеру кадра, другое — номеру луча, третье — «быстрому» времени или глубине прихода сигнала, четвертое — «медленному» времени или номеру импульса в пачке. При обработке в режиме ЦДК рассматриваются ансамбли «медленного» времени, полагается, что они состоят из отсчетов, взятых из одной точки пространства с частотой повторения импульсов. Тогда сигнал представляет собой вектор из K-комплексных чисел: x = [x0, x1,…, xK-1] T.
Ансамбль «медленного» времени в области кровотока содержит три компоненты: 1) отражения от эритроцитов; 2) отражения от тканей; 3) шум приемного устройства. Если же кровотока в рассматриваемой точке нет, то в ансамбль войдут только шум и сигнал от тканей. Тогда ансамбль «медленного» времени можно представить в двух формах в зависимости от наличия кровотока:
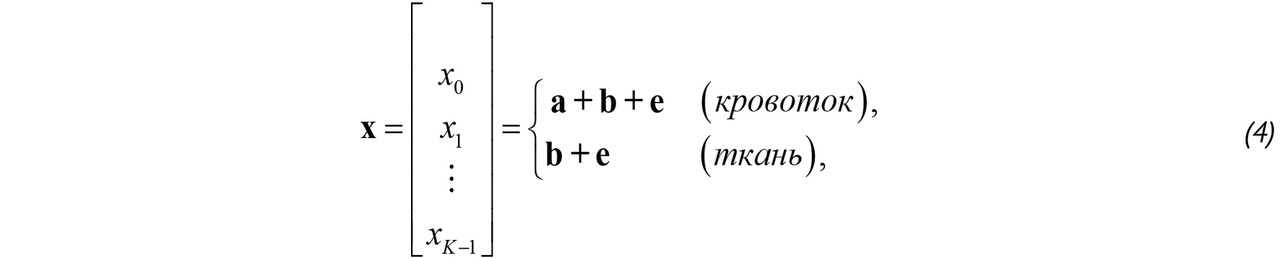
где a, b и e — векторы длиной K, именуемые в дальнейшем компонентами 1) отражения от эритроцитов; 2) отражения от тканей; 3) шума в тракте приема. Компоненты a и b происходят из разных источников, расположенных в разных точках пространства, но попавших в один отсчет из-за наличия боковых лепестков диаграммы направленности решетки пьезокерамических элементов, и поэтому являются статистически независимыми. Поскольку ширина шума в спектральной области на входе доплеровского канала обработки велика по отношению к частоте повторения импульсов, его модулируют как белый шум [57]. А плотность вероятности ансамбля «медленного» времени px (x) соответствует центрированному комплексному гауссову процессу:
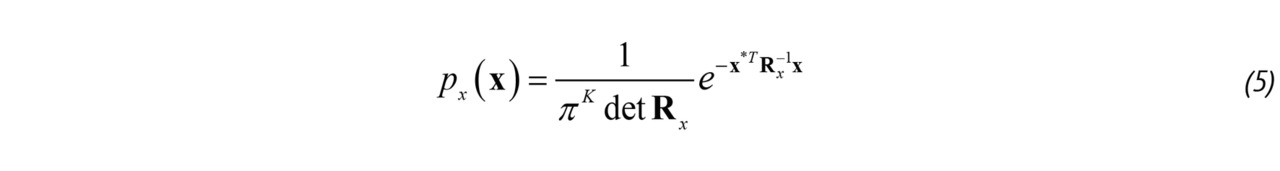
где det Rx — определитель матрицы Rx, а Rx-1 — матрица, обратная Rx.
Являясь гауссовым, ансамбль полностью статистически характеризуется моментом второго порядка, информация о котором содержится в корреляционной матрице:
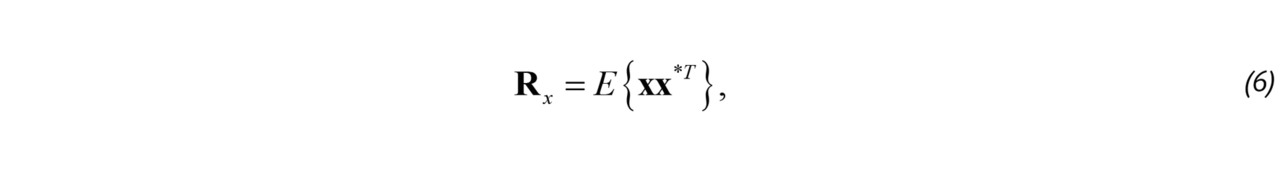
где E соответствует оператору математического ожидания размерностью K 🞩 K.
С учетом предположения о статистической независимости это можно записать так:
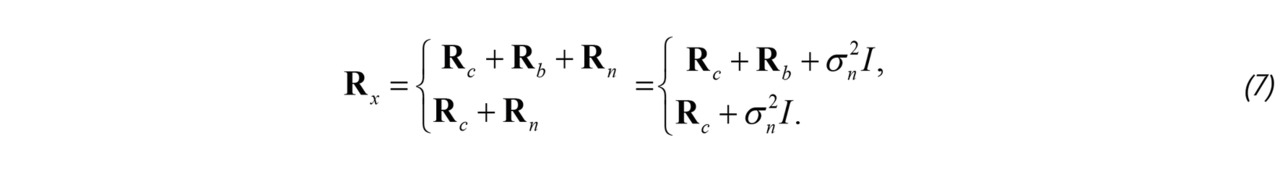
В формуле (7) Rc соответствует корреляционной матрице компоненты ткани, Rb — корреляционная матрица сигнала от эритроцитов, σn2 — дисперсия теплового шума, а I — единичная матрица размерностью K x K.
При формировании карты очень важно определить наличие компоненты кровотока в анализируемом ансамбле. Для этого необходимо подавить компоненту отражения от тканей, мощность которой обычно более чем на 20 дБ превышает другие компоненты. В этом и состоит основная задача фильтрации, которая в случае малой относительной скорости кровотока осложняется наложением спектров компонент отражения от тканей и эритроцитов.
1.2.3. Фильтрация
Компонента отражения от тканей обычно на 20–60 дБ превышает мощность компоненты отражения от эритроцитов [51]. Для определения параметров кровотока компоненту отражения от тканей подавляют при помощи фильтра верхних частот:
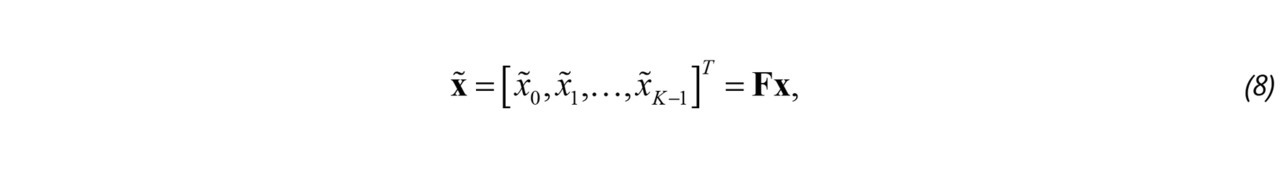
где x̃ — вектор результата фильтрации, F — матрица фильтрации размером K 🞩 K.
Поскольку основными малоподвижными отражателями при доплеровской визуализации являются стенки кровеносных сосудов, эта фильтрация получила название Wall Filtering. Соответствующая доплеровская частота ωB ≫ ωA, поэтому ее влиянием тоже можно пренебречь. Обычно исключается из рассмотрения амплитудная составляющая сканирующего импульса Pk, хотя это и не совсем корректно. Таким образом, анализу подвергаются сигналы с комплексными амплитудами отсчетов вида:
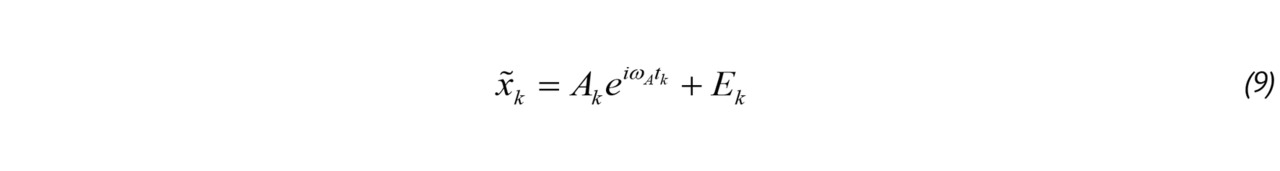
Фильтрация верхних частот в радиоэлектронике обычно реализуются с помощью фильтров с конечной (КИХ) и бесконечной импульсной характеристикой (БИХ). КИХ-фильтр реализуют в цифровой форме как нерекурсивный алгоритм, его выходной сигнал зависит только от входного, а импульсная характеристика конечна. БИХ-фильтр, напротив, рекурсивен:
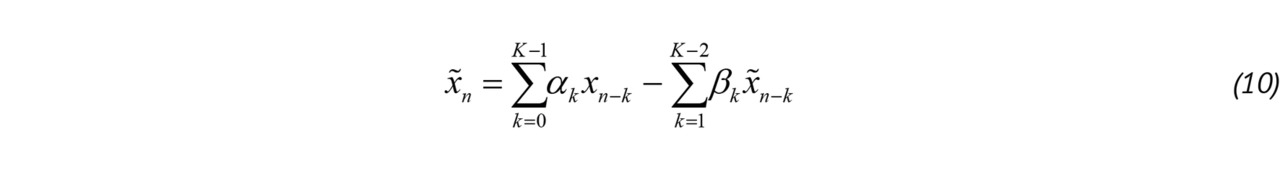
В уравнении (10) αk и 𝛽k — весовые коэффициенты входных и выходных отсчетов. Разностное уравнение КИХ-фильтра совпадает по форме с уравнением (10), но весовые коэффициенты выходных отсчетов равны нулю.
Выбор порядка КИХ- и БИХ-фильтров является непростой задачей, так как для малого порядка характерна неприемлемо широкая переходная область на амплитудно-частотной характеристике, а при большом порядке возникает длинная переходная характеристика, приводящая к потере отсчетов обрабатываемого ансамбля «медленного» времени [57].
1.2.4. Расчет параметров кровотока
Самый первый и наиболее распространенный метод определения параметров кровотока основан на корреляционной функции. Впервые он был применен японскими учеными Никанава и Касаи [51, 57] в середине восьмидесятых годов 20 века при демонстрации работающего в реальном времени режима ЦДК.
Корреляционный метод позволяет оценить основные спектральные моменты:
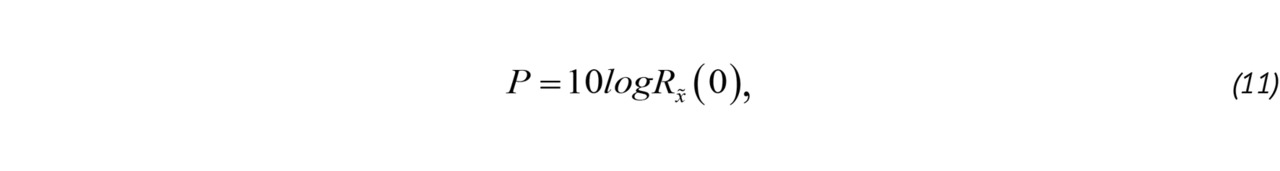
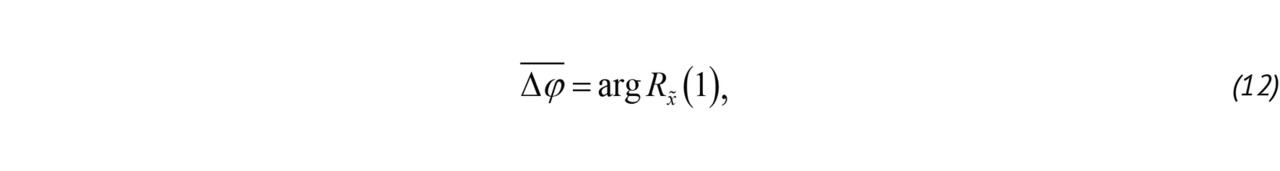
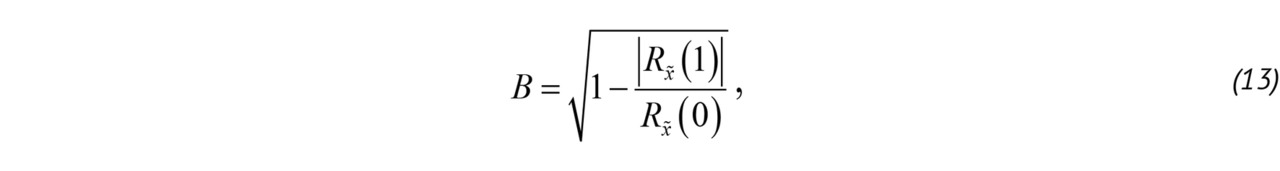
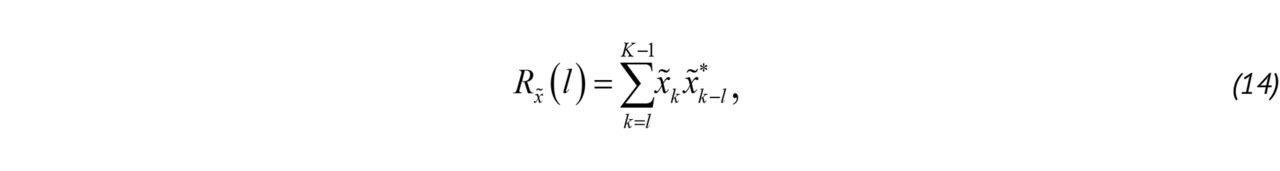
где Rx̃ (1) — корреляционная функция ансамбля «медленного» времени, P — мощность, используемая для определения наличия и интенсивности кровотока, B — величина, характеризующая турбулентность потока [52, 58], Δ͞φ — средний доплеровский сдвиг фазы ансамбля x̃ после фильтрации верхних частот.
В общем случае автокорреляционная функция связана со спектральной плотностью мощности по теореме Винера-Хинчина:
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.