
Бесплатный фрагмент - Комплексная лабораторная биохимическая диагностика атеросклероза
Комплексная лабораторная биохимическая диагностика атеросклероза
ВВЕДЕНИЕ
Актуальность: Объектом особого внимания являются больные с ИБС, атеросклерозом мозговых, периферических артерий и аорты. Именно у них в процессе терапии необходимо стремиться достичь целевых уровней липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП) и триглицеридов (ТГ).Важным аспектом профилактики ЗСС и атеросклероза является выявление лицс нарушенным обменом липидов и липопротеидов без клинических проявлений ИБС.
Объект исследования: лабораторные биохимические методы исследования атеросклероза
Предмет исследования: особенности лабораторных биохимических исследований атеросклероза
Цель: Изучение методов лабораторной биохимической диагностики атеросклероза
Задачи:
— Изучить патогенез и клиническую картину атеросклероза
— Выявить факторы риска атеросклероза
— Изучить профилактику и лечение атеросклероза
— Проделать биохимический анализ крови на атеросклероз
Методы:
— Теоретические;
— Эмпирические.
— ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
— Этиология, патогенез, клинические проявления атеросклероза
Патогенез атеросклероза чрезвычайно сложен и многие его звенья до сих пор остаются малоизученными или имеют различную интерпретацию. Это объясняет отсутствие в настоящее время единой общепринятой теории патогенеза этого заболевания, которая объединяла бы все известные механизмы его развития. Следует упомянуть о классической липидно-инфильтрационной теории Н. Н. Аничкова (1913) и инфильтративно-комбинационной теории Н. Н. Аничкова и С. С. Халатова (1946). Согласно представлениям этих авторов, в основе возникновения атеросклероза лежит инфильтрация в стенку артерий экзогенного и эндогенного ХС, что ведет к своеобразной клеточной реакции сосудистой стенки и формированию атеросклеротической бляшки. По современным представлениям, в основе развития атеросклероза лежит последовательное взаимодействие многих патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки (неосложненной и осложненной) [1].
Различают три основные стадии формирования атеросклеротической бляшки (атерогенез):
— образование липидных пятен и полосок (стадия липоидоза);
— образование фиброзной бляшки (стадия липосклероза);
— образование осложненной атеросклеротической бляшки.
Образование липидных пятен и полосок
Начальная стадия атеросклероза характеризуется появлением в интиме артерий пятен и полосок, содержащих липиды. Липидные пятна представляют собой небольших размеров (до 1,0–1,5 мм) участки на поверхности аорты или крупных артерий, которые имеют желтоватый цвет. Липидные пятна состоят главным образом из пенистых клеток, содержащих большое количество липидов, и Т-лимфоцитов. В меньшем количестве в них присутствуют также макрофаги и гладкомышечные клетки. Со временем липидные пятна увеличиваются в размерах, сливаются друг с другом и образуют так называемые липидные полоски, слегка возвышающиеся над поверхностью эндотелия. Они также состоят из макрофагов, лимфоцитов, гладкомышечных и пенистых клеток, содержащих липиды. На этой стадии развития атеросклероза ХС расположен преимущественно внутриклеточно, и лишь небольшое его количество находится вне клеток [3].
Первым звеном этого процесса является повреждение эндотелия и возникновение эндотелиальной дисфункции, сопровождающейся повышением проницаемости этого барьера [1].
Причинами первоначального повреждения эндотелия могут служить несколько факторов:
— механическое воздействие на эндотелий турбулентного потока крови, особенно в местах разветвления артерий;
— артериальная гипертензия, увеличивающая напряжение сдвига;
— увеличение в крови атерогенных ЛПНП и ЛП (а), особенно их модифицированных форм, образующихся в результате перекисного окисления липидов или
их гликозилирования (при сахарном диабете) и обладающих выраженным цитотоксическим действием;
— увеличение активности САС и РААС, сопровождающееся цитотоксическим
действием катехоламинов и ангиотензина II на сосудистый эндотелий;
— хроническая гипоксия и гипоксемия любого происхождения
— курение;
— повышение в крови уровня гомоцистеина, например, при дефиците витаминов В6, В12 и фолиевой кислоты;
— вирусная и хламидийная инфекция, сопровождающаяся развитием хронического воспаления в стенке артерии.
В результате повреждения эндотелия формируется эндотелиальная дисфункция, проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись азота и др.) и увеличением образования вазоконстрикторных веществ (эндотелиинов, ангиотензина II, тромбоксана А2 и др.), еще больше повреждающих эндотелий и повышающих его проницаемость. мЛПНП, ЛП (а) и некоторые клеточные элементы крови (моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или гликозилированию (модификации), что способствует еще большему повреждению эндотелия и облегчает миграцию из кровотока в интиму артерий этих клеточных элементов. Моноциты, проникшие в интиму, трансформируются в макрофаги, которые с помощью так называемых скэвенджер-рецепторов («рецепторов-мусорщиков») поглощают мЛПНП (в меньшей степени — остатки ХМ и ЛПОНП) и накапливают свободный и эстерифицированный ХС. Перегруженные липидами макрофаги превращаются в пенистые клетки. Макрофаги, перегруженные мЛПНП, а также тромбоциты, проникающие в интиму артерий из крови, секретируют факторы роста и митогены, воздействующие на гладкомышечные клетки, расположенные в средней оболочке артерий (медии) [1].
Под действием факторов роста и митогенов гладкомышечные клетки мигрируют в интиму и начинают пролиферировать. Находясь в интиме, они захватывают и накапливают мЛПНП, также превращаясь в своеобразные пенистые клетки. Кроме того, гладкомышечные клетки приобретают способность сами продуцировать элементы соединительной ткани (коллаген, эластин и гликозаминогликаны), которые в дальнейшем используются для построения фиброзного каркаса атеросклеротической бляшки. Со временем пенистые клетки подвергаются апоптозу — запрограммированной гибели клеток и разрушению клеточной оболочки. В результате липиды попадают во внеклеточное пространство [2].
Образование фиброзной бляшки
По мере прогрессирования патологического процесса в участках отложения липидов разрастается молодая соединительная ткань, что ведет к образованию фиброзных бляшек, в центре которых формируется так называемое липидное ядро. Этому способствует увеличение количества липидов, высвобождающихся в результате гибели (апоптоза) гладкомышечных клеток, макрофагов и пенистых клеток, перегруженных липидами. Экстрацеллюлярно расположенные липиды пропитывают интиму, образуя липидное ядро, которое представляет собой скопление атероматозных масс (липидно-белкового детрита). Вокруг липидного ядра возникает зона соединительной ткани, вначале богатой клеточными элементами (макрофагами, пенистыми и гладкомышечными клетками, Тлимфоцитами), коллагеном и эластическими волокнами. Одновременно происходит васкуляризация очага атеросклеротического поражения. Вновь образующиеся сосуды отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки.
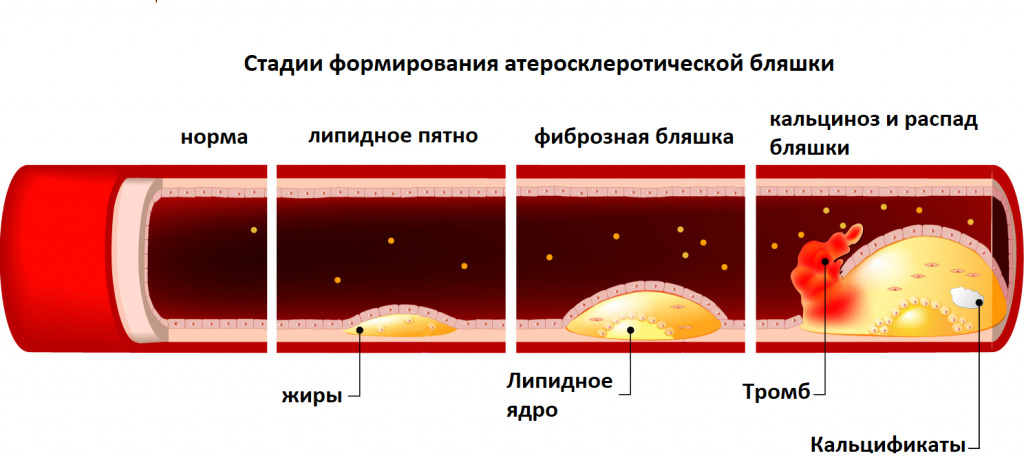
Рис 1. Стадии формирования атеросклеротической бляшки
По мере созревания соединительной ткани количество клеточных элементов уменьшается, а коллагеновые волокна утолщаются, формируя соединительнотканный каркас атеросклеротической бляшки — «покрышка», которая отделяет липидное ядро от просвета сосуда. Формируется типичная фиброзная бляшка, выступающая в просвет сосуда и нарушающая кровоток в нем. Следует заметить, что клиническое и прогностическое значение сформировавшейся атеросклеротической бляшки во многом зависит именно от структуры ее фиброзной покрышки и размеров липидного ядра [4].
В некоторых случаях, в том числе на относительно ранних стадиях формирования бляшки, ее липидное ядро хорошо выражено, а соединительнотканная капсула сравнительно тонкая и может легко повреждаться под действием высокого АД, ускорения кровотока в артерии и других факторов. Такие мягкие и эластичные бляшки иногда называют «желтыми бляшками». Они, как правило, мало суживают просвет сосуда, но ассоциируются с высоким риском возникновения повреждений и разрывов фиброзной капсулы, т.е. с формированием так называемой осложненной атеросклеротической бляшки [4].
В других случаях фиброзная покрышка хорошо выражена, плотная и меньше подвержена повреждению и разрывам. Такие бляшки называют «белыми». Они нередко значительно выступают в просвет артерии и вызывают гемодинамически значимое ее сужение, которое в некоторых случаях может осложняться возникновением пристеночного тромба.
Клиническая картина
Клинические проявления атеросклероза многообразны и зависят от локализации, степени поражения и количества вовлеченных в патологический процесс артерий. Однако существует ряд клинических проявлений, связанных с атеросклерозом, которые можно легко заметить при осмотре больного, независимо от локализации атеросклеротического процесса. Возможными внешними указаниями на предрасположенность к атеросклерозу, выявляемыми при осмотре, считают:
• признаки выраженного и нередко преждевременного старения;
• несоответствие внешнего вида и возраста человека (больной выглядит
старше своих лет);
• раннее поседение волос на голове и передней поверхности грудной клетки (у мужчин);
• ксантомы и ксантелазмы (желтые липидные пятна в области сухожилий и век соответственно).
В большей части случаев (около 60%) первый симптом атеросклероза — острые коронарные синдромы и внезапная сердечная смерть. Тромбоз, развивающийся на поверхности изъязвленной бляшки в различных артериальных бассейнах, в качестве клинических проявлений имеет клинические и инструментальные признаки острой ишемии и некроза соответствующих органов: сердца, мозга, конечностей, кишечника, почки [6].
В случае постепенного прогрессирования атеросклеротических стенотических изменений (без тромбоза) в артериях различных артериальных бассейнов клиническая картина будет представлена хронической ишемией органа, получающего кровь по вовлеченной в патологический процесс артерии. При поражении сосудов сердца проявлением хронической ишемии могут быть стенокардия напряжения или безболевая ишемия миокарда, выявляемая с помощью инструментальных методов. Иногда основным последствием и первым проявлением длительно существующей хронической ишемии миокарда могут оказаться кардиомегалия и/или тяжелая сердечная недостаточность (без предшествующих инфарктов миокарда) [6].
В случае поражения сосудов головного мозга в качестве симптомов ишемии больные могут испытывать головокружение, шум в голове, ощущение звона в ушах, резкое снижение памяти, нарушения сна. Финалом длительно существующей или быстропрогрессирующей ишемии мозга могут стать сосудистая деменция и кахексия. Среди физических признаков атеросклероза артерий, кровоснабжающих головной мозг, может оказаться шум при выслушивании сонных артерий. Однако этот феномен встречается нечасто, только при поражении крупных внечерепных артерий (как правило, общей сонной), и в некоторых случаях шум может оказаться проводным (например, у больных со стенозом аортального клапана) [2].
Облитерирующий атеросклероз артерий нижних конечностей в хронической форме может проявляться слабостью в ногах, ощущением постоянной зябкости, онемением, ощущением ползания мурашек по ногам. Наиболее характерен синдром перемежающейся хромоты: боли в икроножных мышцах, возникающие при ходьбе и заставляющие больного останавливаться, после чего боли проходят. На поздних этапах возможны бледность, похолодание ног, потеря волос (у мужчин), трофические нарушения кожи в области стоп, голеней (образование трофических язв, гангрены). В отличие от сердца и мозга, анатомическая близость артерий нижних конечностей (к поверхности тела) позволяет в рамках обычного врачебного осмотра зарегистрировать ослабление или отсутствие пульса на артериях тыла стопы и заднебольшеберцовых, а в тяжелых случаях — на подколенных и бедренных артериях [1].
При атеросклерозе бифуркации аорты может сформироваться хроническая обструкция бифуркации аорты, для которой характерны следующие симптомы:
— перемежающаяся хромота;
— похолодание, онемение, бледность ног, выпадение волос и нарушение роста ногтей на ногах;
— атрофия мускулатуры бедер и голеней;
— импотенция (у мужчин);
— снижение кожной температуры (холодные ноги);
— отсутствие пульсации артерий стоп, подколенной, нередко бедренной артерии;
— появление язв и некрозов в области пальцев и стоп;
— систолический шум над бедренной артерией в паховом сгибе, по ходу подвздошной артерии или над брюшной аортой;
— невозможность определить артериальное давление на нижних конечностях аускультативным методом.
Следует помнить, что атеросклероз грудной и брюшной аорты может привести к формированию аневризмы этих отделов с соответствующей симптоматикой. Учитывая, что атеросклероз — системное заболевание, у одного больного могут быть симптомы хронической ишемии сразу нескольких органов. Изредка происходит одновременное развитие двух острых событий, обусловленных атеросклерозом, например, инфаркта миокарда и мозгового инсульта [4].
— Обмен липидов
Хиломикроны (ХМ) почти полностью (на 80–95%) состоят из ТГ. Они являются основной транспортной формой экзогенных (пищевых) ТГ, перенося их 6 из тонкого кишечника в скелетную мускулатуру, миокард и жировую ткань. В плазме крови они расщепляются под действием липопротеинлипазы до глице-рина и свободных неэстерифицированных жирных кислот (НЭЖК). Последние используются в периферических органах в качестве энергетического субстрата (Р-окисление жирных кислот). Остатки ХМ (ремнанты) захватываются гепато-цитами и сравнительно быстро удаляются из кровотока: через несколько часов после приема пищи они уже не обнаруживаются в плазме крови [3].
Липопротеины очень низкой плотности (ЛПОНП) — это крупные и «рыхлые» ЛП, содержащие около 55% ТГ, 19% холестерина (ХС) и только 8% белка (апопротеинов (аро-) В-100, Е, С-I и C-II). Этот класс ЛП является главной транспортной формой эндогенных ТГ, синтезируемых в печени. Поступая в кровь, ЛПОНП также подвергаются воздействию липопротеинлипазы, локализующейся в том числе на поверхности сосудистого эндотелия. В результате происходит расщепление ТГ на глицерин и НЭЖК, которые также используются жировой тканью, миокардом и скелетной мускулатурой в качестве энергетического субстрата. Остатки ЛПОНП превращаются в липопротеиды промежуточной плотности (ЛПП), которые затем частично удаляются печенью из кровотока, а частично трансформируются в ЛПНП и тоже удаляются из кровотока [3].
Липопротеины низкой плотности (ЛПНП) представляют собой более мелкие частицы, которые являются основной транспортной формой ХС. Они содержат около 6% ТГ, максимальное количество ХС (50%) и 22% белка. Примерно 2/3 быстро обменивающегося пула ХС синтезируется в организме, преимущественно в печени (эндогенный ХС), и только 1/3 поступает в организм с пищей (экзогенный ХС). Следует помнить, что ключевым ферментом, определяющим скорость синтеза эндогенного ХС, является гидроксиметил-глутарил-КоА-редуктаза (ГМГ-КоА-редуктаза).Дальнейший метаболизм ЛПНП может происходить двумя путями. Первый из них в норме значительно преобладает и заключается в захвате ЛПНП специфическими рецепторами гепатоцитов, имеющими сродство к апопротеинам В и Е, расположенным на поверхности ЛПНП. Захваченные печеночной клеткой частицы поглощаются гепатоцитами и подвергаются гидролизу с образованием свободного ХС, белка и жирных кислот, которые затем утилизируются клетками [4].
Характерно, что уровень внутриклеточного свободного ХС является важнейшим фактором, регулирующим активность ГМГ-КоА-редуктазы и скорость синтеза специфических ЛПНП-рецепторов гепатоцитов, с помощью которых осуществляется захват новых частиц ЛПНП, циркулирующих в крови. Так, при снижении содержания внутриклеточного ХС возрастает активность ГМГ-КоА-редуктазы и соответственно скорость синтеза эндогенного ХС. Одновременно увеличивается синтез ЛПНП-рецепторов гепатоцита и активизируется захват и поглощение ЛПНП из кровотока и их внутриклеточный катаболизм. В результате содержание ХС внутри клетки восстанавливается. Наоборот, при высокой. внутриклеточной концентрации свободного ХС замедляется синтез эндогенного ХС и ЛПНП-рецепторов и уровень внутриклеточного ХС постепенно нормализуется [4].
Второй путь катаболизма ЛПНП — это свободно-радикальное перекисное окисление ЛП. Свободные радикалы, образующиеся в организме человека в процессе обмена веществ, являются, как известно, высокоактивными и нестабильными молекулами, которые легко окисляют ХС ЛПНП. В результате образуются так называемые модифицированные (окисленные) ЛПНП (мЛПНП), которые плохо распознаются В- и Е-рецепторами гепатоцитов и поэтому не участвуют в описанном выше нормальном физиологическом пути катаболизма ЛПНП. мЛПНП захватываются макрофагами, которые при этом трансформируются в пенистые клетки, входящие в состав атеросклеротических бляшек. Кроме того, мЛПНП вызывают повреждение сосудистого эндотелия, запуская целый каскад патологических реакций со стороны сосудистой стенки [6].
Таким образом, ЛПНП относятся к наиболее атерогенной фракции ЛП. Увеличение общего содержания ЛПНП, особенно мЛПНП, ассоциируется с высоким риском возникновения атеросклероза и его осложнений.
Липопротеин (а) (ЛП (а)), близок по своим физико-химическим свойствам к ЛПНП, отличаясь от них наличием в оболочке дополнительного белка-апопротеина а. Последний близок по своим свойствам к плазминогену и поэтому может конкурировать с плазминогеном за места связывания на фибрине и, таким образом, ингибировать фибринолитическую активность крови. ЛП (а) относятся к числу атерогенных ЛП: их повышенный уровень в крови почти всегда ассоциируется с развитием атеросклероза и ИБС, а также с высоким риском тромботических осложнений [2].
Липопротеины высокой плотности (ЛПВП) — самые мелкие и плотные частицы ЛП. Они содержат всего 5% ТГ, 22% ХС и самое большое количество белка (40%) — апопротеинов (А-I, А-II и С и относятся к ЛП, обладающим антиатерогенными свойствами. Последние определяются участием ЛПВП в катаболизме всех остальных ЛП, поскольку с помощью ЛПВП осуществляется обратный транспорт ХС из периферических органов, в том числе из артериальной стенки, с поверхности ХМ и ЛПОНП, макрофагов и гладкомышечных клеток, в печень, где происходят его утилизация и превращение в желчь. Синтез «зрелых» сферических ЛПВП происходит при обязательном участии ХМ, ЛПОНП и ЛПНП за счет присоединения свободного ХС от других ЛП и периферических тканей к начальным формам ЛПВП, имеющим форму дисков. Кроме того, ЛПВП в процессе метаболизма ХМ, ЛПОНП и ЛПНП присоединяют к себе их апопротеины А и С, оказывающие влияние на активность многочисленных ферментных систем, участвующих в метаболизме липидов [1].
Таким образом, ЛПВП защищают сосудистую стенку и другие периферические ткани от избыточного содержания ХС, поддерживая высокую скорость обмена ЛП. Снижение содержания ЛПВП в плазме крови, наряду с увеличени-8 ем уровня ЛПНП, сопровождается значительным увеличением риска развития атеросклероза.
— Факторы риска
Атеросклероз является полиэтиологическим заболеванием, в возникновении и прогрессировании которого имеют значение многие внешние и внутренние факторы, называемые факторами риска (ФР). В настоящее время известно более 30 факторов, действие которых увеличивает риск возникновения и развития атеросклероза и его осложнений [4].
В этом плане полезно различать факторы риска и маркеры риска. Термин фактор риска обычно используют для характеристики, которая считается этиологически связанной с заболеванием. Ее значение в том, что модификация этого фактора предупреждает развитие или прогрессирование заболевания. Другие характеристики могут быть связаны с заболеванием, но не обязательно этиологически. Такие характеристики называются маркерами риска, которые можно использовать для выявления лиц, имеющих высокий риск заболевания, и у которых может быть целесообразно агрессивное вмешательство. Предлагаются различные новые маркеры риска, такие, как показатели воспаления (СРБ), протромботический диатез (фибриноген), изменение эндотелиальной функции (эндотелий-зависимая реакция плечевой артерии), физиологические признаки атеросклероза (например, локте-плечевой индекс артериального давления) и неинвазивные признаки атеросклероза (толщина интима-медиа (ТИМ) сонной артерии и кальцификация коронарных артерий) [6].
К наиболее значимым факторам риска относятся:
— немодифицируемые (неизменяемые): возраст; пол; наследственность.
— модифицируемые (изменяемые): дислипидемии, артериальная гипертензия, сахарный диабет 2 типа, гиподинамия, нерациональное питание, гипергомоцистеинемия, воспаление.
НЕМОДИФИЦИРУЕМЫЕ (НЕИЗМЕНЯЕМЫ) ФР:
— Возраст: мужчины> 40 лет, женщины> 50 лет или с ранней менопаузой.
— Пол: мужской (до 55 лет заболеваемость ИБС, церебральным и периферическим атеросклерозом среди мужчин в 3–4 раза выше, чем среди женщин. В более старшей возрастной группе (старше 65–70 лет) заболеваемость выравнивается). Более позднее развитие атеросклероза у женщин объясняют защитным эффектом эстрогенов.
— Наследственность: раннее начало ИБС у ближайших родственников: острый инфаркт миокарда или нестабильная стенокардия у мужчин в возрасте <55 лет, у женщин <65 лет.
МОДИФИЦИРУЕМЫЕ (ИЗМЕНЯЕМЫЕ) ФР:
— Артериальная гипертония: АД ≥ 140/90 мм рт. ст. или постоянный прием антигипертензивных препаратов.
Высокое АД оказывает повреждающее действие на эндотелий артериальных сосудов. Кроме того, известно, что АГ ассоциируется с нарушением функции эндотелия, которое сопровождается увеличением местной выработки вазоконстрикторных факторов (эндотелиин, ангиотензин II и др.) и уменьшением синтеза простациклина, брадикинина и окиси азота.
Эти изменения могут иметь решающее значение в повреждении эндотелиальной стенки и пропитывании липидами интимы крупных сосудов.
— Курение (вне зависимости от количества) Курение ассоциируется с дисфункцией эндотелия, являющейся пусковым фактором развития и прогрессирования атеросклероза. Кроме того, курение оказывает обратимое протромботическое влияние, повышая уровень фибриногена в крови и адгезию тромбоцитов, приводит к снижению уровня ЛПВП и повышению тонуса сосудистой стенки [3].
— Абдоминальное ожирение: объем талии (у мужчин> 94 см, у женщин> 80 см) или ИМТ ≥ 30 кг/м2 Избыточная масса тела способствует увеличению смертности от различныхзаболеваний, но в первую очередь от осложнений атеросклероза. Ожирение, считаясь самостоятельным ФР развития атеросклероза, способствует развитию дислипидемии, АГ, сахарного диабета (СД), которые также являются ФР развития атеросклероза [1].
— Сахарный диабет 1 или 2 типа, НТГ Для сахарного диабета чрезвычайно характерен процесс гликозилирования ЛП с образованием модифицированных форм ЛПНП и ЛПВП. Как и модифицированные ЛП, образующиеся в результате перекисного окисления липидов, гликозилированные ЛПНП отличаются меньшим сродством к специфическим рецепторам гепатоцитов, что, способствует уменьшению скорости элиминации ЛП. Гликозилированные ЛПНП вызывают также повреждение эндотелия, активируют проникновение моноцитов в интиму артерий, трансформацию макрофагов в пенистые клетки, а также пролиферацию гладкомышечных клеток, способствуя тем самым развитию атеросклероза [4].
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.