
Бесплатный фрагмент - Детский инсульт. Реваскуляризирующие и реконструктивные операции у детей с цереброваскулярной патологией
АВТОРСКИЙ КОЛЛЕКТИВ
Белоусова Ольга Бенуановна
Невролог, доктор медицинских наук, ведущий научный сотрудник сосудистого клинического отделения нейрохирургии ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Коршунов Антон Евгеньевич
Нейрохирург, кандидат медицинских наук, старший научный сотрудник детского клинического отделения ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Нагорская Ирина Андреевна
Медицинский психолог, кандидат психологических наук, медицинский психолог группы психиатрических исследований ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Лукшин Василий Андреевич
Нейрохирург, кандидат медицинских наук, старший научный сотрудник сосудистого клинического отделения нейрохирургии ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Львова Ольга Александровна
Детский невролог, доктор медицинских наук, доцент кафедры психиатрии ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, ведущий научный сотрудник лаборатории мозга и нейрокогнитивного развития ФГАОУ ВО «Уральский федеральный университет имени первого Президента России Б. Н. Ельцина».
Сазонова Ольга Борисовна
Нейрофизиолог, кандидат медицинских наук, ведущий научный сотрудник лаборатории клинической нейрофизиологии ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Шевченко Елена Викторовна
Нейрохирург, кандидат медицинских наук, младший научный сотрудник сосудистого клинического отделения нейрохирургии ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Шишкина Людмила Валентиновна
Патоморфолог, кандидат медицинских наук, заведующая лабораторией патоморфологии ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
Усачев Дмитрий Юрьевич
Нейрохирург, членкорреспондент РАН, доктор медицинских наук, профессор, заместитель директора по научной работе ФГАУ «НМИЦ нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России.
В книге представлены основные литературные сведения об этиологии, патогенезе, клинических проявлениях детского инсульта, методах обследования и тактике консервативного и хирургического лечения острой и хронической церебральной ишемии у детей, а также собственные исследования по диагностике и результатам консервативного и хирургического лечения детей с дебютом заболевания в возрасте от 1го дня жизни до 18 лет.
В книге обобщен опыт НИИ нейрохирургии им. акад. Н. Н. Бурденко и ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России.
Книга позволит широкому кругу специалистов педиатрического профиля получить представление об особенностях детского ишемического инсульта, его диагностики, принципах консервативного лечения и возможностях хирургического лечения патологии.
This book is about pediatric stroke. For this reason we have tried to include all the important issues involved both in current development and in controversy. The book represents the main literary information about the etiology, pathogenesis, clinical manifestations of pediatric stroke, methods of examination and tactics of conservative and surgical treatment cerebral ischemia in children; and the experience of Burdenko Neurosurgery Institute (66 patients, 91 operations) and Federal State Budgetary Institution of Higher Professional Education «Urals State Medical University» of the Ministry of Healthcare of the Russian Federation (162 patients) in conservative and surgical treatment of acute and chronic cerebral ischemia in children. The age varied from 0 to 18 years.
The aim of this monograph is to present a summary of the accumulated information to help readers understand pediatric ischemic stroke in clinical practice and basic research.
Список сокращений и условных обозначений
АГ — артериальная гипертензия
АД — артериальное давление
АСК — ацетилсалициловая кислота
БЦА — брахицефальные артерии
ВББ — вертебробазилярный бассейн
ВОЗ — всемирная организация здравоохранения
ВСА — внутренняя сонная артерия
ДЭП — дисциркуляторная энцефалопатия
ИИ — ишемический инсульт
ЗА — затылочная артерия
ЗМА — задняя мозговая артерия
ЗНМК — завершенное нарушение мозгового
кровообращения/завершенный инсульт
ЗСА — задняя соединительная артерия
ЛСК — линейная скорость кровотока
МНО — международное нормализованное отношение
МРАГ — магнитнорезонансная ангиография
МРТ — магнитнорезонансная томография
НАБИ — национальная ассоциация по борьбе с инсультом
НМК — нарушение мозгового кровообращения
НСА — наружная сонная артерия
ОНМК — острое нарушение мозгового кровообращения
ОСА — общая сонная артерия
ПВА — поверхностная височная артерия
ПМА — передняя мозговая артерия
ПС — пиальный синангиоз
ПЭТ — позитронноэмиссионная томография
СДВГ — синдром дефицита внимания и гиперактивности
СКТ или КТ — спиральная компьютерная томография
СКТАГ — спиральная компьютерная ангиография
СМА — средняя мозговая артерия
ССС — сердечнососудистая система
ТИА — транзиторные ишемические атаки
ТКУЗДГ — транскраниальная ультразвуковая
допплерография
ТМО — твердая мозговая оболочка
УЗИ — ультразвуковое исследование
ЦАГ — церебральная ангиография
ЦО — церебральная оксиметрия
ЦНС — центральная нервная система
ЧМН — черепномозговые нервы
ЭДАС — энцефалодуроартериосинангиоз
ЭДМС — энцефалодуромиосинангиоз
ЭИКМА — экстраинтракраниальный микрососудистый
анастомоз
ЭКГ — электрокардиография
ЭМС — энцефаломиосинангиоз
ЭхоКГ — эхокардиография
ЭЭГ — электроэнцефалография
ADP test — тест агрегации тромбоцитов
с аденозиндифосфатом
ASPI test — тест агрегации тромбоцитов
с арахидоновой кислотой
ASL — Arterial Spin Labeled
CPISR — Canadian Pediatric Ischemic Stroke Registry
MASGS — Modified Ashworth Scale of Grading Spasticity
MONICA — The World Health Organization’s Multinational
Monitoring of Trends and Determinants
in Cardiovascular Disease
NIHSS — National Institutes of Health Stroke Scale
Введение
Детский инсульт представляет собой одну наиболее обсуждаемых проблем современной медицины. Это связано, в первую очередь, с тем, что нарушение мозгового кровообращения (НМК) в детском возрасте встречается значительно реже, чем у взрослых, и потому мало изучено. В то же время, дети, перенесшие НМК, составляют существенную группу среди детейинвалидов. Это обуславливает необходимость более пристального изучения проблемы детского инсульта, особенно на фоне успехов консервативного и хирургического лечения инсульта у взрослого населения.
Спектр клинических проявлений детского инсульта достаточно широк — от легкой очаговой и изолированной общемозговой симптоматики до формирования значимого неврологического дефицита со склонностью к рецидивированию с последующей стойкой инвалидизацией и высоким риском летального исхода. Благодаря повсеместному распространению и техническому совершенствованию методов нейровизуализации детский инсульт диагностируется все чаще. Тем не менее, низкая осведомленность неврологов о проблеме НМК в детском возрасте, в том числе и о транзиторных ишемических атаках (ТИА), нередко приводит к трудностям в диагностике и, как следствие, к несвоевременной и недостаточной медицинской помощи. С учетом разнообразия причин, клинических проявлений и течения детского инсульта, затрудняется выбор тактики ведения пациентов, особенно в неврологических и нейрохирургических отделениях небольших городов, специалисты которых не обладают достаточным опытом по лечению этой патологии.
В книге представлены основные литературные сведения об этиологии, патогенезе, клинических проявлениях детского инсульта, методах обследования и тактике консервативного и хирургического лечения острой и хронической церебральной ишемии у детей, а также собственные исследования по диаг ностике и результатам консервативного и хирургического лечения детей с дебютом заболевания в возрасте от 1го дня жизни до 18 лет, полученные на базе НИИ нейрохирургии им. акад. Н. Н. Бурденко и ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России.
Книга позволит широкому кругу специалистов педиатрического профиля получить представление об особенностях детского ишемического инсульта, его диагностики, принципах консервативного лечения и возможностях хирургического лечения патологии.
Глава I.
Детский инсульт.
Общие сведения
В настоящее время показатель смертности от сосудистых заболеваний головного мозга в России — один из наиболее высоких в мире. Цереброваскулярная патология занимает одно из первых мест в ряду наиболее частых причин смертности и инвалидности и в экономически развитых странах. Многонациональный проект Всемирной Организации Здравоохранения (ВОЗ) по мониторингу тенденций и факторов, обусловливающих сердечнососудистые заболевания (The World Health Organization’s Multinational Monitoring of Trends and Determinants in Cardiovascular Disease — MONICA), определяет течение инсульта как «внезапно появившийся неврологический дефицит, который сохраняется более 24 часов, либо внезапная смерть». Это определение включает как ишемический, так и геморрагический инсульты [262].
Ишемический инсульт в детской популяции является редкой патологией по сравнению со взрослым населением. Инсульт случается у детей любого возраста [33]. Несвоевременный или ошибочный диагноз инсульта у детей — попрежнему достаточно распространенное явление [80; 104].
Описания отдельных клинических случаев нарушения мозгового кровообращения у детей встречаются в литературе, начиная с XVII века. Считается, что первым инсульт у ребенка описал Т. Willis в 1667 году. J. Wepfer (1658) упоминал больных детей, у которых гемиплегия появлялась и регрессировала в течение дня или быстрее [278]. Заболевание, обозначаемое термином «детская гемиплегия», было представлено в работах W. Osler (1889), B. Sachs и F. Peterson (1890) и S. Freud (1893) в серии пациентов детского возраста, перенесших инсульт. Только в 1927 году F. Ford и A. Schaffer публикуют первое систематизированное описание методов оценки и лечения детей с ишемическими инсультами. Авторы проанализировали этиологию детского инсульта, способы и результаты лечения, в дальнейшем влияющие на качество жизни [98]. V. Hachinski (1982) описывал неспецифические симптомы, такие как головную боль и обмороки [118].
Важно отметить, что многие проблемы, которые они выделяли, остаются актуальными и сегодня.
Несомненный интерес представляют работы M. Norman (1957), C. Fischer (1959), E. Frantzen (1961), E. Bickertaff (1964), J. Jackson (1970), J. Abraham (1971), W. Kannel (1972) об инсультах у детей, однако, и в этих публикациях не было упоминания о преходящих нарушениях мозгового кровообращения в детском возрасте [131]. В более поздних исследованиях отмечено, что преходящие нарушения мозгового кровообращения, или, в другой терминологии, транзиторные ишемические атаки (ТИА) у детей встречаются гораздо чаще, чем инсульты [209]. В 2006 году G. Ganesan с соавторами опубликовали статью по результатам ретроспективного (с 1978 по 1990г) и проспективного (с 1990 по 2000г) обследования детей, перенесших инсульт, с использованием нейровизуализации. Ими описано 212 пациентов, у 97 из которых первичный диагноз был поставлен неверно. У 79 детей было отмечено нарастание неврологического дефицита (29 инсультов, 46 ТИА, 4 летальных исхода от повторного инсульта), а при анализе последующих 5 лет у 51 ребенка (67%) были отмечены повторные эпизоды нарушения мозгового кровообращения [104].
Число публикаций на тему детского инсульта во всем мире растет из года в год. В последние годы в программе European Stroke Organization Congress появились образовательные семинары и тематические секции по этой проблеме (Ницца, 2014; Глазго, 2015; Барселона, 2016). Практические врачи за рубежом могут в настоящее время ориентироваться на два руководства: американское — «Management of Stroke in Infants and Children», выпущенное в 2008 году, и европейское — «Stroke and cerebrovascular disease in childhood», опубликованное в 2011 году в Лондоне [105; 267]. Таким образом, практические руководства, аккумулирующие результаты научных исследований и позволяющие принимать клинические решения, единичны и обновляются редко.
Отсутствие общепринятых международных рекомендаций или руководств затрудняет выбор тактики лечения и профилактики инсульта у детей. Низкая осведомленность неврологов педиатрического профиля о проблеме ишемических инсультов и ТИА нередко приводит к трудностям в диагностике и неадекватной терапии у пациентов детского возраста, а, следовательно, — и к несвоевременно оказанной и недостаточной помощи, что отмечали в своих работах В. П. Зыков (2008), F. Kirkham (2011), A. Mallick (2014). Основным недостатком представленных в литературе исследований является уточнение роли лишь отдельных состояний в качестве факторов риска, что, как правило, определялось специализацией исследовательской группы (инфекционисты, ревматологи, генетики, гематологи и т. д.). Малочисленность оцениваемых выборок детей в этих исследованиях, ограничение сбора данных определенной возрастной группой (младенцы, подростки и т. д.) затрудняло возможность обобщения полученных результатов в рамках всех возрастных групп.
1. Эпидемиология
Количество инсультов во взрослой популяции в Российской Федерации составляет около 500 000 случаев в год, средняя заболеваемость инсультом — 4,6 случая на 1000 населения в год (данные НАБИ, 2003).
Согласно данным литературы, средняя заболеваемость дет ским инсультом в мире варьирует в пределах 0,93–13 случаев на 100 000 населения в год [33]. По данным американской ассоциации сердечнососудистых заболеваний (American Heart Association & American Stroke Association, 2012), наибольшая частота инсульта отмечается в первый год жизни — примерно 1 случай на 4000 живорожденных [219]. Заболеваемость инсультом у детей в возрасте от 0 до 15 лет в США составляет 6,4 случаев на 100 000 детей [222]. На протяжении последних 10 лет эта цифра оставалась стабильной, но недавнее исследование показало, что частота заболевания в 3–4 раза выше, чем указывалось ранее [39].
M. Giroud с соавторами (Франция, 1995) сообщают, что частота НМК у детей до 16 лет достигает 13 случаев на 100 000 дет ского населения в год. Из них 7,9 случаев на 100 000 детей приходиться на НМК по ишемическому типу, а 5,1 случа ев — на НМК по геморрагическому типу [110].
По данным канадского педиатрического регистра ишемического инсульта (Canadian Pediatric Ischemic Stroke Registry — CPISR), в 2000 году этот показатель зарегистрирован на уровне 2,7 случая на 100 000 в год [160]. F. Kirkham с коллегами сообщили, что частота НМК у детей в Великобритании в 2004 году составила 13 случаев на 100 000 детского населения [143].
Таким образом, по различным данным, заболеваемость детским геморрагическим инсультом в возрасте от 1 месяца до 18 лет варьирует от 1,5 до 5,1 (в среднем — 2,9), ишемическим — от 0,6 до 7,9 случая на 100 000 населения в год. Приводятся также данные о процентном соотношении двух видов инсульта: 55% приходится на ишемические инсульты, а 45% — на геморрагические [77]. При этом показатель у новорожденных существенно выше при обоих вариантах НМК: 6,7 и 17,8 на 100 000 населения в год для геморрагических и ишемических типов ОНМК соответственно [11; 167; 215].
Приведенные цифры показывают, что в целом частота ишемического инсульта у детей выше, чем геморрагического, однако это различие не так велико, как у взрослых [8; 33; 40], что существенно отличает структуру НМК у детей.
Детская смертность от инсульта в США снизилась на 58% за период с 1979 по 1998 г. Считается, это снижение произошло за счет улучшения качества лечения, но не вследствие падения заболеваемости инсультом [149]. По последним данным, в США после инсульта умирают от 20 до 40% детей [219] и инсульт является одной из десяти ведущих причин детской смертности [68]; около 3000 детей и подростков (до 18 лет) перенесли инсульт в 2004 году [149]; риск инсульта от рождения до достижения 18 лет составляет почти 11 случаев на 100 000 детей в год [219]; у мальчиков инсульт встречается примерно в 1,3 раза чаще, чем у девочек [222]; у афроамериканских детей риск инсульта выше, чем у детей из Европы и Азии [222].
Летальность при инсульте у детей варьирует от 7 до 28% [100; 161], при этом она выше при геморрагических инсультах (до 40%), чем при ишемических (8–16%). Летальный исход обычно наступает в ранний восстановительный период, который полагают наиболее опасным для возникновения повторных острых сосудистых эпизодов и смерти пациента. Такие показатели у детей с ОНМК в целом сопоставимы со статистическими данными у взрослых. Однако уровень смертности в 10–40% может быть расценен как беспрецедентно высокий для педиатрической практики, что позволяет выделить инсульты в данной возрастной группе как одну из ургентных патологий, угрожаемых по фатальному нарушению витальных функций.
Официальная статистика заболеваемости детским инсультом в нашей стране отсутствует [33]. В литературе представлены сведения по отдельным территориям или учреждениям. Так, В. М. Делягин с соавторами (ФГУ «Федеральный научноклинический центр детской гематологии, онкологии и иммунологии», Москва) на примере одной из центральных областей России сообщили, что в период с 2006 по 2009 г. заболеваемость детей (без учета новорожденности) ОНМК составила от 0,93 до 1,1 случаев на 100 000 детей в год. При расчете числа детей и подростков с инсультами на общее количество детей, госпитализированных в многопрофильные детские стационары, частота инсультов составляет 3,5 на 1000 пациентов в год [7; 11], что соответствует данным зарубежных мультицентровых исследований. Из них 2,8 на 1000 пациентов в год составляют дети в возрасте от 0 до 11 лет, 0,7 на 1000 пациентов в год — в возрасте от 12 до 17 лет (подростки); средняя заболеваемость детским инсультом (от 1 месяца до 18 лет) — около 8 случаев на 100 000 населения в год. Смертность среди детей с НМК достигает 0,6 на 100 000 населения в год [8].
Те же авторы, проанализировав сведения о 143 пациентах с НМК в возрасте от 0 до 17 лет (медиана возраста 5 лет, мальчиков — 68 (48%), девочек — 75 (52%)), пришли к выводу, что все типы НМК встречаются одинаково часто как у мальчиков, так и у девочек. Исключения составляют ТИА — у девочек они зарегистрированы в 3 раза чаще. Авторы также отмечают высокий процент (13%) рецидивов инсультов у детей, при этом наибольший риск повторного НМК зафиксирован в первые 2 недели после дебюта заболевания [8].
По данным службы Скорой медицинской помощи г. Москвы, в 2012 году к детям и подросткам с диагнозом «ОНМК» совершено 157 выездов, а в 2013 — 179 [4].
Сотрудниками ФГБОУ ВО «Уральский государственный медицинский университет» проведен анализ инсульта у детей, живущих на территории Екатеринбурга (население 1,5 млн человек) и Свердловской области (4,5 млн человек). Оценены такие показатели как: частота регистрации инсультов по годам с 1995 по 2015 г.; заболеваемость за последние пять лет, в том числе у детей первого года жизни; особенности распределения по полу; частота летальных случаев и рецидивов у 162 детей с ИИ и 73 с ТИА.
Исследование проводилось в течение 10 лет. За этот период было организовано информирование неврологов педиатрического профиля города и области, которые активно направляли уже наблюдавшихся и вновь обратившихся детей с диагностированным ОНМК ишемического типа или с подозрением на этот диагноз. Мы полагаем, что практически все пациенты с ИИ или ТИА, дебют которых пришелся на детский возраст, были включены в эту базу данных, что позволяет относиться к этому исследованию, как к эпидемиологическому.
По полученным данным, заболеваемость за последние пять лет составила: 3,4 (2011 г.), 4,9 (2012 г.) и 4,9 (2013 г.), 4,6 (2014 г.) и 5,0 (2015 г.) на 100 000 детского населения в год. На рис. 1 показано общее число зарегистрированных детей с инсультом на указанной территории на протяжении последних 20 лет, начиная с 1995 года, когда появилась возможность нейровизуализации (КТ головного мозга) и постановки диагноза в неотложном режиме.
Необходимо подчеркнуть, что полученные показатели ближе к нижнему порогу приводимых в литературе значений (2–26,7 на 100 000 в год). В тоже время, отмечена отчетливая тенденция к нарастанию частоты регистрации инсульта у детей в исследуемом регионе, что в последнее десятилетие прослеживается по всем странам, регистрирующим заболеваемость ОНМК у детей.
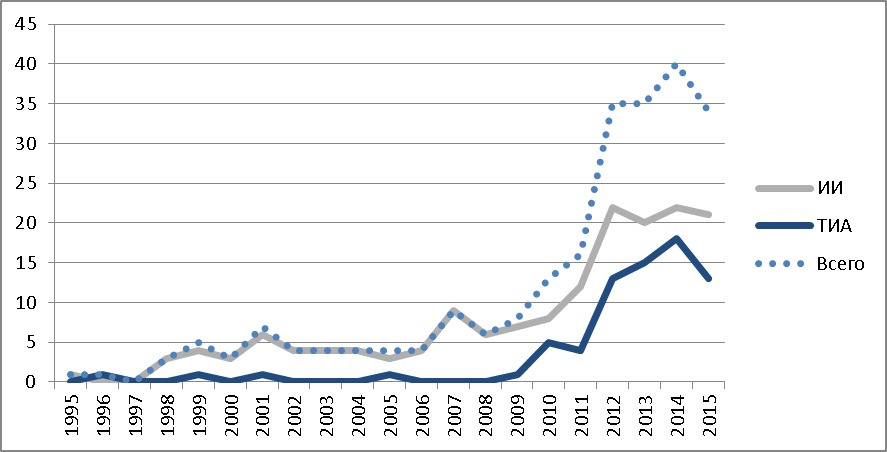
Средний возраст детей с ИИ в случае его манифестации в возрасте до года составил 19,5 ± 1,2 недель (нами выявлено 7 младенцев с фетальным /перинатальным дебютом ИИ), а в возрастной группе с дебютом в возрасте старше одного года — 6,2 ± 0,4 лет. Для ТИА этот показатель составил 11,8 ± 0,3 лет.
Распределение больных по полу было равномерным, и совпадало с литературными данными: мальчики с ИИ составили 62,7% (n=102), а с ТИА — 45,2% (n=33).
Средний риск развития повторного инсульта, по данным литературы, у детей составляет 20%, при этом у детей с одним выявленным фактором риска этот показатель находится в пределах 8%, при сочетании двух факторов и более — нарастает в геометрической прогрессии и достигает 42% [145; 148].
По данным ФГБОУ ВО «Уральский государственный медицинский университет», рецидивирование также зафиксировано на уровне 14,2% (n=23) и 70,4% (n=50) для ИИ и ТИА соответственно. Средняя частота повторных ИИ была
1,6 ± 1,1 (1–2 эпизода ИИ в сочетании с 2–19 случаями ТИА), средняя частота ТИА — 3,4 ± 0,5 случаев (от 2 до 20 эпизодов). Полагают, что именно невысокий уровень распознаваемости ОНМК в детском возрасте приводит к отсутствию своевременного и полноценного обследования, постановки верного диагноза и своевременного применения мер вторичной профилактики. Так, например, зарегистрирован больной, который перенес 6 ТИА и 2 ИИ прежде, чем был проведено полноценное обследование и установлен диагноз болезни моямоя.
Инвалидность присвоена 61,2% (n=90) и 9,1% (n=4) больных из 125 и 62 детей с ИИ и ТИА соответственно, чей катамнез был известен. Стоит отметить, что инвалидность в группе детей с ТИА была обусловлена не неврологическим дефектом: двое детей имели доказанную болезнь моямоя, один — хроническую почечную недостаточность, один — врожденный порок сердца.
Летальность в группе детей с ИИ составила 3,3% (n=4, 2 маль чика и 2 девочки); все пациенты, перенесшие ТИА, были живы на момент последнего катамнестического визита (минимум 2 года наблюдения).
Таким образом, данные литературы и результаты ограниченных эпидемиологических исследований в России позволяют заключить, что ишемические инсульты в педиатрической практике являются относительно редкой патологией, однако для нее характерны высокая частота рецидивирования, инвалидности и летальности.
2. Классификации детского инсульта
Как уже сказано выше, соотношение геморрагического и ишемического инсультов у детей существенно отличается от взрослой возрастной группы. Единого мнения о соотношении этих вариантов у детей не существует. По всей видимости, преобладание ишемического или геморрагического типа ОНМК в каждом новом исследовании обусловлено профилем специализации и видом оказания помощи в лечебнопрофилактическом учреждении.
Существуют также расхождения в определении варианта инсульта у ребенка. Так, в отечественном научном сообществе так и не сложилось единого мнения, могут ли перивентрикулярная ишемия, внутрижелудочковые и субарахноидальные кровоизлияния в качестве морфологического субстрата перинатального поражения нервной системы у младенцев считаться эквивалентами ишемических или геморрагических типов ОНМК (по аналогии с взрослыми пациентами). Авторы зарубежных клинических руководств по диагностике и лечению инсульта указывают, что исключали младенцев с такими очагами из анализируемых источников литературы. По приводимым эпидемиологическим показателям также становится очевидным, что исследователи не включали пациентов с перинатальной энцефалопатией в сферу своего рассмотрения [183; 107; 146; 220; 280].
Хорошо известно, что ишемический инсульт классифицируют как:
• завершенный инсульт — нарушение мозгового кровообращения, в результате которого формируется стойкий неврологический дефицит; при при спиральной компьютерной томографии (КТ) и магнитнорезонансной томографии (МРТ) головного мозга обнаруживаются очаги ишемического поражения мозговой ткани;
• малый инсульт — острое развитие неврологического дефицита с последующим полным регрессом в течение 2–3 не дель; при КТ и МРТ головного мозга могут выявляться небольшие ишемические очаги;
• прогрессирующий инсульт или инсульт в ходу — острое развитие церебральной ишемии, сопровождающаяся постепенным нарастанием неврологического дефицита на протяжении нескольких дней.
Отдельная нозологическая форма ОНМК — транзиторные ишемические атаки (ТИА), которые характеризуются внезапным развитием неврологического или ретинального дефицита ишемического характера, соотносимого с бассейном определенной артерии, который полностью регрессирует в течение 24 часов. ТИА встречаются значительно чаще, чем инсульты. По частоте ТИА подразделяют на редкие (1–2 раза в год), средней частоты (3–6 раз в год), частые (1 раз в месяц и чаще) [17]. ТИА могут быть проявлением хронической церебральной ишемии (недостаточности) с высоким риском развития в последующем обширного ИИ. Таким образом, ТИА можно считать «предвестником» ИИ.
Международная терминология, используемая при описании детского инсульта, включает следующие понятия:
1. фетальный инсульт (пренатальный, внутриутробный) — до рождения ребенка;
2. перинатальный инсульт (при развитии заболевания в период с 28й недели гестационного возраста по конец первого месяца после рождения);
3. детский инсульт — в возрасте от 1 месяца после рождения до 18 лет [37; 148].
В настоящее время у детей предлагают выделять следующие патогенетические типы ишемического инсульта: гемодинамический, метаболический, эмболический, окклюзионный.
Общепринятой и признанной всеми специалистами классификации НМК у детей не существует. Выше нами приведены классификация, учитывающая возраст, на который пришелся дебют инсульта.
В периодизации самой болезни отечественные специалисты предпочитают опираться на временные рамки, сформированные во взрослой практике.
Группы экспертов предпринимают попытки предложить патогенетические варианты классификации детского инсульта, однако дальше обсуждений не продвигаются. Так, предлагают анатомическую классификацию CASCADE (Childhood AIS Standardized Classification and Diagnostic Evaluation), учитывающую локализацию и/или источник тромбоза/эмболии артерий головного мозга (мелкие церебральные артерии, крупные церебральные артерии, аорта и артерии шеи, сердце) [57]. Разработка классификации CASCADE имела целью создать аналог TOAST (Trial of ORG 10172 in Acute Stroke Treatment), принятый во взрослой практике, что практически удалось [76]. Однако, критерии, приведенные в ней трудно или фактически не выполнимы: например, они подразумевают гистологическое подтверждение изменений в церебральных сосудах. Также существенным недостатком данной классификации считается игнорирование в ней эмболического варианта ИИ и тромбофильных состояний.
3. Этиопатогенез и факторы риска
Детский инсульт гетерогенен по этиопатогенезу. Если инсульты у взрослых чаще всего обусловлены атеросклерозом брахиоцефальных артерий (БЦА) [26; 27], то этиология инсультов у детей разнообразна и сложна [40]. В литературе приводится довольно полный перечень болезней и синдромов, которые сопряжены с риском церебральной ишемии в детском, подростковом и молодом возрасте. По данным американской ассоциации сердечнососудистых заболеваний (American Heart Association & American Stroke Association, 2012) у половины всех детей, перенесших инсульт, имелись факторы риска [219].
Мультифакторность и разнообразие этиологии подразумевает широкий круг специалистов, которые должные иметь «инсультную» настороженность в своей повседневной практике.
Болезни сердца (врожденные и приобретенные) — один из наиболее значимых факторов риска, составляющий примерно 20–30% от причин ишемических инсультов детского возраста [161]. В патогенезе кардиоэмболического варианта ишемического инсульта имеет значение сочетание эмболий из левых отделов сердца (или парадоксальная эмболия при сбросе крови справа налево) и декомпенсации сердечной деятельности [1; 7; 22; 52]. Описаны случаи парадоксальной эмболии в сосуды головного мозга у детей и лиц молодого возраста на фоне дефекта межпредсердной перегородки, открытого овального окна, при артериовенозных мальформациях сосудов легких, нейрокожных синдромах [280]. При рассмотрении данной проблемы вновь привлекли внимание малые аномалии развития сердца. У лиц с неясной этиологией инсульта рекомендуют в первую очередь исключать открытое овальное окно, пролапс митрального клапана и аневризму предсердной перегородки в качестве источников скрытой или парадоксальной эмболии [1; 52; 56; 38]. В литературе приводят данные, что у 25% пациентов с митральным стенозом при проведении нейровизуализации выявляют «немые» инфаркты мозга. Также клинически «молчащие» ишемические очаги в мозговой ткани зафиксированы у 20% новорожденных с пороками сердца на дооперационном и у 17,4% на послеоперационном этапах [63; 181; 221]. В настоящее время проведено несколько исследований, в которых предприняты попытки прогнозирования инсульта у грудных детей с врожденными пороками сердца. Показана значимая роль продолжительности и степени гипоксии новорожденного, проведения реанимационных мероприятий, недоношенности, длительности ожидания оперативного вмешательства как факторов риска ОНМК на до и послеоперационных этапах [62; 112; 161; 181; 183; 210].
Нарушения сердечного ритма, в отличие от взрослых, считают очень редкой причиной инсультов в детском и молодом возрасте. Тем не менее, ее все же стоит иметь в виду у детей с гипертиреозом, ревматическими пороками сердца, после оперативных вмешательств и в структуре синдрома Кирнса–Сейра.
Кардиомиопатия как проявление системных заболеваний встречается при врожденных миопатиях (Дюшенна, Беккера, Эмери–Дрейфуса и пр.), атаксии Фридрейха, митохондриальных болезнях. При этой патологии возможен как эмбологенный, так и гемодинамический варианты ишемического инсульта. В ряде случаев возможно одновременное развитие инфаркта миокарда и инсульта, что указывает на общность патогенетических процессов, ведущих к неадекватной перфузии [7].
Гиперкоагуляционные состояния в настоящее время признаны наиболее частыми причинами ишемических инсультов детского возраста, их вклад достигает 87% [3; 16; 138; 144; 170; 265]. Однако, до сих пор не разработано общепризнанного протокола для скрининга на тромбофильное состояние у ребенка с НМК, а часть исследователей оспаривает роль мультигенных тромбофилий как фактора риска инсульта и ТИА у детей [82; 121; 142; 184; 194; 282].
В последнее десятилетие описано большое количество тромбофильных однонуклеотидных генных полиморфизмов. Наиболее клинически значимыми считают носительство проакцелерина, протромбина, ингибитора активатора плазминогена и фибриногена [61; 138]. Генотипы F5: 1691 G> A и АА (мутация Лейден), а также F2: 20210 G> A и АА в настоящее время являются единственными, протромботическое действие которых доказано у новорожденных. Кроме того, есть основание полагать, что степень риска при носительстве тромбогенных мутаций и полиморфизмов у детей различается в соответствии с возрастом [5; 56; 138].
В настоящее время не подвергается сомнению связь гипергомоцистеинемии и мутации MTHFR677C> T с цереброваскулярными нарушениями и сердечнососудистыми заболеваниями [5; 16; 61; 280]. Гомоцистеин выступает как протромботический фактор за счет активации XII и V факторов свертывания, усиления экспрессии тканевого фактора, подавления экспрессии тромбомодулина. Кроме того, повышение уровня гомоцистеина в крови приводит к повреждениям эндотелия сосудов, что проявляется нейротоксическим и проатеросклеротическим воздействиями, а также способствует возникновению резистентности к активированному протеину С [3; 31; 66; 267; 276; 290]. За последние годы была доказана роль гипергомоцистеинемии при повреждении стенки сосудов, его протромботическое и проатеросклеротическое действие, влияние на сосудодвигательную регуляцию [3; 32; 290].
Ген фермента MTHFR обеспечивает метаболизм гомоцистеина с участием фолиевой кислоты. Наибольшую практическую значимость имеет однонуклеотидная замена цитозина на тимин в 677 положении гена, приводящая к замене аминокислотного остатка аланина на валин в каталитическом центре фермента метилентетрагидрофолатредуктазы (MTHFR). Индивиды, гомозиготные по данной аллельной мутации, демонстрируют снижение активности фермента на 60–70%, гетерозиготные — на 35% [28; 159; 275]. Следует отметить, что все имеющиеся данные касаются либо фундаментальных аспектов изучения патологии, либо популяции взрослых пациентов.
У детей, по данным литературы, отмечают наличие положительной корреляционной связи между частотой инсультов (особенно у мальчиков) и полиморфизмом С677Т. Сочетание нескольких вариантов генов сопровождается прогрессивным нарастанием уровня гомоцистеина в крови и увеличивает риск НМК [61; 142; 229; 255; 269; 289]. В то же время, ряд генных полиморфизмов, контролирующих работу фолатного цикла, показали свою протективную функцию в отношении цереброваскулярной патологии в азиатской и европейской популяциях [82; 142]. Несмотря на непрямые взаимоотношения фено и генотипа гипергомоцистеинемии, мнение исследователей единодушно: определение уровня гомоцистеина и состояния генов фолатного цикла должны стать неотъемлемым компонентом диагностического комплекса в этой группе больных, особенно у мальчиков (класс II, уровень рекомендации В) [280].
В литературе описываются единичные клинические случаи тромбоза БЦА у детей. Общей статистики по окклюзиям ОСА, ВСА и СМА в детской популяции нет ни в отечественной, ни в зарубежной литературе. Впервые M. Fisher в 1951 году описал этапы формирования посттромботической окклюзии ВСА у взрослых с гемодинамическими и эмболическими механизмами ишемического инсульта, проанализировав ангиограммы больных с НМК [96]. Посттромботические окклюзии магистральных артерий головы и шеи у детей в структуре причин НМК занимают от 13 до 37%.
Провоцирующих факторов, способных ухудшить гемореологическую ситуацию или снизить атромбогенные свойства сосудистой стенки, в детском возрасте более чем достаточно. Неблагополучное течение периода послеродовой адаптации, инфицирование, микротравматизация, метаболические нарушения могут выступить в роли триггерных факторов и привести к острой церебральной ишемии на фоне носительства однонуклеотидных полиморфизмов в генах тромбофильного спектра и в генах, контролирующих работу ферментов фолатного цикла. У детей с НМК (особенно при дебюте в перинатальный период) рекомендуют проводить поиск протромботических мутаций, даже при идентификации других причин ОНМК (класс IIа, уровень рекомендации C) [107; 280]. В тоже время, обнаружение тромбофильных полиморфизмов не является абсолютным фактором, неизбежно ведущим к тромбозам. Следует обращать внимание на количество выявленных однонуклеотидных мутаций, факт гомозиготного носительства, варианты ген — генные сочетания и их фенотипические проявления [5; 121; 286].
Если гипергомоцистеинемия как фактор риска тромбообразования в нетипичном возрасте не вызывает сомнений у исследователей, то атеротромботический вариант НМК является казуистикой для педиатрической практики. Такие варианты описаны в единичных случаях и ассоциированы с доказанными генетически детерминированными дислипидемическими синдромами [165; 167; 189], большинство из которых протекает бессимптомно [54]. Тем не менее, селективный скрининг и мониторинг липидного обмена предлагают проводить пациентам, имеющим семейную историю раннего дебюта сосудистых заболеваний, а также тем, у кого причина инсульта остается неясной [111; 239].
Значимость инфекционного процесса, в качестве разрешающего фактора, на фоне которого разворачивается острая цереброваскулярная недостаточность, велика как у новорожденных (до 17,6% среди всех причин), так и у пациентов более старшего возраста (до 40,7%) [60; 63; 223; 226; 280]. Клиническое исследование показало значение короткого срока (до 4х недель) и факта «малых» инфекций как независимого фактора риска, повышающих вероятность ОНМК ишемического типа в 4,6 раз [43; 240]. При анализе инсультов неустановленной этиологии отмечено, что незадолго до инсульта дети болели ветряной оспой в 3 раза чаще, чем в популяции; вероятность инсульта в первые четыре месяца после ветряной оспы также оставалась высокой [157; 160]. Кроме того, исследование в 2006 году показало, что риск повторного инсульта у детей с ранее выявленным иммунодефицитом возрастает в 20,9 раз и напрямую коррелирует с уровнем лейкоцитов в острый период болезни. Полагают, что хроническая инфекция и иммунодефицит вносят свой вклад в развитие повторных случаев НМК у детей так же, как у взрослых [108].
Не исключено, что инфекционный процесс в нервной системе протекает по механизму васкулита. В настоящее время проводится исследование VIPS (The vascular effects of infection in Pediatric Stroke Study), по гипотезе которого присутствие инфекционного агента запускает эндотелиальную дисфункцию, системный воспалительный процесс, что при сочетании с недостаточностью соединительной ткани и протромботической настроенностью приводит к повреждению стенки сосудов, ее диссекции, тромбообразованию, окклюзии просвета сосуда и церебральной ишемии [13; 101; 127]. В дальнейшем возможна эмболия из места расслоения стенки артерии, а также геморрагическая трансформация ишемического очага [13; 16; 101]. Кроме того, при тяжелых соматических заболеваниях, помимо васкулита возможны геморрагические осложнения вследствие коагулопатии [54; 55]. В настоящее время нет четких диагностических критериев церебрального васкулита у детей, чтобы с уверенностью утверждать, что именно это заболевание стало причиной НМК [13]. Предлагают иметь в виду возможность васкулопатии в качестве наиболее вероятной этиологии НМК во всех случаях ТИА, и всегда — у пациентов детского или молодого возраста, особенно, при отсутствии очевидных факторов риска [22; 55; 168].
У детей с ОНМК в раннем периоде жизни нельзя не учитывать патологическое течение перинатального периода, что может выступить в качестве одного из провоцирующих факторов [105; 280]. Ухудшение гемореологической ситуации, изменение уровня артериального давления, эндотелиальная дисфункция, системный воспалительный ответ и другие патологические процессы, запускаемые перинатально обусловленной гипоксией, инициируют гиперкоагуляционное состояние и тромбоз различной локализации. В свою очередь, каскадный механизм микротромбообразования влияет на перфузионную ситуацию в месте тромбоза, поддерживая гипоксию, запуская некротические и апоптотические механизмы гибели нервной клетки. Кроме того, неблагополучное течение периода адаптации к новым условиям жизни у младенцев с комбинированным поражением центральной нервной системы и внецеребральной патологией могут стать основой причиной недостаточного кровоснабжения церебральных структур со снижением цереброваскулярных резервов [13; 19; 90; 223; 230]. Безусловно, что сам по себе процесс приспособления плода и новорожденного к новым условиям существования является физиологическим, однако заболевания женщины до и во время беременности, в совокупности с естественным фоном гиперкоагуляции беременной, создают повышенную вероятность развития у новорожденных и детей раннего возраста как ишемии, так и кровоизлияния в церебральные структуры на всех этапах до и послеродовой адаптации [25; 90; 140; 163]. К дополнительным факторам риска относят внутриутробную инфекцию, травму головы и шеи, системные заболевания кишечника, аутоиммунные заболевания, обезвоживание, бесплодие в анамнезе матери, преждевременный разрыв плодных оболочек, материнскую преэклампсию [22; 34; 219]. Отягощенный перинатальный анамнез встречается у каждого четвертого пациента и более ассоциируется с неонатальным и фетальным инсультом, нежели с ОНМК в старшей возрастной группе [34; 223].
Радиационноиндуцированные васкулопатии с последующим стенозированием или окклюзией сосуда чаще всего наблюдаются у пациентов с опухолями головного мозга. Недавнее исследование показало, что примерно у 6% детей с опухолями центральной нервной системы после проведения курсов лучевой терапии были отмечены рентгенологические признаки инсульта [92].
Одной из причин нарушения кровоснабжения головного мозга у детей является цереброваскулярная патология.
В настоящее время многие авторы приходят к выводу о настоятельной необходимости более детально обследовать детей на наличие цереброваскулярных заболеваний. В ситуациях, требующих компенсации за счет перераспределения кровотока (например, в ходе длительного вынужденного положения головы) решающую роль могут сыграть анатомические особенности магистральных артерий головы и шеи, а также сосудов основания мозга, которые и у здоровых людей встречаются нередко (незамкнутый виллизиев круг, гипоплазии отдельных сегментов или целых артерий, стеноз/окклюзия артерий, патологическая деформация ВСА) [7; 12; 30; 108].
Преобладание в структуре инсульта молодого возраста ишемических нарушений, которым, как правило, предшествует хроническая цереброваскулярная недостаточность, требует всестороннего изучения возрастных особенностей функционирования цереброваскулярной системы. Физиология кровоснабжения головного мозга у детей принципиально не отличается от взрослых. Так, головной мозг составляет лишь 2% от всей массы тела человека, но получает около 20% объема крови во время сердечного выброса, и потребляет 20% кислорода. Адекватный мозговой кровоток, достаточный для поддержания нормальной жизнедеятельности головного мозга, составляет в среднем 45–60 мл/100 г мозговой ткани в минуту. Полноценная деятельность мозга зависит от регулярного и адекватного кровоснабжения ввиду его высокой метаболической активности и отсутствия какихлибо значительных энергетических запасов. Состояние недостаточного мозгового кровотока, что известно как церебральная ишемия, может быть как острым, так и хроническим; может носить как локальный, так и распространенный характер. При снижении кровотока до 20–35 мл/100 г/мин падает электрическая активность мозга, но изменения мозговой ткани носят обратимый характер. Это состояние часто характеризуют термином penumbra — ишемическая полутень. При снижении мозгового кровотока до 10–15 мл/100 г/мин развиваются необратимые изменения в мозговой ткани. Данный процесс приводит к гибели клеток (инфаркт мозга). Вовремя восстановленный адекватный мозговой кровоток играет важную роль в лечении определенной группы пациентов с хронической ишемией головного мозга, обусловленной патологией магистральных сосудов головного мозга [92]. Изучение цереброваскулярных нарушений может оказаться связующим звеном между цереброваскулярной патологией у детей и развитием в последующем инсультов у взрослых.
Анатомия брахицефальных артерий индивидуально вариабельна. Как у детей, так и у взрослых, виллизиев круг сформирован правильно всего в 18–20%. Многие авторы считают, что анатомия сосудов мозга не зависит от пола, возраста и расовой принадлежности [89; 150]. По мнению других авторов, у детей, в основном в младшей возрастной группе, определяются анатомофизиологические особенности БЦА и интракраниальных артерий. Так, коллатерали между НСА и ВСА через a. ophtalmica сформированы только у 17–22% детей [173]. Морфометрические параметры ВСА у детей школьного возраста с 7 до 18 лет увеличиваются. Увеличение морфометрических показателей общих сонных артерий происходит скачкообразно. У девочек максимальный прирост происходит раньше, чем у мальчиков [6].
Более столетия назад в литературе уже упоминалось об анатомических особенностях строения ВСА — извитости, перегибе и петлеобразовании. Многие анатомы описывали изогнутую деформированную ВСА. W. Coulson (1852), вероятно, впервые упомянул о петлеобразовании ВСА как о «пульсирующей опухоли на шее». Первыми связь патологических деформаций с повышенным риском развития НМК отметили
M. Riser и соавторами в 1951 году [218]. F. McDowell и соавторы (1959) сообщили о 20 случаях патологической извитости ВСА и нарушениях кровотока по ним при изучении 68 пациентов с цереброваскулярной патологией у взрослых старше 30 лет, у которых не найдено доказательств окклюзии, что подтверждалось ангиографией [92]. H. Metz с соавторами (1961) провели ретроспективное исследование 1000 ангиограмм и обнаружили 161 случай с перегибами и петлеобразованием ВСА, в том числе, у детей в возрасте до 10 лет [182]. В 1965 году J. Weibel и W. Fields, описав 2453 ангиограмм, выявили высокую встречаемость данной особенности анатомического строения в популяции — до 10–15% случаев [274]. N. Sarkari с соавторами (1970) впервые описали 8 детей с патологической извитостью ВСА в сочетании с хронической церебральной ишемией, 7 из которых были младше 10 лет [228].
Развитие современных методов диагностики привело к более частому обнаружению деформаций ВСА в популяции. По данным УЗИ, частота выявления извитостей ВСА достигает 25–30% у взрослых, 43% у детей (R. Hobson, 2004). По данным других авторов (E. Ballota с соавторами (2005), G. La Barbera и др. (2006), W. Perdue с соавторами (1975), C. TogayIsikay с соавторами (2005) патологические деформации встречаются в 10–40%, в зависимости от изучаемой популяции.
По мнению W. Fisher (1982), хирургическое лечение цереброваскулярной недостаточности у детей необходимо в случаях, когда изменения ВСА могут привести к прогрессированию неврологического дефицита. Автор также указывает, что цереброваскулярная недостаточность у детей является серьезной проблемой, так как неадекватная перфузия мозговой ткани приводит к необратимым изменениям с дальнейшим формированием неврологического дефицита. Наиболее частыми причинами, ведущими к цереброваскулярной недостаточности, по его мнению, являются следующие изменения ВСА: 1) врожденная патологическая извитость (кинкинг), 2) посттравматические изменения с тромбозом, аневризмой и эмболией и 3) тромбозы [97].
Причинами НМК у детей могут также стать: болезнь моямоя, фиброзномышечная дисплазия, диссекция артерии [8; 20]. Все вышеперечисленные заболевания приводят к стенозированию либо окклюзии просвета сосуда [213].
Фиброзномышечная дисплазия является одной из причин патологической деформации ВСА и детского инсульта. Патоморфология фиброзномышечной дисплазии характеризуется появлением участков гиперплазии соединительной ткани, неравномерной атрофией мышечных волокон их дегенеративными изменениями сосудистой стенки. Все это приводит к формированию участков стеноза, которые чередуются с постстенотическими аневризмами. Такой вариант поражения брахиоцефальных сосудов может быть изолированным и генерализованным; чаще — односторонним, но не исключается и двустороннее поражение [211].
Постоянное воздействие вектора силы артериального давления на диспластичную стенку сосуда ранее обсуждалось как наиболее провоцирующий фактор формирования патологической извитости ВСА [145]. В 1961 году H. Metz предложил свою классификацию деформаций ВСА. Автор предположил, что выраженность процесса зависит от диспластических изменений сосудистой стенки и конфигурации сосуда, и, таким образом, разделил септальные стенозы ВСА на три типа:
I тип: перегиб артерии под углом более 60°(рис. 2 А);
II тип: перегиб артерии под углом от 30° до 60°(рис. 2 Б);
III тип: острый перегиб артерии под углом менее 30°(рис. 2 В) [182].
В 1974 году О. В. Воронин выделил три группы патологических деформаций: петлеобразование; образование артериями острого угла; извитость артерии без четкого углообразования. В 2001 году П. О. Казнанчян с соавторами, на основании 250 наблюдений, разделили патологические деформации на следующие основные группы:
1. C или Sобразная извитость;
2. удлинение артерии и перегиб артерии под углом менее 90°(ангуляция), вызывающие локальный стеноз магистральной артерии;
3. патологическая петлеобразная или спиральная извитость, а также узлообразование (до 360°);
4. сочетание различных деформаций [12].
В настоящее время активно используется модифицированная классификация по J. Weibel — W. Fields и H. Metz:
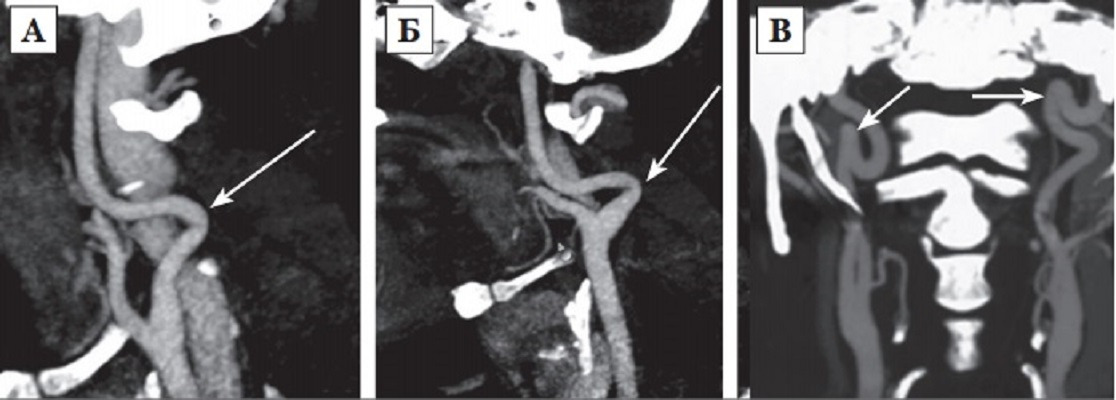
1. Извитости: C и Sобразное удлинение ВСА или деформация по ходу ВСА (рис. 3 А, Б);
2. Незначительная деформация: углообразование или перегиб между двумя сегментами ВСА с формированием петли под углом более или равным 60°, вызывающие локальный стеноз магистральной артерии (рис. 2 А);
3. Умеренная деформация: углообразование или перегиб между двумя сегментами ВСА с формированием петли под острым углом равным 30 — 60°, вызывающие локальный стеноз магистральной артерии (рис. 2 Б);
4. Выраженная деформация: углообразование или перегиб между двумя сегментами ВСА с формированием петли под острым углом менее 30°, вызывающие локальный стеноз магистральной артерии (рис. 2 В);
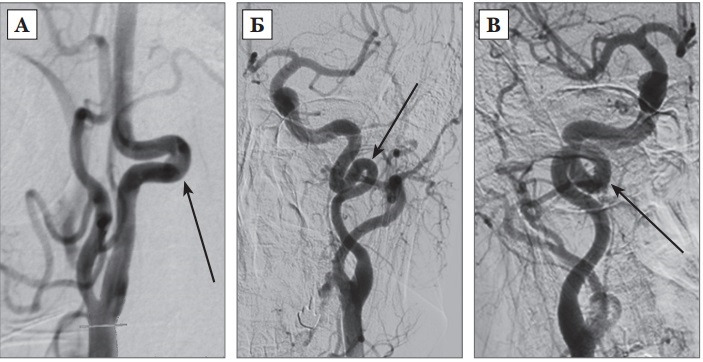
5. Петлеобразование или узлообразование: избыточность длины ВСА, формирующая выраженную Sобразную извитость или кольцевую конфигурацию, при которой в процесс вовлечены более чем два сегмента ВСА, располагающихся в разных плоскостях (рис. 3 В) [264].
Другой важной характеристикой деформации является ее гемодинамическая значимость, которая определяется по степени прироста линейной скорости кровотока (ЛСК) в области деформации вследствие ее локального сужения, что отражает степень выраженности септальных стенозов и перекрута артерии без признаков дистальной гипоплазии и снижения объемного кровотока по деформированной артерии. Извитость рассматривается, как гемодинамически значимая при увеличении ЛСК в области деформации более 170 см/сек (умеренная значимость). Повышение ЛСК более 250 см/сек рассматривается как выраженная гемодинамическая значимость, а более 300–350 см/сек с наличием турбулентного шума — как грубая [26].
По литературным данным, прямой ход магистральных сосудов отмечен у 65–70% индивидуумов, сосудистые деформации — у 23–40%, в том числе, патологические гемодинамически значимые извитости — около 9–16% случаев. По данным J. Weibel и W. Fields (1965) С или Sобразный ход сосуда с удлинением, примерно, на 4 см встречается в два раза чаще с одной стороны, чем с двух сторон. Другие виды патологических деформаций выявляются одинаково часто, независимо от пола и возраста, при этом односторонние патологические деформации также встречаются в два раза чаще, чем двусторонние [14; 20]. Гемодинамически значимые патологические извитости служат причиной, как острых нарушений мозгового кровообращения, так и хронической цереброваскулярной недостаточности. В процессе роста ребенка возможно полное нивелирование патологической извитости ВСА, либо «выпрямление» артерии, что сопровождается восстановлением или улучшением кровотока и регрессом неврологических нарушений [14].
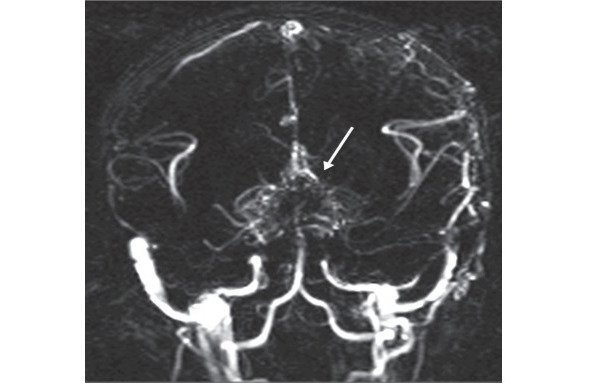
Болезнь моямоя — редкое заболевание [208], характеризующиеся прогрессирующим спонтанным стенозом или окклюзией супраклиноидного отдела ВСА (одной или обеих) на уровне сифона и начальных сегментов передней мозговой артерии (ПМА) и средней мозговой артерии (СМА) с последующим вовлечением ВББ. Характерно вторичное образование анастомотической капиллярной сети на основании мозга, которое напоминает при ангиографическом исследовании облачко дыма (рис. 4), что пояпонски звучит как моямоя. Это слово и стало официальным названием заболевания. В 40% случаях при болезни моямоя отмечается билатеральное поражение ВСА, при первоначальном вовлечении ВСА c одной стороны [233; 285]. Термин «синдром моямоя» чаще применяется для ангиографического описания патологии [266].
По данным различных источников, термин «моямоя» впервые был использован A. Takeuchi и J. Suzuki в 1969 году [254]. По другим данным, открытие этого заболевания относится к более раннему периоду, когда в 1937 году K. Shimizu в Японии была внедрена техника каротидной ангиографии [205].
Вскоре после Второй мировой войны этот вид исследования стал активно использоваться нейрохирургами, что позволило диагностировать и изучать болезнь моямоя. При этом выяснилось, что эта патология часто встречается в странах ЮгоВосточной Азии. Исследовательские работы A. Takeuchi, K. Shimizu (1957), N. Moriyasu (1964), T. Kudo (1968), J. Suzuki и A. Takaku (1969) внесли большой вклад в узнавание и изучение болезни во всем мире.
Было показано, что самый высокий уровень заболеваемости моямоя в мире регистрируется в Японии — 4–5 случаев на 100 000 населения в год. Для сравнения, за 2005 год в Америке заболеваемость моямоя составила 0,086 случаев на 100 000 населения [266]. R. Smith и J. Scott (2012) утверждают, что заболевание моямоя у детей в Америке встречается редко — 1 случай на 1 000 000, и становится причиной 6% всех детских инсультов [243]. По данным различных европейских клиник, за последние 5–6 лет количество пациентов, особенно детей, с болезнью моямоя в Европе увеличилось и продолжает расти [139]. Возможно, такая тенденция связана с улучшением диагностики цереброваскулярных заболеваний, однако этот вопрос мало изучен. Наблюдается некоторое преобладание заболеваемости у женщин (соотношение женщин и мужчин составляет 1,6:1).
I. Ahn и соавторы (Корея, 2014) проанализировали статистические данные с 2007 по 2011 год. В 2011 году общее число пациентов с болезнью моямоя в Корее составило 8154 человек, заболеваемость с 2007 по 2011 год зарегистрирована на уровне 2,3 на 100 000 человек, а в 2011 году — 16,1 на 100 000 человек; соотношение женщин и мужчин составило — 1,8:1 [41].
В России публикации об этом заболевании единичны [15; 18; 29]. Болезнь моямоя имеет два возрастных пика клинической ма нифестации: первый приходится на детей в возрасте 5–10 лет, второй — на возраст 30–40 лет [258; 266]. Патологический процесс наиболее активен примерно до возраста 10 лет, примерно к 20ти годам стабилизируется [208; 270].
Этиология заболевания активно обсуждается, но пока неизвестна [208]. Предполагается, что болезнь моямоя может быть как врожденной, так и приобретенной [133]. Наблюдается ассоциация с другими системными и несистемными заболеваниями (синдром Дауна, нейрофиброматоз I типа, аутоиммунные заболевания, туберозный склероз, атеросклероз, фиброзномышечная дисплазия, талассемия и серповидноклеточная анемия, заболевания щитовидной железы), а также с радиационной терапией глиом основания черепа у детей, с черепномозговой травмой [135; 175; 224; 234; 270].
Наследственные факторы играют важную роль в болезни моямоя [196; 277]. Известны семейные случаи заболевания. По некоторым данным, заболевание имеет семейный характер примерно у 15% больных. В связи с этим на протяжении последних лет ведутся попытки найти генетическую основу заболевания. Опубликованы данные по выявлению локусов ассоциированных с болезнью моямоя на 3, 6, 8, и 17 хромосомах. В 2008 году опубликованы данные о аутосомнодоминантном наследовании (ген картирован на хромосоме 17q25) болезни моямоя [119; 130; 197; 199; 225]. Однако, в литературе описана болезнь моямоя у одного из 2х близнецов, что позволило авторам сделать вывод, что заболевание не является жестко детерминированным [256]. В одной из последних работ J. Ma и соавторы сообщают (Китай, 2013), что при исследовании ассоциативной генетической предрасположенности они выявили связь между болезнью моямоя и генными полиморфизмами в гене RNF213 (p.R4859K и p.R4810K), который чаще встречается в Японии и Корее, и реже в Китае [171].
Несмотря на эти исследования, генетический скрининг при болезни моямоя не получил широкого распространения, так как его эффективность не была доказана [233]. На сегодняшний день исследователи, изучающие эту проблему, считают, что данное заболевание имеет мультифакторный характер [266].
Патофизиология болезни моямоя, как уже сказано выше, заключается в постепенном сужении крупных стволов интракраниальных артерий основания черепа, за счет отложения липидов в интиме при отсутствии признаков воспаления. Средний слой артерий истончен, адвентиция в процесс не вовлекается. Аналогичные изменения сосудов могут наблюдаться в других органах, указывая на то, что поражение сосудов носит системный характер. Не исключается вовлечение в процесс иммунной системы [270]. По мнению некоторых авторов, в развитии заболевания принимают участие воспалительные белки [287]. В любом случае, в процессе прогрессирующей окклюзии сосудов виллизиева круга [270; 277] на основании мозга образуются внутричерепные и экстракраниальные сосудистые анастомозы, что в определенной степени компенсирует критическое снижение регионального мозгового кровотока, но приводит к постепенному нарастанию хронической церебральной ишемии, преимущественно в кортикальных отделах больших полушарий [208; 266; 291]. Анастомотическая капиллярная сеть исчезает по мере развития коллатералей из НСА (менингиальные коллатерали носят название «волшебной сети») [208; 291]. При болезни моямоя нередко встречаются артериальные аневризмы. Частота обнаружения аневризм ВББ составляет, по некоторым данным, до 62%, что превышает в несколько раз встречаемость данной патологии в популяции (5–15%) [196; 270].
Своеобразие клинических проявлений болезни и синдрома моямоя заключается в том, что патология может проявляется как НМК по ишемическому типу, так и внутричерепными кровоизлияниями. При этом оба варианта могут на протяжении жизни встречается у одного больного [192; 196; 270].
В 1990 году Y. Matsushima предложил классификацию болезни моямоя по клиническому течению:
I тип: проявляется редкими ТИА — частота 2 раза в месяц и реже;
II тип: проявляется частыми ТИА — 2 раза в месяц и чаще;
III тип: проявляется малым инсультом (с регрессом неврологического дефицита в течение 2–3 недель). На КТ головного мозга могут выявляться небольшие ишемические очаги;
IV тип: проявляется прогрессирующим инсультом (постепенное нарастание неврологического дефицита с течением времени);
V тип: проявляется завершенным инсультом, в результате которого у пациента формируется стойкий неврологический дефицит; при КТ и МРТ головного мозга обнаруживаются обширные очаги ишемического поражения мозговой ткани.
I–V типы относят к ишемическому варианту течения заболевания.
VI тип: заболевание проявляется НМК по геморрагическому типу, вследствие разрыва сосудов анастомотической сети [178].
C. Mohanty и соавторы (Индия, 2013) сообщают об 11 случаях необычного течения болезни моямоя, когда у пациентов отмечаются очаги НМК в одном и том же полушарии, как по геморрагическому, так и ишемическому типу, одномоментно либо в разные периоды времени [186].
По зарубежным данным, летальность при болезни моямоя у взрослых выше, чем у детей (10 и 4,3% соответственно). Кровоизлияния были причиной смерти у 56% из 9 погибших детей. При хирургическом лечении благоприятный прогноз наблюдается в 58% случаев [268].
4. Клинические проявления нарушений мозгового кровообращения у детей
Клинические проявления острых нарушений мозгового кровообращения в бассейне сонных артерий у детей достаточно типичны и проявляются очаговым неврологическим дефицитом с развитием нарушения движений (87–95%), речи, чувствительности, зрения и других симптомов, соответствующих локализации поражения мозговой ткани. При обширных инсультах в остром периоде заболевания, как правило, более выражена общемозговая симптоматика, обусловленная отеком и дислокацией головного мозга. В случаях, когда зона ишемии имеет небольшие размеры, очаговая симптоматика развивается на фоне общего благополучного состояния. Клиническая картина нарушения мозгового кровообращения у ребенка может быть нетипичной: вместо тошноты, рвоты, угнетения сознания может появляться возбуждение или подъем температуры тела, а также судороги (19–58%).
С целью объективизации тяжести клинических проявлений ОНМК, оценки динамики неврологического дефицита в остром и восстановительных периодах инсульта используют шкалу PedNIHSS (Педиатрическая шкала инсульта национального института здоровья США), которая показала свою сопоставимость со шкалой NIHSS [175; 235]. В периоде остаточных явлений американские исследователи применяют шкалу PSOM (Pediatric Stroke Outcome Measure, оценка исхода педиатрического инсульта) [37; 107]. Указанные шкалы достаточно объемны, но не сложны для заполнения, могут быть автоматизированы и введены в стандарт обследования больных. Препятствием для их внедрения на территории РФ является необходимость обучения специалистов самой методике подсчета, а также необходимость валидизации оценочноизмерительных шкал.
Судорожный синдром нередко становится первым симптомом НМК у детей, независимо от типа НМК. Отмечена более частая регистрация судорожного синдрома у детей младшей возрастной группы [60; 69; 81; 291]. Судорожный синдром у детей характерен не только для инсульта, но и для различных поражений мозга (объемные образования и др.). В связи с высокой диагностической значимостью он рекомендован Американским Обществом Эпилепсии (The American Epilepsy Society) в качестве обязательного показания для проведения МРТ головного мозга [122].
Появление судорог в дебюте цереброваскулярной патоло гии — относительно неблагоприятный признак. Доказано, что именно манифестация ОНМК с судорожных приступов и их повторение в ближайшем периоде ассоциировано с неблагоприятным прогнозом с точки зрения выздоровления и восстановления очагового неврологического дефицита, а также с риском формирования и тяжелого течения симптоматической эпилепсии [99; 125; 259]. Как правило, судороги не являются единственным проявлением ОНМК. Фокальный неврологический дефицит развивается либо одновременно с ними, либо в последующих периодах [35; 220; 280]. Наиболее крупные выборки пациентов с ОНМК и формированием постинсультной эпилепсии в последующий период болезни представлены в табл. 1.
В то же время, первые проявления болезни могут быть весьма неспецифичны: изолированное снижение уровня сознания или головная боль, что, с учетом возраста, затруднением осознавания и вербализации непривычных симптомов самим ребенком и отсутствием «инсультной» настороженности педиатрических неврологов приводит к существенной отсрочке нейровизуализации и постановки диагноза ОНМК [24; 60; 63; 67; 179].
Таблица 1.
Риск формирования эпилепсии у детей, перенесших ишемический инсульт (по данным литературы с 2010 по 2015 гг.
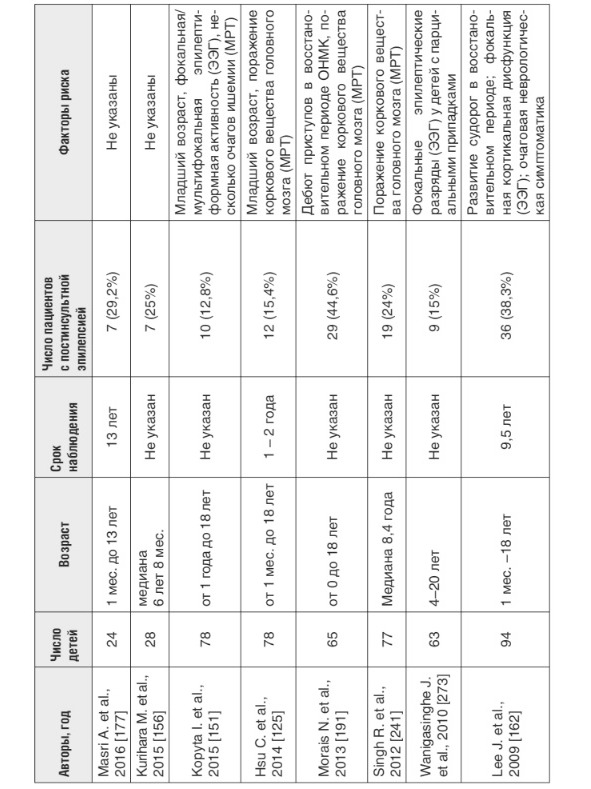
Таблица 2.
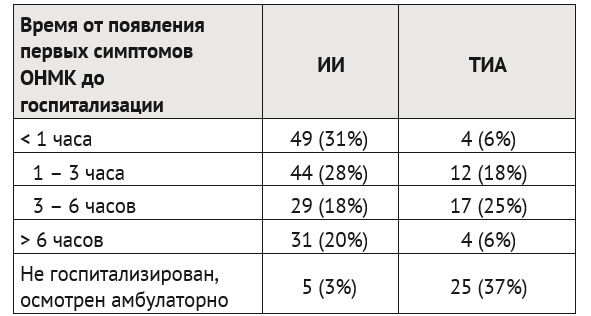
Время от появления первых симптомов ОНМК до госпитализации в ЛПУ неотложного / неврологического профиля.
Нередко при этом складывается достаточно парадоксальная ситуация, получившая название «клиникодиагностических ножниц»: детей, имеющих признаки НМК, достаточно быстро госпитализируют, но адекватной верификации диагноза, в том числе инструментальной, а соответственно, и лечения, они не получают. Пациенты педиатрического профиля оказываются в стационаре в среднем в течение первых трех часов от дебюта симптомов ОНМК, но попадают к нейрорадиологам в течение 8 часов, тогда как для взрослых пациентов эти сроки составляют 8 и 2 часа соответственно [63; 103; 179; 247]. Преходящие двигательные и/или чувствительные нарушения в структуре парциальных приступов приводят к первоначальной установке диагнозов, наиболее часто встречающихся у детей (эпилепсия, нейроинфекция, черепномозговая травма и т. д.), и поэтому занимающих первые позиции в «оперативной» памяти докторов неотложного этапа [103; 247].
При анализе клинической картины у детей с ИИ, обследованных специалистами ФГБОУ ВО «Уральский государственный медицинский университет», получена следующая динамика встречаемости клинической симптоматики у 162 детей (табл. 4). В первые сутки болезни отмечена сопоставимость частоты регистрации общемозговой и очаговой неврологической симптоматики. В остром периоде ИИ наиболее характерным сочетанием симптомов у детей были: снижение уровня сознания, центральные парезы конечностей и мимической мускулатуры. Практически у каждого четвертого ребенка, возраст которого позволил адекватно оценить эту симптоматику, были признаки атаксии и речевые нарушения. Таким образом, наиболее яркие комбинации симптомов, которые формируют диагностические правила «Give me five» и FAST при диагностике инсульта в типичном для ИИ и ТИА возрасте, также могут быть успешно применены в педиатрической практике.
Спектр очаговой неврологической симптоматики у больных соответствовал бассейнам кровоснабжения, а также локализации инфаркта. Стойкость неврологического дефицита в период пребывания в стационаре имела прямую положительную связь с размерами зоны инсульта на КТ или МРТ (r=0,56, p <0,05).
Проанализирована скорость поступления детей с верифицированными ИИ (n=158) и ТИА (n=62) на специализированный этап оказания помощи (табл. 2).
Таким образом, лишь чуть больше половины детей с ИИ попадает на специализированный этап оказания помощи в пределах отчетных сроков, принятых для госпитализации взрослых — в рамках так называемого «временно&го окна» (до трех часов) — 59% (n=93), когда возможно проведение тромболизиса. Для детей с ТИА появление очаговой или общемозговой симптоматики не осталось незамеченным также более чем в половине случаев — 60% (n=37). В тоже время, кратковременный и преходящий характер симптомов при ТИА привели к отсутствию неотложной госпитализации и обращению за помощью в плановом порядке у 40% детей этой группы (n=25).
При нарушении кровообращения в ВББ характерны такие симптомы, как головокружение с тошнотой и рвотой, нарушение статики и походки, атаксия в конечностях и нистагм; менее типичны парезы в конечностях и различные изменения чувствительности, поражения черепномозговых нервов (ЧМН), вызванные нарушением кровообращения в стволе мозга. При ишемии затылочных долей возможны расстройства зрительных функций [17].
Хроническая церебральная ишемия чаще всего проявляется признаками дисциркуляторной энцефалопатии (ДЭП), для которой характерны головные боли диффузного характера, головокружение, шум в ушах, расстройства памяти, эмоциональная лабильность, повышенная утомляемость и снижение работоспособности, нарушение сна. При ДЭП преобладают общие симптомы без очаговой неврологической симптоматики: сильные головные боли (77%), повышенная утомляемость (68%), снижение памяти (44%) [17]. Для таких детей характерно снижение обучаемости (65%).
Касаясь специфики клинического течения при отдельных видах патологии, следует сказать, что клинические проявления стеноза и окклюзии магистральных сосудов головного мозга не имеют специфических черт и могут проявляться различными ишемическими нарушениями мозгового кровообращения. Умеренное снижение мозгового кровотока клинически, как правило, не проявляется (бессимптомное течение заболевания), либо сопровождается неспецифическими жалобами.
Клинические проявления болезни и синдрома моямоя в дебюте заболевания достаточно разнообразны и могут быть схожи с клиническими проявлениями сосудистых церебральных нарушений при патологических деформациях магистральных сосудов головного мозга, тромбозе и атеросклерозе внутричерепных артерий, а также с проявлениями других заболеваний (эпилепсия, пороки развития церебральных сосудов, субарахноидальные и внутримозговые кровоизлияния различного генеза) [192; 196; 270].
Головная боль фигурирует в качестве манифестирующего симптома во множестве исследований, посвященных болезни моямоя, в том числе у детей. В литературе существует даже отдельное понятие — головная боль, ассоциированная с болезнью моямоя (HAMD — headache associated with moyamoya disease) [141; 233; 238; 288]. Нередко головная боль бывает единственным симптомом в дебюте этого заболевания. Предположительно, головная боль обусловлена компенсаторным расширением менингиальных и лептоменингиальных артерий, что может стимулировать ноцептивные рецепторы твердой мозговой оболочки (ТМО). Головная боль может иметь мигренеподобный характер и не поддаваться медикаментозной терапии. Однако, данный симптом, как правило, не расценивается в качестве фатального признака. У большинства пациентов головная боль регрессирует после операции [71; 136; 238].
Последующее присоединение преходящих очаговых неврологических симптомов расценивается неврологами за частую как проявление суб или декомпенсации резидуального органического фона под влиянием школьных нагрузок, интенсивных занятий спортом, вирусных инфекций, прививок и т. д. Распознавание их как ТИА чаще всего происходит ретроспективно, после верификации болезни моямоя. Кратковременный и преходящий характер симптомов у детей, часто в сочетании с невозможностью вербально охарактеризовать свои «необычные» жалобы, способствуют позднему обращению за помощью и несвоевременной госпитализации. По литературным данным, отсроченная постановка диагноза отмечена у всех пациентов, и может достигать более двух лет. Идентификация болезни моямоя, как правило, происходит только после того, когда ребенок переносит типичный ИИ, после которого проводятся различные нейровизуализационные обследования. Клинические проявления у детей с болезнью моямоя распределяются по час тоте встречаемости следующим образом: ишемические симп томы — 80% случаев (из них инсульты составляют 40%, транзиторные ишемические атаки — 41%) [21; 80; 224; 242; 254]; эпилеп сия — 5%, внутричерепные кровоизлияния — 2,5%; другие симп томы — 12,5% случаев (головная боль, двигательные расстройства, или комплекс симптомов) [72; 80; 224; 242; 254].
5. Диагностика детского инсульта
Всероссийского рекомендумого перечня диагностических процедур с целью дифференциальной диагностики НМК в детском возрасте не существует. Он активно обсуждается и формируется в отдельных центрах. Вариабельность причин НМК значительно затрудняет диагностический поиск. В острейшем и остром периодах болезни сосредотачивают усилия на определении патогенетического варианта НМК, прежде всего, на идентификации наиболее частых заболеваний, терапию которых можно начать незамедлительно (кардиопатология, врожденные нарушения гемокоагуляции, врожденная и приобретенная патология церебральных сосудов) с учетом возрастного периода [22; 34]. Если причина не установлена, в дальнейшем рекомендуют последовательно исключать другие, более редкие, причины НМК в детском возрасте [7; 9; 22; 24; 134].
Известно, что, несмотря на достаточно четкую организацию диагностического процесса в клиниках за рубежом, около 20% ишемических инсультов остаются этиологически неясными. Аналогичный отечественный показатель достигает 65–70% [161; 174; 280]. Несмотря на высокую стоимость лабораторноинструментального обследования и его продолжительность, проведение такого обследования необходимо. Скорейшее выявление причины ОНМК у ребенка считается приоритетной и наиболее важной задачей диагностического поиска на любом этапе болезни. Точное выявление этиологии ОНМК ишемического типа определяет направление медикаментозной коррекции, систему мер профилактики и прогноз в отношении дальнейшего течения и рецидивирования болезни.
На базе ФГБОУ ВО «Уральский государственный медицинский университет» разработан и внедрен в повседневную практику перечень диагностических мероприятий, которые необходимо провести для обследования детей с ИИ и ТИА на неотложном (стационарном) этапе (табл. 3).
Необходимо отметить, что последовательное клиническое, лабораторное и инструментальное обследование с выполнением всех предложенных выше пунктов следует провести даже в тех случаях, когда причина инсульта или ТИА кажется очевидной. Это связано с тем, что помимо очевидной причины, возможно присутствие других, не менее важных факторов риска, особенно различных факторов, ведущих к патологии свертывающей системы крови. Именно индивидуальные комбинации факторов риска, при воздействии провоцирующих факторов, облегчают реализацию генетически детерминированной протромботической настроенности и приводят к формированию фокуса инфаркта или ТИА у детей.
Все выше перечисленное направлено на выявление причин ОНМК, а также на дальнейшее предотвращение повторных инсультов. Однако, с точки зрения определения показаний к хирургическому лечению при неэффективной консервативной терапии или в дополнение к ней, а также при выборе метода хирургического вмешательства необходимы дополнительные исследования с целью оценки состояния магистральных сосудов и системы кровообращения головного мозга. В отличие от взрослых, алгоритм инструментального обследования детей с цереброваскулярными заболеваниями не разработан.
Для верификации цереброваскулярной патологии на протяжении нескольких десятилетий использовали традиционную прямую церебральную селективную ангиографию (ЦАГ), разработанную E. Moniz в 1927 г. [188; 189; 227]. В последнее время прямое ангиографическое исследование практически вытеснено такими методами, как спиральная компьютерная ангиография (СКТАГ) и магнитнорезонансная ангиография (МРАГ).
Таблица 3.
Объем диагностических мероприятий для детей с ОНМК ишемического типа при первичной госпитализации.

Тем не менее, ЦАГ остается незаменимой для оценки коллатерального кровообращения.
Важным этапом в исследовании цереброваскулярной патологии стало появление ультразвуковых методов исследования. Эти методы получили широкое распространение в связи с неинвазивностью и высокой информативностью. В настоящее время используются такие методы, как ультразвуковое исследование брахицефальных артерий (УЗИ БЦА) с цветным картированием, транскраниальная ультразвуковая допплерография сосудов головного мозга (ТКУЗДГ).
К методикам, позволяющим оценить перфузию головного мозга и ее резервы, относятся: СКТперфузия, МРперфузия, позитронноэмиссионная томография (ПЭТ).
При оценке функционального состояния мозга на протяжении многих десятилетий применяется электроэнцефалография (ЭЭГ). Изучение цереброваскулярной реактивности путем применения нагрузочных тестов с гипервентиляцией при ЭЭГ (отсроченная реакция кривой и клинические проявления) и нейропсихологическое обследование — позволяют уточнять показания к операции, сторонность поражения при двустороннем процессе, а также отслеживать динамику состояния мозга после операции.
Выбор инструментальных методов обследования в каждой конкретной ситуации определялся необходимым объемом данных для определения показаний к хирургическому лечению, а также с целью планирования оперативного вмешательства.
При дополнительном обследовании детей с целью выбора тактики хирургического лечения основными задачами являются:
1. Оценка состояния экстракраниальных и интракраниальных артерий головного мозга и определение вида патологии (стеноз, окклюзия, патологическая извитость);
2. Оценка гемодинамической значимости выявленных изменений с определением их влияния на церебральную гемодинамику;
3. Оценка компенсаторных возможностей коллатерального кровообращения: анатомические особенности виллизиева круга, оценка его функционального состояния в покое и при нагрузочных тестах, наличие естественных экстраинтракраниальных анастомозов, симметричность кровотока.
При оценке состояния сосудистой системы мозга при болезни моямоя актуальна ангиографическая классификация, предложенная J. Suzuki в 1969 г (рис. 5). Она позволяет определить стадийность процесса облитерации сосудов и состояние сосудистой системы на момент обследования:
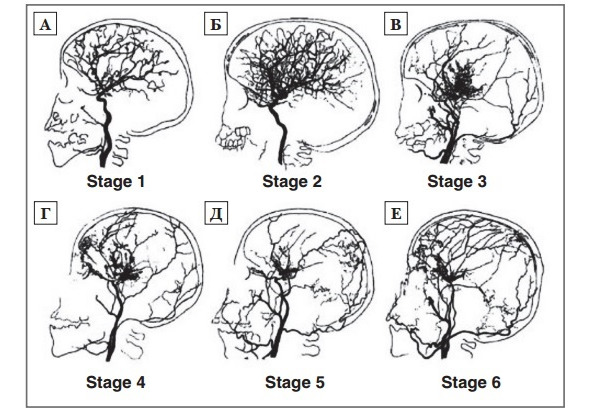
1. Стеноз супраклинодной части ВСА, обычно двусторонний (рис. 5 А);
2. Развитие сосудистых анастомозов на основании мозга (рис. 5 Б);
3. Нарастание стеноза ВСА и выраженности анастомотической капиллярной сети на основании мозга (в большинстве случаев заболевание диагностируется в этой фазе) (рис. 5 В);
4. Окклюзия всего виллизиева круга и ЗМА, начало появления экстракраниальных анастомозов (рис. 5 Г);
5. Редукция анастомотической капиллярной сети (рис. 5 Д);
6. Полное исчезновение сосудов типа «моямоя» и основных мозговых артерий (рис. 5 Е) [254].
Помимо ЦАГ, при болезни моямоя полезны и другие исследования: ЭЭГ, ТКУЗДГ, СКТ — перфузия, МРТ — перфузия, ПЭТ.
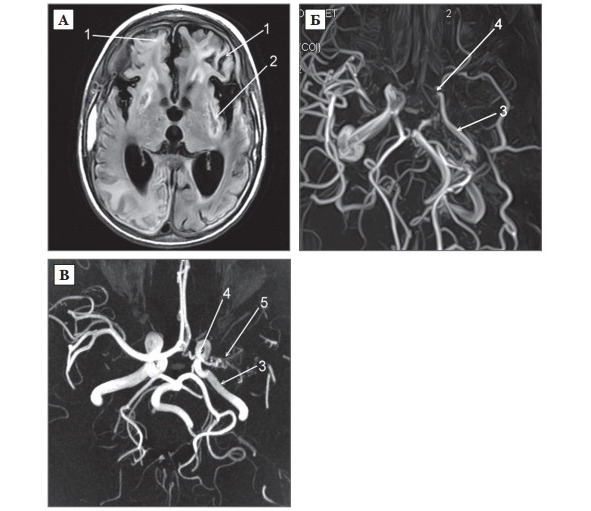
В настоящее время в зарубежной литературе у пациентов с болезнью моямоя (рис. 6 А, Б, В) огромное значение придается наличию корковой ишемии, а также выявлению симптома «плюща» («ivy sign») на МРТ головного мозга. Симптом «плюща» характеризуется повышенным лептоменингиальным сигналом в режиме FLAIR (fluidattenuated inversion recovery) вдоль корковой поверхности борозд головного мозга и ТМО (рис. 6 А).
Ряд авторов [192; 205] предположили, что данный симптом указывает на недостаточность цереброваскулярного резерва.
Последние исследования показали [193], что симптом «плюща» более интенсивен в полушарии на стороне с худшей визуализацией ветвей СМА при ангиографии. Выявлена корреляция между интенсивностью сигнала и клиническим течением заболевания: чем более интенсивен, тем тяжелее проявляется хроническая церебральная ишемия. После хирургического лечения (реваскуляризации головного мозга), сигнал становится менее интенсивным [193].
Глава II.
Консервативная терапия инсульта и подходы к вторичной профилактике НМК
1. Консервативная терапия в остром периоде инсульта
На сегодняшний день для пациентов детского возраста с НМК не существует разработанных и утвержденных руководств по оказанию помощи на всех этапах стационарного и амбулаторного лечения. По рекомендациям американской ассоциации сердечнососудистых заболеваний (American Heart Association & American Stroke Association, 2012) в остром периоде необходимо использовать общие принципы контроля жизнедеятельности; поддерживать общий объем циркулирующей крови, стабилизировать гемодинамику (избегать гипотонии), поддерживать нормальную температуру тела (избегать переохлаждения/ перегревания), независимо от вида НМК (Class I, Level of Evidence A) [107; 280].
Первоочередным в лечении ОНМК по ишемическому типу у взрослых пациентов в настоящее время считается тромболизис. Вся система мер, связанных с оказанием неотложной помощи, подразумевает определение показаний и оценку технической возможности выполнения тромболизиса. В литературе представлены успешные попытки тромболитической терапии в острейшем периоде ИИ и в детском возрасте [91; 117; 272; 260]. Несмотря на высокую эффективность (до 80%), международным педиатрическим сообществом наложен мораторий на применение всех методик тромболизиса в связи с высоким риском осложнений. Его предложено сохранять — до тех пор, пока не будут опубликованы новые данные об эффективности и безопасности этого вида лечения (Class III, Level of Evidence C) [45; 48; 201; 280]. Исключение составляют клинические исследования в подростковой группе — тромболизис может быть применен, если подросток соответствует критериям включения [44; 45; 58; 280].
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.