
Бесплатный фрагмент - Дерматомные соматосенсорные вызванные потенциалы
Практическое руководство
Список сокращений
ДССВП — дерматомные соматосенсорные вызванные потенциалы
КТ — компьютерная томография
МРТ — магнитно-резонансная томография
ОО — объект обследования
ССВП — соматосенсорные вызванные потенциалы
ТМС — транскраниальная магнитная стимуляция
ТС — точка стимуляции
ЭМГ — электромиография
ЭНМГ — электронейромиография
Введение и обзор литературы
Одной из основных в неврологии является проблема объективизации поверхностной кожной чувствительности. До сих пор исследование болевой чувствительности неврологи проводят с помощью иголки, температурной — с помощью пробирок с горячей и холодной водой, тактильной — с помощью кусочка ваты, вибрационной — с помощью камертона. Все эти методы являются субъективными, зависящими от психологических особенностей пациента. Наиболее известная объективная методика диагностики нарушений кожной чувствительности — соматосенсорные вызванные потенциалы. ССВП — это ответ различных структур нервной системы на электрическую стимуляцию периферических нервов или кожных зон (дерматомов). Стандартное исследование ССВП предполагает стимуляцию периферических нервов, наиболее часто большеберцовых и срединных. Некоторые исследователи применили стимуляцию кожи для изучения чувствительности отдельных дерматомов. Метод был обозначен как дерматомные (кожные, сегментарные) соматосенсорные вызванные потенциалы (ДССВП — от dermatomal somatosensory evoked potentials). Первые сообщения об этом методе диагностики относятся к началу восьмидесятых годов прошлого века (Scarff T.B. et al., 1979; Green J. et al., 1983; Dvonch V., 1984) [26, 27, 47]. После первых положительных откликов на новый диагностический метод последовал ряд публикаций, подвергающих сомнению его диагностическую значимость. Aminoff M. J., Goodin D. S. с соавторами (1985) исследовали соматосенсорные вызванные потенциалы на стимуляцию малоберцовых нервов и L5 и S1 дерматомов у 19 пациентов с односторонней радикулопатией на этом уровне. ДССВП правильно идентифицировали поражение только у пяти пациентов. В 10 случаях они дали «вводящую в заблуждение» информацию: у девяти пациентов патологии обнаружено не было, у одного патология выявлялась на бессимптомной стороне [12, 13]. Rodriquez A., Kanis L. с соавторами (1987), на основе сопоставления диагностической эффективности ДССВП с ЭМГ, миелографией и компьютерной томографией, у 13 пациентов с поясничной радикулопатией обнаружили 86% корреляцию между уровнем поражения и данными ЭМГ и ДССВП. Шестьдесят пять процентов патологических результатов ДССВП были на основе критерия разницы сторон латентных периодов и 35% на основе отсутствующей односторонней реакции. Несмотря на полученные результаты, авторы сделали вывод о том, что ДССВП «добавляют немного к диагнозу радикулопатии» [46]. Green J., Hamm A. с соавт. (1988) на основании анализа 129 случаев шейных и поясничных радикулопатий считали ДССВП исследованием низкой чувствительности и высокой специфичности [27]. Date E. S. с соавторами (1991) не обнаружил существенных изменений ДССВП при травмах плечевого сплетения [23], однако в том же году японские исследователи Machida M., Usui T. (1991) у 10 больных с выраженным травматическим повреждением плечевого сплетения в 100% случаев обнаружили патологические ДССВП [39]. Yazicioglu K. c соавторами (1999) представил критические данные о диагностической полезности ДССВП. Автор изучал показатели ДССВП у больных с радикулопатиями L4, L5, S1. При этом полное совпадение данных ДССВП с клиническими показателями выявлялось в 7% случаев, в 37% случаев ДССВП правильно идентифицировал уровень поражения, однако давал «вводящую в заблуждение» информацию о патологии на других уровнях [57]. Другие авторы свидетельствуют об эффективности ДССВП в диагностике сенсорных нарушений. Dvonch V., Scarff T. с соавторами (1984) сопоставили данные миелографии и ДССВП у больных с поясничной радикулопатией и выявили 85,7% соответствие. При сопоставлении результатов ДССВП с операционными данными авторами выявлено соответствие в 87,5% случаев [26]. Machida M., Asai T. C. с соавторами (1986) считали ДССВП «ценным не травматичным диагностическим инструментом для оценки пролабированного люмбосакрального диска» [38]. В 1987 году Katifi H. A. и Sedgwick E. M. выявили изменения ДССВП в 19 из 20 случаев хирургически подтвержденной компрессии поясничных корешков [30]. Date E. S., Ortega H. R. (1988) изучали показатели латентных периодов, межпиковых интервалов и амплитуд церебральных компонентов ДССВП на стимуляцию кожных зон от С5 до Тh1 у 15 здоровых и 12 пациентов с травматическим повреждением спинного мозга на шейном уровне. Авторы отмечают постоянство и хорошую повторяемость компонентов с кожных зон С6, С7, С8 и меньшую повторяемость компонентов с кожных зон С5 и Th1 у здоровых. У больных с травмой спинного мозга компоненты были нечеткими, отмечался большой разброс их латентных периодов и снижение амплитуд. Эти изменения встречались как на уровне поражения, так и в клинически интактных сегментах, что позволяет сделать вывод о способности метода выявлять субклиническую патологию. Авторы указывают на сферы применения метода ДССВП: 1) контроль хирургического лечения спинномозговой патологии; 2) определение повреждения одного корешка; 3) при острой травме спинного мозга и неадекватности пациента. Авторы считают критерий межпиковых интервалов менее надежным в определении патологии [22]. Leblhuber F., Reisecker F. с соавторами (1988) изучали диагностическую ценность различных электрофизиологических тестов при цервикальном дисковом пролапсе. Авторы обследовали 24 пациента с подтвержденным цервикальным дисковым пролапсом. Расстройства ЭМГ выявлялись в 67% случаев, кожные соматосенсорные вызванные потенциалы показали 85-процентные патологические обнаружения на поврежденной стороне, но также выявили расстройства в смежных сегментах. F-волны были патологическими в 38% случаев. Авторы считают, что электродиагностические обнаружения на уровнях без дискового пролапса, вероятно, обусловлены спондилогенными дегенеративными и сосудистыми факторами [34]. В работе японских исследователей Tokuhashi Y., Satoh K. (1989) показано, что ДССВП является наиболее чувствительным методом обнаружения нарушений сенсорной функции пальцев рук при цервикальной миелопатии [55]. Lund C. с соавторами (1989), Dahl J., Rosenberg J. (1990) контролировали при помощи ДССВП степень эффективности эпидуральной блокады. Авторы заключили, что количественное исследование невральной блокады измерениями ДССВП может быть более точным, чем исследование степени утраты чувствительности после блокады при помощи булавочного укола [21, 36]. Benzon H. T., Toleikis J. R. (1993) использовали ДССВП для контроля эффективности эпидуральной анестезии лидокаином [15]. Herron L. D. с соавторами (1987) использовали ДССВП для интраоперационного контроля у 30 пациентов с поясничным стенозом. Исследовали зоны дерматомов L4, L5 и S1. Для интраоперационного контроля выбирали один из корешков «соответственно рентгенологическим и физическим обнаружениям». Контроль был выполнен до начала операции, во время хирургии и после проведенной декомпрессии корешков. Для шести случаев односторонней декомпрессии нервного корешка среднее уменьшение латентного периода было на 9 мс на прооперированной стороне и на 3 мс на противоположной стороне. Для 24 случаев двусторонней декомпрессии отмечено в среднем уменьшение латентности на 8—9 мс с обеих сторон. Авторы считают метод полезным в интраоперационной оценке адекватности декомпрессии поясничных корешков [28]. Врачи департамента медицинской реабилитации Вашингтонского университета Storm S. A. и Kraft G. H. в 2004 году представили данные об эффективности и полезности ДССВП в определении сенсорного дефекта у больных со спинальным стенозом. Несмотря на то что изменения ДССВП не коррелируют, по заключению авторов, с точным уровнем люмбального стеноза, при правильном выполнении методики они позволяют наилучшим образом отслеживать результаты хирургической декомпрессии. Кроме того, авторы рекомендуют использовать метод в целях нейрофизиологического контроля эффективности консервативного лечения [53]. Cohen B. A. с соавторами (1988) указывают на возможность использования ДССВП для контроля возможного повреждения спинномозговых корешков во время ортопедических операций по исправлению спондилолистеза [17], а также на ценность ДССВП интраоперационного контроля в прогнозе качества декомпрессии спинномозговых корешков, делая акцент на возможность отслеживания чувствительности отдельных дерматомов [18]. Coscia M. F., Trammell T. R. с соавторами (1995) проводили интраоперационный мониторинг ДССВП при ортопедических операциях на поясничном отделе позвоночника у 108 пациентов. По их заключению, ДССВП является превосходным методом контроля операционной безопасности, так как позволяет отслеживать «интраоперационный неврологический статус». Однако имеются особые требования к аппаратуре и необходима «высокая степень сотрудничества» между хирургами, анестезиологами и врачами, проводящими мониторинг [20]. Бельгийские ученые Debatisse D., Desfontaines P. с соавторами (1994) оценили диагностическую эффективность и прогностическое значение ДССВП у 120 хирургически пролеченных пациентов с пояснично-крестцовой радикулопатией. ДССВП регистрировали с кожных зон L5 и S1 до операции, на 4 и 50 дни после операции. По данным авторов, ДССВП были чувствительны к патологии в 70% случаев. При сочетанном применении ДССВП, ССВП на стимуляцию заднего большеберцового и перонеального нервов, а также игольчатой ЭМГ, эффективность диагностики значительно увеличивалась. ДССВП имели прогностическую ценность. Авторы показали, что при улучшении ДССВП на 4 день после операции хороший результат лечения на 50 день отмечен у 91,8% пациентов. При отсутствии положительного изменения ДССВП на 4 день после операции положительный клинический результат на 50 день отмечался у 56% пациентов [24]. Chabot R. J. с соавторами (1995) у 37 пациентов исследовал диагностическую полезность ДССВП, анализируя соответствие их клинике и данным магнитно-резонансной томографии. По мнению автора, ДССВП дает надежную информацию о функции спинномозгового корешка, которая соответствует клиническим симптомам более близко, чем данные МРТ. При этом ДССВП часто предоставляют дополнительную информацию о латерализованной дисфункции корешка при нормальной МРТ [16]. Righetti C. A. c соавторами (1996) оценил изменения ДССВП у 15 пациентов с болями в пояснице. Была выявлена следующая закономерность: у 7 пациентов с псевдорадикулярными (костно-суставными, связочными) болями ДССВП были в пределах нормы, так же как и при небольших центральных протрузиях. У 8 пациентов с радикулярным синдромом выявлялись изменения ДССВП, соответствующие степени поражения корешка. Авторы считают, что метод ДССВП позволяет дифференцировать боли вследствие возбуждения рецепторов костно-суставных структур от истинных радикулярных болей [45]. Sitzoglou K. с соавторами (1997) исследовали диагностическую ценность ДССВП у 24 больных с односторонней радикулопатией вследствие дискового пролапса, подтвержденного МРТ. Оценивали латентный период и амплитуду первого положительного компонента ответа. В 83,3% случаев авторы выявили соответствие между клиникой радикулопатии и изменениями первого положительного компонента ДССВП. При этом игольчатая ЭМГ у этих больных коррелировала с клиникой в 62,5% случаев. Авторы отмечают нетравматичность и чувствительность метода ДССВП в диагностике корешковых поражений [51]. Naguszewski W. K. с соавторами (2001) применили методику ДССВП для контроля эффективности тракционной терапии поясничного отдела позвоночника у больных с радикулопатиями на уровне L5 и S1 корешков. Клинически более чем у 50% отмечена редукция корешковой симптоматики после 12—35 сеансов тракционной терапии, среднее сокращение боли составило 77%. Из 28 корешковых зон после лечения, по данным ДССВП, в 17 корешках отмечено улучшение сенсорного проведения, в восьми показатели не изменились, в трех ухудшились. Авторы делают вывод о том, что компрессия корешка не является единственной причиной отраженных болей в конечности при радикулопатиях [40]. Tsai T. M. с соавторами в 2005 году провел исследование на крысах, целью которого было определение диагностической эффективности ДССВП при обнаружении острого повреждения (рассечения) одного корешка. В одной группе крыс был рассечен корешок L4, в другой L5. До и после рассечения исследовались спинальные ДССВП на тораколюмбальном уровне при суб- и супрамаксимальной интенсивности тока. Основным показателем травмы корешка было снижение амплитуд компонентов ДССВП, вплоть до их редукции. При субмаксимальной стимуляции результат был значительно более воспроизводимым, чем при супрамаксимальной. Частота стимуляции при этом существенной роли не играла. Авторы сделали вывод о ценности ДССВП для обнаружения ранения одного корешка. Было рекомендовано применять для исследования субмаксимальную стимуляцию [56]. Пластический хирург Del Vecchyo C. с соавторами в 2004 году опубликовали данные по изучению кожной чувствительности женской груди после операции по ее уменьшению. Используя кожные соматосенсорные вызванные потенциалы, авторы нашли, что кожа маленьких грудных желёз была более чувствительна, чем кожа больших грудных желёз, что соответствует данным других исследователей, использующих иные методы диагностики чувствительности кожи грудной железы. По мнению автора, методика ДССВП является не инвазивной, позволяющей получать количественные результаты и объективно сравнивать чувствительность кожи грудной железы до и после операции. С помощью данного метода автор обнаружил, что при уменьшении груди происходит увеличение ее кожной чувствительности [25]. Talavera-Carbajal M. R. с соавторами (2003) сравнивали показатели ССВП на стимуляцию нервов рук и дерматомных ССВП у 17 пациентов с шейными радикулопатиями, подтвержденными МРТ и электромиографией. Авторы отметили, что, несмотря на сходство формы ответов, дерматомные ССВП были ниже по амплитуде, их латентные периоды были большими, чем у ССВП на стимуляцию периферических нервов. Наиболее диагностически значимым было увеличение межпикового интервала между периферическим компонентом N9 (т. Эрба) и N13 (на уровне С6 позвонка). При этом у 13 пациентов были найдены измененные дерматомные ССВП, и всего лишь у пяти из этих тринадцати выявлялась патология ССВП на стимуляцию нервов. Была отмечена неинвазивность и хорошая переносимость ДССВП [54]. В последние годы появились публикации, описывающие методологию совместного применения ДССВП с другими нейрофизиологическими методами. Например, Shields C. B. с соавторами (2006) считает, что для объективной оценки повреждения спинного мозга на шейном уровне недостаточно только транскраниальной магнитной стимуляции. Авторы описывают технику обследования, сочетающую ТМС и ДССВП, так как эта техника позволяет более точно определять уровень поражения [50]. Kramer J. L. с соавторами (2008, 2010) разработал методику, сочетающую исследование ДССВП, порога восприятия электрического стимула и порога боли. Авторы считают, что подобное сочетание обеспечивает надежную количественную сенсорную информацию при повреждениях спинного мозга [32, 33]. Collado-Corona M. A. с соавторами (2009) включал ДССВП в комплекс нейрофизиологических методик для мониторинга при операциях на спинном мозге [19]. Обращает внимание отсутствие публикаций о применении ДССВП при патологии периферических нервов, несмотря на ее высокую чувствительность при неврогенной патологии. Наиболее часто для диагностики сенсорных невропатий применяют метод ЭНМГ, который в ряде случаев позволяет выявить сенсорное поражение, однако малопригоден для исследования большинства дерматомов. Это связано с трудностями в регистрации сенсорного ответа с нервов, большой вероятностью ошибки, так как даже минимальное отклонение отводящего электрода от ствола нерва приводит к выраженному изменению ответа. ЭНМГ позволяет исследовать только те нервы, которые находятся непосредственно под кожей. При исследовании ДССВП отведение осуществляется с черепа, а стимуляция — с любого участка кожи, что значительно упрощает диагностику, унифицирует ее, уменьшает вероятность ошибок.
Области применения ДССВП:
— диагностика монорадикулопатий;
— дифференциальная диагностика радикулярных и псевдорадикулярных поражений;
— оценка функции спинного мозга при его локальных повреждениях;
— диагностика сенсорного дефекта у больных со спинальным стенозом;
— контроль эффективности консервативного лечения вертеброгенных заболеваний;
— прогнозирование качества хирургической декомпрессии спинномозговых корешков;
— контроль эффективности тракционной терапии позвоночника;
— контроль эффективности эпидуральной блокады;
— интраоперационный контроль при нейрохирургических операциях на спинном мозге;
— интраоперационный контроль при ортопедических операциях на позвоночнике у больных с поясничным стенозом, спондилолистезом;
— в пластической хирургии;
— при неадекватности пациента.
Таким образом, несмотря на ряд критических публикаций, большинство авторов отмечают высокую информативность методики ДССВП в диагностике нарушений поверхностной кожной чувствительности, простоту, широкий спектр применения, безболезненность и неинвазивность.
1. Методика ДССВП
1.1. Условия регистрации и отведения
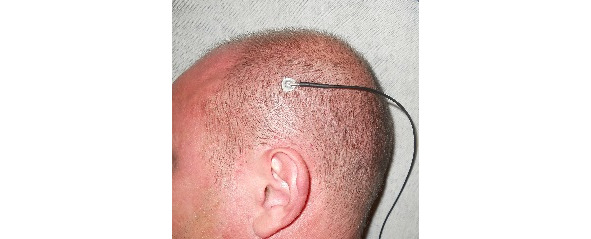
Регистрация ДССВП проводится со скальпа. Для нижних конечностей активный электрод располагается на вертексе (Cz), для верхних активный С3 и С4 контрлатерально стимулируемой руке, референтный во всех случаях нижний лобный Fрz, заземляющий лобный Fz или на стимулируемой конечности. Рисунки 1—3.
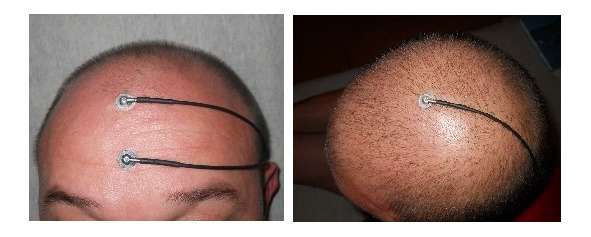
Рис. 2 (справа). Активный электрод для ноги
Исследуются ранние компоненты ДССВП — эпоха анализа до 100 мс. В норме коротколатентный ДССВП представляет из себя последовательность позитивных и негативных пиков Р1, N1, P2, N2, P3, N3 (см. рис. 5 и 6). Первый позитивный пик (Р1) регистрируется непостоянно (примерно в 15—20% случаев) и не имеет диагностического значения. Основной компонент диагностики — Р2. Сила стимула соответствует тройному сенсорному порогу, обычно 8—18 мА, длительность стимула 100—200 мкс, частота стимуляции 3—4 Гц, чувствительность стимулятора 1—2 мкВ/дел., полоса пропускания усилителя 10—3000 Гц. Количество усреднений 200—500. В практике наиболее часто возникает необходимость в исследовании корешковых зон С6, С7, С8, L5, S1. Для исследования корешка С6 рекомендовано проводить стимуляцию кольцевыми электродами первого пальца кисти, для корешка С7 — третьего пальца, для корешка С8 — пятого пальца, для корешка L5 — второго пальца стопы, для корешка S1 — пятого пальца стопы. Для исключения патологии периферических нервов рекомендовано перед ДССВП провести электронейромиографическое исследование сенсорной проводимости срединного, локтевого и лучевого нервов на кисти (ортодромная стимуляция палец — запястье), на стопе подошвенных нервов, икроножного нерва и сенсорных аксонов глубокого малоберцового нерва. Достоверность исследования ДССВП повышается при условии нормальной периферической сенсорной проводимости нервов. Одним из критериев монорадикулопатии может быть нормальный ССВП на стимуляцию нерва (срединного, локтевого или большеберцового) в сочетании с патологическим ДССВП с определенной корешковой зоны.
1.2. Общая методика обследования
Пациент лежит на спине, глаза закрыты, максимально расслаблен. Во время исследования не должно быть громких звуков, яркого света, нужно избегать напряжения мышц лица, моргания, глотательных движений. Последовательно стимулируется сначала «здоровая сторона», затем сторона поражения. При стимуляции не должно быть болевых ощущений, если они возникнут, необходимо силу стимула уменьшить.
Точки стимуляции корешковых дерматомов представлены на рисунке 4 и описаны в таблице 1 (из ст. J. C. Slimp et al.) [52].
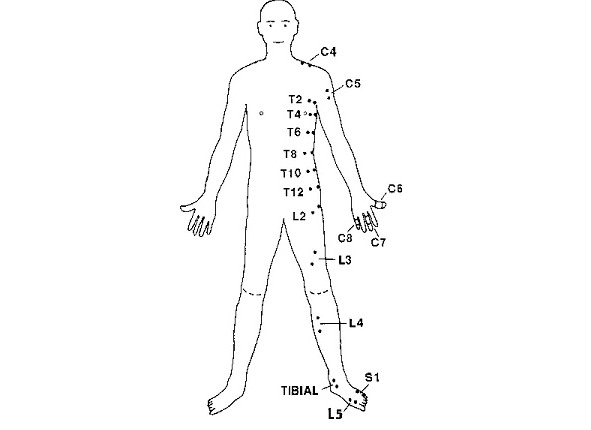
Таблица 1. Точки стимуляции корешковых дерматомов
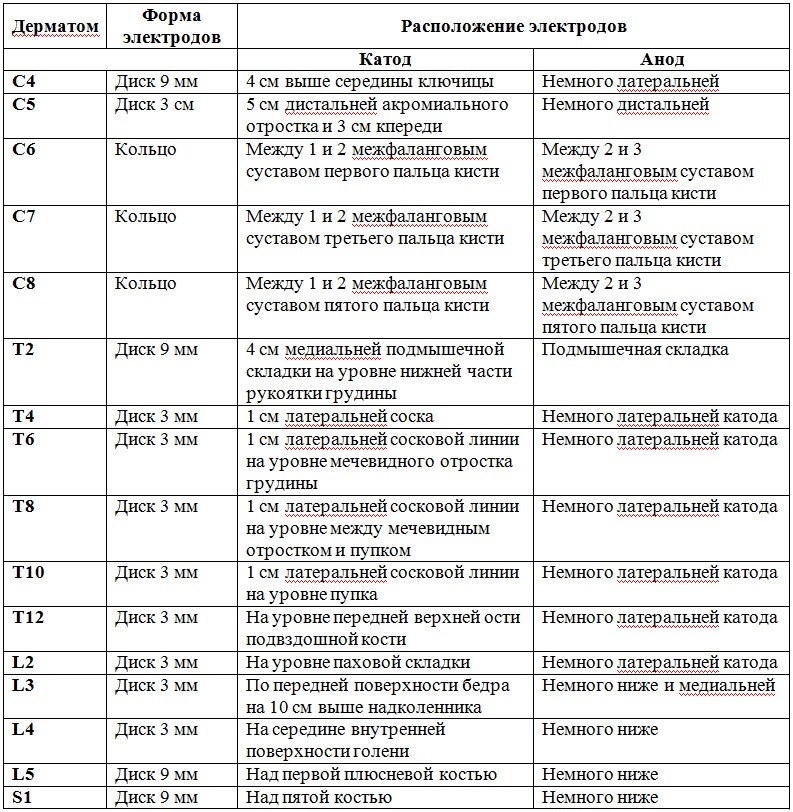
Примечание: таблица в нашей редакции.
На рисунках 5 и 6 представлены ДССВП с корешковых зон в норме.
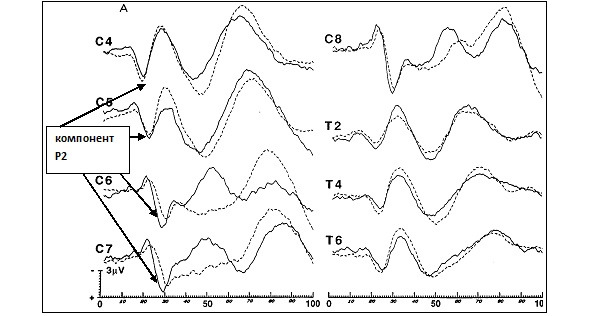
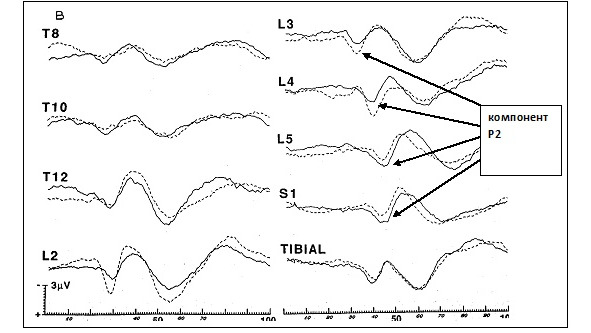
Из статьи Slimp J. C. еt all. [52].
2. Диагностические алгоритмы для верхних конечностей
2.1. Точки стимуляции верхних конечностей и объекты обследования
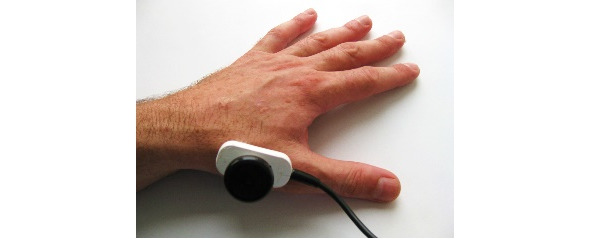
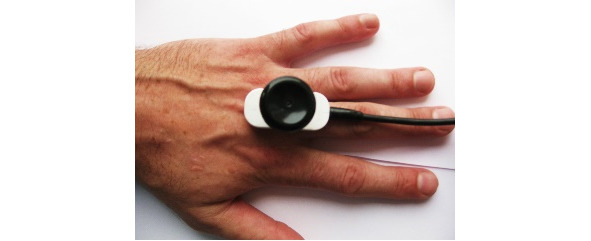
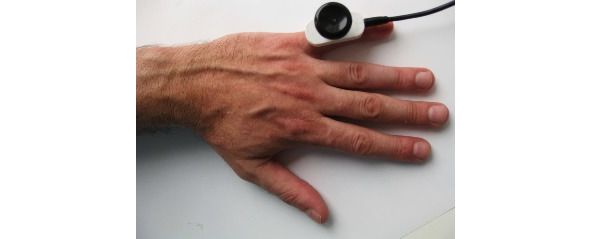
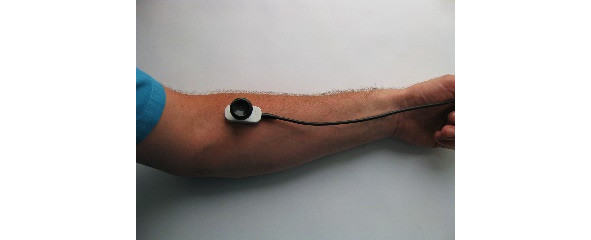
Ниже на рисунках (7—19) представлены точки стимуляции (ТС) верхних конечностей и описаны предполагаемые объекты обследования (ОО).
ОО: корешок С6, срединный нерв




2.2. Диагностика поражения нижнего пучка плечевого сплетения
Алгоритм диагностики поражения нижнего пучка плечевого сплетения представлен на рисунке 20.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
