
Бесплатный фрагмент - COVID-19/SARS-CoV-2
Посвящается всем медицинским работникам, отдавшим жизни в борьбе с COVID-19
АКРОНИМЫ
АГ — артериальная гипертензия
АИГА — аутоиммунная гемолитическая анемия
АЛТ — аланинаминотрансфераза
АПФ — ангиотензинпревращающий фермент
АСТ — аспартатаминотрансфераза
БАЛ — бронхоальвеолярный лаваж
ВДП — верхние дыхательные пути
ВОЗ — Всемирная организация здравоохранения
ВТЭ — венозная тромбоэмболия
ГГТ — гамма-глутамилтрансфераза
ГКС — глюкокортикостероиды
ДВС — диссеминированное внутрисосудистое свёртывание
ДН — дыхательная недостаточность
ЖКТ — желудочно-кишечный тракт
иАПФ — ингибиторы ангиотензинпревращающего фермента
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИМТ — индекс массы тела
ИПП — ингибиторы протонной помпы
ИТП — иммунная тромбоцитопения
КТ — компьютерная томография
мРНК — матричная рибонуклеиновая кислота
МФГ — мульти-функциональная группа
НДП — нижние дыхательные пути
НФГ — нефракционированный гепарин
ОАЭ — Объединенные Арабские Эмираты
ОИМ — острый инфаркт миокарда
ОРДС — острый респираторный дистресс-синдром
ПДКВ — положительное давление конца выдоха
ПНС — периферическая нервная система
ПЦР — полимеразная цепная реакция
РНК (RNA) — рибонуклеиновая кислота
САД — систолическое артериальное давление
СД — сахарный диабет
СИЗ — средства индивидуальной защиты
ТОРИ — тяжелая острая респираторная инфекция
ТЭЛА — тромбоэмболия легочной артерии
ФВ ЛЖ — фракция выброса левого желудочка
ФП — фибрилляция предсердий
ХБП — хроническая болезнь почек
ХОЗЛ — хроническое обструктивное заболевание легких
ЦНС — центральная нервная система
ЧД — частота дыхания
ЧСС — частота сердечных сокращений
ШКГ — шкала ком Глазго
ЭКМО — экстракорпоральная мембранная оксигенация
aOR — adjusted Odds Ratio
aPTT — activated partial thromboplastin time (активированное частичное тромбопластиновое время)
AB0 — система групп крови
ACE2 — аngiotensin-converting enzyme 2
ADCC — Antibody-dependent cell-mediated cytotoxicity
ADCP — antibody-dependent cellular phagocytosis
AIFA — Agenzia Italiana del Farmaco
AKI — acute kidney injury
ARB — angiotensin receptor blockers
ARDS — острый респираторный дистресс-синдром
ART — методы вспомогательной репродукции
ATI — acute tubular injury
BAL — бронхоальвеолярный лаваж
BCG — Bacillus Calmette-Guérin
Bi-PAP — bilevel positive airway pressure
BMJ — British Medical Journal
BSL3 — Уровень биобезопасности 3
CAPA — легочный аспергиллез, связанный с COVID-19
CKD — chronic kidney disease
CLEIA — chemiluminescence enzyme immunoassay
COVID-19 — COronaVIrus Disease 19
CPAP — постоянное положительное давление в дыхательных путях
CRISPR — clustered regularly interspaced short palindromic repeats
CRP — С-реактивный белок
CTD — C-terminal domain
CVD — cardiovascular disease
CVST — тромбоз церебрального венозного синуса
CXCL8 — chemokine (C-X-C motif) ligand 8
CXR — рентгенограмма грудной клетки
DOAC — пероральные антикоагулянты прямого действия
DPI — средства индивидуальной защиты
ECMO — экстракорпоральная мембранная оксигенация
ELISA — enzyme-linked immunosorbent assay
EMA — Европейское агентство по лекарственным средствам
EMT — epithelial-mesenchymal transition
EUA — Разрешение на экстренное использование
EUL — Emergency use listing
FA — мерцательная аритмия
FDA — Food and Drug Administration
FFP — filtering facepiece
FiO2 — фракционное содержание кислорода во вдыхаемом воздухе
GCS — шкала ком Glasgow
GDG — Guideline Development Group
GDS — Geriatric Depression Scale
GLP1 — glucagon-like peptide 1
GOLD — Global Initiative for Obstructive Lung Disease
GSCF — Granulocyte-colony stimulating factor
HAT — human airway trypsinlike protease
HCoV — Human Coronavirus
HE — гемагглютининэстераза
HFNC — назальная канюля с высоким потоком
HFNO — назальный кислород с высокой скоростью потока
HIPA — тест на гепарин-индуцированную агрегацию тромбоцитов
HIT — гепарин-индуцированная тромбоцитопения
HIV — Human immunodeficiency virus
HR — hazard ratio
IBD — inflammatory bowel disease
ICU — отделение интенсивной терапии
IFN — интерферон
IFR — Infection Fatality Ratio
IgM — иммуноглобулин «M»
IL — интерлейкин
ILI — Immune-mediated liver injury
INR — international normalized ratio
INS — idiopathic nephrotic syndrome
IOIBD — International Organization for the Study of IBD
IP10 — interferon-inducible protein
IPB — доброкачественная гиперплазия предстательной железы
ISPED — Italian Society for Pediatric Endocrinology and Diabetology
ISTH — International Society on Thrombosis and Haemostasis
IQR — межквартильный диапазон
JAKs — Janus kinase inhibitors
KL-6 — KREBS Von Den Lungen-6
LDH — лактатдегидрогеназа
LFIA — lateral flow immunoassay
LUTS — lower urinary tract symptoms
mAb — моноклональное антитело
miR — micro-RNA
mRNA — матричная РНК
MAFLD — metabolic-associated fatty liver disease
MAIT — Mucosal-associated invariant T
MAP — среднее артериальное давление
MBL — mannose binding lectin
MCP1 — Monocyte Chemoattractant Protein 1
MDA5 — melanoma differentiation-associated gene 5
MDT — multidisciplinary team
MERS — Ближневосточный респираторный синдром
MEWS — Modified Early Warning Score
MFG — многофункциональная группа
MHPSS — mental health and psychosocial support
MIP1A — macrophage inflammatory protein-1 alpha
MIS-C — Multisystemic inflammatory syndrome in children and adolescents temporally related to COVID-19
MPV — mean platelet volume
MR-proADM — Mid-regional proadrenomedullin
MSC — мезенхимальные стволовые клетки
nsp — неструктурный белок
NAAT — Nucleic Acid Amplification Test
NAFLD — nonalcoholic fatty liver disease
NET — Neutrophil extracellular trap
NEWS2 — National Early Warning Scores
NGS — next-generation sequencing
NICE — National Institute of Health and Clinical Excellence
NIV — non-invasive ventilation
NK — natural killer
NMDA — N-метил-D-аспартат
NPPV — Noninvasive Positive-Pressure Ventilation
NTD — N-terminal domain
NYHA — New York Heart Association
NXP2 — nuclear matrix protein 2
OR — Odds Ratio
ORF — Open Reading Frame
PaO2 — парциальное давление кислорода
PAPR — Powered Air Purifying Respirator
PASC — post-acute sequelae of COVID-19
PBW — predicted body weight
PDE5 — phosphodiesterase type 5
PEEP — positive end-expiratory pressure
PEWS — Paediatric Early Warning Scores
PF4 — Тромбоцитарный фактор 4
PICS — post-intensive care syndrome
PLR — Platelet‐to‐lymphocyte ratio
POC — Point-of-care
PPCI — primary percutaneous coronary intervention
PPI — proton pump inhibitor
PrEP — pre-exposure prophylaxis
PRES — posterior reversible encephalopathy syndrome
PSV — Pressure Support Ventilation
PT — протромбиновое время
PTSD — Post-traumatic stress disorder
PUFA — polyunsaturated fatty acids
PVR-SAE — potentially vaccine-related serious adverse event
PVS — post-VAC syndrome
RAAS — Renin-angiotensin aldosterone system
RBD — Receptor-binding domain
RCOG — Royal College of Obstetricians and Gynecologists
RCPCH — Royal College of Paediatrics and Child Health
RCT — рандомизированное контролируемое исследование
RdRp — RNA polimerasi RNA-dipendente
RDT — rapid diagnostic test
RDW — red blood cell distribution width
RNA — рибонуклеиновая кислота
ROX — взаимосвязь между насыщением кислородом, измеренным с помощью пульсоксиметрии/FiO2, и частотой дыхания
RPA/RAA — recombinase polymerase amplification/Recombinase-aided amplification
RT-PCR — полимеразная цепная реакция с обратной транскрипцией
SAGE — Strategic Advisory Group of Experts on Immunization
SAR — Secondary attack rate
SARI — тяжелая острая респираторная инфекция
SARS — Острое респираторное заболевание
SARS-CoV-2 — Коронавирусный тяжелый острый респираторный синдром 2
SDGs — Sustainable Development Goals
SGLT2 — Sodium-glucose Cotransporter-2
SGTF — S gene target failure
SIC — sepsis-induced coagulopathy
SIIA — Итальянское общество артериальной гипертензии
SIMG — Società Italiana di Medicina Generale e delle Cure primarie
SISET — Società Italiana per lo Studio dell’Emostasi e della Trombosi
SOFA — Sequential Organ Failure Assessment
SpO2 — насыщение крови кислородом
SSE — Superspreading events
STEMI — ST-Elevation Myocardial Infarction
TAPSE — Tricuspid annular plane systolic excursion
TGF-β — фактор роста опухоли бета
TGM/CGM — Tixagevimab/cilgavimab
TIMI — Thrombolysis in Myocardial Infarction
TLR2 — toll-like 2 receptor
TMPRSS2 — Transmembrane Serine Protease 2
TNF-α — фактор некроза опухоли альфа
TREM-1 — Triggering receptor expressed on myeloid cells-1
UFH — нефракционированный гепарин
VATTS — Vaccine-associated Thrombosis and Thrombocytopaenic Syndrome
VE — Vaccine effectiveness
VITT — vaccine-induced immune thrombotic thrombocytopenia
VKA — vitamin K antagonists
VOC — variant of concern
VOI — variant of interest
VTE — венозная тромбоэмболия
VUI — variant under investigation
VZV — varicella zoster virus
+ssRNA — Positive-Sense Single-Stranded RNA
ВВЕДЕНИЕ
В этой книге я постараюсь рассказать вам все то, что известно о коронавирусе SARS-CoV-2 на февраль 2023 года. Я буду исходить из принципов доказательной медицины. В книге, одной из первых в своем роде, предоставляются более полные и обновленные данные о свойствах вируса, его происхождении, эпидемиологии. Я также расскажу о патофизиологии, клинических данных, осложнениях, диагностике, лечении и прогнозе COVID-19, long COVID, профилактике, вакцинации против SARS-CoV-2, гигиенических процедурах и правильном использование средств индивидуальной защиты, влиянии COVID-19 и вакцин на сексуальное и репродуктивное здоровье, влиянии инфекции SARS-CoV-2 на беременных матерей, а также на плод и новорожденного. Рекомендации по лечению и диагностике основаны на документации ВОЗ, SISET, ISTH, AIFA, NIH, SIMG, RCPCH, RCOG, NICE, SIIA, ISPED, GOLD. Это полное и синтетическое клиническое руководство, которое будет полезно студентам медицинских ВУЗов, аспирантам, преподавателям, педиатрам, гинекологам, сотрудникам отделений, занимающихся лечением больных COVID-19 и всем, кто интересуется этой темой, поскольку включает в себя исчерпывающую библиографию.
Для сбора данных был проведен поиск в PubMed систематических обзоров и метаанализов по ключевым словам «covid19 pathology», «covid-19», «SARS-CoV-2» с 2020 по 2023 год. Последний поиск в базе данных PubMed с ключевым словом «SARS-CoV-2» был выполнен 02.02.23. Помимо самых последних метаанализов и систематических обзоров, были проанализированы несколько отдельных исследований, опубликованных с начала пандемии до сентября 2021 г. Было изучено более 12 000 систематических обзоров и метаанализов, а также несколько отдельных РКИ. Не все исследования были процитированы в этой работе. Однако, это не означает менее важной роли других опубликованных статей. Пищевые добавки/витамины, фитотерапия, пробиотики или традиционная китайская медицина/аюрведическая медицина в качестве возможной терапии COVID-19 не рассматриваются в этой книге.
Интерпретация данных: необходимо учитывать риск bias; кроме того, многие исследования о COVID были ретроспективными или обсервационными. Кроме того, одно исследование (A Capodici, 2022) предполагает, что было обнаружено двадцать семь отозванных статей о COVID. Многие статьи, опубликованные в течение первого года пандемии, были отозваны, в основном из-за научных нарушений со стороны авторов. Дублирование, плагиат, мошенничество и отсутствие согласия были основными причинами отзыва. Кроме того, Yanfei Li, 2021, отмечает, что среди 243 проверенных систематических обзоров с точки зрения методологического качества исследований 12,3% были среднего качества, 25,9% — низкого качества и 61,7% — критического качества. [683] Было показано, что такие факторы, как предвзятость дизайна исследования в текущей литературе, дублирование отчетов, различные критерии включения в систематические обзоры, недостаточность данных, неадекватный период наблюдения и ограничения систематических обзоров, препятствуют возможности точной экстраполяции данных. (X L Ang, 2021) I. Skafle et al., 2022, определили 3 основные темы дезинформации в контексте пандемии: медицинская дезинформация, разработка вакцин и заговоры. Дезинформация, распространяемая в социальных сетях, оказала негативное влияние на недоверие к вакцинам и их принятие; одно исследование содержало дезинформацию об аутизме как о побочном эффекте вакцин против SARS-CoV-2.
S Zhao, 2023, предполагает, что дезинформация о вакцинах включала заговоры, опасения по поводу безопасности и эффективности вакцин, бесполезность вакцин, мораль и прочее. Вопросы заговора и безопасности были самой распространенной дезинформацией. Распространенность дезинформации сильно различалась: от 2,5% до 55,4% среди населения в целом.
Однако это, конечно, не означает, что все, что мы знаем о вирусе до сих пор, бесполезно. Эти данные говорят нам о том, что исследования нужно совершенствовать, нужно искать ответы, которые еще не даны на некоторые вопросы о COVID-19. Кроме того, организации здравоохранения должны подготовить свои ответы на следующие этапы инфодемии COVID-19 и будущей инфодемии в целом.
Целью этой книги было, прежде всего, собрать всю важную, основанную на доказательствах, доступную информацию о вирусе SARS-CoV-2 и заболевании COVID-19, стимулировать исследования (прежде всего, качественные исследования, без плагиата и/или мошенничества), найти ответы на различные вопросы. Ожидается, что после публикации можно будет выявить другую информацию особой важности, исправить неверные/неполные данные. Кроме того, эта книга может быть полезна для управления здравоохранением и экономикой при подобных пандемиях в будущем, которые весьма вероятны в эпоху глобализации.

Все данные были пересмотрены и интегрированы в феврале 2023 года.
Об авторе. Врач-терапевт, выпускник ДГМА 2016 года. В 2018 году закончил интернатуру в городе Днепр («Внутренняя медицина»). В 2012—2013 гг. — практика в Италии (отделения ортопедии и внутренней медицины). В июле 2021 г. — успешное подтверждение украинского диплома в Università degli Studi di Perugia в Италии. Автор книг «Коронавирус и артериальная гипертензия», «Профилактика коронавирусной инфекции»; соавтор книг «Коронавирус и беременность», «Страна 38-UA или украинская аномалия» и др. В 2020 г. получил сертификаты ВОЗ «Клиническое Ведение ТОРИ», «Профилактика и контроль новой коронавирусной инфекции (COVID-19)». В ноябре 2020 года прослушал многочасовой семинар по COVID-19 в Италии: «Condividiamo? Coronavirus, non solo una sfida clinica» с участием микробиологов, инфекциониста, эпидемиолога, клиницистов, анестезиолога и экономиста. В ноябре-декабре 2020 года — волонтерство в Департаменте гигиены и профилактики города Перуджа (проект «Contact tracing COVID-19») во время всплеска заболеваемости COVID-19 в регионе Умбрия. В мае 2021 года — участие в семинаре «Применение вакцин от COVID-19: разъяснения о редких тромбозах при применении вакцины AstraZeneca» в Италии. Посетил более 30 конференций, среди которых: XXIV Всеукраинский съезд кардиохирургов, VI Научная сессия ГУ «ИГ НАМН У», Украинский симпозиум «PainControl» и др.

I. ЭПИДЕМИОЛОГИЯ
Новый коронавирус появился в китайском городе Ухань (Wuhan) 25 ноября 2019 года [1]. 11 февраля 2020 Международный комитет по таксономии вирусов дал ему официальное название SARS-CoV-2 (изначально его называли 2019-nCoV). По данным ВОЗ, вспышка связана с циркуляцией инфекции на рыбацком оптовом рынке Хуаньань в Ухане, где также продавались живые животные. Этот рынок был закрыт 1 января 2020 г.
Из числа возможных возбудителей новой болезни были исключены грипп, птичий грипп, SARS-CoV, MERS-CoV и другие патогены. Симптомы заболевания у 41 заболевшего с подтвержденным заболеванием наступили в период с 8 декабря 2019 г. по 2 января 2020 г. [2]
Пандемия, несомненно, застала нас врасплох. Многие страны оказались неготовыми к эпидемии, другие же стали примером для остальных. В некоторых странах сначала удалось сдержать вспышку (Тайвань, Япония), в других вирус распространился быстрее (Италия, Испания, Иран). Был нанесен вред экономикe многих стран, здравоохранению и социальному благополучию населения.
По состоянию на 4 апреля 2023 года в мире зафиксировано 761.402.282 подтвержденных случая COVID-19, погибли более 6.887.000 человек. Из них, в Италии 25 673 442 случая, 188933 погибших [3] (в т.ч. 379 медицинских работников [4]).
В период со 2 по 29 января 2023 года во всем мире было зарегистрировано почти 20 миллионов новых случаев заболевания и более 114 000 случаев смерти. В эпидемиологических тенденциях в последние недели января 2023 г. преобладал значительный всплеск заболеваемости и смертности в западно-тихоокеанском регионе, особенно в Китае.

На региональном уровне число новых случаев, зарегистрированных со 2 по 29 января 2023 г., уменьшилось во всех регионах ВОЗ: регион Западной части Тихого океана (-81%), регион Юго-Восточной Азии (-71%), Европейский регион (-63%), регион Америки (-35%), Африканский регион (-20%) и Регион Восточного Средиземноморья (-15%). Число новых случаев смерти, зарегистрированных за 28 дней, увеличилось в трех регионах: регионе Западной части Тихого океана (+173%), регионе Восточного Средиземноморья (+29%) и регионе Америки (+13%). Число смертей снизилось в трех регионах ВОЗ: регионе Юго-Восточной Азии (-62%), Африканском регионе (-45%) и Европейском регионе (-25%).
На национальном уровне наибольшее количество новых случаев со 2 по 29 января 2023 г. было зарегистрировано в Китае (11 354 058 новых случаев; -85%), Японии (3 207 097 новых случаев; -20%), Соединенных Штатах Америки (1 513 538 новых случаев; -16%), Республике Корея (1 032 801 новый случай; -43%) и Бразилии (459 986 новых случаев; -54%). Наибольшее количество новых смертей за 28 дней было зарегистрировано в Китае (62 759 новых смертей; +244%), Соединенных Штатах Америки (14 625 новых смертей; +31%), Японии (10 122 новых смертей; +46%), Великобритании (3137 новых смертей; -3%) и Бразилии (2889 новых смертей; -24%). [223]
Во всем мире с 16 января по 12 февраля 2023 года было зарегистрировано более 6,7 миллионов новых случаев заболевания и более 64 000 смертей, что на 92% и 47% меньше по сравнению с предыдущими 28 днями. (Weekly epidemiological update on COVID-19, 130 - 15 января 2023) Некоторые эпидемиологи, в связи с этим, осторожно предполагают о возможном завершении пандемии.
Пандемия распространилась на более чем 190 стран; потребовалось более трех месяцев, чтобы достичь первых 100 000 подтверждённых случаев, и всего 12 дней, чтобы достичь следующих 100000. 30 января 2020 г. Всемирная организация здравоохранения объявила эту вспышку чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение. 11 марта 2020 г. ВОЗ определила вспышку как пандемию.
Для сравнения, во время вспышки SARS-CoV было более 8000 подтвержденных случаев и 800 погибших по всему миру; во время MERS-CoV — 2494 подтвержденных случая и 858 погибших. [98]

COVID‐19 — зооноз [71] (т.е., резервуаром вируса являются животные). Источник инфекции — больной человек и реконвалесцент (человек, который выздоравливает), выделяющие вирус в окружающую среду при кашле и процедурах, сопровождающихся повышенным образованием аэрозолей (БАЛ, интубация, бронхоскопия и др.). В шестом руководстве Китая по COVID-19 отмечалось, что бессимптомные пациенты также могут служить источником инфекции.
Соотношение подтвержденных случаев по полу (М:Ж) составляет 1,03:1. Для мужчин средний возраст составляет 52 года (IQR 37—65), а для женщин 50 лет (IQR 35—64). [5]
R0 (индекс репродукции, reproductive number) = 2—2,5 [38], по некоторым данным 5,7 [42]. Индекс репродукции дельта-штамма R0=5.08. [176] Индекс репродукции штамма омикрон R0=4,20 [473], штамма бета в настоящее время не показывает преимущества передачи по сравнению с B.1.617.2. [794] Индекс репродукции штамма альфа R0≈4,6, штамма эпсилон R0≈1,2. [461] Индекс репродукции — это количество здоровых человек, которым больной может передать вирус. R0 SARS-CoV-2 растет с увеличением числа подтвержденных случаев, и до настоящего времени он превысил R0 MERS (R0=0,6) и SARS (R0=1). [96] Вирусная нагрузка при появлении симптомов составляет 4,78 log (копий/мл). [576]
Распространение вируса при ветре 4км/час — на расстояние 6м за 5 секунд.
Смертность: около 0,66% в Китае, 2,7% вне Китая [43] (для сравнения, при гриппе смертность обычно значительно ниже 0.1%). [38] По данным одного метаанализа, смертность госпитализированных пациентов с COVID-19 — 6,5%, при гриппе типа А — 6%, а при гриппе типа В — 3%. [321] Мета-регрессионный анализ также показал, что общий IFR составляет 0,03% и 0,07% в возрастных группах 0–59 и 0–69 лет соответственно. [555]
Что касается смертности по некоторым странам, то, по состоянию на 2 апреля 2020, официальная статистика показала, что в Германии было зарегистрировано 872 погибших от COVID из 73522 подтвержденных случаев, что соответствует коэффициенту смертности 1,2% [108]; при этом, в Италии смертность 11,9%, 9% в Испании, 8,6% в Нидерландах, 8% в Великобритании и 7,1% во Франции. [109]
Возможные причины низкой смертности в начале вспышки в Германии: быстрое реагирование и принятие необходимых мер, массовое тестирование, отсутствие случаев передачи инфекции в домах престарелых или внутрибольничных вспышек. [110] Как ни странно, смертность от всех причин во время вспышки COVID-19 в Японии в 2020 году снизилась по сравнению с историческим исходным уровнем. (D Onozuka, 2022)
Похоже, что афроамериканцы и латиноамериканцы непропорционально пострадали от COVID-19 и в большей степени, чем белые, с точки зрения заболеваемости, госпитализаций и смертности. [563]
Один метаанализ указывает на то, что CFR COVID-19 не является фиксированным или статическим значением. Скорее, это динамическая оценка, которая меняется со временем, численностью населения, социально-экономическими факторами и усилиями отдельных стран по смягчению последствий. [554]
Стабильность вируса при разных условиях окружающей среды (в экспериментальных условиях):
Температура: 4° С — выживаемость более 14 дней, 22° С — выживаемость от 7 до 14 дней, 70° С — выживаемость до 5 минут.
Выживание на поверхностях: бумага — до 3 часов, одежда и дерево — до 2 дней, сталь и пластик — до 7 дней, стекло — до 4 дней, банкноты — до 4 дней, внешняя поверхность маски — больше 7 дней. Вирус чувствителен к бытовому отбеливателю, этанолу (70%), хлоргексидину (0,05%) и т. д. [10]
Определена опасная вирусная нагрузка на поверхности до 21 дня на полимерных, стальных, стеклянных поверхностях и бумажных банкнотах. Для вирусов, отличных от SARS-CoV-2, самый длительный период выживания составил 14 дней, зафиксированный на стекле. Условия окружающей среды могут влиять на выживаемость вируса, и фактически низкие температуры и низкая влажность способствуют длительному выживанию вируса на зараженных поверхностях, независимо от типа поверхности. [463]
Несмотря на различия в опубликованных исследованиях, похоже, что хлоргексидин в разных концентрациях может быть эффективным для снижения вирусной нагрузки SARS-COV-2 в слюне. [477]
Необходимы дополнительные исследования не только по специфической дезинфекции в контексте коронавируса, но и по регулярному надзору или мониторингу вирусной нагрузки в осадке сточных вод, сточных водах и фильтрате свалок. Наконец, присутствие SARS-CoV-2 и других патогенных микроорганизмов в осадке сточных вод, сточных водах и фильтрате свалок может препятствовать обеспечению безопасной воды и здоровья населения в экономически маргинализированных странах. [483]
II. ЭТИОЛОГИЯ
Новый вирус SARS-CoV-2 — это несегментированный РНК-содержащий (single-stranded, ssRNA+) бетакоронавирус (относится к тому же семейству, что и MERS-CoV и SARS-CoV), Baltimore group IV. Принадлежит к семейству Coronaviridae, подсемейству Orthocoronavirinae, род Betacoronavirus, подрод Sarbecoviridae и к отряду Nidovirales [258—261]. Размер вируса — 0,1 микрон (100—150 нм).
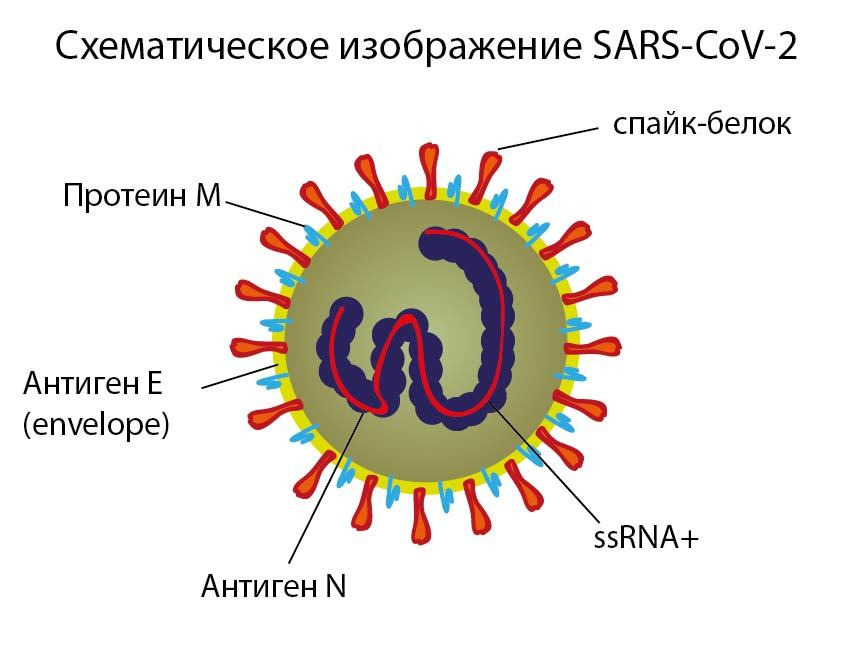
Коронавирусы получили свое название от характеристики их S-белка, который напоминает эффект ореола, наблюдаемый во время солнечного затмения, или короноподобный вид под электронным микроскопом [264].
На поверхности вируса имеются выступы гликопротеина — спайк (S) длиной около 20 нм, состоящие из двух субъединиц (S1 и S2). [6] Коронавирус использует свой белок S, основную мишень для нейтрализующих антител, для связывания со специфическими рецепторами и обеспечения слияния мембран и проникновения вируса. Это тримерный белок [264], состоящий из трех переплетенных цепей, имеющих идентичные аминокислотные последовательности, каждая из которых называется протомером.
Однако, протомеры не имеют идентичных трехмерных конформаций. Мономер тримерного белка S составляет примерно 180 кДа. [266] По своей структуре N- и С-концевые части S1 представляют собой два независимых домена: N-концевой домен (NTD) и С-концевой домен (CTD). В зависимости от вируса NTD или CTD могут действовать как рецептор-связывающий домен (RBD).
Коронавирусы также имеют мембрану (M), нуклеокапсид (N) и белки envelope (E), димер гемагглютинин-эстеразу (HE).
Другие патогенные для человека коронавирусы: SARS-CoV, MERS-CoV, HCoV-HKU1, HCoV-NL63, HCoV-OC43 и HCoV-229E. Среди них 229E и NL63 — α-коронавирусы, а OC43 и HKU1 — β-коронавирусы [257].
Геном SARS-CoV-2
Геном вируса покрыт белком N, образующим спиральный нуклеокапсид [262]. Геном, покрытый N-белком, заключен в липидную оболочку, а вирусная липидная оболочка усеяна вирусными белками [262, 263].
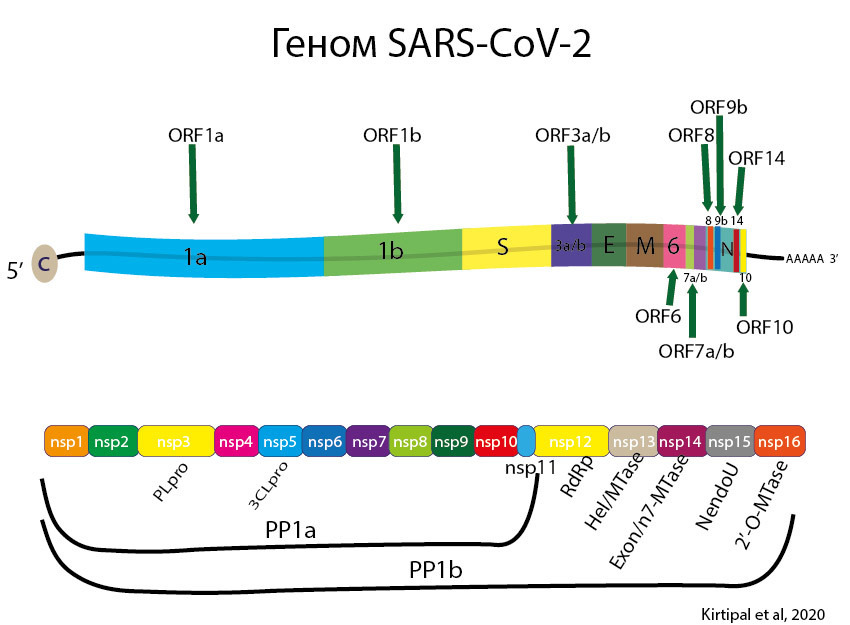
SARS-CoV-2 состоит как минимум из 14 ORF [231] (Open Reading Frames) общей длиной 29 903bp. [93] Его геном подобен SARS-CoV с порядком генов 5′-ORF1ab-S-E-MN3′. [93] Он также содержит РНК-зависимую РНК-полимеразу (RdRp). SARS-CoV-2 считается генетически более стабильным, чем SARS-CoV и MERS-CoV.
Однако, в публикации от 12 марта 2020 года сообщалось о том, что в геноме коронавируса SARS-CoV-2, обнаруженного у восьми госпитализированных пациентов в Сингапуре, зафиксирована делеция (потеря части генетического материала). [8] Известно, что с тех пор произошло много других мутаций.
2 большие ORF (Open Reading Frames) кодируют 2 полипротеина (pp1a и pp1b), которые после протеолитической активности дают начало 16 неструктурным белкам (nsp). Остальная часть состоит из вкраплений Open Reading Frames, кодирующих неструктурные и вспомогательные белки, которые не важны для репликации, но обладают иммуносупрессивной активностью. [231]
Комплекс репликации вирусной РНК состоит из неструктурных белков:
— nsp 12 (RdRp)
— nsp 7
— nsp8 (I/II).
Поскольку вирусы не могут производить свои собственные липиды, они используют липиды хозяина для репликации и морфогенеза [265]. Белок N играет решающую роль в фазе морфогенеза жизненного цикла вируса во время образования вириона [262].
Популяционно-генетический анализ 103 геномов SARS-CoV-2 показал что, по состоянию на начало 2020 года, вирус эволюционировал в два основных типа (L и S). Тип L (~70%) встречался чаще, чем тип S (~30%). Тип S эволюционно старше и менее агрессивен. [9] По состоянию на февраль 2023 года уже существует множество других штаммов.
Генетически, SARS-CoV-2 примерно на 79% похож с SARS-CoV и примерно на 50% с MERS-CoV. (Zhang et al, 2020, Kirtipal et al, 2020)
III. ШТАММЫ SARS-COV-2
Эволюция вируса была ожидаемой, и чем больше распространяется SARS-CoV-2, тем больше у него возможностей для развития и мутаций. Снижение передачи с помощью установленных и проверенных методов борьбы с болезнью, а также недопущение интродукции в популяции животных являются ключевыми аспектами глобальной стратегии по сокращению появления мутаций, которые имеют негативные последствия для общественного здравоохранения.
На Gisaid по состоянию на февраль 2023 г. доступны данные о более чем 4000 геномов SARS-CoV-2. [228] По состоянию на 3 февраля 2023 г. в GISAID загружено более 7 400 000 последовательностей Omicron SARS-CoV-2. [174]
Так, замещение D614G в феврале 2021 года увеличивает инфекционность вируса (Plante et al, 2020). Volz et al, 2021, опубликовал данные о том, что D614G ассоциировалось с более высокой вирусной нагрузкой и более молодым возрастом заболевших.
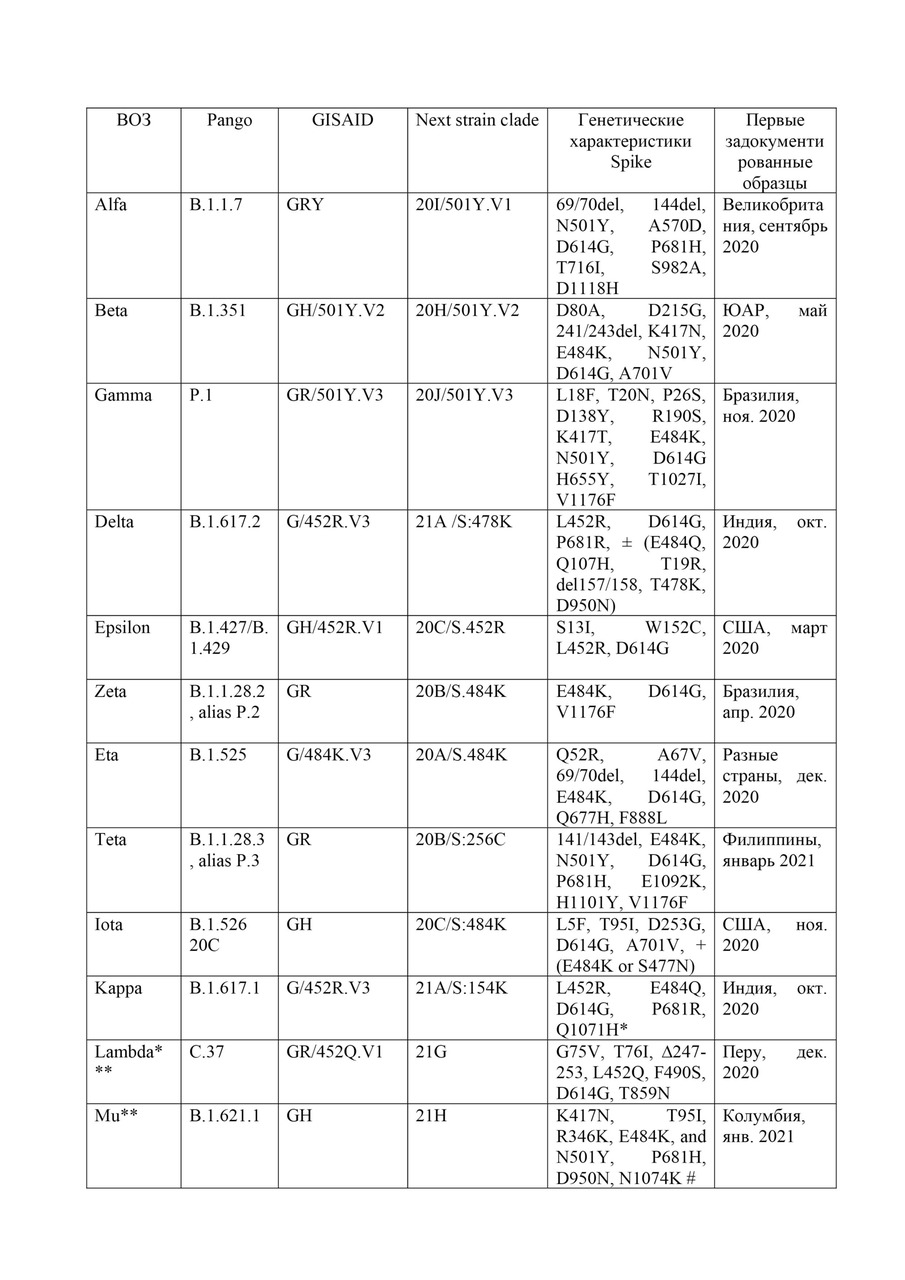
20 декабря 2020 года в Соединенном Королевстве был выделен штамм SARS-CoV-2 Альфа (ранее VUI 202012/01, изначально назван в СМИ «британским»). Основные мутации штамма: делеция 69—70, делеция 144, N501Y, A570D, D614G, P681H, T716I, S982A, D1118H. Мутация N501Y произошла непосредственно в RBD.
Возможное происхождение штамма Альфа: длительное персистирование инфекции у иммунокомпрометированного пациента с возможным накоплением «escape mutations», либо вирус попал к животному, а от животного снова к человеку.
Ретроспективное когортное исследование (препринт, 2021) у людей с положительной реакцией на SARS-CoV-2 с помощью ОТ-ПЦР было проведено с использованием наборов медицинских данных в провинциях Онтарио и Альберта, Канада, которые были наиболее пострадавшими провинциями во время возобновления случаев заболевания в Канаде с февраля до мая 2021 года. За это время 30-дневные исходы для тех, кто был инфицирован VОС (n=37902), из которых 91% были инфицированы штаммом Alpha, показали более высокий риск смерти [скорректированное отношение шансов (aOR) 1,34 в Онтарио и 1,53 в Альберте] и госпитализации [aOR 1,57 в Онтарио и aOR 1,88 в Альберте] по сравнению с инфицированными не-VОС. [224]
В проспективном клиническом когортном исследовании госпитализированных и внебольничных случаев (n=1475), проведенном в период с 1 ноября 2020 года по 30 января 2021 года в Шотландии в рамках более крупного исследования в Соединенном Королевстве и опубликованном в качестве препринта, заражение альфа-штаммом было ассоциировано с повышенной клинической тяжестью [совокупный OR 1,40] по сравнению с инфекцией, не связанной с Alpha SARS-CoV-2. Кроме того, вирусная нагрузка в образцах, положительных на штамм Alpha, была ниже, чем в образцах с не-Alpha. [225]
Штамм Бета (ранее 501.V2, изначально назван в СМИ «южноафриканским») был впервые обнаружен в Южной Африке.
Также в начале января 2021 было известно о «нигерийском» штамме P681H. В мае 2021г. важные штаммы были переименованы литерами греческого алфавита. Хочется уточнить, что в период пандемии некорректно называть штаммы с привязкой к названию местности. Это вызывает стигматизацию населения.
Штамм Гамма (ранее Р.1) был впервые обнаружен в Бразилии в ноябре 2020 года.
Штамм Дельта (ранее B.1.617.2) был впервые обнаружен в Индии в октябре 2020 года. По некоторым данным, R0 штамма Дельта =5.08. [176]
Недавнее исследование из Китая, опубликованное в качестве препринта, обнаружило более высокую вирусную нагрузку и более высокий риск пресимптоматической передачи у пациентов, инфицированных штаммом Delta, по сравнению с пациентами, инфицированными не-VОС SARS-CoV-2. [226] В ходе исследования было выявлено 167 пациентов, инфицированных штаммом Delta во время вспышки в провинции Гуандун. Средние оценки латентного периода и инкубационного периода составили 4,0 и 5,8 дня соответственно. Относительно более высокая вирусная нагрузка наблюдалась в случаях Delta. Исследование также показало, что SAR среди лиц, близко контактировавших с больными Дельта-штаммом, составил 1,4%, и 73,9% случаев передачи произошли до появления симптомов. Не вакцинированные (OR=2,84) или вакцинированные одной дозой вакцины (OR=6,02) с большей вероятностью передали инфекцию своим контактам, чем те, кто получил две дозы вакцины. [226] Хотя это исследование дает представление о различиях в инкубационном периоде и вторичной передаче штамма Дельта, это предварительные результаты, характерные для одной вспышки, и дальнейшие исследования помогут понять, как эти результаты могут быть обобщены на другие контексты.
Крупное национальное когортное исследование, проведенное в Соединенном Королевстве, выявило более высокий риск госпитализации или оказания неотложной помощи для пациентов с COVID-19, инфицированных штаммом Delta, по сравнению с пациентами, инфицированными штаммом Alpha. [227] В этом исследовании 2,3% пациентов, инфицированных штаммом Delta, против 2,2% пациентов, инфицированных штаммом Alpha, были госпитализированы в течение 14 дней после первого положительного взятого образца. Кроме того, HR для госпитализации и обращения за неотложной помощью был выше у пациентов, инфицированных штаммом Delta в течение 14 дней (5,7%), чем у пациентов, инфицированных штаммом Alpha (4,2%). Почти три четверти (74%) всех лиц в обеих группах, включенных в исследование, были непривитые. [227] В целом, эти результаты позволяют предположить, что вспышки штамма Дельта могут привести к большей нагрузке на службы здравоохранения, чем штамм Альфа, и эта нагрузка может быть даже большей в группах не вакцинированного населения.
«Датский» штамм (кластер 5). Обнаруженный в Дании штамм, названный «кластер 5» (или ΔFVI-spike из Statens Serum Institut), вызвал строгий карантин и кампанию по эвтаназии на датских норковых фермах. [246] Обнаруженный в Северной Ютландии, Дания; считается, что он передался от норок людям на фермах.
«Испанский» штамм (20A.EU1). В октябре 2020 года ученые описали в препринте, что вариант 20A.EU1 впервые наблюдался в Испании в начале лета и стал наиболее частым штаммом в нескольких европейских странах. По данным Medical Express, новый штамм, возникший летом в Испании, связан со сверхраспространением среди сельскохозяйственных рабочих на северо-востоке страны. [249]
На основании последних оценок VOI Epsilon (ранее B.1.427 / B.1.429), Zeta (ранее P.2) и Theta (ранее P.3) были реклассифицированы ВОЗ как «Alerts for further monitoring». Хотя все три штамма несут мутации с предполагаемым и / или установленным фенотипическим воздействием, зарегистрированное обнаружение этих штаммов со временем уменьшилось, что свидетельствует о снижении их соответствующей распространенности во всем мире и снижении рисков для здоровья населения по сравнению с другими VОС и VOI. ВОЗ, COVID-19 Weekly Epidemiological Update. Edition 47, 6 July 2021
Штамм Эпсилон (ранее B.1.427 / B.1.429) был связан с повышенной трансмиссивностью, умеренным снижением чувствительности к некоторым видам лечения антителами и снижением нейтрализации сыворотками выздоравливающих и привитых. [173] По состоянию на 6 июля 2021 в GISAID было загружено чуть менее 50 000 последовательностей из 45 стран. [174]
Распространенность во всем мире среди секвенированных образцов снизилась с 5% на пике в начале февраля 2021 до менее 0,5% образцов в июне-июле 2021. [175] Подавляющее большинство всемирных последовательностей (98%) было зарегистрировано в Соединенных Штатах Америки, где штамм Epsilon был постепенно вытеснен появлением штаммов альфа, гамма, дельта и др. Более того, имеющиеся данные свидетельствуют о том, что вакцины и методы лечения остаются эффективными в случае с этим штаммом.
Штамм Zeta (ранее P.2) несет в себе пик аминокислотного изменения E484K, который участвует в устойчивости к нейтрализующим антителам; однако, отсутствует совокупность мутаций, синонимичных другим VОС и VOI. Он возник в октябре 2020 года одновременно с увеличением заболеваемости в некоторых частях Южной Америки, что указывало на потенциальное увеличение риска. Глобальная распространенность образцов, секвенированных с наличием Zeta, оставалась относительно низкой и постепенно снижалась до очень низкого уровня (<0,5%) с марта 2021 года. По состоянию на 6 июля 2021 в GISAID было загружено 4439 последовательностей из 42 стран. Половина глобальных последовательностей (52%, n=2319) происходила из Бразилии, где пик распространенности достиг около 55% в начале января 2021 года. После появления и доминирования VОС-гамма в Бразилии распространенность Zeta упала до <2% секвенированных образцов в течение апреля 2021 г. и продолжала снижаться. [177]
Штамм Тета (ранее P.3) содержит несколько аминокислотных изменений, указывающих на повышенную устойчивость к нейтрализующим антителам, и потенциально более трансмиссивен; однако общее количество обнаружений этого штамма на сегодняшний день остается относительно низким. По состоянию на 6 июля 2021 в GISAID было загружено 269 последовательностей из 14 стран. Большинство этих последовательностей (71%, n=191) были зарегистрированы на Филиппинах; преимущественно в Центрально-Висайском регионе, где группа случаев была выявлена ранее в 2021 году. [174] В глобальном масштабе были зарегистрированы только спорадические случаи выявления или небольшие группы случаев.
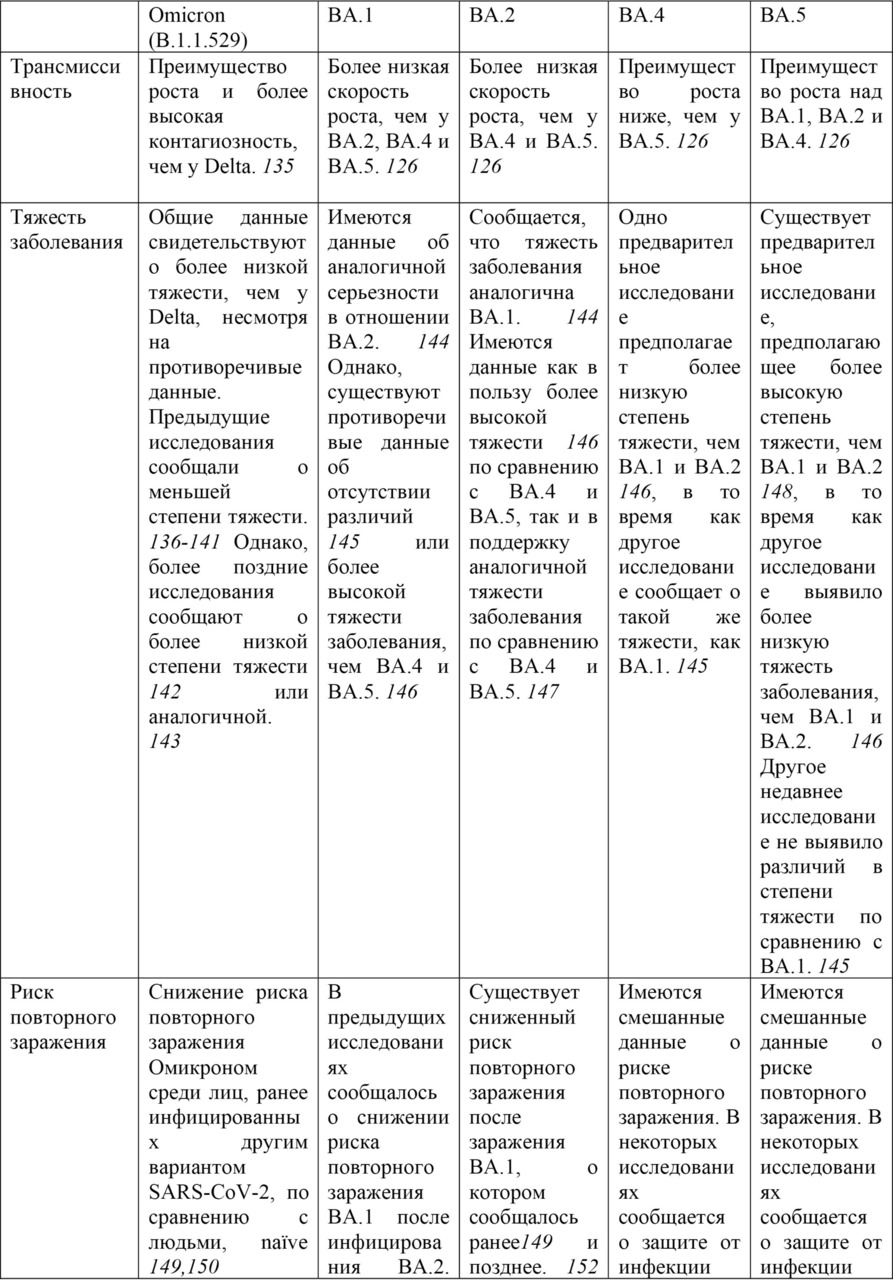
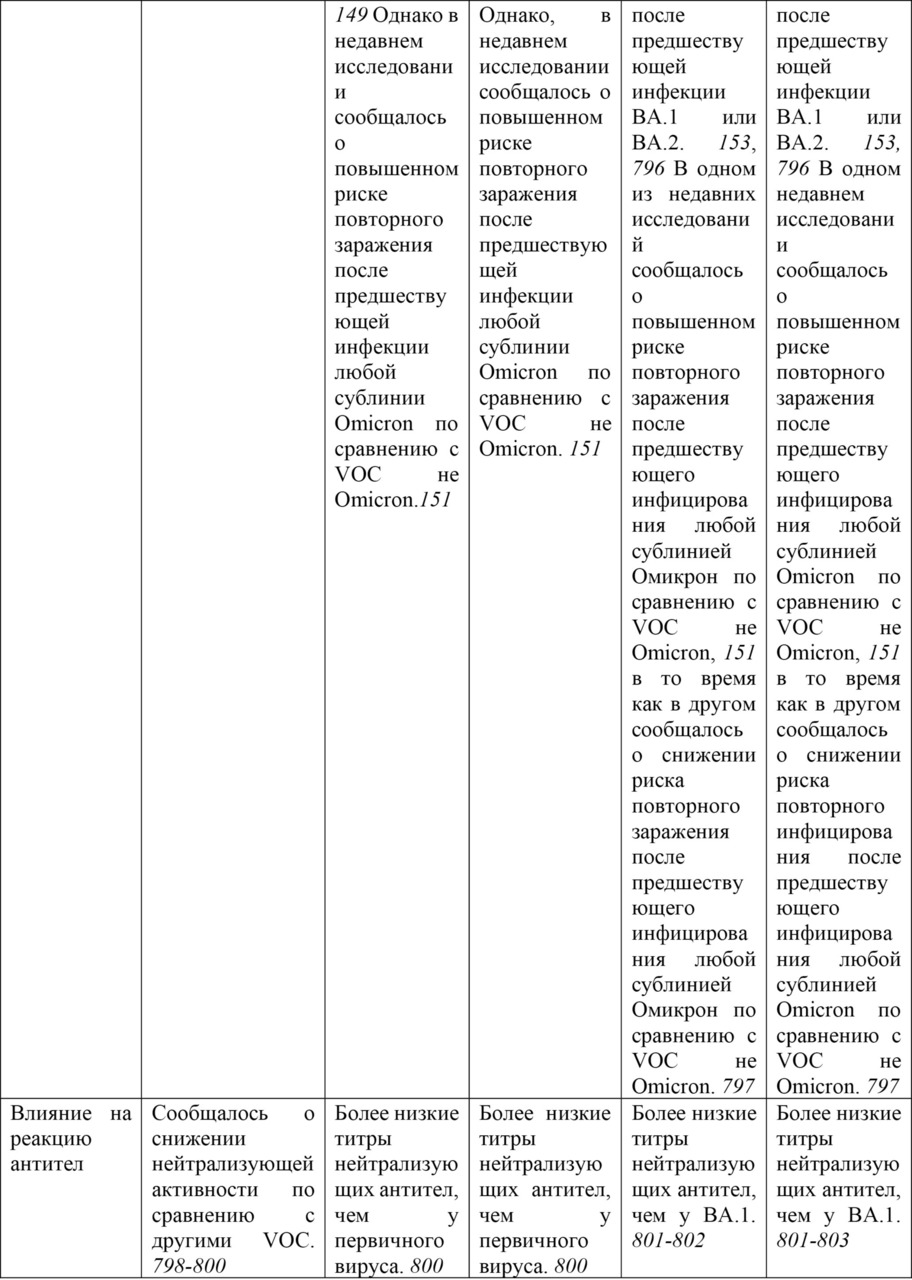
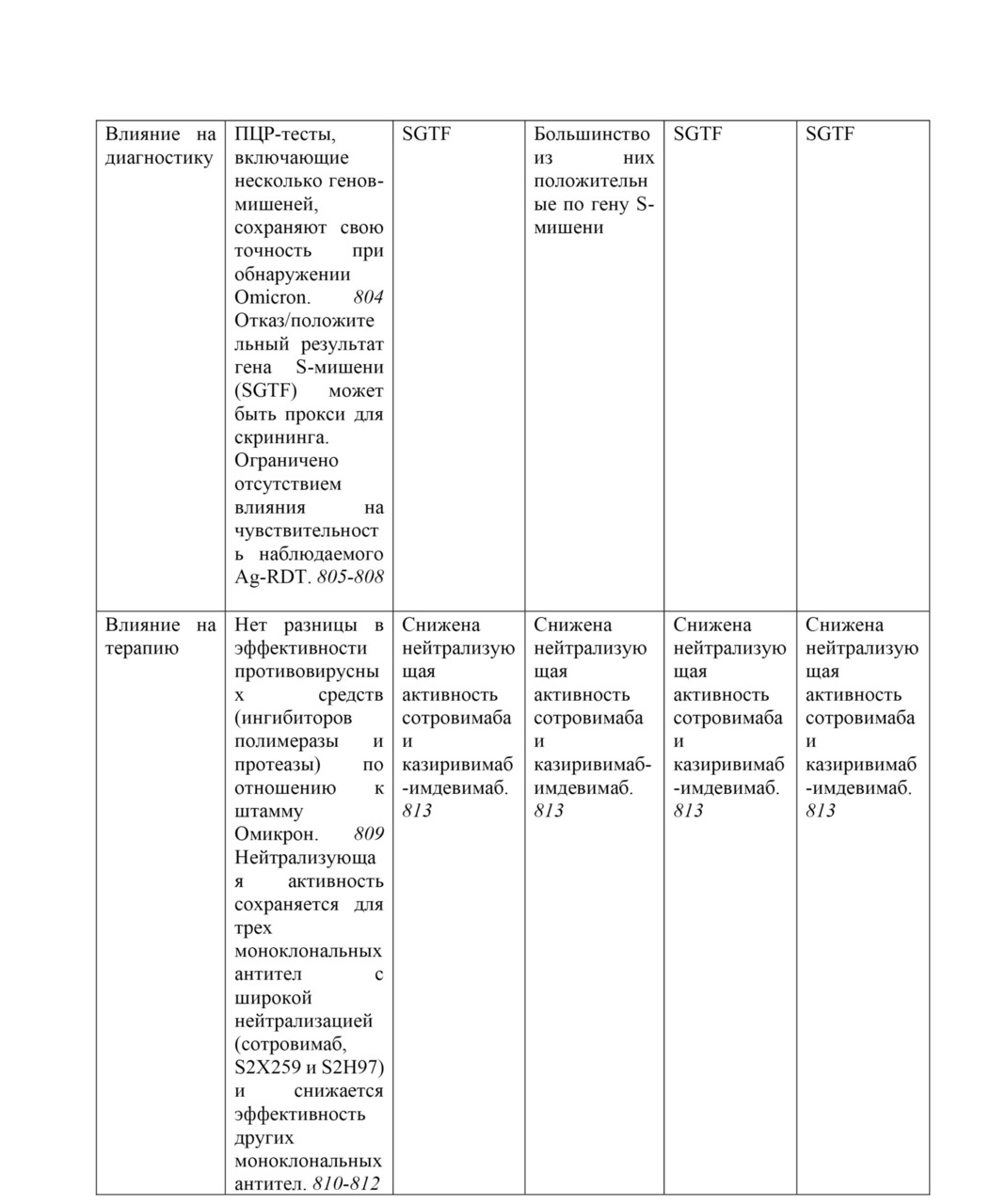
Штамм Омикрон (B.1.1.529). 26 ноября 2021 г. Техническая консультативная группа по эволюции вируса SARS-CoV-2 (TAG-VE) сообщила ВОЗ, что штамм B.1.1.529 должен быть обозначен как VOC. Ему дали имя Омикрон. Решение обозначить его как VОС было основано на доказательствах, представленных на TAG-VE, о том, что Омикрон имеет несколько мутаций (в том числе 26—32 в шиповидном белке), которые могут повысить его трансмиссивность и/или обеспечить некоторую степень ускользания от иммунитета. Штамм B.1.1.529 впервые был зарегистрирован в ВОЗ 24 ноября 2021 г. из Южной Африки, а первый известный лабораторно подтвержденный случай был выявлен в образце, взятом 9 ноября 2021 г. (Еженедельный эпидемиологический бюллетень COVID-19 (выпуск 68), опубликовано 30 ноября 2021 г.)
Когортный анализ, проведенный Агентством по безопасности здравоохранения Великобритании [814], оценил вероятность внутренней передачи для индексных случаев штамма Омикрон по сравнению с индексными случаями штамма Дельта. Анализ включал 72 761 показательный случай Delta и 121 случай Omicron в жилых домохозяйствах с датой сбора образцов в период с 15 по 28 ноября 2021 года. Бытовая передача была определена как один (первый) показательный случай, за которым следует один или несколько лабораторно подтвержденных случаев SARS-CoV-2 в одном и том же частном домохозяйстве в течение 14 дней (минимум 7 дней наблюдения). Модель многомерной логистической регрессии показала, что скорректированное отношение шансов для передачи в домохозяйстве от случая с индексной инфекцией Омикрон составило 3,2 по сравнению со случаями с индексной инфекцией Дельта.
Предварительные испытания показали, что сыворотки, полученные от вакцинированных и ранее инфицированных лиц, обладают более низкой нейтрализующей активностью в отношении Омикрона, чем любые другие циркулирующие VОС SARS-CoV-2 и его предкового варианта. (Еженедельный эпидемиологический обзор COVID-19. Выпуск 70, опубликовано 14 декабря 2021 г.)
Хотя нейтрализующая активность специфических антител, по-видимому, снижена по сравнению с Омикроном, предварительные исследования показывают, что ответы Т-клеток CD8+ могут по-прежнему сохранять способность распознавать Омикрон. [815]
Подштамм Omicron XBB.1.5 (называемый в СМИ «Kraken»)
Подштамм Omicron XBB.1.5 представляет собой рекомбинант сублинии BA.2.10.1 и BA.2.75, о котором впервые было сообщено 13 августа 2022 г., с мутацией F486P в шиповом белке, повышающей инфекционность из-за повышенной аффинности связывания с рецептором ACE2. За неделю, закончившуюся 21 января 2023 г., подштамм XBB.1.5 стал причиной 49,1% случаев COVID-19 в США. Быстрое увеличение распространенности этого подштамма может быть объяснено иммунным уходом от предыдущих инфекций или вакцин, спайковыми мутациями в F486P и повышенной аффинностью к рецептору ACE2. Кроме того, современные бустерные вакцины могут не обеспечивать адекватной защиты от заражения этим подштаммом. [795]
С 22 октября 2022 г. по 23 января 2023 г. сообщалось о 8931 последовательности штамма Omicron XBB.1.5 из 54 стран (исключая последовательности с низким охватом). Большинство этих последовательностей происходило из Соединенных Штатов Америки (75,0%); страны с распространенностью> 1% — это Великобритания (9,9%), Канада (3,0%), Дания (2,0%), Германия (1,5%), Ирландия (1,3%) и Австрия (1,3%). Основываясь на своих генетических характеристиках и оценках скорости роста, XBB.1.5, вероятно, будет способствовать увеличению заболеваемости во всем мире. Имеются доказательства умеренной силы в отношении повышенного риска передачи инфекции и ускользания от иммунитета. Согласно сообщениям из нескольких стран, не было обнаружено никаких ранних признаков обострения заболевания. Число случаев, связанных с XBB.1.5, все еще невелико, и поэтому степень тяжести еще не может быть достоверно оценена. В заключение, XBB.1.5, по-видимому, не несет каких-либо дополнительных рисков для здоровья населения по сравнению с другими потомками Omicron. (Еженедельный эпидемиологический бюллетень COVID-19. Выпуск 127, опубликованный 25 января 2023 г.)
Соответствующие мутации в подштамме XBB: S:G339H, S:R346T, S:L368I, S:V445P, S:G446S, S:N460K, S:F486S и S:F490S. В конце 2022 г. глобальная распространенность ХВВ составляла 3,8%, и он был обнаружен в 70 странах. Пятью странами с самой высокой распространенностью XBB были Индия (62,5%), Доминиканская Республика (48,2%), Сингапур (47,3%), Малайзия (40,9%) и Индонезия (29,3%).
Подштамм BA.2.75 содержит замены S:D339H, S:G446S, S:N460K и инверсию S:Q493R. Двумя примечательными штаммами BA.2.75 с дополнительными интересующими мутациями в белке Spike являются BA.2.75.2 (BA.2.75 + S:R346T, S:F486S и S:D1199) и CH.1.1 (BA.2.75 + S: R346T), S:K444T, S:L452R и S:F486S). BA.2.75 был впервые обнаружен 31 декабря 2021 года и начал распространяться в некоторых странах региона Юго-Восточной Азии. С момента появления о BA.2.75 сообщили 85 стран. Пятью странами, сообщающими о самой высокой распространенности ВА.2.75, являются Таиланд (53,8%), Австралия (25,1%), Малайзия (22,5%), Китай (18,8%) и Новая Зеландия (16,3%). BA.2.75 быстро стал доминирующим в Индии и Бангладеш; но затем был заменен на XBB без указания на значительное увеличение частоты зарегистрированных случаев. Судя по имеющимся в настоящее время данным, BA.2.75 не показал существенного отличия фенотипа от других штаммов Omicron в странах, где он распространился.
Подштамм BA.5 с одной или несколькими из 5 мутаций S:R346X, S:K444X, S:V445X, S:N450X и/или S:N460X находится под наблюдением, поскольку эти мутации были связаны с важной функциональной ролью вируса (например, устойчивость к нейтрализации, повышенная трансмиссивность). Этот класс штаммов быстро увеличивается и был обнаружен в 119 странах с общей распространенностью 15,0%. Пять стран, сообщающих о самой высокой распространенности ВА.5, — это Южная Африка (75,4%), Коста-Рика (70,9%), Перу (53,5%), Мексика (49,8%) и Бразилия (42,4%).
Подштамм BQ.1 является потомком BA.5 с дополнительными заменами S:K444T и S:N460K. Линия потомков BQ.1 с наибольшей распространенностью — это BQ.1.1, несущая дополнительную мутацию S:R346T. BQ.1 является одним из самых быстрорастущих штаммов и распространился на 90 стран. Пятью странами с самой высокой распространенностью штамма BQ.1 являются Эквадор (65,5%), Португалия (56,7%), Испания (54,1%), Франция (48,7%) и Колумбия (46,8%).
BA.2.30.2 содержит мутации S:K444R, S:N450D, S:L452M, S:N460K и S:E484R. В конце 2022 года глобальная распространенность BA.2.30.2 составляла 0,3%. Странами с самой высокой распространенностью были Исландия (4%), Словения (2%), Австралия (1,1%), Колумбия (0,9%) и Республика Корея (0,6%). (Еженедельный эпидемиологический обзор COVID-19. Выпуск 122, опубликованный 14 декабря 2022 г.)
Перечень всех штаммов с мутациями доступен по ссылке: covdb.stanford.edu/page/mutation-viewer.
Цифры курсивом рядом с текстом таблиц указывают на источники информации.

* covdb.stanford.edu/page/mutation-viewer
** Weekly_Epi_Update_55
*** https://www.who.int/en/activities/tracking-SARS-CoV-2-variants#
P J Halfmann et al., 2022
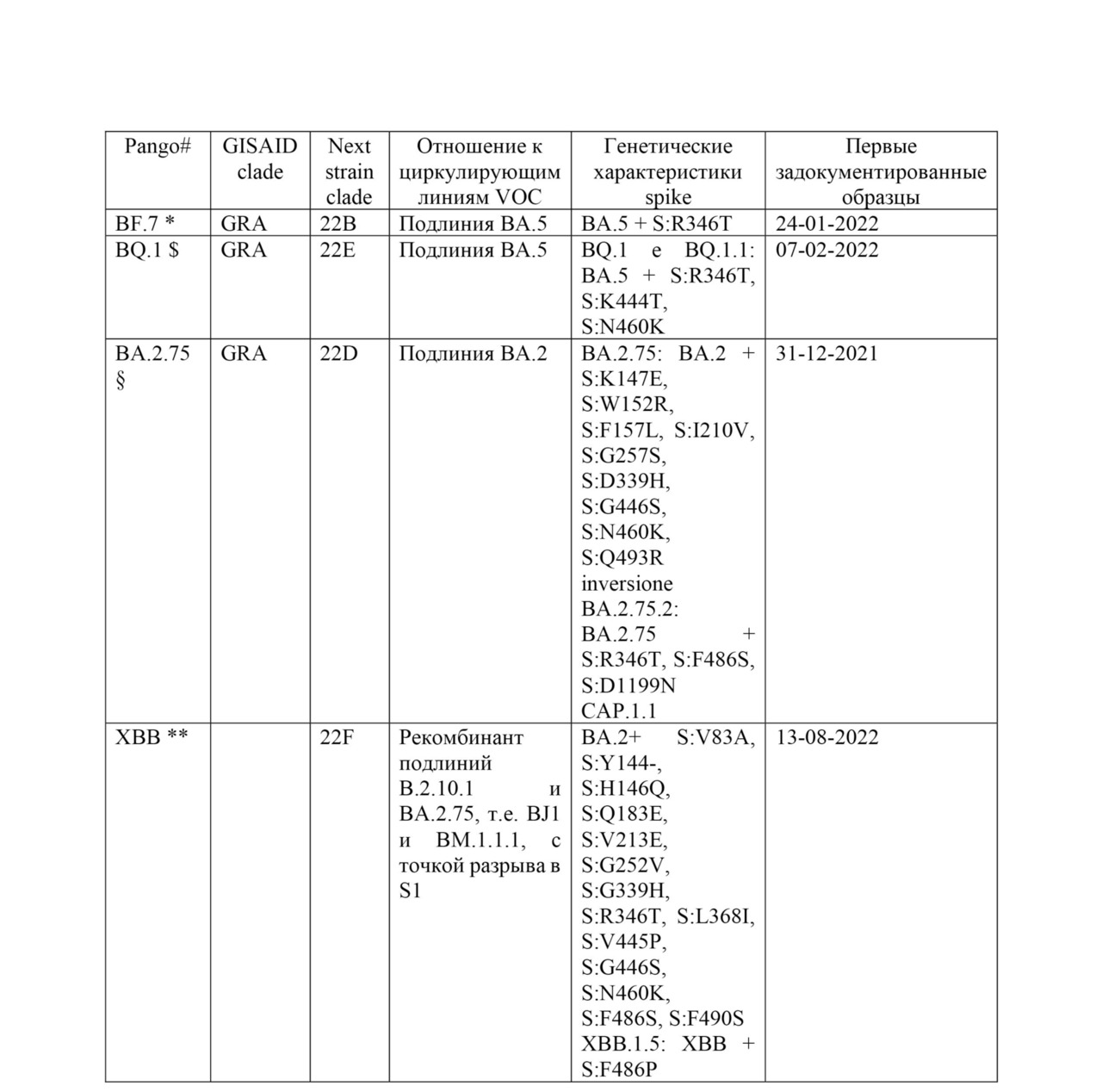
# включая потомки; * дополнительные мутации вне белка S: N: G30-, S33F, ORF9b: M26-, A29I, V30L; $ дополнительные мутация вне белка S: ORF1a: Q556K, L3829F, ORF1b: Y264H, M1156I, N1191S, N: E136D, ORF9b: P10F; § дополнительные мутации вне белка S: ORF1a: S1221L, P1640S, N4060S, ORF1b: G662S, E: T11A; ** дополнительные мутации вне белка S: ORF1a: K47R, ORF1b: G662S, S959P, E: T11A, ORF8: G8*.
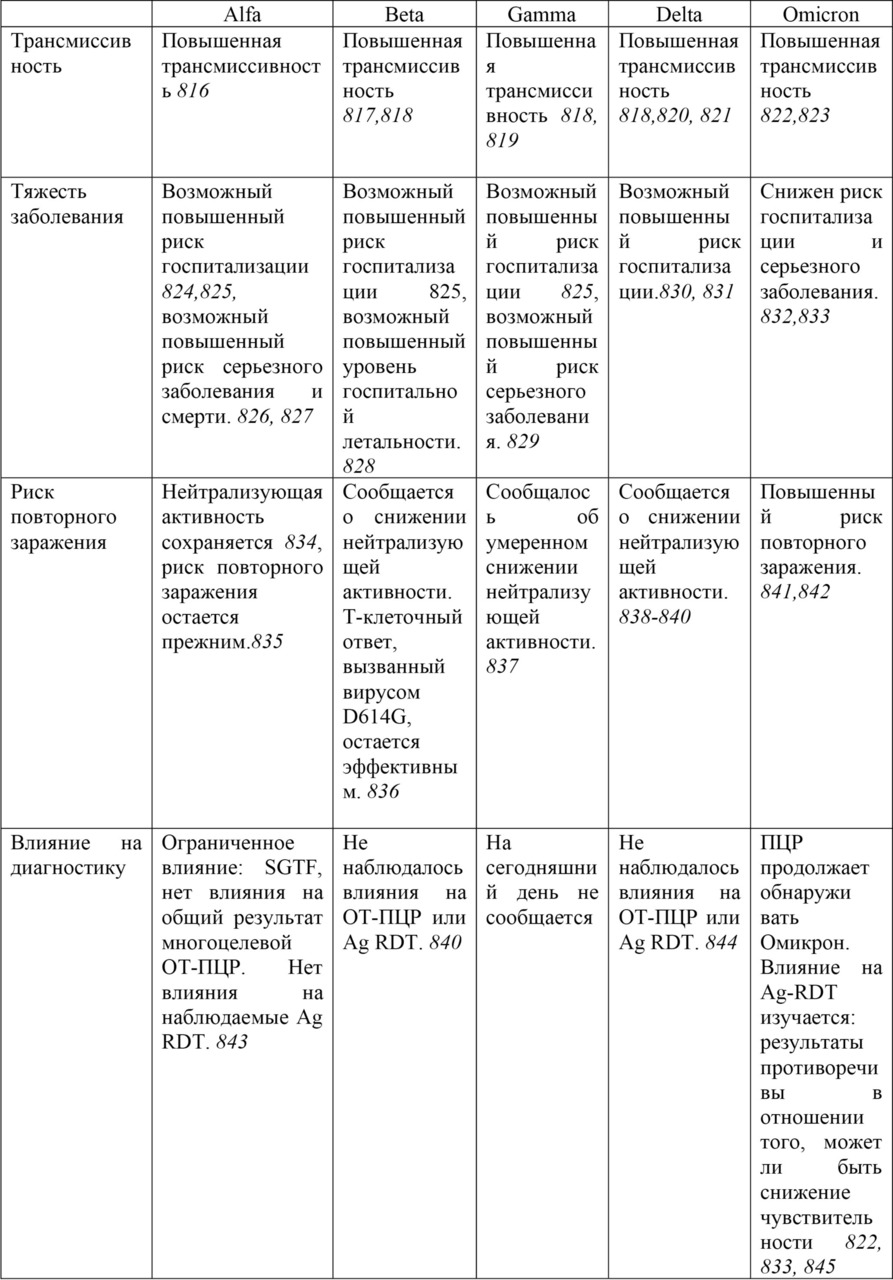
ВОЗ, Еженедельное эпидемиологическое обновление COVID-19. Выпуск 128, 1 февраля 2023 г.
Во всем мире с 30 декабря 2022 г. по 30 января 2023 г. через GISAID было передано 90 985 последовательностей SARS-CoV-2. Из них 90 937 последовательностей были штамм Omicron (VOC), что составляет более 99,9% последовательностей, зарегистрированных во всем мире.
Во всем мире BA.5 и его потомки остаются доминирующими. С 9 по 15 января 2023 г. на них приходилось 65,7% (с 16357 последовательностями) всех последовательностей, представленных в GISAID. Распространенность BA.2 и его потомков составила 14,6%, а BA.4 и его потомков — 0,3%. В январе 2023 года в тройку самых распространенных штаммов в мире вошли BQ.1.1 (28,2%), BQ.1 (14,1%) и XBB.1.5 (11,5%). BQ.1.1 и BQ.1 являются потомками линии BA.5, тогда как XBB.1.5 является рекомбинантной линией потомка BA.2.
Динамика циркуляции штаммов различается в зависимости от региона ВОЗ и между странами в пределах одного региона из-за множества факторов, включая предыдущие циркулирующие штаммы, охват вакцинацией и принятые медицинские и социальные меры. По состоянию на январь 2023 г. тройка наиболее распространенных штаммов в каждом регионе выглядела следующим образом [175]:
• Африка (332 последовательности): BQ.1.1 (23,7%), BA.2.10.1 (12,3%) и XBB.2 (12,1%);
• Америка (40 010 последовательностей): BQ.1.1 (37,5%), XBB.1.5 (19,6%) и BQ.1 (19,6%);
• Восточное Средиземноморье (85 последовательностей): XBB.1 (37,2%), BN.1 (10,3%) и BA.5.2 (10,3%);
• Европа (40379 последовательностей): BQ.1.1 (31,3%), BQ.1 (13,0%) и CH.1.1 (12,3%);
• Юго-Восточная Азия (389 последовательностей): XBB.1 (41,1%), BQ.1.1 (14,3%) и BA.2.10.1 (6,0%);
• Западная часть Тихого океана (15515 последовательностей): BA.5.2 (30,1%), BF.7 (13,2%) и BQ.1.1 (8,5%).
В настоящее время ВОЗ уделяет первоочередное внимание мониторингу четырех потомков Омикрона. С 9 по 15 января 2023 г. было зарегистрировано 1147 последовательностей BF.7 (4,6%), 11 674 последовательностей BQ.1 (46,9%), в том числе BQ.1.1 (7189 последовательностей, 28,9%). Было 3473 последовательности BA.2.75 (13,9%), включая BA.2.75.2 (35 последовательностей, <1%) и CH.1.1 (1672 последовательности, 6,7%). Наконец, 4049 последовательностей XBB (16,3%), включая XBB.1.5 (3005 последовательностей, 12,1%), были отправлены в GISAID по всему миру. [175]
Согласно обновленной информации китайских властей, с 26 сентября 2022 года по 23 января 2023 года по всей стране было проанализировано 18 906 последовательностей. Распространенность подштаммов: BA.5.2 (70,8%) и BF.7 (23,4%) были наиболее распространенными циркулирующими подштаммами. Что касается региональных различий, согласно имеющимся данным, BF.7 доминирует в Пекине и Тяньцзине, а BA.5.2 доминирует в большинстве других провинций. (ВОЗ)
В данный момент я веду также подробную хронологию о COVID, и подробнее напишу обо всем в моей новой книге (пока не знаю, когда эта книга будет опубликована).
IV. ПРОИСХОЖДЕНИЕ ВИРУСА
В определенный момент вирус в своем природном очаге мутировал и приобрел новый протеин, который сделал его опасным для человека. Это произошло в процессе спилловера (англ. spillover).
Однако, данные систематического анализа предложили три постулированные гипотезы относительно происхождения SARS-CoV-2, которые включают зоонозное происхождение, лабораторное происхождение и неясное происхождение. [425]
Резервуар вируса — летучие мыши (Rhinolophus sinicus [12]); промежуточный хозяин: ящерица панголин (Manis javanica)? [615—617] Существование промежуточного животного-хозяина SARS-CoV-2 между вероятным резервуаром летучей мыши и людьми все еще находится в стадии исследования. [13] Этим промежуточным животным-хозяином может быть домашнее животное, дикое животное или одомашненное дикое животное. [71]
22 января 2020 в Journal of Medical Virology Wei Ji и соавторами было опубликовано исследование о том, что SARS-CoV-2 обладает наиболее сходной генетической информацией с коронавирусом летучей мыши и наиболее схожим смещением в использовании кодонов со змеиным коронавирусом. Тем не менее, последующие исследования показали, что источником вируса всё же являются летучие мыши.
Обнаружение белка AS-SCoV2 и bat-SL-RatG13 у вируса SARS-CoV-2 позволило предположить, что новый коронавирус, вероятно, возник в результате генетического дрейфа из bat-SL-CoV-RaTG13 [15] или Bat SARSr CoV-ZC45, Bat SARSr CoV-ZXC21. [93]
В исследовании «Genomic variance of the 2019‐nCoV coronavirus» обнаружено, что геном CoV летучей мыши на 96,2% идентичен геному 2019-nCoV, также набор белков SARS-CoV-2 на 77,1% идентичен протеому вируса SARS. [16] Исследования множественного анализа последовательностей показали, что последовательности генома SARS-CoV-2 демонстрируют более чем 99% идентичность [16,90,91]. Низкая гетерогенность последовательностей свидетельствует о том, что все эти SARS-CoV-2 происходили от одного и того же источника в течение очень короткого периода. [90] При анализе 160 полных геномов SARS-CoV-2 человека в начале пандемии исследователи из Кембриджского университета обнаружили три центральных типа вируса, отличающихся аминокислотным изменением: A, B и C. Типы A и C были обнаружены, в основном, у европейцев и американцев, тогда как тип B был наиболее распространенным типом в Восточной Азии. [111] В начале пандемии уровень мутаций SARS-CoV-2 был низок, и не было никаких доказательств того, что произошла вирусная рекомбинация. [93]
Учёные пришли к выводу, что вирус SARS-CoV-2 не произошел непосредственно от панголинов. Однако, из-за ограниченных метагеномных данных о вирусах, полученных из панголинов, нельзя исключить, что другие китайские панголины могут содержать коронавирусы, которые демонстрируют большее сходство с вирусом SARS-CoV-2. [17]
Анализ общедоступных данных о последовательности генома из SARS-CoV-2 и родственных вирусов не выявил доказательств того, что вирус был произведен в лаборатории. [31] Все имеющиеся на сегодняшний день доказательства свидетельствуют о том, что вирус имеет естественное животное происхождение и не является манипулируемым или сконструированным вирусом. (ВОЗ 2020, Coronavirus disease 2019 (COVID-19). Situation Report — 94) [71]
На основании имеющейся информации в начале вспышки не было известно, оказывает ли SARS-CoV-2 влияние на здоровье животных, и о конкретных событиях не сообщалось у конкретных животных. [14]
Однако, в начале февраля 2020 года собака из Тай-Хана, Гонконг, которая жила в той же семье, что и пациент с COVID-19, стала положительной на SARS-CoV-2 при ОТ-ПЦР, и не имела клинических признаков.
На факультете ветеринарной медицины Университета Льежа была обнаружена РНК вируса SARS-CoV-2 в кале кошки с рвотой и клиническими признаками заболеваний органов пищеварения и дыхательных путей. Кот заболел через 1 неделю после возвращения хозяина из Италии. Он имел клинические симптомы (анорексия, диарея, рвота, кашель и поверхностное дыхание), совместимые с классической коронавирусной инфекцией (респираторные и / или пищеварительные симптомы). У кошки был положительный результат на вирус SARS-CoV-2 в последующих пробах стула и желудочного сока. Положительные результаты ПЦР были подтверждены секвенированием. Через девять дней после появления клинических симптомов состояние кошки улучшилось. Мнение Научного комитета: «Научный комитет принял к сведению сообщения о предполагаемых случаях обнаружения вируса SARS-CoV-2 у домашних животных (2 собаки в Гонконге и 1 кошка в Бельгии). На основании этих данных Научный комитет считает низким риск передачи вируса от человека к животным». [73]
Позже также сообщалось об обнаружении SARS-CoV-2 у тигра из зоопарка в Нью-Йорке. [72]
Ещё одно исследование показало, что SARS-CоV-2 легко заражал кошек и хорьков, но обладает слабой способностью заражать собак, свиней, кур и уток. [92]
Было обнаружено, что значительный процент животных инфицирован SARS-CoV-2, при этом норка входит в число наиболее частых животных, за ней следуют собаки и кошки. [536]
Некоторые млекопитающие, включая кошек, собак, полевок, хорьков, летучих мышей, хомяков, норок, свиней, кроликов, енотовидных собак и белохвостых оленей, заразились вирусом естественным путем. Некоторые лабораторные открытия показали, что такие животные, как кошки, хорьки, фруктовые летучие мыши, хомяки, енотовидные собаки и белохвостые олени, могут передавать болезнь другим животным того же вида. [583]
Большинство моделей COVID-19 на животных повторяли мягкую модель человеческого COVID-19 с фенотипом полного выздоровления. Серьезных заболеваний, связанных со смертностью, не наблюдалось, что свидетельствует о большом разрыве между COVID-19 в моделях человека и животных. [595]
В отчете Нацразведки США в конце августа 2021 года говорится, что все разведагентства США рассматривают две версии происхождения вируса: естественный контакт с инфицированным животным или инцидент, связанный с лабораторией Уханьского института вирусологии. При этом, в разведке считают, что коронавирус не был разработкой биологического оружия. Большинство разведагентств также полагают, что SARS-CoV-2 не был создан с помощью генной инженерии. [183]
Недавно директор Федерального бюро расследований США Кристофер Рэй заявил, что коронавирус «скорее всего» был спровоцирован утечкой из лаборатории в Китае. Об этом он сказал в интервью телеканалу Fox News. По его словам, в ФБР давно считают, что причиной пандемии «вероятно является потенциальный инцидент в лаборатории в Ухане, Китай».
Несмотря на то, что зоонозное происхождение SARS-CoV-2 до сих пор окончательно не установлено, другие данные предполагают зоонозное происхождение, в отличие от некоторых альтернативных концепций, включая вероятность лабораторной аварии или утечки. Данные показывают, что зоонозное происхождение имеет более высокую доказательную поддержку, чем лабораторное происхождение. [425]
5 июля 2020 г. британский эпидемиолог Том Джефферсон, почетный старший научный сотрудник Центра доказательной медицины (CEBM) Оксфордского университета [239], выдвинул гипотезу о том, что вирус SARS-CoV-2 является «спящим» вирусом и что он был активирован, породив эпидемию COVID-19 в результате конкретных и малоизвестных экологических обстоятельств; в поддержку этой гипотезы два факта [240] [241]:
— по мнению исследователей из Института Макса Планка и Каролинского Института, вирус уже присутствовал во времена неандертальцев, на самом деле они обнаружили унаследованный от неандертальцев геномный сегмент размером ~ 50 kb, который встречается с частотой ~ 30% в Южной Азии и ~8% в Европе [242];
— вирус был обнаружен задолго до вспышки COVID-19 в разных сточных водах из разных канализационных систем по всему миру. [243] [244]
До сих пор не было доказательств того, что морепродукты с рынка в Ухане вызвали пневмонию, связанную с SARS-CoV-2. [37] Хотя, пробы окружающей среды, взятые с этого рынка в декабре 2019 года, дали положительный результат на SARS-CoV-2, что еще раз свидетельствует о том, что рынок в городе Ухань был источником этой вспышки или играл роль в её первоначальном усилении. [71]
V. МЕХАНИЗМЫ ПЕРЕДАЧИ
1) Прямой — капельный, от человека к человеку [97] (через капельки слюны зараженного пациента после длительного прямого контакта, более 15 минут, на расстоянии менее 1 метра). Является основным путём передачи вируса; несколько исследований демонстрируют непрерывную передачу от человека к человеку [277,278; RCOG].
2) непрямой (контактно-бытовой) — при прикосновении к поверхностям, на которых находится вирус. Этот путь инфицирования менее вероятный. Команда вирусолога Хендрика Штрека из Хайнсберга пришла к выводу, что на поверхностях жизнеспособных вирусов нет — только нежизнеспособные.

Интересно, что у полностью бессимптомных субъектов может быть вирусная нагрузка, аналогичная таковой у пациентов с симптомами [284].
Данные одного систематического обзора показывают положительную корреляцию между вирусной нагрузкой SARS-CoV-2 и его трансмиссивностью. [310]
Эпидемиологические данные из нескольких источников показывают, что передача SARS-CoV-2 более эффективна в холодном и сухом климате, чем в жарких и влажных местах. [378,379]
Текущие данные свидетельствуют о том, что SARS-CoV-2 может передаваться во время авиаперелетов, но опубликованные данные не позволяют сделать убедительную оценку вероятности и масштабов. [422] В одном обзоре говорится, что скученность и большее количество людей в каюте были связаны с повышенным риском передачи инфекции на круизных лайнерах. (E C Rosca, 2022)
В среднем, на каждое первичное заражение приходилось 5,8 близких контакта. Среди близких контактов с COVID-19 пожилой возраст и контакты в домохозяйствах были связаны с более высокими показателями заражения, а тесные контакты с симптоматическими пациентами имели в три раза более высокий риск заражения, чем тесные контакты с бессимптомными пациентами. [645]
Передача SARS-CoV-2 с хирургическим дымом и аэрозолями еще не наблюдалась. Однако, учитывая потенциальный риск передачи вируса, при выполнении операций следует соблюдать осторожность, чтобы обеспечить безопасность персонала операционной. [654]
В исследовании китайских врачей были упоминания об обнаружении вируса в фекальных массах больных. [18] Выделение вируса SARS-CoV-2 из образцов стула от пациентов с COVID-19 продемонстрировало, что SARS-CoV-2 может распространяться через фекалии. Тем не менее, фекально-оральный механизм передачи официально не подтверждён.
Продолжительность положительного результата на РНК SARS-CoV-2 составила 18,29 дня в образцах из верхних дыхательных путей. Продолжительность в мокроте и кале была больше, а в крови короче. Продолжительность обнаружения в образцах верхних дыхательных путей была больше у лиц пожилого возраста, с любыми сопутствующими заболеваниями, более тяжелыми и получавшими глюкокортикоиды. [569]
Совокупная распространенность РНК SARS-CoV-2 в желудочно-кишечном тракте у детей с COVID-19 составила 86%. После того, как респираторный образец стал отрицательным, у 72% была стойкая элиминация в желудочно-кишечных образцах. РНК SARS-CoV-2 в желудочно-кишечном тракте дает положительный результат теста в течение более 70 дней после появления симптомов. [449] У детей с COVID-19 наблюдается более длительное выделение вируса с калом по сравнению со взрослыми. Плохая практика гигиены рук у детей, их склонность к глотанию мокроты и/или слюны, разница в экспрессии ACE2 в кишечнике у детей и взрослых, а также различия в иммунном статусе и кишечном микробиоме могут рассматриваться как потенциальные факторы более длительного веделения вирусной инфекции с фекалиями у детей. [530]
Анализ показал постоянное обнаружение вируса в образцах верхних дыхательных путей, нижних дыхательных путей и стула, независимо от клинической тяжести COVID-19. Этот анализ показывает, что SARS-CoV-2 дольше сохраняется в нижних дыхательных путях, чем в верхних дыхательных путях у взрослых пациентов. [552]
Кроме того, Xia и соавт. обнаружили РНК SARS-CoV-2 в двух образцах слёз и секрета конъюнктивы у одного пациента из 30 с конъюнктивитом и с диагнозом COVID‐19. У 29 остальных пациентов конъюнктивита не было. Исследователи отметили, что передача SARS-CoV-2 через конъюнктивальный секрет не распространена и менее вероятна, но также заявили, что риск передачи не может быть полностью исключен. [19] В Италии также обнаружили SARS-CoV-2 в образцах слёз пациента. Другое исследование предполагает, что нет никаких доказательств того, что структура глаза может быть дополнительным путем передачи SARS-CoV-2, однако это заслуживает дальнейшего изучения. [467]
Риск, связанный с человеческой кровью для передачи другим людям, достоверно неизвестен. Имеются данные, что ни у одного реципиента тромбоцитов или эритроцитарной массы от доноров в Корее, у которых после донорства была диагностирована инфекция SARS-CoV-2 или был получен положительный результат на РНК SARS-CoV-2, не развились симптомы, связанные с COVID-19. [11] Несмотря на отсутствие каких-либо доказательств передачи COVID-19 при донорстве органов [104], нельзя пренебрегать этим путем передачи, поскольку вирус был выделен из крови приблизительно у 15% пациентов [105].
Использование нелегочных органов (почек, печени и сердца) от доноров, положительных на SARS-CoV-2, представляется безопасной практикой с низким риском передачи независимо от наличия симптомов на момент сбора. Низкая репликация вируса (Ct> 30) была безопасной среди доноров органов, не являющихся легкими. [452]
Вертикальная передача SARS-CoV-2 (от матери к ребенку) уже выявлена. [44—47] Однако, для подтверждения этого вывода необходимы дополнительные исследования и доказательства, поскольку некоторые исследования в Великобритании и других странах подтвердили низкую частоту вертикальной передачи SARS-CoV-2 [279—283]. Вертикальная передача встречается редко. Если это происходит, на неё, по-видимому, не влияют способ родов, позднее пережатие пуповины, контакт кожа к коже, способ кормления или то, находятся ли женщина и ребенок в одной комнате. [RCOG] Вирус не был обнаружен в образцах пуповинной крови, плаценте или вагинальных выделениях. В начале пандемии РНК SARS-CoV-2 не обнаруживалась в грудном молоке. [48,49] Ограниченные доказательства низкого качества свидетельствуют о том, что РНК SARS-CoV-2 обнаруживается в грудном молоке в крайне низкой пропорции. Однако, в соответствии с рекомендациями Всемирной организации здравоохранения, исключительно грудное вскармливание следует рассматривать во всех случаях, если нет других противопоказаний. (J Kumar et al., 2022)
Имеются убедительные доказательства трансплацентарной передачи антител против COVID-19 после инфицирования матери. Несколько исследований продемонстрировали наличие IgG в образцах пуповинной крови, что позволяет предположить, что пассивный иммунитет может передаваться новорожденному. Через шесть месяцев после рождения антитела IgG к SARS-CoV-2 были обнаружены в образцах крови младенцев после заражения во время беременности. [RCOG-882]
Грудное молоко кормящих женщин после инфицирования SARS-CoV-2 содержит специфические анти-SARS-CoV-2 IgG, IgM и/или IgA даже после легкой или бессимптомной инфекции. Текущие данные показывают, что эти антитела могут нейтрализовать вирус SARS-CoV-2 in vitro. [528]
Patrì и соавт. выдвинули гипотезу о возможном сексуальном пути передачи вируса. [86]
РНК SARS-CoV-2 была обнаружена в сперме людей. Концентрация спермы была значительно снижена, а также снижены общий объем эякулята и спермы в группе А по сравнению с контрольной группой. Отмечалось незначительное влияние на прогрессивную моторику и наличие лейкоцитов в сперме. РНК SARS-CoV-2 в сперме инфицированных лиц обнаруживается редко. По этой причине передача инфекции половым путем через сперму маловероятна и мало опасна для общественного здравоохранения. Однако, было отмечено значительное снижение объема сперматозоидов, концентрации сперматозоидов и общего количества сперматозоидов в эякуляте. [568]
Ling Y и соавторы [102] продемонстрировали в своем исследовании из 66 пациентов, которые выздоровели от COVID-19, что вирусная РНК была обнаружена в образцах мочи у 6,9% пациентов, даже после того, как глоточные мазки стали отрицательными. Напротив, Wang W и соавт. [103] сообщили, что SARS-CоV-2 не был обнаружен в образцах мочи среди пациентов.
Нельзя пренебрегать такими путями, как передача во время переливания крови [106] или передача во время эндоскопической хирургии желудочно-кишечного тракта [107].
Загрязнение воздуха и распространение вируса
Было проведено несколько исследований связи между загрязнением воздуха, смертностью и распространением SARS-CoV-2.
Предыдущие исследования продемонстрировали положительную связь между загрязнением воздуха и смертностью от атипичной пневмонии среди населения Китая. [384]
Опубликованные исследования подтверждают гипотезу передачи вируса на расстоянии 2м от инфицированного человека. Исследователи продемонстрировали более высокую устойчивость SARS-CoV-2 к поверхностному аэрозолю по сравнению с SARS-CoV-1 (при этом, вирус остается жизнеспособным и заразным в аэрозоле в течение нескольких часов), а также то, что передача SARS-CoV воздушно-капельным путем может происходить при тесном контакте. Действительно, существуют разумные доказательства возможности воздушно-капельной передачи SARS-CoV-2 из-за его персистенции в каплях аэрозоля в жизнеспособной инфекционной форме. Основываясь на имеющихся знаниях и эпидемиологических наблюдениях, вполне вероятно, что мелкие частицы, содержащие вирус, могут распространяться в закрытых помещениях на расстоянии до 10м от источников выделений, что представляет собой своего рода аэрозольную передачу. [385]
В Соединенных Штатах было обнаружено, что увеличение концентрации PM2,5 всего на 1 мкг/м3 связано с увеличением смертности от COVID-19 на 8%. [381] Некоторые результаты показывают, что более мелкие частицы в большей степени связаны с заболеваемостью COVID-19, и большинство эффектов PM2,5 и PM10 на COVID-19 могут быть в основном связаны с PM1. [551]
Загрязнители воздуха, такие как твердые частицы, двуокись азота и окись углерода, скорее всего, направлены на то, чтобы способствовать выживанию вирусных частиц в благоприятных климатических условиях. Исследование показывает, что регионы Северной Италии, которые больше всего пострадали от COVID-19, также являются регионами с высоким содержанием твердых частиц в атмосфере (PM10 и PM2,5), превышавшим установленные законом нормы (предел, 50 мкг/м3 в сутки) в феврале 2020 г. [382]
Другое исследование показывает потенциальную корреляцию между распространением тяжелых вспышек COVID-19 и стагнацией загрязняющих веществ в результате сочетания конкретных климатических условий, местных выбросов человека и региональной топографии. [383] Некоторые данные свидетельствуют о том, что на взаимосвязь между метеорологическими факторами и передачей SARS-CoV-2 могут влиять сезон, геопространственный масштаб и широта. [512]
Результаты исследований показывают, что длительное воздействие NO2 может быть одним из наиболее важных факторов смертности от COVID-19 в некоторых регионах и, возможно, во всем мире. [380]
К основным факторам окружающей среды, которые служат имитаторами распространения вируса, относятся метеорологические вариации, плохое качество воздуха, обилие пыльцы и пространственно-временные вариации. Однако, влияние этих факторов окружающей среды на распространение COVID-19 по-прежнему неоднозначно. [411]
В одной публикации показано, что метформин подавляет один из молекулярных триггеров провоспалительных и протромботических процессов городского загрязнения воздуха PM, а именно митохондриальный каскад АФК/Са2+, активируемый высвобождением Са2+ (CRAC) /ИЛ-6. [376]
Было бы важно активно продвигать активное повторное увлажнение сухого воздуха во всех отапливаемых общественных и частных помещениях. Дополнительно, по возможности, пациентов на инвазивной вентиляции следует вентилировать увлажненным воздухом. [377]
Кроме того, может возникнуть дополнительная потребность в снижении уровня загрязнителей воздуха в рамках мер общественного здравоохранения по сдерживанию распространения SARS-CoV-2 и других инфекций.
События суперраспространения (SSE)
События сверхраспространения могут быть типичной чертой COVID-19. [250] Описано несколько случаев такого события (AP Schmitz Rambo, 2021). Всемирная организация здравоохранения определяет суперраспространителя как пациента (или событие), который может передать инфекцию большему количеству людей, чем ожидается от одного человека (или события). [251]
Исследование, опубликованное в журнале Lancet в марте 2020 года, показывает, что среди 137 участников произошло 48 вторичных инфекций, если предположить, что все эти вторичные инфекции были вызваны одним первичным случаем. Это привело к вторичной заболеваемости (SAR), определяемой как вероятность заражения среди восприимчивых лиц в определенной группе, которая довольно высока, хотя и определяется событиями кратковременного воздействия. [252]
В целом, согласно исследованию, проведенному в США, около 2% случаев COVID-19 были непосредственными причинами 20% всех инфекций. Кроме того, исследования показали, что инфицированные не пожилые люди (младше 60 лет) могут быть в 2,78 раза более заразными, чем пожилые, причем первые, как правило, являются основным фактором сверхраспространения. Роль перенаселенности в усилении эпидемии в большом городском районе может иметь большое значение. [255]
Кроме того, случаи сверхраспространения могут происходить из-за того, что люди с легкими симптомами или без симптомов могут остаться недиагностированными и может быть не предпринято никаких мер. Похоже, что лица с многочисленной и продолжительной социальной жизнью с большей вероятностью заразят большее количество людей, чем лица с ограниченным социальным взаимодействием, поэтому дети также могут иметь более высокий уровень бессимптомного течения болезни и, таким образом, могут передавать инфекцию другим людям. [251]
Пение, особенно в хоре, признано уникальным обстоятельством SSE. [256]
Факторы, повышающие риск сверхраспространения SARS-CoV-2: возбудитель, хозяин, окружающая среда, поведение. [253] Причины включают: иммуносупрессию, повышенную тяжесть заболевания и вирусную нагрузку, бессимптомное течение заболевания и интенсивные социальные взаимодействия. [251]
Поскольку задержка с диагностикой и неспособность быстро реализовать меры по изоляции и реагированию подпитывали предыдущие SSE, страны должны иметь планы и оперативные возможности на этапе локализации реагирования для немедленных расследований и осуществления мер контроля. На последующем этапе смягчения последствий, когда ресурсы эпиднадзора и лабораторий ограничены, усилия по эпиднадзору и целенаправленному реагированию должны отдавать приоритет средам и местам с высоким риском SSE, включая закрытые помещения, такие как медицинские учреждения, дома престарелых, тюрьмы, приюты для бездомных, школы и места массовых собраний. [253]
VI. ПАТОГЕНЕЗ
Патогенез COVID-19 еще детально и до конца не изучен. Предполагается, что он может быть идентичен патогенезу SARS.
После попадания в верхние дыхательные пути коронавирусы колонизируют клетки эпителия носо- и ротоглотки, активно размножаются и разрушают клетки эпителия.
Клинические последствия инфекции SARS-CoV-2 чрезвычайно разнообразны: от доброкачественного течения до быстро прогрессирующего заболевания, приводящего к смерти в течение 2—3 недель после появления симптомов. В то время, как у многих инфицированных людей симптомы отсутствуют [851,852] или наблюдаются только симптомы со стороны верхних дыхательных путей, у других развивается интерстициальная пневмония, которая может быстро прогрессировать до дыхательной недостаточности и острого респираторного дистресс-синдрома (ОРДС), требующих искусственной вентиляции легких и госпитализации в отделение интенсивной терапии и, возможно, заканчивающихся полиорганной недостаточностью. [853—855] Кроме того, у бессимптомных пациентов могут быть значительно более длительные периоды выделения вируса, что имеет значение для распространения болезни. [856]
Состояние пациентов с тяжелой формой COVID-19 может быстро ухудшаться. В первой опубликованной серии случаев сообщалось о быстром прогрессировании дыхательной недостаточности [857] со средним временем до появления симптомов 1—2 недели для ОРДС, требующего искусственной вентиляции легких в отделении интенсивной терапии, 8 дней для одышки, 9 дней для ОРДС и 10,5—14,5 дней для госпитализации/интубации в ОИТ. Основной причиной смерти была дыхательная недостаточность (85%), в трети случаев связанная с шоком. [858]
Инкубационный период между воздействием SARS-CoV-2 и появлением симптомов составляет примерно пять дней. Известно, что инфекция COVID-19 является многофазной, то есть в процессе заражения есть несколько стадий. Первая стадия инфекции включает репликацию вируса. На этом этапе SARS-CoV-2 закрепляется в организме хозяина и начинает быстро размножаться. [661]
Роль структурных компонентов вируса:
— ORF1a, вирусная транскрипция/репликация;
— ORF1b, вирусная транскрипция/репликация, рибосомная транслокация;
— белок S: начальное связывание → протеолитическая активность → слияние с мембраной; [230]
— E, сборка и морфогенез вириона;
— ORF7a — активирует высвобождение провоспалительных цитокинов вирусного патогенеза;
— HE: этот покрывающий белок, меньший, чем S-гликопротеин, выполняет важную функцию во время фазы высвобождения вируса внутри клетки-хозяина; [245]
— N — сборка вирусного генома, транскрипция, сборка вириона;
— основная протеаза, Mpro или 3CLpro, играет важную роль в цикле репликации вируса, процессируя большие вирусные полипротеины и делая отдельные белки функциональными. [914]
Первый контакт, ферментативное расщепление белков, репликация и сборка
Нуклеокапсидный (N) белок SARS-CoV-2 образует спиральный капсид для упаковки генома, а спиральный капсид окружен оболочкой, состоящей из шиповидного поверхностного гликопротеина (S), небольшого белка оболочки (E) и матричного белка (М) [635]. Поверхностный гликопротеин spike (S) регулирует связывание рецептора и проникновение вируса в клетки-хозяева, в то время как белок малой оболочки (E) и белок матрикса (M) участвуют в сборке вируса [636]. Белок S играет ключевую роль в определении вирулентности вируса, определении тканей-мишеней и разнообразия хозяев [614, 619]. Spike CoV имеет три основных домена: небольшой цитоплазматический домен, эктодомен, который содержит большинство элементов, участвующих в связи с клеткой-хозяином, включая слияние, и трансмембранный домен [618, 620]. Два основных домена, S1 N-концевой (S1-NTD) и S1 C-концевой домен (S1-CTD), в основном участвуют в качестве RBD [618]. RBD spike SARS-CoV-2 является горячей точкой для адаптивных мутаций, которые повышают эффективность связывания вируса с его носителем [623], что приводит к появлению более вирулентных штаммов с более высокой инфекционностью и передачей [624]. RBD вируса SARS-CoV-2, вероятно, менее экспонирован (lying down position), в то время как RBD вируса SARS-CoV находится в standing up position. [230]
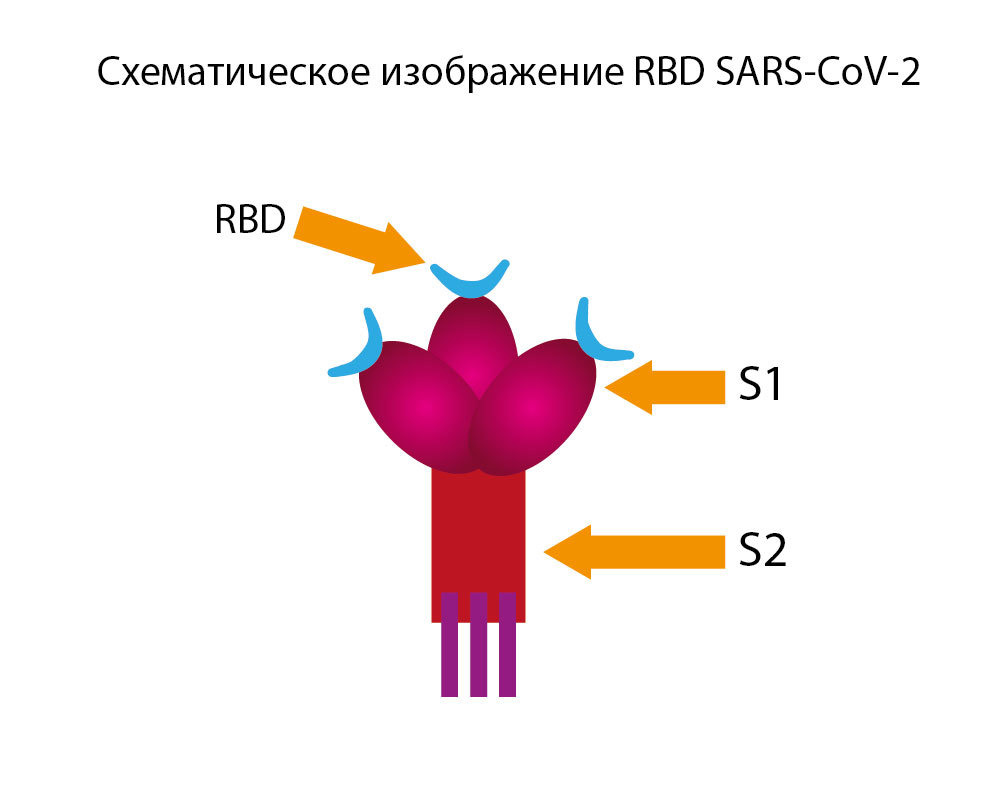
S-гликопротеин SARS-CoV-2 связывается с рецепторами клетки-хозяина через ангиотензинпревращающий фермент 2 (ACE2), который имеет решающее значение для проникновения вируса. [7] Сегмент S1 (состоящий из 200 аминокислотных остатков, который прочно связывается с host-ACE2) связывается с рецепторами клеточной мембраны. Сегмент S2 (имеет две повторяющиеся области: HR-C и HR-N, которые образуют спираль на эктодомене белка, разделенную межспиральной областью примерно из 140 аминокислот) способствует слиянию вируса с клеткой.
ACE2, TMPRSS2 и IFITM3 являются основными генами, вовлеченными в инфицирование SARS-CoV-2. (S Suh et al., 2022; C Muus, 2021). Одно исследование показало, что S-белок SARSCoV-2 в 10–20 раз более вероятно связывается с человеческим ACE2, чем S-белок SARS-CoV начала 2000-х годов [274] (более эффективное проникновение в клетку). Повышенное сродство к распространенным клеточным рецепторам может быть фактором, увеличивающим передачу [275]. Однако, аффинность всего S-белка SARS-CoV-2 к рецептору ACE2 такая же или даже ниже, чем у SARS-CoV. Было обнаружено, что несколько других белков рецепторов или вспомогательных мембран (включая CD147, NRP-1, CD26, AGTR2, Band3, KREMEN1, ASGR1, ANP, TMEM30A, CLEC4G и LDLRAD3) вместе с ACE2 облегчают проникновение и передачу вируса. Экспрессия белка Band3 на поверхности эритроцитов и признаки связывания с S-белком SARS-CoV-2 могут объяснить бессимптомную гипоксемию при инфекции COVID-19. [531] Другими рецепторами, участвующими в проникновении SARS-CoV-2, являются обонятельный рецептор OR51E2 [628] и гепарансульфат (HS) [629]. Спайковый белок также взаимодействует с ацилтрансферазным комплексом GOLGA7 и ZDHHC5, которые способствуют пальмитоилированию цитозольного хвоста. [630] Недавно сообщалось, что проникновение SARS-CoV-2 в клетки-хозяева также опосредуется трансмембранным рецептором нейропилином-1 (NRP1) [626]. Поскольку NRP1 в значительной степени экспрессируется в центральной нервной системе, он был предложен в качестве пути для SARS-CoV-2 в головном мозге хозяина, что может объяснить неврологические проявления COVID-19 [627].
Во время репликации SARS-CoV-2 использует ферменты протеазы хозяина для ковалентного связывания сахаров с боковыми цепями аспарагина вблизи поверхности белка [268]. Субъединица S1 RBD связывается с ангиотензинпревращающим ферментом 2 (ACE2), чему способствует расщепление фурином [272, 273]. Протеолитическое расщепление S-гликопротеина также определяет возможность межвидового скрещивания вируса, например, от летучих мышей к человеку [276].
Белки коронавируса могут расщепляться одной или несколькими протеазами хозяева на основе штамма вируса и типов клеток, включая трипсин, катепсин, TMPRSS-2, TMPRSS-4 или трипсиноподобную протеазу дыхательных путей человека (HAT) [267, 269]. Было обнаружено, что TMPRSS2 является кофактором для проникновения SARS-CoV-2 в здоровые клетки. Протеаза TMPRSS2 способствует «ферментативному расщеплению» S1 и S2. Протеазы фурин и катепсин B и L способствуют высвобождению капсидных вирионов, проникших в клетку (Bergmann et al, 2020, [231]). Однако, специфические протеазы, которые способствуют проникновению вируса в SARS-CoV-2, остаются неустановленными [267, 269, 270].
Слияние SARS-CoV-2 с клетками легких в решающей степени зависит от сайта расщепления S1/S2 фуриновой протеазой [270], ферментом, принадлежащим к семейству субтилизин-подобных пропротеинконвертаз, и его мотивом RXXR, который тесно связан с последовательностью консенсуса фурина RX (K/R) R [621]. Фурин расщепляет белки-предшественники и способствует их переводу в биологически активное состояние [271]. Кроме того, добавление остатка аргинина к этому мотиву сильно усиливает образование синцития в клетках-хозяевах, что указывает на то, что вставка RRAR в эту область может усиливать клеточное распространение и патогенность SARS-CoV-2 [621, 622].
Когда геном вируса проникает в клетки, рибосомы хозяина переводят вирусную РНК в белки РНК-полимеразы. Затем эта РНК-полимераза повторно считывает положительную цепь для создания одноцепочечных цепей РНК с отрицательным смыслом (ssRNA-). Цепи ssRNA- затем используются РНК-полимеразой в качестве матрицы для создания дополнительных цепей ssRNA+. Небольшие нити РНК считываются рибосомами хозяина в эндоплазматическом ретикулуме для создания структурных компонентов вируса. Эти структурные компоненты затем переносятся из эндоплазматического ретикулума в аппарат Гольджи. В аппарате Гольджи геномы ssRNA+ упаковываются в нуклеокапсиды для создания новых частиц вирионов. [266] Эти дочерние вирусы затем высвобождаются из клетки-хозяина посредством экзоцитоза через секреторные везикулы. Репликация вируса в альвеолярных клетках опосредует повреждение и вызывает воспалительную реакцию в тканях. [266]
Цикл репликации вируса в клетках респираторного тракта: прикрепление вируса к клетке-хозяину и проникновение путем слияния мембран или эндоцитоза → высвобождение вирусного генома в цитоплазму → трансляция вирусных протеин-полимераз (pp1a и pp1b) → репликация РНК → субгеномная транскрипция → трансляция структурных белков вируса → белки S, E и M связываются с нуклеокапсидом → образование зрелого вириона → экзоцитоз. [232]
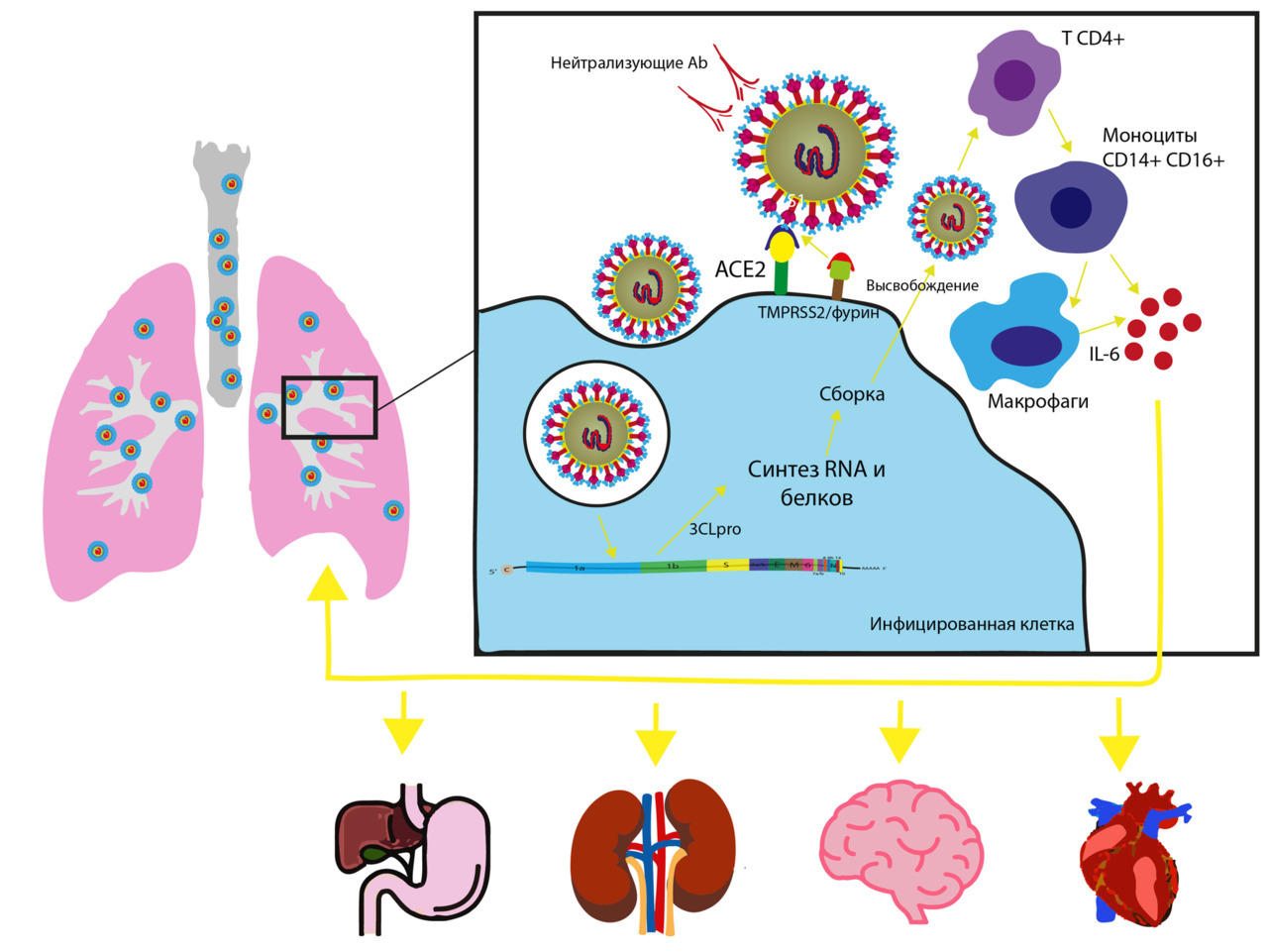
Существование вирусного генома в иммунных клетках было обнаружено у пациентов с COVID-19, что позволяет предположить, что иммунная система является биологической мишенью вируса, проявляющего необходимую «патогенную подпись» иммунной дисрегуляции. [389]
Иммунопатогенез COVID-19 предполагает модель межмолекулярной и межклеточной «иммунной асинхронии», основанную на нарушении регуляции времени, местоположения, качества и количества иммунного ответа. [390,391]
Ряд генов, сцепленных с Х-хромосомой (таких, как IL13, IL4, IL10, XIST, TLR7, FOXP3) и генов, сцепленных с Y (SRY, SOX9), могут лежать в основе иммунных реакций с половой диморфностью [916].
Иммунное обнаружение SARS-CoV-2
Было показано, что как отсутствие, так и вмешательство в работу toll-подобного рецептора 2 (TLR2) снижают провоспалительную реакцию на SARS-CoV-2, что позволяет предположить, что TLR2 является одним из модельных распознающих рецепторов (PRR), которые распознают вирус. Также было показано, что TLR7 активируется в ответ на SARS-CoV-2, а аномалии в гене TLR7 коррелируют с тяжелым течением COVID-19. [662, 663]
SARS-CoV-2 избегает врожденного иммунитета
У SARS-CoV-2 есть стратегии, позволяющие избежать обнаружения или воздействия иммунной системы. [665—667]
Врожденный иммунный ответ играет важную роль в первичной защите и является одной из отправных точек иммунного уклонения от SARS-CoV-2. [448]
Предварительные данные свидетельствуют об очень значительном снижении инвариантных Т-клеток, ассоциированных со слизистой оболочкой (MAIT), у пациентов с COVID-19 [660]. Текущие наблюдения показывают, что SARS-CoV-2 особенно подходит для уклонения от иммунного ответа на ранней стадии инфекции. Большинство механизмов связаны с неадекватным ответом IFN 1 типа, массивной продукцией воспалительных цитокинов и, возможно, дефектом функций NK-клеток. Предварительные данные также свидетельствуют об уклонении от адаптивного иммунитета, на что указывает истощение Т-лимфоцитов [655].
Было показано, что белок Orf6 SARS-CoV нарушает транспорт кариоферина [656] и, следовательно, ингибирует импорт факторов транскрипции, таких как STAT1, в ядро, что приводит к ингибированию ответа IFN. Точно так же белок Orf3b SARS-CoV ингибирует фосфорилирование регуляторного фактора интерферона 3 (IRF3) [657], белка, участвующего в активации IFN-α/β.
Ответ CD8+, CD4+ Т-клеток и плазматических клеток. Роль IFN и интерлейкинов
CD4+ Т-клетки играли более важную роль в процессе «здоровье-болезнь», чем В-клетки и CD8+ Т-лимфоциты. Преобладающими субпопуляциями Т-хелперных (Th) лимфоцитов у пациентов в критическом состоянии являются Th1, Th2, Th17 и Т-регуляторные (Treg) клетки, тогда как в легких случаях наблюдается приток Th1, Th2, Th17 и фолликулярных Т-хелперных (Tfh) клеток. Эти клетки отвечают за секрецию цитокинов, включая интерлейкин (IL) -6, IL-4, IL-10, IL-7, IL-22, IL-21, IL-15, IL-1α, IL-23, IL-5, IL-13, IL-2, IL-17, фактор некроза опухоли-альфа (TNF-α), CXC-мотивирующий лиганд (CXCL) 8, CXCL9 и фактор роста опухоли бета (TGF-β); первые 8 упомянутых выше медиаторов воспаления коррелировали с клиническими преимуществами, в то время как другие с плохим прогнозом. Некоторые маркеры CD8+ Т-лимфоцитов связаны с тяжестью заболевания, например, человеческий лейкоцитарный антиген (HLA-DR) и белок 1 запрограммированной гибели клеток (PD-1). Среди антител, продуцируемых SARS-CoV-2, иммуноглобулин (Ig) A выделялся своим мощным высвобождением, связанным с более тяжелой клинической формой. [546]
Ответ IFN является важной первой линией защиты от вирусов. Для многих респираторных вирусов, включая SARS-CoV-1, IFN типов I и III (так называемые «врожденные» IFN), по-видимому, играют роль в ограничении инфекции [861], устанавливая клеточное состояние вирусной резистентности и активируя адаптивный иммунный ответ. [862]
Недавние данные также указывают на возможное нарушение регуляции IFN I и III типов в ответ на SARS-CoV-2. [863,864] Blanco-Melo et al. [864], анализируя профили транскриптома различных типов клеток, показали, что инфекция SARS-CoV-2 вызывает очень низкую экспрессию IFN I и IFN III и ограниченный ответ со стороны IFN-стимулированных генов, и индуцирует нормальную экспрессию хемокинов и генов провоспалительных цитокинов. Другое исследование выявило нарушение ответа IFN I типа у пациентов с COVID-19 в тяжелом или критическом состоянии, сопровождающееся высокой вирусной нагрузкой в крови и чрезмерной воспалительной реакцией, вызванной NF-kB (ядерным фактором kB), что связано с увеличением фактора некроза опухоли TNF-α и интерлейкина (IL) -6. [865]
IFN типа III лямбда (IFN-λ) (IL-28/IL-29), еще один член семейства IFN врожденного иммунитета, имеет сходство с IFN типа I и IL-10. Экспрессия IFN III типа более ограничена, чем экспрессия широко распространенных IFN I типа, и происходит в основном на слизистых (дыхательных и желудочно-кишечных) барьерах. Это говорит о том, что интерфероны III типа играют более специализированную роль в иммунном ответе слизистых оболочек и в регуляции адаптивного ответа. IFN типа III играют особую роль в легочных иммунных реакциях: они индуцируются раньше и при более низкой вирусной нагрузке (по сравнению с типом I), они также ограничивают начальное выделение вируса [866] и его передачу из верхних дыхательных путей в легкие. [867] Они не обладают провоспалительным потенциалом IFN I типа и могут фактически оказывать противовоспалительное и тканезащитное действие. [861, 868]
IL-1 — еще один важный цитокин, связанный с воспалением и врожденным иммунитетом. Он в основном продуцируется активированными мононуклеарными фагоцитами и может индуцировать другие провоспалительные цитокины, такие как IL-6 и TNF.
У пациентов с COVID-19 были показаны изменения в циркулирующих субпопуляциях В-клеток. Многочисленные исследования показали, что тяжелое течение COVID-19 характеризуется увеличением пролиферирующих, метаболически гиперактивных плазмобластов (PB) и относительным снижением В-клеток памяти, причем было установлено, что эти изменения совпадали с тяжестью воспаления и исчезали по мере выздоровления. [870]
Активация комплемента
Система комплемента является критическим компонентом врожденного иммунного ответа на вирусы, но она также может запускать провоспалительные реакции. [850]
MBL (маннозосвязывающий лектин), один из компонентов системы комплемента при врожденном иммунитете, распознает остатки маннозы в мембранах различных микроорганизмов и действует как растворимый паттерн-распознающий рецептор (PRR). Это распознавание активирует систему комплемента, вызывая воспаление и усиливая фагоцитоз. Известно, что MBL может связывать SARS-CoV, что приводит к отложению С4 в вирусе и, в экспериментальных моделях, к снижению его способности инфицировать. [859] Присутствие богатых маннозой гликанов в области S1 SARS-CoV-2 породило гипотезу о том, что распознавание гликанов и связывание с MBL может ингибировать взаимодействие S1-ACE. [850] Некоторые генетические полиморфизмы MBL, связанные с более низкими уровнями MBL в сыворотке крови, также были связаны с восприимчивостью к SARS-CoV. [860]
Доказательства отложения C3a в образцах биопсии легких и повышенный уровень C5a в сыворотке наблюдались у пациентов с тяжелой формой COVID-19, которые умерли. [880] Необходимо контролировать активацию комплемента, поскольку она вызывает диссеминированное внутрисосудистое свертывание крови, воспаление, гибель клеток, полиорганную недостаточность и смерть. В заключение, активация системы комплемента может играть роль как на ранних, так и на поздних стадиях COVID-19. На начальной стадии она может быть вовлечена в первоначальный иммунный ответ, необходимый для элиминации возбудителя, а на второй стадии — в воспалительное повреждение. [881]
Цитокиновый шторм (синдром цитокинового шторма) или синдром активации макрофагов (MAS) [872, 873]
Иммунная дисрегуляция, вызванная COVID-19, характеризуется замедленным и нарушенным ответом на интерферон, истощением лимфоцитов и цитокиновым штормом, что в конечном итоге приводит к обширному повреждению легочной ткани и поздним тромботическим явлениям. [697]
Тяжелая форма COVID-19 характеризуется значительно повышенным уровнем провоспалительных цитокинов и сниженным уровнем Т-лимфоцитов. (R Mulchandani, 2021) Каждый второй смертельный случай COVID-19 страдает от цитокинового шторма, 82% из которых старше 60 лет [658].
Проникновение вируса в клетки вызывает воспалительную реакцию путем рекрутирования Т-хелперных клеток, которые продуцируют IFN-γ, IL-2 и IL-12 [285]. Поврежденные альвеолярные клетки также выделяют интерфероны, цитокины и другие внутриклеточные компоненты. Последующее привлечение других воспалительных клеток приводит к развитию «цитокинового шторма», который может ускорить повреждение органов и полиорганную недостаточность, наблюдаемую при тяжелом заболевании [285]. В результате у пациентов с COVID-19 наблюдалось повышение уровня системного интерлейкина IL-2, IL-6 и IL-7, гранулоцитарного колониестимулирующего фактора, ФНО-α и др. [112] Цитокиновый ответ, вызванный SARS-CoV-2, отличается от других респираторных вирусов, вызывающих синдром высвобождения цитокинов. (M Olbei, 2021 г.)
Было высказано предположение, что взаимодействие между иммуностарением и воспалением способствует цитокиновому шторму у пожилых пациентов с COVID-19. [874]
Цитокиновый шторм был связан с ОРДС, основной причиной смертности у пациентов с COVID-19, и клиническая картина, сходная с MAS, может наблюдаться у части пациентов с тяжелым заболеванием. [873] В этом контексте некоторые авторы предположили, что COVID-19 может подпадать под спектр гиперферритинемических синдромов. Однако, не все пациенты с COVID-19 соответствуют диагностическим критериям гиперферритинемического синдрома, поскольку у них умеренно повышен уровень ферритина, и именно легкие являются органом-мишенью при тяжелом заболевании. [875] Пока неясно, является ли ферритин простым белком острой фазы или активным патогенным медиатором при COVID-19. [876]
Silvin et al. [877], в свою очередь, заметили, что тяжелая форма COVID-19 была специфически связана со всплеском циркулирующего кальпротектина, который предшествует синдрому высвобождения цитокинов; низкий уровень неклассических моноцитов в периферической крови; и экстренный миелопоэз, который стимулирует высвобождение незрелых и диспластических миелоидных клеток с иммуносупрессивным фенотипом.
Синдром высвобождения цитокинов имеет как системные, так и легочные эффекты в рамках этой гипервоспалительной реакции. Повышенные уровни провоспалительных цитокинов (IL-1/TNF/IL-6) связаны с полиорганной недостаточностью, которая может привести к повреждению миокарда, гипотензии и шоку, сочетание, которое получило название «синдром вирусного сепсиса» [871] и наблюдается у пациентов с тяжелой формой COVID-19. SARS-CoV-2 может достигать других органов, кроме легких, особенно, если они коэкспрессируют ACE-2 и связанные с ним протеазы. [878,879] Однако, относительный вклад вируса и цитокинового ответа хозяина в полиорганную недостаточность, наблюдаемую у некоторых пациентов, все еще неясен. [871]
Легкие
Siddiqi et al, 2020, выделяет следующие стадии заболевания [189]:
— I — раннее заражение: легкие симптомы, лихорадка, сухой кашель. Для этой стадии характерна лимфопения.
— II — легочная фаза: одышка без (IIA) и с гипоксией (IIB) — PaO2/FiO2 <300 мм рт. ст. Эта стадия характеризуется изменениями в легких на КТ/рентгенограмме грудной клетки, нормальным или низким уровнем прокальцитонина.
— III — гипервоспалительная фаза: ОРДС, сепсис/шок, сердечная недостаточность. Эта фаза характеризуется увеличением СРБ, ЛДГ, IL-6, D-димера, NT-proBNP, ферритина и тропонина.
Патологические признаки ранней стадии включают: отек легких, экссудацию белка, застой сосудов, гиперплазию пневмоцитов, интерстициальное утолщение и воспалительную инфильтрацию фибриноидным материалом и многоядерными гигантскими клетками, сопровождающие некоторые похожие на вирус включения, незначительную нейтрофильную инфильтрацию и образование гиалиновой мембраны [637]. Патологические особенности поздней стадии включают: диффузное альвеолярное поражение с фиброзным слизеподобным экссудатом; отторжение пневмоцитов и образование гиалиновых мембран (указывает на ОРДС); отек правого легкого и образование прозрачной оболочки (признак ранней стадии ОРДС); двусторонние воспалительные интерстициальные мононуклеарные инфильтраты левого легкого без вирусных включений [638].
Альвеолярные макрофаги отвечают секрецией цитокинов и хемокинов [286]. Воспалительный процесс, возникающий в паренхиме легкого, стимулирует нервные окончания, ответственные за инициацию кашлевого рефлекса, поэтому люди часто обращаются с ранним сухим кашлем [286]. Фактор некроза опухоли (TNF) -α и IL-1β представляют собой провоспалительные цитокины, которые вызывают повышенную проницаемость сосудов, увеличивают экспрессию молекул адгезии и индуцируют рекрутирование большего количества иммунных клеток, включая нейтрофилы и моноциты. Они связываются с белками адгезии на поверхности ткани и проникают в место повреждения [287]. IL-8 рекрутирует нейтрофилы, а другие хемокины привлекают моноциты [288]. Повышенная проницаемость сосудов вызывает просачивание жидкости в интерстициальное пространство и альвеолы, что приводит к интерстициальному отеку и отеку легких. Это может привести к одышке, нарушению оксигенации или гипоксемии. [266]
Нейтрофилы поглощают вирусы и другой мусор вокруг поврежденной области, что может быть вредным, поскольку эта активность также вызывает высвобождение побочных химических продуктов, которые повреждают окружающие ткани [289]. Следовательно, при наличии поврежденных альвеолярных клеток вырабатывается меньше сурфактанта. Альвеолы могут легко спадаться, что приводит к снижению оксигенации или гипоксемии. [290] Изменения в генах, участвующих в метаболизме гиалуронана, гликозаминогликанов и мукополисахаридов, были чрезмерно представлены в инфицированных SARS-CoV-2 бронхоальвеолярных клетках. [429]
Поврежденные лейкоциты и эндотелиальные клетки высвобождают другие медиаторы воспаления, в том числе метаболиты арахидоновой кислоты, лейкотриены и простагландины. Лейкотриены вызывают бронхоконстрикцию, приводящую к нарушению вентиляции и последующей гипоксемии [291]. Простагландины, IL-1, IL-6 и TNF-α ответственны за лихорадку, основную особенность COVID-19 [292, 293]. Снижение уровня кислорода в крови стимулирует хеморецепторы в сердечно-легочном центре головного мозга, что вызывает увеличение частоты вдоха для повышения уровня кислорода в крови, а также заставляет сердце работать быстрее, чтобы доставить кислород в организм [294]. Так, у больных с гипоксемией обычно развиваются тахипноэ и тахикардия [295].
Отличительной особенностью COVID-19 является низкая частота одышки среди пациентов с рентгенологическими признаками пневмонии и гипоксии, обозначаемой как «тихая гипоксия», или «счастливая», или «недиспногенная острая гипоксическая дыхательная недостаточность». [587—589] Диссоциация между вегетативной реакцией на дыхательную недостаточность и ее осознанным восприятием привела некоторых авторов к предположению об интероцептивном расстройстве, при котором нарушается передача нервных сигналов от легких к ЦНС. [590]
Данные свидетельствуют о том, что пропорциональные изменения ЕМТ (эпителиально-мезенхимального перехода) при COVID-19 статистически значимы. Дальнейшее перечисление ранней и поздней ЕМТ предполагает корреляцию между инвазивными генами и COVID-19. Наконец, ЕМТ активируется у пациентов с COVID-19 и обогащен множеством воспалительных цитокинов. Кроме того, было обнаружено, что ранний ЕМТ положительно коррелирует с входными факторами, чего нельзя сказать о позднем ЕМТ. [511]
Сердечно-сосудистая система
Хотя это предварительно респираторный вирус, он поражает многие системы органов, включая сердечно-сосудистую систему [129]. Сердечные осложнения могут затронуть 20—30% пациентов с COVID-19 и привести к ухудшению заболеваемости и смертности [130,131]. Сердечно-сосудистые осложнения могут включать миокардит, острый инфаркт миокарда, сердечную недостаточность и аритмии [129].
Предполагается, что патофизиология миокардита, связанного с COVID-19, включает сочетание иммуноопосредованного повреждения и прямого цитотоксического действия вируса на миокард [160]. Рецептор ACE2 обнаружен во многих системах органов, включая сердечную ткань [160].
Связь миокардита с инфекцией COVID-19 хорошо установлена многочисленными исследованиями [133, 141, 154]. Миокардит относится к воспалению сердечной мышцы, вызванному инфекционной и неинфекционной этиологией [155, 156, 157], при этом вирусная этиология чаще встречается в США и других развитых странах [157]. Он может проявляться очаговым или диффузным поражением миокарда и может быть охарактеризован как острый, подострый или хронический процесс [157,158]. Его симптомы и признаки сильно варьируют и могут включать генерализованную усталость, боль в груди, синусовую тахикардию, впервые возникшую застойную сердечную недостаточность, аритмию, кардиогенный шок и смерть [157, 158, 159]. Это часто связано с повышением уровня тропонина, С-реактивного белка и скорости оседания эритроцитов (СОЭ) [158]. Эхокардиограмма является частью стандартной оценки и может показать сниженную фракцию выброса [158]. В то время, как биопсия миокарда является золотым стандартом диагностики миокардита, магнитно-резонансная томография сердца является золотым стандартом для неинвазивной оценки объемов желудочков, массы сердца и фракции выброса [158].
Госпитальная смертность была значительно выше у пациентов с COVID-19 и миокардитом, чем у пациентов с COVID-19 без миокардита. [128]
Хотя миокардит связан с худшими исходами у пациентов с COVID-19 [133], существует ограниченное количество крупномасштабных исследований, оценивающих исходы, связанные с миокардитом, связанным с COVID-19.
Нервная система
Yan-Chao Li et al. выдвинули гипотезу о тропизме нового коронавируса к нервной ткани, поскольку у некоторых пациентов отмечались такие симптомы, как головная боль, тошнота и рвота. Кроме того, ранее было обнаружено сродство SARS-CoV и MERS-CoV к нервной ткани. Интраназальное введение SARS-CoV-1 или MERS-CoV мышам приводило к быстрому проникновению вирусных частиц в мозг, возможно, через обонятельную луковицу. Ствол мозга, в котором расположен дыхательный центр, был сильно инфицирован обоими типами вирусов, что может способствовать деградации и поражению дыхательных центров. Сообщалось как минимум о двух случаях человеческого энцефалита/энцефаломиелита, вызванного NCoV-OC43. [53] Аносмия наблюдалась у многих пациентов с COVID-19 [54]. Мутация D614G является важным фактором, способствующим увеличению распространенности аносмии при COVID-19, и это усиленное влияние на обоняние представляет собой ранее неизвестный фенотип мутации D614G. [648] Также сообщалось о случаях энцефалита/аутоиммунного энцефалита, связанного с COVID-19 [55; F Nabizadeh, 2022]. Частота обнаружения РНК и белков SARS-CoV-2 в образцах головного мозга не различалась между пациентами с неврологическими симптомами и пациентами без них; отек головного мозга, гипоксически-ишемические поражения и воспалительные инфильтраты чаще встречались у лиц с неврологическими нарушениями; неврологические симптомы чаще встречались у пожилых людей. [419] Таким образом, нельзя исключать интраназальный путь проникновения SARS-CoV-2 в мозг.
Нейровоспалительная реакция, цитокиновый шторм, аутоиммунный ответ, системная гипоксия — все это части нейропатогенеза COVID-19.
Существует гипотеза, что активация иммунной системы может вызывать неврологические расстройства, вызывая окислительный стресс и нейровоспаление. [432]
F Gentile et al., 2022, описывает предполагаемую роль оси «легкие-мозг» в патогенезе COVID-19. [591]
Белок S1 SARS-CoV-2 имеет в 10–20 раз большее сродство к рецептору ACE2, чем в других коронавирусах. Эта особенность могла приводить к прикреплению вириона к стенкам мозговых капилляров после гематогенной диссеминации с последующим нарушением гематоэнцефалического барьера и проникновением вируса в ткань мозга [753, 754]. Когда вирус попадает в церебральную микроциркуляцию, он может создать состояние гиперкоагуляции, которое может замедлить поток мозгового кровообращения, обеспечивая большее взаимодействие между вирусом и рецепторами ACE2. [755]
Глиальные клетки, как и нейроны, экспрессируют рецепторы ACE2; следовательно, присоединение вируса к рецептору может способствовать его нейротропизму, что, в свою очередь, может инициировать цикл репликации с повреждением нервных клеток [753,754]. SARS-CoV-2 также может вызывать повреждение эндотелия в нервной системе из-за прямого инфицирования, активации иммунной системы и тромбовоспалительной реакции, что приводит к микроваскулярным и макроваскулярным тромботическим событиям [756, 757].
Молекулярная мимикрия рецепторов NMDA может способствовать нейропсихиатрическим симптомам в тяжелых случаях COVID-19. (V Vasilevska et al., 2021)
Микроглиоз ствола мозга представлял собой единственное невропатологическое явление у пациентов с COVID-19 легкой/средней степени тяжести и у тех, кто не имел неврологических симптомов, что подтверждает его связь с инфекцией SARS-CoV-2. Кроме того, в некоторых исследованиях сообщалось об обнаружении вируса в эндотелиальных клетках областей инфаркта. [Bulfamante, G, 2021; Kirschenbaum, D, 2021; Meinhardt, J, 2021; Poloni T.E, 2021] J Matschke et al.,2020, обнаружили, что продолжительность заболевания обратно пропорциональна вирусной нагрузке ЦНС. Вирус, по-видимому, нацелен на избирательные нейроанатомические структуры, такие как ретикулярная формация, ядра блуждающего нерва, солитарный тракт/ядро и вентральный дыхательный столб, которые необходимы для нейронного контроля дыхания и других нейровегетативных функций [Cutsforth-Gregory J.K, 2017]. Дисфункция этих цепей может нарушать бодрствование, вегетативные функции и спонтанное дыхание, о чем обычно сообщают пациенты с COVID-19. Кроме того, пространственные паттерны вирусной нейроинвазии указывают на нейрональный транспорт как на главный вход в центральную нервную систему. Обонятельный, тройничный, языкоглоточный и блуждающий нервы иннервируют все дыхательные пути, где в острую фазу заболевания отмечается высокая вирусная нагрузка. Вирус может проникать в окончания периферических нервов и, таким образом, перемещаться по аксональному пути ретроградно. [591] Кроме того, вирус также был локализован в каротидном теле [Lambermont B, 2021], что указывает на локальную дисфункцию системы восприятия кислорода и представляет собой потенциальный путь проникновения через языкоглоточный нерв.
Результаты одного обзора подтвердили отсутствие изменений структурной визуализации обонятельной системы у пациентов с COVID-19, что согласуется с результатами недавних гистопатологических оценок. [423] Нарушения обоняния, такие как аносмия и гипосмия, могут быть связаны с повреждением обонятельного эпителия с преимущественным поражением ненейрональных клеток. Однако, могут поражаться и нервные клетки, что ухудшает состояние потери обоняния. [501] Обнаружение SARS-CoV-2 в спинномозговой жидкости с помощью ПЦР или оценка интратекального синтеза антител редко встречается у пациентов с нарушением обонятельной/вкусовой функции. [426] Имеются исследования, описывающие пациентов с SARS-CoV-2 в спинномозговой жидкости. У этих пациентов наиболее частым симптомом была лихорадка (55%), за которой следовали головная боль (41%), кашель (32%) и рвота/тошнота (32%). Большинство включенных случаев имели энцефалит (57%), 8 из которых были подтверждены на МРТ. Вторым наиболее частым проявлением был менингит. Анализ спинномозговой жидкости в большинстве случаев выявил несоответствие уровня белка и нормального уровня глюкозы. [470]
SARS-CoV-2 может напрямую достигать передней поясной извилины и базальных отделов переднего мозга [749,750]. Вовлечение ствола мозга также может произойти после контакта с коронавирусами человека через носовую полость [751, 752].
Есть некоторые аргументы в пользу того, что измененные пути синтеза дофамина могут быть связаны с патофизиологией COVID-19. [87]
Желудочно-кишечный тракт
Интересно, что инфекция SARS-CoV-2 в кишечнике с опасными для жизни случаями относительно ниже, чем в легких, хотя ACE2 хозяина (hACE2) в значительной степени сверхэкспрессирован в энтероцитах тонкого кишечника по сравнению с легкими. [614] Это можно объяснить взаимодействием обильного человеческого дефенсина 5 (HD5) (амфифильный антимикробный пептид из 32 остатков, секретируемый клетками Панета) с hACE2, обладающим достаточно сильным сродством (39,3 нМ), который блокирует связывание белка S1 с hACE2 [625]. В желудочно-кишечном тракте при гистологическом окрашивании повреждений слизистого эпителия пищевода, желудка, двенадцатиперстной и прямой кишки не выявлено. Присутствует случайная инфильтрация лимфоцитов в плоский эпителий пищевода и инфильтрация плазматических клеток и лимфоцитов в собственную пластинку желудка, двенадцатиперстной кишки и прямой кишки. [639]
Что касается сродства белка S к рецепторам ангиотензинпревращающего фермента, то SARS-CoV-2 также использует рецепторы трансмембранной протеазы серина 2, которые также обнаружены в эпителиальных клетках тонкого кишечника [348]. Изменения в ACE2 могут быть вызваны новым коронавирусом, который может вызывать воспаление кишечника и диарею. Изменение микробиоты кишечника может быть вызвано микробами и цитокинами, которые могут вызывать воспаление и высвобождать кишечные цитокины. [336] Новая коронавирусная инфекция может вызывать дисбактериоз кишечника. Ангиотензин II-превращающий фермент, присутствующий в кишечнике, вызывает пищеварительные симптомы, сходные с гастроэнтероколитом у пациентов с COVID-19 [350].
У пациентов с COVID-19 дыхательная недостаточность может вызвать повреждение печени, поскольку спровоцированная аноксия может, в конечном итоге, ухудшить функцию печени, развивая гипоксический гепатит [351]. Лабораторные результаты показали, что количество повышенных цитокинов было заметно выше у лиц с печеночной недостаточностью, чем у лиц без печеночной недостаточности, что указывает на то, что сильный воспалительный ответ и цитокиновый шторм также способствуют дисфункции печени [352]. Тем не менее, следует с осторожностью рассматривать возникающие дополнительные аспекты, такие как использование гепатотоксических средств (антибиотики, противовирусные препараты, стероиды) для терапевтического лечения инфицированных пациентов, которые, исходя из своего воздействия, могут вызывать поражение печени.
Почки
Zou X et al. [99] сообщили, что сердце, подвздошная кишка, пищевод, мочевой пузырь (ACE2-положительные клетки в уротелии мочевого пузыря — 2,4%) и почки (ACE2-положительные клетки в проксимальном извитом канальце — 4%) могут подвергаться высокому риску вирусной инвазии. Это может объяснить острое повреждение почек, которое встречается у 0,1–29% пациентов с COVID-19. Кроме того, острое поражение почек у пациентов с COVID-19 может быть объяснено сепсисом или септическим шоком, ведущим к цитокиновому шторму или иммуноопосредованному повреждению почек [100, 101]. В частности, у пациентов с хронической почечной недостаточностью и COVID-19 высокая смертность (60—90%) [101].
Индуцированное COVID-19 острое повреждение почек (AKI) значительно повышает уровень смертности и заболеваемости (MS Moitinho, 2020). Обнаружение белка и/или крови в лабораторных анализах мочи является ранним признаком поражения почек у людей с подтвержденным COVID-19. Вирус имеет тот же функциональный рецептор, ACE2, обнаруженный в почках, в основном присутствующий в проксимальных канальцах, приносящих артериолах, собирательных трубочках и толстой восходящей части петли Генле. SARS-CoV-2 вызывает острый канальцевый некроз путем прямого инфицирования почечных канальцев. Вирусные частицы могут напрямую инфицировать цитоплазму эпителия проксимальных канальцев почек и подоцитов, что может вызвать AKI у пациентов с COVID-19. [296] Биомолекулярные процессы почечной недостаточности у пациентов, инфицированных новым коронавирусом, по-видимому, многофакторны и до конца не выяснены. [336]
Гиперкоагуляция и повреждение эндотелия
Пациенты с тяжелой формой COVID-19 имеют повышенный риск тромбоза и кровотечения. [306, 335] Тромбин, вырабатываемый в избытке в случаях тяжелой формы COVID-19, вызывает активацию тромбоцитов и превращение фибриногена в фибрин и, таким образом, состояние гиперкоагуляции.
Установлено, что перед смертью уровень нейтрофилов, D-димера, мочевины и креатинина в крови у пациентов с COVID-19 продолжал увеличиваться, а количество лимфоцитов продолжало снижаться. Эти изменения были связаны с цитокиновым штормом, предполагающим активацию системы свертывания крови, стойкий воспалительный ответ и возникновение острого повреждения почек, что может быть связано с патогенезом обострения COVID-19 и объяснить смерть пациентов с COVID-19. [113]
Существующая литература о роли P-селектина (sP-sel) у пациентов с COVID-19 предполагает, что он может быть ценным биомаркером для прогнозирования клинических исходов у пациентов с COVID-19. Активация Р-селектина на поврежденных эндотелиальных клетках и активированных тромбоцитах способствует протромботическому состоянию, ведущему к иммунотромбозу и тромбовоспалению. [741] Goshua et al. [742] обнаружили, что P-селектин и другие тромбоцитарные и эндотелиальные маркеры значительно повышены у пациентов в ОИТ по сравнению с контрольной группой, а также значительно выше у пациентов в ОИТ, чем у пациентов, не находящихся в ОИТ. Смертность значительно коррелировала с повышением этих маркеров. Hotz et al. [743], оценивая значения Р-селектина в течение 72 часов после поступления в ОИТ, продемонстрировали повышение уровня у этих пациентов по сравнению со здоровым контролем и у бессимптомных или легко инфицированных пациентов. Плохие исходы у пациентов, включая потребность в искусственной вентиляции легких и внутрибольничную смертность, прогнозировались по уровням Р-селектина выше медианы контрольной группы и от экспрессии TF зависимого от тромбоцитов при поступлении. У пациентов с тяжелым синдромом COVID-19 наблюдалась более высокая активация тромбоцитов и образование агрегации тромбоцитов-моноцитов, однако, у пациентов с легким самоизлечивающимся заболеванием COVID-19 этого не было. С другой стороны, на значения P-селектина и sCD40L влияла тяжесть COVID-19, при этом уровни P-селектина и sCD40L были выше у пациентов в ОИТ. По сравнению с нормальными референсными значениями и здоровыми донорами, отобранными в контексте, Agrati et al. [744] обнаружили повышенную концентрацию Р-селектина в плазме у пациентов с COVID-19, независимо от поступления в ОИТ. Паттерн гиперактивности тромбоцитов был подтвержден Comer et al. [745]. По сравнению с контрольной группой, циркулирующие уровни маркеров активации тромбоцитов PF4 и sP-sel были значительно выше у лиц, положительных на SARS-CoV-2. В то время, как уровни циркулирующего PF4 не отличались между людьми с тяжелым и нетяжелым течением COVID-19, группа с тяжелым течением COVID-19 имела более высокий уровень sP-sel. Frazer et al. [746] использовали систему машинного обучения для профилирования тромбоза (с использованием значения P-селектина) в отделении интенсивной терапии, прогнозируя тяжесть и смертность от COVID-19. В плазме пациентов SARS-CoV-2+ и SARS-CoV-2–, находящихся в реанимации, а также в контрольной группе того же возраста и пола оценивали три тромботических фактора и пять маркеров повреждения эндотелиальных клеток. У пациентов с SARS-CoV-2+ уровень vWF был выше, чем у здоровых участников контрольной группы, но важно то, что в плазме пациентов с COVID-19+ уровень sP-sel был заметно повышен с 3-го дня в ОИТ и оставался постоянно повышенным по сравнению с плазмой до 7-го дня в ОИТ. У пациентов с SARS-CoV-2+ отмечалось обострение и хроническое повреждение эндотелия, о чем свидетельствует повышение уровня sP-sel. Из-за повышенного риска осложнений заболевания у пациентов с COVID-19 срочно необходимы крупномасштабные проспективные исследования для изучения полезности Р-селектина в качестве маркера активации тромбоцитов и эндотелия, для стратификации риска и неблагоприятных прогностических исходов. [741]
Репродуктивная система
Среди различных тканей организма яичко демонстрирует почти самый высокий уровень экспрессии ACE2. На уровне клеток яичка, семенных канальцев, сперматогония, клеток Лейдига и Сертоли наблюдается повышенная экспрессия мРНК ACE2. Если вирус вызывает повреждение этих клеток, он теоретически может повлиять на процесс сперматогенеза, что может представлять риск для мужской фертильности. Существует теоретическая возможность повреждения яичек и последующего бесплодия после COVID-19. Возможность повреждения яичка может быть вызвана прямой вирусной инвазией за счет связывания вируса SARS-CoV-2 с рецепторами ACE2 или вторичной иммунной и воспалительной реакцией. [89] Однако считается, что негативное влияние на мужскую фертильность носит временный характер и исчезает после выздоровления. [459]
Иммунное истощение
Гиперцитокинемия представляет собой тяжелый врожденный иммунный ответ на инфекцию SARS-CoV-2 и способствует ослаблению иммунитета во время адаптивного иммунного ответа [672]. Механически, тяжелое заболевание возникает, когда избыточная продукция цитокинов приводит к истощению лимфоцитов, потенциально открывая дверь для оппортунистических инфекций [673]. Кроме того, было показано, что SARS-CoV-2 способен инфицировать ACE2-независимые Т-лимфоциты, что еще больше способствует лимфоцитопении и истощению Т-клеток [674].
Другие задействованные механизмы
Xu et al. описали эффективное создание вирусоподобных частиц (VLP) SARS-CoV-2 путем плазмидной трансфекции вирусных структурных белков в клетки млекопитающих. Они продемонстрировали, что M + E минимально необходимы для эффективной сборки и выработки VLP SARS-CoV-2 и что присутствие E может повысить эффективность высвобождения как M, так и S [679]. Wan Lu et., 2022, подробно описывают роль VLP для исследований. [680]
NET представляют собой внеклеточные сети ДНК, гистонов, микробицидных белков и окислительных ферментов, высвобождаемых в ответ на PPR или активацию нейтрофилов хемокинами. [869] NET играют критическую роль в патогенезе воспалительной реакции. [578; 750; Veras et al.]
Многие ученые согласны с тем, что SARS-CoV-2 может функционировать как важный стимулятор воспалительных и иммунологических состояний за счет молекулярной мимикрии, хотя точные механизмы, лежащие в основе возникновения иммунных и воспалительных заболеваний, еще не установлены [363].
Путь катаболита триптофана (TRYCAT) вовлечен в патофизиологию и прогрессирование COVID-19 и может сигнализировать об ухудшении исхода заболевания. [747]
У пациентов с COVID-19 более высокая продукция miR-155 (в частности, miR-155-3p и miR-139-5p), а у пациентов мужского пола относительно более высокая вирусная нагрузка и уровни miR-155, чем у пациентов женского пола. Исследование Keikha et al., 2021, показало, что относительная экспрессия противовоспалительных микроРНК была снижена, а относительная экспрессия их мРНК-мишеней увеличилась у бессимптомных или критически больных пациентов с COVID-19. Кроме того, это исследование продемонстрировало, что относительная экспрессия провоспалительных микроРНК увеличивается, а относительная экспрессия их мРНК-мишеней снижается у бессимптомных или критически больных пациентов с COVID-19. [190]
Интересно, что NLRP3 (NLR Family Pyrin Domain Containing 3), важный белковый компонент инфламмасомы, может играть роль в патофизиологии. [659]
Гликом IgG у пациентов с тяжелым течением COVID-19 статистически значимо изменен, что указывает на снижение иммуносупрессивного действия циркулирующих иммуноглобулинов. Величина наблюдаемых изменений связана с тяжестью заболевания, что указывает на то, что аномальный состав гликозилирования IgG или изменения в гликозилировании IgG могут быть важным молекулярным механизмом при COVID-19. [642]
Некоторые результаты могут свидетельствовать о провоспалительной роли TREM-1 при COVID-19, который может способствовать воспалительному профилю и прогрессированию заболевания. [433]
Время адаптивного иммунного ответа. Антитела к SARS-CoV-2. Иммунный клиренс SARS-CoV-2
Адаптивный иммунный ответ вступает в силу не менее чем через пять дней [664].
Tan et al. [692] обнаружили, что IgM выявлялся на 7-й день и достигал пика на 28-й день (у 28 пациентов), а IgG появлялся на 10-й день и достигал пика на 49-й день (45 пациентов), в то время как Zhao et al. [693] определили, что сероконверсия среди 173 пациентов произошла в среднем через 12 (IgM), 14 (IgG) и 11 (нейтрализующие антитела) дней.
Среднее время обнаружения среди различных антител к SARS-CoV-2 составило 11,0 дней. Тяжесть, по-видимому, связана со временем обнаружения IgG (на 2—3 дня больше в более тяжелых случаях). [686]
Иммунный ответ на SARS-CoV-2 соответствует общей схеме вирусной инфекции. Иммунитет, возникающий в результате естественной инфекции, оказывается недолговечным. (S Nair, 2022) Другое исследование предполагает, что сильный естественный иммунитет следует за первичной инфекцией и может сохраняться более года. [481, 646] Некоторые модели передачи SARS-CoV-2 предполагают, что инфекция создает иммунитет к повторному заражению на период не менее 1 года. [687—689] Некоторые авторы проводили экспериментальные исследования заражения человека (так называемые провокационные исследования человека), предполагая, что защита от коронавирусных инфекций может длиться всего 1 или 2 года [690—691].
Приобретенные естественным путем антитела против SARS-CoV-2 могут значительно снизить риск последующего заражения с защитной эффективностью 84%. (Qi Chen, 2022) До появления штаммов Delta и Omicron вновь инфицированные люди имели надежную защиту от симптоматических повторных инфекций в течение 7 месяцев по сравнению с невакцинированными и ранее неинфицированными людьми. [647]
Как только активируется адаптивный иммунный ответ, Т- и В-клетки становятся критически важными для элиминации вируса, которая развивается в течение нескольких дней или недель [671].
Реакция антител на SARS-CoV-2 необходима для элиминации вируса. Созревание антител увеличивает способность организма защищаться от инфекции SARS-CoV-2 [668—670].
VII. ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
Патологические изменения в организме при SARS: отечные легкие с множественными зонами застоя, обнажение бронхиального эпителия, выпадение ресниц и плоскоклеточная метаплазия, острое диффузное альвеолярное поражение; увеличение лимфатических узлов в бифуркации бронхов и в брюшной полости, а также уменьшение размеров селезенки. [23]
Повреждение легких у пациентов, инфицированных SARS-CoV, по-видимому, связано с высокими исходными титрами вируса, повышенной инфильтрацией моноцитов, макрофагов и нейтрофилов в легкие и повышенным уровнем провоспалительных цитокинов и хемокинов в сыворотке крови. Устойчивая репликация вируса способствует накоплению патогенных воспалительных моноцитов/макрофагов, что приводит к повышению уровня цитокинов/хемокинов, повышению проницаемости сосудов и ослаблению вирус-специфического Т-клеточного ответа [23].
Патологическая анатомия при SARS-CoV-2
Легкие. Вскрытие лиц, умерших от COVID-19, выявило диффузное альвеолярное повреждение с образованием гиалиновых мембран [324] и лимфоцитарно-содержащие воспалительные инфильтраты в легких [51,315], иногда с острой бронхопневмонией, микротромбы, повреждение эндотелиальных клеток [315], фибриноидный некроз мелких сосудов, вирусные частицы в пневмоцитах типа 1 и типа 2. [328] Иммуногистохимические данные: CD3+, CD4+, CD8+ и CD45+ лимфоциты, CD68+ макрофаги, CD61+ мегакариоциты, CD57+ NK-клетки, TTF-1 и CK-7 альвеолярные пневмоциты + с экспрессией CK 5/6. [328]
Центральная нервная система: микротромбы, некроз [315], очаговый Т-лимфоцитарный инфильтрат [328]. Гипоксические изменения являются наиболее частыми изменениями ткани головного мозга, за которыми следуют ишемические и геморрагические поражения, а также реактивный астроглиоз и микроглиоз. Эти результаты, по-видимому, не являются специфическими для инфекции SARS-CoV-2, но, скорее всего, связаны с системным воспалением и коагулопатией, вызванными COVID-19. [316]
Сердце. Были представлены интересные данные систематического обзора вскрытий сердца. Обзорная когорта включала 50 исследований, в том числе 548 сердец. Средний возраст умерших составил 69 лет. Наиболее распространенными острыми сердечно-сосудистыми симптомами были некроз миокарда и отек миокарда. Наиболее частыми хроническими изменениями были гипертрофия миоцитов. SARS-CoV-2 был обнаружен в миокарде со средней распространенностью 60,8% [307]. Описано повреждение эндотелиальных клеток [315], лимфоцитарная инфильтрация миокарда и микротромбоз мелких коронарных сосудов. Имеются также увеличенные миоциты с затемненной цитоплазмой, ядерным полиморфизмом, очаговым отеком и фиброзом, лимфоцитарной инфильтрацией в миокарде и эпикарде, апоптозными тельцами, утолщением интимы и медиальных сосудов, лимфоцитарным эндотелиитом и тромбозом вен миокарда. [328] Иммуногистохимический анализ выявил воспалительное состояние с преобладанием постоянного присутствия CD3+ и CD8+ цитотоксических лимфоцитов и CD68+ макрофагов. [323,328]
Почки: некроз из-за гипоксии/гипоперфузии, отек и гиперемия, микротромбы [315], острое повреждение почечных канальцев [326, 328], клеточный отек и отечное расширение в дистальных канальцах и собирательных трубочках, гранулы гемосидерина в канальцевом эпителии, хронический воспалительный инфильтрат с интерстициальным фиброзом и канальцевая атрофия, набухание клубочков и перитубулярных капилляров с тромбами, гломерулярное мезангиальное расширение и гиалиноз артериол, лимфоцитарный эндотелиит, множественные везикулы, склеенные рибосомы и двойные мембраны в цитоплазме подоцитов, вирусные частицы в цитоплазме эпителия проксимальных канальцев и в клетках клубочков эндотелия. Иммуногистохимические данные: смесь Т- и В-лимфоцитов с некоторыми макрофагами, CD235+ микроваскулярная эритроцитарная обструкция, окклюзия перитубулярных капилляров, подтвержденная окрашиванием CD31 на эндотелиальные клетки, ACE2+ в эпителиальных клетках проксимальных и париетальных канальцев у пациентов с тяжелым ATI. [328]
Селезенка. В связи с COVID-19 описано истощение белой пульпы селезенки, [326] увеличение с расширением красной пульпы за счет застоя и лимфоплазмоцитарного инфильтрата, атрофия белой пульпы с отсутствием маргинальных зон, некоторые тромбы с геморрагическими участками, острый спленит с септическим нейтрофильным лейкоцитозом красной пульпы, вирусные частицы в цитоплазме макрофагов. Иммуногистохимические данные: снижение CD3; CD4 и CD8+ Т-лимфоциты, CD20+ В-клетки в лимфоидной оболочке вокруг селезеночной артерии, окрашивание CD20 и CD21 выявило атрофические узелки в селезенке, CD68+ макрофаги преимущественно в мозговых синусах. [328]
Печень. Гистологическое исследование биопсии печени пациента, умершего от COVID-19, выявило микровезикулярный стеатоз и легкую дольковую активность [52], гепатит и некроз [315]. Отмечены также другие изменения: макровезикулярный стеатоз печени, легкая очаговая лимфоцитарная дольковая инфильтрация, центролобулярная синусоидальная дилатация, ишемический коагуляционный некроз с нейтрофильной инфильтрацией, лимфоцитарная и плазмоклеточная инфильтрация с признаками фиброза в портальных венулах, эндотелиит подслизистых сосудов с апоптозными тельцами, вирусные частицы в цитоплазме гепатоцитов, увеличенные митохондрии, увеличенный эндоплазматический ретикулум, редуцированные гранулы гликогена и двуядерные гепатоциты с апоптотическими клетками. Иммуногистохимические данные: увеличение CD68+ клеток Купфера, редкое количество CD4+ лимфоцитов и небольшое количество CD8+ лимфоцитов, CD61+ тромбы с ранней организацией в портальных венулах. [328] Эти гистологические изменения могут быть вызваны инфекцией SARS-CoV-2 или лекарствами, используемыми при терапии. [52]
Кишечник. У одного пациента выявлена сегментарная дилатация и стеноз тонкой кишки. Дегенерация, некроз и отслоение слизистой желудочно-кишечного тракта различной степени были обнаружены гистологически у другого пациента, умершего от тяжелой формы COVID-19. [56] Сообщалось о микротромбах и некрозе [315].
Лимфатические узлы. Лимфоцитарная деплеция с отсутствием зародышевых центров, расширением синусов и сосудов, повышением реактивности плазмобластов, гистиоцитозом синусов с очаговым гемофагоцитозом в грудных ЛУ, микротромбами в сосудах, вирусными частицами в цитоплазме. Иммуногистохимические данные: снижение количества CD3+ Т-клеток; CD4+> CD8+ Т-клетки. [328]
Костный мозг. Реактивный лимфоцитарный инфильтрат, гемофагоцитоз; выраженная гиперплазия CD8+ Т-клеток. [328]
Надпочечники. Узелково-диффузная гиперплазия коры надпочечников в пучковой зоне, признаки шока. [328]
Плацента. Имеются данные метаанализа и систематического обзора, включавшего 1008 беременностей. О мальперфузии сосудов матери сообщалось в 30,7% плацент, а о мальперфузии сосудов плода — в 27,08% случаев. Острые и хронические воспалительные заболевания регистрировались в 22,68% и 25,65% случаев соответственно. Повышение периворсинчатого фибрина наблюдалось в 32,7% плацент, подвергнутых гистологическому исследованию, а межворсинчатый тромбоз — в 14,6% случаев. Другие признаки, в том числе микроскопическая аккретизация, отек ворсинок и др. были зарегистрированы в 37,5% случаев, и только в 17,5% случаев гистологические изменения плаценты отсутствовали. [309]
Другие органы. Глотка — хронический фарингит с гиперемией и чередованием плотных лимфоцитарных инфильтратов. Яичко — орхит и тромбы в яичке. Простата — тромбоз; скелетные мышцы — миозит и некротические волокна; повреждение от вирусного цитопатического эффекта и повышенного уровня цитокинов [475]; вирусная РНК присутствует в глотке, подкожной вене и сетчатке. [328] Анализ трех различных последовательностей — гена RdRo, гена E и гена Orf1: было показано, что в сетчатке присутствует вирусная РНК SARS-CoV-2. [475]
Гистиоцитарная гиперплазия с гемофагоцитозом, гемофагоцитарным лимфогистиоцитозом и гиалуронановым гликозаминогликаном (ГА) наблюдалась в смертельных случаях. [475]
Васкулит был обычным явлением только при биопсии кожи [315]. Однако, также возникал клинически различимый внелегочный васкулит, включая кожный и сердечный васкулит. Было отмечено, что синдром Гудпасчера редко был связан с естественной инфекцией SARS-CoV-2, но не с вакцинами. [418]
Согласно систематическому обзору, в образцах легких диффузное альвеолярное повреждение (DAD) было наиболее частым обнаружением в 239 случаях (84,4%). Гипертрофия миокарда (87 случаев, 51,2%), артериосклероз (121 случай, 62%) и стеатоз (118 случаев, 59,3%) были наиболее частыми патологическими изменениями в сердце, почках, и в гепатобилиарной системе, соответственно. [367]
Вирусные частицы SARS-CoV-2 были обнаружены в органоспецифических клетках трахеи, легких, печени, толстой кишки, почек, центральной нервной системы с помощью электронной микроскопии, иммунофлуоресценции или иммуногистохимии. [315]
Вскрытие у детей
Макроскопически имел место перикардиальный и плевральный выпот, гепатоспленомегалия, кардиомегалия, тяжелое мягкое легкое, увеличенная почка и увеличенный мозг. Результаты вскрытия легких: диффузное альвеолярное поражение (78,3%), фибриновые тромбы (43,5%), кровоизлияния (30,4%), пневмония (26%), гиперемия и отек (26%), ангиоматоидный рисунок (17,4%) и альвеолярные мегакариоциты (17,4%). В сердце выявляли интерстициальный отек (80%), очаги полосчатого некроза миокарда (60%), фибриновые микротромбы (60%), интерстициальное и периваскулярное воспаление (40%) и панкардит (30%). В печени выявлен центрилобулярный застой (60%), микро/макровезикулярный стеатоз (30%) и артериальные/венозные тромбы (20%). В почках выявлен острый канальцевый некроз (75%), гиперемия (62,5%), фибриновые тромбы в гломерулярных капиллярах (37,5%) и нефрокальциноз, гиперплазия мезангиальных клеток, гиалиновые/зернистые тубулярные цилиндры (по 25%). В селезенке выявлены спленит (71,4%), кровоизлияния (71,4%), лимфоидная гипоплазия (57,1%) и гемофагоцитоз (28,6%). В головном мозге: отек (87,5%), застой (75%), реактивная микроглия (62,5%), ишемический некроз нейронов (62,5%), менингоэнцефалит (37,5%), фибриновые тромбы (25%). SARS-CoV-2 и CD68 были положительными при иммуногистохимическом исследовании в 85,7% и 33,3% случаев соответственно. [393]
VIII. КЛИНИКА
Инкубационный период: в среднем 5—6 дней. Средний инкубационный период COVID-19 составил 5,00 дня для случаев, вызванных штаммом Альфа, 4,5 дня для штамма Бета, 4,4 дня для штамма Дельта и 3,4 дня для штамма Омикрон. Средний инкубационный период составил 7,4 дня у пожилых пациентов (старше 60 лет), 8,8 дня у детей (18 лет и младше), 6,99 дня у пациентов с легким течением заболевания и 6,69 дня у пациентов с тяжелым заболеванием. [485] У некоторых людей тест на SARS-CoV-2 может быть положительным за 1–3 дня до появления симптомов. Поэтому, вполне возможно, что люди, инфицированные SARS-CoV-2, могут передавать вирус до появления серьезных симптомов. [74] Бессимптомные случаи с COVID-19 составляют примерно 1% от общего числа пациентов, а вирусная нагрузка у бессимптомных пациентов была аналогична таковой у пациентов с симптомами, что указывает на то, что даже бессимптомные пациенты могут передавать вирус. [94,95]
Первоначально, вероятно, из-за ограниченного количества опубликованных данных, повторное заражение считалось невозможным (M Arafkas, 2021; A Gidari, 2021). Однако, как известно, повторное заражение SARS-CoV-2 возможно (M Koupaei, 2022; Xiangying Ren, 2022; AT Huang, 2020). Вероятно, первым зафиксированным был так называемый гонконгский случай, с интервалом между заражениями 142 дня у одного больного (2 отрицательных ПЦР-теста с интервалом 24 часа после 1-го заражения). [186]
«Первый» и «второй» COVID-19 сходны по клиническим характеристикам. (M Koupaei, 2022) Неполная элиминация вируса, низкая чувствительность современных диагностических тестов, появление мутантных штаммов, недостаточный сбор слизи при мазке из зева, и т.д., являются одними из возможных причин повторного заражения. [572]
Защита от повторного заражения SARS-CoV-2 наблюдается до 10 месяцев. Защитный эффект предыдущей инфекции SARS-CoV-2 при повторном заражении высок и аналогичен защитному эффекту вакцинации. Необходимы дополнительные исследования, чтобы охарактеризовать продолжительность защиты и воздействия различных штаммов SARS-CoV-2. [430]
Метаанализ исследований, проведенных до появления более трансмиссивного штамма Омикрон, показал, что люди с предшествующей инфекцией SARS-CoV-2 могут повторно заразиться и иметь более низкий риск заражения, чем те, у кого ранее не было инфекции. [446]
Один мета-анализ показывает, что совокупная доля бессимптомной инфекции и легкой формы заболевания при наличии штамма Омикрон составила 25,5% и 97,9%, что значительно выше, чем у Дельты (8,4% и 91,4%). Во время волны Омикрона дети и подростки имели более высокий уровень бессимптомной инфекции. [484]
При сборе анамнеза у пациентов с COVID необходимо обращать внимание на: возраст (особенно, если более 60 лет), хронические заболевания легких и ССС, СД и ХБП, ожирение, иммуносупрессия, пониженное питание, курение, онкологические заболевания (активные/ прием препаратов), цирроз печени, беременность, психические нарушения, алкоголизм или зависимость от наркотических веществ.
В большинстве случаев заболевание протекает как обычная простуда, в 15% случаев — тяжелая инфекция, требующая кислородотерапии; 5% — критическая инфекция, требующая вентиляции лёгких. [22]
Поначалу считалось, что азиаты мужского пола более восприимчивы к инфекции SARS-CoV-2. [5] Однако, это не совсем так. [917, 918]
В нескольких исследованиях были показаны возрастные различия в растворимом ACE2 и его связывании с мембраной, при этом, экспрессия ACE2 увеличивалась с возрастом. Низкая экспрессия основных белков хозяина может частично объяснить снижение заболеваемости тяжелым COVID-19 среди детей, хотя, необходимы дополнительные исследования. [451]
Клинические проявления (основанные на данных обзора, включающего данные о 1994 пациентах): повышение температуры тела (88,7%), сухой кашель (67,8%), слабость (38,1%), образование мокроты (33,4%), одышка (18,6%), боль в горле (13,9%) и головная боль (13,6%), диарея (4,8%), тошнота и рвота (3,9%) [24].
Диарея может быть начальным симптомом, а в некоторых случаях она может возникнуть даже до гипертермии или респираторных симптомов. [57]
Что касается продолжительности «ношения» SARS-CoV-2 у пациентов с COVID-19, была изучена информация 161 пациента: 89 (55,3%) были мужчинами, а 72 (44,7%) были женщинами. Средний возраст составлял 44 года (от 2 до 94 лет). Средняя продолжительность «ношения» SARS-CoV-2 составляла 20 дней (6–50 дней). Средняя продолжительность «ношения» SARS-CoV-2 составляла 21 день (IQR от 16,5 до 29 дней) у 89 мужчин и 20 дней (IQR от 16 до 26,8 дней) у 72 женщин. [125]
По меньшей мере 74 различных клинических проявления связаны с COVID-19. (X Luo et al., 2022 г.)
Признаки и симптомы
Широкий спектр признаков и симптомов COVID-19 представлен в таблице ниже.


Относительно анатомического распределения неврологических событий у пациентов с COVID-19, есть интересные данные из препринта (23.01.23). У 91 пациента были изменения серого вещества, у 95 пациентов были изменения белого вещества и у 72 пациентов были подтверждены церебральные микрокровоизлияния. События в белом веществе наблюдались в пределах 14 из 42 пучков белого вещества из атласа IIT. Наибольшая доля событий наблюдалась в двусторонних корково-спинномозговых путях. Splenium и половина мозолистого тела были поражены в 14% и 9% случаев соответственно. События в сером веществе были пространственно распределены по 41 области мозга в атласе Desikan-Killiany. Самые высокие доли событий наблюдались в областях, включая двустороннюю верхнюю височную, прецентральную и латеральную затылочную кору. Подкорковые события чаще всего выявлялись в паллидуме. [438]
Похоже, что у пациентов с поражением черепных нервов инфекция COVID-19 обычно протекает в легкой форме. [509]
Зуда, по-видимому, не было или он был легким, и, по-видимому, не было корреляции с тяжестью заболевания и наличием кожных проявлений.
К сожалению, неясно, вызваны ли поражения слизистых оболочек непосредственно SARS-CoV-2 или лечением кортизоном/антибиотиками. Учитывая, что везикобуллезные высыпания при вирусной экзантеме и лекарственных реакциях встречаются редко, они считаются отличительным признаком поражений кожи, связанных с COVID-19, и используются в качестве основного дифференциального диагноза. Эти высыпания состоят из локализованных или диссеминированных пузырьков или булл, которые могут возникать в ладонно-подошвенной области, не затрагивая слизистых оболочек. Эти высыпания появляются почти через 2–3 дня после появления типичных симптомов и сохраняются в течение 1–2 недель [365].
Кроме того, представляется, что негативное влияние на мужскую фертильность носит временный характер и исчезает после выздоровления. [459]
Тромбоз аорты может возникать без клинических симптомов или в качестве основного признака у бессимптомных пациентов с COVID-19. [544] Были обнаружены доказательства со средней степенью достоверности в отношении связи между VTE и пиком D-димера и продолжительностью госпитализации и интубации. Выявлены доказательства с низким уровнем достоверности в отношении связи между VTE и СРБ, D-димером, тропонином Т и потребностью в инотропных препаратах. Традиционные факторы риска VTE (например, рак в анамнезе, предшествующие случаи VTE, ожирение) не были связаны с VTE при COVID-19. [545]
Факторы риска ТОРИ
К ним относятся: возраст более 60 лет, сахарный диабет, артериальная гипертензия, сердечная и почечная недостаточность, проблемы с коагуляцией (венозный тромбоз в анамнезе), предшествующие хронические заболевания легких, неоплазии [88] (в частности, пациенты, получающие химиотерапию), курение [21,85; R Patanavanich, 2021, 2023] и злоупотребление алкоголем (ВОЗ, 2020), туберкулез (риск тяжелого течения COVID-19 повышен в 2,10 раза) [308]. Однако, один метаанализ показал, что туберкулез не был связан с повышенным риском смертности у пациентов с COVID-19 (OR= 1,40). [308]. Пожилой возраст, сопутствующие заболевания, более высокий показатель SOFA и d-димера> 1 мкг/л при поступлении были связаны с более высокой смертностью. [22]
Ожирение связано с уменьшением резерва выдоха, функциональных возможностей дыхательной системы. У пациентов с повышенным абдоминальным ожирением легочная функция еще больше нарушается из-за уменьшения движения диафрагмы, что затрудняет вентиляцию легких [50].
Выводы о взаимосвязи между тяжестью COVID-19 и вирусной нагрузкой были неубедительными. [310]
Следует учитывать, что устройства для вейпинга подвергают риску усиления респираторного заболевания, вызванного SARS-CoV-2 из-за их потенциальной острой легочной токсичности. Кроме того, аэрозоли и пары, генерируемые электронными системами доставки вещества, могут участвовать в распространении вируса в непосредственной близости от инфицированных вирусом SARS-CoV-2. Рекомендуется прекратить использование электронных сигарет во время циркуляции SARS-CoV-2 или, по крайней мере, с момента появления симптомов. [121]
Zhang Q. еt al, 2020 предполагает, что генетические факторы также могут влиять на тяжесть заболевания.
В соответствии с данными о погибших от COVID-19 в Италии на 7 сентября 2020г. (до появления штамма омикрон), у 27.9% была в анамнезе ИБС, у 23.8% ФП, у 16.1% сердечная недостаточность, у 11.1% инсульт, у 65.6% АГ, у 29.3% СД 2 типа, у 21.3% серьезное когнитивное нарушение (деменция), у 16.9% ХОЗЛ, у 17.1% активное онкозаболевание в течение последних 5 лет, у 4.6% хроническое заболевание печени, у 20.8% ХБП, 2.1% на диализе, 6.3% с ДН, у 0.2% ВИЧ, у 4.3% аутоиммунные заболевания, у 10.3% ожирение. Из них 3.5% были без сопутствующих заболеваний, у 13.2% 1 заболевание, у 19.3% 2 заболевания, у 64% 3 и более сопутствующие патологии (Istituto Superiore di Sanità).
Фенотипы и тяжесть пневмонии
Всего существует 2 фенотипа вирусной пневмонии COVID19. [233]
Пневмония COVID-19, тип L:
1. Низкая эластичность; количество газов в легких близко к нормальному.
2. Низкое соотношение вентиляции и перфузии (VA / Q); давление в легочной артерии теоретически близко к нормальному.
3. «Низкая» масса легочной ткани; инфильтраты видны лишь на КТ и расположены субплеврально, вес легких лишь незначительно увеличен.
4. Низкая способность легких к рекрутированию; количество не вентилируемой ткани незначительное.
Пневмония COVID-19, тип H:
1. Высокая эластичность; низкое содержание газов и отек легких.
2. Увеличение шунта справа налево.
3. Повышенная масса легочной ткани (увеличение> 1.5 кг).
4. Высокая способность легких к рекрутированию; количество не вентилируемой ткани значительное.
По степени тяжести COVID-19 (Istituto Superiore di Sanità):
1) Бессимптомная или «пресимптомная» болезнь (30% случаев): пациенты с положительным ПЦР или серологическим тестом, но не имеют симптомов.
2) Легкая степень (55% случаев вместе со средней степенью): пациенты с минимум одним симптомом или признаком COVID-19, но при этом не имеют одышки или изменений в легких при радиологических обследованиях (рентген/КТ).
3) Умеренная или средняя степень: пациенты с клиническими признаками поражения нижних дыхательных путей или определенными радиологическими методами и с SpO2 ≥94%.
4) Тяжелая степень (10% случаев): ЧД> 30/минуту у взрослых и детей от 5 лет, ≥60/мин у детей <2 мес, ≥50/мин у детей 2—11 мес и ≥40/мин у детей от 1 до 5 лет; SpO2 <94%, PaO2/FiO2 <300, или признаки легочной инфильтрации> 50%.
5) Критическая степень (5% случаев): пациенты с признаками ДН, септического шока и/или мультиорганной недостаточности.
ОРДС представляет собой острое начало двусторонних интерстициальных легочных инфильтратов с выраженной гипоксемией (P/F <200 мм рт. ст.) и отеком легких, которые не могут быть объяснены сердечной недостаточностью или перегрузкой жидкостью.
— Легкий ОРДС: 200 мм рт. ст. <PaO2/FiO2a ≤ 300 мм рт. ст. (при PEEP или СРАР ≥ 5 см вод. ст.);
— ОРДС средней степени тяжести: 100 мм рт. ст. <PaO2/FiO2 ≤ 200 мм рт. ст. (при PEEP ≥ 5 см вод. ст.);
— тяжелый ОРДС: PaO2/FiO2 ≤ 100 мм рт. ст. (при PEEP ≥ 5 см вод. ст.).
ОРДС, являющийся основой тяжелого заболевания, нетипичен при COVID-19. Существует диссоциация между хорошо сохранившимися легочными механизмами и тяжестью гипоксемии. Если при типичном ОРДС лишний вес легких составляет около 1000 граммов, то при пневмонии COVID-19 — 300 граммов (фенотип 1) и 800 граммов (фенотип 3) соответственно (Robba et al, 2020; Ball L. et al, 2020). При вентиляции этих пациентов уровень PEEP должен быть как можно ниже.
Необходимо помнить, что клиническая картина COVID-19 может постоянно меняться.
Для начальной оценки состояния пациента была предложена шкала Modified Early Warning Score (MEWS). При этом оценивается САД, ЧСС, ЧД, температура тела и сознание; каждому параметру присваиваются баллы от 0 до 3. В зависимости от результата суммы баллов, возможно проводить стратификацию риска:
— низкий риск/пациент стабилен: 0—2 балла;
— средний риск/пациент нестабилен: 3—4 балла;
— высокий риск/критическое состояние: 5 баллов.
Кроме того, к пациентам низкого риска можно отнести:
пациентов с симптомами ОРЗ (ринит, головная боль, боль в горле, миалгии), пациентов с отсутствием одышки и тахипноэ (SpO2> 92%), температура тела ≤38С или ≥38С в течение менее 72 часов, наличие гастроинтестинальных симптомов (при отсутствии обезвоживания и частых жидких испражнений), наличие агевзии/аносмии/дисгевзии.
Индикаторы резкого ухудшения клинической картины
В среднем, пациенты становятся критическими через 7—10 дней от начала симптомов заболевания.
Факторы возможного риска ухудшения состояния пациента:
— возраст;
— хронические заболевания: сосудов головного мозга (OR 3.66), кардиоваскулярные заболевания (OR 2.84), СД (OR 2.78), ХОЗЛ (OR 2.39), АГ (OR 2.24), курение (OR 1.54), ожирение;
— мужской пол;
— испанская и негроидная раса.
Узелки, паттерн crazy-paving и/или новые поражения в верхней и средней доле правого легкого и нижней доле левого легкого с обеих сторон на КТ могут указывать на ухудшение заболевания. [424]
Критерии тяжелого повреждения легких (могут помочь определить нужный момент для начала интубации):
— ЧД> 30/минуту;
— SpO2 ≤ 90%* при дыхании комнатным воздухом;
— Р/F <200 mmHg;
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
