
Бесплатный фрагмент - Рабочая тетрадь по неорганической химии
От автора
Здравствуйте!
Меня зовут Елена Владимировна. Я репетитор по химии с 20-тилетним стажем.
Очень важно при подготовке к экзаменам по химии (и не только) четко структурировать материал, знать закономерности и иметь под рукой всю необходимую теорию. При этом не менее значимым для ее усвоения является собственноручное написание уравнений реакции — тут вам и тренировка, и лучшее запоминание. Поэтому к своему курсу подготовки я создала эту рабочую тетрадь. В ней можно и нужно писать!
Заполнять ее вам придется самостоятельно. Материал можно брать из моих лекций и вебинаров, либо из учебников и справочников. Это вам позволит не только выучить химию на 100 баллов, но и научиться работать с учебной литературой. Важное умение, в институте пригодится!
Инструкция
1. Начинайте с первого химического элемента и продвигайтесь далее по порядку.
2. Прежде чем заполнять конспект, ознакомьтесь с теорией.
3. На каждой строке пишите по одному уравнению реакции.
4. В конце каждого конспекта (посвященного, как правило, отдельному элементу) есть место «Для заметок». Оно для того, чтобы вписать дополнительную информацию, которая может появиться в процессе подготовки.
Если вы заметили неточности, опечатки или ошибки, сообщите пожалуйста в WhatsApp по номеру +7 (903) 1787693.
Успехов в подготовке!
Водород
Общая характеристика
1. Положение в ПС___________________________________________________
2. Строение атома (число e-, n0, p+) ________________________________
3. Электронная конфигурация_____________________________________
4. Внешний электронный уровень_________________________________
5. Валентности_______________________________________________________
6. Степени окисления (в соединениях):
+1
0
— 1
Степень окисления 0. Простое вещество H2
Физические св-ва ___________________________________________________
Получение
В промышленности
1. Электролиз водных растворов солей
________________________________________________________________________
2. Пропускание водных паров над коксом/цинком/железом/
магнием
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
3. Из природного газа
________________________________________________________________________
4. Крекинг, реформинг углеводородов
________________________________________________________________________
________________________________________________________________________
В лаборатории
1. Действием разбавленных кислот на металлы
________________________________________________________________________
2. Действием щелочей на цинк или алюминий
________________________________________________________________________
3. Действием щелочей на кремний
________________________________________________________________________
4. Гидролиз гидридов
________________________________________________________________________
5. Действием воды на металлы I, II групп
________________________________________________________________________
6. Электролиз растворов солей
________________________________________________________________________
Химические свойства
А. Восстановитель
1. С неметаллами
с хлором _____________________________________________________________
с кислородом ________________________________________________________
с серой _______________________________________________________________
с азотом ___________________________________ (условия:______________)
с углеродом __________________________________________________________
Si + H2 ≠
P + H2 ≠
2. С оксидами металлов (кроме металлов I — III групп)
________________________________________________________________________
3. С оксидом углерода (II)
________________________________________________________________________
4. С другими сложными неорганическими веществами
________________________________________________________________________
Б. Окислитель
5. С активными металлами I — III групп
________________________________________________________________________
В. С органическими соединениями
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Степень окисления -1. Гидриды
Получение
1. С щелочными металлами
________________________________________________________________________
2. AlCl3 + LiAlH4 = AlH3 +3LiCl
Химические свойства
1. Гидролиз
________________________________________________________________________
2. С оксидами металлов
________________________________________________________________________
2AlH3 +3ZnO = 2Al +3Zn +3H2O
3. Термическое разложение
________________________________________________________________________
4. 3CaH2 + N2 = Ca3N2 +3H2
Степень окисления +1. Вода
Химические свойства
При комнатной температуре
1. С металлами I, II группы (кроме Mg, Be)
________________________________________________________________________
2. С основными оксидами (если образуется щелочь)
________________________________________________________________________
3. С галогенами
F2:_____________________________________________________________________
Cl2: ___________________________________________________________________
________________________________________________________________________
4. С кислотными оксидами (кроме SiO2)
________________________________________________________________________
5. C ангидридами и галогенангидридами карбоновых
и неорганических кислот
________________________________________________________________________
________________________________________________________________________
6. С активными металлорганическими соединениями
(RMgBr, CH3Na и т. д.)
________________________________________________________________________
7. С карбидами, нитридами, фосфидами, силицидами,
гидридами активных металлов (Ca, Na, Li и др.)
________________________________________________________________________
8. C галогенидами неметаллов (P, Si)
________________________________________________________________________
9. С солями (гидролиз)
________________________________________________________________________
При нагревании
10. С металлами (Mg, Mn — Pb)
Mg:___________________________________________________________________
Zn:____________________________________________________________________
Fe:____________________________________________________________________
11. С углем, метаном
С:_____________________________________________________________________
CH4:___________________________________________________________________
В присутствии катализатора
12. С амидами, эфирами карбоновых кислот (H+)
________________________________________________________________________
13. С ацетиленом и другими алкинами (Hg2+)
________________________________________________________________________
________________________________________________________________________
14. С алкенами (H+)
________________________________________________________________________
15. С нитрилами (H+)
________________________________________________________________________
ДЛЯ ЗАМЕТОК
Галогены
Общая характеристика
1. Положение в ПС _____________________________________________________
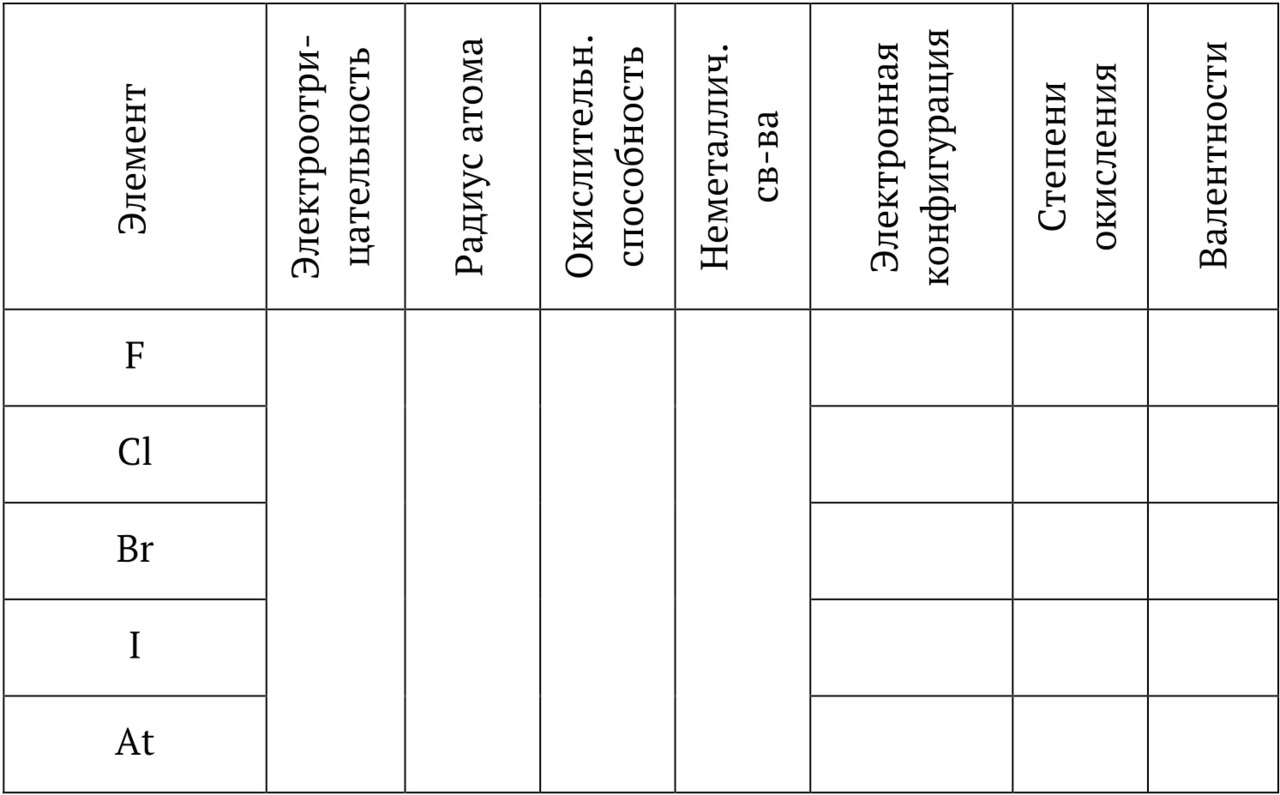
Степень окисления 0. Простые вещества
Получение
В промышленности
1. Электролиз расплавов и растворов солей (единственный
способ получения фтора)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
2. Окисление солей хлором (для брома и йода)
________________________________________________________________________
В лаборатории (окислители PbO2, KMnO4, KClO3, K2Cr2O7)
3. Окисление галогеноводородов (для хлора, брома, йода)
________________________________________________________________________
4. Окисление солей (для йода)
________________________________________________________________________
Химические свойства
1. С металлами
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
2. С неметаллами
(F2 — со всеми, Cl2 — кроме O2, N2, инертных газов)
________________________________________________________________________
________________________________________________________________________
Hal2 + F2 = 2Hal+F-
3. С водой
F2:_____________________________________________________________________
Cl2:____________________________________________________________________
4. С щелочами
F2:_____________________________________________________________________
Cl2:__________________________________________________________ (tкомн.)
Cl2:__________________________________________________________ (нагрев)
I2:________________________________________________________ (tкомн., tº)
5. C другими соединениями
SO2:____________________________________________________________________
K2CO3:________________________________________________________________
NH3:__________________________________________________________________
NaNO2 + H2O:________________________________________________________
Особые свойства
Фтор
2NaOH +2F2 = OF2 +2NaF + H2O (разбавленная щелочь)
Хлор, бром
1. P:___________________________________________________________________
2. S:___________________________________________________________________
3. Si:__________________________________________________________________
Йод
1. Fe:__________________________________________________________! (FeI3)
2. Восстановитель
Cl2:____________________________________________________________________
3. Окислитель
Na2S2O3:_______________________________________________________________
SO2 +2H2O:___________________________________________________________
Степень окисления -1. Галогеноводороды
Получение
1. Гидросульфатный (HF, HCl)
________________________________________________________________________
2. Из галогенидов неметаллов (HBr, HI)
________________________________________________________________________
3. Из солей (HI)
________________________________________________________________________
4. В промышленности
________________________________________________________________________
Химические свойства
1. Кислотные
HF → HCl → HBr → HI → сила кислот увеличивается
HF — слабая, остальные сильные
а) с металлами
________________________________________________________________________
б) с оксидами металлов
________________________________________________________________________
в) с основаниями и амфотерными гидроксидами
________________________________________________________________________
г) с солями
________________________________________________________________________
д) с аммиаком
________________________________________________________________________
2. Восстановительные (особенно HI)
O2:____________________________________________________________________
H2SO4 (конц.):_________________________________________________________
3. Особые
SiO2 +4HF:____________________________________________________________
KOH +2HF:___________________________________________________________
Соли. Галогениды
Хлориды НЕ являются восстановителями!
KCl + H2SO4 (конц.):_____________________________________________________
KBr + H2SO4 (конц.):____________________________________________________
KI + H2SO4 (конц.):______________________________________________________
Гидродиз галогенидов
PCl3:_________________________________________________________________
SiBr4:_________________________________________________________________
Кислородсодержащие кислоты (на примере хлора)
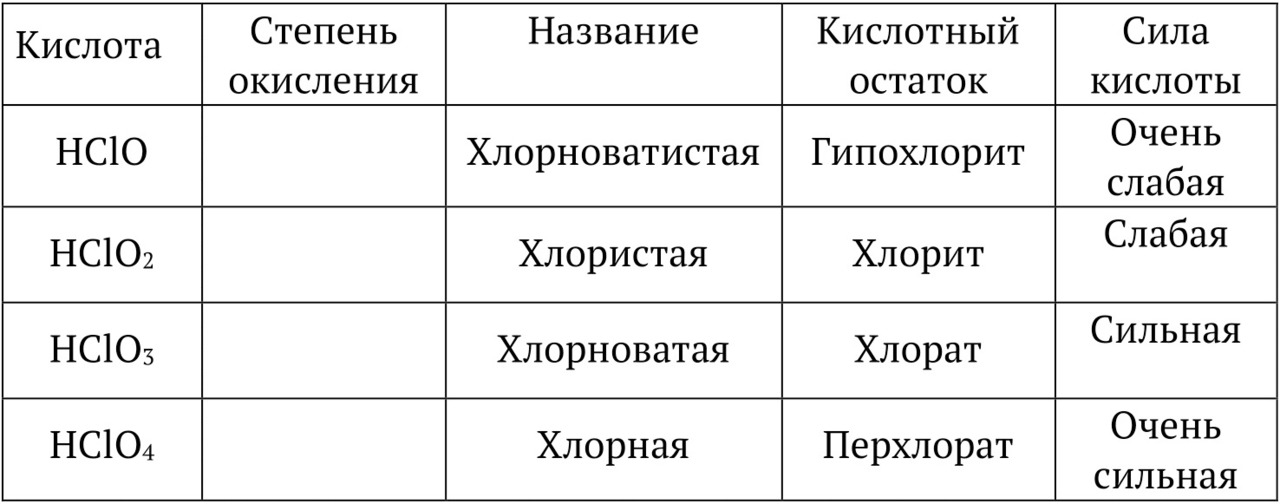
Хлорноватистая кислота HClO, гипохлориты
Получение
1. Из солей
________________________________________________________________________
2. Растворение хлора в воде
________________________________________________________________________
Химические свойства
1. Разложение на свету
________________________________________________________________________
2. Термическое разложение
________________________________________________________________________
3. Разложение под действием водоотнимающего средства (CaCl2)
________________________________________________________________________
4. Окислитель
________________________________________________________________________
Хлористая кислота HClO2, хлориты
Получение
1. Из солей
________________________________________________________________________
2. ClF3 + H2O:________________________________________________________
3. Взаимодействие перекиси водорода и оксида хлора (IV)
________________________________________________________________________
________________________________________________________________________
Химические свойства
1. Разложение
________________________________________________________________________
2. Кислотные свойства
________________________________________________________________________
3. Окислительно-восстановительные
________________________________________________________________________
________________________________________________________________________
Хлорноватая кислота HClO3, хлораты
Получение
1. Из солей ___________________________________________________________
2. Разложение хлорноватистой кислоты
________________________________________________________________________
3. Хлорат калия (бертолетова соль)
________________________________________________________________________
Химические свойства
1. Окислитель (H+, tº)
________________________________________________________________________
2. Каталитическое разложение бертолетовой соли
________________________________________________________________________
3. Термическое разложение бертолетовой соли
________________________________________________________________________
4. Бертолетова соль с серой
________________________________________________________________________
5. Бертолетова соль с фосфором
________________________________________________________________________
Хлорная кислота HClO4, перхлораты
Получение
1. Из солей
________________________________________________________________________
2. Электрохимическое окисление HCl
________________________________________________________________________
Химические свойства
1. Термическое разложение
________________________________________________________________________
2. Разложение под действием водоотнимающего средства (P2O5)
________________________________________________________________________
3. Кислотные свойства (самая сильная кислота)
________________________________________________________________________
4. Окислитель
________________________________________________________________________
ДЛЯ ЗАМЕТОК
Кислород
Общая характеристика
1. Положение в ПС __________________________________________________
2. Строение атома (число e-, n0, p+) ________________________________
3. Электронная конфигурация _____________________________________
4. Внешний электронный уровень _________________________________
5. Валентности ______________________________________________________
6. Степени окисления (в соединениях):
— 2
— 1
0
+2
Степень окисления 0. Простые вещества. Кислород
Физические св-ва
O2 _____________________________________________________________________
Получение
В помышленности
1. Электролиз воды
________________________________________________________________________
2. Из воздуха
3. Фотосинтез
________________________________________________________________________
В лаборатории
Разложение
1. перманганат калия
________________________________________________________________________
2. дихромат калия
________________________________________________________________________
3. хлорат калия
________________________________________________________________________
4. перхлорат калия
________________________________________________________________________
5. гипохлорит кальция
________________________________________________________________________
6. нитрат натрия
________________________________________________________________________
7. нитрат магния
________________________________________________________________________
8. нитрат серебра
________________________________________________________________________
9. перекись водорода
________________________________________________________________________
10. пероксид бария
________________________________________________________________________
11. оксид серебра
________________________________________________________________________
12. оксид ртути (II)
________________________________________________________________________
13. смешанный оксид свинца (II, III)
________________________________________________________________________
14. надпероксид калия + углекислый газ
________________________________________________________________________
15. озон + йодид калия
________________________________________________________________________
Химические свойства
1. С металлами
а) Li:__________________________________________________________________
б) Na:_________________________________________________________________
в) K:__________________________________________________________________
г) Zn:_________________________________________________________________
д) Fe:_________________________________________________________________
2. С неметаллами (кроме азота, галогенов, инертных газов)
F2:_____________________________________________________________________
H2:____________________________________________________________________
S:_____________________________________________________________________
P:_____________________________________________________________________
Si:____________________________________________________________________
C:_________________________________________________________ (избыток)
С:______________________________________________________ (недостаток)
N2:______________________________________________________ (2000ºC) __
3. Со сложными веществами
H2S:___________________________________________________________________
NH3:_____________________________________________ (без катализатора)
NH3:______________________________________________ (с катализатором)
Сульфиды металлов ________________________________________________
Оксиды металлов в промежуточной степени окисления
________________________________________________________________________
Оксиды неметаллов в промежуточной степени окисления
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Органические соединения (без катализатора)
________________________________________________________________________
Органические соединения (с катализатором)
________________________________________________________________________
Степень окисления 0. Простые вещества. Озон
Физические св-ва
O3 _____________________________________________________________________
Получение
1. При электрическом разряде
________________________________________________________________________
Химические свойства
1. Разложение
________________________________________________________________________
2. Сильный окислитель
________________________________________________________________________
Степень окисления -1. Перекись водорода
Физические св-ва
________________________________________________________________________
Получение
1. Электролиз сульфата аммония в серной кислоте
________________________________________________________________________
2. Пероксид бария с серной кислотой (в лаборатории)
________________________________________________________________________
3. Каталитическое окисление изопропилового спирта
________________________________________________________________________
Химические свойства
1. Разложение (нагрев, щелочная среда, оксид марганца (IV))
________________________________________________________________________
________________________________________________________________________
2. Кислотные свойства (с щелочами)
________________________________________________________________________
________________________________________________________________________
3. Окислитель (с йодидами, нитритами, сульфидами,
сульфитами, аммиаком, хромом (III))
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
4. Восстановитель (с нитратами, хлоратами, хроматами,
перманганатами и др.)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________

ДЛЯ ЗАМЕТОК
Сера
Общая характеристика
1. Положение в ПС __________________________________________________
2. Строение атома (число e-, n0, p+) ________________________________
3. Электронная конфигурация _____________________________________
4. Внешний электронный уровень _________________________________
5. Валентности ______________________________________________________
6. Степени окисления (в соединениях):
— 2
0
+2
+4
+6
Степень окисления 0. Простое вещество. Сера
Физические св-ва
S ______________________________________________________________________
________________________________________________________________________
Получение
В помышленности
1. Природная
2. Из нефти
3. Восстановление сернистого газа
а) углем ______________________________________________________________
б) сероводородом ___________________________________________________
Химические свойства
А. Окислитель
1. С металлами
а) Li:__________________________________________________________________
б) Fe:_________________________________________________________________
в) Hg:_________________________________________________________________
2. С неметаллами
H2:____________________________________________________________________
P:_____________________________________________________________________
C:_____________________________________________________________________
3. Со сложными веществами
HI:____________________________________________________________________
Na2SO3:_______________________________________________________________
Б. Восстановитель
4. С галогенами
F2:____________________________________________________________________
Cl2:___________________________________________________________________
5. С кислородом
_______________________________________________________________________
6. С кислотами-окислителями
HNO3 (конц.):________________________________________________________
HNO3 (разб.):________________________________________________________
H2SO3 (конц.):________________________________________________________
7. С щелочами
________________________________________________________________________
Степень окисления -2. Сероводород
Физические св-ва
H2S ____________________________________________________________________
________________________________________________________________________
Получение
1. Из простых веществ
________________________________________________________________________
2. Действием H2SO4 конц. на активные металлы
________________________________________________________________________
3. Необратимый гидролиз сульфидов
________________________________________________________________________
4. Действием сильных кислот на сульфиды металлов
________________________________________________________________________
Химические свойства
А. Кислотные (слабая кислота, Ka (I) = 6*10—8, Ka (II) = 1*10—14)
1. С металлами ______________________________________________________
2. С основными оксидами __________________________________________
3. С щелочами (избыток) ___________________________________________
4. С щелочами (недостаток) ________________________________________
5. С солями __________________________________________________________
Б. Восстановитель
6. С галогенами
Cl2:____________________________________________________________________
Br2:____________________________________________________________________
7. С кислородом
в избытке ____________________________________________________________
в недостатке _________________________________________________________
8. Со слабыми окислителями
SO2:___________________________________________________________________
FeCl3:_________________________________________________________________
9. С сильными окислителями
HNO3 (конц.):___________________________________________________________
HNO3 (разб.):___________________________________________________________
Степень окисления -2. Сульфиды
1. Сульфиды щелочных металлов:
а) с сильными кислотами-неокислителями
________________________________________________________________________
б) гидролиз
________________________________________________________________________
2. Сульфиды алюминия, хрома и др.
(в таблице растворимости -/?) — необратимый гидролиз
________________________________________________________________________
3. Нерастворимые сульфиды
________________________________________________________________________
4. «Суровые» сульфиды (Cu, Ag, Pb, Hg)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
— CuS +8HNO3 = CuSO4 +8NO2 +4H2O
— CuS +10HNO3 = Cu (NO3) 2 +8NO2 + H2SO4 (или S, SO2) +4H2O
— Ag2S +10HNO3 = 2AgNO3 +8NO2 + H2SO4 +4H2O
Степень окисления +4. Оксид серы (IV)
Физические св-ва
SO2 ___________________________________________________________________
Получение
В промышленности
1. Из простых веществ
_______________________________________________________________________
2. Обжиг пирита
_______________________________________________________________________
3. Горение сероводорода
_______________________________________________________________________
В лаборатории
4. Действием H2SO4 конц. на неактивные металлы
_______________________________________________________________________
5. Действием кислот-неокислителей на сульфиты
_______________________________________________________________________
Химические свойства
А. Кислотные свойства
1. С водой ____________________________________________________________
2. С основными оксидами __________________________________________
3. С щелочами (избыток) ___________________________________________
4. С щелочами (недостаток) ________________________________________
Б. Восстановитель
5. С галогенами _____________________________________________________
6. С кислородом (кат. V2O5) _________________________________________
7. H2O2:_______________________________________________________________
8. NO2 + H2O:_________________________________________________________
В. Окислитель
9. H2S:________________________________________________________________
10. CO:_______________________________________________________________
Г. Другие
11. PCl5:______________________________________________________________
Степень окисления +4. Сернистая кислота. Сульфиты
Химические свойства
1. Cлабая двухосновная кислота
Известна только в разбавленных водных растворах (<6%)
2. Соли — восстановители
S:_____________________________________________________________________
2AgNO3 + H2O:_______________________________________________________
Степень окисления +6. Оксид серы (VI)
Физические св-ва
SO3 ____________________________________________________________________
Получение
В промышленности
1. Окисление сернистого газа в присутствии катализатора
________________________________________________________________________
В лаборатории
2. Разложением солей
________________________________________________________________________
Химические свойства
А. Кислотные свойства
1. С водой ____________________________________________________________
2. С основными оксидами __________________________________________
3. С щелочами (избыток) ___________________________________________
С щелочами (недостаток) __________________________________________
Б. Окислитель
4. H2S:________________________________________________________________
5. HBr:________________________________________________________________
Степень окисления +6. Серная кислота
Физические св-ва
H2SO4 _________________________________________________________________
Получение
В промышленности
1. _____________________________________________________________________
Химические свойства
Разбавленная серная кислота
А. Кислотные свойства (разбавленная)
1. С металлами (до Pb) ______________________________________________
2. С основными и амфотерными оксидами
________________________________________________________________________
________________________________________________________________________
3. С щелочами (избыток кислоты)
________________________________________________________________________
С щелочами (недостаток кислоты)
________________________________________________________________________
4. С солями _________________________________________________ (осадок)
__________________________________________________________________ (газ)
Концентрированная серная кислота
Б. Окислитель
1. Металлы до Al
________________________________________________________________________
2. Металлы Mn — H
________________________________________________________________________
3. Металлы после H
________________________________________________________________________
4. Al, Fe, Cr на холоду (tкомн.) пассивируются.
Реакция только при нагревании!
________________________________________________________________________
5. Неметаллы
S:_____________________________________________________________________
P:_____________________________________________________________________
C:_____________________________________________________________________
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
