
Бесплатный фрагмент - Пособие по изучению иммунного ответа
Патофизиология TLR и её влияние на механизмы развития патогенеза заболеваний иммунной системы
Слово к читателю
Дорогие настоящие, а может быть после прочтения и будущие коллеги: студенты, врачи разных специальностей, коих нет числа, доктора наук и просто люди взявшие в руки эту книгу. После прочтения многое что тут написано может показаться непонятным, а может и вовсе неясным, но моя убедительная просьба к Вам будет не пугаться огромного наплыва информации. Ведь все мы-это одна единая машина, призванная встать на защиту здоровья людей- их физического, психического и социального благополучия. И мы должны отдавать себе ясный отчет что без получения новых знаний мы не продвинемся в понимании лечения болезней: лучше двигаться с заданной целью вперед, чем стоять и уж тем более бесмысленно пятится ползком назад. Мне сложно сказать что это: настольная книга, «краткий очерк» по описанной проблеме, длинная брошюра. Назову это по-простому-национальное руководство по иммунологии. Надеюсь, Вы проведете время с толком за чтением данной книги.
Пособие по изучению иммунного ответа
Роль триггерного рецептора, экспрессируемого на миелоидных клетках, в активации врожденного иммунитета
Исследование патофизиологии и корригации механизмов развития инфекционных и нефинфекционных патологий, в связи функциональной активности триггерного рецептора. Role of Triggering Receptor Expressed on Myeloid Cells in the Activation of Innate Immunity
The innate immune system plays a key role in triggering a systemic inflammatory response (SIR). The triggering receptor expressed on myeloid cells (TREM51), which is located on neutrophils and monocytes, is involved in SIR, by regulating the effector mechanisms of innate immunity. Hyperproduction of proinflammatory cytokines is a pathogenetic component of the hyperergic phase of acute systemic inflammation. The simultaneous activation of Toll5like receptors and TREM51 increases the production of cytokines manifold. This is compensatory and adaptive, however, resulting in damage to organs and tissues during excessive production of cytokines.
Список условных обозначений и ключевые слова:
AKT — протеинкиназа В (Activation of Akt/protein kinase B);
AРQ1 — активирующий протеинQ1 (Activator proteinQ1);
CD — кластер дифференцировки (Cluster of differentiation);
DAP12 — ДНК-активирующий белок молекулярной массой 12 кДа (DNAXQactivating protein of molecular mass 12 kilodaltons);
GMQCSF — гранулоцитарно-макрофагальный колонестимулирующий фактор (Granulocyte macrophage colonystimulating factor);
HMGBQ1 — высокомобильный белок группы ВQ1 (Highmobility group protein BQ1);
ICAM — молекула межклеточной адгезии (InterQCellular Adhesion Molecule);
IFN β — интерферон β (Interferon β);
IL — интерлейкин (Interleukin);
IRAKQ4 — ILQ1 рецептор асоциированная киназа (ILQ 1RQassociated kinasesQ4);
IRF3 — регулирующий интерферон фактор Q-3 (Interferon regulatory factor 3);
ITAM — активирующий мотив иммунорецептора на основе тирозина (immunoreceptor tyrosineQbased activation motif);
LPS — липополисахариды (Lipopolysacharide);
MyD88 — белок миелоидной дифференцировки первичного генного ответа (Myeloid differentiation primary response protein 88);
NF-kB — ядерный фактор (Nuclear factor kB);
PGE2 — простагландин GE2;
PI3K — Фосфатидилинозит киназа (phosphoinositideQ3 kinase);
PLСQγ — фосфолипаза СQγ;
PRR — паттерн распознающие рецепторы;
RIP1 — взаимодействующий с рецептором белок 1 (ReceptorQinteracting protein 1);
TIRQ домен — Toll QIL1 рецепторный домен (toll Qinterleukin
1 receptor);
TLR — Toll Qlike рецептор (TollQlike receptor);
TNFα — фактор некроза опухоли α (Tumor necrosis factor alpha);
TRAF6 — ассоциированный с рецептором фактора некроза опухоли фактор Q6 (TNFQreceptorQassociated factor 6);
TREMQ1 — триггерный рецептор, экспрессируемый на миелоидных клетках (Тriggering receptor expressed on myeloid cells Q1);
TRIF — TIRQ доменсодержащий адаптор, индуцирующий IFNQγ (TIR domainQcontaining adaptorQinducing IFNQγ);
МАРК — митоген активируемые протеинкиназы (MitogenQactivated protein kinase)
МНС II класса — главный комплекс гистосовместимости II класса (Major Histocompatibility Complex II);
ЦОГ — циклооксигеназа
Ведущее значение иммунологических нарушений заключено в системной воспалительной реакции (СВР) и обусловлено патофизиологическими изменениями в организме.
Факторы воздействия патогенного фактора индуцируются в организме за несколько минут или часов, и иммунная защита обеспечивается в первую очередь механизмами врождённого иммунитета. Сам по себе механизм представлен комплексной системой различных по строению и функционированию анатомо-физизиологических структур. В распознавание чужеродных структур (патогенов, ЛПС, пептидогликанов, липопептидов, флагеллинов и прочих элементов) особую и главенствующую роль играют PAMPs (патоген- ассоциированные молекулярные паттерны) через наследственно закодированные рецепторы PRRs (паттерн- распознающие рецепторы).
Среди PRRs центральное место занимают Toll- like рецепторы (TLR), которые управляют целым рядом эффекторных функций (хемотаксис, фагоцитоз, респираторный взрыв, дегрануляция нейтрофилов, синтез эффекторных и регуляторных молекул), а также активируют и регулируют адаптивный иммунный ответ (адаптивная/ приобретенная иммунная система), необходимый (-ая) для узнавания более сложных высокоорганизованных изменяющихся молекулярных структур (белков). В процессе формирования и реализации функций клеток врожденной иммунной системы (дендритные клетки, макрофаги, нейтрофилы, тучные клетки, эозинофилы и др.), происходит изменение их поверхностных структур, активация захвата АТ, и изменение эффекторных механизмов. И вследствие этого, происходит обеспечение контроля иммунного гомеостаза: полная реализация эффекторных реакций врождённой иммунной системы и индукция приобретённого иммунитета.
Среди PAMPs выделяют:
MAMPs (микробно- ассоциированные молекулярные паттерны), преимущественно- рецепторы флагеллина (липополисахариды, манноза, пептидогликаны, липопротеины). Установлена зависимость распознавания флагеллина от рецепторного гена FLS2. В результате взаимодействия флагеллина и продукта гена FLS2- трансмембранная рецептподобная протеинкиназа, происходит активация каскада митогенактивируемых протеинкиназ и как итог- индукция комплекса защитных реакций в виде иммунного распознавания;
DAMPs (ассоциированные с повреждением молекулярные паттерны) — молекулярные фрагменты, способные инициировать неинфекционный воспалительный ответ на неинфекционный возбудитель. При повреждении тканей генерируются следующие структуры DAMPs: S100 белок (участвует во внутриклеточной и внеклеточной регуляции: клеточный рост и дифференциация, транскрипция, прогрессия клеточного цикла, организация клеточных мембран и динамика цитоскелета, защита от оксидативного повреждения клетки, секреция, фософолирование). Его повышенная концентрация в крови может свидетельствовать о образовании и развитии в организме меланомы, активно продуцирующей S100 и массивная гибель нейронов и как последствие- высвобождение белка S100 в общий кровоток. Таким образом, ECLIA- электрохемилюминнсцентный анализ- позволяет диагностировать рак кожи и заболевания ЦНС (травмы ГМ, ОНМК, нейдегенерация, болезнь Крейтцфельда- Якоба и др.) Белки теплового шока (HSP): поддержание структуры стероидных рецепторов и факторов транскипции, принимает участие в сворачивании и разворачивании белков, тем самым, обеспечиваю клетке нечувствительность к нагреванию, а именно их транскрипционный фактор, регулирующий экспрессию гена Hsp70, который является фактором канцрогенеза. Помимо этого, ингибирование HSP позволяет бороться против некоторых видов рака.
TLRs, о которых мы говорили раньше, способны идентифицировать и связываться с обеими видами паттернов. Сами по себе TLRs представлены как трансмембранные интегральные белки и между своими представителями имеют сходное строение. Структура молекулы представлена из нескольких содержательных компонент: поверхностная зона- N-концевая область аминокислотной последовательности из 19—25 участков, обогащённых лейцином (функция заключается в связывании лиганда). Далее- переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, содержащий в себе преимущественно цистеин. Внутренняя дистальная часть рецептора представлена TIR доменом, имеющий сходное строение с семейством цитокинов IL-1.
В зависимости от локализации TLRs в клетке выделяют рецепторы, расположенные на цитоплозматической мембране и на мембранах внутриклеточных органелл- лизосом, эндосом, аппарат Гольджи; лигандами самих рецепторов являются поверхностные структуры микроорганизмов- липопротеин, липополисахариды, флагеллин, зимозан.
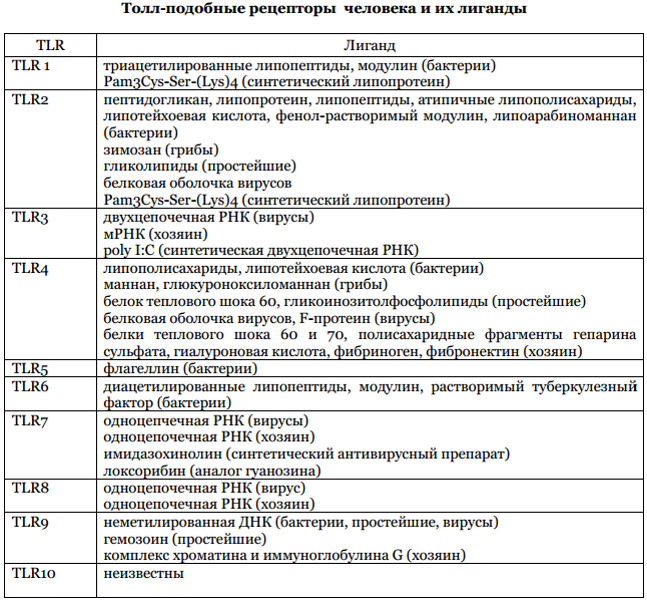
Ниже будут представлены все собранные сведения о TLR в виде проведенных исследований за 2016—2017 гг.
TLR-1
TLR-1- мембранный белок, распознающий патоген-связанные молекулярные структуры грам- положительных бактерий: пептидогликаны и липопептиды. Способен образовывать комплекс с TLR-2. Присутствует на всех лейкоцитах; обладает самой высокой экспрессией среди членов своей группы.
Чтобы проверить общие и редкие ТЛР варианты, участвующие в предрасположенности или резистентности к инфицированию микобактериями туберкулеза мы проанализировали экзоны генов, кодирующих ТЛР 1, 2, 4, и переходник молекулы TIRAP в более чем 4500 случаев туберкулеза (ТБ). Проведенный анализ позволил определить 109 вариантов с возможными функциональными воздействиями, в том числе 101 не синонимичный вариант. Анализ ассоциации дал значительный результат: 533 афроамериканца подтвердили защитный эффект и вызывает обмен аминокислоты из гистидина на лейцин в позиции 305.
Поэтому наблюдаемый эффект может быть обусловлен структурными изменениями TLR-1 молекулы, позволяющие связать эти микобактериальные лиганды, которая преимущественно может вызывать защитный иммунный ответ. Это подтверждается анализом БЦЖ-стимулированных периферических мононуклеарных клеток, проявляет повышенный индукции провоспалительного цитокина ИФН-γ у носителей мутантного TLR1 rs3923647 ТТ генотипом, по сравнению с ИФН-γ уровней лиц с АТ и АА генотипов.
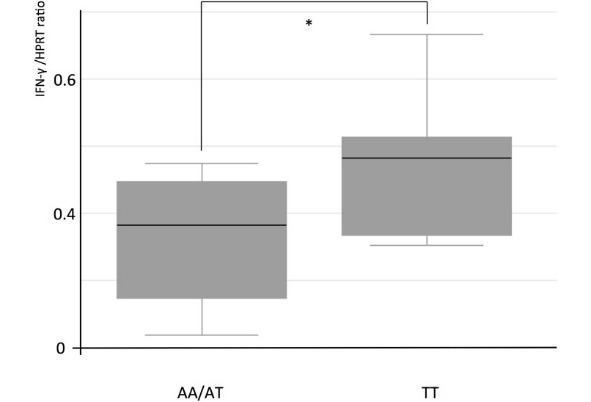
IFN-y expression in M. bovis BCG stimulated cultured PBMCs.
Туберкулез (ТБ), заболевание, вызываемое микобактериями туберкулеза (МТБ) инфекцией, до сих пор остается глобальной проблемой общественного здравоохранения. Восприимчивость к туберкулезу очень сильно варьируется в инфицированных, так и микобактериальных атаках на врожденную иммунную систему, вероятно, влияет на ход заболевания и его исход. Данное исследование описывает однонуклеотидный полиморфизм toll-подобных рецепторов TLR-1 ген, функционально меняет врожденный иммунный ответ.
206 больных туберкулезом и 239 здоровых от Хайдарабад, Индия были проанализированы на Снпс в TLR-1 и TLR-2 генов, которые впоследствии были соотнесены с восприимчивостью ТБ. Чтобы проверить индивидуальную реакцию, мы стимулировали Мнпк, а также Хек клетки, трансфицированные с TLR1/2 вариантов. Производство tnf и NF-кв активации были оценены соответственно.
TLR1—248N СНП связана с защитой от туберкулеза в индийском населении и проявляет повышенный иммунный ответ.
Оценка клинической значимости однонуклеотидных полиморфизмов в TLR-1, TLR-2 и TLR-6 у пациентов с метастатическим колотеральным раком (mCRC). Была проведения терапия препаратами FOLFIRI первой линии (комбинированная терапия иринотеканом, фторурацилом-5 и фолиновой кислотой) + бевацизумаб. Для проведения были взяты две когорты пациентов (228 и 297 человек соотвественно). Наши данный свидетельсвуют о проведении многомерного анализа+ TLR-1 может служить предиктором клинического ответа на FOLFIRI+ бевацизумаб у пациентов с mCRC.
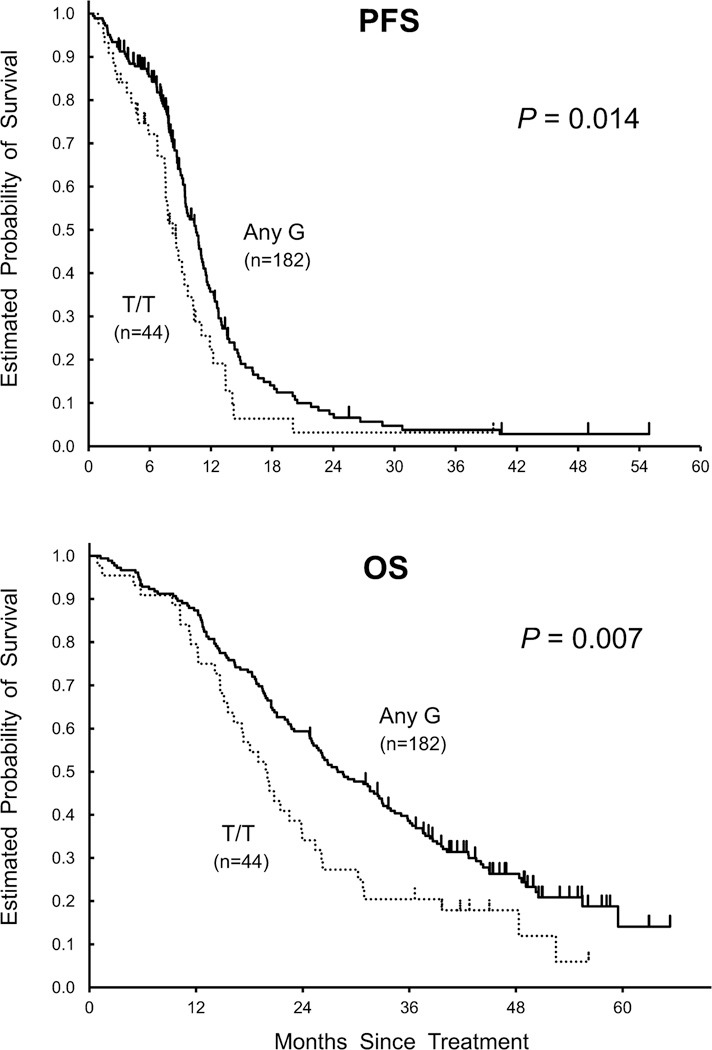
Генетические вариации в TLR1 и TLR6 могут изменить риск развития осложненной малярии и способность принимающей для борьбы с паразитами нагрузку во время острых плазмодийных инфекций.
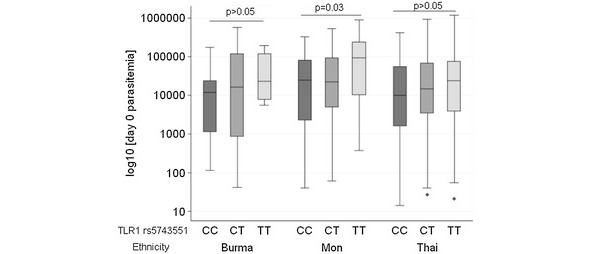
Пять однонуклеотидных полиморфизмов в TLR-1 и TLR-6 у 432 пациентов с клиническими П. тропической моноинфекцией, приобретенным на границе Таиланда и Мьянмы были генотипированы. С помощью логистической регрессии, ассоциации с развитием осложненной малярии и определения процента зараженных эритроцитов (паразитемии) на день предъявления медицинской помощи (нулевой день) были протестированы.
Генотипов, несущих Т (основных) аллель Гена TLR1 rs5743551 — аллели, связанные с улучшением исхода были связаны с высокой паразитемией и измерялись на нулевой день (р = 0,03).
Так как это заболевание оказывает сильное генетическое давление на геном человека, защита от паразитемии, связанные с TLR1 rs5743551 может составлять содержание аллеля ассоциировано с неблагоприятным исходом.
Эти данные предполагают, что генетические вариации в TLR1 оказывает влияние на реакцию хозяина к тропической малярии в Азии. Генотипы с TLR6 показали никаких доказательств ассоциации с осложненной малярией или паразитоносителя бремя.
Генетические факторы, вероятно, способствуют низким серьезным показателям летальности от малярии в Меланезийских популяциях, но исследования могут быть недостаточными и не могут предоставить правдоподобного механистического объяснения при обнаружении существенных ассоциаций. В рамках подготовки к геном-широкому изучение ассоциации, однонуклеотидные полиморфизмы (Онп) с малой частоты аллелей> 5% были рассмотрены в случае контроля исследования 504 ребенка с тяжелой формой малярии. Параллельно, для повышения иммунитета y была выполнена на выздоравливающих мононуклеарных клеток вливание периферической крови (Мнпк). После стимуляции Толл-подобных рецепторов, эффекторные цитокини и хемокины были исследованы. Единственная существенная генетическая связь наблюдается участвует несинонимичных СНП (TLR1rs4833095) Гена TLR1. Был рецессивный (ТТ) — Генотип ассоциирован с уменьшенным коэффициентом тяжелой малярии 0.52 (95% доверительный интервал (0.29—0.90), Р=0,006). Концентрации провоспалительных цитокинов интерлейкина-1β и фактора некроза опухоли α в тяжелых случаях малярии значительно выше по сравнению со здоровыми лицами, но ниже у детей с защитной рецессивный (Генотип ТТ).
Генетический вариант в TLR1 может способствовать низкое тяжелой малярии коэффициент летальности в этой области, за счет снижения провоспалительного клеточного фенотипа.
Данное исследование проводилось с целью определения влияния TLR-1 на патогенез механизмов аллергии.
TLR-1/2 в периферической крови мононуклеарных клеток и моноцит-производных дендритных клеток разных генотипов были измерены с помощью твердофазного иммуноферментного анализа (ИФА). 93 тайваньских пациента, страдающих аллергией (бронхиальная астма, аллергический ринит или атопический дерматит) были привлечены для генотипирования. Сыворотка иммуноглобулина Е (IgE) уровень были оценены для 60 пациентов, страдающих аллергией.
TLR1 несущей аллель возросло Pam3CSK4-индуцированного фактора некроза опухоли-α и интерлейкина-12 ответов в периферической крови мононуклеарных клеток и моноцит-производных дендритных клеток, соответственно. Кроме того, хотя Генотип С/С не был связан с восприимчивостью к атопическим заболеваниям, это сопровождается снижением уровня общего IgE в сыворотках крови пациентов, страдающих аллергией.
Наши данные свидетельствуют о том, что TLR1 полиморфизм может играть роль в формировании th1/Тһ2-дифференцировки, и определение сывороточного уровня IgE. Однако, взаимодействия с другими генетическими и экологическими факторами может потребоваться внести вклад в риск возникновения аллергических заболеваний у населения.
Можно обнаружить в зараженных перипротезных тканях TLR и оценить полезность этих биомаркеров в качестве тестов для выявления перипротезной инфекции.
Пятьдесят девять пациентов, перенесших пересмотра эндопротезировании (двадцать семь бедра и тридцать два колена) были перспективно оценены по перипротезной инфекции в соответствии с рекомендуемыми в настоящее время диагностическими критериями. Девять пациентов были исключены из-за нехватки работы, оставив пятьдесят доступны для изучения.. Перипротезные ткани были собраны интраоперационно, и тотальную РНК выделяли по стандартным методикам. Экспрессию ТЛР-мессенджер РНК оценивали по первой нити комплементарной синтез ДНК 1 мкг тотальной РНК с последующим ПЦР в реальном времени (полимеразная цепная реакция).
TLR1 экспрессия мРНК была значительно выше в инфицированных по сравнению с незараженных образцов (0.600 по сравнению с 0,005, р = 0.0003); то же самое касается TLR6 (0.208 по сравнению с 0.0165, р = 0.0059), но не TLR10 (0.00019 по сравнению с 0.00014, р = 0.6238). Аук был 0.995 для TLR1, TLR6 для 0.883, и 0.546 для TLR10. Оптимальный порог для диагностики перипротезной инфекции 0.0924 для TLR1 (чувствительность = 95.2%, специфичность = 100%, ОП+ = 13.80, ЛР- = 0.91) и 0.0215 для TLR6 (чувствительность = 85.7%, специфичность = 82.8%, ОП+ = 4.98, ЛР- = 0.83).
В нашем экспериментальном исследовании, TLR1 выраженны в перипротезные ткани и наиболее точно предсказывали перипротезные инфекции. Эта мера реакции хозяина могут быть особенно полезны в обнаружении культура-отрицательных инфекций.
Инфекции нижних дыхательных путей, вызванных бактериями являются основной причиной смерти людей независимо от пола, расы, или географии. Действительно, накопленные данные свидетельствуют о более высокой смертности и заболеваемости из-за этих инфекций, чем от рака, малярии или ВИЧ-инфекции. Успешное признание, за которым последует соответствующий ответ, бактериальных патогенов в легких имеет решающее значение для эффективного легочного узла обороны. Хотя активация нейтрофилов в легких является ключевым фактором в ответе от вторжения микробов-возбудителей, альвеолярные макрофаги, эпителиальные клетки, дендритные клетки и CD4 (+) Т-клеток, также способствует ликвидации бактериальной нагрузки. Распознавания образов рецепторы, такие как toll-подобные рецепторы (tlrs) и нуклеотид-связывающий домен олигомеризации-подобных рецепторов, имеют важное значение для признания и учета микроорганизмов в легочной инфекции. Однако, бактериальные патогены приобрели хитрую уклончивую стратегию, чтобы обойти распознавание отклика рецептора и таким образом создать инфекции. Углубление понимания функции системы tlrs и уклончиво механизмов, используемых микроорганизмами в легочной инфекцией позволит углубить наши знания об иммунопатогенезе и имеет решающее значение для разработки эффективных терапевтических и/или профилактических мер. В настоящем обзоре обобщены современные знания несколько ролей системы tlrs в бактериальные инфекции легких и основные механизмы, используемые патогенными для модуляции или мешать ТЛР сигнализации в легких.
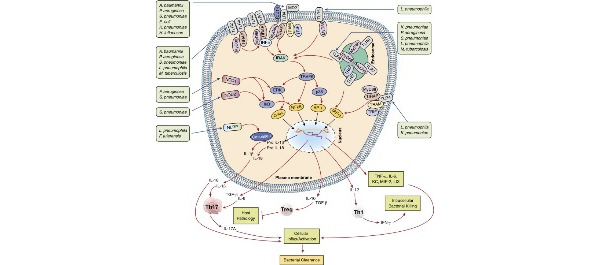
Сигнальный каскад при активации распознавания рецепторов легочных патогенов. Плазматическая мембрана-граница Толл-подобных рецепторов (tlrs) (TLR1, 2, 4, 5) и мембраносвязанных температуры окружающей среды системы tlrs (TLR9) распознает бактерии в легких. После этого происходит активация фактора транскрипции ядерного фактора-кв (NF-кВ) и митоген-активируемых протеинкиназ (MAPKs). АП-1 активацию Map-киназного каскада, в свою очередь, приводит к индукции транскрипционных факторов и C-ФОС. Кроме того, при стимуляции лигандами, в NOD-подобного рецептора белка (NLRP) индуцируют активацию эффекторной каспазы-1. В свою очередь, ведет к активации цитокинов в дифференцировке Т-клеток на th1 -, th17-лимфоцитов, или регуляторные Т-клетки (Tregs), что приводит к формированию легочного узла обороны.
А. baumannii = инфекциями, вызванными acinetobacter baumannii; е. coli = кишечная палочка; Ф. название рода = мелкая грамотрицательная палочка; культура H. influenzae = Гемофильная инфекция; К. рпеимопіае = Клебсиелла пневмонии; л. pneumophila = Легионеллы pneumophila; микобактерии туберкулеза = микобактерий туберкулеза; клеток P. aeruginosa = Синегнойная палочка; С. рпеимопіае = пневмококк.
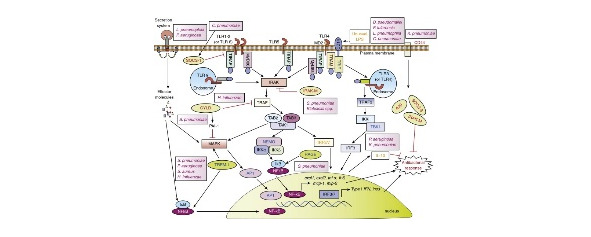
Сигнализация при бактериальных инфекциях легких
Негативные регуляторы системы tlrs (показано красным цветом бледно-зеленые эллипсы), ил-1 рецептор-ассоциированной киназы-М (Ирак-М), супрессоры цитокиновых сигналов 1 (МНК-1), предназначенные для разных молекул внутри ТЛР сигнального пути для подавления их экспрессии или активации.
Положительные регуляторы (показаны синим цветом на темно-зеленых эллипсах), срабатывающие на миелоидные клетки 1 (ТРЭМ-1), рецептор для конечных продуктов гликирования, секреторные молекулы бактериальной системы секреции, усиливают ТЛР срабатывания сигнализации путем активации ядерного фактора (НФ) -KB и/или митоген-активируемых протеинкиназ (MAPKs).
Б. псевдоволосы = отличает псевдоволосы; С. рпеимопіае = хламидии пневмонии; Ф. название рода = мелкая грамотрицательная палочка; культура H. influenzae = Гемофильная инфекция; К. рпеимопіае = Клебсиелла пневмонии; л. pneumophila = Легионеллы pneumophila; П. аегидіпоѕа = Синегнойная палочка; золотистый стафилококк = стафилококк; С. рпеимопіае = пневмококк.
Неалкогольная жировая болезнь печени (НАЖБП) предполагает, что увеличение транслокации бактериальных эндотоксинов приводит к активации толл-подобного рецептора и зависимых сигнальных каскадов (системы tlrs) с повышенным образованием активных форм кислорода, что может способствовать развитию инсулинорезистентности и индукции ингибитора активатора плазминогена-1 (ИАП-1) в печени. Если подобные механизмы также участвуют в развитии НАЖБП у человека, то необходимо определить насколько сильно их влияние предопределяет патогенез болезни.
Toll-подобные рецепторы (1—10), миелоидная дифференцировка первичной реакции Гена (MyD88), интерферон регулирующего фактора транскрипции 3 (ИРФ-3) и инсулин-рецепторного субстрата 1 (опи-1) + экспрессия мРНК была определены с помощью печеночных проб из 11 пациентов с НАЖБП.
Печеночные пробы ТЛР 1—5 показали результат экспрессии мРНК значительно выше в печени НАЖБП у больных, в то время как экспрессию ТЛР 6—10 мРНК не отличались между группами.
Эти результаты добавляют веса гипотезе о том, что изменения на уровне барьерной функции кишечника может быть критическим в развитии НАЖБП у людей.
Определить, связаны TLR со смертностью, в частности сепсис-ассоциированной смертности.
TLR-S могут вызвать раннее воспалительные реакции на возбудителя. Генетические вариации в системе TLR-S связаны с восприимчивостью и результатов в ряде государств инфекционных и неинфекционных заболеваний.
Пациентов, поступивших в отделение интенсивной терапии травмы на уровне 1 травмпункт были генотипированы, а также проведен логистический регрессионный анализ для определения ассоциаций между TLR1 и смертности. Далее мы исследовали связи между TLR1 и смертности в подгруппах на основе наличия сепсиса и типа сепсис-ассоциированных организмов.
TLR1—7202G (rs5743551) был связан с повышенной смертностью после травмы, и эта ассоциация была в первую очередь наблюдалось в подгруппе больных, у которых развился сепсис [скорректированное отношение шансов (Ош): 3.16; 95% доверительный интервал (ди): 1.43—6.97, Р=0,004]. Эта ассоциация сохранялась после дальнейшего ограничения к грамположительным сепсисом. TLR1 (742A/г (Asn248Ser)) (rs4833095), кодирующий SNP в ЛД с TLR1—7202G, был также связан со смертностью в грамположительный сепсис (с учетом или: 4.16; 95% ди: 1.22—14.19, Р=0,023).
Генетической изменчивости в TLR1 связан с повышенной смертностью у пациентов с сепсисом после травмы и может представлять собой новый маркер риска смерти у критически травмированных пациентов.
TLR-2
TLR-2- мембранный белок, распознает грамположительные бактерии, а именно пептидогликаны, липотейхоевую кислоту, некоторые компоненты микобактерий и зимозан клеточной стенки дрожжей.
Они распознают патоген-ассоциированные молекулярные паттерны (Пампс), которые выражаются на инфекционные агенты, и опосредуют продукции цитокинов, необходимых для развития эффективного иммунитета. Различные системы tlrs демонстрируют различные модели выражения. Этот ген экспрессируется наиболее обильно в лейкоцитах периферической крови и опосредует реакции хозяина к грам-положительных бактерий и дрожжей через стимуляцию NF-кв.
В кишечнике, tlr2 и регулирует экспрессию CYP1A1, которая является ключевым ферментом в детоксикации канцерогенных полициклических ароматических углеводородов, таких как бензапирена.
Заболеваемость ишемическим реперфузионным повреждением (ИРИ) в ранней стадии после трансплантации и активация толл-подобных рецепторов (tlr-2) и tlr-4, которые могут заметно повлиять на результат почечного аллотрансплантата.
Необходимо разобраться, соответствует ли экспрессия системы tlrs в мононуклеарах периферической крови (Мнпк), которые могут предсказать вероятный клинический исход аллотрансплантации почек.
Нами были получены образцы крови у 52 больных до пересадки почек с целью анализа экспрессии tlr-2 и tlr-4 на моноцитах периферической крови. Особенности экспрессии tlr-2 и tlr-4 были сравнены между пациентами с дисфункцией трансплантата (ГД) и с хорошо функционирующим трансплантатом.
Существенные динамические изменения экспрессии ТЛР-2 в зависимости от ТЛР-2+ клеток между (в ГД и также) группами существовали в самый раз до и после трансплантации почки (р=0,007), за исключением 2-й день после трансплантации. Мы наблюдали значимо более высокие средние показатели интенсивности флуоресценции tlr-2 и tlr-4 на cd14+ клетках в ГД группу по сравнению с группой. Этот вывод особенно наблюдался через 180 дней после трансплантации (р=0,001).
В результате последовательный контроля экспрессии tlr-2 и tlr-4 моноцитов в периферической крови появляются прогностические биомаркеры для ранней и поздней стадии результатов аллотрансплантата почки.
В этом исследовании, мы исследовали влияние Толл-подобного рецептора 2 (tlr2 и на активировацию CD4+ Т-клеток у ВИЧ-1-инфекции путем сосредоточения наших экспериментов по относительной чувствительности подмножеств клеток на основе их экспрессии CCR6. Очищенный первичные CD4+ Т-клетки были впервые подвергнуты костимуляции перед началом лечения с агонистами tlr2 и Pam3CSK4. Мы сообщаем здесь, что репликация ВИЧ-1 увеличивается при участии tlr2 на клеточной поверхности. Дополнительные исследования показывают, что высшее проникновение вирусов и полимеризации кортикального актина не видно в этой камере подмножества следующим tlr2 и стимуляции.
После первичной инфекции, ВИЧ-1 вызывает иммунологические и структурные нарушения слизистой оболочки кишечника, что приводит к транслокации бактерий и выделению микробных компонентов в кровоток. Эти возбудители-производные компоненты, включают в себя несколько агонистов toll-подобных рецепторов, которые могут влиять на кишечник-самонаводящиеся CD4+ Т-клеток, таких как те, выражая хемокиновых рецепторов CCR6, которые являются весьма свободными для проникновения для ВИЧ-1 инфекции. Наши результаты указывают на потенциальное влияние бактериальной транслокации на общую вседозволенность CCR6+ и клеток CD4+ для продуктивной инфекции ВИЧ-1.
Toll-подобных рецепторы (tlr) играют ключевую роль в работе иммунной системы человека; для того чтобы получить лучшее представление о связи между полиморфизмом TLR4 и риском СКВ, Мета-анализ был проведен. В общей сложности проведены 4 контрольных исследования с участием 503 636 случаев с СКВ и здоровых. Статистические данные были использованы для оценки степени неоднородности. Ассоциация между TLR4 и СКВ была изучена с помощью теста Эггера и теста по Бегг.
В целом, нет никаких доказательств прямой связи между риском СКВ и D299G и T399I полиморфизмов TLR4. Мета-анализ показал нулевую ассоциацию между полиморфизмом TLR4 и риском СКВ и в входит исследование популяций, но роль полиморфизмов TLR4 в развитии СКВ среди населения остается неопределенным. Кроме того, некоторые лабораторные исследования обнаружили участие TLR4 в процессе СКВ. Таким образом, ассоциация между полиморфизмом TLR4 и риск СКВ требует дальнейшего исследования как в лабораторных, так и в эпидемиологических усилия.
Внутрипеченочная холангиокарцинома (ICC) является редкой патологией, которая часто диагностируется на поздних стадиях, что ограничивает возможности лечения. Несмотря на увеличение заболеваемости и смертности во всем мире, патогенез ЕРЦ до сих пор не до конца разобран. Здесь, мы исследовали влияние регуляции врожденного иммунного ответа на канцерогенез, исследуя роль толл-подобных рецепторов (tlr) 2 в патогенезе дабы изучить скрытые механизмы патогенеза.
Иммуногистохимический анализ, ПЦР в реальном времени и вестерн-блоттинг показал более высокие уровни tlr2 у ЕРЦ тканей и клеточных линий. гиперэкспрессия tlr2 способствует инвазии, индуцирует экспрессию эпителиальных тканей, в результате чего происходит мезенхимальный переход (ЕМТ) маркеры, следствием которого является выработка провоспалительных цитокинов фактора некроза опухоли (ФНО) -α, интерлейкина (ил) -6, ил-1β, одновременно с активации NF-κb. Ингибирование NF-кб активности также угнетает и действие tlr2, регуляции провоспалительных цитокинов, а также подавляет эффект экзогенного ФНО-α.
Проведенные вместе исследования показывают, что tlr2 и имеет метастатический эффект в результате повышенной экспрессии провоспалительных цитокинов и производит воздействие на индуцированную активацию NF-κb. Исходя из данного исследования, нам открываются потенциальные новые терапевтические мишени для лечения ICC.
Менингококк является условно-патогенным грамотрицательных штаммом бактерий человека, который колонизируют на эпителиальных тканях носоглотки человека. Бессимптомное носительство является общим, но некоторые штаммы менингококков могут проникать в эпителиальные клетки носоглотки и быть причиной тяжелых и часто смертельных инфекций.
Вторжение стимулируется экспрессией факторов вирулентности бактерий хозяина с участием клеточных рецепторов для распознавания бактерий. Порины являются одними из компонентов штамма менигококков, участвующих в активации бактериальных процессов интернализации. Похожи на другие факторы вирулентности, в поринах присутствуют антигенные структуры, которые способствуют активации процесса изменчивости структуры строения бактерий среди штаммов.
Такие антигенные структуры коррелируют с бактериальной инвазией и изменчивостью размещения иммунного ответа через Толл-подобного рецептора 2 (tlr2 и). Здесь, мы исследовали, влияет ли экспрессия tlr2 на порины и на восстановление внутриклеточного состава менингококка. Наши результаты показывают, что экспрессия TLR-2, как правило, повышает интернализацию в эпителиальнах клетках. Tlr2 через ERK1/2, JNK и, в частности, NF-кв играет важную роль в этом процессе. Основываясь на этих результатах, tlr2 может стать механизмом для повышения инвазивных особенности патогенных штаммов Neisseriae.
Толл-подобные рецепторы (tlrs) являются рецепторами, преимущественно располагающиеся на поверхностях клеток врожденной иммунной системы. Курение производит на иммунную систему значительный патологический эффект, который распознается через каскад клеток tlrs. Существуют полиморфизмы генов tlr, которые имеют восприимчивость к различным видам злокачественных новообразований.
Исследование было проведено с целью изучить возможную экспрессию и последующую взаимосвязь между TLR-2 и механизмом развития рака желудка. В общей сложности 133 гистологически подтвержденных случаев заболевания раком желудка были отобраны для этого исследования. Взаимосвязь Tlr2 и 22 генотипов определяли аллель-специфической полимеразной цепной реакции (ПЦР). Бинарные условный логистический регрессионный анализ был использован для поиска ассоциации между tlr2 и риском развития рака желудка. Логистическая регрессия с использованием иерархической, четко сформулированной моделью был использован для анализа взаимодействия между tlr2 и механизмом развития болезни.
Лица, имеющие гетерозиготный генотип и повышенные показатели экспрессии TLR-2, попали в группу повышенного риска развития рака желудка в модели многомерной логистической регрессии. Наши исследования показали, что tlr2 значительно и независимо связан с риском развития рака желудка.
Для того чтобы установить взаимосвязь влияния экспрессии однонуклеотидных полиморфизмов (SNP) rs5743704 в TLR-2 с первичной открытоугольной глаукомой (ПОУГ) или любой из его клинических проявлений в Саудовской когорте.
Девяносто пять случаев ПОУГ были генотипированы с использованием TaqMan (R) анализа. Ассоциации между генотипами и различных клинических показателями важных для ПОУГ также были исследованы.
В генотипических и аллельных частотах среди случаев существенно не различалась по сравнению с контролем. Нет значимой связи с внутриглазным давлением и коэффициентом экспрессии TLR-2. Тем не менее, носителей С/A генотипа прооходили более длинный курс, включащий противоглаукомные препараты по сравнению с контрольной группой (р = 0,04).
Rs5773704 в TLR-2 не связан с ПОУГ в Саудовской когорте пациентов.
Клетки Лангерганса представляют собой узкоспециализированное подмножество эпидермальных дендритных клеток (ДК), где еще не полностью понято значение их функции балансировки иммунитета кожи. Мы получили и исследовали в пробирке клетки Лангерганса, полученные от человека с формой острого миелобластного лейкоза клеточных линий с), необходимые для изучения влияния экспрессии ТЛР, связанной с цитокин-зависимой активации эпидермального рогового слоя. Активация tlr2 и снижение активности CCR6 и одновременное повышение экспрессии мРНК с CCR7. Аналогичные результаты были получены при стимуляции провоспалительных цитокинов tnf-α и Il-1β. Несмотря на ограниченность генов и экспрессию провоспалительных цитокинов, взаимосвязь привела к значительному увеличению ИФН-γ и ил-22.
Автоматизированное исследование подтвердило неселективное связывание антагониста tlr2. Взятые вместе, наши результаты показывают важную роль для tlr2 и установки распознавания МУТЦ-Лвп.
Недавние исследования установили связь между системой реагирования и распознавания врожденной системы иммунитета в патогенезе миелодиспластического синдрома (МДС). Недавно мы выявили несколько генов, регулирующие системы tlrs, и предположили, что экспрессия TLR аномально активирована в МДС.
Мы проанализировали большую когорту пациентов с МДС и установили экспрессию с TLR1, tlr2 и TLR6. В результате глубокого секвенирования были обнаружены периодические генетический варианты. Функционально, экспрессия tlr2 и-F217S приводит к повышению активации распознавания механизма развития патологии, включая активность NF-кв. Ингибирование tlr2 у БМ cd34+ клеток у пациентов с низким риском МДС, привело к увеличению образования эритроидных колоний. Наконец, уровни экспрессии РНК tlr2 и TLR6, а также наличие связанной экспрессии у tlr2 и-F217S, может быть предназначением предикторов прогноза и клинического определения параметр и характеристик заболевания.
Эти результаты свидетельствуют о том, что экспрессия tlr2 устанавливает и распознает путь развития МДС, что является терапевтической мишенью для лечения патологии.
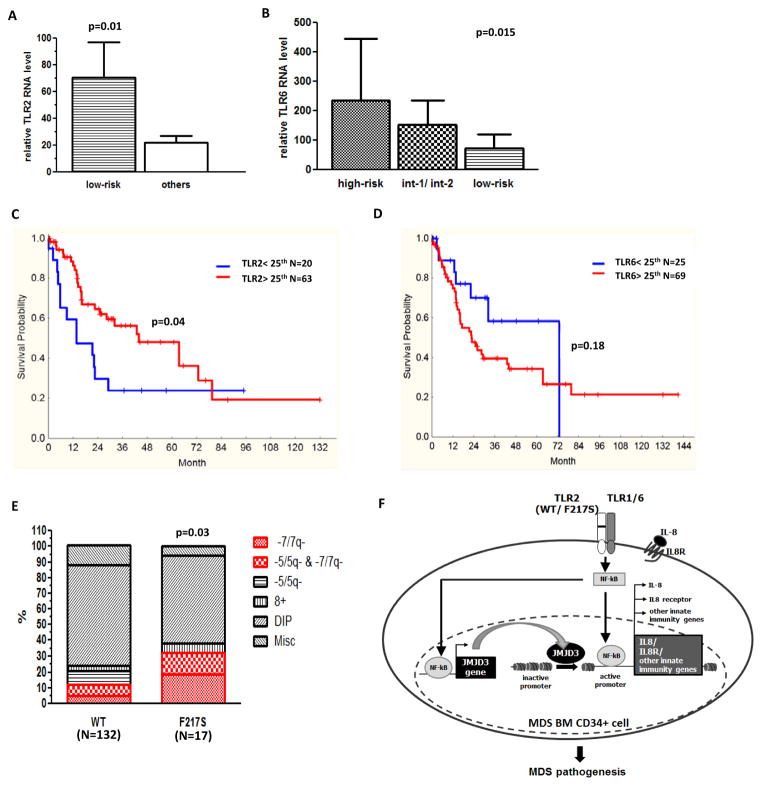
Высокий уровень экспрессии tlr2 у больных с низким риском по сравнению с другими.
Пациенты (B) с различными уровнями экспрессии TLR6 в группах высокого риска, среднего и низкого риса. (С–D) Соотношение tlr2 и 6 и общей выживаемости больных. (E) Пациенты с tlr2 и-F217S. (F) Предложена модель потенциального взаимодействия tlr2 и-JMJD3-у ил8.
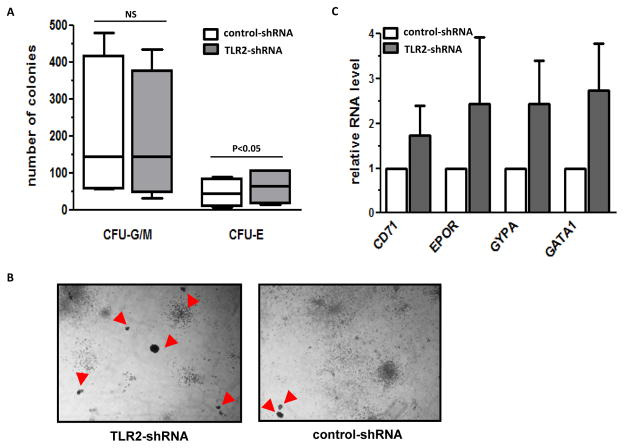
(A) Количество миелоидных колоний и эритроидных колоний образуется после двух недель трансдукции tlr2 и-shRNA, выделенных от больных с низким риском МДС. (B) представитель микрофотографии колоний образуется в виде пластин после трансдукции tlr2 и-shRNA (левая панель) и управления shRNA (правая панель). (C) анализ уровня РНК CD71, ЭПО, GYPA и GATA1 в клетке, собранные из общей колонии после трансдукции.
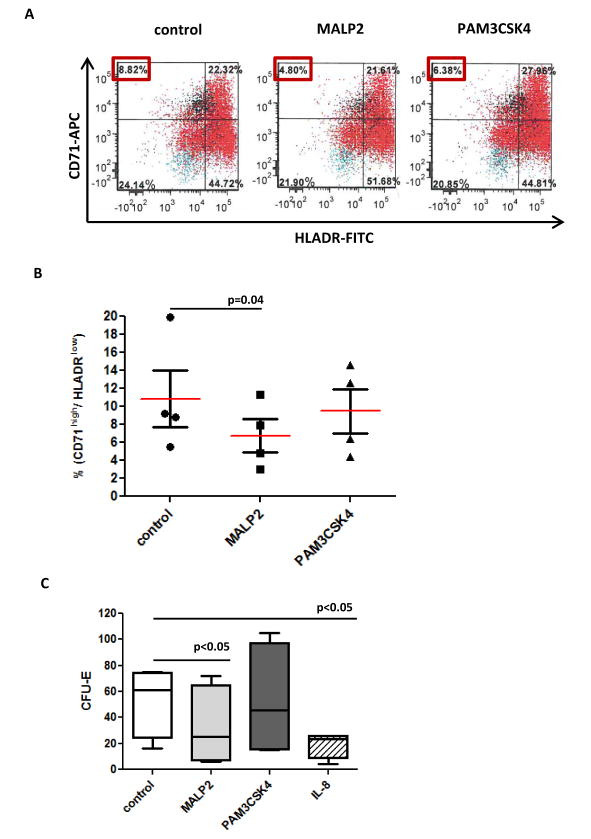
Анализ методом проточной цитометрии нормальных cd34+ клеток после лечения с MALP2 или PAM3CSK4 в течение 48 часов.
По сравнению с контролем, лечение привело к снижению доли ранних эритроидных прогениторных клеток. (B) краткое изложение анализа проточной цитометрии из CD71+ и HLADR — клеток в первичной БМ cd34+ клеток от четырех разных доноров. (C) Среда поддерживает формирование колонии, анализы показали пониженный уровень формирования эритроидных колоний.
TLR-3
TLR-3- мембранный белок, основная функция которого заключается в связывании двухцепочочной РНК вирусов и таким образом, играет важную роль в противовирусной защите организма.
Естественным лигандом рецептора является молекула двухцепочечной РНК. В силу своей симметричной природы РНКовый дуплекс обеспечивает связывание двух молекул TLR3, повёрнутых навстречу друг другу. Такая димеризация является сигналом, активирующим каскад последующих внутриклеточных процессов этого сигнального пути. В экспериментальных исследованиях используется аналог двухцепочечной РНК — поли. Чем длиннее этот полимер, тем лучше он активирует рецептор TLR3.
Данный рецептор находится на внешней плазматической мембране клетки и в мембране эндосом. Таким образом, клетка отвечает на проникновение вирусной РНК, которая попадает внутрь клетки в процессе эндоцитоза. Двухцепочечные РНК самой клетки находится в цитоплазме и в силу своей локализации не попадает в зону действия TLR3. Однако, при разрушении соседних клеток высвобождающаяся РНК может вступить во взаимодействие с ТЛР3, что может вызвать неблагоприятные реакции организма.
Энтеровирус 71 (ЭВ71) инфекции стал одной из основных угроз для детей во всем мире в последние годы. TLR3 играет важную роль в иммунной защите против ЭВ71 инфекции. Это исследование было разработано для оценки возможной связи между TLR3c.1377C/T полиморфизм и механизмом протекания ЭВ71 инфекции.
Уровни сывороточных ИФН-γ и ил-4 были измерены с помощью твердофазного иммуноферментного анализа. Наличие ТТ генотипа (р = 0.030) и аллель Т (или 1.8; 95% ди, 1.2—2.8; р = 0,010) встречались чаще в тяжелых случаях. Плазменные уровни ИФН-γ и ИФН-γ/ил-4 соотношение было значительно ниже ТТ (102.0 ± 24.2 ПГ/мл, р <0,01 и 14,2 ± 2.8, р <0,001) и ТТ генотипов (114.1 ± 26.2 ПГ/мл, р <0,05 и 18,0 ± 3.1, р <0,001) по сравнению с СС генотипом (135.5 ± 36.8 ПГ/мл и 24,9 ± 4.7), но плазменные уровни ил-4 с ТТ (7.3 ± 1.7 ПГ/мл, р <0,01) и ТТ генотипов (6.4 ± 1.3 ПГ/мл, р <0,05) были достоверно выше по сравнению с СС генотипом (5.5 ±1.3 ПГ/мл).
Эти данные свидетельствуют о том, что TLR3c.1377T аллель связан с восприимчивостью к тяжелым ЭВ71.
Хотя подавление экспрессии генов TLR-3 в основном сообщалось у пациентов, инфицированных вирусом гепатита С, влияние TLR-3 на генотип и на риск развития HCV-инфекции, связанных с циррозом печени и/или гепатоцеллюлярной карциномы (ГЦК) еще предстоит определить.
TLR-3 SNPs были проанализированы у когорты из 563 пациентов с гепатитом С, которая состояла из 437 больных хронической HCV-инфекцией, 88 с HCV-индуцированным циррозом печени, и 38 с ГЦК. Среди TLR-3, в rs78726532 SNPs были тесно связаны с HCV-инфекцией. rs5743314 SNPs также был сильно связан с прогрессированием заболеваний печени (цирроза и ГЦК).
В целом, эти результаты показывают, что различные генетические варианты TLR-3 SNPS связаны с HCV-инфекцией и гепатитом.
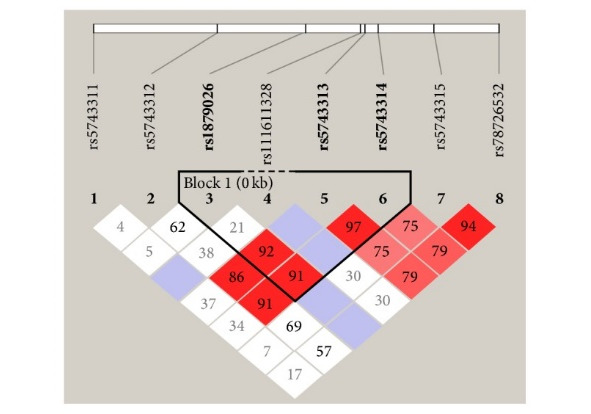
Цифры в квадратах показывают отличие среди SNps.
Воздействие TLR-3 на прогрессирование и последствия ОНМК пациентов не выяснено до сих пор. Мы стремились оценить уровень экспрессии TLR03 мРНК включая в исследование пациентов с различными формами протекания заболевания.
Восемьдесят шесть случаев ишемического инсульта в течение 14 дней разделены между собой на 2 группы: с благоприятным протеканием заболевания (N = 47) и неблагоприятным исходом (N = 39) в зависимости от значение по модифицированной шкале Ренкина баллы (≤2 балла за 90 дней после инсульта -хороший результат). Мы измерили уровень экспрессии мРНК в каскаде системы TLR-3 в мононуклеарных клетках периферической крови больных за 24 часа, 3 суток, 4 суток, 7 дней и 14 дней от начала заболевания соответсвенно. Результат и объем инсульа оценивали при поступлении и на 7—14 день соответственно.
Только экспрессия TLR-3 на мРНК дала хороший результат группе с благоприятным исходом, чем у пациентов с неблагоприятным протеканием заболевания при острой и подострой фазах. Кроме того, обе группы не имели существенных различий с точки зрения взаимодействия между мРНК и TLR-2. Экспрессия интерферона β в исследовании была значительно выше у группы с благоприятным протеканием заболевания, чем у когорты пациентов с неблагоприятным исходом болезни, и он имел положительную корреляцию с экспрессией TLR-3 и оказывал регуляторную функцию на фактор интерферона 3.
Взаимосвязь между TLR3 + интерферон β + мРНК повышены в периферической крови больных с ишемическим инсультом с благоприятным исходом, которое может повлечь их дальнейшей нейропротекции.
TLR-3 принимает участие в обострении бронхиальной астмы и может способствовать ее дальнейшему развитию. Однако, генетическая связь между TLR-3 и астмой остается пока неопределенной. Цель этого исследования-оценить влияние полиморфизма TLR-3 в пределах от риска астмы. В данное исследование были включены в общей сложности 462 неродственных взрослых пациента с астмой и 398 здоровых добровольцев.
Генотипыодиночных нуклеотидных полиморфизмов (Онп) TLR-3 определяли с помощью мультиплексного снимка генотипирования SNP анализа. Результаты показали, что генетические вариации SNP в TLR-3 были связаны с астмой + с измерением сывороточного уровня иммуноглобулина Е. Однако, не было никакой очевидной связи между TLR-3 SNP и установкой патогенеза, чувствительности или степени тяжести астмы.
TLR-3 полиморфизм может играть значительную роль в патогенезе астмы. Это поможет лучше понять патогенез бронхиальной астмы и повлияет на разработку более эффективных стратегий для профилактики, прогнозирования и лечения астмы.
Иммунопатогенез хронического гепатита В (ХГВ) еще не выяснен до конца. TLR-3 являются рецепторами, которые инициируют распознавательную функцию иммунитета с экзогенно-эндогенных лигандов и играет важную роль в патогенезе инфекции. В данном исследовании мы стремились исследовать частоту TLR-3 (rs3775290) полиморфизм и его роль у пациентов с ХГВ. Мы включили 50 здоровых лиц в качестве контрольной группы и 73 пациента с активной и 43 с неактивной формой гепатита B.
Все образц ДНК были выделены из проб крови. Для обнаружения TLR-3 (rs3775290) однонуклеотидного полиморфизма, нами был получен полиморфизм длин рестрикционных фрагментов. Самые высокие уровни HBV ДНК были обнаружены у лиц с ТТ генотипом. Кроме того, частота генотипа СС была выше у больных с активной фазой ХГВ по сравнению с неактивной ВГВ пациентов (p = 0.044). Статистически значимая разница экспрессии TLR-3 (rs3775290) однонуклеотидного полиморфизма была выявлена между здоровыми добровольцами и больными гепатитом в (п = 0.342).
В заключение, уровень ДНК HBV была выше у лиц с ТТ генотипом, и генотип СС встречался чаще у лиц с преобладанием активной фазы ХГВ. Эти результаты свидетельствуют о возможной ассоциации и взаимосвязи между патогенезом болезни и экспрессией TLR-3 (rs3775290) однонуклеотидного полиморфизма.
Новые доказательства от нынешней вспышки вируса Зика (ZIKV) указывает на прочную причинно-следственную связь между самим вирусом и возникновением микроцефалии. Чтобы выяснить, как ZIKV инфекция приводит к микроцефалии, мы использовали эмбриональные стволовые клетки церебральных органоидов на первом триместре развитие мозга плода. Здесь нам показывают, что штамм прототип ZIKV-MR766, эффективно заражает органоиды и вызывает уменьшение общего размера органа, который коррелирует с кинетикой нарастания количества вирусных копий.
TLR-3 был активируются и начинают распознавание патогенов после заражения органоидов и нейросферы мыши и происходит ингибирование TLR-3. Анализ путей генных изменений экспрессии при активации TLR-3 предполагает, что нарушения также связаны с развитием нейронов, и как следствие, приводит к нарушению нейрогенеза.
Таким образом, результаты нашего исследования позволили выявить связь между заражением вирусом ZIKV и е активации системы экспрессии TLR-3, а также уменьшение объема мозга.
Опухолей, как известно, могут принимать участие в инициации и прогрессировании развитии патогенеза самих опухолей. Однако, взаимосвязь между вирусом и аденогипофизом остается неизвестной. Здесь, мы исследовали изменение состояние протекания инфекций трех типов вирусов (ВПЧ 16, HHV6B и ВПГ1) и уровень экспрессии TLR-3. Мы также определили роль TLR-3 в распознавания патогенов.
Во-первых, мы обнаружили, что положительные темпы ВПЧ и HHV6B инфекции были значительно выше в инвазивных образцах, чем в образцах неинвазивной ткани (р <0,01). Аналогично, TLR-3 и взаимосвязь с мРНК и экспрессии белка также увеличивается в инвазивных образцах (р <0,01). Инвитро анализ показал, что клеточная пролиферация расширена и усилилась за счет активации каскада системы распознавания TLR-3, который сопровождался активацией NF-кв. Наши данные свидетельствуют о том, что ВПЧ и HHV6B вирусы могут быть вовлечены в регулирования процесса прогрессирования развития опухолей ассоциированных с вирусными инфекциями путем активации TLR-3 сигнального пути.
Ассоциация однонуклеотидного полиморфизма TLR-3 (rs3775291) с возрастной макулярной дегенерации (ВМД) интенсивно исследуются с переменными результатами. Мы провели мета-анализ для верификации влияния гена rs3775291 на ВМД. Мы искали ассоциации генетических исследований, опубликованных в PubMed, Embase и WebScience от начала 10 марта 2015 года. Были получены совершенно разные по структурной компоненте содержания 235 докладов и 9 исследований, которые в последующем были включены в мета-анализ, с участием 7400 случаев и 13579 контроля.
Коэффициенты соотношений (ОШ) с 95% доверительными интервалами для аллелей и генотипов соответственно оценивались. Анализ расслоения по этническому признаку указал, что ген rs3775291 был связан со всеми формами ВМД только у европеоидной расы (ОШ = 0.87, 0.78 0.77 и, соответственно, Генотип ТТ), но не в Восточной Азии. Однако ассоциации не могли выдержать поправки Бонферрони.
Этот Мета-анализ показал, что данные для ассоциации однонуклеотидного полиморфизма TLR-3 (rs3775291) в качестве маркера для АМД у европеоидной расы, но не у азиатов.
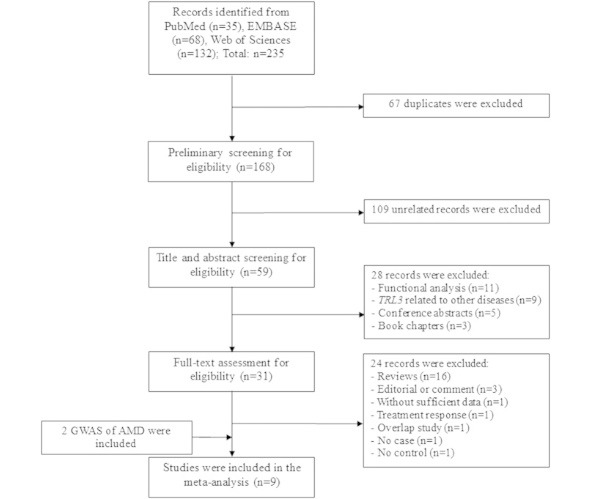
Схема для включения исследований по изучению ассоциации между ассоциацией однонуклеотидного полиморфизма TLR-3 и гена rs3775291.
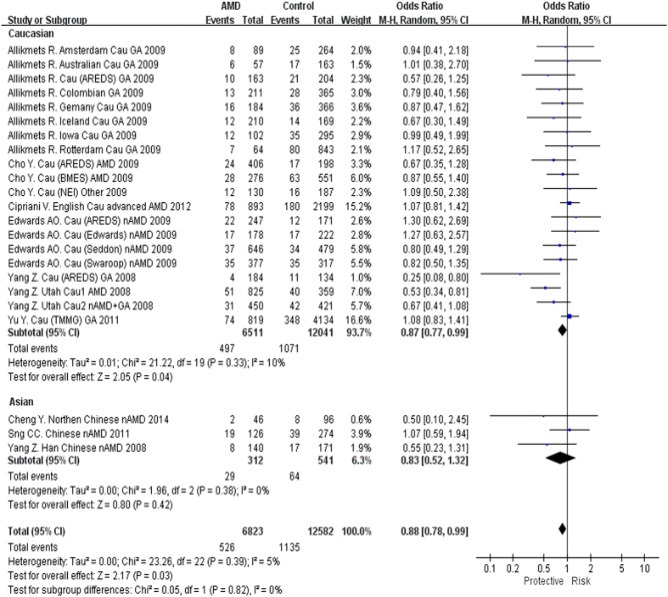
Участок TLR-3 и гена rs3775291 (Т) во всех формах ВМД в рецессивной модели.
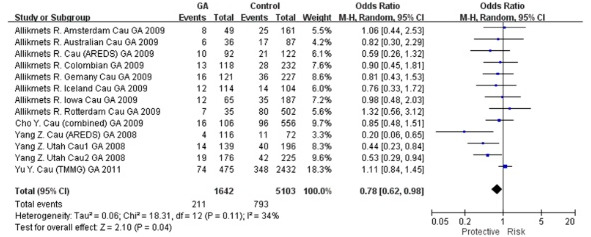
Участок TLR-3 и гена rs3775291 в гомозиготной модели.
Вирусные инфекции, такие как респираторно-синцитиальный вирус и риновирус, негативно влияют на неонатальный период развития малыша, что приводит к значительному увеличению заболеваемости легких, в том числе и обострение астмы. Исследования у взрослых показали, что клетки гладкой мышечной мускулатуры модулируют воспаление дыхательных путей через их способность к секреции провоспалительных цитокинов и хемокинов.
В нашем исследовании мы использовали человеческие эмбриональные клетки в пробирке для моделирования эффекта секреции провоспалительных хемокинов и последующее влияние на них агонистов TLR-3. Мы обнаружили, что у плода усиленно функционирует каскад системы распознавания TLR-3, которые участвуют в патогенезе респираторно-синцитиального вируса и риновирусной инфекции. Клетки обрабатывались полиаминокарбоновыми кислотами и липополисахаридами. Изучение сигнальных путейраспознавания патогенов дали следующие результаты: полиаминокарбоновая кислота усиливает функцию идентификации патогенов. Фармакологическое ингибирование тоже определяет структурирование сигнальных путей.
В целом, наши данные показывают, что полиаминокарбоновая кислота инициирует активацию провоспалительных путей в развитии РСР, которые могут привести к реакции иммунного ответа на респираторные инфекции и обострении бронхиальной астмы.
Накапливающиеся данные свидетельствуют о том, что системный воспалительный ответ связанный с чрезмерной активацией иммунной системы играет важную роль в развитии преэклампсии (ПЭ). В этом исследовании, мы му устанавливали ассоциацию однонуклеотидного полиморфизма TLR-3.
Мы отобрали 98 пациентов с ПЭ и 1227 здоровых беременных женщин. Два полиморфизма генов (rs3775291 и rs3775296) TLR-3 были генотипированы по аллельной дискриминации ПЦР TaqMan в реальном времени. Ассоциация между генотипом и аллельной частотой с ПЭ проводили при помощью критерия хи-квадрат. Клинические данные были сопоставлены и контроль проводился с использованием критерия T Стьюдента.
Никаких существенных различий в генетическом распределение генов rs3775291 и rs3775296 не наблюдалось. Не было также никаких существенных различий между генотипом и частотами аллелей либо между здоровыми беременными женщинами и больных с поздним или ранним началом ПЭ, или с легкой или тяжелой ПЭ.
Хотя это первое исследование ассоциации между однонуклеотидного полиморфизма TLR-3 и преэклампсии, мы обнаружили, что TLR-3 полиморфизм вряд ли будут играть значительную роль в развитии гестоза.
Инфекционные агенты являются экологическими триггерами для возникновения и развития аутоиммунного. Полиморфные варианты генов, вовлеченных в иммунныйответ могут повлиять на иммунные реакции и, следовательно, способствовать торможение и угнетению аутоагрессивных патологий. TLR-3 участвует в распознавании чужеродных молекул и агентов, и способствует созданию первой линии защиты против вирусных инфекций, являясь перспективным функциональным регулятором атак при аутоиммунных условиях.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.