
Бесплатный фрагмент - Местные анестетики
Введение
Внимание! В книге описаны лекарственные препараты, которые назначаются врачом.
Имеются противопоказания. Необходима консультация специалиста!
Местноанестезирующими средствами или местными анестетиками (МА) называются вещества, которые при взаимодействии с нервными волокнами или окончаниями афферентных нервных волокон способны обратимо угнетать образование и проведение нервного импульса по нервным волокнам. Также они тормозят развитие потенциала действия в других наружных клеточных мембранах, где для развития потенциала действия необходим вход ионов натрия в клетку. Действие средств для местной анестезии в большей степени проявляется в области окончаний чувствительных нервных волокон (особенно воспринимающих чувство боли). Кроме этого препараты блокируют проведение импульса по двигательным и вегетативным нервным волокнам. Эффект МА зависит от свойств и концентрации препарата, а также толщины миелиновой оболочки нервов и положения нерва в нервном стволе. Местные анестетики нарушают развитие потенциала действия в миоцитах скелетных мышц, вызывая временный паралич, кардиомиоцитах и синусовом узле (водитель ритма). Наиболее часто препараты применяются для блокады болевых импульсов из определенных областей организма при проведении операций, болезненных диагностических манипуляций, а также для купирования болевых синдромов и лечения аритмий.
В 1860 году Ниманн, а 1879 году Василий Константинович Анреп обнаружили анестезирующие свойства кокаина. В 1884 году Коллер применил кокаин для анестезии в офтальмологической практике. Несмотря на большое количество нежелательных побочных эффектов, препарат широко применялся в течение многих лет. В дальнейшем было синтезировано большое количество соединений, обладающих местноанестезирующей активностью. Однако большинство из них не удовлетворяло требованиям, предъявляемым к этим лекарственным средствам (ЛС). В 1880 году было выявлено, что этиловый эфир парааминобензойной кислоты обладает местноанестезирующей активностью. Это соединение с конца 90-х годов XIX века до настоящего времени используется в качестве ЛС для местной анестезии и называется бензокаин (анестезин). Препарат применяется как самостоятельно, так и в сочетании с другими лекарственными средствами. Большим недостатком бензокаина является его нерастворимость в воде. В 1905 году Эйнхорном был получен прокаин гидрохлорид (новокаин), ставший основоположником данной группы ЛС. В 1943 году Лефгрен синтезировал лидокаин, который и до сих пор широко применяется в клинической практике.
Основные требования, предъявляемые к местным анестетикам, можно свести к следующим положениям:
• препараты должны обладать высокой избирательностью действия;
• оказывать минимальный резорбтивный эффект, то есть не вызывать развития нежелательных побочных эффектов;
• препараты не должны оказывать раздражающего действия;
• анестезия должна развиваться быстро, быть достаточной глубины и продолжительности;
• лекарственные средства должны хорошо растворяться в воде и не разрушаться при стерилизации и хранении.
Создано большое количество средств для местного обезболивания, но и сегодня продолжаются исследования, направленные на создание новых препаратов. Целью поиска является синтез соединений:
• с низким местнораздражающим действием,
• с низкой общей токсичностью,
• с быстрым началом эффекта,
• с продолжительным действием.
Список сокращений

Глава 1. Химическое строение местноанестезирующих средств
Изучение местноанестезирующих свойств и химического строения соединений позволяет выявить определенные закономерности их химической структуры. В общем виде формулу МА можно представить:
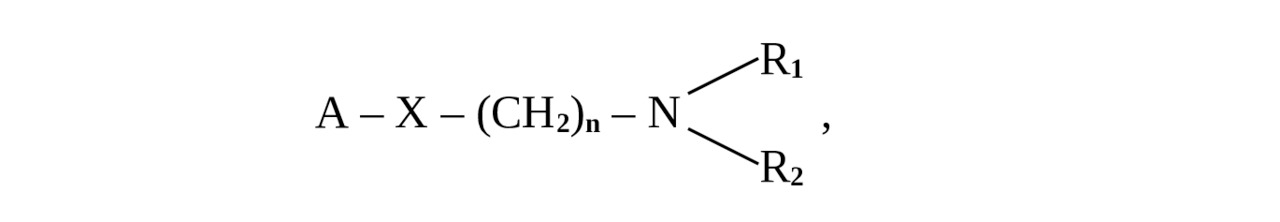
где А — ароматический радикал, R1 и R2 — алкильные группы,
Х — эфирная или амидная группы

То есть молекула местноанестезирующего средства состоит из трех частей:
• ароматическая часть,
• промежуточная цепь, в состав которой входит эфирная или амидная группа,
• амидная группа.
В молекуле местноанестезирующего средства алкильные радикалы, присоединенные к атому азота (аминогруппа, как правило, третичная), и ароматическое кольцо могут быть различными. Ионизирующаяся аминогруппа (как правило, третичная) определяет специфичность действия веществ, ароматическое кольцо — степень липофильности соединения. Большое значение для проявления специфического действия, а также развития нежелательных побочных эффектов имеет стереохимическая конфигурация соединений. К изменению (усилению) анестезирующей активности веществ приводит модификация молекулы соединения:
• удлинение промежуточной цепи;
• присоединение дополнительной группы к амидной группе или ароматическому кольцу.
Например:

В зависимости от присутствия в молекуле МА эфирной или амидной группы их делят на две группы:
• группа сложных эфиров,
• группа сложных амидов.
Между соединениями, содержащими эфирную и амидную группы, основными различиями являются:
• пути метаболизма,
• аллергенность препаратов с эфирной группой выше, чем с амидной.
В настоящее время синтезированы МА химической структуры, которые не описываются представленной выше формулой:
• морфолины (эфиры) — прамокаин,
• пропиофеноны (кетоны) — диклонин,
• производные фенетидина — фенакаин.
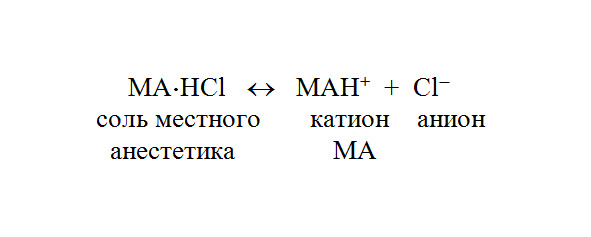
Лекарственные средства для местной анестезии являются слабыми основаниями практически нерастворимыми в воде. Для того чтобы повысить растворимость и стабильность водных растворов при хранении, МА производят в виде солей (чаще хлористоводородных). В водном растворе соль МА диссоциирует на катионы и анионы:
При кислотности (рН) сред организма соединения находятся частично в виде катиона и в неионизированной форме:
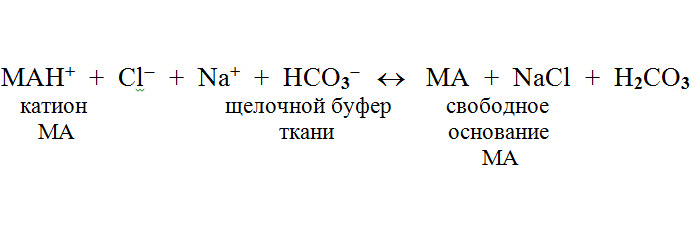
Соотношение ионизированной и неионизированной форм зависит от рН среды и константы диссоциации конкретного вещества (рКa) и описывается уравнением Гендерсона-Хассельбаха:
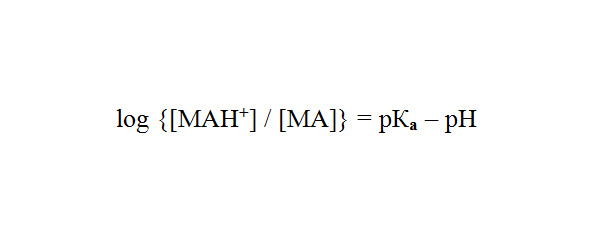
Константа диссоциации большинства МА колеблется от 8,0 до 9,0, поэтому большая часть молекул соединений в жидких средах организма находится в ионизированном (катионном) виде.
Следует отметить, что только свободное основание соединения (неионизированная форма) может проникать через клеточные мембраны, благодаря его липофильным свойствам.
Глава 2. Классификация местноанестезирующих средств
Местноанестезирующие средства можно классифицировать по следующим признакам:
• химическая структура,
• выраженность эффекта и длительность действия,
• растворимость в воде,
• с точки зрения практического применения.
Классификация местных анестетиков по химической структуре.
1. Группа сложных эфиров — бензокаин (анестезин), прокаина гидрохлорид (новокаин), хлоропрокаин (незакаин), тетракаина гидрохлорид (дикаин), бензофурокаин.
2. Группа сложных амидов — лидокаин, бупивакаин, артикаин, мепивакаин, тримекаин, бумекаин гидрохлорид, прилокаин, этидокаин (дуранест), ропивакаин (наропин).
3. Различной химической структуры — прамокаин, диклонин, фенакаин.
Классификация в зависимости от выраженности эффекта и длительности действия при парентеральном введении.
1. Низкая выраженность эффекта и длительность действия — прокаин гидрохлорид, хлоропрокаин.
2. Средняя выраженность эффекта и длительность действия — лидокаин, тримекаин, мепивакаин, прилокаин.
3. Высокая эффективность и длительность действия — тетракаина гидрохлорид, бупивакаин, артикаин, этидокаин, ропивакаин.
В таблице 1 представлена сравнительная характеристика основных местноанестезирующих средств.
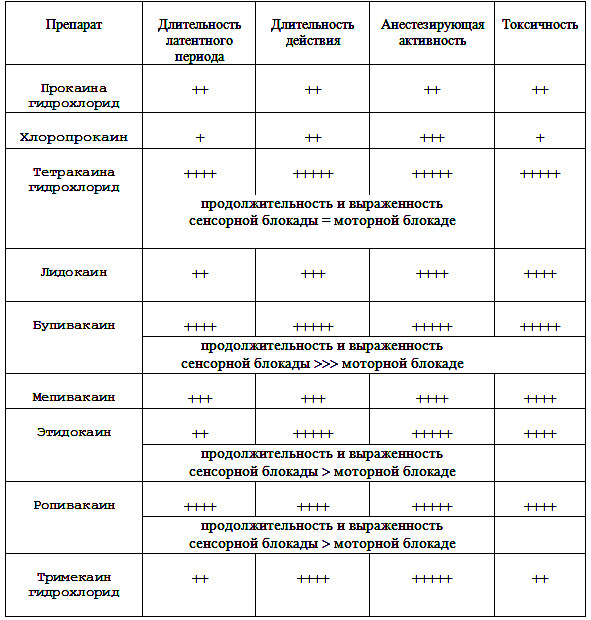
(Примечание:
• латентный период: очень короткий — +, короткий — ++, средний — +++, длинный — ++++;
• длительность действия: кратковременное — ++, среднее — +++, длительное — ++++, очень длительное — +++++;
• активность: низкая — ++, невысокая — +++, умеренная — ++++, высокая — +++++;
• токсичность: очень низкая — +, низкая — ++, умеренная — ++++, высокая — +++++.
Бупивакаин — по выраженности и длительности эффекта превосходит лидокаин в 2–4 раза.)
Классификация в зависимости от растворимости в воде солей местноанестезирующих средств.
1. Плохо растворимые в воде — бензокаин.
2. Хорошо растворимые в воде — прокаин гидрохлорид, тетракаина гидрохлорид, лидокаин, бупивакаин, артикаин и другие.
Классификация местноанестезирующих средств, с точки зрения практического применения.
1. Средства, используемые для проведения терминальной анестезии — бензокаин, тетракаина гидрохлорид, бумекаин гидрохлорид, лидокаин.
2. Средства, используемые для проведения инфильтрационной анестезии — прокаин гидрохлорид, лидокаин, бупивакаин, артикаин, мепивакаин, хлоропрокаин, тримекаин, бензофурокаин.
3. Средства, используемые для проведения проводниковой анестезии — прокаин гидрохлорид, лидокаин, тримекаин, бупивакаин, артикаин, этидокаин.
4. Средства, используемые для проведения спинальной анестезии — тетракаина гидрохлорид, лидокаин, бупивакаин, тримекаин, артикаин.
5. Средства, используемые для проведения эпидуральной анестезии — лидокаин, бупивакаин, тримекаин, артикаин, хлоропрокаин, этидокаин.
6. Средство, используемое для проведения всех видов анестезии — лидокаин.
7. Средства, используемые в качестве антиаритмических — лидокаин, бумекаин гидрохлорид, тримекаин.
8. Средство, используемое в качестве обезболивающих (центральное действие) — бензофурокаин.
Местноанестезирующим эффектом также обладают лекарственные средства, которые относятся к другим фармакологическим группам:
• пропранолол (неселективный β-адреноблокатор),
• хлорпромазин (нейролептик),
• дифенгидрамин (Н1-блокатор) и т. д.
Глава 3. Фармакокинетика местноанестезирующих средств
Абсорбция (всасывание) местноанестезирующих средств из места введения зависит от многих факторов, среди которых основными являются:
• способ введения ЛС;
• место введения препарата;
• доза МА;
• физико-химические свойства препарата, в том числе способность связывания МА с белками тканей в месте введения;
• способность препарата оказывать сосудорасширяющее действие.
Как при аппликационном, так и инъекционном способах введения местных анестетиков большое влияние на всасывание соединений оказывает степень васкуляризации тканей. Например, при аппликации местного анестетика на слизистую трахеи (хорошая васкуляризация) происходит его быстрая абсорбция и значительное количество ЛС попадает в системный кровоток. При введении МА в сухожилие, где кровоснабжение сравнительно низкое, всасывание препарата осуществляется медленно. При регионарной анестезии возможная максимальная концентрация МА в плазме крови снижается в следующей последовательности, в зависимости от интенсивности кровообращения в окружающих тканях при проведении:
межреберной анестезии> корешковой анестезии>
> анестезии плечевого сплетения>
> анестезии седалищного нерва
Место введения препарата во многом определяет возможность использования определенных (высоких) доз ЛС. Например, при введении лидокаина в дозе 400 мг (без эпинефрина) для проведения блокады межреберных нервов его содержание в крови достигает 7 мкг/мл, тогда как при применении ЛС для блокады плечевого сплетения — 3,5 мкг/мл. В первом случае вероятность развития нежелательных побочных эффектов значительно выше, чем во втором.
Для большинства МА выявлена прямая зависимость между общей дозой и величиной максимальной концентрации в плазме крови независимо от пути введения. Например, при введении лидокаина эпидурально в поясничную область в дозах 200 и 600 мг содержание препарата в плазме крови составляет 1,5 и 4 мкг/мл, соответственно.
Степень связывания с белками тканей является особенностью каждого конкретного препарата. Чем выше аффинность препарата к белкам тканей, тем процесс всасывания более медленный, так как препарат только в свободной форме может диффундировать в кровяное русло. Большинство МА быстро связываются с белками тканей (особенно, нервной) в месте введения, но это взаимодействие не стойкое. Прокаин гидрохлорид практически не связывается с белками плазмы крови. Большинство местных анестетиков, производных сложных амидов, связывается с кислым α1-гликопротеидом плазмы крови.
Липофильность соединения — одно из главных физико-химических свойств, влияющих на скорость абсорбции ЛС из места введения. Вещества с высокой липофильностью быстрее проникают сквозь гистобарьеры по сравнению с менее липидорастворимыми.
Большинство местных анестетиков вызывает расширение сосудов, что способствует их всасыванию, попаданию в системный кровоток и, соответственно, развитию резорбтивных эффектов. Для предотвращения вазодилатации в месте введения МА одновременно вводят лекарственные средства, вызывающие сужение сосудов. Наиболее часто для этих целей используют эпинефрин (адреналин) и фенилэфрин (мезатон). В результате снижения интенсивности местного кровотока:
• уменьшается абсорбция МА;
• повышается концентрация препарата в месте введения и, как следствие, большее количество молекул соединения вступает в контакт с рецептором;
• возможность использовать более высокие дозы МА;
• увеличивается длительность местноанестезирующего действия для МА короткого действия и средней продолжительности примерно на 50%;
• понижается концентрации анестетика в периферической крови (примерно в три раза);
• снижается количество нежелательных побочных и токсических эффектов.
Влияние сосудосуживающих препаратов на перечисленные эффекты выражены в большей степени при применении МА короткого действия (прокаина гидрохлорид) и средней продолжительности (лидокаин, мепивакаин), обладающих относительно меньшей липофильностью по сравнению с ЛС длительного действия (бупивакаин). При совместном применении МА длительного действия и вазоконстрикторов продолжительность анестезии практически не изменяется. Это, вероятно, связано с их высокой аффиностью к белкам тканей, при которой скорость кровотока практически не влияет на процесс абсорбции этих соединений.
Распределение. Распределение препаратов, относящихся к группе сложных эфиров, по органам и тканям мало изучено, так как их период полувыведения из плазмы крови составляет несколько минут.
Процесс распределения местных анестетиков — производных сложных амидов, можно разделить на две фазы:
• первая — начальная (быстрая) фаза,
• вторая — медленная фаза.
Во время начальной фазы распределения препараты накапливаются в обильно перфузируемых органах (мозг, печень, почки, сердце). Затем наступает медленная фаза перераспределения МА, которую в свою очередь можно разделить на две подфазы:
• поступление препаратов в ткани с низкой скоростью кровообращения — скелетные мышцы, жировую ткань и т.д.,
• процессы метаболизма и экскреции, которые начинают вносить определенный вклад в снижение концентрации препаратов в плазме крови.
Отмечено, что длительность медленной фазы у лидокаина и мепивакаина практически одинакова, а у прилокаина она значительно короче, что объясняется его быстрым метаболизмом. Период полувыведения этидокаина во время медленной фазы значительно меньше, чем бупивакаина, что определяется более медленной биотрансформацией последнего.
Самое большое количество МА в течение длительного срока сохраняется в скелетных мышцах, что связано с их относительно большой массой и низкой скоростью кровообращения. Отмечается, что в жировой ткани возможна кумуляция местных анестетиков.
Большое значение имеет способность МА проникать через плаценту. Считается, что основным механизмом прохождения МА через плацентарный барьер является пассивная диффузия. Скорость и степень диффузии значительно отличаются у различных препаратов. Показано, что чем выше степень связывание МА с белками плазмы крови, тем ниже их содержание в пупочной вене плода. Например, бупивакаин и этидокаин имеют высокую степень связывания с белками плазмы крови (95% и 94%, соответственно) и соотношение количества ЛС в пупочной крови к содержанию в крови матери низкое (в среднем 0,36 и 0,25, соответственно).
Метаболизм. Производные сложных эфиров в основном гидролизуются в плазме крови при участии бутирилхолинэстеразы, и в меньшей степени — тканевыми эстеразами, в том числе печеночными. Скорость гидролиза различных препаратов неодинакова и составляет:
• 4,7 мкмоль/мл, час. — у хлорпрокаина,
• 1,1 мкмоль/мл, час. — у прокаина гидрохлорида,
• 0,3 мкмоль/мл, час. — у тетракаина гидрохлорида.
Поэтому период их полувыведения из плазмы крови равен нескольким минутам. Например, этот показатель для прокаина гидрохлорида и хлорпрокаина составляет менее одной минуты.
Биотрансформация производных сложных амидов осуществляется микросомальными ферментами (система цитохрома Р-450) печени, а также других органов, например, почек. Основными реакциями, при участии которых происходит метаболизм МА, являются деалкилирование и гидролиз амидной связи. Скорость гидролиза амидной связи у препаратов различна и увеличивается в следующей последовательности:
прилокаин> этидокаин> лидокаин> мепивакаин> бупивакаин
Скорость метаболизма является одним из важных факторов, определяющих длительность действия МА. Например, метаболизм лидокаина происходит достаточно быстро и длительность нарушения проведения нервного импульса составляет 60—120 минут. Самым медленно метаболизирующимся препаратом, из рассматриваемых нами, является бупивакаин, продолжительность блокады проведения импульса которого составляет 180—360 минут.
Период полувыведения лидокаина на фоне применения галотана (средство для наркоза) значительно увеличивается за счет:
• ингибирования системы цитохрома Р-450 печени последним,
• снижения печеночного кровотока.
Отмечается, что токсические эффекты при применении производных амидов развиваются чаще, чем при использовании производных сложных эфиров. Особенно это может быть выражено у пациентов с поражением печени. При введении лидокаина пациентам с тяжелыми поражениями печени период полувыведения препарата увеличивается более чем в три раза (в норме — 1,8 часа, при патологии — до 6 часов).
Выведение. Основное количество МА группы сложных амидов подвергается биотрансформации, а затем их метаболиты выводятся почками. Лишь незначительное количество (около 5%) ЛС эксретируется в неизмененном виде. Между почечным клиренсом препарата и его способностью связываться с белками, а также рН мочи отмечается обратно пропорциальная зависимость. Прилокаин взаимодействует с белками плазмы в меньшей степени, чем лидокаин и, соответственно, выводится почками быстрее. Снижение экскреции ЛС при уменьшении значения рН мочи свидетельствует, что в данном процессе ведущую роль играет процесс диффузии неионизированных форм МА. Лидокаин и тетракаина гидрохлорид, а также их метаболиты способны накапливаться в желчи и выводится в кишечник. Из кишечника соединения могут вновь всасываться, то есть происходит гепатоэнтеральная циркуляция ЛС.
Глава 4. Общие сведения о развитии потенциала действия в клетках
В соответствии с мембранной теорией, возбуждение (повышение функциональной активности) в клетке развивается, как правило, в ответ на стимуляцию рецептора биологически активным соединением (нейромедиатора, гормона, лекарственного средства и т.д.), что наиболее часто связано с изменением проницаемости ионных каналов. Рассмотрим этот процесс на примере изменений, происходящих на постсинаптической мембране синапса. В состоянии покоя наружная поверхность постсинаптической мембраны заряжена положительно, в то время как внутренняя поверхность имеет отрицательный заряд. Разность потенциалов между наружной и внутренней поверхностью постсинаптической мембраны составляет от –90 до –60 мВ (потенциал покоя). Наличие потенциала покоя связано с различной концентрацией ионов натрия (Nа+) и калия (К+) внутри и вне клеток. Внутри клетки концентрация ионов калия примерно в 30 раз выше, чем в экстрацеллюлярной жидкости. Содержание ионов натрия и хлора в цитоплазме в 8–10 и 15–20 раз, соответственно, ниже, чем в окружающей клетку среде. Таким образом, в состоянии покоя существует ионная асимметрия. Она определяется избытком ионов калия и органических анионов на внутренней поверхности мембраны, а на внешней поверхности — преобладанием ионов натрия и хлора. Причинами ионной асимметрии являются:
• различная скорость пассивной диффузии ионов через каналы мембраны — в состоянии покоя ее проницаемость для ионов натрия приблизительно в 50 раз ниже, чем для ионов калия;
• наличие специальных механизмов трансмембранного переноса ионов на наружных мембранах клеток, которые обеспечивают активный перенос ионов против градиента концентрации: ионы калия входят в клетку, а ионы натрия выходят из нее.
При взаимодействии биологически активного вещества (БАВ) с рецептором резко изменяются свойства мембраны. Натриевые каналы открываются и ионы натрия поступают в клетку. Скорость поступления ионов натрия превышает данный показатель для ионов калия примерно в 20 раз. Отрицательный заряд внутренней поверхности мембраны не только полностью компенсируется притоком ионов натрия, но она даже приобретает положительный заряд (+30 мВ). Этот скачок потенциала от –80 мВ до +30 мВ называется фазой деполяризации.
Важно отметить, что конформационные изменения ионных (Nа+ и К+) каналов регулируются ионами кальция (Са2+). Ионы кальция взаимодействуют со специфическими структурными единицами клеточной мембраны (рецепторами). В результате повышается ее проницаемость для ионов.
Процесс поступления ионов натрия в клетку заканчивается (каналы закрываются) после прекращения взаимодействия БАВ с рецептором (натриевые каналы инактивируются). Проницаемость мембраны для ионов возвращается в исходное состояние, а именно — вновь становится низкой для ионов натрия и высокой для ионов калия (калиевые каналы открываются). Механизмы активного транспорта ионов (натриевый насос) начинают осуществлять выброс ионов натрия из клетки и вход ионов калия в клетку. В результате восстанавливается ионная асимметрия мембраны. Эта фаза называется реполяризацией.
Развитие потенциала действия в клетках сопровождается изменением их функциональной активности, в частности осуществляется проведение нервного импульса по нервному волокну, высвобождение нейромедиаторов из окончаний нервных волокон и т. д.
Глава 5. Механизм действия местных анестетиков
Механизм действия МА связывают с нарушением электрохимических процессов в окончаниях нервов или нервном волокне. При этом транспорт ионов через мембрану и проведение нервных импульсов изменяется.
Виды нарушения функциональной активности натриевых каналов:
• предотвращение инактивации Nа+-каналов — биологические токсины (типа бутрахотоксина, аконита, вератридина, яда скорпионов) — взаимодействуют с рецепторами, расположенными в ионных каналах и пролонгируют ток ионов натрия; считается, что эти соединения повышают активность Nа+-каналов;
• блокада Nа+-каналов — биологические токсины (токсины морских животных, тетродоксин, сакситоксин) — связываются с рецепторами ближе к наружной поверхности мембраны и нарушают вход ионов натрия в клетки.
Средства для местной анестезии действуют в области натриевых каналов в различных клетках организма. Эффект МА наиболее выражен в области нервных окончаний, нервных волокон и кардиомиоцитов.
Местноанестезирующие средства нарушают развитие фазы деполяризации мембраны клеток в результате взаимодействия со специфическими рецепторами в потенциал-чувствительных натриевых каналах, расположенных на внутренней стороне мембраны. В результате развивается время- и потенциал-зависимая блокада канала. Это приводит:
• к блокаде стимулирующего влияния ионов натрия на проводимость;
• к снижению скорости и степени деполяризации мембраны;
• к нарушению образования и распространения потенциала действия;
• к уменьшению возбудимости окончаний нервных волокон;
• к стабилизации потенциала действия мембраны;
• к блокаде проводимости в периферических нервах;
• к снижению ответа центральной нервной системы на стимуляцию нерва.
Эти рецепторы в норме взаимодействуют с ионами кальция.
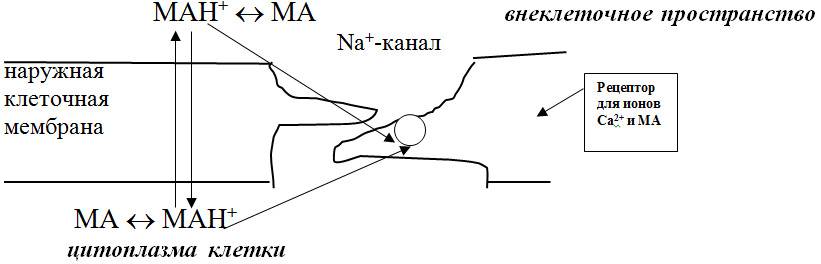
Выявлено, что МА способны взаимодействовать с рецептором как в виде неионизированной [МА], так и ионизированной [МАН+] формы. Как показано на рисунке 1, место связывания для неионизированных молекул на специфическом рецепторе расположено ближе к наружной поверхности мембраны, а для ионизированных форм — к внутренней. Чтобы осуществилось присоединение местного анестетика к месту связывания, расположенном ближе к внутреннему краю мембраны, молекула ЛС должна проникнуть внутрь клетки. Соединение поступает в клетку только в том случае, если оно находится во внеклеточной среде в неионизированном виде. В цитоплазме клеток происходит диссоциация молекулы МА с образованием катиона, который и взаимодействует с рецептором. При присоединении МА к рецептору происходят структурные изменения липопротеинов мембраны, что вызывает уменьшение диаметра и снижение проницаемости натриевого канала. Считается, что большее значение в реализации анестезирующего эффекта имеет взаимодействие с рецепторами именно ионизированной формы МА.
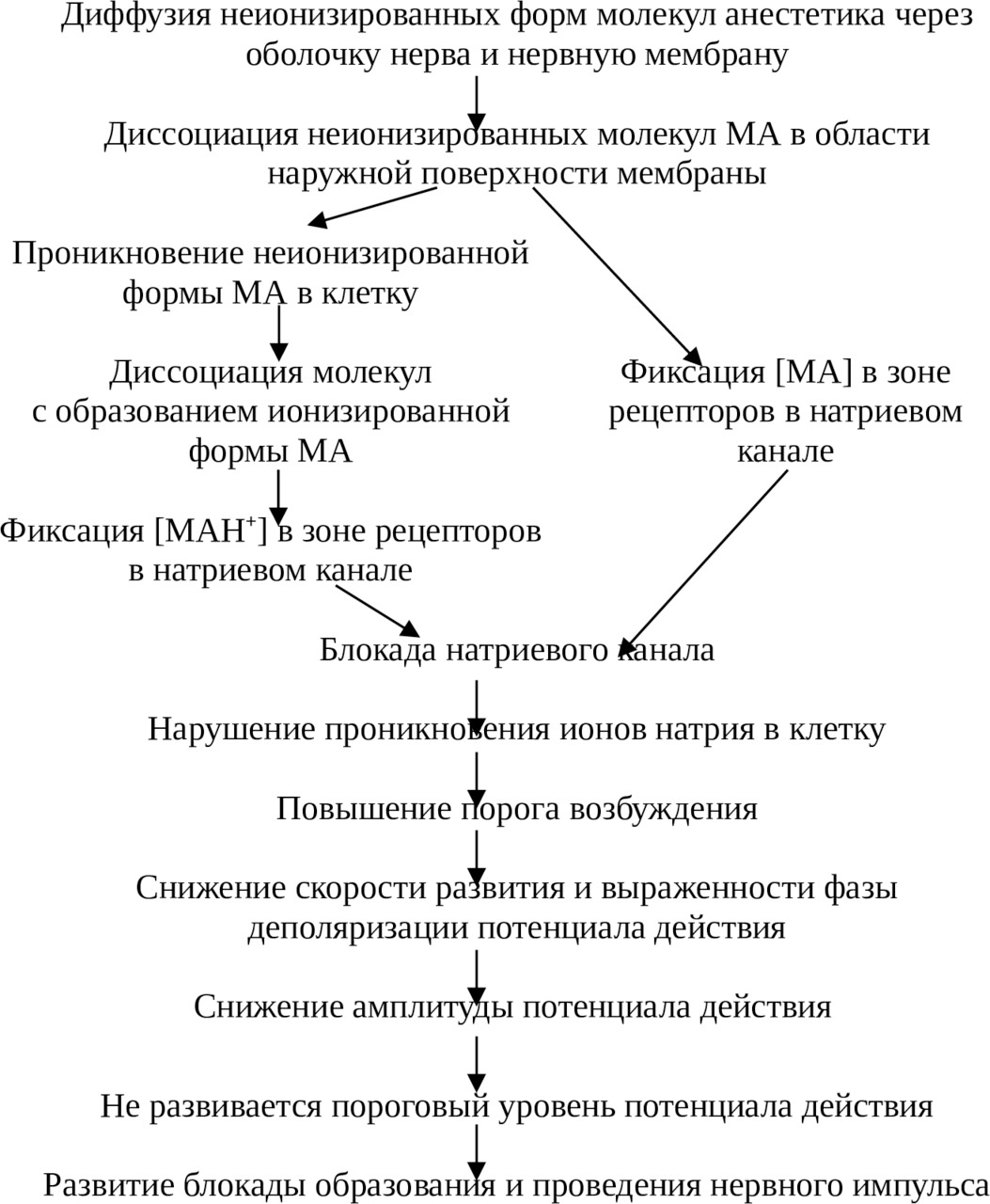
Последовательность процессов, приводящих к блокаде проведения импульса по нервному волокну под влиянием местноанестезирующего средства, представлена на схеме 1. Такая последовательность развития событий связана с увеличением количества рецепторов, заблокированных МА, то есть чем выше концентрация препарата, тем выраженность анестезирующего эффекта больше.
Таким образом, взаимодействие МА с рецепторами приводит к изменению конформации ионного канала и нарушению его функциональной активности. Это приводит к блокаде транспорта ионов натрия и калия через мембрану клеток. В результате снижается скорость развития и величина потенциала действия.
При использовании метода молекулярного моделирования показано, что участок молекулы, с которым происходит нековалентное взаимодействие МА с рецептором, состоит из остатков аминокислот тирозина, фенилаланина, серина, валина и трех остатков изолейцина. Таким образом, данный участок представлен остатками гидрофобных аминокислот.
Существует мнение, что кроме описанного механизма действия, под влиянием местных анестетиков нарушается проницаемость клеточной мембраны для ионов кальция и калия. Уменьшение проницаемости мембраны для этих ионов объясняется изменением поверхностного натяжения фосфолипидов (липидной фазы), образующих ее наружный поверхностный слой.
Показано, что тетракаина гидрохлорид снижает концентрацию ионов кальция внутри клетки, тормозя их высвобождение из саркоплазматического ретикулума клеток скелетных мышц крыс. Это связано с нарушением открытия кальциевых каналов, регулируемых рианодониновыми рецепторами, в присутствии тетракаина гидрохлорида.
Механизм взаимодействия местных анестетиков с N-холинорецепторами.
N-холинорецепторы относятся к рецепторам третьего типа, при стимуляции которых происходит изменение проницаемости ионных каналов, в том числе, натриевых. Показано, что на трансмембранном домене М2 расположены места связывания (сайты) для неконкурентных ингибиторов рецепторов, обращенные в просвет ионного канала. В состав этих сайтов входит остаток серина. Местные анестетики являются представителями неконкурентных блокаторов N-холинорецепторов и, присоединяясь к остатку серина, блокируют вход ионов натрия в клетку, на которой расположены N-холинорецепторы.
Механизм антиаритмического действия.
В механизме антиаритмического действия местноанестезирующих средств основное значение имеет нарушение поступления ионов натрия в кардиомиоциты. Однако определенный вклад в развитие данного эффекта вносит изменение проницаемости наружной мембраны кардиомиоцитов для ионов кальция и калия, причем уменьшение поступления ионов калия связывают со снижением открытия несопряженных К+-каналов.
В ранних исследованиях с помощью конформационного анализа показано, что гидрофобная часть молекулы лидокаина и его производных взаимодействует с участком натриевого канала с образованием электростатических связей. В исследованиях Sunami A. с соавторами (1997) выявлено, что гидрофильный участок молекулы МА присоединяется к S6 сегменту IV домена избирательного фильтра Na+-канала. Однако нельзя полностью отвергать результаты более ранних исследований, так как возможно, что молекула препарата связывается с определенными компонентами ионного канала при участии как гидрофильного, так и гидрофобного участка.
Отмечается, что нарушение проницаемости клеточной мембраны для ионов натрия и, соответственно, анти-аритмический эффект МА могут быть связаны с блокадой Nа+–К+-зависимой АТФазы. Данный фермент осуществляет энергозависимый транспорт ионов натрия, эндогенным ингибитором которого является оубаин, а известными экзогенными блокаторами — сердечные гликозиды (дигоксин). Наиболее вероятным местом взаимодействия препаратов с ферментом является центр связывания, к которому присоединяется оубаин. Однако возможно присоединение МА и к другим структурам Nа+–К+-зависимой АТФ-азы.
Механизм центрального анальгетического и противосудорожного действия.
При изучении механизмов центрального противосудорожного и анальгетического действия МА отмечается, что данные эффекты связаны с нарушением проницаемости мембраны для ионов натрия, но опосредуются через изменение функциональной активности различных рецепторов.
Изучение влияния лидокаина на изменение проницаемости мембран для различных ионов проводилось с использованием изолированных нервных окончаний (синаптосом) коры головного мозга крыс. Показано, что препарат ингибирует вератидин- и калийстимулированный вход ионов кальция в клетку, а также нарушает проницаемость мембраны для ионов натрия. По мнению авторов (Ferrendelli J. A., Daniels-McQueen S.) этот эффект лежит в основе противосудорожного и анальгетического действия лидокаина.
Известно, что ГАМК-ергическая система в головном мозге является ведущей в развитии тормозного эффекта, тогда как различные аминокислоты-нейромедиаторы (глутаминовая кислота, аспарагиновая кислота) обладают стимулирующим влиянием на ЦНС. Отмечается, что лидокаин в определенном диапазоне доз (низкие) способен повышать функциональную активность ГАМК-ергической системы или снижать передачу импульса в синапсах, в которых медиатором является глутаминовая кислота. То есть увеличение активности угнетающего компонента приводит к повышению судорожного порога и является одним из компонентов механизма противосудорожного действия препарата.
Развитие потенциала действия в вентральных корешках спинного мозга в ответ на стимуляцию дорсальных корешков происходит при участии различных систем. Выделяют 3 фазы развития потенциала действия в вентральных корешках спинного мозга:
— ранняя фаза длительностью 10 миллисекунд опосредует передачу импульса с Аβ-волокон (моно- и полисинаптический ответ);
— медленная фаза (1,5 сек.) связана с передачей импульса от афферентных нервных волокон при участии рецепторов N-метил-D-аспарагиновой кислоты (NMDA);
— отсроченная фаза обусловлена передачей импульса при участии нейрокининовых (NK) рецепторов.
При применении лидокаина развитие потенциала действия в вентральных корешках значительно снижается в медленную и отсроченную фазу, не изменяя показателя в ранней фазе. Отмечается, что препарат взаимодействует с тетродоксин-резистентными Na+-каналами, связанными с NK- и NMDA-рецепторами. Авторы (Nagy I., Woolf C.J.) считают, что низкие концентрации лидокаина могут селективно нарушать передачу болевого импульса в спинном мозге.
Глава 6. Факторы, влияющие на выраженность действия местных анестетиков
Выраженность действия местноанестезирующих средств определяется:
• физико-химическими свойствами МА;
• связыванием с белками тканей;
• концентрацией МА в месте действия;
• совместным применением с вазоконстрикторами;
• местом введения МА;
• константой диссоциации МА;
• кислотностью (рН) среды;
• состоянием (активностью) ионных (натриевых) каналов;
• содержанием ионов кальция в экстрацеллюлярной среде;
• количеством ионов калия во внеклеточной жидкости;
• беременность.
Физико-химические свойства местных анестетиков. Большее влияние на скорость развития (латентный период) местноанестезирующего эффекта оказывает величина и липофильность молекулы МА. Чем меньше размер молекулы и больше ее липофильность, тем эффект развивается быстрее. Липофильное вещество легче проникает через мембрану нервного волокна. Лидокаин, прокаин гидрохлорид и мепивакаин сравнительно менее липофильны, чем тетракаин гидрохлорид, этидокаин и бупивакаин. Выраженность действия (глубина и длительность анестезии) у трех последних препаратов значительно выше. Следует отметить, что этот эффект наиболее выражен в опытах in vitro, тогда как в условиях in vivo корреляция между липофильностью и выраженностью действия незначительна. Например, в опытах на изолированном нерве действие лидокаина почти в два раза больше, чем прилокаина и мепивакаина, а этидокаина, чем бупивакаина. При исследовании в условиях целого организма выраженность анестезирующего эффекта лидокаина, прилокаина и мепивакаина практически одинаково, так же как этидокаина и бупивакаина.
Связыванием с белками тканей. Высокая степень связывания МА с белками тканей приводит к увеличению продолжительности действия и снижает всасывание препаратов в кровь. Наиболее изучено взаимодействие местных анестетиков с белками плазмы крови. Предполагается, что степень связывания МА с белками плазмы крови аналогична процессам, происходящим в мембране клеток. Степень связывания с белками плазмы крови наиболее высокая у бупивакаина и этидокаина (94%, 93%), а у прокаина гидрохлорида — около 55%. Длительность блокады плечевого сплетения при использовании бупивакаина продолжается около 10 часов, а при применении прокаина гидрохлорида — в течение 30–60 минут. Этот пример демонстрирует наличие прямой зависимости между степенью связывания препарата с белками и длительностью анестезии.
Концентрация соединения в месте действия. Выраженность местноанестезирующего эффекта МА прямо пропоциональна концентрации (дозе) соединения в месте действия. Чем выше содержание в ткани препарата, тем скорость развития и величина потенциала действия меньше (рисунок 2). То есть эффект будет быстрее начинаться, будут более выражены его глубина и продолжительность. Например, при повышении концентрации бупивакаина с 0,125% до 0,5% раствора (объемы равны, доза от 100 до 150 мг) при эпидуральном введении анестезия развивается значительно быстрее и более выражена.
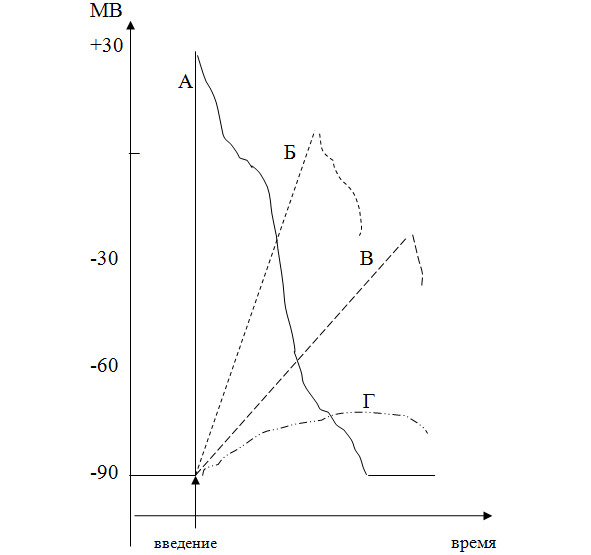
(Примечание:
А — развитие потенциала действия в норме; Б,В,Г — концентрация местного анестетика возрастает в последовательности Б <В <Г.
Ось абсцисс — потенциал внутренней поверхности мембраны.)
Совместное применение с вазоконстрикторами. Снижение абсорбции МА в системный кровоток при совместном применении с сосудосуживающими средствами (эпинефрин, фенилэфрин и т.д.) приводит к увеличению времени, в течение которого МА находятся в месте введения. Однако влияние вазоконстрикторов на выраженность анестезии зависит от ряда причин:
• применяемого препарата;
• вида анестезии;
• места введения.
Так совместное введение МА и эпинефрина приводит к увеличению длительности местной анестезии при:
• проведении инфильтрационной анестезии;
• блокаде периферических нервных стволов;
• эпидуральной блокаде с использованием прокаина гидрохлорида, мепикаина и лидокаина;
• эпидуральной блокаде при родах с использованием 0,125% и 0,25% раствора бупивакаина;
• субарахноидальной блокаде при применении тетракаина гидрохлорида.
В то же время применение эпинефрина вместе с МА не изменяет длительности местной анестезии при эпидуральной блокаде:
• при родах с использованием 0,5% и 0,75% раствора бупивакаина;
• при применении этидокаина и прилокаина.
Способ и место введения. В зависимости от способа и места введения МА начало и продолжительность действия значительно варьируют. При субарахноидальном и подкожном введении эффект развивается наиболее быстро, но он непродолжительный. Самое медленное развитие анестезии и большая продолжительность отмечаются при проведении блокады плечевого сплетения. Это наглядно видно при применении бупивакаина:

Различия сроков наступления и продолжительности анестезии определяется анатомическими особенностями данной области и во многом зависят от васкуляризации ткани.
Константа диссоциации местноанестезирующих препаратов. Важным параметром, влияющим на выраженность эффектов местных анестетиков, является константа диссоциации (рКа) соединения. В том случае, если данный показатель является низким (7,6–7,8), то количество неионизированных молекул ЛС будет высоким при физиологических значениях рН. Следовательно, значительное их число проникнет внутрь клетки и будет способно взаимодействовать с местом связывания на рецепторе, расположенным ближе к внутренней поверхности мембраны. Действие таких препаратов развивается быстро и достаточно хорошо выражено, но сравнительно непродолжительно. Показано, что время наступления обезболивания находится в прямой зависимости от количества препарата в неионизированной форме (таблица 2). То есть процентное содержание МА в неионизированной форме при его введении в ткани с рН 7,4 обратно пропорционально рКа соединения. Например, константа диссоциации мепивакаина, лидокаина и этидокаина составляет 7,7. При введении препаратов в ткани с рН 7,4 около 65% общего количества их молекул переходит в ионизированную форму, а 35% — остаются неионизированными. Тетракаин гидрохлорид имеет рКа 8,6. Поэтому в тканях с рН 7,4 только 5% молекул этого препарата остается в неионизированном виде, а 95% — переходит в катионную форму. Величина рКа бупивакаина равна 8,1, и в тканях с нормальным рН только около 15% молекул присутствуют в неионизированной форме, а 85% — в виде катиона. Следовательно, при введении лидокаина, мепивакаина и этидокаина эффект будет развиваться быстро, а действие прокаина гидрохлорида и тетракаина гидрохлорида наступает медленно. Бупивакаин занимает промежуточное положение между этими группами препаратов как по величине константы диссоциации, так и по наступлению анестезии.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.