
Бесплатный фрагмент - Кристаллохимические задания Всероссийских химических олимпиад
Учебно-методическое пособие
Предисловие
В настоящем сборнике собраны фрагменты задач заключительного этапа Всероссийских олимпиад школьников по химии (далее ВХО) в XXI веке. Общая черта собранных задач — их тематическая принадлежность к кристаллохимии.
Теоретический тур заключительного этапа ВХО проводится в два этапа: 1 — задачи, обязательные для участников конкретного возраста (9, 10 и 11 классы); 2 — задачи, из которых участнику требуется решить несколько по выбору (широта выбора тоже зависит от возраста), причем на этом этапе задачи классифицированы не по возрастам, но тематически. Они относятся к одной из рубрик: «Неорганическая химия», «Органическая химия», «Физическая химия», «Химия и жизнь».
Некоторые важные разделы химии, такие как аналитическая, коллоидная, кристаллохимия, не имеют самостоятельной рубрики, однако типичные задачи по этим дисциплинам иногда включаются в смежные рубрики. Кристаллохимия как наука о взаимосвязи кристаллической структуры и химических свойств вещества может быть представлена в каждой из перечисленных рубрик. При этом до настоящего времени она оказывалась лишь в двух рубриках: «Неорганическая химия» и «Физическая химия». Это может быть связано с тем, что в органической химии и биохимии кристаллическим структурам традиционно уделяется меньше внимания, чем структурам молекулярным, ведь молекулярных веществ там гораздо больше, чем среди неорганических соединений. Больше всего кристаллохимических задач оказалось на ВХО в последние годы: в настоящее время они встречаются практически каждый год. Эта тенденция наблюдается и на Международных химических олимпиадах.
Вопреки обычному движению от простого к сложному, кристаллохимические задачи на олимпиадах из года в год отнюдь не становятся все менее простыми. Это означает, что в данной области нет устоявшихся школьных знаний, которые можно считать необходимым минимумом. По сравнению с традиционными разделами физической химии (химическая термодинамика, кинетика, электрохимия и др.) и неорганической химии кристаллохимия до сих пор не популяризирована в массовых школьных учебниках по химии. Можно ожидать, что это произойдет не ранее чем через 10—15 лет.
Поскольку нас интересовало только кристаллохимическое содержание олимпиадных задач, при составлении сборника мы использовали большинство заданий не целиком, а частично. В некоторых случаях от оригинальных текстов задач отсекались вопросы, ответ на которые был необходим для ответа на кристаллохимические вопросы. В таких случаях менялась нумерация вопросов, а недостающие для решения сведения добавлялись в качестве примечания. Оригинальные тесты заданий, а также ответы и решения доступны на сайте химического факультета МГУ: http://www.chem.msu.su/rus/olimp/
Кристаллохимия как самостоятельно оформленная учебная дисциплина преподается в очень небольшом числе российских ВУЗов и касается, в основном, геологических специальностей. Среди крупнейших университетов России единственным, где кристаллохимия преподается студентам-химикам автономно от смежных дисциплин, является Московский государственный университет. С помощью нашего сборника мы надеемся привлечь внимание школьников, увлекающихся химией, и школьных педагогов к этому красивому разделу химии.
<Без названия> (ВХО 2006, Уфа, неорг. химия)
Можно представить себе, какую бурную реакцию вызвало сообщение швейцарских физиков, ныне лауреатов Нобелевской премии, Беднорца и Мюллера, обнаруживших осенью 1986 г существование сверхпроводимости (СП) при 30—35 К. Открытие Беднорца и Мюллера разрушило все теоретические, технологические и психологические барьеры, и в течение нескольких месяцев новые сверхпроводники почти одновременно были синтезированы в США, Японии, Китае и СССР. Сама хронология событий, происшедших в начале минувшего года, передает их исключительный динамизм: январь 1987 г. — несколько американских и японских лабораторий подтверждают открытие швейцарских исследователей; февраль — в научном семинаре в ИФП АН СССР сделаны сообщения о первых в нашей стране испытаниях новых сверхпроводников на основе оксидов лантана-меди-бария-стронция с температурой перехода в сверхпроводящее состояние (Тс ~ 40 К); март — сообщение американских ученых о синтезе сверхпроводящей керамики из оксидов бария-иттрия-меди с Тс ≈ 98 К, т.е. выше точки кипения жидкого азота… (Акад. АН СССР Третьяков Ю. Д., 1988 г.)
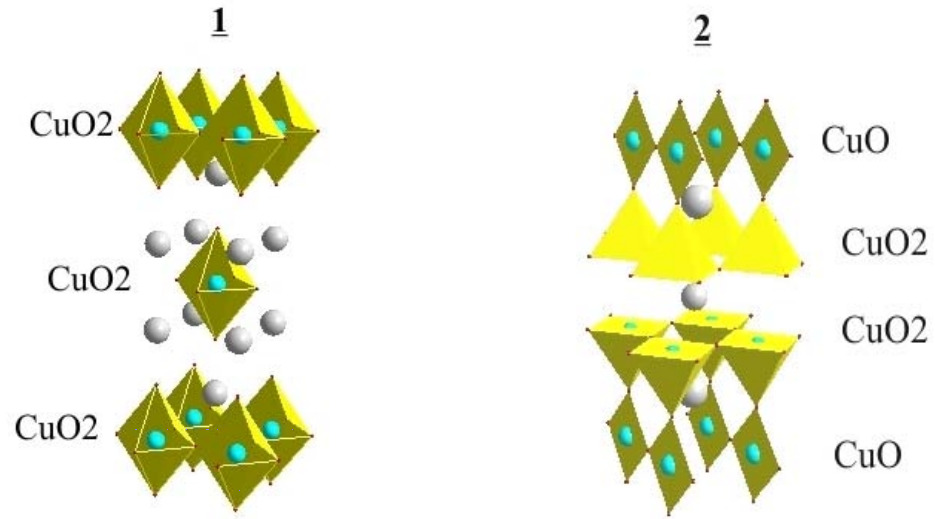
Беднорц и Мюллер впервые синтезировали соединение La1.85Ba0.15CuO4 (Тс = 30 К) со структурой 1, последующая активность исследователей была направлена на получение аналогов La1.85Ba0.15CuO4 для РЗЭ меньшего радиуса, с целью уменьшить расстояние Cu–O, увеличивая перекрывание орбиталей кислорода и меди. Иттриевый аналог этого вещества получен не был: в смеси были обнаружены 3 вещества: Y2BaCuO5 («зеленая фаза»), Y2Cu2O5 и YBa2Cu3O7 со структурой 2. Последнее соединение обладало чрезвычайно высокой Tc (Тс = 90 К). Аналогичный результат был получен в ряде лабораторий мира. Структура YBa2Cu3O7 оставалась неизвестной до тех пор, пока ученые из США не получили изображения электронной дифракции этого компонента смеси. Информация о структуре в соответствии с предполагаемым составом этого соединения позволила провести направленный синтез YBa2Cu3O7 и открыть новый класс ВТСП — керамик, т.н. 123 — фаз для более тяжелых РЗЭ. В соответствии с современными представлениями носителем СП свойств является слой соединенных вершинами октаэдров CuO6, пирамид CuO5 или цепочек из ромбов CuO4. Оптимальной степенью окисления меди для возникновения СП в слое (цепи) является +2.1 — +2.2. Влияние А-катионов (РЗЭ и ЩМ), на ковалентность связи Cu–O, ближайшей к рассматриваемому А-катиону может связано с отношением формального заряда этого катиона к его радиусу. Чем больше эта величина, тем менее ковалентна связь Cu–O. Перенос электронов в купратах возможен благодаря двум факторам: а) перекрывание 3d орбиталей меди и 2р орбиталей кислорода, б) наличие носителей заряда — «Cu3+», перемещающихся по схеме: -О-Cu3+-O-Cu2+-О…→…О-Cu2+- O-Cu3+-О, путем переброса «дырки» между соседними Cu2+ и Cu3+.
1. Рассчитайте «среднюю» степень окисления меди в 1 и 2 стехиометрического состава.
2. Соединение La1.85Ba0.15CuO4 является членом ряда твердых растворов La2–xBaxCuO4; могут ли быть получены крайние члены этого ряда: х = 0 и х = 2? Ответ обоснуйте.
3. Какие координационные числа имеют катионы ЩМ и РЗЭ в структуре: а) 1, б) 2?
4. Соединения с крупными РЗЭ — катионами (La, Pr — Gd), способны образовывать твердые растворы состава R1±δBa2±δCu3O7 в отличие от РЗЭ с меньшим радиусом. Предложите этому химическое объяснение.
Фазовые состояния воды (ВХО 2009, Архангельск, физ. химия)
Кубический лёд Ic — метастабильная форма воды. Он образуется в результате конденсации водяного пара при низкой температуре. Элементарная ячейка имеет кубическую гранецентрированную структуру: молекулы воды находятся во всех вершинах куба, в серединах всех граней, и ещё 4 молекулы занимают тетраэдрические пустоты внутри ячейки. Длина ребра ячейки — 0,636 нм:
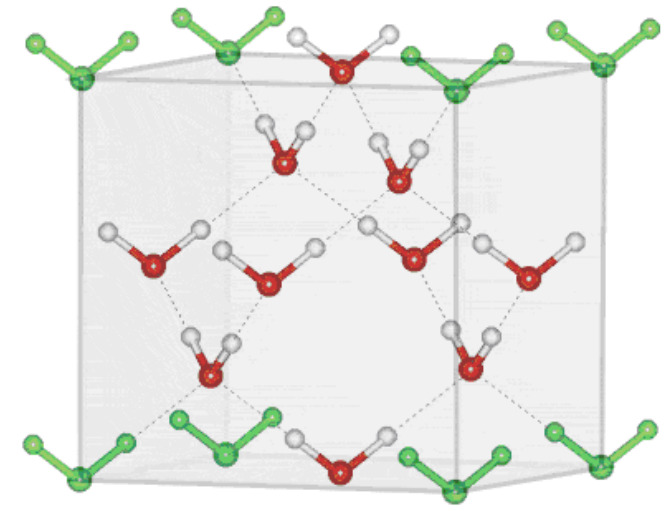
Сколько молекул приходится на одну элементарную ячейку льда Ic? Рассчитайте плотность кубического льда. Будет ли он тонуть в воде или плавать на её поверхности?
Соединения водорода с водой (ВХО 2014, Казань, физ. химия)
Газовые гидраты — кристаллические вещества, в которых молекулы газа находятся внутри кластеров, образованных молекулами воды. Молекулы в них удерживаются ван-дер-ваальсовыми связями. Не так давно газовые гидраты предложили использовать для хранения молекулярного водорода.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.