
Бесплатный фрагмент - Клинические и методологические аспекты обратного переливания крови
Предисловие
На рубеже ХХ-ХХI веков началось лавинообразное развитие всей совокупности наук о жизни, начался процесс переосмысления на основе новых данных накопленных медициной фактов предрасположенности человека к различным заболеваниям, механизмов его иммунной защиты, а также роли окружающей среды и стрессов в развитии болезней — всего, что определяет здоровье человека, его долголетие и качество жизни. Появилась синергетическая наука — биомедицина. Биомедицина — это симбиоз медицины и биологии, в основе которого лежит использование для решения медицинских проблем идей и технологий, разработанных в биохимии, иммунологии, клеточной биологии и других биологических науках.
Наиболее важные направления биомедицина — это: ранняя диагностика заболеваний, в т.ч. выявление наследственной предрасположенности к «обычным» болезням; определение индивидуальных генетически обусловленных особенностей реакций организма на лекарственные вещества (фармакогеномика); разработка методов лечения наследственных болезней; методы диагностики инфекционных и неинфекционных заболеваний (в частности, с помощью т.н. биочипов); многократное ускорение разработки новых лекарственных средств за счет компьютерного моделирования, автоматизированного скрининга потенциальных препаратов, применения в преклинических испытаниях кандидатных веществ клеточных культур вместо лабораторных животных; создание принципиально новых лекарственных препаратов на основе антител, генотерапии, в т.ч. с помощью коротких интерферирующих РНК, и других достижений в области молекулярной биологии и нанотехнологий; применение методов генной инженерии, в частности, для получения человеческих белков с помощью трансгенных микроорганизмов, растений и животных; клеточная терапия, тканевая инженерия и разработка методов выращивания органов для трансплантации.
Считаем наужным перечислить соответстующие определения биомедицины. Биомедицина — это комплексная, интегративная, медико-биологическая, междисциплинарная отрасль знания, в основе которого лежит использование для решения медицинских проблем идей и технологий, разработанных в клеточной биологии, биохимии, биофизики, патофизиологии, патоморфологии, иммунологии, и других биологических науках. Биомедицина — это отрасль науки, изучающая жизнь человека и качество этой жизни, основанном на переосмыслении новых научно-медицинских данных предрасположенности человека к различным заболеваниям, механизмов его функционально-физиологической, иммунной защиты, а также роли окружающей среды и стрессов в развитии болезней. Биомедицина — это основа развития ранней диагностики заболеваний, основанной на прогнозировании предрасположенности к человека к болезням; на определении индивидуальных генетически обусловленных особенностей реакций организма. Биомедицина — это основа разработки эффективных методов лечения болезней, основанных на многократном ускорении разработки новых лекарственных средств за счет компьютерного моделирования, автоматизированного скрининга потенциальных препаратов, применения в преклинических испытаниях кандидатных веществ клеточных культур. Биомедицина — это основа для создания принципиально новых лекарственных препаратов на основе антител, методов клеточной и тканевая инженерии, а также разработка методов выращивания органов для трансплантации.
Итак, безусловно, биомедицина — одна из кардинальных направлений современной биологии и медицины в симбиозе. Когда мы говорим о возможностях, которые предоставляют медицине новые направления науки, надо всегда ставить вопрос: готовы ли медики, в особенности хирурги, к тому, чтобы использовать достижения биологических наук в своей деятельности? Как известно, хирурги всегда отличались консервативностью взглядов. Возможно, это оправдано, так как предметом деятельности хирургов является человек и его жизнь. Суть консерватизма хирургов состоит прежде всего в укоренившейся привычке, твердо закрепленной в десятках поколений врачевателей и ученых, делить и строить науки, руководствуясь функциональным, а не субстратным принципом, придерживаясь и проповедывая тем самым принцип сепаратизма своей науки. А ведь во дворе XXI век, который диктует синергетичность наук. В этом аспекте, современная хирургия все чаще представлет собой биоинженерную специальность, так что, сейчас, в настоящее время «хирургия слишком серьезная специальность, чтобы ею занимались только хирурги». Это и есть та самая истина, которую можно запомнить даже не совсем понимая. А если все же понять ее, то это было бы здорово.
ВВЕДЕНИЕ
Безусловно, острая полостная и просветная кровопотеря является самым критическим интраоперационным инцидентом в экстренной хирургии и анестезиологии-реаниматологии, а потому проблема оптимизации их разрешения, повсеместно и всегда была, есть и останется самой актуальной научно-практической задачей (А.И.Воробьев, 2006; М.М.Мамакеев и соавт., 2010; В.А.Дмитрьев, 2013; Cipolletta L. et al., 2001). Причем, оптимизация результатов лечения больных с острой патологией, осложненной кровопотерей, во многом связана с выработкой согласованной тактики ИО ИТТ (Е.С.Горобец, 2001; Н.Н.Терехова, 2010; Luis, D. et al., 2006).
На современном этапе развития хирургии и анестезиологии-реаниматологии предложены множество программ ИО ИТТ при острой кровопотере, включая гомологичную и аутологичную гемотрансфузию, механическую и аппаратную ИО РИК {{}}В.Д.Малышев и соавт., 2002; В.А.Журавлев и соавт., 2007; Germanos S. et al., 2007{{}}.
По сводным данным, при кровопотерях частота применения гемотрансфузии колеблется в пределах 11—76% случаев гастродуоденальных кровотечений, в 36—97% — артропластики бедра и колена, в 51—100% — пересадки органов {{}} М.М.Мамакеев и соавт., 2001; В.В.Мороз и соавт., 2002; В.П.Савченко и соавт., 2004; Heriot A.G. et al., 2002; Alam H.B. et al., 2005 {{}}. По сводным данным, частота использования ИО РИК колеблется в пределах 5,5—76% случаев травм груди и живота, 3,2—18% — травм конечностей, 44—88% — пересадки органо {в} И.В.Богомазова, 2005; Е.Н.Кобзева, 2002; Ahmed N. et al., 2011 {{}}.
На протяжении многих лет (1998—2017) в НХЦ ведутся клинико-экспериментальные и клинико-вероятностные исследования по разработке программы экстренного восполнения полостной и просветной кровопотери у пострадавших с абдоминальными и торакальными повреждениями, а также у больных с осложненной ЯБ ДПК {{}}М.М.Мамакеев и соавт., 2001; А.Т.Буланбеков, 2006; Б.Ж.Мусалиев, 2010; Ж.А.Чынгышева, 2011; И.А.Ашимов, 2012; Н.М.Мамажусупов, 2012{{}}. В течение ряда лет ведется работа по научному обоснованию адаптированной программы ИО ИТТ. Именно с такой целью проведены ККИ на основе диахронных параллелей ЭК и КК (Ж.А.Чынгышева).
Следует отметить, экспериментальные, клинические, статистические, вероятностные исследования являются методологическими кластерами, каждый метод которых имеет собственный предел рациональной обоснованности (интервал абстракции). Если очевидность того, что внутри конкретного кластера, методы релевантны друг другу, тогда как релевантность методов исследования одного кластера, таковым другого не всегда очевидна {{}}И.А.Ашимов, 2002; В.А.Коменская, 2002{{}}. Насколько они дополняют друг друга для решения общей задачи? Насколько можно экстраполировать данные ЭК? Каковы пределы обоснования КК и ЭК? Какова динамика использования элементов адаптированной программы ИО ИТТ во времени и в практике?
Полагаем, что научное обоснование адаптированной программы ИО ИТТ, должна базироваться на сравнительной характеристике данных, полученных в результате использования методов различных методологических кластеров (ЭК, КК, ККИ). То есть путем приведения в его пользу дополнительных аргументов на примере проблемы разрешения адекватного восполнения крови при острой полостной и просветной кровопотере. Очевидно, на определенном этапе исследований какой-либо сложной проблемы необходимо осуществить концептуальную развертку объекта в виде совокупности его проекции в различных методологических кластерах {{}}И.А.Ашимов, 2002; В.А.Коменская, 2002{{}}. Такова логика настоящего исследования.
ГЛАВА I
ИНТРАОПЕРАЦИОННАЯ ХИРУРГИЧЕСКАЯ И АНЕСТЕЗИОЛОГО-РЕАНИМАЦИОННАЯ ТАКТИКА ПРИ КРИТИЧЕСКИХ ПОЛОСТНЫХ И ПРОСВЕТНЫХ КРОВОПОТЕРЯХ (Обзор позиции клинической и доказательной медицины)
1.1. Позиции клинической медицины по полостным кровопотерям
Задачей главы I является обзор и аналитическая проработка современной позиции клинической и доказательной медицины по вопросу интраоперационной хирургической и анестезиолого-реанимационной тактики при критических полостных и просветных кровопотерях.
Общеизвестно, что острая кровопотеря во время операции всегда была, есть и останется важнейшей интраоперационной проблемой для анестезиологов-реаниматологов и хирургов {{}}2,10,24,199{{}}. Если раньше считалось, что для хирургов — это проблема лишь хирургического гемостаза, а для анестезиологов-реаниматологов — прежде всего, проблема ИО ИТТ, то сейчас проблема адекватного восполнения потерянной крови — это общая задача хирургической бригады в цело{м{}} 19,29,46,196{{}}.
По мнению Н.Н.Тереховой (2010), при острой и массивной кровопотери в половине случаев летального исхода, связанных с проведением анестезиолого-реанимационной помощи на операционном столе могла бы быть предотвращена при условии тесного взаимодействия между хирургами и анестезиологами-реаниматологами {{}}167{{}}. «Больной, находящийся во время оперативного вмешательства в условиях анестезии, в ряде случаев может пострадать вследствие неправильных действий анестезиолога и ошибок хирурга в отношении тактики восполнения крови, включая игнорирования возможностей современного медицинского оборудования», — пишет авто{р{}} 167{{}}.
Безусловно, речь идет о таком, на сегодня общепризнанном методе восполнения потерянной крови, как ИО РИК, в том числе аппаратным способом. Как известно, острая и массивная кровопотеря, безусловно, определяет тяжесть состояния больного или пострадавшего, в связи с чем, разумеется, приобретает исключительную важность оценка не только степень острой кровопотери, а также обусловленную ими тяжесть состояния пациента, но и сиюминутной коррекции кровопотери {{}}171,172,200{{}}.
Л.В.Пыщева (2009) пишет: — «Бесспорно, операция и наркоз сами по себе являются стрессогенными факторами {{}}138{{}}. По мнению автора, до настоящего времени не разработаны четкие критерии выбора анестезиологического пособия, нет единых стандартов и алгоритмов обезболивания. Многое зависит от степени дисфункции систем в результате чрезмерного стресса от операции и самого наркоза. При этом острая кровопотеря является наиболее демонстративным усугубляющим факторо{м{}} 138{{}}.
По мнению многих исследователей, так или иначе, проблема обеспечения интраоперационной безопасности в экстренной хирургии и анестезиологии-реаниматологии при острой кровопотери, всегда входила в список наиболее актуальных проблем клинической медицины {{}}145,147,163,206{{}}. Очевидность того, что проблемы безопасности больных в интраоперационном этапе ведения, зависит от состояния анестезиолого-реанимационной и медико-хирургической помощи в целом, не вызывает сомнений и споро{в{}} 150,174,213{{}}.
Все авторы солидарны в том, что интраоперационные инциденты, в том числе и, прежде всего, острая кровопотеря, должны решаться хирургической бригадой в тесном содружестве {{}}24,33,196{{}}. По мнению Н.Н.Тереховой (2010), в настоящее время эффективным инструментом, позволяющим определить оптимальный объем мониторинга, является внутренний медицинский аудит на основе регистрации критических инцидентов, включая, прежде всего, острую кровопотерю во время операци{и{}} 167{{}}.
Прежде всего, возникает вопрос: как оценивать степень острой кровопотери на интраоперационном этапе? В литературе приводятся обобщенные данные по оценке кровопотери. В частности, по объему кровопотери выделяют малую (0,5—10% ОЦК или 500 мл), среднюю (10—20% ОЦК или 500—1000 мл), большую (21—40% ОЦК или 1000—2000 мл), массивную (41—70% ОЦК или 2000—3500 мл) и смертельную (> 70% ОЦК или> 3500 мл) кровопотерю {{}}54,58,64,203{{}}. По степени гиповолемии и возможности развития шока выделяют легкую (10—20% ОЦК, <30% ГО, шока нет), умеренную (21—30% ОЦК, 30—45% ГО, шок), тяжелую (31—40% ОЦК, 46—60% ГО, шок) и крайне тяжелую кровопотерю (> 40% ОЦК,> 60% ГО, шок, терминальное состояние{){}} 2,20,37,53,215{{}}.
Безусловно, именно показатель степени кровопотери является определяющим в принятии того или иного медико-хирургического и анестезиолого-реанимационного решения во время операции {{}}65,73,86,221{{}}. В этой связи, интерес представляет обзор наиболее известных методов определения степени кровопотери.
Общеизвестный колориметрический метод основан на извлечении крови из операционных материалов с последующим определением концентрации составных частей (Эр, Hb, Ht) крови и пересчетом на объем излившейся крови {{}}98,101,228{{}}. Гравиметрический метод основан на допущении, что 1 мл крови имеет массу 1 г. К недостаткам указанных методов следует отнести трудность извлечения всего объема крови из марлевых тампонов и салфеток, а также сложности взвешивания больного, находящегося на операционном столе. Нужно заметить, что при их применении погрешности оценки достигают 50% [103,113,218].
Разумеется, величину интраоперационной кровопотери оценивают более точно по объему крови, собранной по ходу операции в мерные емкости. Речь идет об учтенной кровопотери (объем крови, собранной во время операции из серозных полостей или операционной раны, с учетом веса сгустков), величину которой оценивают в мл., дефицита ГО у пациента от должного в % или в стандартных дозах Эр. (СДЭ). Одна СДЭ равняется 200 мл клеток с Ht 100об%, что соответствует ГО стандартной дозы (450 мл) эксфузии донорской крови [21,46,225].
По мнению многих исследователей, наиболее простым, а потому наиболее используемым методом определения объема кровопотери является оценка величины АД и ЧСС через индекс шока Аллговера-Бурри (ИШ) [49,65,232]: ИШ = ЧСС/АД сист. (N — 0,54 ± 0,021 ед. Каждое последующее увеличение на 0,1 ед. соответствует потере 200 мл крови или 4% ОЦК. Так, при ИШ — <0,84 — объем кровопотери = 10% ОЦК, при ИШ = 0,94—1,24 — 20%, при ИШ = 1,34—1,44 — 30%, при ИШ ≥1,54 -> 40% ОЦК [65,72].
Как известно, ЦВД и АД являются интегральными показателями и имеют достаточно высокую эффективность для определения дефицита ОЦК {{}}76,86{{}}. Другим показателем, позволяющим косвенно оценить степень кровопотери и эффективность лечебных мер, является величина почасового диурез{а{}} 100,111{{}}. Так, снижение диуреза до 15—20 мл/ч (N — 50—70 мл/ч) наблюдается при значительном (> 30) дефиците ОЦК [37,73,235].
Разумеется, о степени кровопотери можно судить и по содержанию Эр., Hb, Ht. Кровопотеря ведет к снижению числа Эр., ЦП, Hb в периферической крови. Однако, из-за гемоделюции число Эр., уровень Hb, Ht и удельный вес крови в первые часы кровотечения и кровопотери остаются относительно нормальными даже при значительной кровопотере {{}}84,87,212{{}}.
Другим не менее важным критерием оценки степени кровопотери является относительная плотность крови, на чем основан метод Карабанова [99,101,115,233]. Так, относительная плотность цельной крови = 1056—1060 мг/мл, при плотности крови 1053—1050 мг/мл — объем кровопотери = 1000 мл, при 1049 -1044 = 1500 мл, а <1044 ≥1500 мл [101,121,224].
Ряд авторов отмечают, что потеря 500 мл крови ведет к снижению уровня Hb на 10—15 г/л. [150,172,174]. В норме у взрослых Ht варьирует в пределах 32—49 об%. После кровопотери, в связи с нарастающей гемодилюцией, объем плазмы увеличивается, в результате чего объем Эр. становится меньшим относительно объема крови.
Предложены методы, позволяющие оценить объем кровопотери по профилю белков плазмы крови. Так, Е.А.Евтеева с соавт. (2001) предложили использовать динамику циркулирующих белков плазмы крови {{}}65{{}}. По мнению автора, диагностическая чувствительность метода составляет 87,5%, а специфичность и эффективность, соответственно, 90 и 89%. Отмечено, что концентрация белков плазмы крови, равной ≤1 г/л, свидетельствует о кровопотере> 1000 мл{.{}} 65{{}}.
Важными критериями гиповолемии являются показатели метаболизма. В частности, КЩС, газы крови, уровень лактата крови, транспорт и потребление О2 [64,240]. Одним из объективных тестов, характеризующих степень кровопотери, является уменьшение ОЦК и ГО [32,244,246]. П.Г.Брюсов (2008) предложил формулу расчета степени кровопотери по дефициту ГО: Укп = ОЦКд х (ГОд — ГОф / ГОд), где Укп — объем кровопотери (мл), ОЦКд — должный (мл), ГОд и ГОф — должный и фактический ГО (мл) {{}}32,256{{}}.
В настоящее время предложены лучевые методы оценки объема кровопотери. Установлено, что если при выполнении рентгенографического исследования органов грудной клетки, когда уровень гемоторакса достигает угла лопатки — это соответствует кровопотере 1000—1500 мл; на уровне тела лопатки — 2000—2500 мл; тотальный гемоторакс -> 3000 мл [29,38,46,229].
Установлено также, что при рентгенологическом исследовании пациентов с травмой живота наличие симптома «полной луны» соответствует объему кровопотери — 1000 мл, а исчезновение четкости анатомических структур брюшной полости и забрюшинного пространства -> 2500 мл [46,53,65,258].
По данным некоторых авторов, ультразвуковая диагностика гемоперитонеума в настоящее время имеет ряд преимуществ перед традиционными рентгенологическими исследованиями {{}}68,71{{}}. Применяются также биофизические методы — термодилюция, магнитная флуометрия, эхокардиография, реография и др{.{}} 73,77,260,263,271,275{{}}. Основу многих методов оценки объема потерянной крови составляет катетеризация легочной артерии катетером Сван-Ганца (1970) с расчетом минутного объема работы сердца, ударного объема работы сердца, общего периферического сопротивления и пр. [87,98,262].
В настоящее время появилось множество публикации о расчете ОЦК и его компонентов с помощью различных уравнений и номограмм с использованием специальных компьютерных программ. Все они построены на установлении корреляционной зависимости между величиной ГО, показателями Ht, массы тела, уровня Hb [101,111,269]. Одним из таких подходов является способ А.Т.Староверовой и соавт. (1995), включающий определение ГО с последующим расчетом ОЦК и ОЦП на основании уравнения регрессии: FO = (11,08 +0,615 — Ht +0,0354 — Hb) — 0,254 — Р, где ГО (мл/ 1 кг массы тела, Ht (в об%), Hb (г/л), Р — масса тела в кг.{{}}цит. — В.П.Савченко, 2004
Таким образом, анализ литературы позволяет констатировать, что до настоящего времени не существует оптимального способа, обеспечивающего не только быстрое и точное определение степени кровопотери, но и позволяющий многократно повторять исследование для динамического наблюдения на интраоперационном этапе.
В этой связи, очевидной необходимостью является разработка комплексного метода оценки объема кровопотери для оптимизации именно ИО ИТТ у пациентов с кровопотерями. Тем не менее, с этой целью, в особенности на интраоперационном этапе, целесообразно использовать наиболее доступные и известные методы, несмотря на их очевидную приблизительность.
Многие авторы солидарны в том, что неправильно рассматривать острую кровопотерю как простой дефицит крови {{}}1,6,28,61,258,263{{}}. В действительности, это сложный патофизиологический процесс, развивающийся в организме, процесс, в котором сам факт кровотечения является лишь этиологическим моментом [2,28,274,277]. Доказано, что острая кровопотеря вызывает в организме глубокие изменения гемодинамики и вводит в действие сложнейшие механизмы компенсации нарушенного гемостаз{а{}} 1,2,6,59,219,235{{}}.
Какова патофизиология острой кровопотери? Чем чревата острая кровопотеря как интраоперационный критический инцидент и критическая проблема? Находим нужным в конспективном порядке осветить патофизиологию острой кровопотери.
Итак, как правило, пусковым звеном в развитии нарушений является нарастающее снижение ОЦК и падение сердечного выброса [6,7]. В ответ запускается компенсаторный механизм в виде активизации симпатоадреналовой системы, когда скорость выброса катехоламинов в кровяное русло возрастает> 300 раз [7,21,241].
Как цепная реакция развивается так называемая централизация кровообращения {{}}24,35,247{{}}. В результате длительного и выраженного спазма прекапиллярных сфинктеров, а также посткапиллярных венул наступает тахикардия и тахипноэ, свидетельствующие о дефиците О2 и переходе тканевого обмена на анаэробный метаболизм {{}}48,65,260{{}}. Постепенно развивается метаболического ацидоза, что в свою очередь приводит к параличу прекапиллярных сфинктеров и капилляров, приводящие к децентрализации кровообращения [68,78,135,266].
Установлено, что нарастание концентрации альдостерона в крови вызывает ряд существенных изменений водно-солевого обмена, приводящие к гемоделюции. Водно-солевые расстройства приводят к увеличению ОЦК, повышению ОЦП. Это на время стабилизирует центральную гемодинамику, улучшает реологические свойства крови, микроциркуляцию, дезагрегирует застойное депонирование Эр., повышает кислородную ёмкость крови [87,90, 245].
Доказано, что в условиях острой кровопотери в печени начинается усиленная продукция белков, прежде всего, альбумина, который способствует повышению онкотического давления плазмы [100,110,264]. Гемоконцентрация, стаз крови, ацидоз и гипоксия способствуют образованию внутрисосудистых агрегатов форменных элементов крови, что вызывает блокаду капилляров и выключение их из кровотока. Наступает секвестрация кровотока, которую следует воспринимать как непрямую кровопотерю {{}}113,135,269{{}}.
При быстрой геморрагии наступает компенсаторная гипервентиляция, обусловленная хеморецепторным влиянием {{}}132,151,275{{}}. Увеличение ЧД сопровождается уменьшением ДО и МОД. Последующее снижение вентиляции легких приводит к респираторному, а затем метаболическому ацидозу [150,156]. Малый сердечный выброс вызывает застой в мелких сосудах легких, в результате чего ухудшается легочная микроциркуляция, увеличивается мертвое альвеолярное пространство, что на фоне неэффективности вентиляции легких приводит к дыхательной недостаточности [21,34,76,272].
Установлено, что в печени возрастает содержание трансаминаз, снижается количество тромбина, развивается гипоальбуминемия [46,57,267]. Доказано, что на 50—70% снижается почечный кровоток с селективным снижением кортикального кровотока. Вследствие преклубочковой артериальной вазоконстрикции снижается клубочковая фильтрация до полного её прекращения и развития олиго- или анурии [61,64,268].
Доказано, что в почках наступает канальцевая обструкция, развивается обратная обструкция клубочкового ультрафильтрата, что ведет к снижению коэффициента клубочковой проницаемости {{}}68,86{{}}. Происходит отложение фибрина в клубочковых капиллярах, изменяется метаболизм клеток, ведущий в конечном итоге к канальцевому некрозу [92,138].
Снижение общего ГО сопровождается, увеличением функциональной нагрузки на сохранившиеся Эр. и другие форменные элементы и способствует сокращению срока их активного функционирования [145,148,277]. Дефицит О2 и ацидоз усиливают процесс выхода ионов К+ из клеток и проникновения в нее Na++ {{}}151,157{{}}. При этом развивается отек клетки, нарушается нормальный ход метаболических процессов в ней, что приводит к разрушению Эр{.{}} 157,160,261{{}}.
Установлено, что в результате гибели Эр. из-за гипоксии активирует эритропоэз {{}}163,171,263{{}}. Снижение почечного кровотока и воздействие продуктов разрушенных Эр. обусловливает выделение почками гормона эритропоэтина, который стимулирует формирование проэритробластов, но не оказывает прямого воздействия на их дальнейшее созревание, обусловливая появление функционально неполноценных форменных элементов [171,181].
Изменения в ходе острой кровопотери поверхностно-активных свойств Эр. и других элементов крови, отложение на их поверхности фибрина и увеличение адгезивности обусловлены тканевым фактором (серотонин, норадреналин, АТФ, липопротеиды). Доказано, что в условиях нарушенной микроциркуляции, они способствуют, развитию синдрома ДВС [143,144]. Длительное усиление свободно-радикального окисления при кровопотере вызывает ряд последствий: повреждение мембранных липидов, липопротеидов и белков, инактивацию ферментов, подавление деления клеток [129,138,276].
Таким образом, возникающие при острой кровопотере изменения в организме — многокомпонентные и каскадные. Они проявляются в нарушении количественного соотношения ОЦП и ГО, изменении реологических свойств крови, гемокаогуляции, качественной трансформации отдельных форменных элементов, извращении гемопоэза, органно-тканевых нарушений. Вот таков краткий очерк о патофизиологии острой кровопотери.
Итак, трудно переоценить значимость острой, тем более массивной, кровопотери на исход у хирургических больных. Ю.В.Буйденок (2005) подчеркивает тот факт, что в настоящее время, появилась тенденция, когда хирурги, стремясь оказать радикальную помощь больным, все чаще применяют обширные, чрезвычайно сложные и травматичные операции {{}}37{{}}. Между тем, в этих случаях больные теряют большое количество крови, а массивная кровопотеря, как известно, чревата опасными последствиям{и{}} 37,55{{}}.
По мнению многих исследователей, в любом случае, такой исход следует рассматривать как недостаточность анестезиолого-реанимационного обеспечения на операционном столе {{}}57,61,72,87{{}}. Между тем, в теории ИО ИТТ существуют полярные мнения о пользе и вреде гемотрансфузий и аутогемотрансфузий. Естественно, возникает вопрос о целесообразности использования того или иного метода экстренного восполнения кров{и{}} 99,103,123{{}}.
В настоящее время во всем мире происходит пересмотр концепции гемотрансфузии. Ю.В.Буйденок (2005) считает необходимым создать рабочую анестезиологическую концепцию обоснования основных причин патофизиологических расстройств при выполнении расширенных комбинированных хирургических вмешательств у больных и выявить у них группы высокого анестезиологического риска {{}}37{{}}.
По мнению многих исследователей, исключительно важное значение приобретает разработка методов ИО РИК, которого следует рассматривать в качестве эффективной технологии анестезиолого-реанимационной защиты пациента в целях предотвращения у них целого ряда тяжелых осложнений, как в момент операции, так и после нее {{}}24,33,48,61{{}}. Причем, по сообщениям ряда авторов, при возникновении массивной кровопотери принципиальное значение имеет интенсивность и продолжительность кровотечения, приводящие к массивной или сверхмассивной кровопотер{и{}} 46,49,92,102{{}}.
Д.П.Доев (2006) считает, что высокий уровень летальности у больных с кровопотерей в 75% случаев связан с неустраненной гиповолемией, а значительный процент осложнений, является следствием неадекватного восполнения кровопотери по качественному составу. Поэтому в современных условиях ведущее место в комплексе лечения кровотечений занимает адекватная программа ИО ИТТ {{}}цит. — В.А.Журавлев, 2007{{}}.
А.В.Шаталин (2004) полагает, что на современном этапе развития хирургии, анестезиологии, трансфузиологии сформированы уже устоявшиеся традиции по восполнению кровопотери, возникающей в ходе оперативного вмешательства и в раннем послеоперационном периоде {{}}182{{}}. Многие авторы отмечают, что в настоящее время идет активное преодоление представлений об абсолютной необходимости переливания препаратов донорской крови при целом ряде оперативных вмешательст{в{}} 21,24,30,37,49,62,222,232{{}}.
Многие годы считалось, что у хирургических больных в определении показаний к гемотрансфузии главным критерием было наличие операционной кровопотери {{}}71,86{{}}. Даже установилась достаточно долгая традиция, что объем переливаемой крови и эритроцитарных компонентов должна определяться формулой «капля за каплю{»{}} 99,103{{}}. Начиная с 70-х годов ХХ в. решение о трансфузии Эр. в основном базировалось на правиле «100: 30», согласно которого, если концентрация Hb у больного снижается до уровня <100 г/л и величина Ht <30%, то необходимость трансфузии считалось очевид{н{}}ой 104,111,114, 192{{}}.
Последующая жизнь и практика показало, что применение донорской крови и ее компонентов связано со значительными потенциальными опасностями развития самых разнообразных осложнений: посттрансфузионная иммуносупрессия, нарушение функции ССС, легких, печени и почек, передача инфекций и пр. {{}}36,54,64{{}}. Тем не менее, до сих пор при одинаковых этиологических факторах кровопотери в различных медицинских центрах США и Европы частота применения гемотрансфузий до сих пор, колеблется в пределах в широких пределах. В частности, в 51—100% случаев пересадки органов, 11—76% случаев гастродуоденальных кровотечений, 36—97% случаев артропластики тазобедренного или коленного сустав{а{}} 200,221{{}}.
К.А.Сагаева (2006) пишет, что аллотрансфузию следует рассматривать как трансплантацию реципиенту чужеродной ткани. {{}}147{{}}. Многие авторы, обсуждая недостатки донорской крови, указывают на два основных фактора: 1) Чужеродность ее белковой структуры, вызывающая иммунологические реакции для организма реципиента; 2) Консервация цельной крови или эритромассы, приводящие к негативным изменениям их свойств. Так или иначе, консервированная донорская кровь в принципе не способна выполнять свои функции с той же эффективностью, которую можно ожидать от аутокрови пациента, — таково мнение многих исследователей [21,24,30,37,49,62].
Ряд авторов изучили пригодность донорской крови для гемотрансфузии и установили, что во время хранения Эр. теряют до 96% 2,3-дифосфоглицерата, что сопровождается повышением сродства Hb к О2 и смещением кривой диссоциации оксигемоглобина влево [36,54,229]. По мнению ряда исследователей, считается доказанной тот факт, что Hb Эр. донорской крови долгих сроков хранения, на протяжении 4 ч. после гемотрансфузии не способен отдавать О2 тканям. Оказывается, что свои функции Эр. полностью восстанавливают лишь в суточные сроки [64, 124].
Установлено, что общая приживаемость донорских Эр. разных сроков хранения тоже различна: наиболее жизнестойкие Эр. В частности, в сроки хранения <5 суток, 22% количества Эр. выключается из кровообращения, тогда как при больших сроках выключается около 50% [71,87,100]. Считается доказанной тот факт, что при хранении в донорской крови постепенно снижается кислотность, нарастает К+, количество микросгустков, наступает критическая недостаточность количества факторов свертывания [113,115,143,276].
Таким образом, вышеуказанные факты свидетельствуют о необходимости ограничить использование донорской крови, а в идеале полностью отказаться от нее. Каковы основные мотивы для пересмотра классических показаний к гемотрансфузии? По мнению, абсолютного большинства исследователей, это, прежде всего, использование искусственных заменителей крови, а также использование аутокрови пациента [123,146,150,174,234].
А.В.Ложкин (2005) считает, что использование параметра «учтенная кровопотеря», оцениваемого в СДЭ позволяет объективно отражать степень тяжести кровопотери и на количественной основе адекватно компенсировать дефицит ГО эритроцитсодержащими средами {{}}103{{}}.
Б. Н. Шах (2006), основываясь на результатах изменений гомеостаза, попытался создать алгоритм базисной и дополнительной программ ИО ИТТ. Программа учитывает фазовый характер гемостаза. В фазе гипоперфузии ИО ИТТ направлена на скорейшее восстановление висцерального кровообращения и транспорта О2, а в фазе стабилизации — на улучшение параметров системной гемодинамики и ликвидацию последствий системной гипоксии {{}}181{{}}.
Е.В.Гутова (2005) считает, что интраоперационное резервирование аутокрови, как компонент нормоволемической гемодилюции, не оказывает отрицательного влияния на функцию систем жизнеобеспечения: кровообращения, кислородного обеспечения организма, гемостаза {{}}59{{}}. При операциях с потенциально большой кровопотерей метод дает возможность обойтись без донорской крови, предотвратить развитие вторичного иммунодефицит-ного состояния, снизить количество послеоперационных гнойно-воспалитель-ных осложнени{й{}} 59{{}}.
Целый ряд авторов акцентируют внимание на потенциальную эффективность ИО РИК [24,29,48,73]. По сводным данным, метод имеют следующие преимущества: исключается опасность гемотрансфузионных осложнений на основе несовместимости; уменьшается риск аллоиммунизации и опасность заражения реципиента инфекционными, вирусными, паразитарными заболеваниями; отмечается повышенный лечебный антианемический эффект; отсутствует иммунодепрессивный эффект трансфузии {{}}34,81,99{{}}.
В экстренной хирургии ИО РИК применяется при целом ряде хирургических вмешательств с хорошим результатом. Есть большой опыт ИО РИК при разрывах селезенки, печени, почек, при нарушенной внематочной беременности, при операциях на крупных сосудах, на органах грудной клетки [29,48,81].
Опыт и оценка эффективности ИТТ отражены во многих монографиях Е.Н.Кобзева (2002) пишет о том, что ИТТ, безусловно, является неотъемлемой составляющей современной интенсивной терапии критических состояний {{}}83{{}}. Наиболее приемлемым из всех видов аутотрансфузий в неотложной хирургии является традиционная ИО РИК при экстренных оперативных вмешательствах, закрытой травме груди и живота, проникающих ранениях грудной и брюшной полостей, сочетанной травме, нарушенной трубной беременност{и{}} 84{{}}.
По мнению большинства исследователей, для крови, собираемой во время операции по поводу внутриполостных кровотечений, характерны минимальные морфологические и биохимические сдвиги. Такая кровь мало, чем отличается от донорской крови трехнедельной консервации. В частности, характерно некоторое уменьшение количества Эр. и тромбоцитов [36,124,140,222].
Безусловно, разрушение форменных элементов зависит от гемолитического воздействия серозных оболочек и, главным образом, от механической травмы во время сбора крови [140,144]. Само по себе разрушение части Эр. не обесценивает аутокровь, поскольку оно не превышает 25% их общего количества [146,162]. Немедленное же введение этой крови в сосудистое русло позволяет не только улучшить гемодинамику, но и восстановить транспорт О2 к тканям, снизив тем самым степень развивающейся гипоксии [36,124].
Как считают некоторые исследователи, повышенное содержание в плазме крови свободного Hb, связанное с разрушением Эр., не превышает предельно допустимых значений и практически не сказывается на функции почек [36,124,163,255]. Надо отметить, использование в комплексе ИО ИТТ введения кристаллоидов, ощелачивания плазмы крови и сохранение адекватного диуреза поможет избежать скопления и задержку кристаллов Эр. в почечных канальцах [171,172].
Оказывается, лейкоциты аутокрови мало подвергаются разрушению, их количество остается в пределах физиологической нормы, что обеспечивает более высокие бактерицидные свойства реинфузированной крови по сравнению с консервированной [71,85]. По сводным данным, кровь, излившаяся в серозные полости при повреждениях груди и живота (если нет нарушения целостности полых органов брюшной полости) — стерильна [99,103]. Это объясняется ее высокими бактерицидными свойствами из-за высокого содержания свежих лейкоцитов.
Считается доказанной, что аутокровь сохраняет также нормальный электролитный и белковый состав. Изменения сводятся к гиперкалиемии, которая возникает в связи с разрушением форменных элементов крови, когда К+ и Эр. переходит в плазму [110,123].
Ряд исследователей установили, что для аутокрови характерно либо полное отсутствие фибриногена, либо резкое снижение его уровня, вследствие чего она не свертывается [55,62,242]. Нужно заметить, что дефибринирование в значительной степени обусловлено ее контактом с серозными оболочками. Биохимический механизм этого явления заключается в том, что плевра содержит активатор и проактиватор плазминогена, которые обеспечивают образование плазмина и процесс фибринолиза [36,81].
В виду вышеуказанного обстоятельства, для предупреждения острого фибринолиза и, связанной с ним кровоточивости, авторы рекомендуют профилактическое внутривенное введение эпсилон-аминокапроновой кислоты [91,143]. Между тем, по мнению ряда авторов, ИО РИК возможна даже при кровопотерях, связанных с острым нарушением свертываемости [93,143]. Оказывается, метод не вызывает дополнительных нарушений гемостаза.
ИО РИК противопоказана лишь при гемолизе крови вследствие длительного пребывания в полостях, при сопутствующем повреждении полых органов и при выраженных воспалительных процессах, при которых возможно инфицирование крови [147,155]. Достоинства ИО РИК особенно ощутимы при оказании помощи больным с торакальными повреждениями. Если при абдоминальных травмах необходима ревизия органов брюшной полости, чтобы убедиться в целостности полых органов, то при повреждении груди это условие отпадает [174,194].
Многие авторы отмечают положительный клинический эффект ИО РИК, в то же время, не исключая возможных осложнений [15,19,34,53,247]. Производимая многими авторами упрощённая обработка крови (сбор и реинфузия цельной крови) имела множество побочных эффектов из-за трансфузии лизированных Эр., когда имеет место повышение уровня свободного Hb, первичной активации свёртывания либо фибринолиза [46,72].
Таким образом, проблема ограничения использования донорской крови путем использования аутокрови пациента в настоящее время решается 4 основными путями: 1) Предоперационная заготовка крови пациента; 2) Острая нормоволемическая гемодилюция; 3) Интраоперационный забор крови из операционной раны с дальнейшей РИК; 4) Послеоперационный забор крови из дренажей с ее обработкой и РИК [83,84].
И.Н.Сандакова (2005) разработала и научно обосновала двухэтапный способ заготовки препаратов аутокрови в объеме 20% ОЦК за 5—7 дней до операции. Установлено, что способ дооперационной заготовки препаратов аутокрови уменьшает объем послеоперационной геморрагии и в 60—70% случаев позволяет отказаться от гомологичных гемотрансфузий {{}}150{{}}.
Общеизвестно, как самостоятельный метод восполнения операционной кровопотери, предварительно заготовленной аутокровью, в хирургической практике используется уже давно, но широкого распространения не получил. До настоящего времени существуют определенные разногласия, как в определении оптимального объема заготовки аутокрови, так и в отношении возрастных границ, где можно использовать данный кровесберегающий метод {{}}167,171,172{{}}.
И.Н.Сандакова (2005) считает, что модифицированная тактика ИТТ с использованием компонентов аутокрови во время оперативного вмешательства и в раннем послеоперационном периоде является эффективной кровесберегающей методикой, которая позволяет в 90% случаев исключить использование препаратов донорской крови {{}}150{{}}.
Однако, как пишут ряд исследователей, методы традиционной ИО РИК не позволяют избежать введения пациенту микросгустков, биологически активных веществ, активирующих систему гемостаза, способствующих развитию ДВС-синдрома, а также в ряде случаев, не исключена возможность бактериального загрязнения реинфузируемой крови {{}}36,124,140{{}}.
Безусловно, сказанное выше определяет необходимость использования аппаратов для фракционирования крови с отмыванием, которые, кстати, нашли широкое применение за рубежом {{}}15,38,62,212,234,241,245{{}}. Большой опыт использования аппаратной ИО РИК накоплен и в отечественной хирургической практике. Е.Н.Кобзева (2002) разработала дифференцированную тактику интраоперационного фракционирования полостной и раневой аутокров{и{}} 83{{}}.
Э.С.Нунаева (1997) на основании результатов лабораторных и клинических исследований представила преимущества и возможности применения ИО РИК аппаратным способом при выполнении кесарева сечения, позволяющей в 99,6% случаев сохранить ультраструктуру и функциональные способности Эр. [цит. — Е.Н.Кобзева, 2002]. Е.Н.Кобзева упоминает, что электронно-микроскопические исследования Э.С.Нунаевой (1997) показали, что Эр., использованные для ИО РИК и полученные способом аппаратной обработки, обладают нормальными структурно-функциональными свойствами, что делает их способными к полноценному функционированию после ИО РИК [84].
По сводным данным, доказано уменьшение времени стабилизации гемодинамических показателей крови и улучшение показателей КЩС, объемного транспорта О2, более быстрое восстановление показателей Hb, количества Эр. и ОЦК в раннем послеоперационном периоде [24,36,71,124,140].
ИО РИК при кесаревом сечении показана при кровопотере> 700 мл у женщин группы высокого риска развития кровотечений (предлежание и отслойка плаценты, варикозное расширение вен матки, гемангиома органов малого таза и др.), а также при расширении объема оперативного вмешательства (консервативная миомэктомия, надвлагалищная ампутация и экстирпация матки) [24].
И.В.Богомазовой (2005) разработана тактика проведения ИО РИК аппаратным способом во время кесарева сечения. В конструкциях аппаратов нового поколения предусмотрен режим высококачественной отмывки Эр. большим количеством раствора, делающим процедуру безопасной [24].
Как известно, медицинская технология аппаратной ИО РИК проводится с учетом макроскопической оценки излившейся крови, времени ее нахождения в серозной полости или операционной ране, характера травмы и тактики оперативного вмешательства. Установлено, что трансфузионная среда — клеточный компонент аутокрови — не содержит включений, примесей и биологически активных веществ, которые могли бы при переливании больному неразделенной аутокрови, существенно изменить систему гомеостаза и вызвать ятрогенные осложнения {{}}49,54{{}}.
Е.Н.Кобзевой (2002) разработан и внедрен в практику ИО ИТТ, включающая клеточный компонент аутокрови, объем которой в 1,4—1,8 раза превышает величину учтенной кровопотери. Ее основной составляющей являются кристаллоиды и коллоиды (55—60%), а эритроцитсодержащие среды не превышают 20—27% {{}}83,84{{}}.
Автором введен новый параметр — «учтенная кровопотеря», который оценивается в СДЭ {{}}83{{}}. Такой подход в практике ИО ИТТ позволил объективно отражать степень тяжести кровопотери, на количественной основе адекватно компенсировать дефицит ГО эритроцитсодержащими трансфузион-ными средами и проводить сравнение различных трансфузионных програм{м{}} 84{{}}.
По данным Е.Н.Кобзевой (2002), адекватное интраоперационное восполнение аутотрансфузионными средами большой, массивной и смертельной кровопотери у больных и пострадавших позволило, в среднем, в 33% случаев полностью исключить, а в 67% значительно уменьшить применение компонентов аллогенной крови {{}}83,84{{}}.
И.В.Богомазова (2005) пишет о том, что трансфузиологическая программа кровесберегающих технологий должна включать различные варианты предоперационной заготовки компонентов аутокрови, управляемую интраоперационную гемоделюцию, ИО РИК. Они способствуют быстрой нормализации в послеоперационном периоде состояния параметров периферической и центральной гемодинамики, системы гемостаза, гемограммы и биохимических показателей крови {{}}24{{}}.
В настоящее врем, появились современные, высокотехнологичные методы ИО РИК, которые позволяют устранить риск развития осложнений обусловленных ИО РИК {{}}55,73{{}} Тем не менее, многие авторы подчеркивают неоднозначную безопасность аутотрансфузии, считая, что требуется более детальное исследование проблемы ИО РИ{К{}} 81,115{{}}.
По мнению К.А.Сагаевой (2006), ИО РИЭ по сравнению с другими методами трансфузии в меньшей мере оказывает негативное влияние на гомеостаз пациенток, не вызывает усугубления тяжести ДВС, имеющего место у больных с массивной кровопотерей {{}}147{{}}. По ее мнению, метод достоверно значимо влияет на состояние системной гемодинамики (снижение ЧСС на 21,4%, повышение АД на 20,6%, увеличение СИ — на 31,1%, снижение ОПСС — на 21,5%) и КОС (нормализация Ph-крови и емкости буферной системы{){}} 147{{}}.
Исследователи, занимающиеся проблемой ИО РИК отмечают, что в процессе контактирования с воздухом происходит полная оксигенация излившейся крови, ее рН приближается к рН системной крови [157,171,225]. Кроме того, подчеркивается то, что аутотрансфузируемая кровь, в отличие от донорской, не депонируется. То есть, кровь включается в русло циркуляции, а при этом эффективнее нормализует кислородно-транспортная функция крови [172].
Исследователи неоднократно заявляли о том, что излившаяся кровь незначительно отличается по составу от циркулирующей в сосудистом русле [171,174]. Восстановление показателей Hb, Эр., ОЦК происходит быстрее, чем при использовании донорской крови. Установлено, что реинфузируемые Эр. обладают нормальной продолжительностью жизни, мало секвестрируются в селезенке [61]. С другой стороны, для крови, собранной из серозных полостей, характерно почти полное отсутствие фибриногена, повышение тромбопластической и фибринолитической активности [65,84].
Кровь, излившаяся в грудную или брюшную полость, безусловно, контактирует с серозными оболочками и тканями раны. Установлено, что в излившейся крови концентрация тромбоцитов снижено, в среднем на 16%, а Эр. — в 2,6 раза [86,93]. Доказано, что содержание Hb снижено на 5—10%, минимальная осмотическая резистентность Эр. уменьшается до 0,62 NaCl, а уровень 2,3-дифосфоглицерата в реинфузируемой крови, зачастую оказывается в норме. В целом, такая кровь обеспечивает достаточную оксигенацию тканей [36,100].
По данным литературы электролитный состав собираемой крови мало чем отличается от состава электролитов циркулирующей крови. Имеется небольшое повышение концентрации К+, что, вероятно, связанно с гемолизом [110,114]. В целом, для крови, собираемой во время операции по поводу полостного кровотечений, как правило, характерны минимальные морфологические и биохимические сдвиги [36,122]. Итак, такая кровь является полноценным резервом для возмещения массивной кровопотери.
Таким образом, на фоне того, что идет кардинальный пересмотр вопросов трансфузии крови, к сожалению, до сих пор, ИО РИК относится к числу еще недостаточно разработанных методов коррекции острой кровопотери. Причем, в технологическом отношении многие вопросы, включая сбор, очистка и само по себе ИО РИК решены.
К сожалению, ряд патофизиологических феноменов, связанных с морфологическими, физколлоидными, биохимическими и коагулографическими изменениями излившейся крови не обоснованы. В особенности, когда речь идет о массивных и поздних ИО РИК. Именно этот момент является сдерживающим фактором для широкого, безопасного применения этого метода. В этом плане, кровь, излившаяся в грудную или брюшную полость, безусловно, контактирует с серозными оболочками и различными тканями, в результате чего происходят те или иные изменения, что, конечно же, отразятся на физико-химическом ее состоянии, что принципиально важно учитывать при проведении ИО РИК.
Технику «отмывания» крови применили многие зарубежные и российские ученые. Основной частью аппарата для ИО РИК — это центрифуга, с помощью которой переливаемая кровь очищалась от лизированных Эр., свободного Hb, антикоагулянтов, активированных факторов свёртывания, внеклеточного К+, миоглобина, частиц кости, жира и клеточного детрита {{}}15,38,62,212,234{{}}.
Все авторы солидарны в том, что аппаратное усовершенствование процедуры сделали ИО РИК значительно более безопасной. В 90-х гг. XX в. была разработана уникальная проточная непрерывная система для ИО РИК с сепарационной камерой, работающей в непрерывном режиме и позволяющей одновременно сепарировать и отмывать эритромассу [87,55,124,241].
Если говорить об абсолютных и относительных противопоказаниях к ИО РИК следует привести следующие сведения. По решению 25-го съезда Международного трансфузиологического общества, абсолютным противопоказанием к ИО РИК является наличие в излившейся крови: гноя; содержимого толстого кишечника; веществ, противопоказанных к введению в сосудистое русло [86].
Дискуссионным вопросом являются особенности и ограничения ИО РИК у больных с различными заболеваниями крови [37,240]. Относительными противопоказаниями для ИО РИК считаются примесь амниотической жидкости, содержимого тонкого кишечника, онкология, когда решение о возможности использования ИО РИК принимается хирургической бригадой в коллегиальном режиме [46,49,55].
Общеизвестно, что наиболее распространёнными возможными недостатками отмытой эритромассы являются наличие разрушенных Эр., бактериальная контаминация, попадание загрязняющих частиц и жидкостей из операционной раны, невозможность длительного хранения [62]. Отмытая эритромасса не активирует плазматические факторы свёртывания, но, тем не менее, существуют сообщения о серьезных нарушениях гемостаза у больных, которым проводилась ИО РИК [87,93,256].
Авторы объясняют их присутствием конгломератов из лейкоцитов и тромбоцитов при неправильно выбранном режиме обработки эритромассы [99,115]. Ряд авторов, с целью профилактики попадания лейкоцитарных и тромбоцитарных конгломератов, рекомендуется применение на выходе современных лейкоцитарных фильтров {{}}113,123,244{{}}.
По мнению исследователей, результатом недостаточной обработки эритромассы может также быть наличие в ней примеси гепарина, используемого для стабилизации крови [86,123]. При переливании такой крови у больного возможно развитие гипокоагуляции [146]. В настоящее время доказано, что система свертывания и фибринолиза крови, собираемой во время операции из серозных полостей, претерпевает существенные изменения, связанные с гипо- или афибриногенемией, тромбоцитопенией, резким повышением тромбопластической активности и увеличением активности фибринолизина [36,124,172].
По сообщениям ряда авторов, уменьшение концентрации фибриногена и количества кровяных пластинок отчасти, по-видимому, связано с потреблением их в процессе свертывания в полости, а отчасти — с разрушением в аспирационной системе [36,172]. Между тем, увеличение тромбопластической активности, вероятно с одной стороны, является следствием попадания в собираемую кровь тканевых факторов из поврежденных в ходе вмешательства тканей, а с другой стороны, может быть результатом гемолиза [124,194].
Известно, что в Эр. содержатся факторы, которые, высвобождаясь при гемолизе, способны сокращать время свертывания нормальной крови и время рекальцификации нормальной плазмы [36,124]. Экспериментально установлено, что после ИО РИК возникает умеренная гипокаогуляция крови и рекальцификация плазмы, снижении протромбиновой и тромбопластической активности, снижении толерантности к гепарину увеличении фибринолитической активности [36,172].
По мнению некоторых авторов, ИО РИК на фоне гипокаогуляции не вызывает глубоких сдвигов в системе гемостаза и не способствует развитию клинически выраженного ДВС-синдрома [61,64]. Хотя, первоначально исследователи считали, что ИО РИК высоких объемов обработанной крови и прямая ИО РИК необработанной крови вызывают каогулопатию [81,147].
В конце 60-х годов XX в. ряд авторов сообщил о ИО РИК в случае фибринолитического кровотечения. Было зафиксировано, что обратное переливание не усиливает фибринолиз [цит. — А.Т.Буланбеков, 2016]. Общеизвестно, что для коррекции подобных нарушений ряд исследователей рекомендует вливание тромбоконцентрата, а также СЗП с небольшими дозами гепарина {{}}36{{}}.
Исследователи подчеркивают, что в случаях массивной трансфузии гемолизированной эритромассы возможно развитие ОПН [145,182]. В качестве корригирующей терапии ряд авторов рекомендуют вливание щелочных растворов, диуретиков, увеличении объема инфузатов с целью удаления свободного Hb с мочой. В настоящее время предложены высокотехнологичные селл-сэйверы {{}}15,36,38,62,124, 172,212,234{{}}. По мнению ряда исследователей, эти технологии, разумеется, при условии их правильной эксплуатации, практически лишены побочных эффектов [36,62,172,230,247,258].
Так или иначе, несмотря на крайне тяжелое состояние больных с острой кровопотерей, противопоказаний к ИО РИК в экстренной хирургии практически нет. Таким образом, при отсутствии достаточного количества донорской крови и тяжелом состоянии больного, как единственно возможное средство, ИО РИК применимо даже при повреждениях полых органов.
Начиная с 2000 г., различные компании выпускают промышленные стерильные системы сбора и фильтрации раневой крови: ИГ-2, Solcotrans, Berkley, Davol и др. Эти устройства, как правило, состоят из кардиотомного резервуара с антикоагулянтом, 260—300 микронного фильтра и шланга подключения вакуум-аспиратора [182]. При этом ИО РИК происходит прямо из кардиотомного резервуара через микрофильтр без всякой дополнительной обработки крови, как правило, в объеме 200—250 мл. У больных со значительной кровопотерей объём ИО РИК может достигать 200 мл/ч, но не более 1500—2000 мл во избежание развития каогулопатий [72,81].
По сводным данным, летальность после операций, осложнившихся массивной кровопотерей, без использования ИО РИЭ составляет, в среднем 17,8%, а при использовании, в среднем 5,4% [81]. С одной стороны, использование селл-сейверов во много раз ускоряет процесс обработки, что жизненно важно при массивной кровопотере, а с другой — ультразвуковые и инфракрасные датчики аппаратов позволяют осуществлять тонкий контроль над качеством эритромассы [15,36,,212,234].
Так или иначе, современные аппараты позволяют достичь такой степени очистки эритромассы, что появилась возможность применять селл-сейверы в ситуациях, ранее числившихся в списке противопоказаний для ИО РИК: при загрязнении крови амниотической жидкостью, содержимым тонкого кишечника и пр. [38,62,124,172,259]. Главный недостаток селл-сейверов — высокая стоимость аппаратуры и расходных материалов к ней. Стоимость последних для одной процедуры ИО РИК составляет порядка 120—150 долларов США. Центрифугирование и отмывание эритромассы можно производить и без применения дорогостоящей аппаратуры [124].
Современные аппараты имеют в своём распоряжении следующий спектр режимов: 1) «Малообъёмный» — тщательная обработка (7 циклов отмывания) малых объёмов крови; 2) «Высококачественный» — тщательная обработка (7 циклов отмывания) загрязнённой крови; 3) «Качественный» — стандартная программа интра- и послеоперационной обработки (5 циклов отмывания) как раневой, так и дренажной крови; 4) «Ускоренный» — для обработки (3 цикла отмывания) чистой крови при массивной одномоментной кровопотере. Поток эритромассы — 30—70 мл/мин; 5) «Быстрый» — для обработки (1 цикл отмывания) чистой крови при массивной одномоментной кровопотере. Поток эритромассы — 50—100 мл/мин; 6) «Срочный» — максимальная скорость обработки (1 цикл отмывания). Поток эритромассы — 50—100 мл/мин; 7) «Экстренный 190» — работает как система сбора и фильтрации в ургентных случаях. Кровь только фильтруется и перегоняется из кардиотомного резервуара в мешок для РИАК со скоростью 100—190 мл/мин. Кровь не отмыта и не концентрирована; 8) «Экстренный 350» — то же самое, только скорость перегонки повышается до 200—350 мл/мин; 9) «Крио-режим» — обработка свежезамороженных Эр. с применением 20% глицерина; 10) «Непрямая сепарация» — сепарация собранной и стабилизированной крови на эритромассу, плазму и тромбомассу; 11) «Прямая сепарация» — сепарация крови из прямого венозного доступа на эритромассу, плазму и тромбомассу.
Даже в РФ только крупные клинические центры могут позволить себе использование селл-сейверов [37,62]. Там же, где аппараты для ИО РИК действительно жизненно необходимы — в стационарах экстренной помощи — они практически недоступны [55,61].
Таким образом, метод ИО РИК и ИО РИЭ с применением современных аппаратов является эффективными методами ИО ИТТ. К сожалению, технологии ИО РИЭ остаются малодоступными для широкой хирургической практики. Во многом остается неизученной специфика их использования при полостных кровопотерях. Вышеизложенное побудило нас провести целенаправленное и системное исследование, целью которого является клиническое изучение возможности применения ИО РИК, ИО РИЭ у пострадавших с травмами и ранениями органов грудной и брюшной полостей, как в комплексе медико-хирургического лечения, так и анестезиолого-реанимационного их обеспечения.
1.2. Позиции доказательной медицины по просветным кровопотерям
Общеизвестно, что современная медицина приближается к точным наукам. Причем, золотым стандартом является клиническое исследование, выполненное в соответствии с правилами ДМ (ICH-GCP) {{}}18,249,250{{}}. Общепринято, ДМ — это сознательное и последовательное применение в клинической практике технологий, в отношении полезности которых есть убедительные доказательств{а{}} 22,252{{}}. Характерной чертой ДМ является использование вероятностного подхода, а вероятность, как известно, лучше всего оценивать на основе предыдущего опыта, накопленного в отношении групп аналогичных боль{н{}}ых 43,251{{}}.
Согласно концепции ДМ, обычно формируются две группы пациентов: 1) Основная группа, подвергаемая новой тактике лечения; 2) Контрольная группа, подвергаемая стандартной тактике лечения [22,43,253,254]. По окончании исследования сравнивают эффективность воздействий в опытной и контрольной группах, проводя анализ данных. Только в случае обнаружения статистически значимой положительной разницы эффектов делают вывод о преимуществе «нового» по сравнению с обычно применяемым.
Нужно отметить, что ДМ предоставить количественную оценку, полученную на основе ККИ и научно сформированной выборки (в нашем примере: изучения параллелей ЭК и КК). Итак, ДМ — это практика получения и применения научно-обоснованных результатов медицинских исследований [47,252]. В целом, по мнению ряда авторов, проблема медицины, основанной на доказательствах, глубже, чем просто сбор, обработка и накопление информации, независимо, это экспериментальные или клинические исследования.
Касательно тематики раздела 1.1. хотелось бы изложить методологию исследования. Как известно, экспериментальные и стендовые исследования являются лишь этапом разработки той или иной технологии. В нашем примере — это результаты совместных экспериментов по патофизиологии полостной крови (Ж.А.Чынгышева, А.Т.Буланбеков), а также по характеристике крови до и после аппаратной ИО РИК различного скоростного режима (Ж.А.Чынгышева, Б.Т.Мусалиев). Методом же внедрения научных исследований в практическое здравоохранение является создание клинических руководств и протоколов ведения больных {{}}47{{}}.
Применение протоколов позволяет врачу осуществлять выбор терапии не на основании мнений и научных выкладок, а на основании ККИ, то есть доказательства [43,47]. В указанном аспекте, систематизированные обзоры представляют собой серьезные научные исследования, на основе которых, как правило, проводится обобщение и статистический анализ результатов отдельных клинико-экспериментальных либо аналитических исследований (мета-анализ) [63].
Что означает мета-анализ? Это, прежде всего, получение более стабильной оценки эффекта терапии; оценка различий между исследованиями и возможности генерализации результатов; анализ эффекта терапии в отдельных подгруппах; сравнение результатов данного исследования с другими, проводившимися по данной теме {{}}47,63,249{{}}. Мета-анализы помогают ученым: сформулировать и обосновать исследовательскую клинико-экспериментальную гипотезу; обосновать суть ККИ и оценки эффективности той или иной технологии; установить значимые факторы развития того или иного исхода заболевани{я{}} 80,89{{}}.
Достоверная информация о ККИ содержится в электронных базах данных Меdicine, Cochrane Controlled Triels Register и др. [47,89,250,252]. В настоящее время наиболее популярны Review Manager (Cochrane Collaboration), EpiInfo (6-я версия) и др. [80,251,253,254]. Нужно отметить, что рондомизированные клинические испытания, так или иначе стали вершиной методологии, лучшим стандартом КК.
Общепринято, клинические исследования могут быть ретроспективными и проспективными. В ретроспективных исследованиях оценивают уже прошедшие события. В нашем примере: аналитические исследования и экспериментальные работы наших коллег — А.Т.Буланбекова, Б.Т.Мусалиева, Н.А.Мамажусупова. В проспективных исследованиях вначале составляется план исследования, устанавливается порядок сбора и обработки данных, а затем проводится исследование по этому плану [36,124,109]. В нашем примере: наши ККИ на основе выявления параллелей КК и ЭК.
Понятно, что в полной мере ККИ являются проспективные исследования. Именно исследования такого порядка обеспечивают качество доказательств предыдущих и нынешних исследований в комплексе и во взаимосвязи [80,89]. В нашем примере: период 1998—2006 гг. (1-й период) и 2007—2017 гг. (2-й период).
Согласно принципов ДМ при анализе полученных результатов исследований применяют шкалу оценки доказательств [43,47]: А — доказательства убедительны; В — относительная убедительность; С — достаточных доказательств нет, но могут быть даны рекомендации; D — достаточно отрицательных доказательств; Е — веские отрицательные доказательства.
Приступая к непосредственном обзору позиций ДМ в отношении тактики хирургов и анестезиологов-реаниматологов при острой просветной кровопотери хотелось бы прояснить следующую методологию исследований. Нами изучена сравнительная эффективность активной и выжидательной хирургической тактики при ЯБ ДПК, осложненной просветной кровопотерей по результатам систематического анализа и мета-анализа.
В разделе 1.2. изложены результаты систематического анализа тематической литературы, включающих 154 источников (89 русскоязычных и 65 — иностранных) и мета-анализ (количественный синтез информации) данных, представленных в диссертациях и монографиях (соответственно, 48 и 20). Задачей было проанализировать разброса мнений по статистике заболевания и, главным образом, стратегии применения той или иной хирургической тактики (активной и выжидательной) при ЯБ ДПК, осложненной просветной кровопотерей.
В диссертации М.Г.Абакирова (1999) {{}}цит. — А.Ж.Мусалиев, 2010{{}} уже констатировалось тот факт, что количество больных с ЯБ ДПК, осложненной просветной кровопотерей приобрела тенденцию неуклонного роста. За последние пять лет, утверждает диссертант, число пациентов увеличился более чем в два раза, по сравнению с началом 1990-х годо{в{}} 124{{}}.
В следующем десятилетии, по мнению другого диссертанта (И.О.Абуладзе, 2009) частота госпитализации больных с ЯБ ДПК, осложненной просветной кровопотерей в хирургический стационар за период 1998—2008 гг. не имела тенденции к снижению. Диссертант отмечает, что в последние 5 лет чаще наблюдалось скрытое и в то же время более агрессивное течение ЯБ, которая склонна впервые проявляться профузным ДК {{}}4{{}}.
А.В.Яковченко (2009) сообщает о том, что частота госпитализации пациентов с ЯБ ДПК, осложненной просветной кровопотерей в хирургический стационар, оказывающий неотложную хирургическую помощь, за последние 11 лет не уменьшается. Диссертант подчеркивает, что за последние 5 лет отмечено скрытое и более агрессивное течение ЯБ ДПК {{}}192{{}}.
По мнению многих авторов, занимающихся данной проблемой, лечение пациентов с ЯБ ДПК, осложненной просветной кровопотерей продолжает оставаться одной из самых актуальных проблем современной ургентной хирургии по целому ряду причин. В частности, составляя до 60—80% от всех геморрагических осложнений заболеваний пищеварительного тракта, дуоденальное кровотечение язвенной этиологии и сегодня сопровождаются достаточно высокой летальностью. Об этом сообщают И.И.Затевахин (2001), В.К.Гостищев (2005), А.В.Алекберзаде (2003), А.Р.Андреасян (2006), Х.М.Авад (2009), Barkun, A.N. et al. (2003), Jensen, D.M. (2003), Kang J.Y. et al. (2006) и др. {{}}5,8,13,51,74, 207,208,217{{}}.
По данным диссертационного исследования А.В.Яковченко (2009): 1) у 51,8% больных отсутствовал язвенный анамнез; 2) 34,9% пациентов составили лица пожилого и старческого возраста; 31,4% больных представлены женщинами; у 8,2% больных были сочетанные язвы желудка и ДПК {{}}192{{}}.
По данным кыргызских ученых, в числе которых М.М.Мамакеев и соавт. (2001, 2010), Э.У.Алыбаев (2003), К.К.Исмаилов (2007), несмотря на внедрение новых антисекреторных препаратов, вызывающих значительное снижение желудочной секреции и методов эрадикации Helicobacter pylori и в КР наблюдается увеличение заболеваемости и осложнений ЯБ в виде просветной кровопотери {{}}12,79,105{{}}.
По сводным данным ученых-гастроэнтерологов стран СНГ, показатели общей и, особенно, послеоперационной летальности остаются высокими и не имеют тенденции к снижению. Об этом можно проследить по материалам и резолюциям многих хирургических форумов на территории стан СНГ {{}}5,9,11,16,39,51{{}}.
Исследованиями Ю. М. Панцырева (2000), И.И.Затевахина (2001), В.К.Гостищева (2005) установлено, что показатели общей и послеоперационной летальности у больных с ЯБ ДПК, осложненной просветной кровопотерей, колеблются в пределах 5,2—6,1% и 9,1—11,2%, соответственно {{}}51,52,74,{{}}. По данным А.С.Ермолова (2007) в среднем уровень общей и послеоперационной летальности при ЯБ ДПК, осложненной просветной кровопотерей составил 6,8% и 15,2%, соответственн{о{}} 69{{}}.
В связи с изложенным выше, несмотря на то, что многие вопросы лечебной тактики при ЯБ ДПК, осложненной просветной кровопотерей сегодня уже детально разработаны, значительная часть тактических положений остается по-прежнему не разработанной и спорной. Об этом сообщают А.В.Алекберзаде (2003), А.Р.Андреасян (2006), Х.М.Авад (2009) и др.{{}}5,8,13{{}}.
На наш взгляд, то обстоятельство, что связано с выраженной разнородностью контингента больных, госпитализируемых по поводу ЯБ ДПК и сложностью определения некоего универсального тактического подхода при язвенных ДК, разнородность методов оценки и прогнозирования обуславливает интерес теоретиков и клиницистов. Об этом говорили в свое время В.Н.Антонов (2006), В.М.Воробьев (2006), А.В.Климашевич (2007) {{}}14,45,82,{{}}.
Безусловно, во многих исследованиях говорилось о том, что при рассмотрении проблемы ЯБ ДПК, осложненной просветной кровопотерей необходимо принятия во внимание фактов значительной разнородности пациентов по возрасту и выраженности сопутствующей патологии, различной тяжести кровопотери, наконец, различной этиологии язв. Ссылаемся на сообщение А.К.Кутманбекова (2002 {{}}97{{}}.
В большинстве публикаций по проблеме ЯБ ДПК, осложненной просветной кровопотерей особое место отводится обсуждению особенностей клинического течения, возможностям и результатам лечения у пациентов разных возрастных групп. Сказанное можно проследить по данным М.А.Евсеева (2005), К.К.Исмаилова (2007) и др. {{}}66,79{{}}.
Традиционно наибольшее число вопросов возникает при обсуждении проблемы ЯБ ДПК, осложненной просветной кровопотерей у пациентов пожилого и старческого возраста. Ссылаемся на результаты исследований А.В.Алекберзаде (2003), А.Р.Андреасян (2006), Х.М.Авад (2009) и др.{{}}5,8,13{{}}. Авторы едины во мнении о том, что, несмотря на используемые различные варианты лечебной тактики, летальность при язвенных ДК остается высокой, особенно в пожилом и старческом возрасте, достигая у оперированных больных величины 25% и выше.
В этой связи актуальным и потенциально значимым для клиники представляется исследование, имеющее своей принципиальной задачей определение особенностей клинического течения ЯБ ДПК у больных с различными факторами риска. В частности, сроки выполнения операций, степень кровопотери и, конечно же, возрастной аспект проблемы.
На наш взгляд, важно дать верную оценку непосредственных результатов лечения пациентов с ЯБ ДПК, осложненной просветной кровопотерей при различных тактических подходах, но с учетом вышеперечисленных факторов риска. В противном случае, на результат оценки окажет влияние тот самый неучтенная разнородность клинического и статистического материала.
В.Ю.Алмазкин (2000) утверждает, что кровотечения из язв ДПК являются самым тяжелым осложнением, встречающимся у 15—20% больных ЯБ{{}} Кровотечение язвенной природы составляет 45—58% от всех желудочно-кишечных кровотечени{й{}} {1{}}1{{}} У мужчин язва желудка или ДПК является причиной кровотечения в 92%, а у женщин — в 62% случаев
По данным В.Н.Антонова (2006) наиболее часто массивные, угрожающие жизни ДК встречаются из каллезных язв заднемедиального отдела луковицы ДПК, что связано с особенностями кровоснабжения этой области{{}} Кровотечение из язв ДПК встречается в 4—5 раз чаще, чем из язв желудк{а{}} {1{}}4
В.М.Воробьев (2006) подчеркивает такую особенность кровоточащей язвы ДПК. Язвенные ДК часто бывают упорными или повторяются через короткие промежутки времени, причем с нарастающей интенсивностью, что приводит к массивной кровопотере {{}}45{{}}{{}} По мнению диссертанта, это сопровождается неудовлетворительными результатами как консервативного, так и оперативного лечения, особенно при запоздалых вмешательствах.
С.В.Голубев (2000) сообщает, что летальность при тяжелой кровопотере может достигать 10—50%{{}} По его мнению, факторами риска неблагоприятного исхода язвенного кровотечения являются: объем и темп кровотечения; возраст> 65 лет; повторное кровотечение в условиях стационара; сопутствующие заболевани{я{}} {5{}}0.
По мнению В.Н.Антонова (2006), В.М.Воробьева (2006), А.В.Климашевича (2007), А.Е.Борисова и соавт. (2008), Brehant О. et al. (2008), Kang J.Y. и соавт. (2006) и др., наиболее частым и грозным осложнением ЯБ ДПК является профузное кровотечение с острой, массивной кровопотерей {{}}14,26,50,82,222,236,238{{}}.
По данным авторов, в последние годы увеличивается количество пациентов с кровоточащими язвами ДПК, в том числе больных пожилого и старческого возраста. Многие авторы из числа клиницистов, так как В.К.Гостищев и соавт. (2007), И.А.Наумов (2003), Barkun, A.N. et al. (2003), Jensen D.M. (2003), Kang J.Y. et al. (2006) отмечают, что до настоящего времени остаются нерешенными вопросы выбора тактики и способов лечения язвенных кровотечений {{}}51,128,227,237,239{{}}.
В.Г.Вербицкий и соавт. (2004), И.В.Мельник (2007) и др. отмечают, что в настоящее время наблюдается большое разнообразие тактики лечения больных с язвенными кровотечениями — от консервативно-выжидательной до активно-агрессивной. По их мнению, вопросы о показаниях к оперативному лечению подобных больных продолжают дискутироваться {{}}40,117{{}}.
Таким образом, проблема хирургического лечения профузных язвенных ДК продолжает оставаться актуальной. Это диктует необходимость совершенствования хирургической лечебной тактики, уточнения роли консервативного и оперативного лечения, усовершенствования показаний, выбора сроков выполнения и объема оперативных вмешательств в различных клинических ситуациях.
С.В.Голубев (2000), М.А.Евсеев (2005); О.А.Краснов (2009) и др. утверждали, что число сочетанных осложнений ЯД ДПК (перфорация язвы и кровотечение; двойная локализация язв; сочетание перфорации язвы или кровотечения с пенетрацией в поджелудочную железу или малый сальник; сочетание осложнений с пилородуоденальным стенозом; сочетание всех осложнений — перфорации язвы, кровотечения, пенетрации и стеноза) увеличивается {{}}50,66,94{{}}.
Такая тенденция становится критической в настоящее время, о чем пишут Э.С.Варданян (2008), И.О.Абуладзе (2009) и др. {{}}4,39{{}}. По их мнению, в этой ситуации наиболее неблагоприятен вариант множественных кровоточащих язв или сочетание кровотечения из язвы желудка с язвой ДПК{{}} Вопрос о выборе метода операции в таких случаях следует решать индивидуально в зависимости от состояния больного, характера язвенного процесса, интенсивности кровотечения и степени кровопотери.
Различают экстренные операции, которые выполняют в первые часы, ранние операции — в течение первых 1—5 суток от начала кровотечения после стабилизации гемодинамики и плановые операции — через 2—4 недели после остановки кровотечения и проведения курса консервативной противоязвенной терапии. Об этом утверждают В.Н.Антонов (2006), А.В.Климашевич (2007), Garnett, W.R. (2003) и др. {{}}14,82,248{{}}.
В связи с новыми технологиями лечения, многие авторы, в числе которых В.Н.Антонов (2006), А.В.Климашевич (2007), Garnett, W.R. (2003), Barkun, A.N. et al. (2003), Jensen D.M. (2003), Kang J.Y. et al. (2006) отмечают тот факт, что изменилась сама концепции хирургического лечения больных с ЯБ ДПК, осложненной кровотечением: во-первых, современное комплексное консервативное лечение, включающее комбинированный эндоскопический гемостаз, дает возможность в большинстве наблюдений остановить профузное ДК из хронических язв ДПК; во-вторых, показанием к экстренной операции при язвенном ДК должна являться только невозможность достижения гемостаза консервативными мерами, включая комбинированную лечебную эндоскопию {{}}14,82,216,222,265{{}}.
Такой подход снижает уровень хирургической агрессии и позволяет выполнять преимущественно срочные, отсроченные и плановые радикальные операции в более благоприятных условиях. Выжидательная тактика предполагает прежде всего использование комплекса консервативных мероприятий, позволяющих достигнуть надежного гемостаза.
По мнению многих исследователей, включая В.К.Гостищев и соавт. (2005), В.Н.Антонова (2006), А.В.Климашевича (2007), Garnett W.R. (2003), прогнозирование и профилактика рецидивов язвенных кровотечений с помощью динамической ФГДС, тщательная коррекция сопутствующих заболеваний с выполнением преимущественно срочных, отсроченных и плановых операций способствуют улучшению непосредственных результатов лечения больных с профузными язвенными дуоденальными кровотечениями {{}}14,51,82,270{{}}.
Резюме:
— Позиция клинической медицина на проблему оптимизации ИО ИТТ при полостной кровопотери: А) Традиционная ИО РИК приемлема, но в целях ее оптимизации требуется прояснить патофизиологию излившейся крови в зависимости от плевральной и брюшной полостей на основе не только ЭК, но и КК; Б) Аппаратная ИО РИК приемлема, но в целях оптимизации требуется прояснить патофизиологию кров, собранной из плевральной и брюшной полостей в различном скоростном режиме на основе не только ЭК, но и КК;
— Позиция доказательной медицины на проблему оптимизации ИО ИТТ при просветной кровопотери: А) Необходимо оптимизировать не только анестезиолого-реанимационную, но и хирургическую тактику на базе четкой выверки активной либо выжидательной тактики ведения больных; Б) Необходимо не только оптимизировать, но и унифицировать адаптировать программу ИО ИТТ на базе адекватного соотношения крови, коллоидов и кристаллоидов.
ГЛАВА II
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Характеристика материала и методов клинико-экспериментальных исследований при полостных кровопотерях
Цель исследования. Повысить результативность экстренной хирургии и анестезиологии-реаниматологии при критических полостных и просветных кровопотерях на основе оптимизации ИО ИТТ.
Методологические и научно-практические задачи исследования:
1. Провести анализ современных концепций интраоперационной хирургической и анестезиолого-реанимационной тактики при критических кровопотерях в ракурсе позиций клинической и доказательной медицины;
2. Осветить научно-методологические проблемы интраоперационного инцидента, связанного с критической кровопотерей, а также выполнить клинический и вероятностный мониторинг таких инцидентов;
3. Осуществить ККИ, а также определить релевантность КК и ЭК состояния полостной крови для ИО РИК;
4. Выполнить ККИ, а также определить релевантность КК и ЭК эффективности аппаратной ИО РИК;
5. Изучить пределы обоснования адаптированной программы ИО ИТТ при критических просветных кровопотерях у больных с ЯБ ДПК, осложненной острой кровопотерей, в зависимости от скорости кровотечения, тяжесть состояния пациентов, степени кровопотери, преклонного возраста пациентов. Клинико-статистическим материалом исследований при полостных кровопотерях служили результаты диагностики и лечения 302 пациентов, госпитализированных и оперированных в экстренном порядке в хирургической клинике НХЦ по поводу травм и ранений органов груди и живота за период 1998—2017 гг.
У пациентов имело место острая внутриполостная кровопотеря и постгеморрагический гемоциркуляторный шок различной степени. Их распределение по полу и удельному весу ИО РИК дано в таблице 2.1. Нужно отметить, что гемоторакс, вследствие травмы и ранения груди имело место у 68 пациентов, что составляет 22,5%, тогда как гемоперитонеум вследствие травмы и ранения живота — у 234 пациентов (77,5%).
Таблица 2.1. Распределение пациентов с повреждениями органов груди и живота по полу и удельному весу ИО РИК
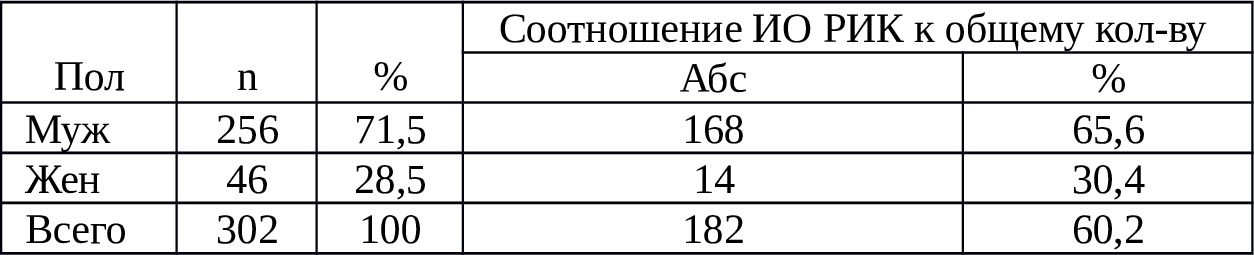
Как видно из табл. 2.1., удельный вес ИО РИК в системе экстренной анестезиолого-реанимационного обеспечения хирургических вмешательств составил 60,2%. То есть у более половины оперированных. Из таблицы также видно, что около ¾ пострадавших (71,5%) составляют лица мужского пола. Причем, у них в 2 раза чаще, чем у женщин, применялась ИО РИК.
Таким образом, ИО РИК был использован у более половины (60,2%) пострадавших с острой внутриполостной кровопотерей. Частота использования ИО РИК у пострадавших с повреждениями груди и живота за период 2007—2017 гг. по сравнению с периодом 2003—2007 гг. увеличился на 2,6%
Следует напомнит, что в свое время, Б.Ж.Мусалиев (2010) отмечал рост количества ИО РИК на 5,2% за период 2003—2007 гг. по сравнению с периодом 1998—2002 гг. (4,4%) {{}}124{{}}. В целом, за 19-летний период (1998—2017) в НХЦ удельный вес ИО РИК возрос на 12,2%. Частота ИО РИК до 1998 г. в НХЦ составлял 50,6%.
Итак, в системе оказания экстренной хирургической помощи пострадавшим с повреждениями органов грудной и брюшной полостей имеет место увеличение частоты применения ИО РИК и повышение соответствующего опыта сотрудников НХЦ.
Основным клиническим материалом исследования послужили результаты целенаправленного морфологического, биохимического, гемостазиологического, инструментального исследования и использования в системе лечения ИО РИК у 128 пострадавших с различными травмами и ранениями органов грудной и брюшной полостей, поступивших в НХЦ за период 2007—2017 гг.
Важно отметить, что в предыдущие периоды, наши совместные с А.Т.Буланбековым (2006), Б.Ж.Мусалиевым (2010), исследования, были посвящены, главным образом, научно-экспериментальному обоснованию (ЭК) технологий ИО РИК, тогда как в период 2007—2017 гг. нами осуществлялось клиническое испытание (КК) и внедрение научных разработок в ежедневную практику экстренной хирургии {{}}36,124{{}}. За указанный период ИО РИК прочно вошла в программу анестезиолого-реанимационного обеспечения хирургических вмешательств у пациентов с полостными кровопотерями.
Таблица 2.2. Распределения пациентов по полу и возрасту
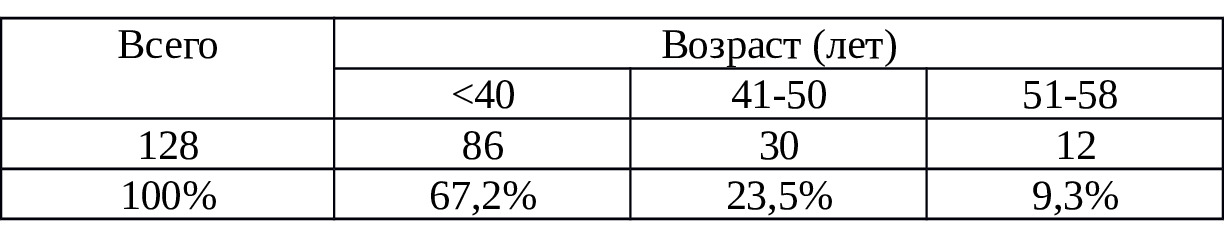
Следует заметить, у пострадавших имело место острая внутриполостная кровопотеря и постгеморрагический гемоциркуляторный шок различной степени. Их распределение по возрасту приведены в таблице 2.2. Мужчин было 102, женщин — 26. Соотношение составило 1:4. Возраст пострадавших колебался в пределах 24—58 лет.
Как видно из табл.2.2, более половины (67,2%) пострадавших составили лица в возрасте 24—40 лет, а удельный вес лиц в возрасте 41—50 лет составлял 23,4%. Таким образом, абсолютное большинство (90,7%) пострадавших с острой кровопотерей составили лица трудоспособного возраста.
Нужно отметить, что при выборке истории болезни пострадавших мы учли полостную кровопотерю лишь II — III ст. Распределение пострадавших по характеру повреждения и степени кровопотери приведено в таблице 2.3.
Таблица 2.3. Распределение пациентов по характеру повреждения и степени полостной кровопотери
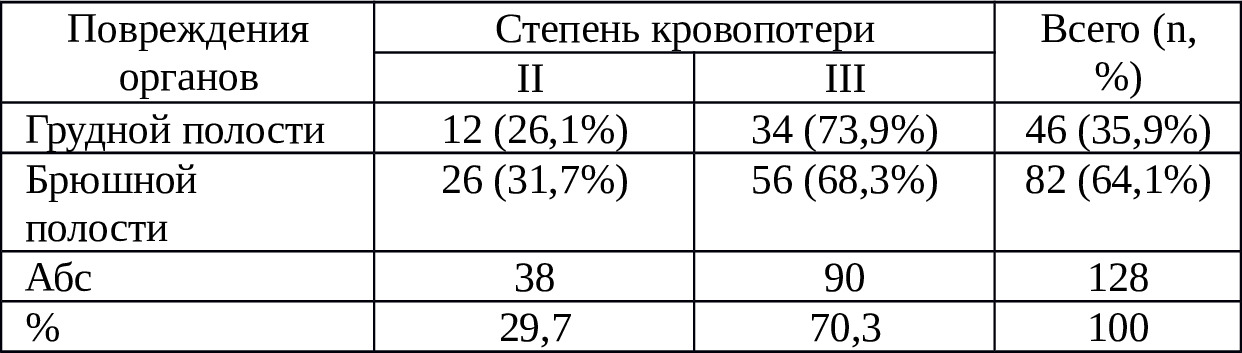
Как видно из табл.2.3. лица с повреждениями органов брюшной полости составили 64,1% пострадавших. У них удельный вес кровопотери с образованием гемоперитонеума III ст. было меньше, чем таковой с образованием гемоторакса у пострадавших с ранениями груди, составляя 68,3% против 73,9%. Между тем, удельный вес кровопотери с образованием гемоперитонеума II ст. было больше, чем таковой с образованием гемоторакса у пострадавших с ранениями груди, составляя 31,7% против 26,1%.
В период 2007—2017 гг. нами проведены клинико-лабораторные исследования по сравнительной оценке физико-химического состояния крови, излившейся в брюшную и плевральную полость у пациентов с повреждениями органов грудной и брюшной полостей с соответствующим образованием гемоторакса и гемоперитонеума.
Ранее в исследованиях А.Т.Буланбекова (2006) аналогичные исследования были проведены в условиях экспериментального моделирования гемотракса и гемоперитонеума в различные сроки {{}}36{{}}. Собранная кровь предназначалась для ранней (2 ч.) и поздней (6 ч.) ИО РИК.
Наши клинические исследования проведены у 92 пациентов с полостными кровопотерями, что составляет 71,8% от общего числа обследованных пациентов (n-128), у которых была использована ИО РИК. Речь идет об использовании традиционной ее технологии, когда кровь, излившейся в ту или иную полость собирали ковшем и пропускали в емкость со стабилизатором крови через 8-слойную марлю.
Исследования проведены во время операции в первые 2 ч. Распределение на клинические группы приведено в таблице 2.4.
Таблица 2.4. Клинические группы по оценке физико-химического состояния крови, излившейся в брюшную и плевральную полость (n-92)

Как видно из табл.2.4., в 63% случаев кровь была собрана из брюшной полости, а в 37% случаев — из грудной полости.
Таблица 2.5. Клинические группы по оценке физико-химического состояния собранной крови из брюшной и плевральной полости (А,Б), а также по оценке эффективности (В,Г) ИО РИК в условиях быстрого и медленного режима сбора крови для ИО РИК (n-44)
Нами проведена серия исследований у 44 пациентов с полостными кровопотерями, что составляет 34,3% от общего числа обследованных пациентов (n-128), у которых была использована аппаратная технология ИО РИК. Исследования проведены также во время операции в первые 2 ч. Распределение на клинические группы приведено в таблице 2.5.
Как видно из табл.2.5., быстрый режим сбора излившейся крови применен у 18 (40,9%) пациентов (группа А), а медленный (группа Б) — у 26 (59,1%) пациентов. Причем, 18 пациентов представляли клиническую группу по оценке физико-химического состояния крови из плевральной полости, тогда как 26 — из брюшной полости.
Оценка эффективности ИО РИК выполнено у всех 44 пациентов, у которых кровь из полостей собраны в различных режимах. Причем, в условиях быстрого режима (группа В) оценка выполнена у 18 (40,9%) пациентов, а в условиях медленного (группа Г) режима — у 26 (59,1%) пациентов.
Ниже приводится характеристика объема и методов исследования по полостным кровопотерям.
Методы интраоперационного исследования пострадавших. Материалом анализа являются данные 128 пострадавших, госпитализированных и оперированных в условиях острой полостной кровопотери вследствие повреждения органов грудной и брюшной полостей. У них применены клинико-лабораторные, пункционные, лапароскопические, торакоскопические, ультразвуковые методы исследования
Таблица 2.6. Объем и характер интраоперационных инструментальных исследований у пациентов с травмами груди и живота (n-34)
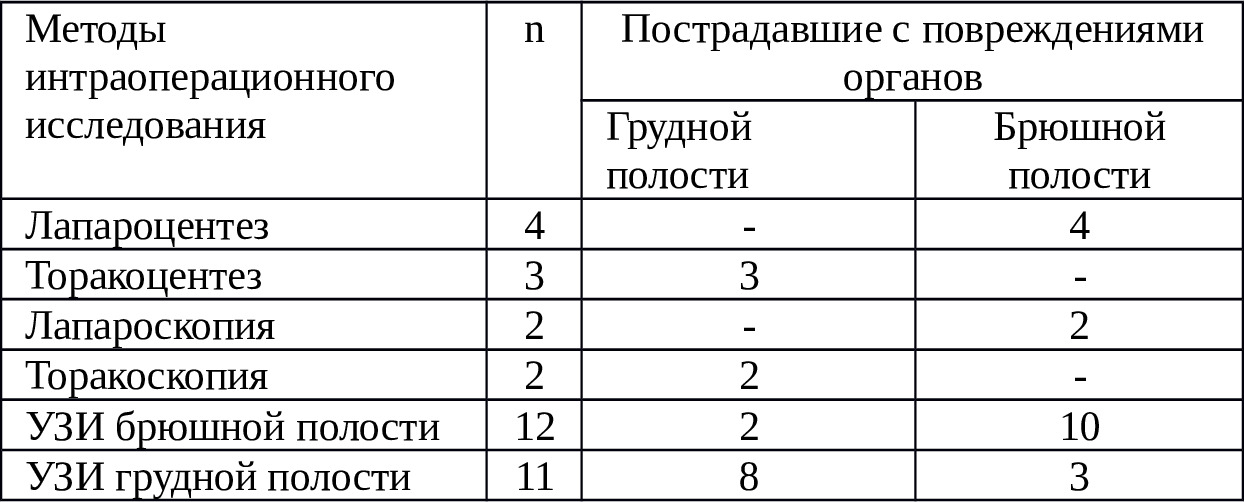
Как видно из табл. 2.6., инструментальным исследованиям во время нахождения пострадавшего на операционном столе подвергнуто всего 34 пациента, что составляет 26,5% от общего числа пострадавших (n-128). В большей степени были использованы УЗИ грудной и брюшной полостей.
Лапароцентез использовали лишь в 4 случаях при подозрениях на повреждения внутрибрюшных органов. Стилет вводили в точке, расположенной на 2 поперечных пальца ниже пупка по средней линии. В 2-х случаях по троакару начала поступать кровь, а в 2-случаях кровь начал поступать по «шарящему катетеру» после вливания 200 мл теплого физиологического р-ра. В обоих случаях пациенты подвергнуты лапаротомии.
Торакоцентез использовали при подозрении на внутриторакальное повреждение у 3-х пациентов. Стилет вводили в области VII — межреберья по задней аксилярной линии. В 2-х случаях проба Грегуара-Релуа была положительной, а в 1 случае вопрос решился в пользу торакотомии по аэростатическим показаниям. Итак, все пациенты подвергнуты торакотомии.
Лапароскопию использовали в 2-х случаях из-за неясности в отношении внутрибрюшного повреждения. Лапароскоп вводили в точке Калька. В 1 случае кровь начал поступать сразу после удаления стилета, а в другом случае был выполнен пневмоперитонеум, который накладывался дробно по 50—60 мл, объемом до 1600 мл. Во время осмотра в брюшной полости обнаружена жидкая кровь. В обоих случаях выполнена лапаротомия.
Торакоскопия использовали в 3-х неясных случаях внутриплеврального повреждения. Торакоскоп вводили в области III — V-межреберьев по средней подмышечной линии. В 2-х случаях был обнаружен гемоторакс с положительной пробой Грегуара-Релуа. Пациенты подвергнуты торакотомии. В 1 случае исследование завершили оставлением трубки для пассивного дренирования плевральной полости. Однако, спустя 20—30 мин по дренажу начала выделяться кровь. Пациент подвергнут торакотомии.
Задачами экстренного УЗИ были выявление и оценка степени внутриполостного кровотечения в грудную и брюшную полости, на основании чего хирургу следовало решить, в какую из полостей в первую очередь ему следует вмешаться. Такая ситуация возникла у 3-х пациентов.
УЗИ легких, плевры, а также органов и углублений брюшной полости осуществляли ультрасонографом японской фирмы Aloka SSD-500 и SSD-260. Из литературы известно, что эхолокационная картина гемоторакса характеризуется дифференцировкой париетального и висцерального листков плевры и наличием на эхограмме между отражениями от них импульсами ультразвука дистанции, свободной от импульсов. Причем расстояние между этими импульсами, то есть размеры «немой зоны» характеризуют толщину слоя скопившееся в плевральной полости крови и позволяет ориентировочно судить о размерах гемоторакса и величине кровопотери.
Практически во всех случаях УЗИ грудной клетки нами была установлена эхокартина гемоторакса. Пациенты подвергнуты экстренной торакотомии.
Практически у всех 12 пациентов с травмой живота при УЗИ органов брюшной полости имело место эхокартина гемоперитонеума (участки затемнения с акустическим сопротивлением от I,66 x I05 г/см 2/с до 1,71 х I05 г/см 2/с.). Причем, чем больше ее протяженность при топографировании на переднюю брюшную стенку, тем больше степень гемоперитонеума {{}}{{}}. Все пациенты подвергнуты лапаротомии.
Оценочные исследования пострадавших. У 66 пациентов из 128 обследованных, что составляет 51,5%, для унификации процесса оценки, объективизации тяжести состояния пациентов, прогнозирования исхода, качественной и количественной оценки качества медико-хирургической и анестезиолого-реанимационной помощи, индивидуализации ИО ИИТ применены расчетные методы.
Таблица 2.7. Характер и объем оценочных исследований (n-66)
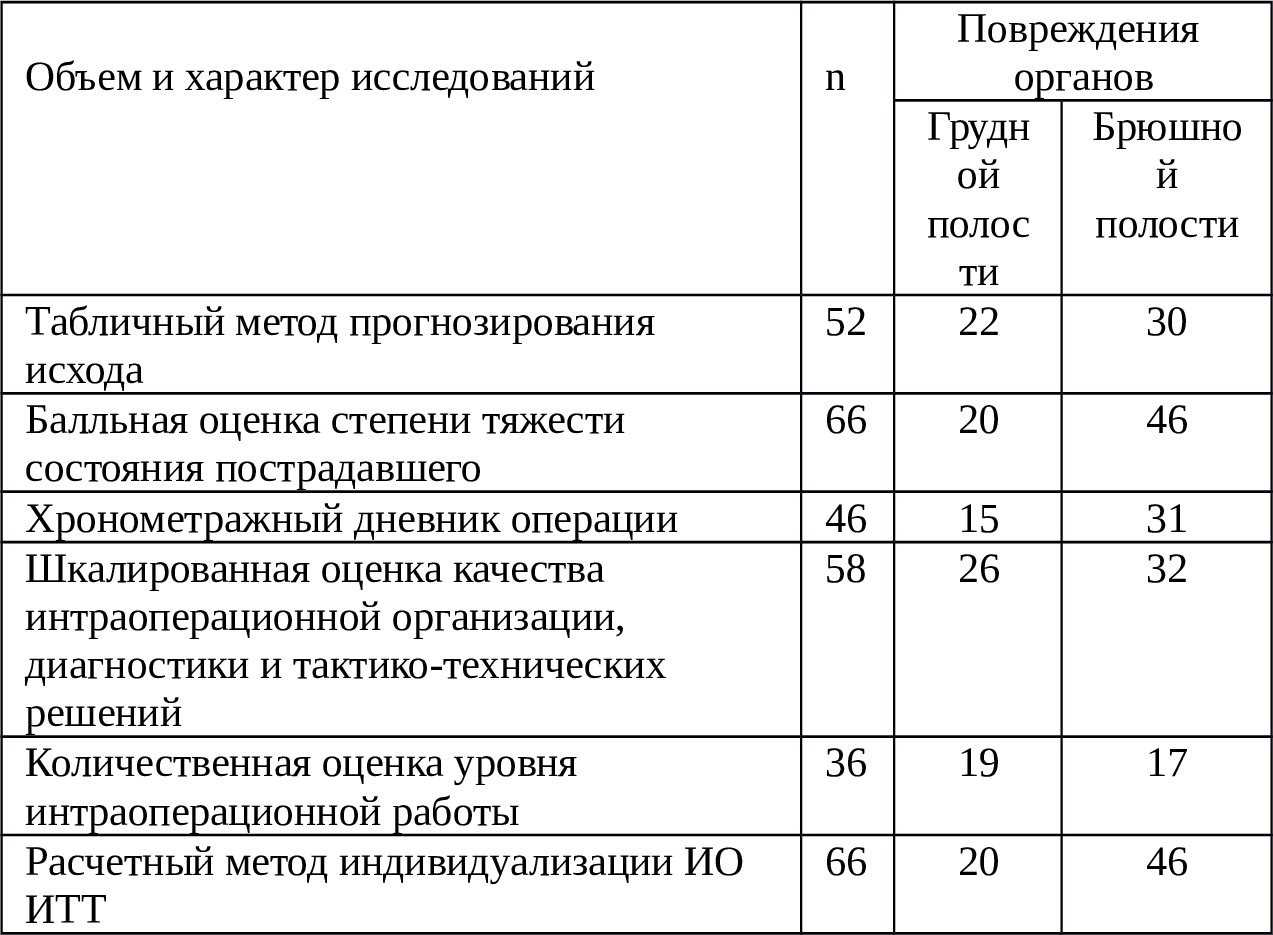
Как видно из табл. 2.7., расчетный метод индивидуализации ИО ИТТ, а также баллная оценка степени тяжести состояния пострадавшего было использована у всех обследованных пациентов. Остальные методы использованы в среднем у 2/3 пациентов.
Методика количественной оценки тяжести состояния пострадавшего. Прямо на операционном столе приступали к оценке степени тяжести состояния пациентов. Для оценки тяжести состояния пострадавшего использована модифицированная нами таблица балльной оценки.
Методика количественной стандартизации ИТТ. Прогнозируемый объем ИТТ прямо пропорционален тяжести механической травмы (К) и обратно пропорционален уровню АД сист. С учетом дополнительных показателей — ЧСС, возраста больных (В), объема вводимой жидкости (У), длительность шока (Т) рассчитывали должный прогнозируемый объем ИТТ (У/Т) по уравнению: У/Т х 100/5100 — 0,064 х В — 0,019 (ЧСС/АД) +0,035 (В х ЧСС) /АД +0,53 х (К х ЧСС/АД +0,006 х В х К.
Хронометражный операционно-реанимационный дневник. Дневник является достоверным источником информации о динамике (во времени и в полноте) реализации лечебно-диагностических мероприятии у пострадавших с травмами груди и живота.
Методика табличного прогнозирования исхода шока. Заполняется таблица весовых коэффициентов для показателей участвующих в формировании ответа, которые затем переносятся в прогностическую карту, после чего раздельно складываются положительные и отрицательные их значения. Если сумма положительных коэффициентов превысит сумму отрицательных — прогноз благоприятный, если наоборот — прогноз неблагоприятный.
Таблица 2.8. Величина кровопотери при гемотораксе и гемоперитонеуме
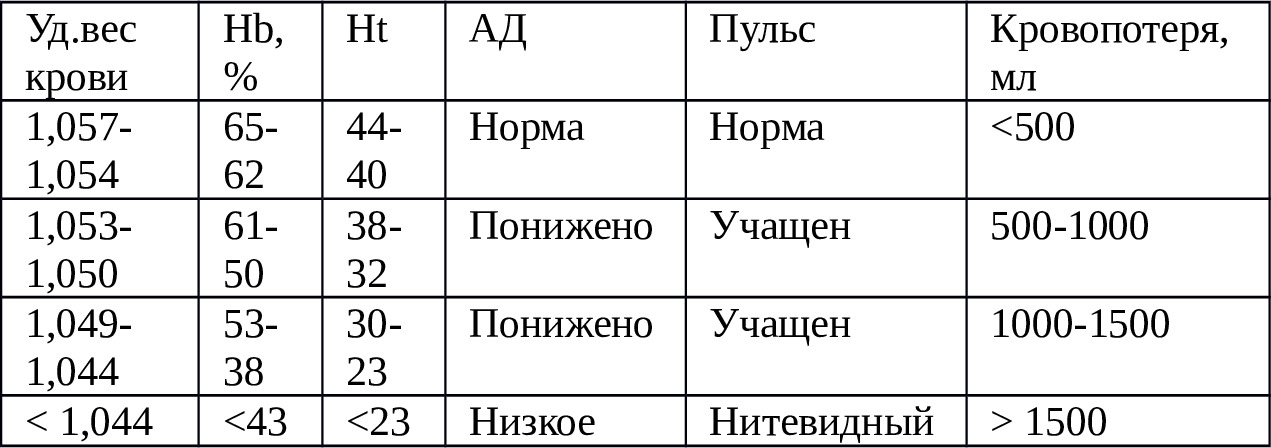
Методика определения величины кровопотери. Величину кровопотери у пострадавших с травматическим гемотораксом и гемоперитонеумом определяли по таблице Г.А.Барашкова (Табл.2.8).
У пострадавших с ранениями груди и живота использовали расчетный метод ретроспективного определения величины кровопотери (2-й метод): V вк = ОЦКд х Ht1 — Ht2 / Ht1, где ОЦКд- должный ОЦК, Ht1 — должный Ht, Ht2 — фактический Ht.
Мы провели сравнительную оценку информативности и достоверности указанных методик, результаты которой приведены в таблице 2.9.
Как видно из табл.2.9., величина расхождения результатов оценки в проспективном и ретроспективном материалах незначительная, а пределы допустимых погрешностей не превышает 5%, что предполагает возможность использования обеих методов расчета величины кровопотери в условиях неотложной хирургии.
Таблица 2.9. Сравнительная оценка информативности и достоверности методов определения величины кровопотери
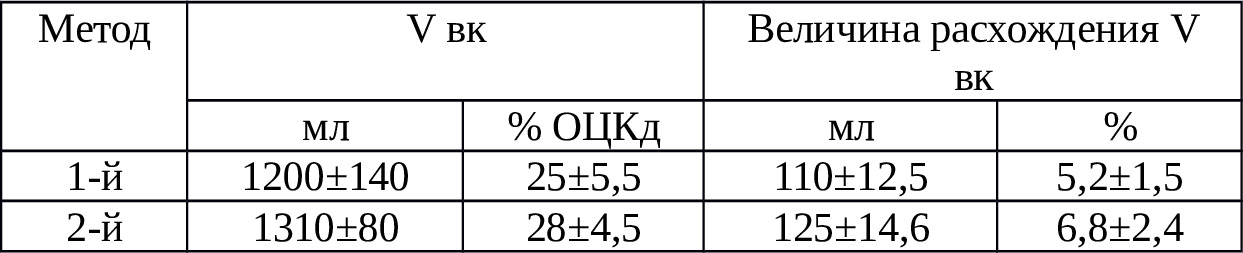
В свое практике мы ориентировались на следующая зависимость величины кровопотери от дефицита ОЦК: при ЦВД — +4,0 см. вод. ст. дефицит ОЦК составляет <10%. При значении ЦВД — +2,0 — дефицит ОЦК — 20%, при значении ЦВД — 0 — дефицит ОЦК составляет 25%, а при ЦВД = — 2,0 — дефицит ОЦК составляет> 40%. У части пациентов использована оценка объема кровопотери на основании плотности крови и величины Ht: при Ht (л/л) — 0,44—0,40 объем кровопотери составит <500 мл, при 0,38—0,32 — 1000 мл, при 0,30—0,22 — 1500 мл, а при <0,22 –> 1500 мл.
Разумеется, во время операции прибегали к эмпирической оценке величины кровопотери по следующим критериям (Табл.2.10): при травматическом гемотораксе — 1500—2000 мл; при травме живота — до 2000 мл; операционная кровопотеря составляет при лапаротомии — 1000—15000 мл; при торакотомии — 1000—15000 мл; при резекции желудка — 400—800 мл.
Таблица 2.10. Ориентировочная оценка степени кровопотери
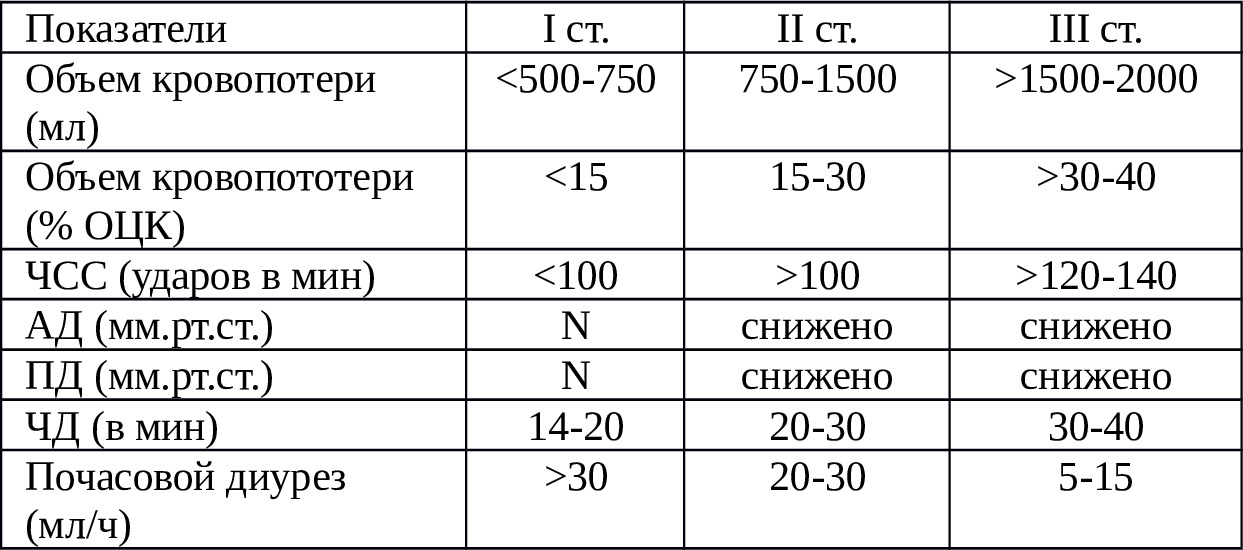
В условиях операционной приемлемы следующие расчеты объема кровопотери: 1) Расчет шокового индекса Альговера = ЧСС/АДсист, в норме 0,50—0,54; при шоковом индексе 0,8 и менее потеря крови 10% ОЦК, 0,9—1,2 — 20%, 1,3—1,4 — 30%,> 1,5 — 40% (каждое последующее увеличения от нормы на 0,1 = потере 200 мл крови = 4% ОЦК); 2) Формула Нельсона: объем кровопотери на массу тела (мл/кг) = 24/0,86 х НСТ х 100; 3) Объем кровопотери на массу тела (мл/кг) = 0,036 х установленный объем кровопотери х НСТ/вес тела;
Методы исследования, показатели и физические константы крови. Физико-химические константы крови зависят не только от клеточного состава, факторов гемостаза, но и от соотношения основных белковых фракций и электролитов. Следует обратить внимание на то, что речь идет о показателях крови, «вышедших» из сосудистого русла в какую-либо серозную полость (плевральная, брюшная).
Приведем лишь ориентиры вероятных причин изменения этих показателей. Надо заметить, что в доступной нам литературе мы не встретили сведений о тех или иных изменений именно излившейся в серозную полость крови.
1) Морфологическая характеристика крови, излившейся в серозную полость, осуществлялась на основе гемограммы, которая включала в себя определение: 1) концентрации Hb (г/л); 2) кол-ва Эр. (х1012/л); 3) кол-ва лейкоцитов (х109/л); 4) кол-ва тромбоцитов (х109/л); 5) величины Ht (%); величины ЦП.
Эритроцитоз развивается при сгущении крови, когда уменьшается объем плазмы при сохранении кол-ва Эр., а эритроцитопения развивается в результате гемолиза. При этом важно учитывать следующие физиологические формы Hb: 1) оксигемоглобин (HbО2) — соединение Hb с О2 образуется, преимущественно, в артериальной крови и придает ей алый цвет; 2) восстановленный Hb или дезоксигемоглобин (HbH) — Hb, отдавший О2 тканям.
Снижение содержания Hb в крови может быть следствием повышенных потерь Hb при разного рода кровотечениях или повышенном разрушении (гемолизе) Эр., а повышение уровня Hb сгущении крови. Ht — это доля (%) от общего объема крови, которую составляют Эр. и его повышение обуславливается гемоглобинопатией, гемоконцентрации, дегидратации, а понижение Ht в результате анемии, гипергидратации.
Лейкоцитоз возникает при травматизации тканей, воздействии холода и тепла. Возможен реактивный лейкоцитоз за счет перераспределения пристеночного пула нейтрофилов, а лейкопения — за счет гемолиза.
2) Физколлоидная характеристика крови, излившейся в серозную полость, выполнена на основе определения следующих констант крови: 1) эритроцитарные индексы крови — MCH, MCHC, определяемые расчетным методом; 2) осмотическая резистентность Эр (%); 3) механическая резистентность Эр.; 4) свободный Hb (мг%); 5) степень гемолиза (% к общему Hb).
Эритроцитарные индексы — это расчетные величины, позволяющие количественно характеризовать важные показатели состояния Эр. MCH — среднее содержание Hb в Эр. Вычисляется в абсолютных единицах делением величины концентрации Hb на число Эр. Этот параметр определяет среднее содержание Hb в отдельном Эр. и аналогичен ЦП, но более точно отражает синтез Hb и его уровень в Эр.
MCHC — средняя концентрация Hb в Эр. Рассчитывается путем деления концентрации Hb крови (в г/100 мл) на Ht и умножения на 100. Показатель отражает Эр. в насыщении Hb и характеризует отношение количества Hb к объему клетки. Не зависит, таким образом, от объема клетки, в отличие от МСН. Понижение МСНС происходит при анемии и гемоглобинопатии.
Степень гемолиза излившейся крови определяется гемометром Сали, а осмотическая резистентность Эр. — методом Идельсона, основанном на изучении минимальной и максимальной степени гемолиза Эр. при инкубации их в р-ре различной концентрации NaCl. У здоровых начало гемолиза Эр. отмечался в 0,5% р-ре NaCl, а полный гемолиз — в 0,3% р-ре. При снижении резистентности Эр. гемолиз наступает при более высокой концентрации (0,6—0,8% р-ра).
Исследование механической резистентности Эр. основано на определении в плазме Hb после обработки крови в аппарате для встряхивания. У здоровых в плазме образуется 15—30 г/л Hb. Снижение механической резистентности Эр. сопровождается образованием повышенной, чем указанное число концентрации Hb. На основании этих цифр рассчитывался % гемолиза.
3) Биохимическая характеристика крови, излившейся в серозную полость, осуществлялась на основе протеинограммы и ряда биохимических показателей крови. Протеинограмма включала: 1) общий белок (г%); 2) альбумин (г%); 3) глобулин (г%); 4); коэффициент альбумин / глобулин (А/Г).
Снижение концентрации белка возникает, в первую очередь, при распаде. Одновременно с определением общего белка сыворотки крови проводят исследование белковых фракций. В норме они имеют следующее соотношение: альбумины — 54—65%, глобулины — 35—46%. Снижение концентрации альбумина может происходить при его распаде, а также при повышенном расходе.
Определяли следующие биохимические показатели: 1) общий билирубин (ммоль/л); 2) остаточный N (ммоль/л); 3) мочевина плазмы (ммоль/л); 4) К+ (ммоль/л); 5) Na++ (ммоль/л). Определяли ферменты крови (АЛТ, АСТ, амилаза), а также показатели КОС.
Коагулографическая характеристика крови проводилась по следующим показателям: 1) Тромбоциты (х109/л); 2) Агрегация тромбоцитов (сек); 3) Время свертывания по Ли-Уайту в силиконированной пробирке (сек); 4) Время свертывания по Ли-Уайту в несиликонированной пробирке (сек); 5) Каолиновое время свертывания плазмы (сек); 6) Каолин-кефалиновое время свертывания плазмы (сек); 7) Время рекальцификации плазмы (сек); 8) Тромбиновое время (сек); 9) Протромбиновое время (сек); 10) Толерантность плазмы к гепарину (мин); 11) Фибриноген (г/л); 12) Фибринолиз (мин); 13) АКТ на 6,8 и 10 мин (сек).
Тромбоцитопения развивается при анемии, ДВС-синдроме и при массивной гемотрансфузии. Адгезия и агрегация тромбоцитов позволяют обеспечивать гемостаз за счет того, что скапливаются в области повреждения, прилипают к поврежденной стенке. Стимуляторами агрегации тромбоцитов являются тромбин, адреналин, серотонин, коллаген. Тромбин вызывает агрегацию кровяных пластинок.
Ретракция кровяного сгустка — это свойство тромбоцитов к уплотнению тромба и отжатию сыворотки. При этом тромбоциты прилипают к нитям фибрина и высвобождают тромбостенин, который осаждается на нитях фибрина, в результате последние уплотняются и скручиваются, образуя первичный тромб.
Методика механической ИО РИК. Во время операции, в емкость 500 мл с помощью стерильного ковша собирается кровь из грудной либо из брюшной полости. Для стабилизации крови чаще всего используют гемоконсервант: 4%-ный р-р цитрата Nа из расчета 10 мл на 100 мл крови; р-р «глюгицира» из расчета 100 мл на 500 мл крови; р-р АСD в соотношении 1:3; р-р гепарина из расчета 1000 Ед на 500 мл крови.
Собранную кровь процеживают сквозь 8 слоев смоченной в физиологическом р-ре марли и с помощью обычной внутривенной или внутриартериальной системы ее возвращают больному. Достоинством этого метода можно считать его быстроту и доступность, а главным недостатком — марля задерживает лишь крупные сгустки крови и частицы тканей. Фильтры обычных систем для переливания крови тоже слишком крупнопористы.
Методика аппаратной аппаратной ИО РИК. Нами разработана простейшая методика аппаратной ИО РИК. Устройство состоит из программного реле времени, соединенного с микровиброкомпрессором и отсосом. Компрессор имеет ручки для регулировки степени создания вакуума. Компрессор со своей стороны соединен с герметичной, градуированной стерильной емкостью-сборником крови.
Устройство работает следующим образом: свободный конец магистрали подсоединяется к наконечнику, с помощью которого хирург во время операции отсасывает кровь, излившейся в грудную или в брюшную полость. Указанная модификация заключается в том, что для сбора крови используется отградуированный силиконированный сосуд вместимостью 1000 мл и соединенный с вакуум-отсасывателем.
Отсасываемая кровь поступает в градуированный резервуар со стабилизатором крови. Для широкой практики мы рекомендуем использовать традиционную ампулу ЦИПК с ЦОЛИПК-7б. При использовании современных одноразовых систем для внутривенных инфузий кровь в достаточной степени надежно фильтруется и самотеком возвращается в вену больного.
Статистическая обработка материала была произведена с помощью ПК с использованием пакета стандартных программ. Для изучения достоверности различий в количественных параметрах между сроками исследования и группами экспериментальных животных применялись парный и непарный t-тесты Стьюдента. Для изучения распределения дискретных признаков в сравниваемых группах применялся стандартный метод анализа сопряженности х 2 — по Пирсону {{}}141{{}}.
2.2. Характеристика материала и методов клинико-вероятностных исследований при просветных кровопотерях
Считаем нужным, подчеркнуть, что исследования проведены согласно «Методология разработки и адаптации клинических руководств, основанных на доказательной медицине», предложенной А.З.Зурдиновой и В.В.Власовой (2008) в несколько взаимосвязанных и последовательных этапа:
I этап. Нами выполнен мета-анализ тематической литературы (154 источников, в том числе 89 русскоязычных и 64 — иностранных), среди которых 48 диссертаций и 20 монографий. Если предметом исследований Н.А.Мамажусупова (2012) является сопоставительный анализ эффективности активной и выжидательной хирургической тактики у больных с ЯБ ДПК, осложненной просветной кровопотерей, то предметом наших исследований является анализ эффективности адаптированной программы ИО ИТТ у пациентов, у которых была предпринята активная и активно-выжидательная тактика.
II этап. Нами выполнены ККИ и оценка данных исследования больных с ЯБ ДПК, осложненной просветной кровопотерей (n-172). Если Н. А. Мамажусупов (2012) в зависимости от разновидности предпринятой хирургической тактики, выделял группы больных, у которых реализована активная хирургическая (n-100) и выжидательная (n-72) тактика, то нами изучалась эффективность адаптированной программы ИО ИТТ у пациентов, у которых была предпринята активная и активно-выжидательная тактика.
III этап. Нами выполнены ККИ и оценка данных исследования больных с ЯБ ДПК, осложненной кровотечением на основе выделенного нами главных факторов риска, каковыми являются: 1) Скорость кровотечения (Фактор №1); 2) Степень тяжести состояния пациента (Фактор №2); 3) Массивность кровопотери (Фактор №3); 4) Преклонный (> 60 лет) возраст пациентов (Фактор №4).
Итак, у больных с ЯБ ДПК, осложненной кровотечением с учетом главных факторов риска были выделены по две клинические группы (n-172): 1) основная группа №1 — больные с III ст. кровопотери (n-44); 2) контрольная группа №1 — больные со II ст. кровопотери (n-100). Основную группу №2 составили больные в возрасте> 60 лет (n-42), а контрольную группу №2 — больные в возрасте <60 лет (n-140).
IV этап. Если Н. А. Мамажусупов (2012) на основе полученных данных выполнил расчет шкалы уровня доказательности и на этой базе разработал градуированные практические рекомендации по выбору срока операции у больных с ЯБ ДПК, осложненной кровотечением, то нами исследованы пределы обоснования адаптированной ИО ИТТ у этих пациентов с оценкой его эффективности в зависимости от главных факторов риска (скорость кровотечения; степень тяжести состояния пациентов, массивность кровопотери, преклонный возраст пациентов).
Общая характеристика больных. Клиническим материалом ККИ являются 172 больные с ЯБ ДПК, осложненной просветной кровопотерей, оперированных в НХЦ за период 2005—2009 гг. Мужчин — 143 (83,1%), женщин — 29 (16,9%). Возраст больных колебался в пределах 25—72 лет. 78 (46%) больных составили лица наиболее трудоспособного возраста (<45 лет). На таком фоне больных> 60 лет было 42 (24%), а лица среднего возраста (45—59 лет) составили 52 (30%) больных.
В экстренном и срочном порядке всего выполнено ФЭГДС у 101 (58,7%) из 172 больных с ЯБ ДПК, осложненной просветной кровопотерей. Хроническая язва луковицы ДПК установлена у 72 (71,3%) из 101 обследованных больных. Залуковичная язва ДПК, осложненная просветной кровопотерей обнаружена у 29 (28,7%). У 25 из них имело место сочетание кровотечения и рубцового стеноза, а у 4-х больных — сочетание кровотечения и пенетрации в головку поджелудочной железы.
У 102 (59,3%) из 172 больных обнаружены сопутствующие патологии. 55 (31,9%) из 172 больных страдали заболеваниями ССС, а у 22 (12,8%) больных имело место ХНЗЛ. 38,8% больных были оперированы в сроки <6 ч. с момента начала кровотечения.
Из 172 больных с язвенным кровотечением 64 (37,2%) были оперированы в сроки> 4-х суток после остановки кровотечения и нормализации состояния больных. Несмотря на поздние сроки с момента начала кровотечения кровопотеря было II ст.
108 (62,8%) больных оперированы в сроки <4 суток с момента возникновения кровотечения. В первые 6 ч. операция выполнена у 72 (41,8%) больных. В сроки 7—12 ч. операция выполнена у 12 (6,9%) больных, в сроки 13—24 ч. — у 9 (5,2%), в сроки 1—4 сутки — у 15 (8,7%) больных. Таким образом, в экстренном порядке были оперированы 72 (41,8%) больных, в отсроченном порядке — 100 (58,2%).
У 72,2% больных отмечалось головокружение, у 20,5% наступало обморочное состояние, у 62,4% больных имело место однократная рвота кровью, у 12,4% — многократная. У 68,8% больных отмечался дегтеобразный стул, а кровавый понос был у 3-х больных.
У больных с ЯБ ДПК, осложненной кровотечением I ст. кровотечения имело место у 28 (16%) больных, II ст. — у 100 (58%), III ст. — у 44 (26%). Из 79 больных добиться окончательного гемостаза удалось 61 больному, у 18 больных достигнут временный гемостаз, которые в связи с высоким риском рецидива кровотечения оперированы.
У 12 (7%) больных ЯБ ДПК, осложненной кровотечением была предпринята гастродуоденотомия с обшиванием кровоточащей язвы. Иссечение язвы и ваготомия выполнено у 34 (20%) больных, резекции желудка — у 126 (73%) больных.
Характеристика методов исследования. Клинико-статистический анализ проведен по общепринятой методике. Анализируемые данные получены из официальных статистических отчетов организационно-методического кабинета НХЦ. Были отобраны 172 историй болезней больных с ЯБ ДПК, осложненной кровотечением.
Использованы общепринятые методы обследования больного, а также методы обследования, принятые в гастроэнтерологии. Учитывали возраст, пол, характер и давность заболевания, кратность наблюдения и стационарного лечения, наличие сопутствующих заболеваний, сроки наступления осложнения и оказания специализированной помощи.
Клиническое обследование проводилось по общепринятой схеме. Учитывали данные анамнеза, жалобы больного, проводились объективные и дополнительные специальные методы обследования, в том числе для установления и детализации диагноза осложнения ЯБ ДПК.
Эндоскопические методы. ФЭГДС выполняли по общепринятой методике аппаратом фирмы «Olimpus». Обследовано 101 (58,7%) из 172 больных с ЯБ ДПК, осложненной кровотечением. Причем, в 68% случаев исследование проведено в экстренном порядке. С учетом того, что данная работа планировалась выполнить с позиции ДМ, нами использован ряд методов доказательности.
Когортное исследование (КИ). Данный метод позволяет оценить диапазон исходов, связанных с влиянием выбора той или иной хирургической тактики — у больных с ЯБ ДПК, осложненной просветной кровопотерей — активная и выжидательная хирургическая тактика и, сообразно тому, эффективность адаптированной программы ИО ИТТ.
Рондомизированное контролируемое исследование (РКИ). Для исследования сначала отбирают больных из большого числа больных с изучаемой патологией (в нашем примере — ЯБ ДПК, осложненная просветной кровопотерей), затем этих больных рондомизировали на основную и контрольную группы.
Мета-анализ с определением статистической ошибки. Критериям включения оригинальных исследований в мета-анализ были следующими: 1) Результаты диссертационных исследований; 2) Результаты, отраженные в монографиях; 3) Результаты, опубликованные в индексированных научно-периодических изданиях.
Если целью мета-анализа Н.А.Мамаюсупова (2012) является оценка сравнительной эффективности активной и выжидательной хирургической тактики у больных с ЯБ ДПК, осложненной просветной кровопотерей, на основе непосредственных и ближайших результатов соответствующих операций, то целью мета-анализа, проведенного нами, является научное обоснование адаптированной ИО ИТТ на основе изучения пределов ее рационального обоснования в зависимости от основных факторов риска (скорость кровотечения; степень тяжести состояния пациентов, массивность кровопотери, преклонный возраст пациентов) и в зависимости от принятой тактики: 1) Активной; 2) Активно-выжидательной.
Наш мета-анализ основан, главным образом, на результатах диссертационных (n-48) и монографических работ (n-20). Причем, наряду с литературными данными зарубежных авторов, использовали материалы научных исследований, проведенных в КР (в частности сотрудников хирургических учреждений, клиник и НХЦ).
Итак, в нашей практике с целью уменьшения статистической ошибки выполнены: 1) Целенаправленный отбор больных с ЯБ ДПК, осложненной просветной кровопотерей; 2) Материалы диссертационных исследований наших коллег по указанным проблемам, в которых приведены основные характеристики больных, сведения о непосредственных и ближайших клинических исходах, критериях их оценки.
Расчеты ОШ и ОР: ОШ = (a/b) / (c/d) = (ad) / (bc); ОР= (a/ (a+b)) / (c/ (c+d)). Результаты представляли в %. Для максимально полного и объективного отбора данных следует разработать унифицированную форму и стандартизованный метод отбора: 1) В основной группе: а — число больных с неблагоприятным исходом; b — число больных с благоприятным исходом; 2) В контрольной группе: c — число больных с неблагоприятным исходом; d — число больных с благоприятным исходом.
Шкала уровней доказательности и градации рекомендаций. Разработаны 4 градации (А,В,С,D): А — доказательства достаточно убедительны; В — убедительность относительная; С и D –доказательств недостаточны.
Об эффективности лечения мы судили, прежде всего, по документальным (истории болезни, амбулаторные карты пациентов) и статистическим данным, результатам лабораторных и инструментальных методов исследования, а также динамике регрессии клинических признаков. Достоверным считали при Р <0,05.
У больных с ЯБ ДПК, осложненной просветной кровопотерей предприняты 2 вида лечебной тактики, согласно которых нами выделены 2 клинические группы:
1-ая группа — больные с ЯБ ДПК, осложненной просветной кровопотерей, которые были оперированы в ранние сроки после поступления в клинику, то есть предпринята была активная хирургическая тактика;
2-ая группа — больные с ЯБ ДПК, осложненной просветной кровопотерей, которые были оперированы с отсроченные сроки (активно-выжидательная тактика) после временной остановки кровотечения, восполнения кровопотери и стабилизации общего состояния больных.
Активная хирургическая тактика. Все больные оперированы в экстренном порядке в первые 6 ч. с момента поступления больных в клинику. Время отводилось лишь на производство реанимационных мероприятий на операционном столе и выполнение ФЭГДС для уточнения источника кровотечения.
Параллельно диагностического процесса проводили переливание крови, инфузионно-солевых растворов, кровозаменителей, плазму и плазмозамещающие белковые препараты в комплексе с витаминами. Выбор метода операции зависит от ряда факторов, которые должны быть учтены.
Активно-выжидательная хирургическая тактика. Все больные с кровоточащей язвой луковицы ДПК госпитализированы в ОАР, где проводилось дальнейшее обследование и лечение. Лечебные мероприятия включали промывание желудка ледяной водой, ИО ИТТ по унифицированной программе. После уточнения источника кровотечения (ФЭГДС, рентгеноскопия), а также после стабилизации гемодинамики пациентов переводили в операционную либо в специализированное отделение. Операция, таким образом, проводились в отсроченные сроки.
2.3. Программа ИО ИТТ при полостных и просветных кровотечениях
Как известно, общими принципами программы ИО ИТТ при острой кровопотери являются: 1) Установление диагноза острой кровопотери и характера кровотечения; 2) Определение стадии компенсации кровопотери; 3) Окончательный гемостаз и ликвидация дефицита ОЦК; 4) Стабилизация центральной гемодинамики; 5) Диагностика и коррекция последствий гиповолемии; 6) Контроль эффективности терапии.
Программа ИО ИТТ при острой кровопотери заключается, прежде всего, в стабилизации системной гемодинамики, а также улучшении регионарного и органного кровотоков, в том числе на основе своевременного восполнения «утерянной» крови с помощью ИО РИК, ИО РИЭ при полостной кровопотери и гемотрансфузии по стандартной технологии при просветной кровопотери с введением в определенном соотношении коллоидов, кристаллоидов, гемостатиков и других препаратов.
Схема действия хирургической бригады при кровопотери была следующая:
— Оценить важнейшие показатели — ЧСС, АД, ЧД, уровень сознания, и на их основе — степень тяжести кровопотери и ее ориентировочный объем.
— Анестезиологическое пособие начинали с премедикации. Причем, у 14 (%) больных с этой целью вводили: супрастин или димедрол 1%-1 мл; атропин 0,1% р-ра 0,5—1 мл в/в, а у 59 (%) — дроперидол 1%-3 мл; фентанил 1%-2 мл; атропин 0,1% р-ра 0,5—1 мл в/м. Больного интубировали и осуществляли переход к ИВЛ и наркозу. Катетеризировали мочевой пузырь.
2. Одновременно пунктировали и катетеризировали вену, начиная с локтевой вены, а далее обязательно центральную вену. Забирали кровь на исследование групповой принадлежности, общий анализ (Эр., Hb, Ht, ЦП, лейкоциты, тромбоциты), биохимическое исследование (билирубин, остаточный N, мочевина, К+, Na++, хлориды, КОС, общий белок) и на определение показателей свертывания крови.
3. Переливали в течение 30—60 мин до 1000 мл СЗП, а также коллоидные растворы (полиглюкин, препараты гидроксиэтилированного крахмала). Чаще всего начинали переливать коллоидные р-ры. При сохранении проявлений гипокоагуляционной кровоточивости продолжали введение СЗП, доведя объем ее трансфузии до 2000 мл.
4. Переливали р-ры кристаллоидов в объеме 1000—2000 мл до повышения АД не ниже уровня 110/70—100/60 мм рт. ст.
5. При общем объеме кровопотери> 2000 мл или потери крови до 30% от ОЦК, нестабильных показателей гемодинамики переливание эритромассу.
В случаях полостной кровопотери вопрос об использовании ИО РИК или ИО РИЭ решался коллегиально.
На наш взгляд, объем и структура трансфузионных сред определяются массивностью кровопотери. Критерием адекватности восполнения дефицита ОЦК являются ЦВД и почасовой диурез. Пока ЦВД не достигнет 10—12 см вод. ст. и почасовой диурез не станет> 30 мл/ч, пациент нуждается в продолжении инфузионной терапии.
В нашей практике, соотношение объемов переливания СЗП и Эр. составляет, как правило, 3:1. Содержание Hb — 80 г/л при адекватной доставке 02 и обеспечении АДсист — 90 мм. рт. ст. в условиях нормоволемии и остановки кровотечения позволяет уменьшить интенсивность ИО ИТТ.
По нашему мнению, переливание концентрата тромбоцитов показано при снижении их уровня <50,0 х 109/л, появлении геморрагии и петехиальной кровоточивости на коже.
Анестезиологи-реаниматологи осуществляли постоянный контроль за показателями гемодинамики, оксигенации, данными коагулограммы, количества тромбоцитов, концентрационными показателями крови, ЭКГ, КОС, что необходимо для коррекции ИО ИТТ.
Считаем, что при переливании> 4 доз эритромассы или СЗП (со скоростью> 1 дозы за 15—20 мин) показано введение 10 мл 10% р-ра CaCl2 для предупреждения цитратной интоксикации и гипокальциемии.
В нашей практике, нередко однократной трансфузии 1000—2000 мл СЗП оказывается недостаточно, так как перелитые факторы свертывания быстро потребляются и кровоточивость может восстановиться, что требует повторной трансфузии СЗП.
На наш взгляд, объем СЗП зависит от динамики показателей коагулограммы, стабильности показателей гемостаза. Критериями успешности терапии являются уровень протромбина, фибриногена, времени свертываемости крови, протромбиновое и тромбиновое время, количество тромбоцитов. Причем, все эти показатели при достаточной и эффективной терапии должны иметь отчетливую тенденцию к нормализации.
Считаем опасным вызвать перегрузку правых отделов сердца. Слишком интенсивная объемная ИО ИТТ, стремление стабилизировать АД на нормальных цифрах, может привести к циркуляторным перегрузкам, срыву первичной тромбоцитарной пробки, увеличению объема кровопотери, снижению уровня тромбоцитов и плазменных факторов свертывания.
По нашему мнению, умеренная артериальная гипотония (АД в пределах 90/60—110/70 мм рт. ст.), объемная ИО ИТТ, обеспечивающая достаточную органную перфузию (критерий — почасовой диурез и сатурация крови), являются физиологически оправданными, необходимыми и достаточными.
Нужно помнить, тяжесть острой массивной кровопотери определяется в основном возникающим дефицитом плазменных факторов свертывания в циркуляции и потерей ОЦК. Адекватное и быстрое восстановление расходуемых плазменных факторов свертывания и восполнение объема циркулирующей жидкости является наиболее важной целью ИО ИТТ.
По нашим данным, назначение коллоидных растворов и кристаллоидов чаще всего обеспечивает достижение нормоволемии и адекватную оксигенацию тканей при условии, что уровень Hb не ниже 80 г/л.
Пожалуй, переливание СЗП не должно быть стандартным, оно имеет целью восполнение плазменных, прежде всего лабильных (V и VIII) факторов свертывания.
Переливание эритромассы у больных с просветными кровопотерями мы назначали при наличии циркуляторной гипоксии, которая характеризуется выраженной бледностью кожи и конъюнктивы, тахикардией, одышкой и участием лестничных мышц и крыльев носа в акте вдоха при условии обеспечения адекватной доставки О2 и достигнутой нормоволемии (но не массивной гемодилюции).
Следует отметить, что решающим критерием эффективности ИО ИТТ является не столько ее объем, сколько скорость инфузии, которая определяет реакцию гемодинамики на выливания. Р-ры вводят с такой объемной скоростью, которая позволяет добиться максимально быстрой нормализации АДсист., при этом оно не должно быть ниже 70 мм рт. ст., что позволяет сохранить адекватный кровоток в органах жизнеобеспечения.
Практика показывает правильность того, что объем инфузии на первом этапе ориентировочно должен составлять при гемоцикуляторном шоке I ст. — 30 мл/кг, II ст. — 50 мл/кг, III ст. — 60 мл/кг массы. Итак, при массе тела пациента 70 кг объем инфузионной терапии составляет соответственно 2100, 3500 и 4200 мл.
В нашей практике, наиболее типичными вариантами реакции пострадавших с шоком на ИО ИТТ являются следующие:
— АДсист. и ЦВД в ответ на форсированное введение жидкости быстро достигают нормальных значений и является прогностически благоприятным признаком;
— АДсист. на фоне активной ИО ИТТ, в том числе с использованием коллоидных плазмозаменителей и глюкокортикостероидов, начинает постепенно восстанавливаться и стабильно удерживается выше критических значений, а ЦВД остается ниже нормы;
— АДсист. и ЦВД остаются критическими, несмотря на струйную инфузию плазмозамещающих препаратов, глюкокортикостероидов, естественных коллоидов.
В нашей программе ИО ИТТ учитывали и унифицированную схему восполнения кровопотери (расчет на кг массы тела):
— При кровопотере I ст. (5—7 мл/кг) возмещать потерю кровь не нужно;
— при II ст. (10 мл/кг) возмещается на 110—120% коллоидами и кристаллоидами в соотношении 1:1;
— при III ст (11—15 мл/кг) без шока возмещается на 150% переливанием крови, коллоидов и кристаллоидов в соотношении 1:1:1.
— При кровопотери с шоком возмещается на 300% переливанием крови, коллоидов и кристаллоидов в соотношении 1:1:1.
В программе ИО ИТТ мы с успехом применяли и некоторые элементы схемы Е.М.Шифмана (2002) (Табл.2.11). При III ст. кровопотери (20—30 мл/кг, АДсист <70 мм. рт. ст.) и IV ст. кровопотери (> 30 мл/кг, АДсист не определяется) необходимо: катетеризация магистральных вен; контроль почасового диуреза; коллоиды (ГЭК-Рефортан): кристаллоиды 1:2 — 300%; вазопррессоры — Допмин 10—15 мкг/кг мин; СЗП — 15 мл/кг, криопреципитат 7—8 доз, тромбомасса 7—8 доз; гемотрансфузия; глюкокортикоиды (преднизолон до 600 мг); бикорбонат натрия.
Таблица 2.11. Качественный и количественный состав инфузионной терапии при острой кровопотере (Е. М. Шифман, 2002)
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.