
Авторский коллектив
Белоусова Ольга Бенуановна — невролог, доктор медицинских наук, ведущий научный сотрудник отделения сосудистой нейрохирургии НИИ нейрохирургии им. Н. Н. Бурденко
Гаврюшин Андрей Владимирович — нейрохирург, кандидат медицинских наук, врач отделения нейроонкологии НИИ Нейрохирургии им. Н. Н. Бурденко
Голанов Андрей Владимирович — радиолог, доктор медицинских наук, профессор, заведующий отделением радиологии и радиохирургии НИИ нейрохирургии им. Н. Н. Бурденко
Козлова Антонина Борисовна — нейрофизиолог, кандидат медицинских наук, научный сотрудник лаборатории нейрофизиологии НИИ нейрохирургии им. Н. Н. Бурденко
Коновалов Александр Николаевич — нейрохирург, доктор медицинских наук, профессор, академик РАН, НИИ нейрохирургии им. Н. Н. Бурденко
Кушель Юрий Вадимович — нейрохирург, доктор медицинских наук, ведущий научный сотрудник НИИ Нейрохирургии им. Н. Н. Бурденко
Окишев Дмитрий Николаевич — нейрохирург, кандидат медицинских наук, научный сотрудник отделения сосудистой нейрохирургии НИИ нейрохирургии им. Н. Н. Бурденко
Пронин Игорь Николаевич — нейрорадиолог, доктор медицинских наук, профессор, главный научный сотрудник отделения нейрорентгенологии, заместитель директора НИИ нейрохирургии им. Н. Н. Бурденко
Хухлаева Елена Анатольевна — невролог, кандидат медицинских наук, старший научный сотрудник детского нейрохирургического отделения НИИ нейрохирургии им. Н. Н. Бурденко
Шишкина Людмила Валентиновна — патоморфолог, кандидат медицинских наук, заведующая лабораторией патоморфологии НИИ нейрохирургии им. Н. Н. Бурденко
Список сокращений
АВМ — артериовензная мальформация
АГ — ангиография
АМГЭ — амигдалогиппокампэктомия
БЖ — боковой желудочек
ВА (ВМ) — венозная ангиома (венозная мальформация)
ВВБ — вертебро-базилярный бассейн
ВПШ — вентрикулоперитонеальное шунтирование
ВСС — верхний сагиттальный синус
ВЧГ — внутричерепная гипертензия
ГЭБ — гематоэнцефалический барьер
ЗН — зрительный нерв
КМ — кавернозная мальформация
КТ — компьютерная томография
МРТ — магнитно-резонансная томография
МРТ-АГ — магнитно-резонансная ангиография
НКМ — наследственные кавернзные мальформации
ПМА — передняя мозговая артерия
РХ — радиохирургия
СКТ-АГ — спиральная компьютерная ангиография
СМА — средняя мозговая артерия
ТА — телеангиэктазия
ТМО — твердая мозговая оболочка
ХСО — хиазмально-селлярная область
ЭЭГ — электроэнцефалография
МЭГ — магнитоэнцефалография
Введение
Кавернозные мальформации (КМ, каверномы, кавернозные ангиомы) центральной нервной системы представляют собой один из вариантов сосудистых мальформаций, которые могут формироваться в различных отделах головного и спинного мозга. Спектр клинических проявлений этой патологии достаточно широк — от бессимптомного носительства до тяжелых повторных кровоизлияний, приводящих к стойкой инвалидности или смерти больного. Благодаря повсеместному распространению и техническому совершенствованию современных методов нейровизуализации, кавернозные мальформации различных отделов ЦНС обнаруживают все чаще, и поток больных, обращающихся к неврологам и нейрохирургам с этим диагнозом, постоянно возрастает. Тем не менее, каверномы остаются редким заболеванием, что, с учетом разнообразия его клинических проявлений и течения, затрудняет правильный выбор по ведению больного, особенно в небольших нейрохирургических отделениях, не обладающих достаточным опытом по лечению этой патологии.
В предлагаемой книге представлен опыт НИИ нейрохирургии им. акад. Н. Н. Бурденко по хирургическому и консервативному лечению более 1500 больных с каверномами головного и спинного мозга, а также основные сведения о каверномах, содержащиеся в мировой литературе.
Книга позволит широкому кругу нейрохирургов и неврологов получить представление об особенностях этого заболевания и принятых в настоящее время принципах его лечения.
1. История изучения кавернозных мальформаций
1.1. Формирование представлений о КМ и их морфологической принадлежности
Первые описания сосудистых мальформаций ЦНС, согласно сведениям, приведенным в монографии H. Olivecrona and J. Ladenheim (265), появились около 300 лет назад. Они принадлежат W. Hunter, опубликовавшему в 1757 г. работу «Observation on arteriovenous malformations». Достоверные научные данные об этой патологии относятся к концу XIX века — периоду, когда началось интенсивное изучение патоморфологии нервной системы, связанное, в первую очередь, с именем крупнейшего немецкого ученого R. Virchov. В 6-ом томе Вирховского Архива за 1854 г. H. Luschka и R. Virchov обобщили накопленные к тому времени сведения о сосудистых опухолях и сосудистых аномалиях головного мозга. Отличительной особенностью некоторых из этих образований являлось наличие отграниченных от мозга полостей, или «каверн», заполненных кровью, поэтому авторы предложили называть их каверномами, или кавернозными ангиомами. Каверномы были первоначально отнесены к опухолям, но при дальнейшем анализе R. Virchov приходит к выводу, что эти образования представляют собой порок развития сосудистой системы мозга, а в последующих исследованиях выделяет несколько вариантов этих пороков. В публикации 1863 года он разделяет все сосудистые мальформации на простые ангиомы (в эту группу отнесены также телеангиоэктазии), кавернозные ангиомы, группу рацемозных ангиом (артериальный, венозный и артериовенозный варианты) и лимфангиомы (339). Несмотря на достаточно определенные заключения, сделанные R. Virchov, на протяжении всей первой половины XX века клиницисты и морфологи продолжали обсуждать вопрос о происхождении различных патологических сосудистых образований ЦНС, полностью не исключая принадлежность некоторых из них, особенно каверном, к сосудистым неоплазмам (226, 257, 285, 351, 365). Это представление основывалось на наблюдениях, доказывающих возможность истинного роста некоторых сосудистых образований (365). Большой вклад в изучение вопроса о морфологической принадлежности кавернозных ангиом внесли патоморфологи D. Russell, L. Rubinstein (300), которые в обширном исследовании закрепили представление об этих образованиях, как о пороках развития сосудистой системы мозга, отметив при этом, что каверномы не всегда являются статичными и способны к структурным изменениям.
В настоящее время представление о каверномах как о пороках развития сосудистой системы мозга является общепринятым.
1.2. Классификация и терминология
Изучение макро- и микроструктуры различных пороков развития сосудистой системы мозга (сосудистых мальформаций) показало, с одной стороны, их многообразие, с другой — существование определенных групп патологических образований, имеющих общие морфологические характеристики. Выделение этих групп послужило основанием для создания классификаций сосудистых мальформаций (119, 257, 265, 300, 339). Базовые принципы этих классификаций сходны. В клинической практике наибольшее распространение получила классификация американского патоморфолога W. McCormick, опубликованная в 1966 году. На достаточно большом для того времени морфологическом материале (70 случаев) он убедительно показал, что патологические сосудистые образования мозга могут быть разделены на 5 групп (233). Приводим эту классификацию в том виде, в котором она была впервые опубликована:
1. Телеангиоэктазия (включая некоторые случаи синдрома Штурге — Вебера)
2. Варикс (включая некоторые мальформации вены Галена)
3. Кавернозная мальформация («ангиома»)
4. Артериовенозная мальформация («ангиома»)
5. Венозная мальформация («ангиома»)
(включая некоторые случаи синдрома Штурге-Вебера).
Приведенная в первоначальном виде, классификация позволяет понять, почему в дальнейшем для обозначения какого-либо одного типа сосудистой мальформации могли быть использованы различные термины. В частности, синонимами «кавернозной мальформации» следует считать термины «кавернозная ангиома» и «кавернома», хотя первый из этих терминов наиболее точно характеризует тип патологии.
W. McCormick детально описал макро- и микроструктуру мальформаций каждого типа и признаки, которые отличают один тип от другого (236). Он также показал, что описанные ранее в литературе сосудистые мальформации легко «укладываются» в эту классификацию. В то же время, им отмечено, что существуют мальформации, в микроструктуре которых содержатся элементы, характерные для разных типов, что не позволяет однозначно отнести их к какой-либо из описанных групп. В качестве примера автор приводит сочетание телеангиоэктазий с кавернозными ангиомами. Такие мальформации стали называть смешанными.
Смешанные мальформации, а также мальформации, которые невозможно отнести к какому-либо варианту и часто обозначаемые, как «не классифицируемые», описаны в дальнейшем и другими авторами (39, 43, 282). На основании существования таких форм, а также отсутствия четких различий в клинических проявлениях различных мальформаций, некоторые исследователи и в 60-е годы, и в последующем (218, 235), считали, что предложенная McCormick классификация имеет лишь концептуальное, но не практическое значение. Однако анализ последующих публикаций опровергает это мнение. Классификация, с незначительными вариантами, касающимися, главным образом, дифференцировки венозных ангиом, до настоящего времени является основной при определении типа сосудистой мальформации на основании гистологического исследования, и широко используется при изучении сосудистых мальформаций ЦНС, в том числе, и в исследованиях по дифференцированному лечению мальформаций различных типов.
1.3. Диагностика
До появления КТ и МРТ достоверный диагноз каверномы можно было поставить либо по результатам нейрохирургического вмешательства с последующим морфологическим исследованием удаленной ткани, либо на аутопсии. Предоперационное обследование больного, включая ангиографию, позволяло лишь предположить наличие сосудистой мальформации, отличающейся от АВМ или венозной ангиомы. Такое предположение могло быть высказано, если у больных с типичным для сосудистой мальформации клиническим течением заболевания ангиография не выявляла сосудистой патологии, либо обнаруживала неопределенные изменения сосудистой системы в виде отдельных патологических вен или не имеющей специфических черт сосудистой сети. В 1956г J. Crawford, D. Russell предложили называть небольшие мальформации (менее 2см), которые было сложно обнаружить при обследовании, «скрытыми сосудистыми мальформациями» (92). Это понятие, наряду с предложенным позже и аналогичным по смыслу понятием «ангиографически скрытые сосудистые мальформации», получило широкое распространение и использовалось в клинической практике на протяжении нескольких десятилетий, вплоть до появления КТ и МРТ. При морфологическом исследовании «скрытые сосудистые мальформации» чаще всего оказывались каверномами, реже — другими вариантами мальформаций: микро АВМ; тромбированными, и потому не контрастируемыми при ангиографии, АВМ; телеангиоэктазиями; осумкованными хроническими внутримозговыми гематомами без признаков мальформации. Дискуссия о природе образований, обозначаемых этими терминами, отражена в большом числе публикаций (59, 113, 143, 177, 188, 218, 295, 312, 320, 332, 333).
Появление КТ, а затем и МРТ, привело к кардинальным изменениям в диагностике патологии мозга, в том числе, каверном: КТ позволила «увидеть» не обнаруживаемые при ангиографии образования у больных с типичной клинической картиной сосудистого заболевания мозга, а МРТ дала возможность с высокой степенью точности определять структуру этих образований и ставить дооперационный прижизненный диагноз каверномы (18, 314, 358). Тем не менее, и после внедрения МРТ в клиническую практику термин «скрытые сосудистые мальформации» можно было встретить в литературе вплоть до конца 90-х годов прошлого века. В настоящее время понятия «скрытые сосудистые мальформации» и «ангиографически скрытые сосудистые мальформации» используются крайне редко. По мнению С. Mottolesse c соавт., (254) в эру МРТ каверномы нельзя считать «скрытой» патологией. Тем не менее, следует признать, что в ряде случаев гистологический тип мальформации, несмотря на тщательные инструментальные и морфологические исследования, остается не идентифицированным. В наибольшей степени это относится к не удаленным образованиям и к мелким образованиям, которые разрушаются во время кровоизлияния.
1.4. Развитие клинических представлений и методов лечения
В связи со сложной диагностикой, не всегда очевидными показаниями к операции, а также редкими летальными исходами, накопление различных сведений о каверномах происходило достаточно медленно. По данным K. Voigt, M. Yaşargil, к 1976 году в литературе были представлены 163 клинических наблюдения каверном (341). К 90-м годам XX века эта цифра выросла до нескольких сотен больных. В этот период серии, представляемые отдельными клиниками, включали не более 2—3-х десятков случаев. Изменение диагностических возможностей в связи с внедрением в широкую клиническую практику КТ и, в особенности, МРТ, привело к быстрому росту числа выявляемых кавернозных мальформаций. Это позволило существенно расширить представления о клинических проявлениях патологии, методах и результатах лечения больных.
Совершенно новое направление приобрело изучение каверном после открытия генов, ответственных за развитие наследственных (семейных) форм болезни. О существовании семейных случаев каверном было известно уже в первой половине 20-го века. H. Olivecrona, анализируя историю вопроса, ссылается на работу H. Kufs, опубликованную в 1928г, в которой впервые описан такой вариант заболевания (194, 265). Аналогичное наблюдение приводят H. Kidd, J. Cumings в публикации 1947г (178). Примерно с 70-х годов стало появляться все больше сообщений о семьях, в которых каверномы обнаруживали у двух и более кровных родственников (55, 80, 86, 131, 156, 229, 245, 262, 358). В исследовании L. Hayman с соавт. впервые на клиническом уровне был доказан аутосомно-доминантный тип наследования заболевания (156). С начала 90-х годов началась эра генетических исследований с идентификацией генов, обусловливающих формирование каверном (36, 45, 62, 75, 91, 93, 98, 107, 142, 144, 149, 166, 167, 193, 200, 212, 216, 258, 268).
Об удалении каверномы впервые сообщено Bermer и Carson в 1890 году (по Penfield W, Ward A., 274) Первая обзорная работа по хирургическому лечению каверном, опубликованная в 1928г, принадлежит W. Dandy (97). В ней автор описал 5 собственных наблюдений и 44 случая, представленных в литературе. Спустя 8 лет A. Bergstrand с соавт. обобщили сведения по хирургическому лечению каверном в публикации, посвященной результатам лечения нейроваскулярной патологии в Каролинском медицинском госпитале Стокгольма (52). В последующие годы число публикаций по удалению каверном различной локализации стало быстро увеличиваться. По мере совершенствования предоперационной диагностики, нейрохирурги все лучше представляли, какое патологическое образование предстоит удалить, что, в сочетании с клиническими данными, позволило сформулировать показания и противопоказания к операции именно при этой патологии (264).
К настоящему времени операции удаления каверном получили широкое распространение и выполняются во многих нейрохирургических клиниках. Результаты вмешательств показывают, что при полном удалении этих патологических образований операция служит гарантией прекращения кровоизлияний и достаточно эффективна в отношении эпилептического синдрома, являющегося самым частым проявлением патологии (2, 23, 46, 65, 68, 82, 115, 127, 184). В то же время, хирургические вмешательства при каверномах, расположенных в функционально значимых зонах больших полушарий и в глубинных отделах мозга (базальные ганглии, зрительный бугор, срединные структуры), выполняются в ограниченном числе клиник. Показания к таким операциям и методы их выполнения остаются предметом постоянного обсуждения (53, 54, 147). Исключительную сложность для нейрохирурга представляет удаление каверном ствола головного мозга. Такие операции до настоящего времени выполняются преимущественно в наиболее крупных клиниках (29, 148, 342).
В последние десятилетия изучаются возможности радиохирургического лечения каверном. Это, прежде всего, касается каверном, прямое удаление которых сопряжено с высокой степенью риска развития осложнений. Полученные к настоящему времени данные об эффективности метода противоречивы, тем не менее, существует достаточно четкое мнение о том, что радиохирургия может быть методом выбора в ряде клинических ситуаций (152, 162, 183, 188, 190, 213, 243, 275).
К настоящему времени в литературе достаточно полно освещены самые разные вопросы, касающиеся этиологии, патогенеза, клинического течения, диагностики, методов и результатов лечения каверном ЦНС. Число представленных случаев исчисляется сотнями. Несмотря на накопленный за многие десятилетия большой объем разнообразных сведений, интерес к изучению этой патологии остается устойчивым. Ежегодно в крупных нейрохирургических и неврологических журналах появляется не менее 20 публикаций по различным аспектам проблемы, публикуются монографии и сборники с работами нейрохирургов и специалистов смежных областей.
Анализ литературы позволяет проследить, как менялись приоритеты исследований по проблеме каверном. Постепенно уменьшилось количество морфологических исследований и работ, посвященных вариантам клинического течения заболевания; на второй план отошли вопросы дифференциальной диагностики каверном; практически перестал быть предметом дискуссии вопрос о показаниях к операциям при каверномах, расположенных в доступных и функционально менее значимых областях мозга. Наряду с этим, значительно большее внимание стало уделяться проблеме лечения каверном глубинных отделов больших полушарий и ствола мозга, являющихся наиболее сложными для нейрохирургического вмешательства (5, 16, 29, 147, 148). Помимо совершенствования микрохирургической техники, при выполнении таких вмешательств предложен целый ряд вспомогательных методик, облегчающих доступ к каверномам и обеспечивающих максимально возможную сохранность окружающих структур. К ним относятся предоперационная функциональная МРТ и МРТ-трактография, ультразвуковое интраоперационное сканирование, интраоперационная МР-навигация, интраоперационная стимуляция мозга (16, 27, 56, 109, 136, 145, 164, 165, 168, 222, 254, 271, 277, 280, 325, 330, 335, 347, 350, 352). Продолжается обсуждение эффективности операций в отношении эпилептического синдрома (117, 185). В центре внимания остается вопрос о возможностях радиохирургии в лечении каверном (222, 258). В последнее десятилетие наибольшее число публикаций посвящено изучению генетики каверном, основным материалом для которого служат случаи наследственной формы заболевания. К настоящему времени определены гены, связанные с формированием каверном, выявлен целый ряд их мутаций, начата «расшифровка» молекулярной цепи, лежащей в основе нарушения ангиогенеза (36, 58, 75, 123, 167, 201, 210, 216, 237). Эти исследования позволяют предположить, что в будущем будет возможно предотвращение развития болезни на основе генной и молекулярной терапии.
2. Характеристика материала института нейрохирургии
2.1. Общие сведения
Сведения о кавернозных мальформациях ЦНС и их лечении, представляемые в книге, в значительной степени основаны на многолетнем опыте НИИ нейрохирургии. Данная глава дает общее представление о больных с кавернозными мальформациями ЦНС, оперированных или амбулаторно обследованных в институте. Более детальные сведения по различным аспектам заболевания и его лечения приведены в соответствующих разделах.
В НИИ нейрохирургии с проблемой диагностики и лечения каверном впервые столкнулись около 50 лет назад, когда в сосудистом отделении института стала активно развиваться хирургия артерио-венозных мальформаций (25). Первое документированное удаление каверномы мозжечка было произведено в 1966г. Первый анализ клинических сведений и результатов хирургического лечения 50 больных с КМ головного мозга представлен в 1993г в работе Н. Ш. Амиридзе (1). Большинство больных этой серии обследованы до появления компьютерной томографии, поэтому исследование отражает представления о патологии, которые можно было получить при существовавших в то время диагностических возможностях.
С конца 80-х — начала 90-х годов в институте ведется регистрация практически всех стационарных и амбулаторных больных с каверномами ЦНС. На разных этапах работы проводился анализ результатов обследования и лечения больных с супратенториальными каверномами (2, 23) и с каверномами ствола мозга (5, 11, 12).
В настоящем издании представлены результаты лечения около 1500 больных с КМ головного и спинного мозга. Из них более 750 оперированы, в том числе, 70 больных с глубинными каверномами больших полушарий и 220 больных с каверномами ствола мозга. Основные статистические сведения получены при обработке данных по 1272 больным. Наиболее интересные случаи, не вошедшие в этот анализ, приводятся в виде отдельных наблюдений (больные, поступившие после 2011 г.).
К настоящему времени каверномы ЦНС из редко встречающейся патологии стали для врачей института практически рутинным заболеванием. Увеличение количества больных стало особенно заметным с начала 2000-х годов, и число обращений продолжает ежегодно возрастать. Так, в 2011 г. количество обследованных в институте превысило 200 человек, что в 5 раз больше, чем в 2000 г. В последние годы практически все больные обращаются в институт с уже верифицированным с помощью МРТ диагнозом. Параллельно с этим все короче становится период от начала заболевания до консультации нейрохирурга. Эти факты служат показателем принципиального изменения диагностических возможностей различных медицинских учреждений в последние годы, и их адекватного использования в масштабах страны. Тем не менее, и в настоящее время встречаются больные, которым диагноз поставлен через много лет от начала болезни.
Среди обратившихся в институт больных женщины составили 56%, мужчины — 44%.
Средний возраст к моменту первых проявлений заболевания составил 23,0 года, к моменту поступления — 26,4 лет.
У подавляющего большинства больных каверномы имели типичные для этой патологии клинические симптомы и течение. В 44 наблюдениях каверномы явились случайной находкой (около 5% случаев). Поводом для проведения КТ или МРТ у этих больных служили какие-либо другие заболевания, различные неспецифические субъективные симптомы, чаще всего, головные боли, либо профилактическое обследование.
У большинства больных каверномы были одиночными. Множественные каверномы выявлены у 122 больных, что составило 9,6% всех наблюдений. Среди них были больные как только с супратенториальными каверномами, так и с супра- и субтенториальными образованиями. В единичных наблюдениях множественные каверномы располагались только субтенториально. У нескольких больных интракраниальные каверномы сочетались с каверномами спинного мозга. Следует отметить, что больным с каверномами головного мозга МРТ спинного мозга выполняли, как правило, только при наличии соответствующей симптоматики. МРТ головы при обнаружении спинальной каверномы также проводили лишь в некоторых случаях, поэтому точность сведений о сочетании интракраниальных и спинальных каверном низкая.
Распределение КМ по локализации представлено в табл I. Необходимо отметить, что для ряда КМ, особенно глубинного расположения и каверном крупных размеров, принадлежность к той или иной группе достаточно условна. Так например, большинство каверном III желудочка могут быть классифицированы как каверномы гипоталамической области, каверномы зрительного бугра нередко распространяются в средний мозг и т. д. Более детально локализация КМ в определенных отделах мозга представлена в соответствующих разделах книги.
Не оперированные каверномы выделены в отдельную группу, так как их гистологическая верификация отсутствует.
В целом у 1272 больных было выявлено 1430 кавернозных мальформаций. 69,3% каверном располагались супратенториально, 28,5% — субтенториально, 2,2% — в спинном мозге.
Размеры каверном составляли от нескольких миллиметров до нескольких сантиметров в диаметре. Преобладали образования небольших и средних размеров (1,5—3 см в диаметре), но в ряде случаев каверномы достигали крупных и гигантских размеров (более 4 см в диаметре).
Табл. I. Распределение кавернозных мальформаций по локализации у 1272 больных, 1993—2011 гг.*
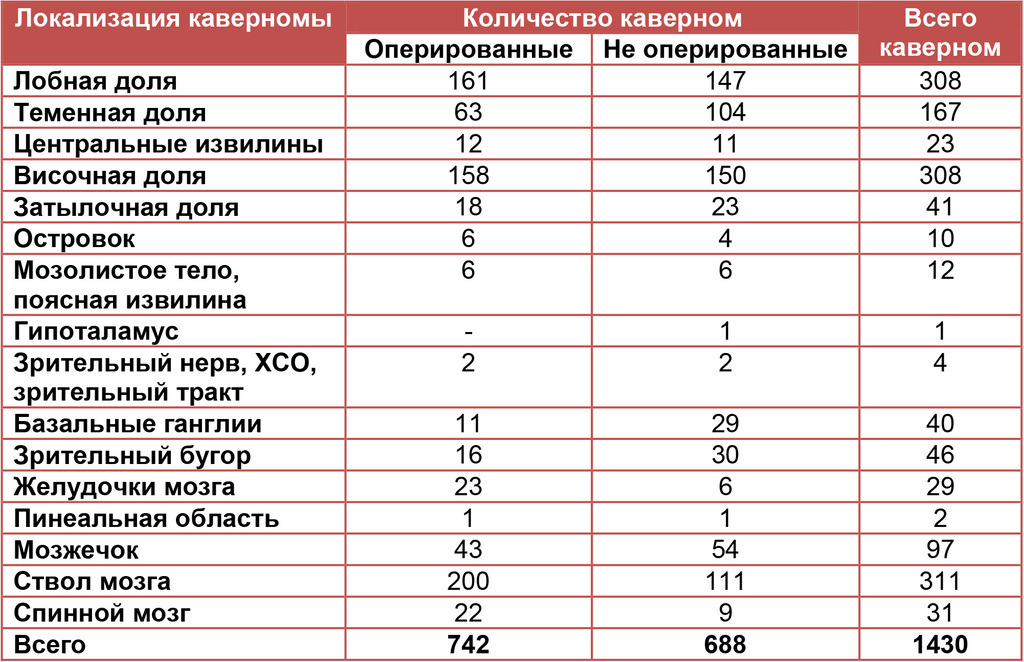
У 39 больных по данным клинического обследования установлена наследственная форма заболевания. В 23 семьях это предположение подтверждено результатами МРТ у кровных родственников (см. главу 14).
2.2. Сочетание КМ ЦНС с другой патологией
Сочетание кавернозных мальформаций с другой патологией ЦНС, а также с патологией других органов и систем установлено у 80 больных, что составило около 8% всех больных с каверномами. В эту группу не включали такие широко распространенные заболевания, как гипертоническая болезнь, атеросклероз, ИБС, сахарный диабет. Выявленные заболевания суммированы в табл. II.
Среди больных с сочетанной патологией в 20% случаев клинически проявилась только кавернома. У 44% больных клинически проявились как кавернома, так и другое заболевание. При этом симптомы каверномы и другого заболевания развивались в разной последовательности и с различными временными интервалами — от нескольких месяцев до нескольких десятков лет. В 28% случаев кавернома явилась случайной находкой. В 8% случаев установить, какое заболевание явилось причиной клинических проявлений, не представлялось возможным.
Табл. II. Сочетание кавернозных мальформаций головного мозга с другой патологией
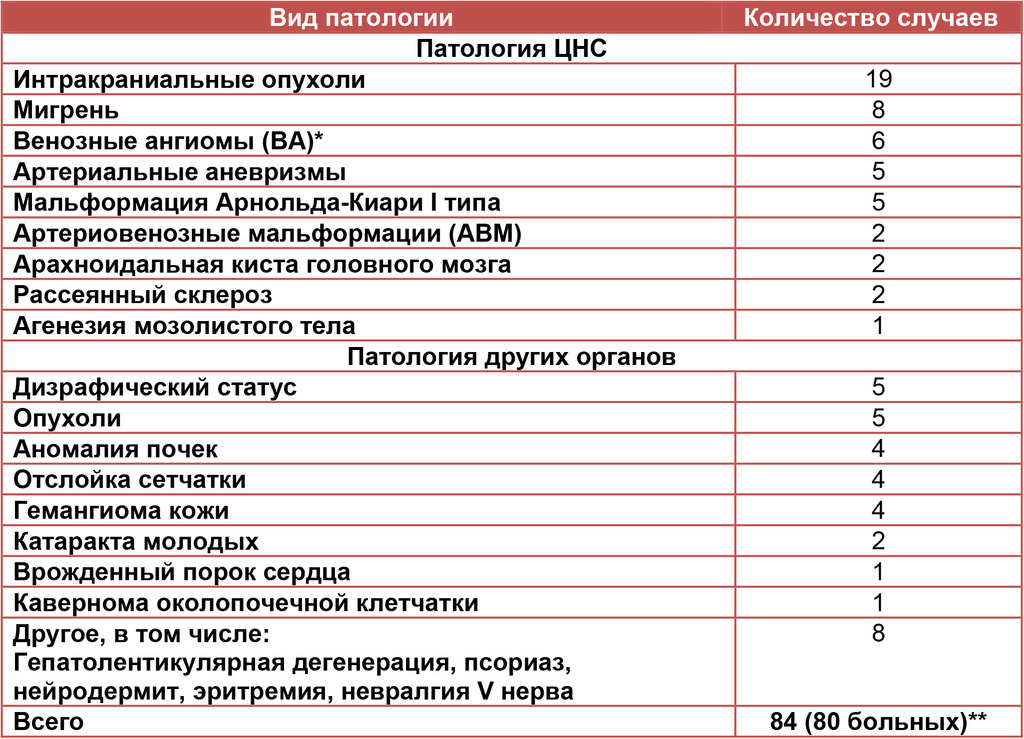
У 50-ти больных (64%) кавернозные мальформации ЦНС сочетались с другими заболеваниями нервной системы.
В 8 случаях это были сосудистые мальформации другого типа: АВМ или венозные ангиомы. Необходимо уточнить, что под «сочетанием» мы подразумевали наличие мальформации, структурно не связаной с каверномой. Случаи, когда при гистологическом исследовании удаленного образования обнаруживали ткань каверномы и другой сосудистой мальформации, отнесены в группу мальформаций смешанного типа и подробно обсуждаются в разделе «Морфология кавернзных мальформаций».
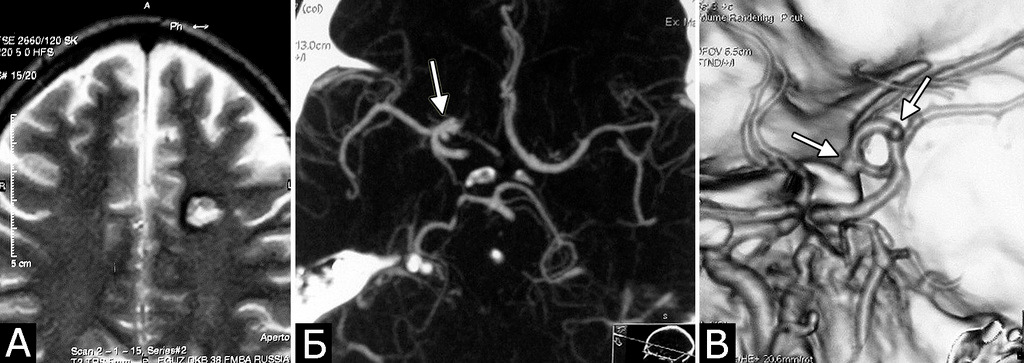
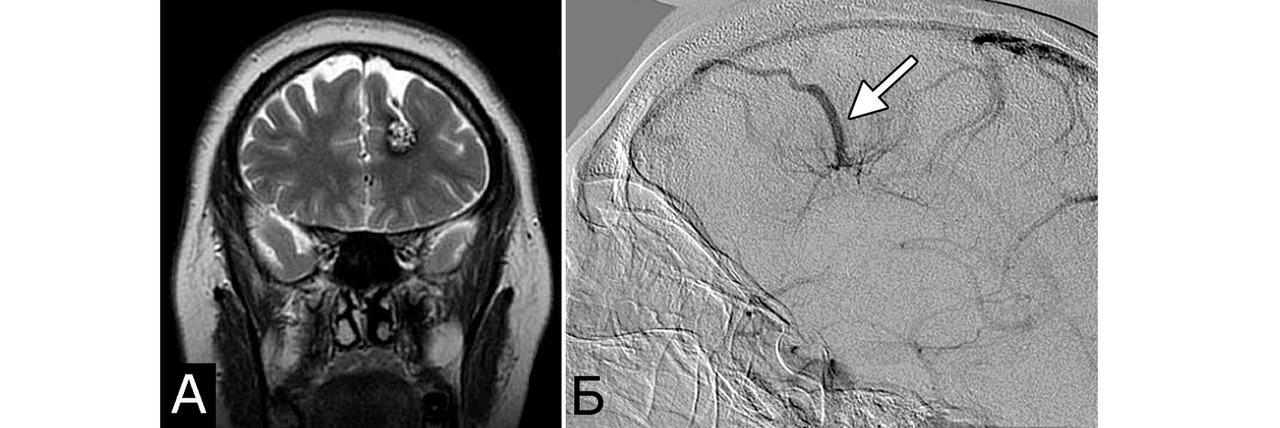
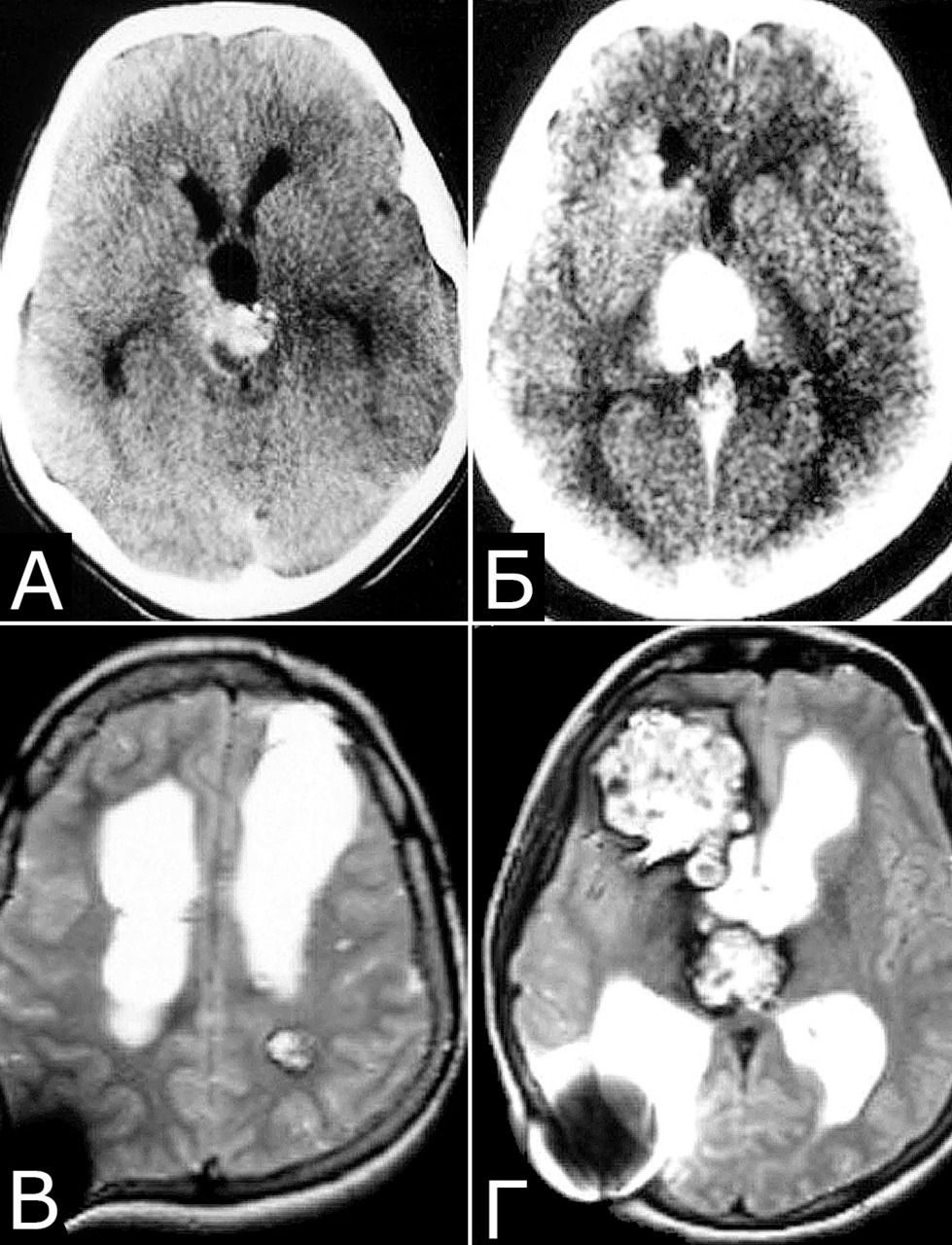
Сочетание каверномы с АВМ выявлено у двух больных, причем в обоих случаях клинические проявления заболевания были обусловлены АВМ, а кавернома явилась случайной находкой (рис. 1).
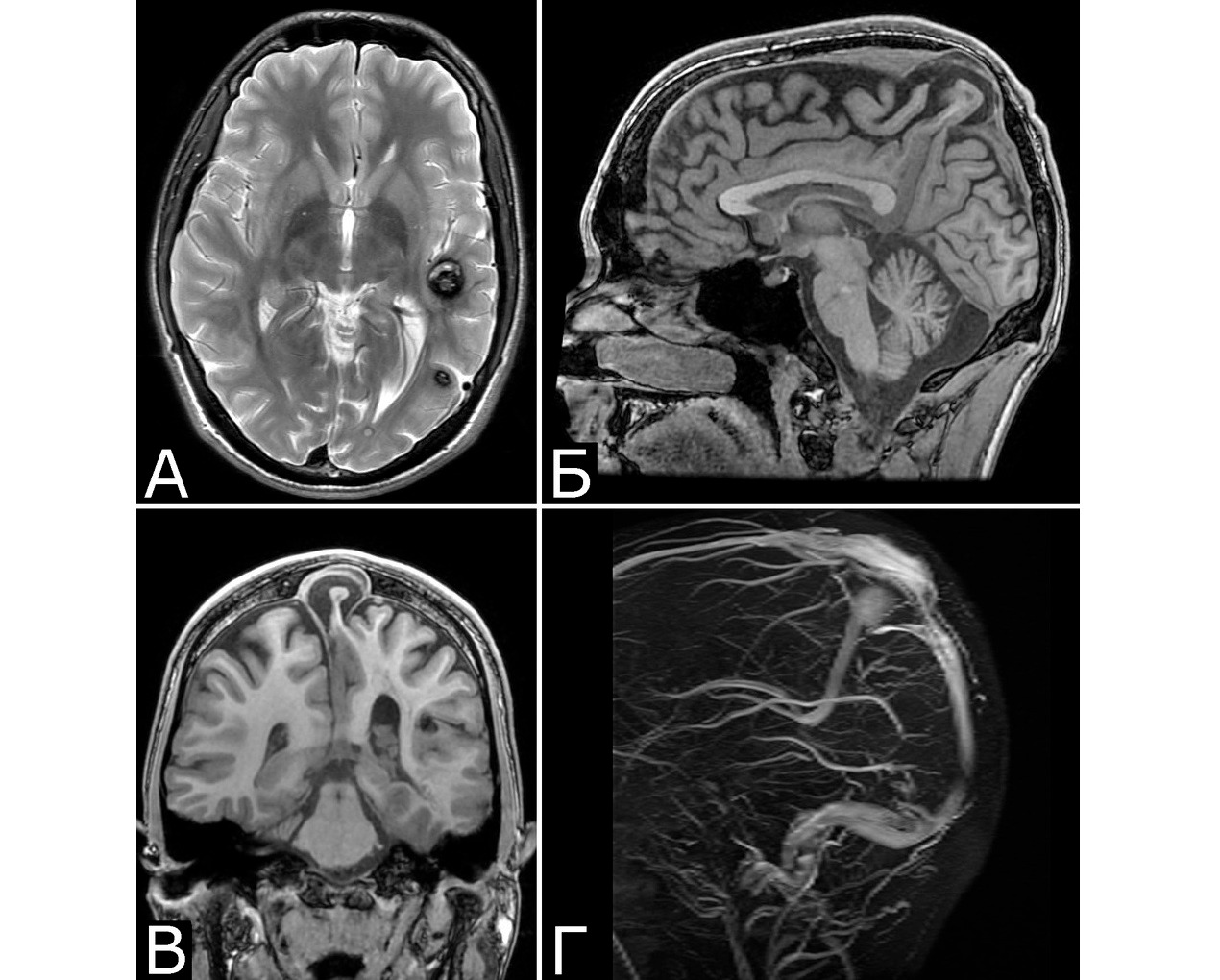
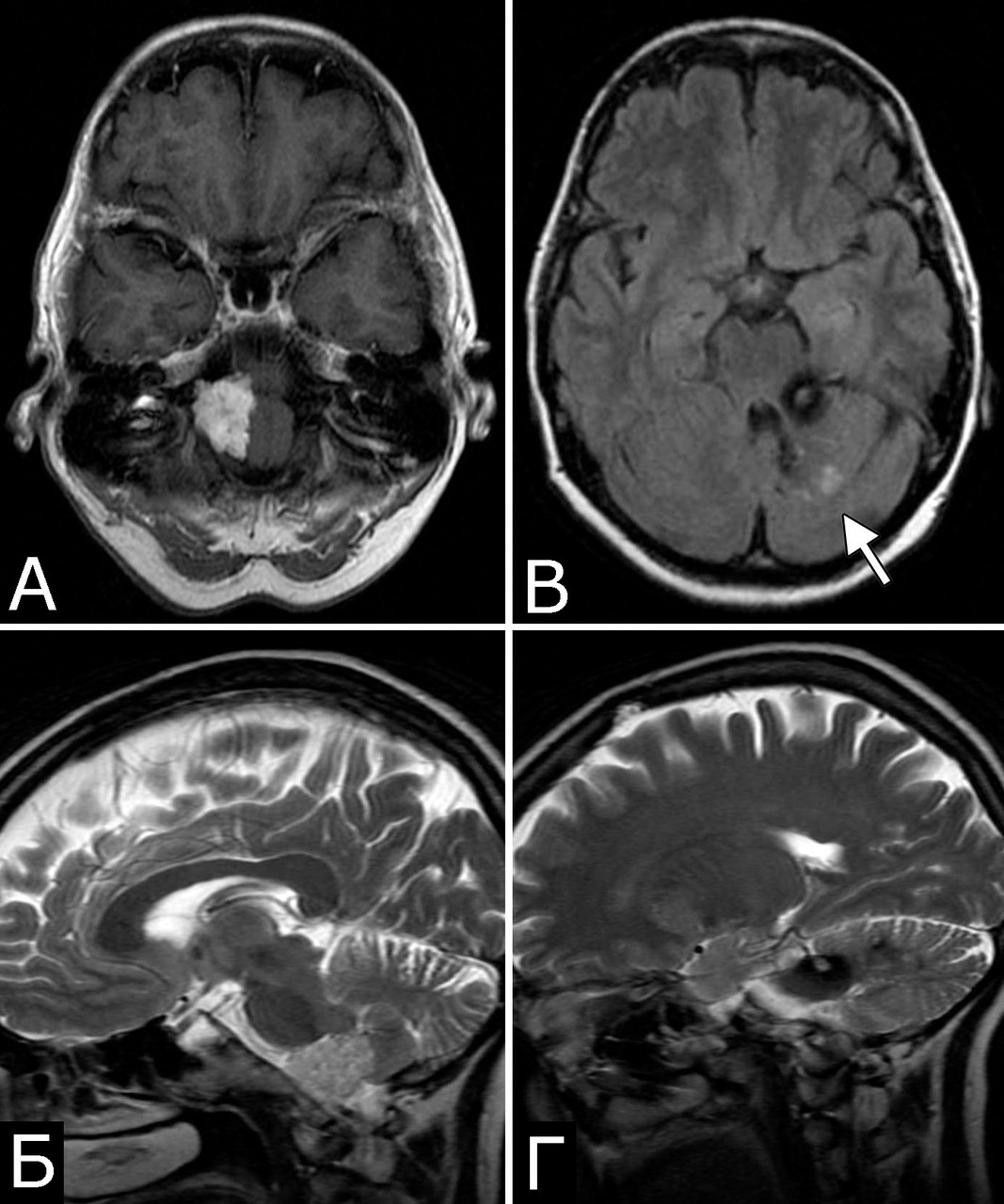
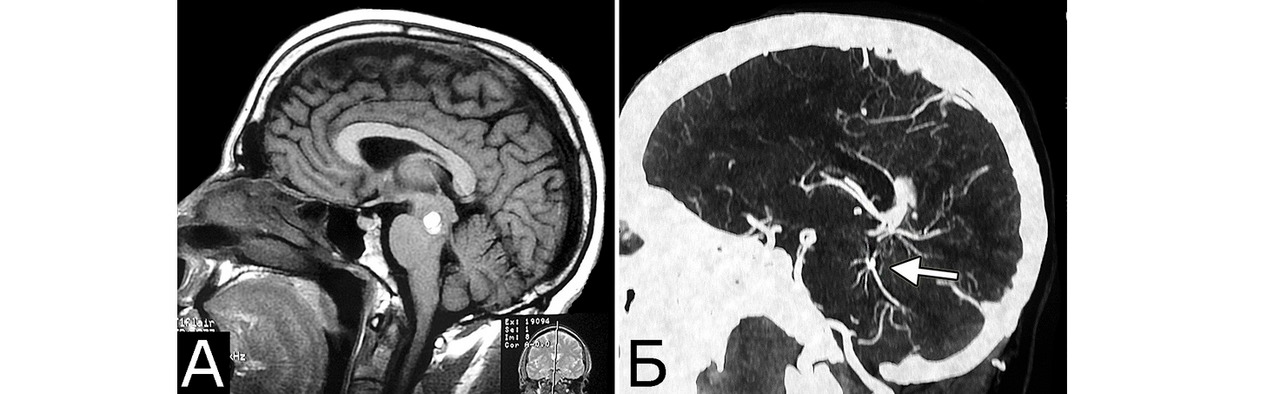
У 6 больных каверномы сочетались с венозными ангиомами и аномалиями венозной системы. Крупные патологические вены, расположенные в непосредственной близости к КМ, часто обнаруживают при МРТ или на операции, в связи с чем многие авторы рассматривают их как единую патологию (28, 93, 154, 351, 357). Тем не менее, в ряде случаев кавернозные и венозные мальформации можно четко дифференцировать как самостоятельные образования, особенно если они находятся в разных отделах мозга. У двух больных патология венозной системы представляла собой аномалию сразу нескольких крупных венозных коллекторов головного мозга (рис. 2).
Во всех случаях сочетания кавернозной и венозной ангиом клинические симптомы были обусловлены каверномами.
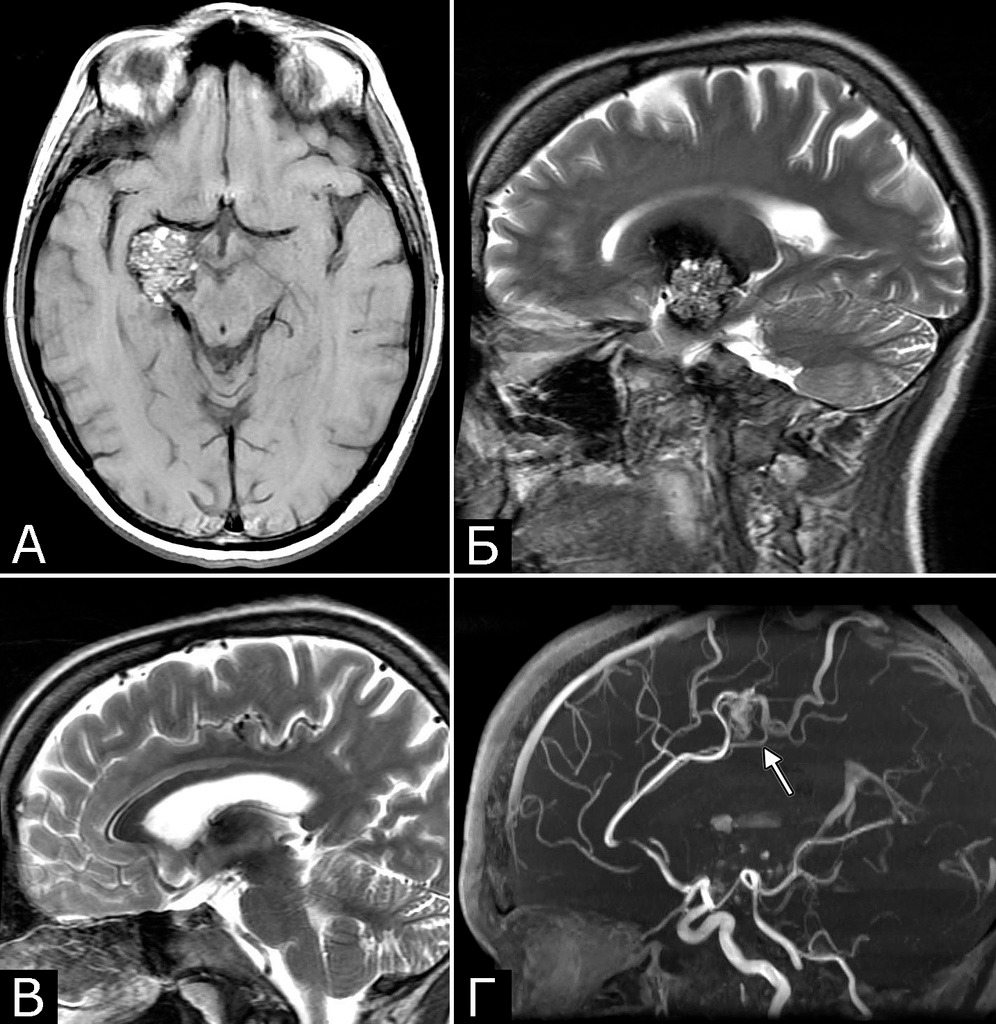
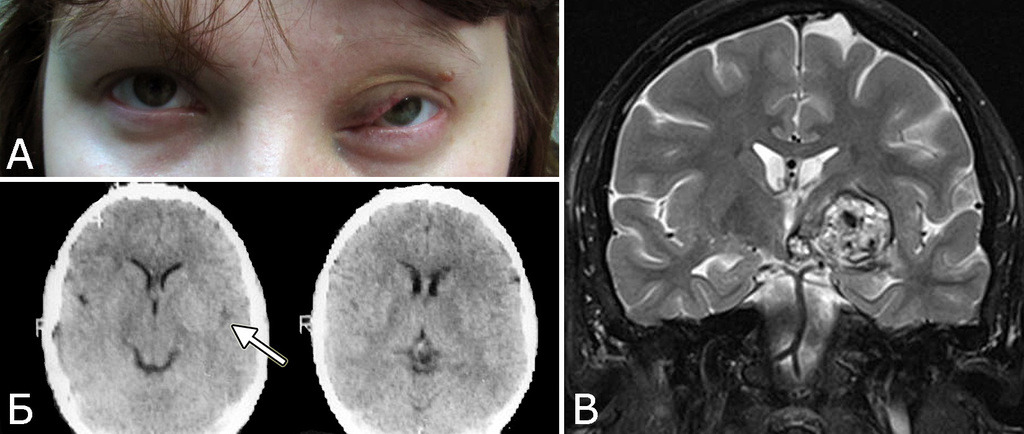
У 5-х больных с клинически проявившимися каверномами в ходе обследования выявлены бессимптомные артериальные аневризмы передних отделов вилизиева круга (рис. 3). Обращал на себя внимание тот факт, что в 4-х случаях аневризмы были множественными.
Довольно большую группу составили больные, у которых кавернома сочеталась с различными опухолями ЦНС. Чаще всего это были одиночные или множественные менингиомы различной локализации (3 наблюдения), опухоли пинеальной области (3 наблюдения), аденомы гипофиза (3 наблюдения), глиомы зрительного нерва (3 наблюдения).
(см. далее)
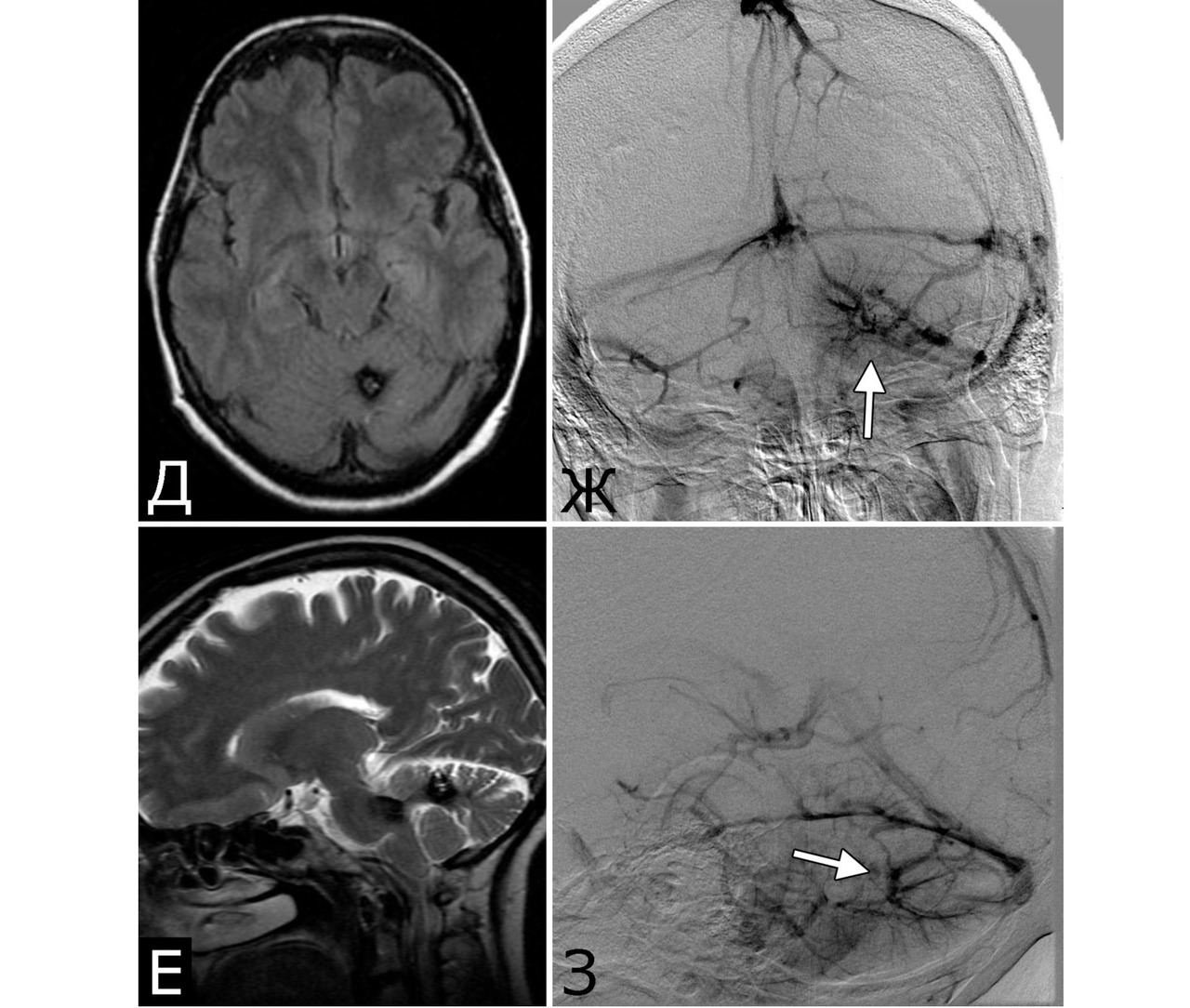
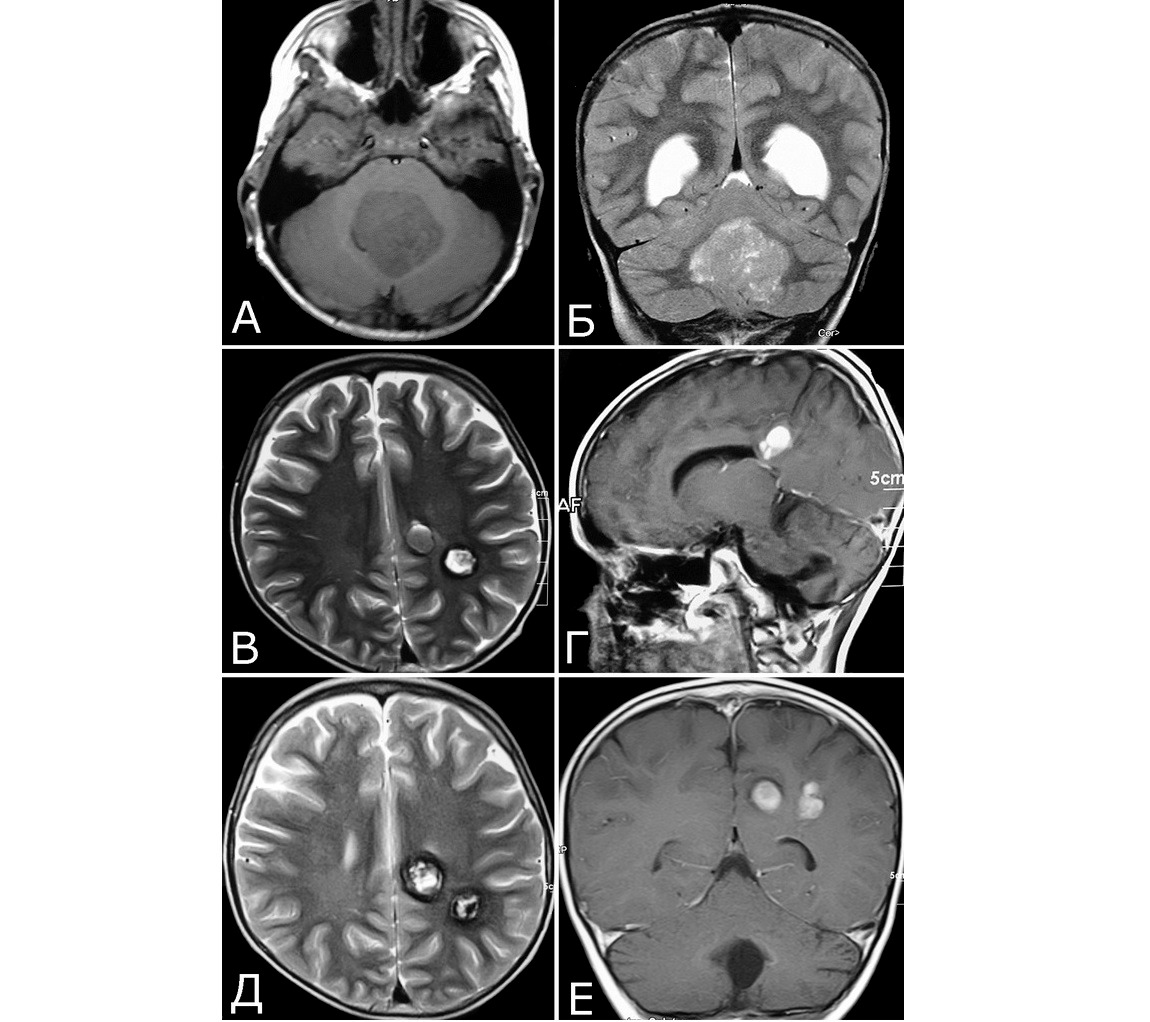
1. Опухоль (менингиома) мосто-мозжечкового угла справа (А — МРТ с введением КВ, режим Т1, аксиальная проекция, Б — МРТ, режим Т2, сагиттальная проекция); 2. КМ верхнее-медиальных отделов левой гемисферы мозжечка (В, Д — МРТ, режим Т1, аксиальная проекция, Г, Е — МРТ, режим Т2, сагиттальная проекция. Стрелкой указана дополнительная тень гиперинтенсивного сигнала — косвенный признак венозной ангиомы). 3. Венозная ангиома (стрелки) левой гемисферы мозжечка (Ж, З — прямая АГ, венозная фаза). Клиническое течение: в течение нескольких лет — сильные стреляющие и ноющие боли в левой половине лица и головы
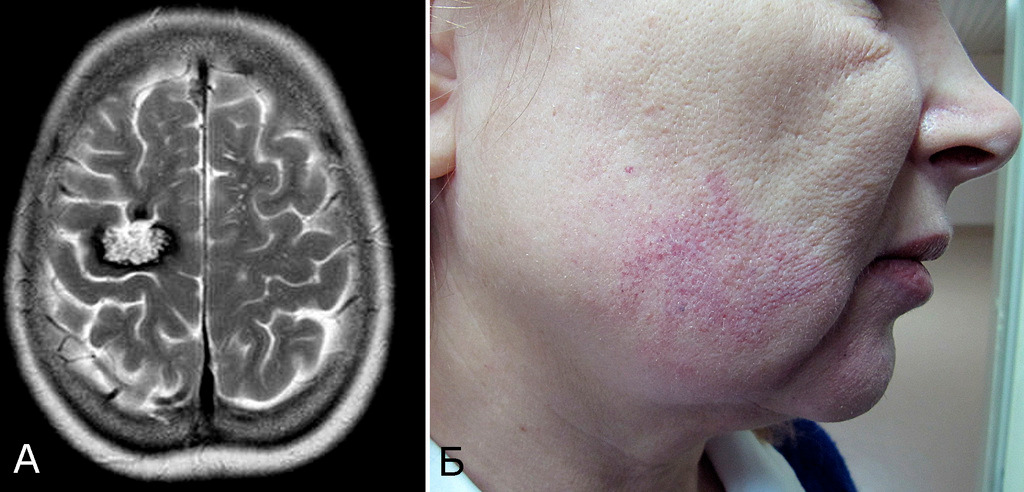
Представляет интерес наблюдение, в котором выявлены сразу три типа патологии — кавернозная мальформация, венозная ангиома и опухоль, причем все образования располагались в задней черепной ямке (рис. 4).
Среди больных с внецеребральными опухолями у трех человек были опухоли головы (ретинобластома, лимфангиома лица, опухоль височной кости).
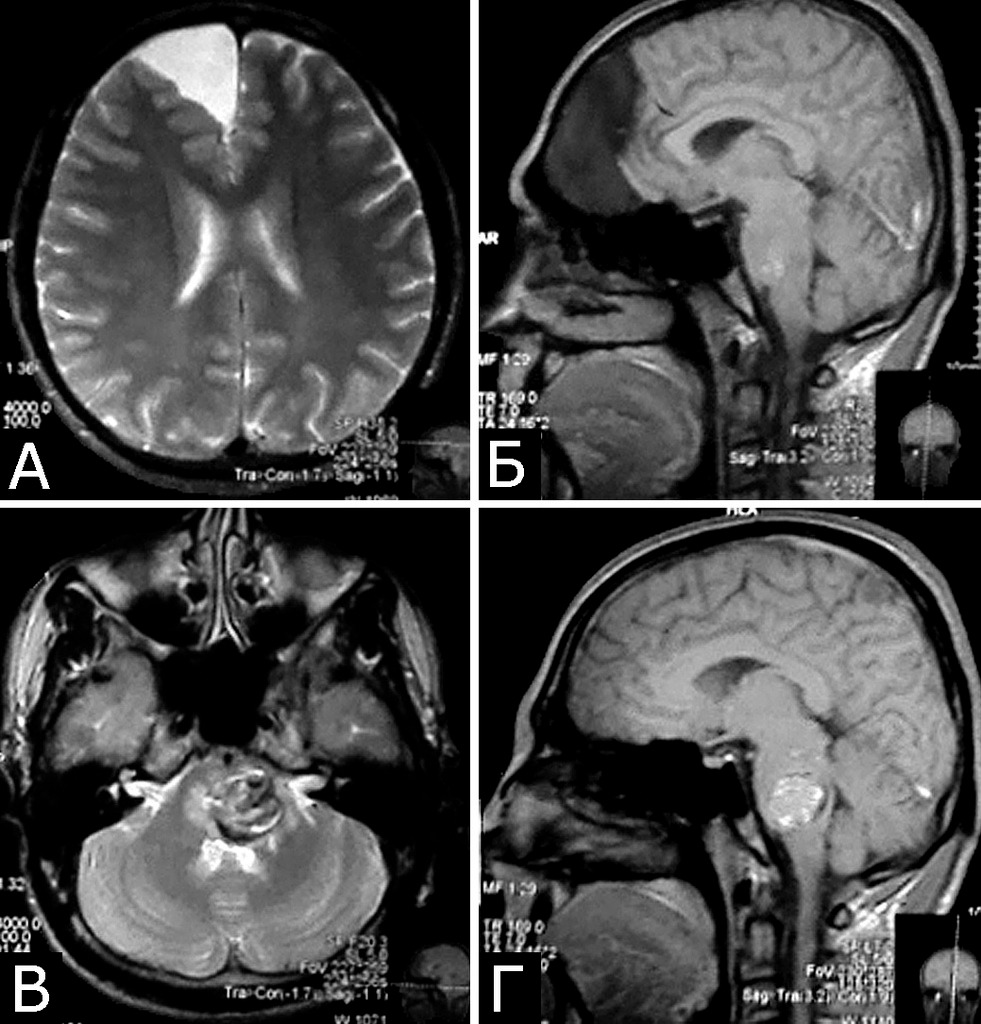
Другая церебральная патология была представлена мальформациями Арнольда-Киари I типа, арахноидальными кистами, рассеянным склерозом, тяжелой невралгией корешка тройничного нерва и другими заболеваниями (рис. 5).
Крайне редким следует считать случай сочетания множественных наследственных каверном с гепатолентикулярной дегенерацией (абдоминальная форма), которая клинически проявилась спустя несколько лет после появления симптомов, обусловленных каверномой зрительного бугра и среднего мозга (см. рис. 75).
Патология, не связанная с ЦНС, была представлена главным образом различными врожденными дефектами: дефектами, которые могут быть отнесены к дизрафическому статусу; сложным пороком сердца; аномалиями развития почек и другими заболеваниями.
Особого внимания заслуживают 4 случая врожденных гемангиом кожи, так как эта патология описана в литературе как генетически сцепленная с наследственными каверномами (рис. 6) (61, 66, 202).
У одной больной, скончавшейся после удаления каверномы мозжечка, при вскрытии обнаружена кавернома в околопочечной клетчатке.
2.3. Хирургическое лечение
Прямые хирургические вмешательства были выполнены 740 больным (58%). Подавляющее число операций заключалось в удалении каверномы. У больных с множественными каверномами удаляли одну или несколько каверном (однократное или повторное вмешательство). Нескольким больным выполнены повторные операции в связи с неполным удалением образований при первой операции. В отдельных случаях, при невозможности удалить каверному, вызывающую окклюзию ликворных путей, выполняли шунтирующие операции на ликворной системе. 55 больным было выполнено радиохирургическое лечение.
Показания и противопоказания к операциям, техника их выполнения и результаты подробно изложены в соответствующих главах.
2.4. Амбулаторное лечение и наблюдение
В случае отсутствия показаний к операции и отказа от нее больных оставляли под наблюдением. Многие их них получали консервативное лечение в виде постоянного приема антиконвульсантов. Повторные обследования включали проведение МРТ, ЭЭГ, коррекцию противосудорожной терапии. Некоторые наблюдавшиеся больные были в последующем оперированы, иногда спустя длительное время после первого обращения в институт.
Под наблюдением находились также оперированные больные. В этой группе дважды за последние 10 лет были проведены катамнестические обследования, направленные, главным образом, на оценку динамики эпилептического синдрома после операции (2, 23).
Таким образом, материал НИИ нейрохирургии представляет одну из самых больших серий кавернозных мальформаций ЦНС, представленных в литературе. Результаты морфологических исследований, клинических обследований больных, включая катамнестические исследования, опыт хирургических вмешательств, в особенности значительного числа операций по поводу глубинных КМ больших полушарий, КМ ствола мозга и спинного мозга, позволили составить представление по различным аспектам данной патологии.
3. Морфология кавернозных мальформаций
Классические описания макро- и микроскопического строения КМ принадлежат морфологам конца 19-го — первой половины 20-го века (233—236, 299, 230, 339). В России значительный вклад в изучение морфологии сосудистых мальформаций, в том числе, кавернозных, внесли исследования Ю. Медведева, Д. Мацко (20).
Существующие в НИИ нейрохирургии представления о морфологии кавернозных мальформаций основаны на анализе исследований материала, полученного во время удаления КМ (более 700 биопсий) интраоперационных данных, нескольких посмертных исследований мозга. Эти исследования, в целом полностью соответствуя мировым данным, позволили внести ряд дополнений, касающихся микроструктуры каверном и окружающих их тканей (2).
3.1. Макроскопическое строение
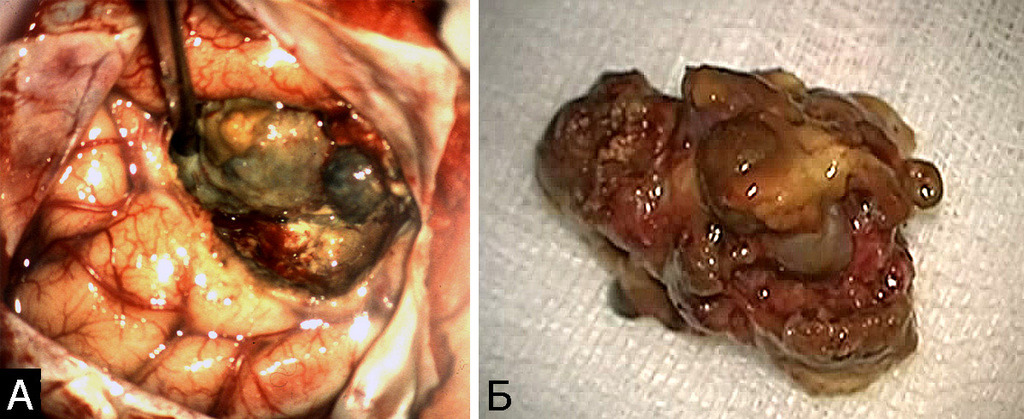
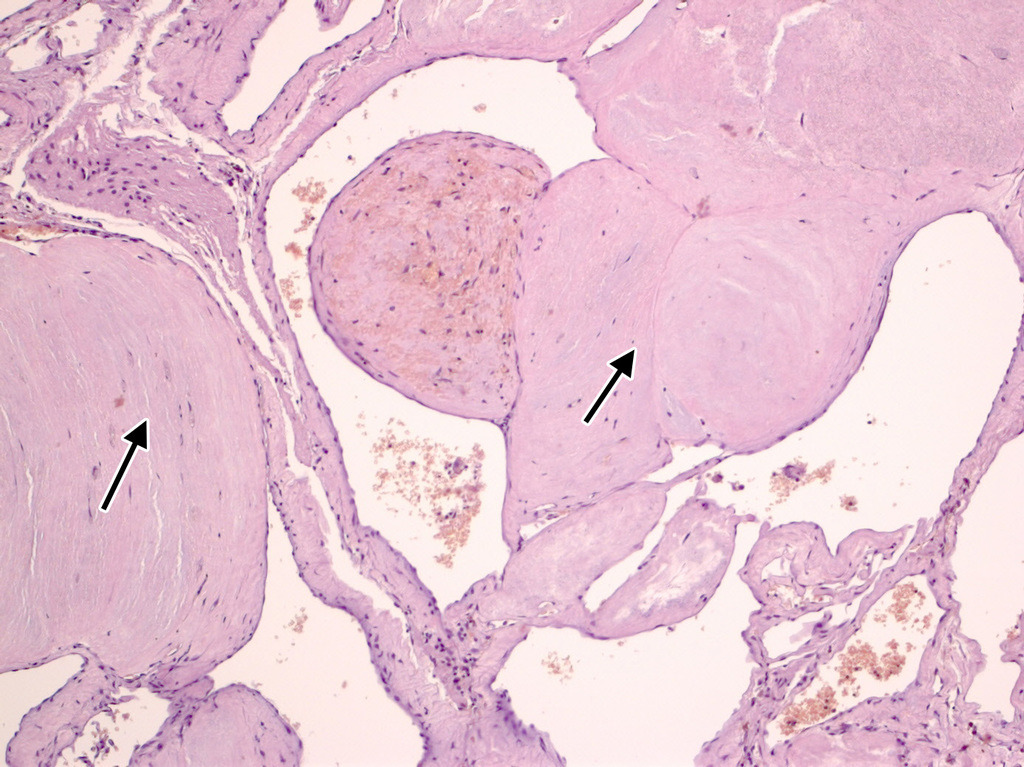
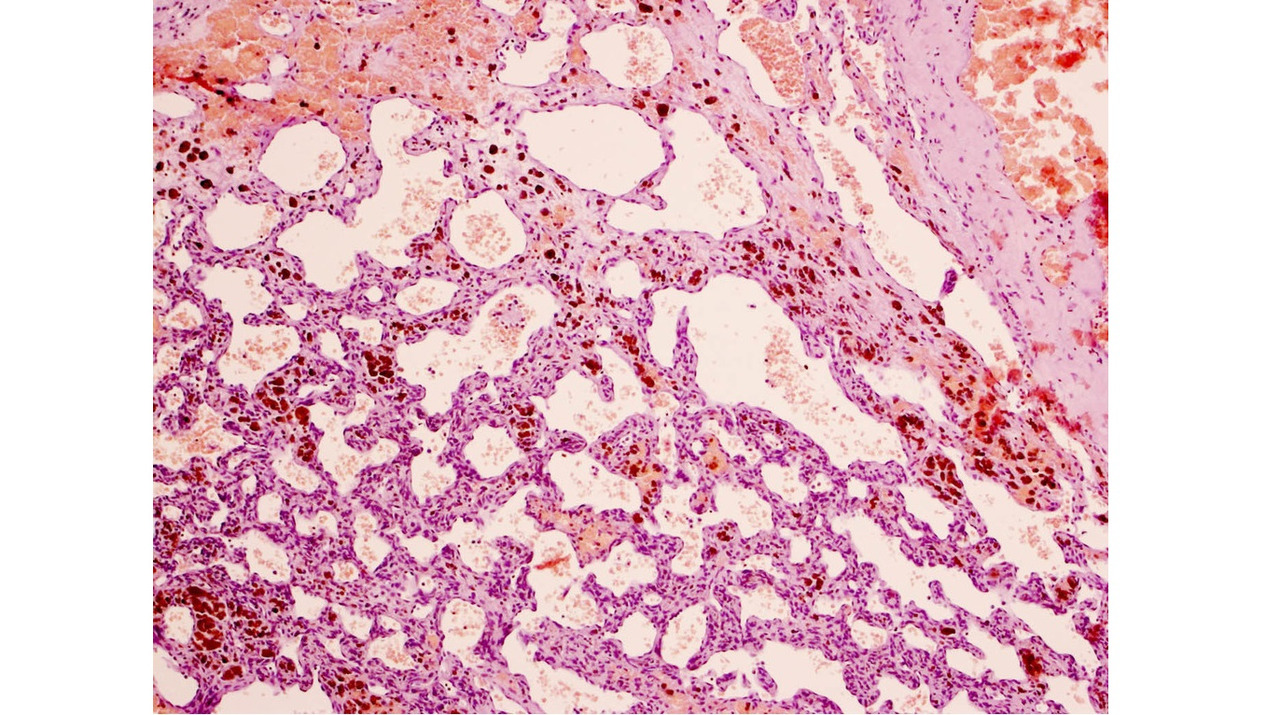
Кавернозные мальформации имеют характерный вид, который трудно спутать с каким-либо другим видом патологии. Они представляют собой округлые образования красно-синюшного или бурого цвета, с неровной, бугристой поверхностью, четко отграниченной от окружающей ткани (рис. 7).
Бугорки, образующие поверхность каверномы, представляют собой полости, заполненные кровью, которые либо плотно прилежат друг к другу, либо включены в строму каверномы в виде отдельных образований, легко отделяющихся от основного конгломерата и напоминающих горошину. Размеры венозных полостей, или «каверн», и их соотношение со стромой могут быть самыми различными. Некоторые каверномы состоят преимущественно из каверн с тонкими, быстро разрушающимися стенками. Размеры таких каверн могут быть достаточно крупными. При таком варианте строения в ходе хирургического вмешательства зачастую сложно обнаружить более или менее плотный участок, который может быть взят для гистологического исследования. Такие образования хирурги нередко характеризуют как «инкапсулированные гематомы».
На другом полюсе находятся «плотные» каверномы, состоящие преимущественно из тромбированных полостей и соединительной ткани. В некоторых из них можно обнаружить обызвествленные участки. Между этими крайними типами существует большое число различных вариантов. Эти особенности каверном хорошо определяются в ходе хирургического вмешательства, что позволило нам проанализировать частоту различных вариантов КМ при удалении мальформаций супратенториальной локализации (табл. III).
Наиболее часто встречались КМ, представленные множеством каверн, объединенных рыхлой соединительной тканью — более половины случаев. «Плотные» каверномы и каверномы, содержащие кальцификаты, встречались с одинаковой частотой. Такие КМ обнаруживали у больных самого разного возраста — от 1г до 56 лет. Тем не менее, при статистическом анализе установлено, что средний возраст больных с «плотными» и кальцифицированными каверномами был больше, чем средний возраст больных с мягкими каверномами (29,5 и 26,4 лет соответственно). Самыми молодыми (средний возраст 19,7 лет) были больные, у которых мальформации были представлены преимущественно гематомами с фрагментами мальформации. Эти данные косвенно указывают на то, что с течением времени структура КМ может становиться более плотной. Следует также отметить, что крупные мальформации чаще имели плотную структуру.
Табл. III. Характеристика структуры супратенториальных кавернозных мальформаций по данным хирургического вмешательства (179 случаев)

Ткани, окружающие каверному, чаще всего грубо изменены. Типична желтая окраска мозгового вещества, мозговых оболочек или нервов, свидетельствующая о перенесенных кровоизлияниях (рис. 8). Этот признак помогает обнаружить каверному в ходе хирургического вмешательства.
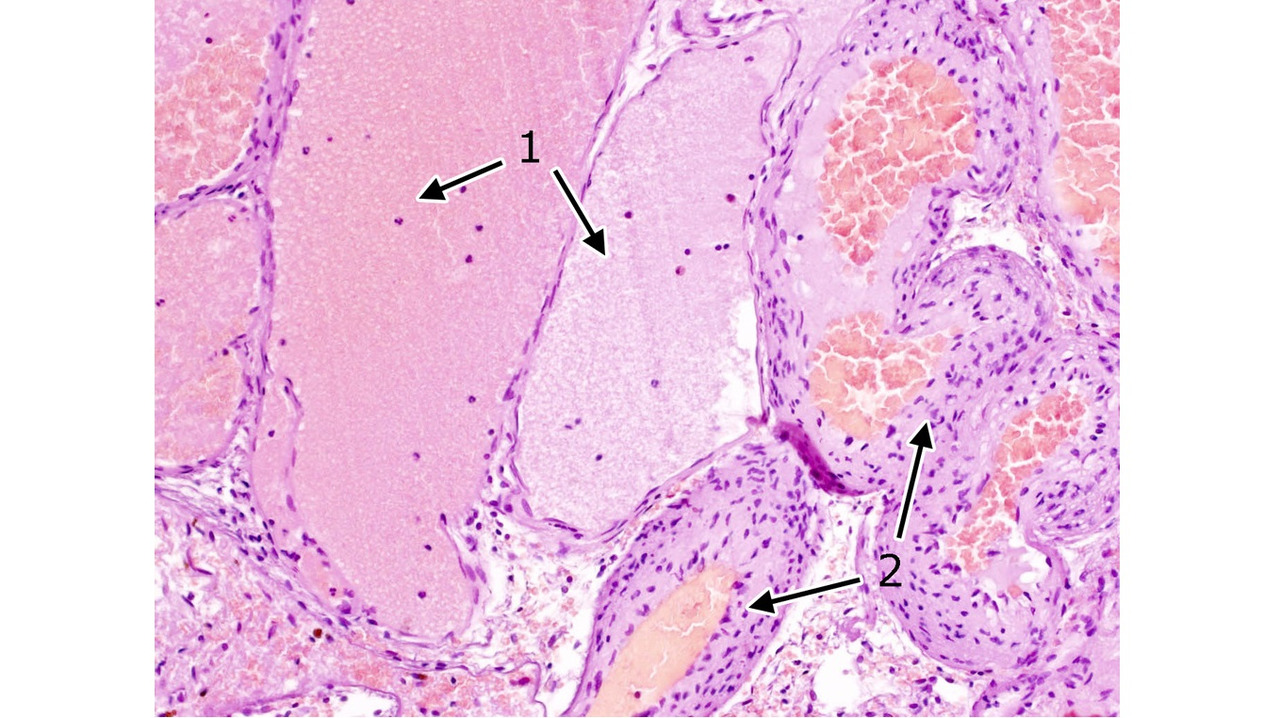
В небольшом числе случаев перифокальные изменения мозговой ткани отсутствуют (рис. 9).
При локализации каверномы в веществе мозга по ее границе в ходе операции можно видеть множество мелких артериальных сосудов, а в непосредственной близости нередко располагаются одна, реже несколько крупных патологических вен. Тем не менее, в отличие от АВМ, явные признаки шунтирования крови в каверноме отсутствуют, хотя доказательств того, что кавернозные полости полностью изолированы от кровеносной системы мозга, не существует. На этом основании некоторые авторы называют каверномы мальформациями с «медленным» типом шунтирования (low-flow malformations) (43, 146, 214). В ряде случаев патологические вены, расположенные в непосредственной близости от каверномы, имеют вид типичной венозной ангиомы по типу «головы медузы» (рис. 10, I — II). По разным данным, частота сопутствующих каверномам венозных ангиом колеблется от 0,7% до 48% (353). По сообщению R. Porter с соавт., венозные ангиомы сопутствовали КМ ствола мозга в 100% случаев (279).
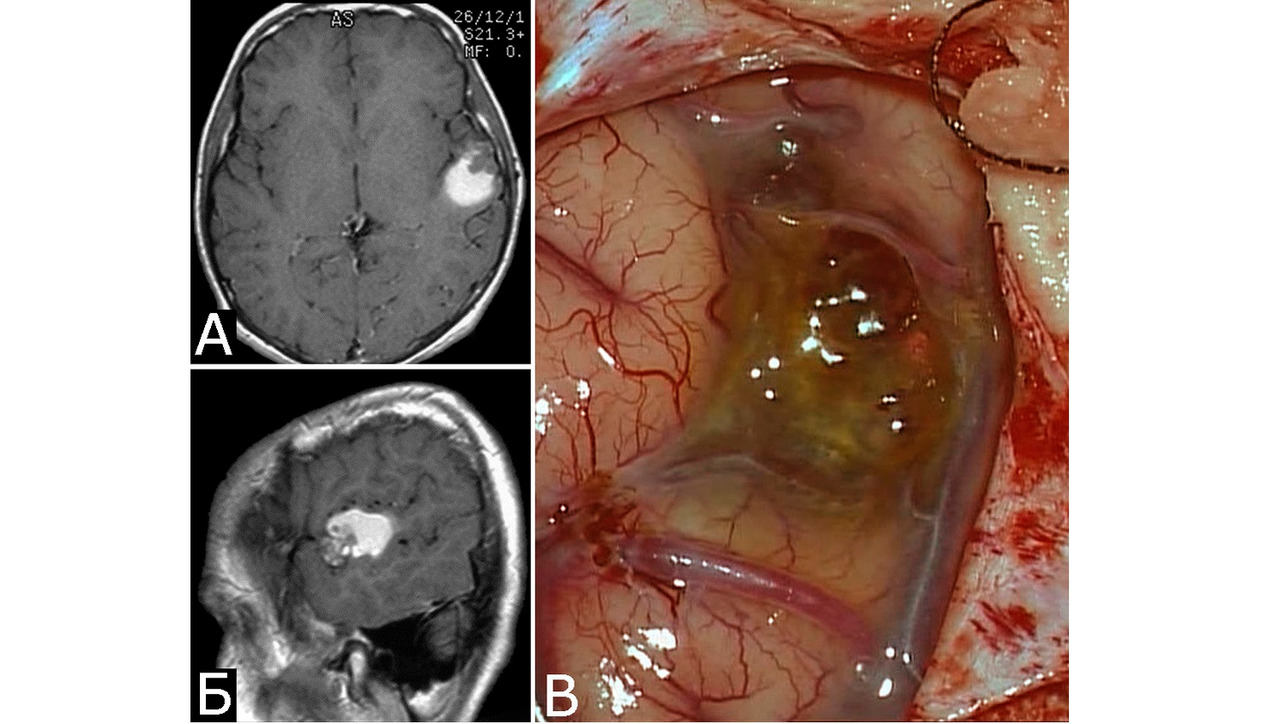
3.2. Микроскопическое строение
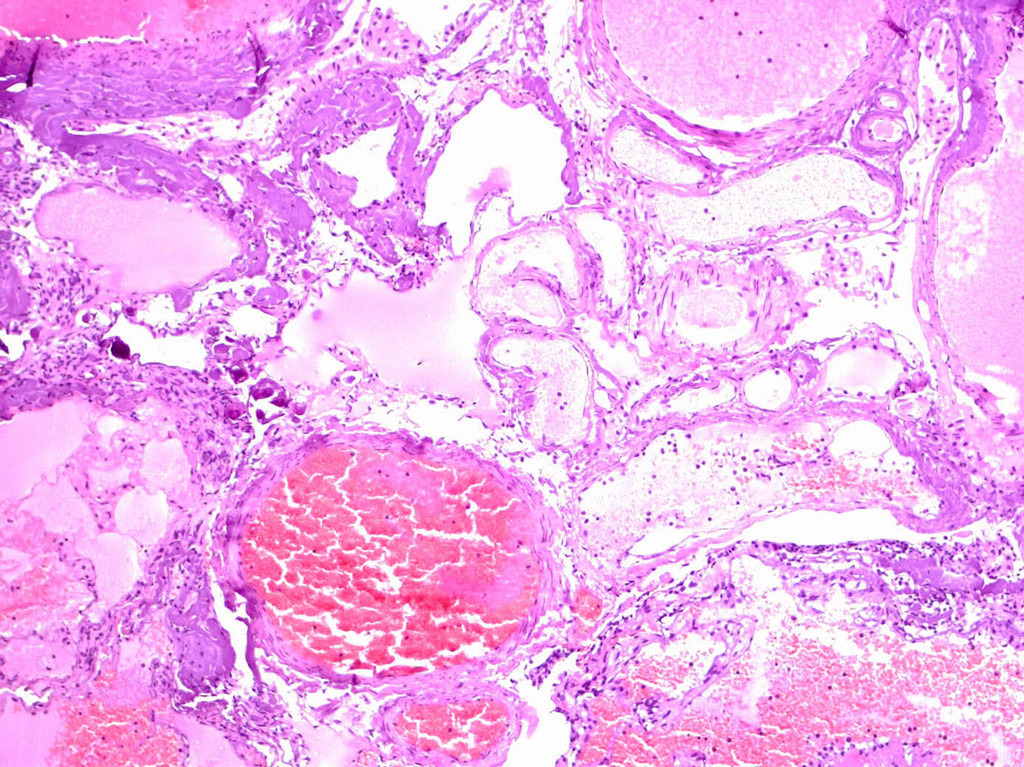
При рутинном исследовании в световом микроскопе (срезы толщиной 5 мкм, окраска гематоксилином и эозином, при необходимости — докрашивание по Ван-Гизон и Маллори) каверномы представляют собой конгломерат тонкостенных полостей разнообразной неправильной формы, выстланных эндотелием и разделенных соединительнотканными перегородками. Соединительная ткань перегородок может быть представлена как тонкими коллагеновыми волокнами, так и грубоволокнистой фиброзной тканью с различной степенью дистрофических изменений. Характерным признаком является отсутствие в стенах каверн гладкомышечных клеток и эластических волокон, а также мозговой ткани между кавернами (рис. 11) (2, 236, 299, 333).
Лишь в отдельных препаратах можно обнаружить незначительные прослойки мозговой ткани. Реактивно измененная мозговая ткань может быть также выявлена вокруг каверн, полностью отделенных, «отшнурованных», от основного конгломерата (рис. 12).
На основании этих признаков проводят дифференциальный диагноз каверном с другими сосудистыми мальформациями, прежде всего, с АВМ, при гистологическом исследовании которых выявляют сосуды артериального и венозного типа с относительно дифференцированными стенками и значительное количество мозговой ткани между ними.
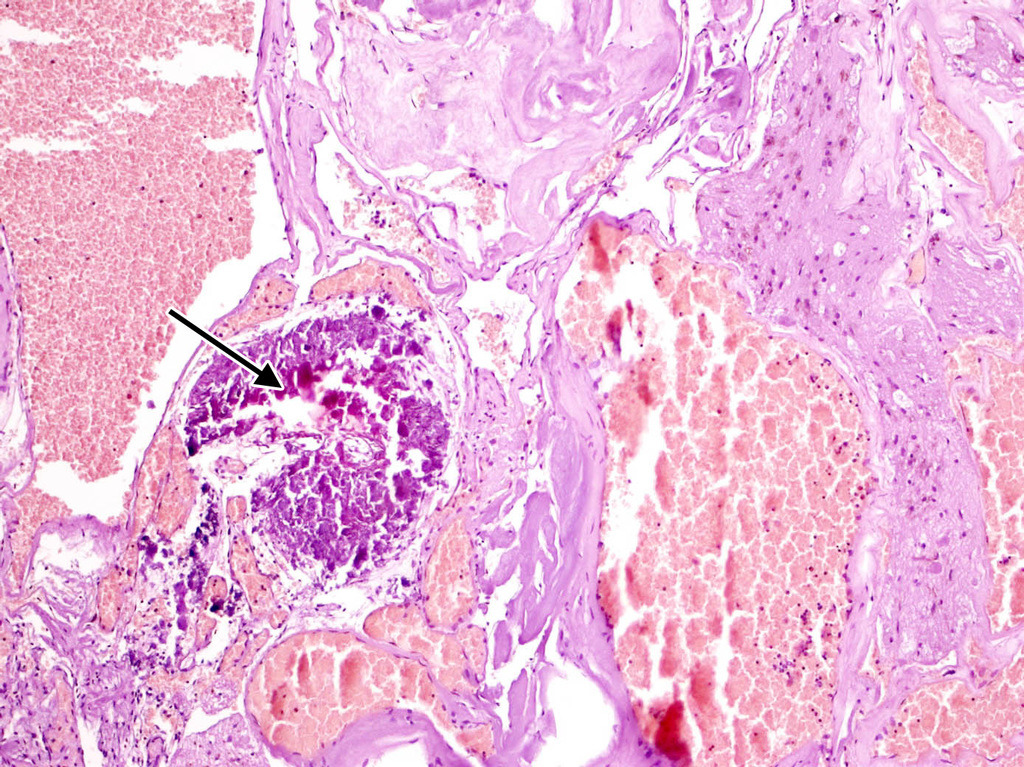
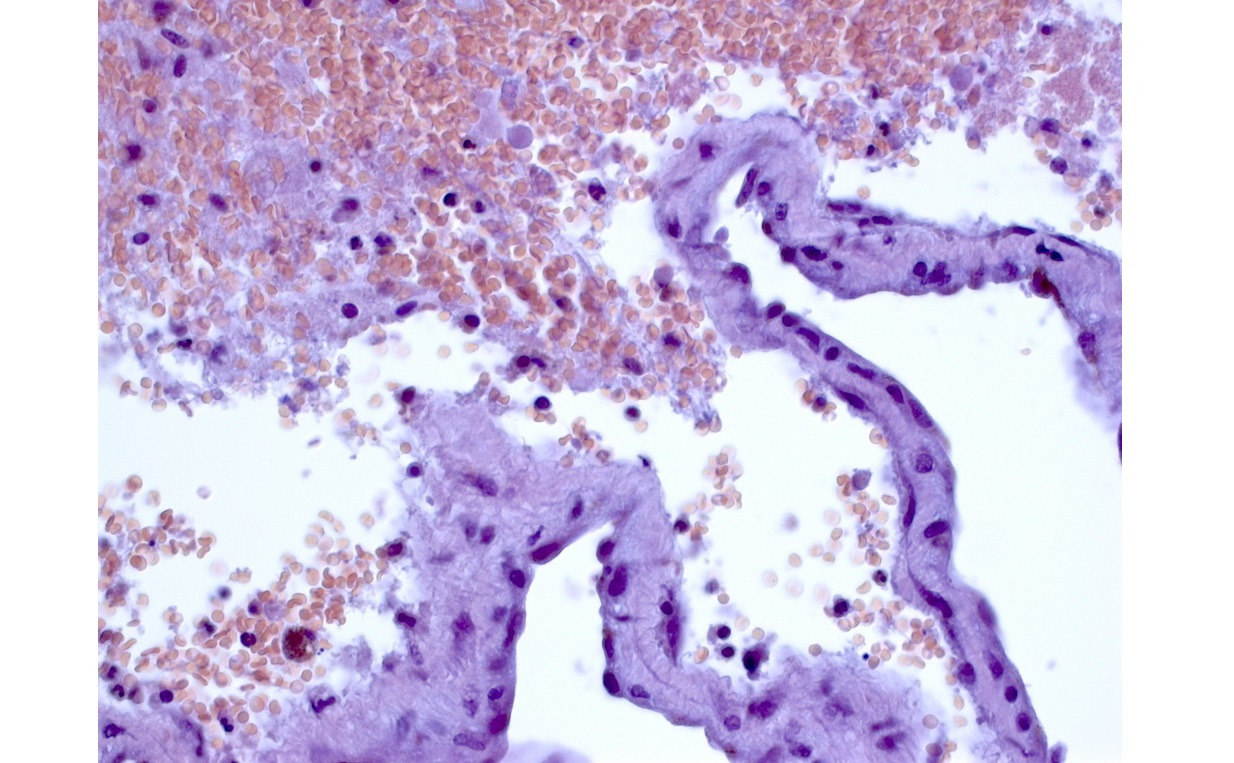
Полости, образующие каверному, могут быть заполнены жидкой кровью либо тромбами в различной стадии формирования (рис. 13).
В ткани КМ могут быть обнаружены участки кальцификации, гиалиноза стенок (рис. 14).
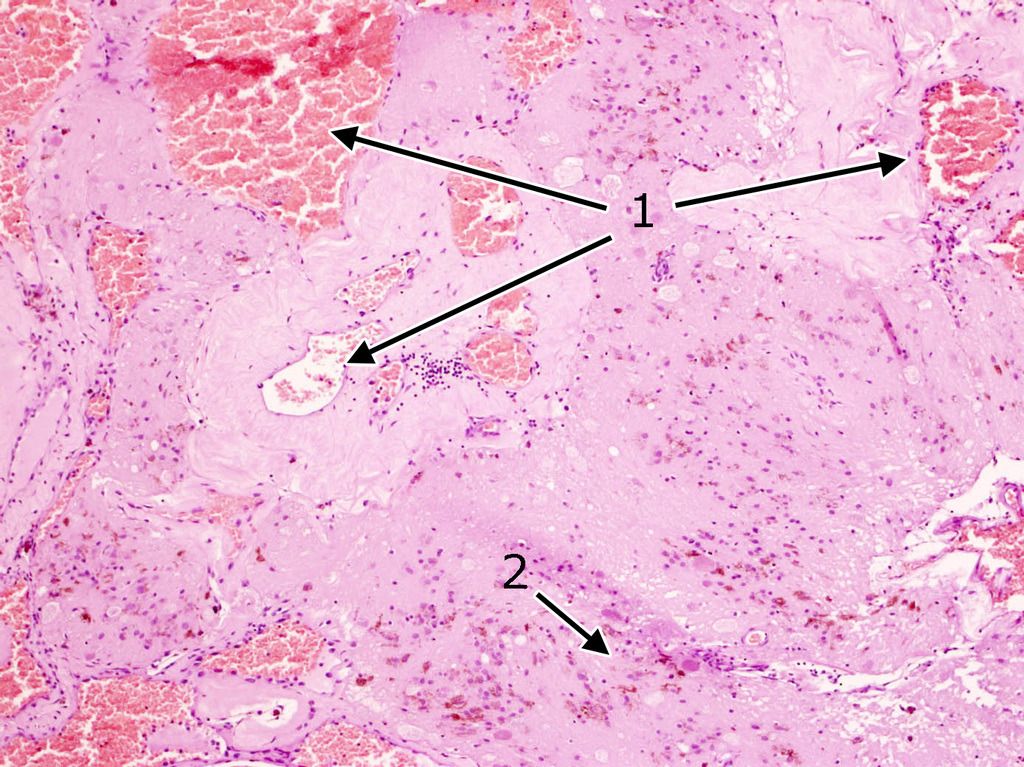
Довольно часто в строме встречаются признаки повторных кровоизлияний в виде остатков гематом различной давности. По периферии каверномы часто можно обнаружить фрагменты капсулы, типичной для хронической гематомы (рис. 15).
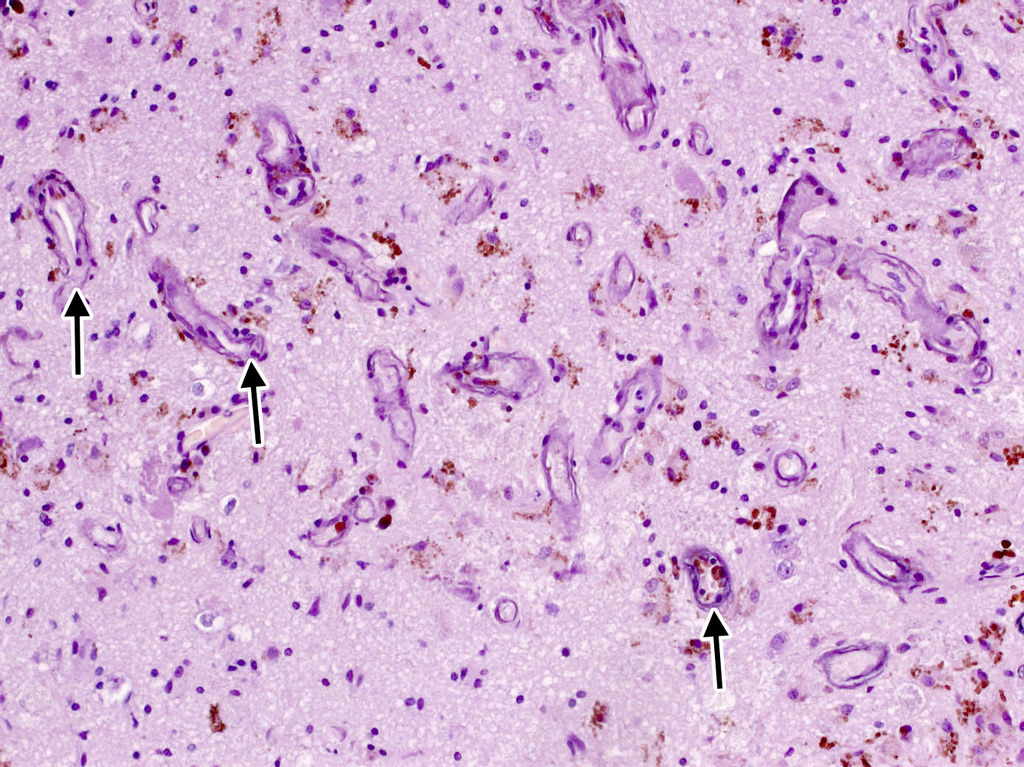
Характерной морфологической особенностью кавернозных мальформаций является наличие многочисленных мелких сосудов с кальцинированными стенками в окружающей мозговой ткани (рис. 16).
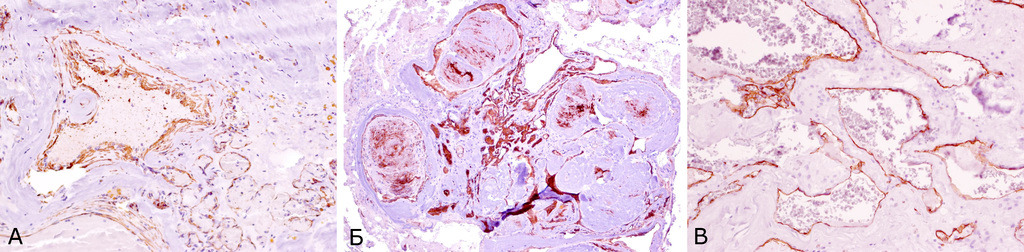
В последние годы проводятся иммуногистохимические исследования кавернозных мальформаций и окружающего мозгового вещества. Эти работы направлены на расшифровку механизмов формирования мальформации и ее биологического поведения (см. раздел «Этиология и патогенез). В исследованиях, выполненных в институте, при стандартном иммуногистохимическом исследовании КМ выявлена экспрессия мезенхимальных маркеров: виментина (Vim), гладкомышечного актина, и эндотелиальных маркеров CD31 и CD34 в стенках полостей мальформации (рис. 17 А, Б, В).
Экспрессия десмина (Des) в исследованных нами образцах отсутствует, пролиферативный индекс Ki-67 крайне низкий, исключая очаги капиллярной пролиферации и капсулы прилежащей гематомы (рис. 18).
Экспрессия фактора роста эндотелия сосудов VEGF, являющегося гликопротеином, влияющим на процессы ангиогенеза (рис. 19), а также эндоглина (СD105) и других факторов, участвующих в неоангиогенезе и сосудистой пролиферации, выявляется далеко не во всех кавернозных мальформациях.
Полученные в ходе иммуногистохимических исследований данные требуют дальнейшего углубленного изучения и сопоставления с особенностями биологического и клинического поведения каверном.
При изучении гистологической структуры различных сосудистых мальформаций было установлено, что, помимо мальформаций определенного гистологического строения, существуют сосудистые мальформации смешанного типа, в которых можно в разных сочетаниях выявить участки, соответствующие кавернозной ангиоме, АВМ, телеангиоэктазии (39, 90, 235, 281, 293, 299). Ю. Медведев, Д. Мацко предложили термин «промежуточные» мальформации для обозначения образований, сочетающих в себе черты как кавернозных, так и венозных мальформаций и/или телеангиоэктазий (20). Некоторые исследователи высказывают предположение, что КМ, ВМ и телеангиэктазии имеют общее происхождение и представляют собой лишь разные этапы формирования мальформации (293).
Морфологические исследования, выполненные в институте нейрохирургии, также показали разнообразие гистологического строения образований, объединяемых термином «кавернозная мальформация» (2). На основании этих исследований выделено три основных гистологических типа каверном:
I тип (классический) — кавернома, состоящая из плотно прилежащих друг к другу каверн, в стенках которых нет мышечных и эластических волокон. Прослойки мозговой ткани между кавернами отсутствуют. Кавернома имеет четкую границу с мозгом и капсулу (см. рис. 11). Этот вариант оказался наиболее распространенным и составил 93,7% всех каверном.
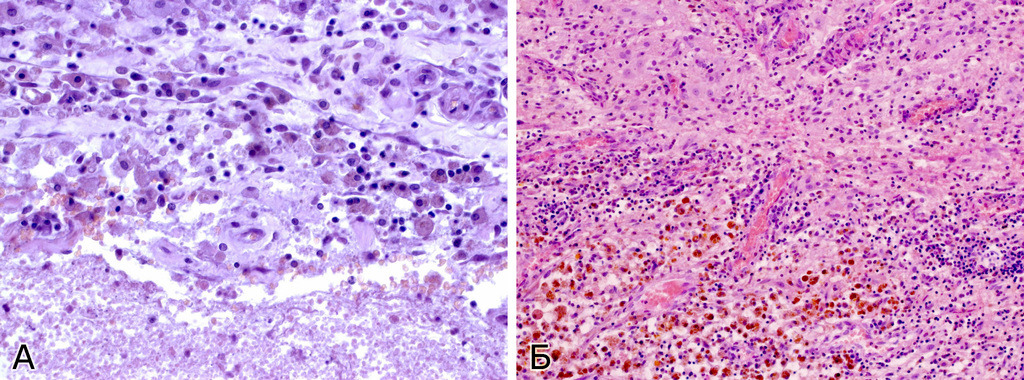
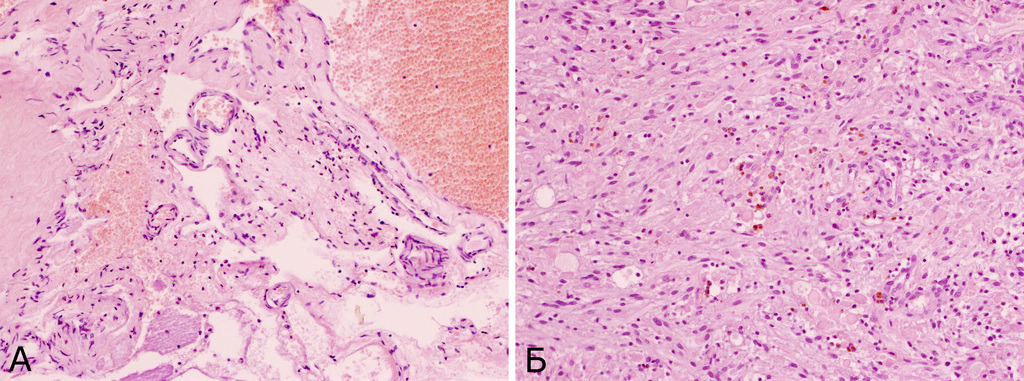
II тип (смешанный) характеризуется тем, что в периферических отделах мальформации наряду с типичной для каверномы тканью обнаруживаются плохо дифференцированные сосуды с элементами артериального и венозного строения в виде мышечных и эластических волокон, с прослойками мозговой ткани между ними. Частота каверном этого типа составила 5,1% (рис. 20).
Для III типа (пролиферативный) характерно наличие в ткани КМ микроскопических участков выраженной клеточной (эндотелиальной) пролиферации. Эти микроочаги напоминают строение капиллярной гемангиомы. КМ такого типа встречались очень редко — 0,5% случаев (рис. 21).
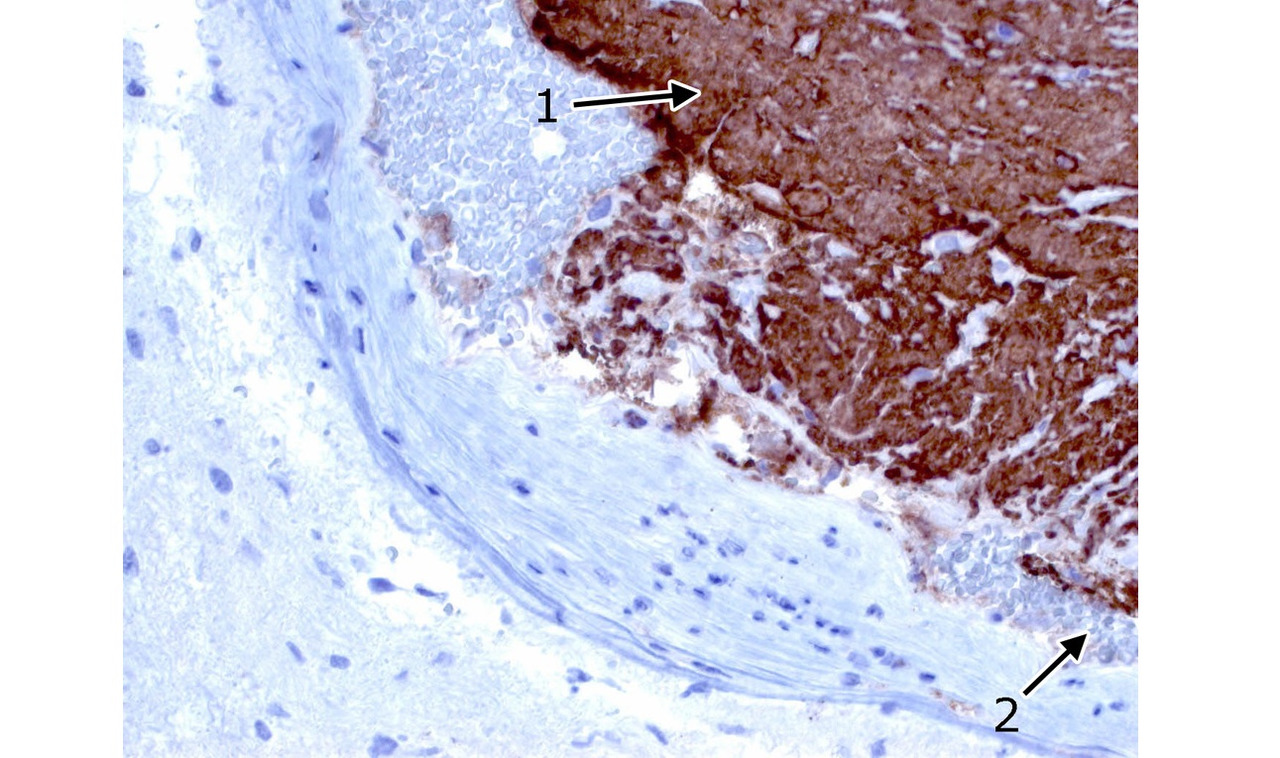
Помимо этих вариантов, в трех наблюдениях (0,5% биопсий) в биопсийном материале выявлено сочетание кавернозной ткани и опухоли. Опухолевая ткань была представлена астроцитомой, ганглиглиомой и гемангиоперицитомой (рис. 22). Образования располагались в веществе больших полушарий и на операции имели вид типичных КМ.
По данным литературы, сочетание каверномы и опухоли встречается крайне редко (151, 269). Следует также иметь в виду, что в некоторых опухолях возможен выраженный ангиоматоз с образованием каверномоподобных структур, которые могут быть ошибочно приняты за кавернозную мальформацию (137).
Венозные ангиомы или их фрагменты в биопсийном материале представлены не были. Расхождение между частым выявлением патологических вен в непосредственной близости от каверном в ходе операции или при СКТ-АГ и МР-АГ и их крайне редкой гистологической идентификацией обусловлено тем, что хирурги практически никогда не иссекают эти вены, даже если они представляются непосредственно связанными с мальформацией. Кроме того, при выявлении сочетания каверномы и типичной венозной ангиомы, расположенных в непосредственной близости друг к другу, хирургическое вмешательство, как правило, не проводится. Гистологически подтвержденные случаи сочетания каверномы с телеангиэктазией в материале биопсий в институте также не встречались.
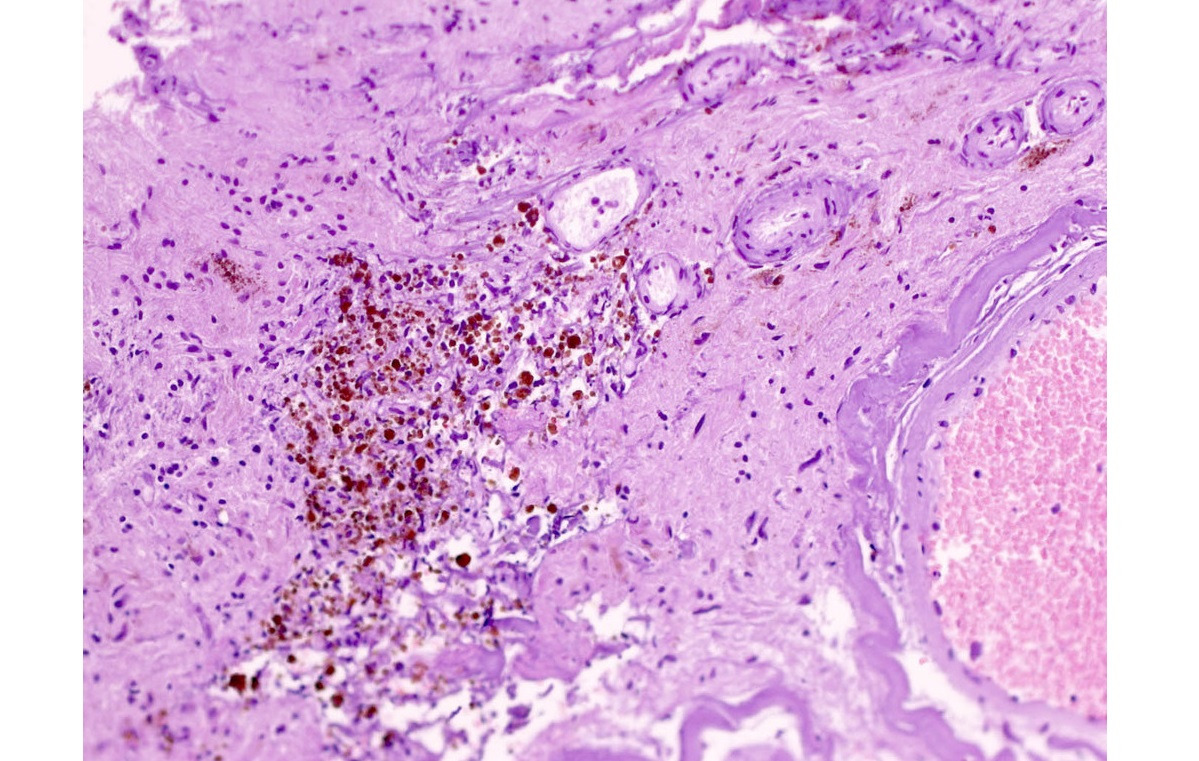
При микроскопическом исследовании мозгового вещества, окружающего каверному, практически облигатным признаком является присутствие отложений гемосидерина, что является показателем кровоизлияний из каверномы (рис. 23).
Микроскопическое исследование также подтверждает видимые невооруженным глазом глиозные изменения мозгового вещества.
При оценке результатов гистологических исследований необходимо учитывать, что в биопсийном материале морфолог имеет возможность исследовать не всю мальформацию, а только ее фрагменты. Часть мальформаций, особенно тонкостенных, разрушается в ходе операции или предшествующего кровоизлияния. Крайне сложно получить материал для биопсии при каверномах малого размера, что особенно характерно для каверном ствола мозга. Гистологическое исследование в подобных случаях может ограничиваться обнаружением капсулы хронической гематомы и следов кровоизлияний разной давности (рис. 24).
Еще один вариант гистологического диагноза — недифференцированный сосудистый порок развития — также чаще всего связан с отсутствием достаточного материала для исследования, хотя нельзя исключить существования мальформаций, которые невозможно классифицировать.
В нашей серии удаленные образования супратенториальной локализации были идентифицированы как кавернозные мальформации в 90,4% случаев при поверхностном расположении и в 70,2% случаев при глубинном расположении. Для образований мозжечка и ствола мозга эти цифры были существенно ниже — 64,1% и 43,2% соответственно. Во всех остальных случаях результаты биопсий были сомнительны, либо определялись недифференцированные пороки развития (преимущественно при супратенториальных образованиях) или капсула хронической гематомы (преимущественно при субтенториальных образованиях). Эти различия, вероятнее всего, обусловлены причинами, приведенными выше. Можно также предположить, что глубинные каверномы и каверномы ствола чаще удаляют на более ранних стадиях формирования, так как их, как правило, выявляют при первых кровоизлияниях. Результатом является более частое выявление гематом, а не типичных кавернозных мальформаций.
3.3. Локализация и размеры
Каверномы могут располагаться в любом отделе ЦНС. Распределение каверном по локализации в нашей серии представлено в табл. I. 69,5% каверном располагались супратенториально. Среди них 84,9% образований имели корковую или субкортикальную локализацию, 14,1% находились в глубинных структурах. Среди корковых и субкортикальных КМ подавляющее большинство было представлено каверномами лобных и височных долей. Субтенториальные КМ составили 27,4% от всех каверном. Наиболее часто они располагались в стволе мозга — 76,3% каверном задней черепной ямки. КМ спинного мозга встречались редко и составили только 2,1% от каверном других локализаций. Полученные нами данные по частоте КМ разного расположения в целом соответствуют сведениям, представленным в различных публикациях (96, 235, 294). Отличие составляет значительное преобладание каверном ствола над каверномами мозжечка — в большинстве исследований их соотношение составляет примерно 1:1, а в нашей серии — 3:1. Мы объясняем этот факт тем, что многие годы институт был единственным в России учреждением, где выполняли операции по поводу КМ ствола, что привело к большому числу больных с этой локализацией мальформаций. Касаясь распределения каверном в головном и спинном мозге, следует упомянуть, что, по общему мнению, число каверном, обнаруживаемых в определенных отделах мозга, пропорционально объемам этих отделов и не зависит от каких-либо других факторов. В нашей серии, помимо традиционных, часто встречающихся локализаций, представлены также такие редко встречающиеся каверномы, как каверномы хиазмально-селлярной области, передних и задних отделов гипоталамуса, III желудочка, пинеальной области, среднего и продолговатого мозга, краниоспинальной области. В литературе описаны как эти, так и другие редкие локализации каверном: отдельные случаи каверном черепных нервов, кавернозного синуса, ТМО передней и средней черепной ямок, мозжечкового намета, меккелевой капсулы, мосто-мозжечкового угла (7, 71, 103, 105, 126, 132, 181, 231, 249, 255, 261, 290).
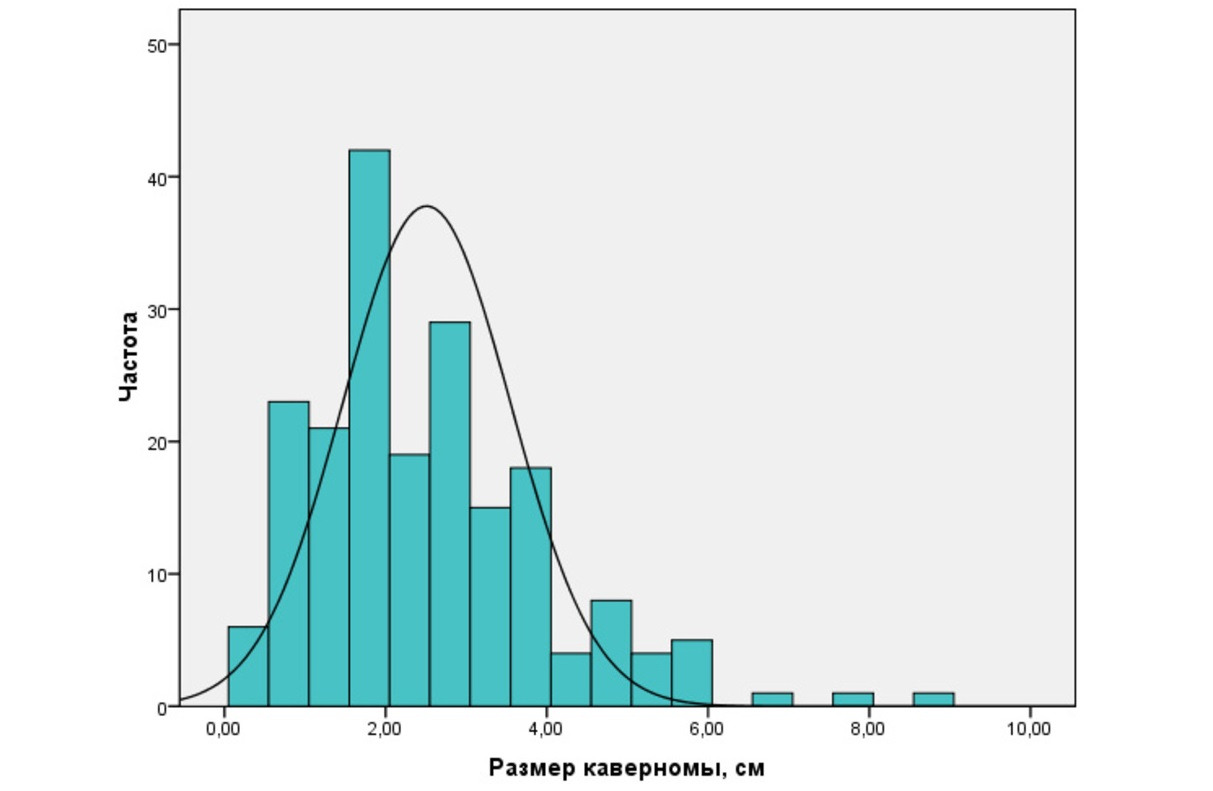
Размеры каверном могут быть самыми разнообразными. В нашей серии эта величина варьировала от нескольких миллиметров до 9см в диаметре. Средний размер каверном составил 2,6 ± 1,5см. В целом крупные каверномы (более 4см в диаметре) встречались реже, чем каверномы средних и небольших размеров (рис. 25).
Динамические исследования показывают, что размеры, форма и структура каверном не являются статичными и могут меняться. Существуют также доказательства возможности новообразования кавернозных мальформаций (см. главу 5).
4. Этиология и патогенез кавернозных мальформаций
4.1. Механизмы образования
Кавернозные ангиомы встречаются в виде двух основных форм — спорадической и наследственной.
В настоящее время этиопатогенез каверном наиболее хорошо изучен на модели наследственных форм заболевания. Существование семейных каверном и аутосомно-доминантный тип наследования патологии был доказан еще на этапе анализа клинических наблюдений (55, 156). На основе полученных данных L. Hayman с соавт. в работе 1982г. (156) впервые показали, что при обследовании кровных родственников больных с клинически проявившимися каверномами можно выявить бессимптомные формы заболевания. J. Dubovksy с соавт. (107) и A. Gil-Nagel с соавт. (142) удалось локализовать первый из генов, ответственных за формирование каверном, в длинном плече 7-ой хромосомы — ген ССМ1 (KRIT1). M. Guenl с соавт. заподозрили и начали поиск мутаций этого гена (149), а S. Laberge-le с соавт. описали связанные с развитием заболевания мутации, вызывающие преждевременное прекращения синтеза белка (201). Впоследствии H. Craig и соавт. (91) установили наличие еще двух локусов, связанных с семейными формами каверном: CCM2 (MGC4607) в коротком плече 7-ой хромосомы и CCM3 (PDCD10) в длинном плече 3-й хромосомы. Согласно последним данным, предполагается наличие четвертого гена (212).
В последние годы количество публикаций по генетике каверном возрастает лавинообразно. Основным направлением исследований является изучение молекулярных механизмов формирования каверном. К настоящему времени уже сформировано представление о том, что кодируемые тремя генами белки, «работают» в тесном взаимодействии, создавая сложный протеиновый комплекс, который обеспечивает морфогенез и стабильность сосудов мозга. Выявлен ряд генных мутаций и расшифровано несколько паттернов нарушения белкового синтеза, ведущих к нарушению формирования эндотелиальных клеток, их миграции и соединения (адгезии) в процессе ангиогенеза, что приводит к формированию каверном (50, 123, 140, 166, 167, 200, 201, 210, 216, 268, 288). Изучаются также генетические основы ассоциации церебральных кавернозных мальформаций с различными видами сосудистых мальформаций кожи, сетчатки, ангиомами печени, клинические описания которых все чаще встречаются в литературе (61, 66, 101, 106, 131, 202, 330). Исследования ведутся как на экспериментальных моделях (75, 91, 93, 98, 216, 237), так и путем изучения генома в семьях с наследственными каверномами (36, 45, 142, 144, 149, 212, 258). Для более полного понимания процессов формирования каверном и процессов, лежащих в основе клинических проявлений патологии, необходимы дальнейшие исследования, которые должны привести к возможности терапевтического лечения заболевания на генном уровне (40, 193, 241, 273).
Пусковой механизм формирования спорадических каверном неизвестен. Считается, что спорадические каверномы в подавляющем большинстве случаев являются врожденными, и образуются на 3—8 неделе беременности, в период, когда происходит закладка и формирование сосудистой системы мозга плода (74). Врожденный характер патологии подтверждается случаями обнаружения каверном у детей первого года жизни, хотя следует признать, что такие случаи довольно редки.
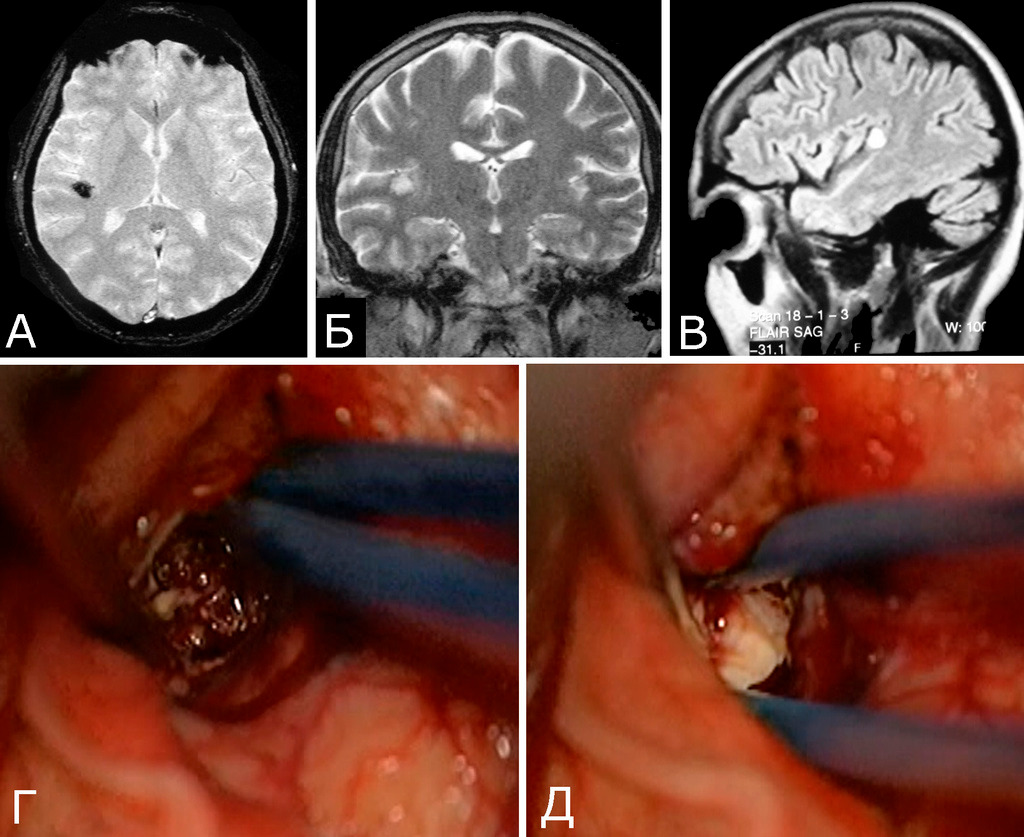
Одним из доказанных факторов новообразования спорадических КМ является лучевое воздействие (радиоиндуцированные каверномы). Первые сообщения о таких случаях появились в начале 90-х годов (133, 282, 348). В этих ретроспективных исследованиях описаны отдельные наблюдения, в которых кавернозные мальформации были обнаружены спустя несколько лет у больных, получавших лучевое лечение по поводу различной патологии головного мозга, главным образом, опухолей различной локализации и гистологической структуры. Необходимо отметить, что в большинстве из этих случаев первоначальное обследование включало только КТ, что не позволяет достоверно судить о состоянии мозга до облучения. Показательным в этом отношении служит одно из наблюдений E. Pozzatti с соавт., когда у больной, облученной по поводу одиночной каверномы головки хвостатого ядра, спустя несколько лет при МРТ были обнаружены множественные каверномы головного мозга. Авторы работы справедливо указывают на то, что в данном случае могло иметь место либо спонтанное новообразование каверном у больной с генетически обусловленной патологией, либо постепенное увеличение уже имевшихся микромальформаций, которые не были диагностированы в силу технологических ограничений (первоначальное обследование выполнено в 1982 г.) (282). На важность качества и сопоставимости разных исследований обращают внимание многие нейрохирурги. Примером может служить следующее наблюдение нашей серии (рис. 26).
Это наблюдение демонстрирует необходимость внимательного отношения к трактовке инструментальных исследований мозга, а также тот факт, что точные оценки ряда исследований, сделанных десятилетия назад, невозможны.
В последние годы формирование радиоиндуцированных мальформаций находит все новые подтверждения (110, 133, 187, 238, 322). В зависимости от дизайна исследований, приводимая частота таких каверном варьирует в достаточно широких пределах. В ретроспективных исследованиях она не превышает 10%, в то время как в появившихся в последнее время проспективных работах эта цифра возросла в несколько раз. Так, R. Duhem R соавт в публикации 2005 г сообщают о выявлении каверном у 2,1% пациентов (9 случаев из 419), прошедших в детстве лучевую терапию по поводу опухолей мозга (110). Дозы облучения составляли от 25 до 55 Gy, а срок после облучения — от 4 до 22 лет. Авторы делают вывод о том, что проблема формирования кавернозных ангиом в поздние сроки после лучевой терапии недооценена и предлагают обязательное МРТ обследование пациентам после лучевой терапии в период до 15 лет после лечения.
V. Strenger с соавт. (2008 г) проследили за судьбой 171 человека, которым в детстве проводили облучение головы по поводу различных злокачественных заболеваний, как интракраниальных, так и системных. У 8-ми из них (4,7%) в сроки от 2,9 до 18,4 лет после облучения были выявлены внутримозговые КМ, причем при анализе 5-летних периодов кумулятивный эффект нарастал (322). Авторы показали, что наибольший риск развития каверном существует у детей, облученных до 10-летнего возраста. О значительно более высокой частоте постлучевых КМ сообщили японскиу исследователи. В проспективной работе с использованием МРТ в режиме GRE они обнаружили каверномы у 41,2% детей (28 из 68), прошедших тотальное облучение в связи с пересадкой костного мозга. Частота появления каверном находилась в прямой зависимости от дозы облучения (187). M. Faraci, G. Morana в проспективном исследовании (МРТ 56 человек в сроки более 2-х лет после облучения) также показали высокий уровень различной радиоиндуцированной патологии мозга после облучения детей по поводу лейкоза, причем каверномы оказались самой частой находкой — выявлено 32 образования, составивших 54% среди 7 различных видов патологии, но только в одном из этих случаев кавернома проявилась клинически в виде микрокровоизлияний и неспецифических неврологических проявлений, остальные образования были бессимптомными (122). Наша серия предположительно радиоиндуцированных каверном включает 11 больных. Они составили 0,8% всех обследованных. Лучевую терапию с облучением головы проводили по поводу различных заболеваний: в 9 случаях по поводу опухолей мозга или головы, в двух — в рамках протокола лечения острого лимфобластного лейкоза.
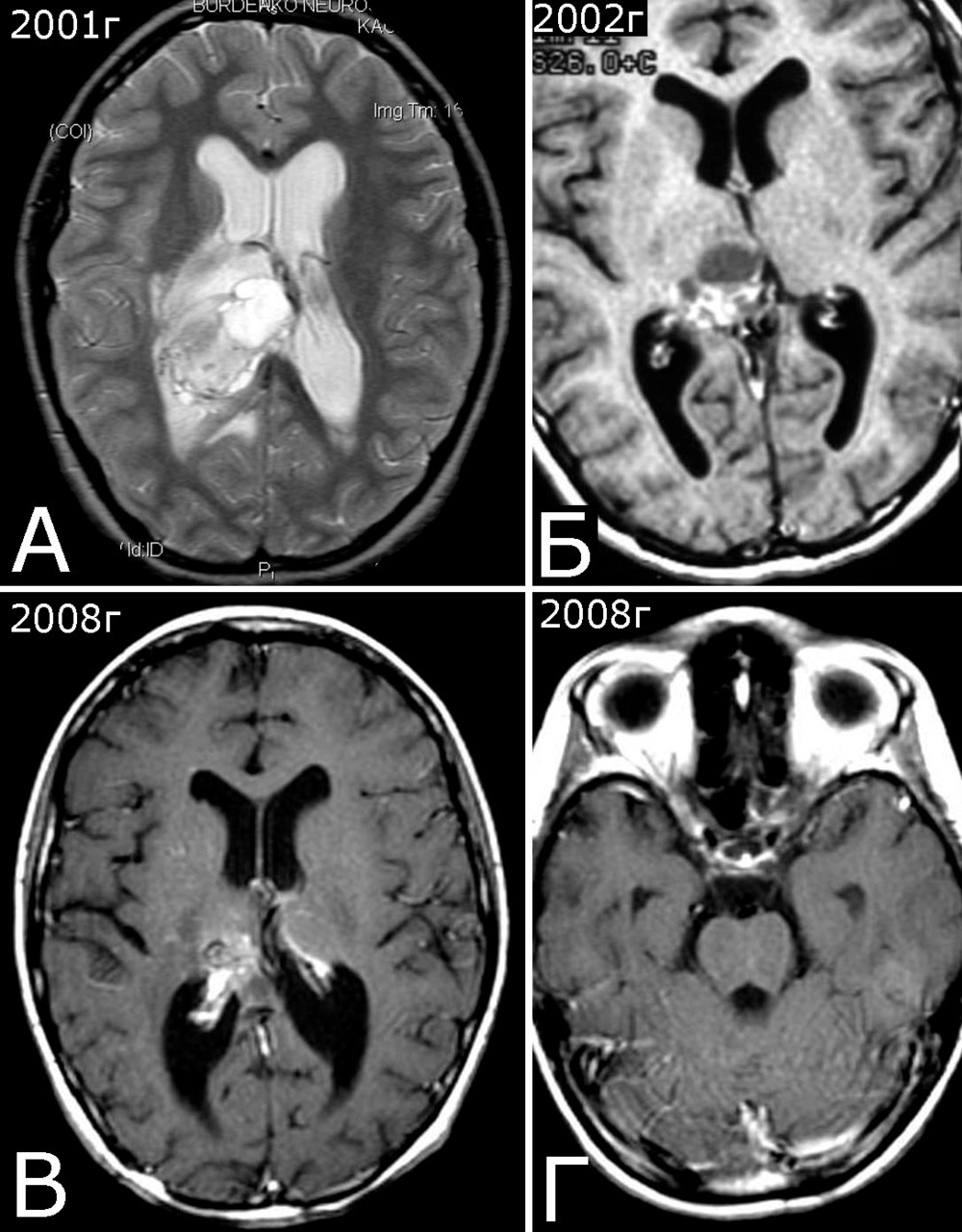
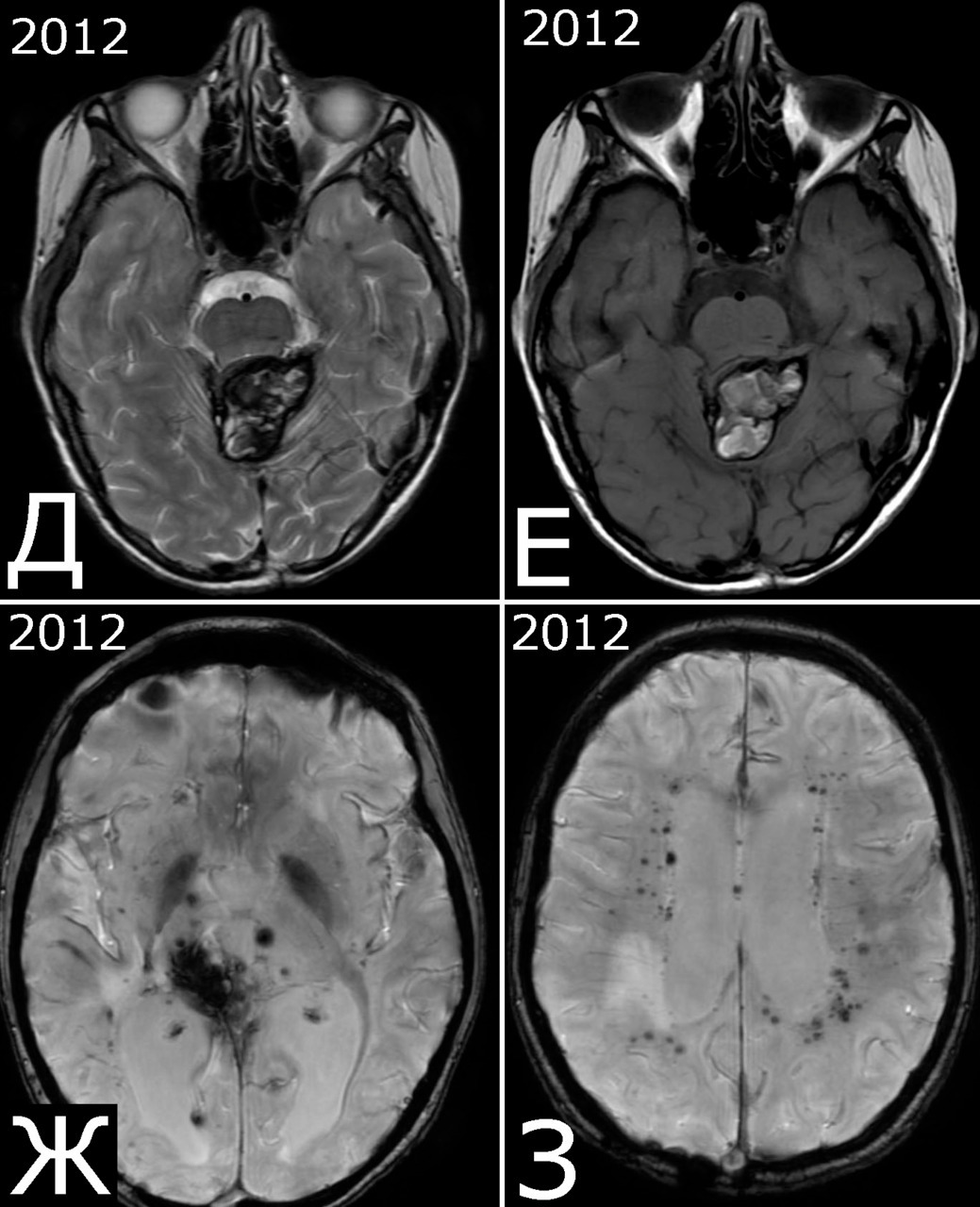
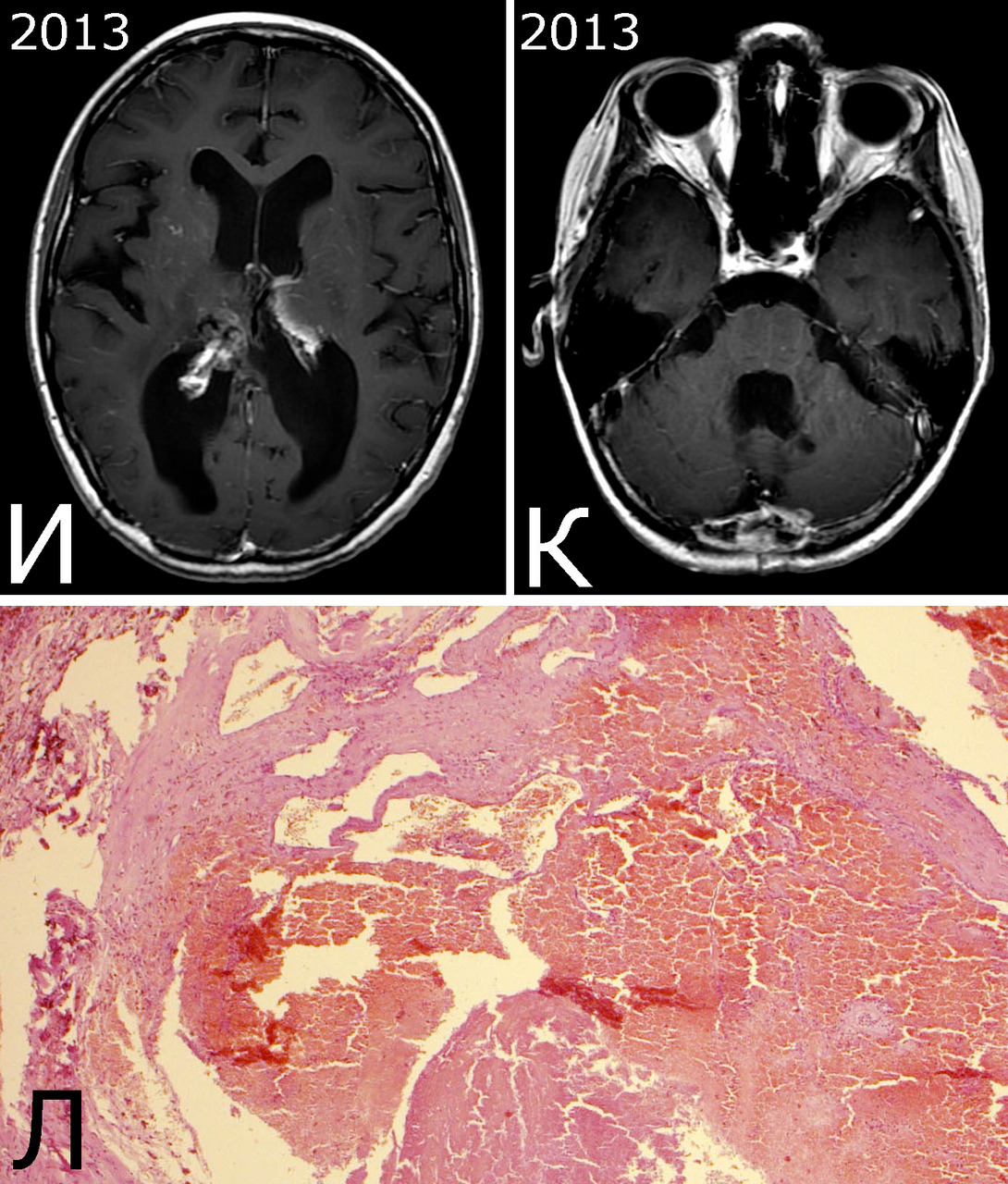
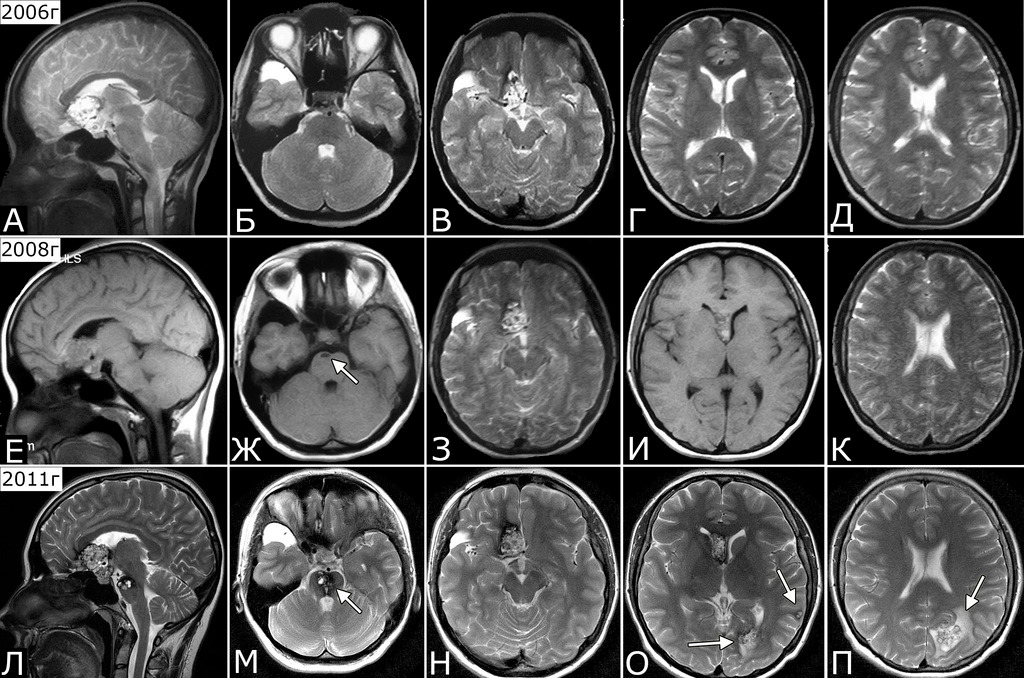
Анамнез (б-ная К-я, 1988 г. р.): в 2001 г (13 лет) обнаружена и удалена (субтотально) глиобластома задних отделов зрительного бугра справа. Проведен курс лучевой терапии. (А — МРТ до операции, режим Т2; Б — МРТ после операции и лучевой терапии, режим Т1). В августе 2002 г произведено радиохирургическое лечение оставшейся части опухоли. При последущих ежегодных обследованиях признаков продолженного роста опухоли не было (В — контрольная МРТ в 2008 г, режим Т1). Неврологического дефицита не было. С января 2011 г после падения на улице появилось пошатывание при ходьбе, которое через несколько месяцев регрессировало. При очередном контрольном обследовании в 2012 г выявлено объемное образование червя мозжечка, расцененное как хроническая гематома (Д, Е — МРТ, режимы Т2, Т1). Кроме того, в режиме SWAN обнаружено множество мелких очагов низкого сигнала, преимущественно перивентрикулярно, имеющих вид КМ IV типа (Ж, З — МРТ, режим SWAN). 01.11.2012 выполнена операция удаления гематомы: Поверхность червя мозжечка в средних его отделах резко изменена, желтого цвета и выбухает. Произведена коагуляция прилежащих участков коры и на глубине нескольких мм обнаружена капсула хронической гематомы. Капсула очень плотная. Она рассечена скальпелем. Содержимое ее — организовавшиеся кровяные сгустки. Помимо основной организовавшейся гематомы было еще несколько крупных полостей с такими же плотными стенками, заполненными кровяными сгустками. С передней части к упомянутому выше новообразованию подходили ветви мозжечковых артерий, которые коагулированы и пересечены. Основные стволы были смещены в сторону и сохранены. Постепенно путем кускования и иссечения фрагментов гематомы, по всей вероятности, и кавернозной мальформации, это новообразование удалено полностью. Оно было окружено измененной мозговой тканью желтого цвета. Ложе удаленной гематомы выложено гемостатической ватой. Образовалась больших размеров полость в пределах верхних и средних отделов червя и прилежащих отделов мозжечка. Гистологический диагноз: ткань мозжечка с капсулой гематомы с кровоизлияниями различной давности, скоплениями макрофагов и сидерофагов, очаговыми лимфоидными инфильтратами. В капсуле гематомы обнаружен микроскопический фрагмент кавернозной мальформации (Л — гистологический препарат, ув. Х 50). МРТ после операции — полное удаление гематомы (И, К — МРТ, режим Т1).
Срок от облучения до выявления каверномы в большинстве случаев был длительным и составил в среднем 12 лет. У двух больных этот период был менее 2-х лет. Все больные были облучены в возрасте до 20 лет, причем 7 из 10-ти — в раннем детском возрасте (до 6 лет). У 8 больных каверномы проявились клинически, либо в виде кровоизлияний (7 наблюдений) либо в виде эпилептических припадков (1 наблюдение). У 3-х больных каверномы были бессимптомными и явились случайной находкой при очередном обследовании в связи с основным заболеванием ((рис. 27).
7-ми больным выполнено удаление каверном, в том числе, бессимптомных. Все образования в ходе операции имели вид типичных КМ. Гистологический диагноз каверномы подтвердился в 4-х случаях, у 3 больных выявлена только капсула хронической гематомы (рис. 28).
Одному больному с каверномой ствола выполнено радиохирургическое лечение. В трех случаях решено было от операции воздержаться в связи с отсутствием клинических проявлений или высоким риском нарастания очаговых симптомов. Как уже сказано выше, несмотря на более чем вероятную связь между облучением и появлением КМ, однозначно утверждать, что обнаруженные в нашей серии мальформации явились следствием лучевой терапии, невозможно. Это связано, прежде всего, с отсутствием в ряде случаев качественного исследования состояния мозга до начала лучевой терапии.
Отдельного внимания заслуживает вопрос о гистологической структуре радиоиндуцированных сосудистых образований. В большинстве публикаций их описывают как кавернозные мальформации, как по данным МРТ, так и по результатам гистологического исследования. В то же время, по мнению E. Pozzatti с соавт. образования, формирующиеся в результате лучевого повреждения, не являются истинными КМ. Авторы предлагают называть их «дисангиогенезом, симулирующим скрытые сосудистые мальформации», хотя и не приводят достаточно обоснованных МРТ или гистологических критериев для дифференцировки таких образований с КМ (282). Предположительным пусковым механизмом формирования постлучевых КМ является тромбоз небольших вен, который запускает каскад формирования мелких патологических сосудов с последующим некрозом стенок и микрокровоизлияниями.
Суммируя сведения по проблеме радиоиндуцированных КМ, можно утверждать, что существование такой патологии не вызывает сомнений. О частоте этой формы мальформаций судить сложно, так как разброс приводимых в литературе данных очень широк. Проспективные исследования, проводимые в настоящее время, позволяют заключить, что радиоиндуцированные сосудистые образования — явление более частое, чем предполагалось ранее, когда выявляли главным образом только те их них, которые проявлялись клинически. В подавляющем большинстве случаев КМ формируются при облучении головы в детском возрасте. При предположении о радиоиндуцированной КМ, помимо доказанного факта облучения, желательно провести тщательный анализ выполненных на протяжении жизни МРТ. Достоверное подтверждение появления радиоиндуцированных каверном может быть сделано только на основании проспективных обследований больных, облученных по поводу какого-либо заболевания. Все более широкое применение в настоящее время радиохирургических методов лечения различной нейрохирургической патологии, а также использование радиотерапии в комплексном лечении детей с онкологическими заболеваниями, обосновывает наблюдение за облученными больными, необходимость формирования групп риска и проведения в этих группах катамнестических обследований.
В отдельных работах представлена воспалительная теория развития каверном. Она основана на результатах изучения иммунного статуса и иммунных реакций больных с КМ (308).
4.2. Биологическое поведение КМ, их рост и новообразование
В настоящее время убедительно показано, что в основе клинических проявлений заболевания лежат микро- и макрокровоизлияния из кавернозных мальформаций. Механизм кровоизлияния связан с нарушением целостности патологически сформированных стенок образования. Учитывая сведения о распространенности каверном очевидно, что лишь малая часть этих образований проявляется клиническими симптомами. Подтверждением этого факта служат многочисленные свидетельства «здорового носительства» КМ. Причины манифестации заболевания до настоящего времени не ясны. Остается загадкой, почему, являясь врожденными либо наследственными, одни КМ остаются бессимптомными на протяжении всей жизни человека, а другие проявляются клинически. Нет ответа на вопрос, что является пусковым механизмом первого и последующих кровоизлияний из каверномы. Требуют объяснения такие факты, как различная частота связанных с каверномой клинических эпизодов (кровоизлияний) у разных больных, разный возраст первого проявления патологии — от нескольких месяцев жизни до 7-го десятилетия, различия в клинических проявлениях наследственных и спорадических каверном.
В ходе обсуждения всех этих вопросов высказываются предположения о том, что пусковым механизмом кровоизлияния может быть нарушение венозного оттока из КМ. Это согласуется с частым соседством каверном и венозных мальформаций (венозных ангиом). Наличие венозной ангиомы вблизи каверномы считается типичным для спорадических каверном головного мозга. Указывается, что такие формы каверном чаще прочих вызывают клинические проявления (28, 353).
На основании данных о том, что каверномы чаще клинически проявляются у женщин, делались попытки связать проявления заболевания с эндокринным статусом (125, 279, 281), но достоверных доказательств такой связи не получено. Исследования также показали, что нет связи между появлением первых симптомов и такими факторами, как физическая нагрузка, артериальная гипертония, беременность и роды (71).
Некоторые исследователи связывают активность КМ с аутоиммунными реакциями в стенке мальформации (154, 308). Эти предположения основаны на выявлении олигоклонального иммунного ответа на структурные компоненты каверном.
Наряду с механизмами клинических проявлений, остаются неясными причины роста и новообразования каверном.
Сведения об изменении размеров и структуры каверном, их росте и новообразовании приводятся в значительном числе исследований (99, 154, 160, 195, 281, 312, 324, 358). Необходимо уточнить, что при обсуждении проблемы роста каверном следует четко разграничивать такие понятия, как изменение размеров и конфигурации (трансформация) и истинный рост, обусловленный пролиферативными процессами. При этом следует учитывать зависимость размера каверномы от метода исследования — размер в режимах SWI всегда больше, так как метод более чувствителен к изменению тканей после кровоизлияния.
Под трансформацией подразумевается изменение размера КМ, как в сторону увеличения, так и в сторону уменьшения, а также их структуры по данным МРТ. Эти изменения могут возникать в результате повторных кровоизлияний с последующим образованием хронических инкапсулированных гематом, либо их рассасывания, отложения гемосидерина в мозговой ткани, окружающей КМ, формирования участков глиальной гиперплазии и (рис. 29, I — II).
Подобный механизм детально описан в работе R. Clatterbuch с соавт. (81). Авторы показали, что размеры каверном при повторных МРТ исследованиях на протяжении в среднем 3,5 лет могут изменяться как в сторону увеличения, так и в сторону уменьшения, причем преобладает уменьшение. Реже всего — менее чем в 20% случаев — размеры каверном оставались неизменными. Авторы также отметили изменение структуры каверном, которое они объясняют медленными процессами трансформации крови после кровоизлияния.
В то же время, существуют многочисленные примеры истинного роста каверном, хотя причины и механизмы, лежащие в основе этого явления, неизвестны (99, 160, 170, 281, 312, 358). Мы располагаем только одним неоспоримым примером роста каверном (рис. 30).
В данном случае имела место редкая гистологическая форма каверномы — кавернома III типа, содержащая пролиферативные клетки, что может объяснить механизм роста мальформаций.
Возможно, новые сведения по этой проблеме можно будет получить, проводя динамическое наблюдения за точечными образованиями IV типа, которые, по некоторым данным, являются телеангиэктазиями (358).
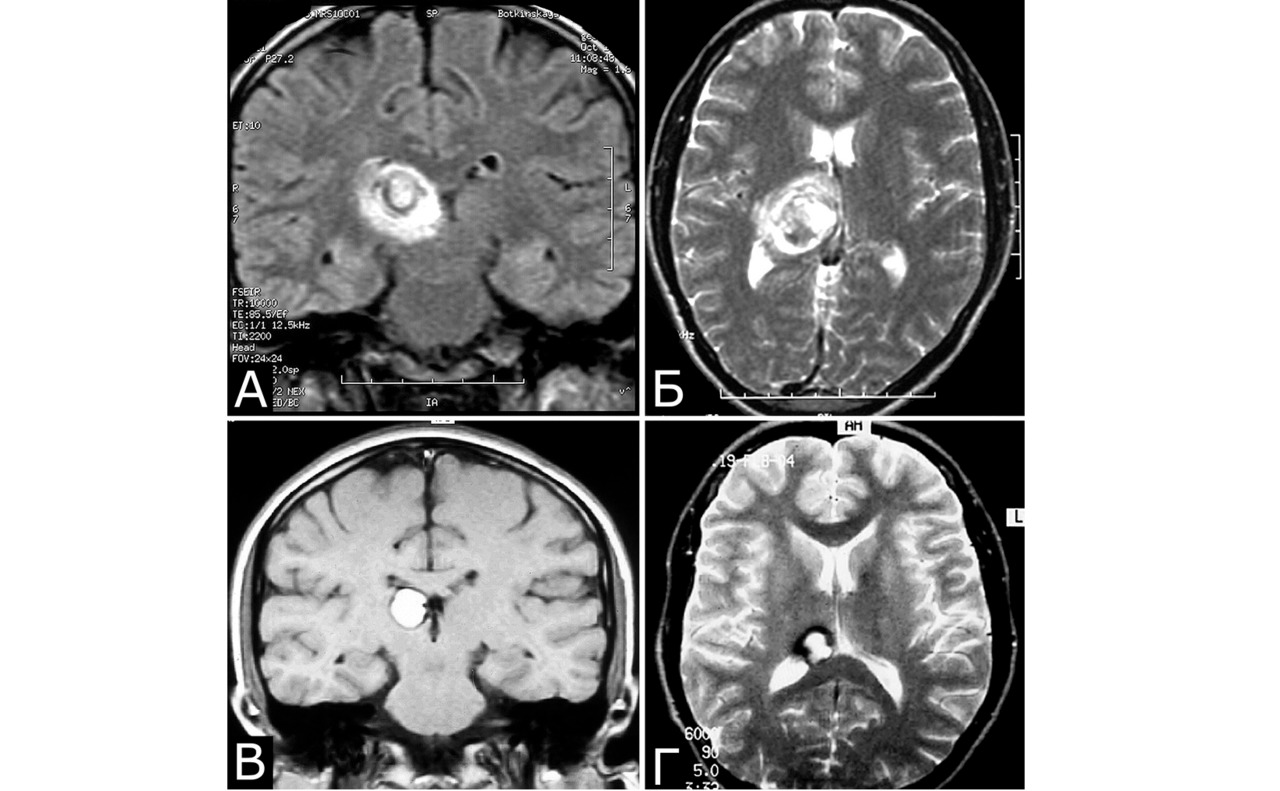
Клинический диагноз (б-ная Ш., 1978 г. р.): множественные КМ головного мозга: правой лобной доли; левой лобной доли; левой теменной доли; задних отделов III желудочка. Состояние после удаления КМ левой лобной доли (III гистологический тип). Состояние после установки ВПШ в задний рог правого бокового желудочка. Развитие заболевания и лечение: в возрасте 4 лет ударилась о спинку кровати, появилась тошнота, рвота, тремор и легкая слабость в левых конечностях. При ЛП выявлена кровь в ликворе. Лечилась по м/ж с диагнозом ЧМТ. Восстановилась полностью. С 1984г (6 лет) — периодическая рвота, тремор в руках, нарушение памяти. С 1985г наблюдалась в институте, где по результатам КТ, МРТ и АГ поставлен диагноз: «объемные образования задних отделов III желудочка и левой лобной доли неясного генеза» (А). В 1989 г в связи с очередным ухудшением и нарастанием гидроцефалии выполнена операция: «Удаление объемного образования левой лобной доли. Установка ВПШ в задний рог правого БЖ». Гистологический диагноз: КМ, пролиферативный тип. В 1992 г госпитализирована повторно в связи с усилением головной боли и эпизодом утраты сознания. При КТ выявлено объемное образование в правой лобной доле, незначительное увеличение образования в задних отделах III желудочка (Б). В связи с компенсированным состоянием операция не производилась. В 1999 г приглашена для контрольного обследования. Жалуется на головные боли, иногда со рвотой, дрожание рук, шаткость. Перенесла несколько генерализованных безсудорожных припадков. Благодушна, некритична. Грубо нарушена память на прошедшие и текущие события. Тремор и вычурная поза левой руки, легкая слабость в правой руке. Нарушения походки по типу астазии — абазии. Нет признаков ВЧГ. При МРТ обнаружено значительное увеличение размера КМ правой лобной доли, появление КМ в задних отделах левой теменной доли, стабильные размеры КМ задних отделов III желудочка, нарастание окклюзионной гидроцефалии. Все образования имеют вид, типичный для КМ (В, Г). Была предложена повторная операция, от которой мать больной воздержалась.
В литературе обсуждается также проблема образования новых каверном (каверномы de novo) у больных с уже имеющимися КМ. При изучении этого вопроса, как и при анализе изменения размеров и структуры каверном, принципиальное значение имеет качество выполненных МРТ, а необходимым условием, позволяющим обоснованно говорить о появлении новой каверномы, являются равноценные технические параметры повторных обследований больного, включая напряженность магнитного поля томографа и режимы исследования. При несоблюдении этих условий о новообразовании каверном у конкретного больного можно говорить лишь предположительно. Необходимо также подчеркнуть, что радиоиндуцированные КМ и КМ, образовавшиеся в месте ранее удаленной мальформации, не рассматриваются как каверномы de novo.
Свидетельства новообразования каверном как при спорадической, так и при семейной форме заболевания, представлены в целом ряде работ (167, 292, 324). Появление каверном de novo в большей степени характерно для семейной формы заболевания и для больных с множественными образованиями (195). В некоторых исследованиях, основанных на длительном наблюдении за больными со спорадическими и семейными формами каверном с проведением повторных МРТ, рассчитан риск возникновения каверном de novo. Он находится в диапазоне от 0,1 до 0,6% на пациента в год (174, 198, 281, 358). Механизмы появления новых каверном неизвестны. Как и при изучении механизмов кровоизлияний, для объяснения этого феномена используется теория «двойного удара» (two — hit mechanism) — в уже существующей генетически измененной ткани происходит какое-то воздействие (эндокринные изменения, травма) которое стимулирует образование каверномы. В ряде работ описано появление новых каверном вблизи от ранее диагностированных венозных ангиом (28, 93, 154, 353). С учетом современных знаний о «точечных» сосудистых мальформациях (IV тип), нельзя также полностью исключить возможность существования очень мелких врожденных образований, которые не были диагностированы в силу ограниченных технических возможностей, и которые на определенном этапе проявились кровоизлияниями и постепенным формированием более крупных мальформаций.
В нашей серии новообразование каверном зафиксировано у 4-х больных. Во всех случаях КМ были множественными, а в одном случае доказан наследственный характер патологии (рис. 31).
Одним из путей изучения биологического поведения каверном являются иммуногистохимические исследования, которые ведутся не менее последних 20-ти лет и получают все более широкое распространение в связи с быстрым развитием новых технологий в этой области. Такие исследования проводятся и в институте нейрохирургии им. Н. Н. Бурденко (см. главу 4).
В ходе иммуногистохимических исследованиий каверном выявлен ряд факторов, связанных с ангиогенезом и пролиферативными процессами в тканях. Так, фактор роста эндотелия (vascular endothelial growth factor, VEGF) был обнаружен в 37,5% — 97% иссеченных каверном (179, 232, 324, 362).
K. Jung c соавт. выявили повышенную экспрессию VEGF у пациентов с множественными каверномами и с «агрессивным» течением заболевания (170). Среди трансформирующих факторов роста (transforming growth factor, TGF) изомер β найден в 54,2% (232), а изомер α в 97—100% удаленных кавернозных ангиом (179, 361). Тенасцин (Tenascin) обнаружен в 83,7—100% случаев (232, 338). Тромбоцитарный фактор роста (platelet-derived growth factor, PDGF) найден в 95,4% каверном (232).
F. Maiuri с соавт. изучали экспрессию факторов роста, ангиогенеза и пролиферативные индексы у больных с «активными» каверномами. К последним относили кавернозные ангиомы как минимум с одним из следующих признаков: размер более 2 см, выраженный масс — эффект, «очевидные» кровоизлияния в анамнезе, документированный рост, семейная форма болезни, случаи с появлением каверном de novo. В этой группе установлена повышенная экспрессия трансформирующего фактора роста TGFβ при отсутствии различий в экспрессии фактора роста эндотелия, тромбоцитарного фактора роста и тенасцина. В группе пациентов с активными каверномами было также установлено наличие повышенной экспрессии трансформирующего фактора роста TGFβ, тромбоцитарного фактора роста и тенасцина в окружающей каверному мозговой ткани (232). Ki-67 и bcl-2 также были выше в группе «активных» каверном.
Иммуногистохимические исследования каверном показали, что по своим биологическим особенностям каверномы далеко не однородны. Несмотря на большое количество новых сведений, пока не удается связать результаты исследований с клиническим проявлением болезни, а тем более использовать полученные данные в клинической практике с целью прогнозирования формы течения заболевания. Тем не менее, в одной из последних экспериментальных работ показана возможность остановки роста сосудистой мальформации при блокировании TGFβ (223).
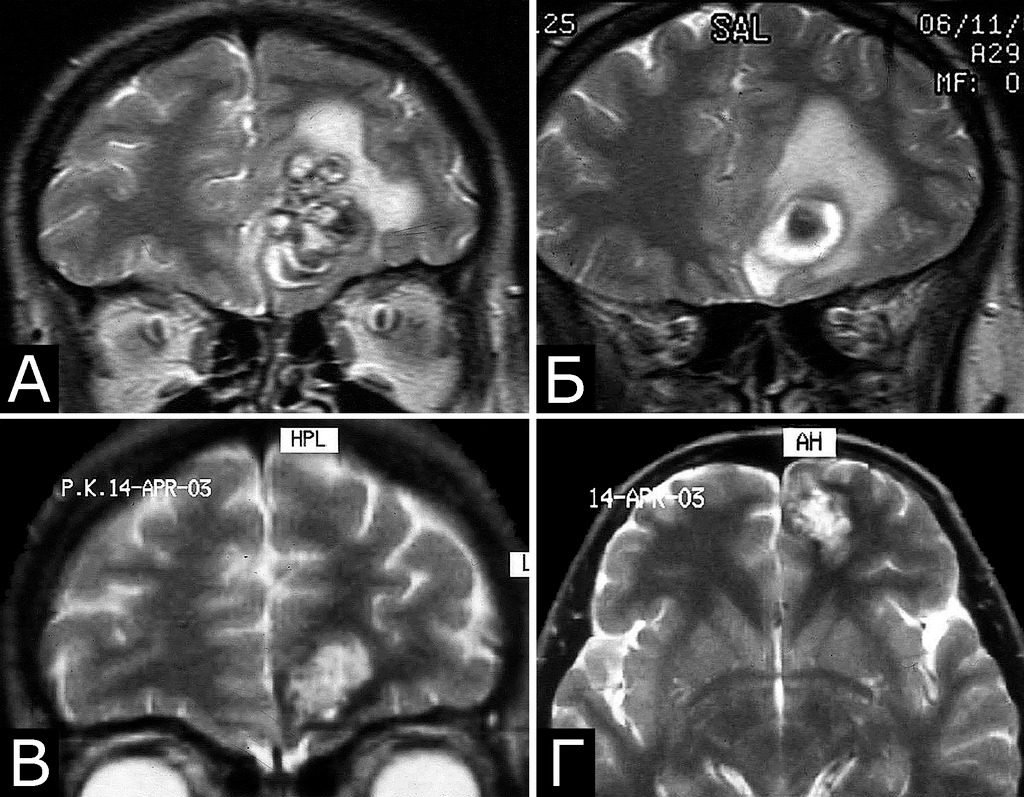
Течение болезни (б-ная Е-ва, 1985 г. р.): 1994 г — клиническая картина САК. Госпитализировна, при ЛП получен кровянистый ликвор. Лечилась с д-зом «гнойный менингит с геморрагическим компонентом». 2000 г. (14 лет) — резкое снижение зрения на OD. При обследовании в офтальмологической клинике выявлена отслойка сетчатки справа, принято решение об операции. С учетом анамнеза, выполнена МРТ головы, при которой выявлена кавернома медиальных отделов лобной доли и передних отделов гипоталамуса справа (22х20х17 мм) и арахноидальная киста полюса правой височной доли. В связи с обнаруженной патологией глазная операция отложена и выполнена только в 2010 г. В 2004 родила дочь. При контрольной МРТ в 2006 г — прежняя патология (А — Д). При контрольной МРТ в 2008 г (23 г) выявлено дополнительное образование в виде небольшой щелевидной полости в основании моста (Ж, стрелка). 8.08.2010 г (25 лет) появилась сильная головная боль, рвота, головокружение, шаткость при ходьбе, неадекватность поведения. Госпитализирована, при МРТ выявлены дополнительные образования в виде гематомы ствола до 2см в диаметре, кавернома левой затылочной доли и микрокавернома субкортикальных отделов левой височной доли. Наличие этих образований подтверждено при МРТ в институте в 2011 г (Л — П, стрелки). При осмотре в институте спустя месяц после кровоизлияния на фоне удовлетворительного общего состояния выявлена рассеянная умеренная стволово-мозжечковая симптоматика, которая полностью регрессировала к моменту осмотра 21.01.2012. Продолжено наблюдение.
Таким образом, многие проблемы этиологии и патогенеза каверном требуют дальнейшего изучения. Эти исследования необходимы для прогнозирования течения заболевания, что может явиться основой для дифференцированного подхода к выбору метода лечения, например, выбору между прямым хирургическим вмешательством и радиохирургией. Расшифровка механизмов формирования каверном в будущем, возможно, позволит разработать медикаментозные способы предотвращения кровоизлияний, роста и новообразования этих мальформаций.
5. Эпидемиология кавернозных мальформаций
Разнообразные сведения, касающиеся распространенности каверном, их соотношения с другими видами сосудистых мальформаций, возрастных, гендерных и других количественных характеристиках патологии, содержатся в достаточно большом числе публикаций разных лет. При сопоставлении данных, приводимых в различных исследованиях, необходимо учитывать методы установки диагноза (аутопсия, дооперационное клинико-инструментальное обследование, послеоперационное гистологическое исследование), соотношение групп по локализации патологии (большие полушария, весь головной мозг, ЦНС в целом) и клиническим проявлениям (клинически проявившиеся и бессимптомные формы).
5.1. Общая распространенность
Поскольку каверномы могут оставаться бессимптомными на протяжении жизни, достоверные данные об их истинной распространенности можно получить только по данным аутопсий. Вторым, не менее точным при современном качестве нейровизуализации, методом может быть МРТ при условии скрининговых исследований населения. В связи со сложностью проведения таких исследований, число работ, посвященных распространенности каверном, невелико. W. McCormick по результатам 5734 аутопсий умерших от разных причин обнаружил каверномы в 0,3% случаев (234). J. Robinson с соавт. при анализе 14035 случайно выбранных МРТ выявили объемные образования, расцененные независимыми рентгенологами как каверномы, в 66 случаях, что составило 0,5% (295). Аналогичную работу выполнили O. Del Curling с соавт., выявив образования, соответствующие каверномам, у 0,39% пациентов из 8131, прошедших МРТ (96). Сходные данные получены еще несколькими исследователями (180, 267). В одной из последних работ, где проведен аналогичный подсчет, частота каверном составила 0,6% (32). Опираясь на эти данные, можно предположить, что на 100 000 населения приходится примерно 500 носителей каверном.
5.2. Соотношение с другими типами сосудистых мальформаций
Проведенное W. McCormick сопоставление распространенности различных видов сосудистых мальформаций показало, что чаще всего при аутопсии можно найти венозные ангиомы — 3% вскрытий, затем следуют телеангиоэктазии — 0,8% случаев, АВМ — 0,5% и каверномы — 0,3% (234). Таким образом, каверномы, по-видимому, являются самым редким вариантом мальформаций, хотя их распространенность сопоставима с распространенностью телеангиоэктазий и АВМ.
Соотношение сосудистых мальформаций, проявившихся клинически, существенно отличается от их распространенности в целом. Многочисленные данные свидетельствуют о том, что наиболее часто симптомы заболевания, независимо от локализации патологии, развиваются при АВМ, а каверномы, как правило, занимают второе место. По данным классической работы W. McCormick с соавт., основанной на детальном изучении структуры и локализации 510 сосудистых мальформаций, проявившихся клинически, АВМ составили 52%, а кавернозные ангиомы — 15,7% (235). Аналогичные сведения приводят китайские исследователи в работе 2008г: среди детей с клинически проявившимися сосудистыми заболеваниями мозга 42,2% составили больные с АВМ, 16,2% — больные с каверномами (354). С появлением и широким распространением МРТ число выявляемых КМ существенно возросло. Помимо клинически проявившихся случаев, появилась и стала быстро увеличиваться группа бессимптомных носителей патологии. Эти привело к необходимости пересмотра некоторых представлений о течении болезни и ее лечении.
5.3. Соотношение спорадических и наследственных форм
Спорадическая форма заболевания считается наиболее частой и, по усредненным данным, составляет около 80% случаев. Соответственно, около 20% случаев относятся к наследственной форме патологии. Однако, это соотношение в различных исследованиях колеблется в очень широких пределах. По данным разных авторов, семейные формы составляют от 1,5% до 50% всех наблюдений (3, 62, 218, 358). Учитывая возможность бессимптомного носительства как спорадических, так и наследственных каверном, становится очевидным, что точные сведения о соотношении спорадической и наследственной форм могут быть получены только при проведении специальных эпидемиологических исследованиий. При клинически проявившихся каверномах изучение этого соотношения в значительной степени зависит от качества обследования родственников больных с проявившейся патологией, и, прежде всего, от числа членов семьи пробанда, охваченных обследованием. Определенное значение имеют также мощность магнитного томографа и режимы МРТ, использованные в ходе обследования. В нашей серии семейные формы составили 3% от всех больных с каверномами. Такая низкая цифра, без сомнения, отражает пока еще низкое качество семейных исследований в связи с малой информированностью врачебного сообщества о проблеме, и необходимостью затраты значительных материальных ресурсов на проведение подобных исследований.
Первоначально предполагалось, что наследственные формы встречаются преимущественно среди испаноязычного населения (107, 141, 142, 229, 292, 358), однако многочисленные публикации о семьях не испанского происхождения из разных стран Европы и Азии опровергли это положение (3, 45, 62, 131, 144, 178, 185, 258, 262). К настоящему времени известно около 30 семьй в России (см. главу 14). Возможно, в будущем систематизация этих сведений в сочетании с генетическими исследованиями позволит составить представление о популяционно-генетических особенностях заболевания.
5.4. Одиночные и множественные каверномы
Каверномы ЦНС могут быть одиночными и множественными. Согласно многочисленным исследованиям, одиночные каверномы преобладают и составляют 80 — 90% всех случаев. Соответственно, доля множественных каверном — 10 — 20%. В нашей серии больные с множественными каверномами составили 9,6% всех наблюдений. Доказана достоверная зависимость между формой патологии и количеством каверном у одного человека — одиночные каверномы типичны для спорадической формы заболевания, а множественные — для наследственной. Тем не менее, при обеих формах можно встретить больных, «нарушающих» это правило, то есть имеющих множественные каверномы при спорадической форме или одиночные — при наследственной. Эти данные свидетельствуют о том, что обоснованное заключение о спорадическом случае, особенно при множественных КМ, можно делать только на основании отрицательных результатов МРТ у нескольких кровных родственников больного. Поскольку это правило выполняется далеко не всегда, к утверждению о спорадической множественной форме каверном следует относиться с определенной степенью осторожности.
В последние годы возросшее качество МРТ и появление дополнительных режимов исследования позволяет выявлять мелкие патологические изменения мозга, которые не могли быть визуализированы ранее. В этой связи определенная часть больных с диагнозом «одиночная кавернома» переходит в группу больных с множественными образованиями, а число обнаруженных ранее множественных каверном может существенно увеличиваться. Как правило, это происходит при выявлении в ходе повторных обследований мелких каверном, которые не были видны при исследовании на низкопольных магнитах, в том числе, выявление множественных точечных образований, представляющих собой сосудистые мальформации, которые можно обнаружить только при использовании режимов SWI (см. раздел «Интсрументальные методы диагностики и исследования КМ»). В подобных случаях необходимо также рассматривать возможность новообразования каверном. Следует также помнить о том, что каверномы ЦНС могут располагаться не только в головном, но и в спинном мозге, где они могут оставаться бессимптомными.
Таким образом, как и в случаях с диагностикой наследственных форм патологии, представления о количестве каверном у одного человека в значительной степени зависит от качества выполненного обследования и его интерпретации.
5.5. Гендерные и возрастные и особенности
Пол. В работе J. Vaquero с соавт. впервые указано на преобладание женщин среди пациентов с симптоматическими каверномами: соотношение женщины/мужчины составило 2:1 (337). В последующем опубликованы работы, как подтверждающие, так и опровергающие данное положение. Преобладание женщин среди больных, перенесших кровоизлияние из каверномы, отметили J. Robinson и соавт., Т. Aiba с соавт., H. Bertallanffy с соавт. (31, 54, 294). В других исследованиях отмечено, что эта разница крайне незначительна (189, 196, 278). Данные о влиянии пола на течение заболевания подкрепляются исследованиями, в которых установлено наличие в каверномах рецепторов к женским половым гормонам (279). Многие исследователи отмечают возможность ухудшения течения заболевания у беременных, что можно объяснить как гормональной «чувствительностью» мальформаций, так и гемодинамическими изменениями, связанными с нарушением венозного кровообращения (125, 281).
В нашей серии количество женщин было несколько больше, чем мужчин — 56% и 44% соответственно. Нами отмечено, что каверномы как случайная находка встречаются у женщин гораздо чаще, чем у мужчин: среди 32 человек со случайно выявленными спорадическими каверномами было 23 женщины (71,8%) и 9 мужчин. Возможно, этот факт обусловлен более частым обращением женщин для обследования в связи с различными неспецифическими жалобами.
Возраст. Каверномы ЦНС могут проявиться клинически в любом возрасте — от младенческого до пожилого. Так, описаны случаи манифестации заболевания у детей 1 — 2 месяцев жизни, а также у пациентов старше 70 лет (13, 51, 128, 134, 249). Возрастные характеристики больных, обследованных в институте, представлены на рис. 32.
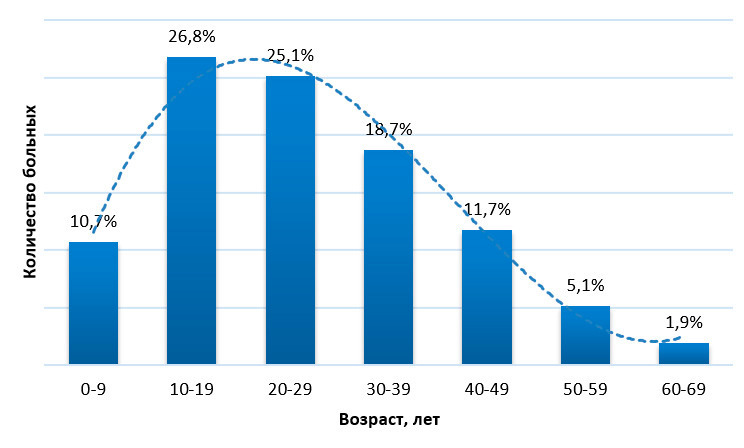
Возраст на момент начала болезни и обращения в институт варьировал в очень широких пределах — от 1,5 месяцев до 71года. Средний возраст к началу заболевания составил 23±12,8 лет, к моменту поступления — 26,4±13,5 лет. Распределение по возрастным группам показывает, что первые симптомы появляются наиболее часто в юношеском и молодом возрасте. Дети (до 18 лет включительно) составили 26% от всех обследованных.
Таким образом, существующие эпидемиологические данные свидетельствуют о том, что каверномы, являясь достаточно частой патологией, редко проявляются клинически. Основную массу больных составляют больные со спорадическими каверномами. Клинически проявившаяся кавернома — болезнь преимущественно людей молодого и среднего возраста. Патология недостоверно чаще встречается у женщин. Представления об эпидемиологических аспектах заболевания в значительной степени зависят от качества обследования обращающихся больных и их родственников.
6. Клинические проявления и течение заболевания
Клинические проявления каверном достаточно хорошо изучены и неоднократно описаны многими авторами. Это могут быть остро или подостро развивающиеся очаговые неврологические симптомы, возникающие либо на фоне общемозговой симптоматики (типичное кровоизлияние), либо при ее отсутствии; эпилептические припадки; гидроцефально-гипертензионный синдром; симптомы поражения отдельных черепно-мозговых нервов. Заболевание может развиваться по типу САК. В ряде случаев поводом для обследования являются неспецифические субъективные симптомы, чаще всего — головные боли. У достаточно большого числа больных возможны все эти проявления в различных сочетаниях. Кроме того, существует группа больных с бессимптомными каверномами, которые являются случайной находкой при обследовании по какому-либо другому поводу.
Описание клинической картины заболевания у больных с каверномами невозможно без понимания патогенеза развития симптоматики.
В настоящее время общепризнанно, что основным механизмом развития любых клинических симптомов при каверномах являются кровоизлияния из этих образований. Доказательством служат интраоперационные и патоморфологические данные, согласно которым в самой каверноме и в окружающем ее мозговом веществе всегда можно обнаружить признаки кровоизлияний различной давности и объема. В то же время, пока не существует сколь-нибудь определенных представлений о том, почему эти кровоизлияния происходят, что считать кровоизлиянием в патофизиологическом смысле, и на основе каких критериев следует ставить клинический диагноз кровоизлияния (см. разделы «Патоморфология», «Этиология и патогенез», «Диагностика»).
Помимо кровоизлияний, в литературе обсуждаются и другие механизмы развития клинических симптомов: тромбообразование с нарушением венозного оттока и увеличением объема мальформации; накопление продуктов распада крови с отложением гемосидерина и других эпилептогенных метаболитов в прилежащем к каверноме мозговом веществе вследствие нарушения гемато-энцефалического барьера; постепенное развитие глиоза в перифокальной зоне. При определенной локализации каверном клиническая картина болезни может быть обусловлена окклюзией ликворных путей.
6.1. Кровоизлияние
Кровоизлияния из каверном могут быть как достаточно объемными, так и протекать в виде микрогеморрагий. Морфологические исследования и данные МРТ показали, что следует различать кровоизлияния, происходящие «внутри» мальформации, и кровоизлияния, выходящие за границы каверномы. В случаях с кровоизлияниями с образованием объемных гематом вокруг последних со временем может формироваться капсула. После рассасывания гематомы клинические симптомы в значительной степени регрессируют. Варианты кровоизлияний можно достаточно точно диагностировать по данным МРТ (рис. 33).
Клинические проявления кровоизлияний из каверном обусловлены их объемом и локализацией мальформации.
При сравнительно большом объеме геморрагий развивается типичная клиническая картина паренхиматозного кровоизлияния в виде острого развития общемозговых и очаговых симптомов. Независимо от объема кровоизлияния, очаговые симптомы, как правило, являются ведущими, а общемозговые симптомы менее выражены и ограничиваются умеренной головной болью, иногда — тошнотой, в редких случаях — рвотой. Кровоизлияния с утратой сознания, даже кратковременной, не характерны. Кровоизлияние может сопровождаться развитием эпилептического припадка, иногда — серии припадков, вплоть до эпилептического статуса. Для каверном, расположенных в функционально значимых зонах мозга, особенно в глубинных образованиях, достаточно типичным является подострое развитие очаговых симптомов на фоне кратковременного периода головной боли. При каверномах, расположенных в стенке или полости желудочков мозга, возможно развитие вентрикулярного кровоизлияния. Кровоизлияния такого типа практически всегда представляют собой ограниченное распространение крови (гематомы) в полость желудочка (см. рис. 87).
При локализации образования в непосредственной близости от субарахноидальных пространств развивается субарахноидальное кровоизлияние с типичным менингеальным синдромом. Такие кровоизлияния встречаются крайне редко, что связано с редкой локализацией каверном в указанных областях. В нашей серии субарахноидальное кровоизлияние было подтверждено данными КТ или люмбальной пункции в 4-х случаях. Очаговые симптомы, развивающиеся при кровоизлиянии из каверномы, особенно при первом, почти всегда достаточно быстро регрессируют и, в подавляющем большинстве случаев, исчезают полностью. При повторных кровоизлияниях очаговые симптомы могут быть более выраженными и стойкими.
Несмотря на общую благоприятную картину, в отдельных случаях кровоизлияния из каверном протекают достаточно тяжело, что особенно характерно для каверном ствола мозга, глубинных отделов больших полушарий, желудочковой системы (см. главу 11). Компактное расположение функционально значимых структур в этих областях приводит у ряда больных к развитию стойких, иногда достаточно выраженных, очаговых симптомов уже после первого кровоизлияния. Тем не менее, кровоизлияния с летальным исходом встречаются крайне редко, хотя полностью вероятность такого развития болезни исключить нельзя (80, 92, 236).
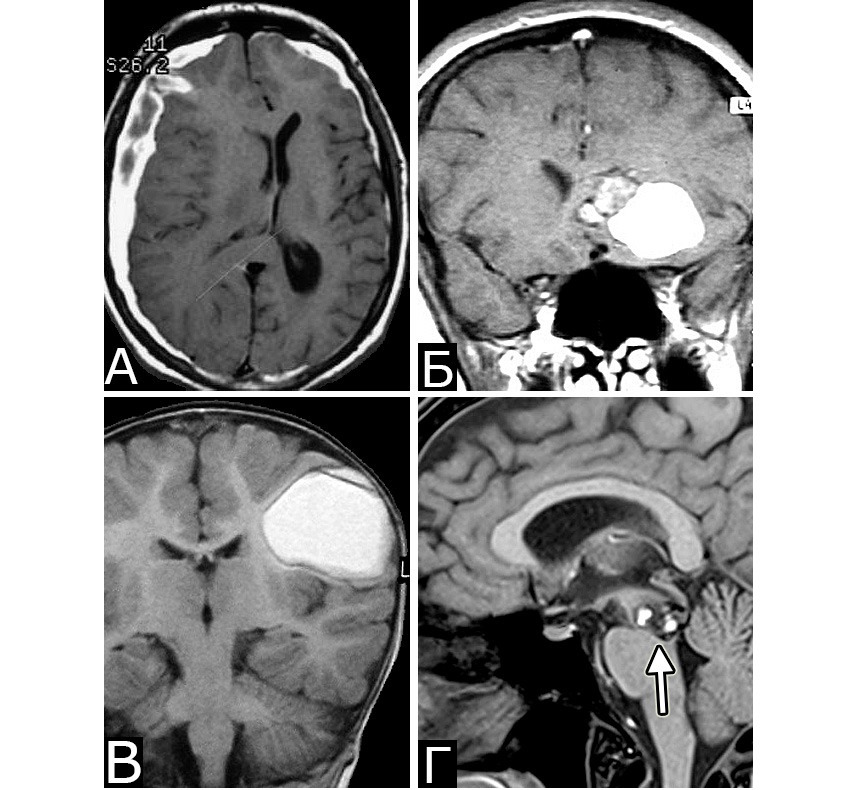
Микрогеморрагии из каверном также могут проявляться развитием преходящих, обратимых или стойких очаговых неврологических симптомов. Нельзя исключить, что периодически возникающие у некоторых больных головные боли разной интенсивности являются проявлением таких небольших кровоизлияний. Небольшим по объему кровоизлиянием можно объяснить также эпилептические припадки без последующего развития очаговых симптомов, особенно в случаях, когда приступы возникают со значительными временными интервалами. Микро кровоизлияния могут протекать бессимптомно, о чем свидетельствуют результаты МРТ и морфологические данные.
Появление очаговых симптомов при кровоизлияниях из каверном в значительной степени зависит от локализации образований. Не требует доказательств тот факт, что любое, даже очень незначительное, кровоизлияние из каверномы ствола вряд ли пройдет незамеченным. То же относится к каверномам спинного мозга, черепно-мозговых нервов, в значительной степени — к каверномам подкорковых ядер и зрительного бугра, особенно в случае их близкого расположения к внутренней капсуле. В тоже время, кровоизлияния из каверном больших полушарий, особенно при небольшом объеме, могут иметь достаточно стертую картину, а в случае расположения в функционально менее значимых участках мозга протекать с минимальной неврологической симптоматикой или бессимптомно.
Какая-либо зависимость между размером каверномы и объемом кровоизлияния из нее не установлена: как при мелких, так и при крупных, и даже гигантских каверномах могут развиваться кровоизлияния любого типа. В целом, массивные кровоизлияния менее типичны, чем микрогеморрагии (38, 95, 294). Склонность к кровоизлиянию определяется, скорее, не размером, а морфологическими и функциональными особенностями образований. Совершенствование МРТ и других методов в определении этих особенностей, возможно, будет способствовать прогнозированию геморрагий (см. главы 4, 5, 8). Кровоизлияния из каверномы могут быть однократными или повторными. Симптомы, возникающие при первом и повторных кровоизлияниях, могут быть однотипными, а могут отличаться, что зависит от того, в какой части каверномы произошло кровоизлияние, и от его объема.
Скорость регресса очаговых симптомов, обусловленных кровоизлиянием, может быть различна и также зависит от его объема и локализации. Длительный регресс и остаточные симптомы более типичны для кровоизлияний из глубинных каверном. Более полное восстановление неврологического дефекта отмечается, как правило, после первого кровоизлияния. При повторных кровоизлияниях из каверном глубинной локализации нередко остается стойкий неврологический дефицит (рис. 34).
Данное наблюдение демонстрирует непредсказуемость и интервалов между кровоизлияниями и возможность большой длительности интервалов между ними (см. ниже). Оно также интересно тем, крупная киста сформировалась, судя по ее рентгенологическим характеристикам, задолго до последнего клинического эпизода, а появившаяся выраженная симптоматика обусловлена небольшим по объему кровоизлиянием во внутреннюю капсулу.
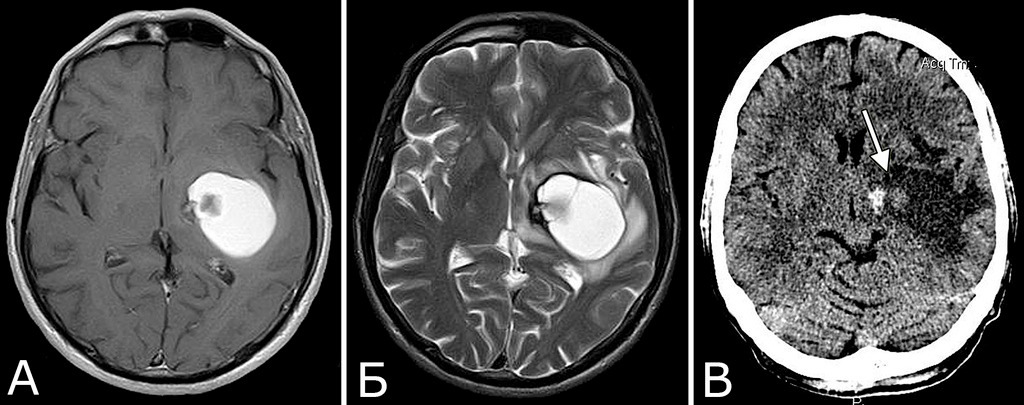
Течение заболевания (б-ной Т-ко, 1950 г. р.): в 1981 г (32 г) в течение нескольких дней появилась и наросла слабость в правых конечностях, которая полностью регрессировала через 3 мес. Лечился с диагнозом «инсульт». При АГ патологии не выявлено. Повторные аналогичные эпизоды в 1989 г (39 лет) и 1998 (48 лет), также с полным регрессом неврологического дефекта. 1.10.2008 (58 лет) остро развился глубокий правосторонний гемипарез, правосторонняя гемигипестезия, моторная афазия. При КТ и МРТ спустя 1 неделю после этого эпизода (ранее эти исследования не проводились) выявлена небольшая КМ наружных отделов левого зрительного бугра, большая кистозная полость, распространяющаяся на внутреннюю капсулу и базальные ганглии) (А — В), признаки небольшого кровоизлияния в проекции внутренней капсулы (В, стрелка). При поступлении спустя месяц после кровоизлияния: выраженная моторная афазия; центральный парез VII нерва справа; выраженная болевая гипестезия на правой половине лица; глубокий пирамидный правосторонний гемипарез, но может передвигаться самостоятельно; глубокая правосторонняя болевая гемигипестезия; нарушение суставно-мышечного чувства в дистальных отделах конечностей справа. Операция: опорожнение кисты и удаление КМ глубинных отделов левого полушария. Послеоперационное течение: без ухудшения. Гистологический диагноз: кавернозная мальформация с гиалинозом стромы и склерозом отдельных полостей.
Критерии диагноза. Вопрос о правомерности и критериях диагноза «кровоизлияние из каверномы» долгое время являлся предметом оживленной дискуссии. Помимо академического интереса, эта проблема важна в связи с тем, что частота кровоизлияний является одним из основных факторов при определении показаний к хирургическому вмешательству, а также при оценке и сопоставлении эффективности различных методов лечения, в особенности, при оценке результатов радиохирургии. Существует два различных подхода к установке диагноза «кровоизлияние». Согласно первому, диагноз можно считать обоснованным только в случаях выявления свежей крови при КТ, МРТ или люмбальной пункции (227, 278, 294) — это так называемые доказанные, или очевидные (overt) кровоизлияния. Однако, рентгенологическая, а тем более, ликворологическая верификация кровоизлияния возможна далеко не всегда. Для подтверждения факта кровоизлияния по КТ или МРТ необходимо, чтобы оно было достаточно массивным. Кроме того, обследование должно быть проведено в ближайшие сроки после появления соответствующей симптоматики, что выполняется достаточно редко, особенно в случаях небольших кровоизлияний. В остром и подостром периоде кровоизлияния, особенно достаточно объемного, может быть выявлен перифокальный отек, хотя выраженный отек в целом не характерен (рис. 35).
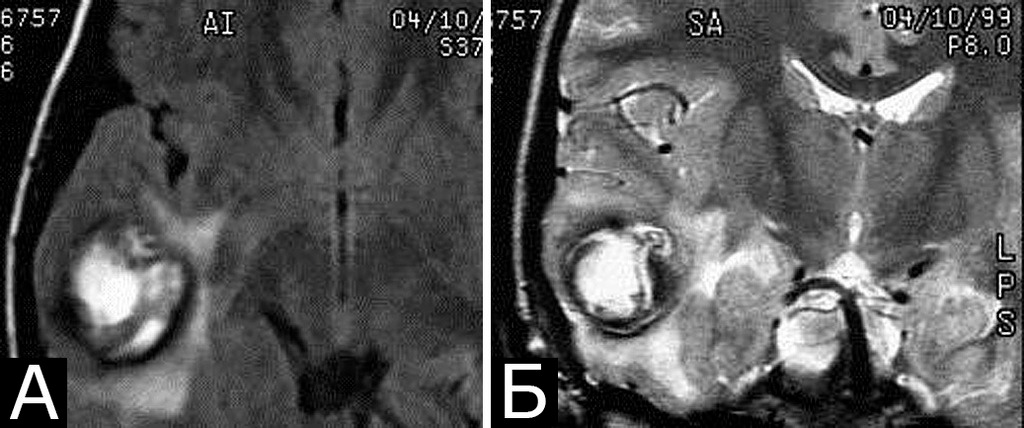
В отдаленном периоде в некоторых случаях можно обнаружить небольшие или достаточно крупные постгеморрагические кисты, прилежащие к каверноме (рис.36, А. Железнова). Признаком ранее перенесенных микрокровоизлияний служит наличие гемосидерина в окружающей каверному ткани, выявляемое при МРТ в виде ободка вокруг образования (рис. 36, Б).
Последний признак все же является косвенным, так как указанное кольцо может образовываться вследствие попадания крови в мозговое вещество per diapedesis.
Второй подход к диагностике кровоизлияний из каверном — фиксация любого острого развития общемозговой или очаговой симптоматики, в том числе, первого эпилептического припадка, как кровоизлияния. Этот подход оправдан при глубинных каверномах больших полушарий и при каверномах задней черепной ямки, но вряд ли может быть применен у больных с эпилептическими припадками, особенно при длительном эпилептическом анамнезе и частых приступах.
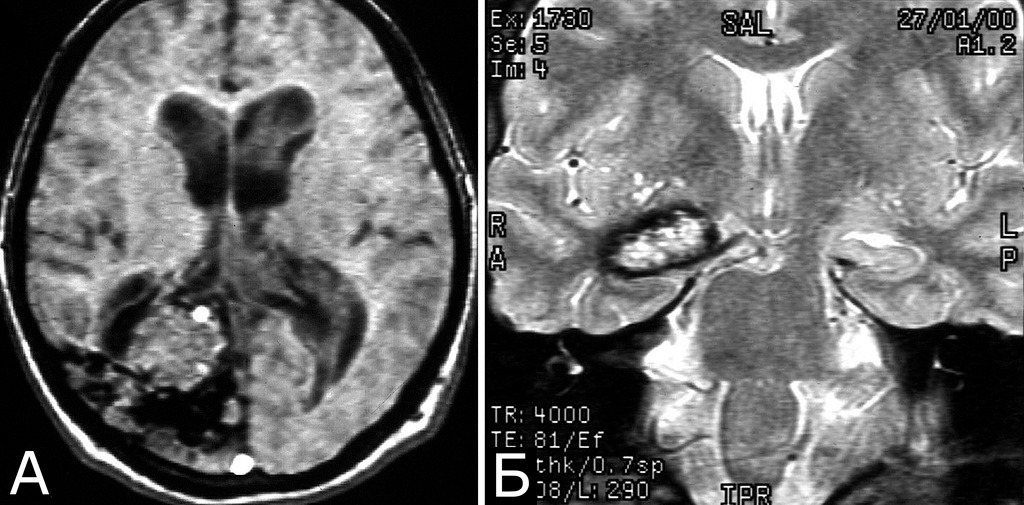
Существующие различия в определении понятия «кровоизлияние» отразились в значительном разбросе данных при оценке его частоты. Так, при условии обязательной верификации, кровоизлияния из супратенториальных каверном отмечаются у 7 — 16% больных (95, 244, 294), а при втором подходе их частота достигает 55% — 88% (34). Ввиду того, что достоверное подтверждение кровоизлияния часто невозможно, а в клинической практике имеет значение не сам факт кровоизлияния, а его последствия для больного, было предложено объединить очевидные кровоизлияния и любое острое развитие очаговых неврологических симптомов термином «неврологическое событие» (278). В последние годы этого подхода придерживаются многие исследователи, особенно при анализе клинических проявлений каверном глубинных отделов больших полушарий и ствола мозга.
При обследовании больных в НИИ нейрохирургии мы пользовались преимущественно клиническими критериями в определении кровоизлияния из мальформации. Диагноз кровоизлияния ставили в случаях острого или подострого развития очаговых неврологических симптомов, которые сохранялись не менее нескольких часов. В пользу кровоизлияния свидетельствовали также интенсивная головная боль, тошнота, рвота. Диагноз кровоизлияния ставили в случае эпилептического припадка, особенно первичного, если после него сохранялась какая-либо очаговая или общемозговая симптоматика. Достоверными признаками кровоизлияния служили данные МРТ или КТ: острые или подострые гематомы, выходящие за границы каверномы или приводящие к увеличению ранее имевшейся мальформации; признаки крови в субарахноидальном пространстве или желудочковой системе; перифокальный отек. По этим данным, среди обследованных больных не менее одного кровоизлияния перенесли около 50% больных. При супратенториальных каверномах эта цифра составила около 24%, а при каверномах задней черепной ямки — около 85%. Эти данные, несомненно, отражают особенности клинических проявлений заболевания и его диагностики, а не истинную частоту кровоизлияний при различной локализации каверном, о чем сказано выше.
Частота и факторы риска. Частота и тяжесть кровоизлияний из каверном является одним из тех показателей, на которых основывается клиницист при выборе тактики ведения и метода лечения больного и оценке их эффективности. Поскольку как «очевидные» кровоизлияния, так и неврологические эпизоды, которые с большой долей вероятности могут быть расценены как кровоизлияния, происходят у конкретного больного с непредсказуемой частотой, и, нередко, с большими временными интервалами, для совокупной оценки кровоизлияний были предложены различные системы подсчетов. В зависимости от поставленных задач, существует система подсчета числа кровоизлияний на одного больного в год, либо на одну каверному в год (общее количество кровоизлияний у всех обследованных Х число прожитых человеко-лет / количество больных или каверном). Рассчитанные таким образом показатели характеризуют усредненное число кровоизлияний на одного человека или на одну каверному в год. Такие подсчеты проводятся как с учетом всех кровоизлияний, включая первое, так и с учетом только повторных кровоизлияний. В большинстве исследований годовой риск кровоизлияния вычисляется исходя из представлений о врожденном характере патологии, то есть с учетом всех прожитых лет, но в целом ряде работ он рассчитывается по числу лет наблюдения. Последний способ адекватен при определенных задачах, как например, при оценке катамнеза, но вряд ли может быть принят для оценки естественного течения болезни. При оценке приводимых в литературе данных следует также обращать внимание на локализацию каверном в анализируемой группе, так как данные по частоте и числу кровоизлияний для супратенториальных и субтенториальных каверном в силу описанных выше причин могут различаться.
Попытка систематизировать сведения по частоте кровоизлияний показала, что делать какие-либо выводы по этому вопросу достаточно сложно, так как отсутствует стандартная общепринятая методика расчетов (табл. IV).
По представленным в таблице данным можно с достаточной уверенностью сделать выводы о том, что риск как первичного, так и повторного очевидного кровоизлияния из КМ достаточно низок и находится для каверном всех локализаций в пределах 0,25% — 6,5% на человека в год. Частота первичных кровоизлияний из каверном ствола выше, и составляет 2% — 7% на больного в год.
Наиболее высокие цифры приводятся для повторных кровоизлияний из каверном ствола. Необходимо еще раз подчеркнуть, что все приведенные данные требуют критической оценки в связи с разными, и не всегда ясными, методами подсчетов.
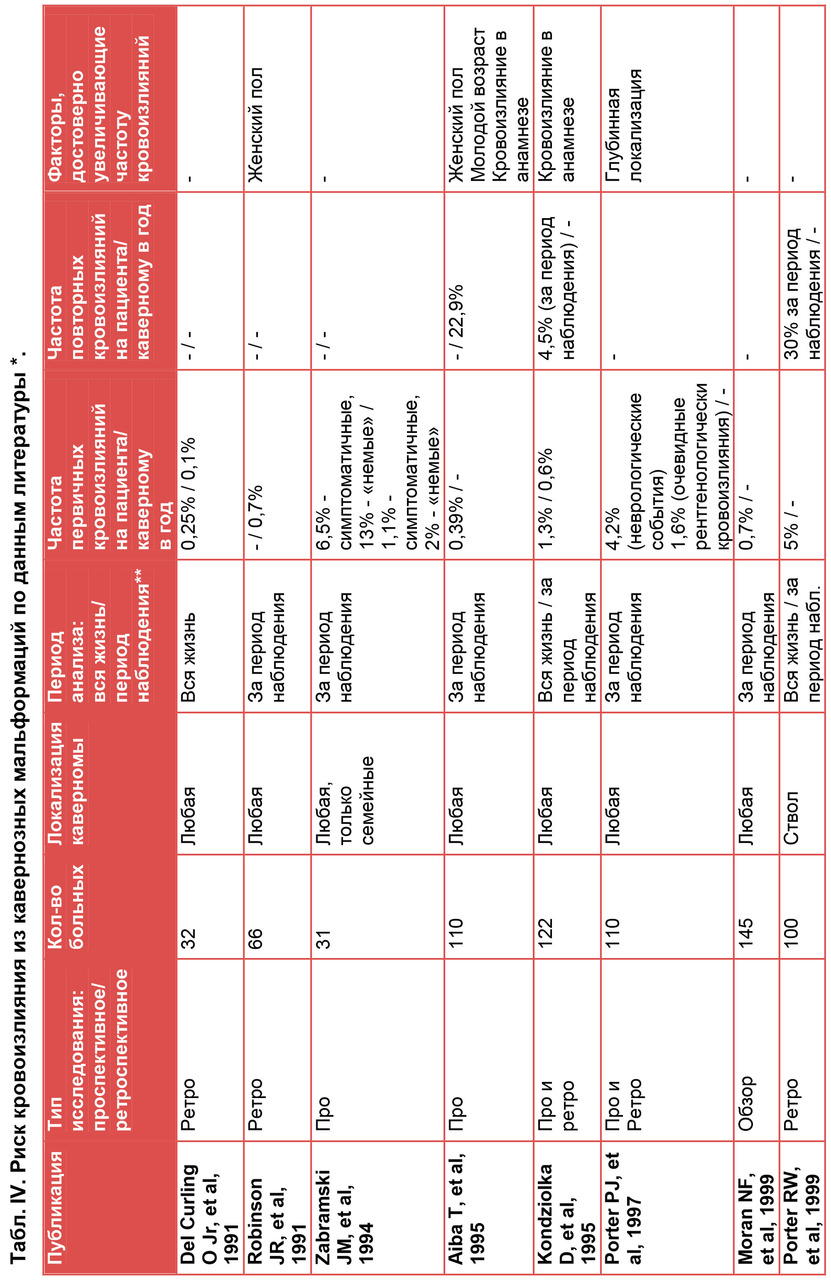
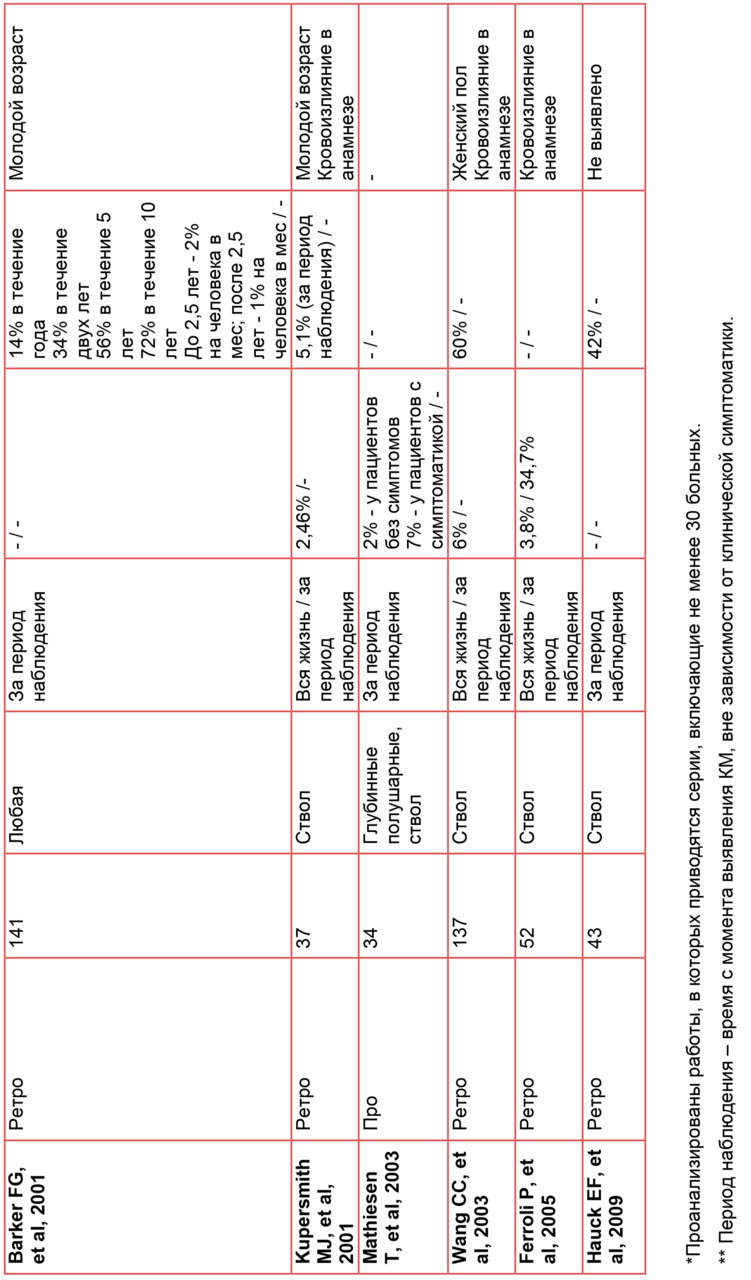
Многие исследователи делали попытку выявить факторы, влияющие на частоту кровоизлияний из каверном.
Одним из общепризнанных факторов, увеличивающих вероятность кровоизлияния, является предшествующее кровоизлияние в анамнезе. Согласно различным работам, посвященным анализу естественного течения заболевания, вероятность повторного кровоизлияния превышает риск первичного в 2—10 раз. Одними из первых на это указали Aiba и соавт. (31). В ретроспективном исследовании на материале 110 больных авторы выявили значительное различие между рисками первичного и повторного кровоизлияния — 0,39% против 22,9%. В других исследованиях получены схожие результаты. Kondziolka с соавт. при ретроспективно-проспективном обследовании 122-х больных установили, что риск клинически значимых кровоизлияний у пациентов без кровоизлияний в анамнезе составляет 0,6% на пациента в год, а у больных, перенесших кровоизлияние, — 4,5% (189). В проспективном исследовании Moriarity с соавт. общий риск кровоизлияния у 68 пациентов с 228 каверномами составил 3.1% на пациента в год (248). Авторы не подтвердили, что кровоизлияние в анамнезе является самостоятельным фактором риска рецидива, и, кроме того, установили, что пациенты с очаговым неврологическим дефицитом, связанным или не связанным с кровоизлиянием, имеют значительно больший риск кровоизлияния из каверномы (8,9% против 0,4% на пациента в год).
В некоторых работах приводятся данные, свидетельствующие о том, что повышенный риск повторного кровоизлияния уменьшается с течением времени. В 2001 году Barker и соавт. на основании изучения кривых риска повторного кровоизлияния у 141 больного, показали спонтанное снижение риска кровоизлияния приблизительно через 2 года после предыдущего (42). Феномен получил название «временная кластеризация» («temporal clustering»). Работы, подтверждающие «временную кластеризацию», малочисленны (343).
Многие авторы указывают на то, что частота кровоизлияний выше при каверномах глубинного расположения. Так, P. Porter и соавт., проанализировав течение болезни у 173 больных, установили, что риск повторных кровоизлияний выше у больных с субтенториальными каверномами по сравнению с супратенториальными, и у больных с глубинными каверномами по сравнению с поверхностными (278). При отдельном анализе кровоизлияний из каверном ствола мозга частота клинически значимого кровоизлияния составила 5% на человека в год, клинически значимого повторного кровоизлияния — 30% на человека в год (279). В ретроспективной работе C. Cantu с соавт. ежегодный риск кровоизлияния для глубинных супратенториальных каверном составил 2,82%, для лобарных — 1,22% (64). Другие авторы, напротив, не находят различий в частоте кровоизлияний при разной локализации каверном (31, 248).
Среди других факторов, связанных с повышенным риском кровоизлияния, указывается на гендерные различия с преобладанием числа кровоизлияний у женщин (31, 71, 282, 294, 337). Данные о влиянии пола на течение заболевания подкрепляются исследованиями, в которых установлено наличие в каверномах рецепторов к женским половым гормонам (279). Отдельные исследователи отмечают возможность ухудшения течения заболевания у беременных (71). В то же время существует немало работ, в которых показано, что гендерные различия в течении болезни крайне незначительны (189, 196).
Некоторые авторы приводят данные, свидетельствующие о более высокой частоте кровоизлияний у детей (30, 84, 253, 297), однако следует учитывать, что этот результат может быть следствием повышенного внимания к любому недомоганию ребенка по сравнению со взрослыми. Каких-либо закономерностей в частоте кровоизлияний в разных возрастных группах у взрослых не установлено.
Для хирургического лечения больных, помимо сведений о естественном течении заболевания, большое значение имеет тот факт, что риск кровоизлияния из частично удаленной каверномы сопоставим с риском повторного кровоизлияния из не оперированной каверномы (230).
Таким образом, следует признать, что несмотря общность подходов различных исследователей к вопросу определения кровоизлияния из каверномы, четких критериев этого диагноза не существует. В этой связи при характеристике клинических проявлений заболевания целесообразным представляется использование термина «неврологическое событие», хотя критерии этого понятия также не вполне очерчены. Неопределенность терминологии отражается в достаточно существенных колебаниях при различных расчетах, связанных с кровоизлияниями из каверном. Частота кровоизлияний из каверном в целом является достаточно низкой. Вероятность повторного кровоизлияния выше, чем первичного, однако нельзя исключить, что частота кровоизлияний с течением времени может уменьшаться. Локализация каверномы в глубинных отделах больших полушарий, стволе мозга и мозжечке — спорный фактор более высокого риска кровоизлияния. Очевидно лишь то, что информация о кровоизлиянии при каверномах этих отделов мозга более достоверна, что обусловлено компактным расположением большого числа функционально значимых структур в перечисленных образованиях. Нет также зависимости между частотой кровоизлияний и размером каверном. Сведения о более высокой частоте кровоизлияний у женщин и детей также нельзя считать доказанными, однако эти факты следует принимать во внимание при планировании лечения.
6.2. Эпилептические припадки
Распространенность и причины. При рассмотрении всей совокупности каверном, наиболее частым клиническим проявлением болезни являются эпилептические припадки. Этот факт, без сомнения, служит отражением преимущественной локализации каверном в корковых и субкортикальных отделах больших полушарий. По нашим данным, среди больных с супратенториальными каверномами эпилептическими припадками страдают около 60% больных, а среди больных, у которых каверномы расположены в неокортексе — примерно 90%. Аналогичные данные приводят все исследователи, занимавшиеся этой проблемой (35, 96, 244, 294). Поскольку эпилептические припадки характерны только для супратенториальных каверном, приводимые далее сведения будут касаться этой группы больных.
Согласно последнему пересмотру классификации, эпилепсия у больных с КМ относится к группе структурно — метаболических (ранее — симптоматических) эпилепсий (49). Многочисленные исследования показали, что каверномы являются одними из самых эпилептогенных внутримозговых патологических образований. Так, J. Robinson с соавт., сравнивая частоту припадков при супратенториальных каверномах, АВМ и глиальных опухолях, показали, что при сопоставимой локализации и размерах образований, эпилептические припадки при каверномах наблюдались в 50 — 70% случаев, при АВМ — в 20 — 40% случаев, при глиомах — в 10 — 30% (294). Считается, что причиной первого припадка практически всегда является кровоизлияние из каверномы. В ряде случаев это положение удается подтвердить выявлением свежей крови на МРТ или КТ. Доказать, что причиной повторных припадков также служит повторное кровоизлияние, гораздо сложнее. При отсутствии объективных доказательств, такой механизм можно предположить у больного с редкими приступами, а также с приступами, которые сопровождаются развитием преходящей или стойкой очаговой симптоматики. У больных с частыми приступами при отсутствии «свежих» геморрагических изменений на КТ или МРТ предположение о повторных кровоизлияниях как причине продолжающихся припадков маловероятно. В этих случаях причину припадков следует искать в формировании эпилептического очага в зоне ранее перенесенного кровоизлияния вследствие структурно-функциональных изменений тканей, окружающих каверному: глиозно-кистозного перерождения, воспаления, высокой концентрации эпилептогенных продуктов. К последним подавляющее большинство исследователей относят гемосидерин и ионы железа, эпилептогенность которых доказана в ряде экспериментальных исследований при их аппликации на кору головного мозга животных (192, 250, 251, 348). Помимо кровоизлияний, высокая концентрация ионов железа может быть следствием процесса деградации крови в кавернах мальформации (96, 192, 227, 291). При электронно-микроскопических исследованиях показана неполноценность эндотелиального слоя и базальной мембраны стенок каверн, что способствует выходу их содержимого в окружающую мозговую ткань (81, 217). В ряде исследований в окружающем каверному мозговом веществе выявлены повышенные уровни содержания глицина и серина, что также характерно для эпилептогенной ткани (117). Некоторые исследователи связывают эпилептогенез при каверномах с высокой концентрацией альбумина в астроцитах по периферии мальформаций. Авторы объясняют этот феномен нарушением гематоэнцефалического барьера в прилежащих к каверномам и АВМ участках мозга (284).
Согласно теории вторичного эпилептогенеза, длительно существующие эпилептические очаги способны приводить к формированию вторичных очагов на расстоянии от локализации патологического образования (252). Это особенно характерно для патологических образований височной доли (207). Вероятность возникновения вторичных эпилептических очагов пропорциональна длительности существования эпилепсии и количеству припадков. Достоверные данные о формировании вторичных эпилептических очагов у больных с каверномами отсутствуют. Тем не менее, этот механизм следует учитывать при обследовании больных, особенно при сохранении приступов после операции.
Учитывая, что у подавляющего числа больных эпилептические припадки являются единственным проявлением болезни, а избавление от них служит основным поводом обращения к врачу и ведущим фактором при обосновании того или иного вида лечения, оценка эпилептического синдрома у больных с каверномами представляется крайне важной. Между тем, анализ типов, частоты и динамики приступов представляет непростую задачу. Он базируется преимущественно на сведениях, которые сообщает больной в процессе сбора анамнеза. Многолетний опыт работы с больными, страдающими эпилептическими припадками, показал, что выяснение всех аспектов течения болезни в ряде случаев бывает достаточно затруднительным: больные и их родственники часто не фиксируют все приступы, не могут точно их описать. Практически все обследованные нами больные до обращения в институт получали атиконвульсанты, однако, большинство из них сообщали неточные сведения о препаратах, дозах, схемах противосудорожной терапии, регулярности приема. Дневник припадков вели лишь некоторые больные, поэтому оценить эффективность терапии часто не представлялось возможным. Тем не менее, по сведениям, полученным от нескольких сотен больных, можно составить достаточно четкое представление о вариантах течения эпилептического синдрома при каверномах больших полушарий.
Типы эпилептических припадков. Как и в большинстве посвященных каверномам работ, при систематизации типов эпилептических припадков мы использовали несколько упрощенную классификацию приступов на основе классификации ILAE 1983 года, выделяя простые парциальные (фокальные), сложные парциальные (фокальные с изменением сознания), первично и вторично генерализованные приступы. У обследованных больных имели место все возможные варианты припадков. У многих на протяжении болезни могли возникать приступы разных типов. В таких случаях мы харатеризовали приступы как полиморфные (минимум 2 класса приступов в любых сочетаниях).
Частота припадков различных типов в нашей серии представлена на рис. 37.
Только генерализованные припадки были у половины больных. Примерно у трети из них установлено наличие фокального начала («вторичная генерализация). У остальных больных генерализованный приступ развивался без явных предвестников. Среди пациентов с полиморфными приступами практически у всех наблюдались и припадки с генерализацией. В целом приступы с генерализацией были у большинства больных — до 80%. Простыми фокальными приступами страдали около 12% больных. Самую маленькую группу составили больные сложными парциальными приступами (приступы с изменением сознания). В литературе приводятся сопоставимые сведения о типах припадков, хотя частота некоторых вариантов приступов варьирует в очень широких пределах. По имеющимся данным, у больных с супратенториальными каверномами генерализованные припадки встречаются в 27% — 63% случаев, простые парциальные — в 27% — 31% случаев и сложные парциальные — в 6% — 45% случаев (244, 313). Значительная доля генерализованных припадков связана с частой локализацией каверномы в лобной доле. Каверномы височной доли проявляются генерализованными припадками в значительно меньшем числе случаев, чем при любой другой локализации (244).
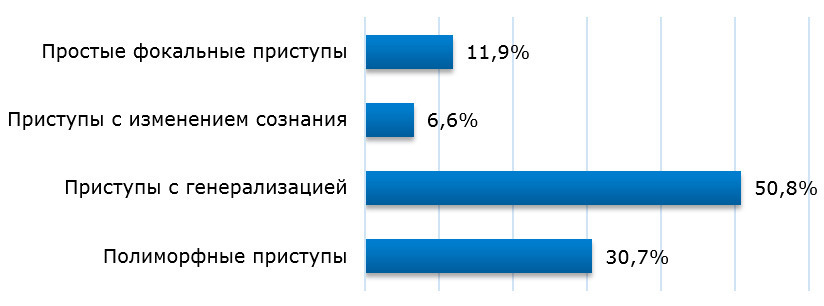
Соотношение локализация каверномы — тип припадка в нашей серии имели «классическую» структуру. Так, при каверномах премоторных отделов лобных долей чаще всего наблюдались генерализованные судорожные или безсудорожные припадки, при каверномах области центральных извилин — парциальные судорожные приступы и вторично генерализованные припадки. У больных с каверномами медиальных отделов височной доли наиболее типичными были приступы в виде висцеро-вегетативных пароксизмов, приступы типа амбулаторного автоматизма, абсансы, а при конвекситальном расположении каверном в доминантном полушарии — приступы с нарушениями речи.
Частота эпилептических припадков служит второй важной составляющей их характеристики. Она является одним из основных факторов, на которых базируются показания к операции, а также критерии оценки эффективности как хирургического лечения, так и приема антиконвульсантов.
Общепринятой оценки частоты эпилептических припадков не существует. В нашей работе мы придерживались классификации, используемой в отечественной психиатрии (24). (Табл. V).
Табл. V. Оценка частоты эпилептических припадков по Ремезовой Е. С. соавт., 1965 г.
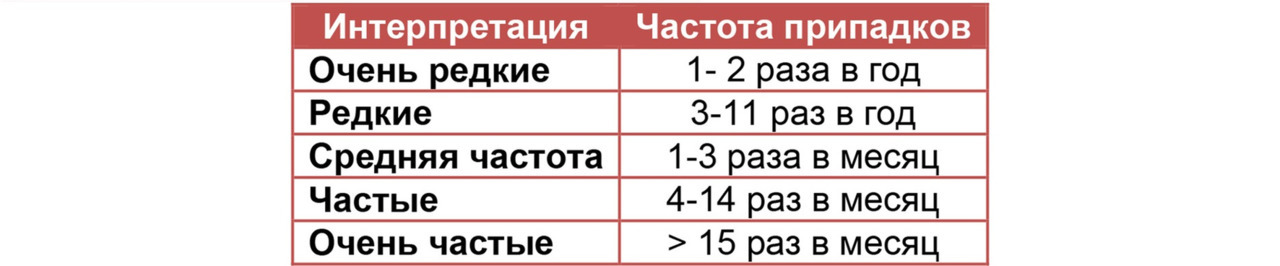
Определенное значение для характеристики частоты припадков у больных с каверномами имеет давность анамнеза. Так, для присвоения категорий «редкие» и «очень редкие» необходимы сведения о приступах за период не менее года, для категорий «средняя частота» и «частые» — не менее месяца. Для категории «очень частые» достаточно наблюдения в течение 1—2 недель. В случаях, когда такая оценка невозможна, следует ограничиться указанием числа приступов за прошедшее с момента первого приступа время. Для более точной характеристики частоты приступов мы проводили оценку за промежуток времени, за который пациент не изменял схему лечения антиконвульсантами. У больных с полиморфными приступами отдельно анализировали частоту генерализованных приступов (как наиболее инвалидизирующих).
Систематизация частоты приступов нередко представляла значительные трудности. Это, прежде всего, связано со своеобразием течения болезни, характеризующимся непредсказуемостью интервалов между припадками у конкретного больного. Так, в отдельных наблюдениях интервал между 1-ым и 2-м припадком составил 30 лет и более. В некоторых случаях после короткой серии приступов, или приступов, регулярно возникавших на протяжении ряда лет, наступала длительная ремиссия, причем как на фоне приема антиконвульсантов, так и без противосудорожной терапии (см. рис. 114). Для характеристики частоты приступов в подобных случаях нами предложена категория «ациклические эпилептические приступы». Мы также выделили группу больных с коротким анамнезом, для которых оценка частоты припадков была невозможна вследствие короткого анамнеза.
Данные, полученные нами в результате опроса более 600 больных с эпилептическими припадками, показали, что частота припадков варьирует в очень широких границах — от крайне редких приступов до нескольких припадков в сутки (рис. 38).
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.