
Об авторе

Доктор Флейшер Григорий Михайлович — псевд. Гершон Флейшер (Dr Grigori Fleicher, pseudonym Dr. Gershon Fleicher) родился 11 января 1970 году в Перми; лето 1977—78 гг. — школа юнг Краснознаменный Черноморский Флот СССР (г. Одесса) — в 1980 г. награждён именной настольной медалью и кортиком-ручкой; 1987 г. — окончил школу №77 с углубленным изучением английского языка, г. Пермь; 1993 г. — окончил стоматологический факультет Пермского государственного медицинского института, г Пермь; 1995—96 гг. — член Международной Ассоциации Молодых Стоматологов (Young Dentists Worldwide, YDW); 1995—96 гг. — член Международной Ассоциации Стоматологов (FDI World Dental Federation);
с 1997 г. по н.в. — действительный член Международной Академии Пародонтологии (International Academy of Periodontology, IAP, New-York);
с 1997 г. по н.в. — член Стоматологической Ассоциации России (СтАР);
2017 г. — Диплом за вклад в современную поэзию (Интернациональный Союз писателей);
2018 г. — Диплом номинанта Международного литературного конкурса Гомера (Интернациональный Союз писателей).
В 2001 году была совместно написана и опубликована работа с проф. Г. А. Пашинян (г. Москва). Д-р Г. М. Флейшер является учеником профессоров А. В. Алимского и Г. В. Банченко (ФГБУ «ЦНИИС и ЧЛХ» МЗ РФ, г. Москва). Совместно были написаны и опубликованы в различных медицинских изданиях работы, посвященных изучению заболеваний слизистой оболочки полости рта, гальванозу, гигиенистам стоматологическим и детской стоматологии.
Впервые в России с 1999 по 2010 гг. на базе Стоматологического центра КМСЧ ОАО НЛМК Д-р Г. М. Флейшер на общественных началах организовал кабинет профилактики стоматологических заболеваний, в котором находилась Выставка средств гигиены полости рта. Целью создания кабинета была пропаганда и программа обучения правильной чистке зубов, языка, выполнение гигиенических манипуляций, выбор необходимой зубной пасты, щетки, ополаскивателя и т. д., обучение пациентов рациональному использованию средств и методов ухода за зубами, пропаганда здорового образа жизни и т. п. Также на базе кабинета проходили обучение и стажировку студенты (гигиенисты стоматологические) Липецкого медицинского колледжа. Д-р Г. М. Флейшер проводил тематические уроки среди школьников в школах г. Липецка, выступал на Липецком радио, телевидении. Область научных интересов: судебная медицина, стоматология (история, развитие, организация, управление стоматологии, пародонтология, детская стоматология, ортопедическая стоматология, имплантология, ортодонтия).
Двукратный рекордсмен Мировой Книги Рекордов Гиннесс, писатель, поэт, автор и соавтор околоо 200 научных публикаций, в том числе 33 книги.
Дети: дочь — Кристина (19.04.1994).
С 1993 г. по н.в. проживает в Липецке и работал врачом-стоматологом (а также — врачом-судебно-медицинским экспертом-стоматологом в Липецком областном бюро судебно-медицинской экспертизы, преподавателем — учебный центр КМСЧ ОАО НЛМК, Липецкий медицинский колледж).
Липецкий стоматолог Г. М. Флейшер — Двукратный рекордсмен Мировой Книги Рекордов Гиннесса. В 2008 г он попал на страницы всемирно известного издания как обладатель самой большой в мире коллекции зубных щеток. Коллекция насчитывала тогда 1320 различных единиц. Второй рекорд — коллекция средств гигиены полости рта насчитывала — более 3000 единиц. Сейчас она значительно выросла. Помимо зубных щеток в коллекции Г. М. Флейшер — зубные пасты, спреи, ополаскиватели, зубочистки и другие средства гигиены полости рта, всего — свыше 4500 экземпляров. Благодаря своей коллекции Г. М. Флейшер является также лауреатом Ассоциации «Русские рекорды» в номинации «Рекорды коллекционирования». Коллекция пополняется собственными приобретениями Г. М. Флейшер и подарками друзей. С 2014 г публикует свои книги в Германии, с 2017 г — в России.
Глава 1. Гигиена полости рта как метод первичной профилактики стоматологических заболеваний
1. Гигиена полости рта как метод первичной профилактики стоматологических заболеваний. Значение гигиены полости рта в профилактике кариеса и воспалительных заболеваний пародонта
В последние годы довольно широко обсуждается вопрос о необходимости реализации здорового образа жизни современного человека, что будет способствовать активному и плодотворному долголетию. При этом уделяют большое внимание борьбе с вредными привычками и совершенно не останавливаются на такой значимой и важной социально-медицинской проблеме, как гигиена человека, в том числе гигиена полости рта, имеющие большое значение, для профилактики общих и стоматологических заболеваний.
Между тем регулярный и грамотный уход за полостью рта должен являться неотъемлемой частью всех профилактических мероприятий. Современная кулинарная обработка пищевых, продуктов и характер употребляемой пищи (много мучных изделий, перемолотая и измельченная продукция, значительное количество сахаросодержащих веществ и др.) не способствуют естественной очистке зубов. Продукты, ускоряющие слюноотделение и механически, очищающие зубы (сырые овощи и фрукты), используются относительно редко. Вместо них жители городов употребляют пирожные, кисели, котлеты и другие подобные блюда, в результате чего в полости рта накапливаются клейкие остатки пищи, являющиеся хорошей питательной средой для многочисленной микрофлоры и основой для образования зубного налета.
Эти положения были наглядно продемонстрированы исследованиями, в которых группе лиц, регулярно чистивших зубы, предложили временно прекратить уход за полостью рта, употреблять мягкую пищу. Через 14—21 день у всех наблюдаемых появились обильные зубные отложения с большим количеством микрофлоры и воспалительные явления в области десневого края, которые диагностированы как диффузный гингивит. Эти патологические явления удалось ликвидировать лишь путем тщательного, профессионального удаления зубных отложений и последующей регулярной и тщательной гигиеной полости рта.
Нельзя недооценивать роль и значимость индивидуальной гигиены полости рта как ведущего местного лечебно-профилактического фактора, ответственного за предупреждение образования и развития зубного налета, запуска механизма деструкции всего комплекса пародонта, начиная с разрушения зубодесневого прикрепления, круговой связки зуба, проникающим вглубь по корню зубным камнем.
На сегодняшний день однозначно доказана взаимосвязь и взаимозависимость между состоянием пародонта и уровнем индивидуальной гигиены полости рта. Подготовка к разрушению пародонта начинается с момента формирования зубной бляшки и накопления мягких зубных отложений. По мере их качественного и количественного увеличения, сопровождающегося минерализацией, происходит накопление предвестников последующего необузданною процесса разрушения всего комплекса пародонта. Мягкий налет, скапливаясь, в первую очередь, в пришеечной области межзубных промежутках, придает зубам желтоватый цвет за счет видимых рыхлых своих отложений, кроме этого, появляется неприятный запах изо рта,;а счет процессов брожения и гниения, происходящих внутри самого налета под воздействием жизнеобеспечивающих метаболических процессов микроорганизмов, составляющих живую флору налета; эти процессы приводят к развитию воспаления подлежащей десны, известное, как гингивит.
Далее воспалительные процессы, на фоне роста зубных отложений, их активности, смещения рН ротовой жидкости и особенно рН зубодесневой борозды в кислую сторону, приведут к разрушению зубодесневого прикрепления и микробной инвазии периодонта, сопровождающегося разрушением межзубных и межкорневых перегородок альвеолярного отростка, нарастанием кровоточивости десен, образованием зубодесневых и костных карманов с обильным серозно-гнойным экссудатом, все увеличивающейся подвижностью зубов, т. е. наиболее яркому проявлению патологического состояния известного как пародонтит. Описание различных состояний пародонта при его патологии можно было бы, и продолжить, но нас интересует, как, на каком из этапов мы можем повлиять на течение этих патологических процессов, не прибегая к радикальным средствам, типа лоскутных операций и другим.
Человечество придумало средства гигиены полости рта не вчера и не сегодня, они насчитывают уже много тысячелетий. Только дошедшие до нас, благодаря археологическим находкам, предметы оральной гигиены насчитывают уже 60 веков. Это достойный возраст для столь скромных атрибутов человеческой жизни, однако, он показывает и доказывает, что человечество не может обходиться без средств гигиены полости рта. И тысячу, и две тысячи лет назад у людей застревала пища между зубов, она накапливалась, разлагалась, давила на подлежащие ткани, вызываю неудобство и боль. Вполне, естественно, что человек стремился избавиться от мучающих его неудобств. Поэтому он взял первый, попавшийся под руку заостренный осколок кости и стал им ковырятъ между зубами. Позднее он уже специально подбирал веточки деревьев, затачивал их с одного конца и разжевывал с другого, это он делал уже осознанно, с тем, чтобы прочистить пространство между зубами, очистить их поверхности и освежить ротовое дыхание за счет фитонцидных свойств используемых деревьев и кустарников.
Цивилизация и прогресс дали мощный толчок к развитию промышленного производства индивидуальных средств гигиены полости рта. Теперь и в России мы можем найти основные средства индивидуальной гигиены полости рта, пусть далеко не все, но достаточное количество, чтобы проводить тщательную, качественную, постоянную и повсеместную индивидуальную гигиену полости рта. Однако, как мы видим по основной массе наших пациентов, этого не происходит. Одни чистят зубы один раз в день, используя полустершуюся зубную щетку годами, как у меня был пациент, который использовал одну и ту же мануальную щетку в течение 5 лет. Невероятно, но факт. Другие чистят зубы для блеска. Немало ситуаций, когда одной и той же мануальной зубной щеткой пользуется вся семья, причем далеко не всегда прослеживается корреляция с уровнем достатка.
Подобных ситуаций мы видим каждый день достаточно много, но уже из написанного вырисовывается достаточно четкая картина: с одной стороны, несоблюдение правил индивидуальной оральной гигиены; с другой стороны, неумение и незнание методов чистки зубов, языка и всей полости рта; что, в конечном итоге, приводит к накоплению и росту зубных отложений и, как следствие этого, развитию всех видов патологии в полости рта.
Безусловно, это упущение, как средств массовой информации, так и стоматологов, в отсутствии надлежащей и постоянной информации населения страны по индивидуальной гигиене полости рта. С другой стороны, сами врачи-стоматологи должны четко представлять себе, как и какими средствами индивидуальной гигиены полости рта следует пользоваться в зависимости от стоматологического статуса их пациентов.
Гигиена полости рта включает в себя комплекс общих и местных мероприятий, направленных на сохранение зубов, пародонта, слизистой оболочки рта в здоровом состоянии, обеспечение полноценных функций жевания, глотания, речи и др. К загрязнению полости рта (образованию зубного налета и зубной бляшки, скоплению пищевых остатков в межзубных промежутках, кариозных полостях, размножению патогенных микроорганизмов и т. д.) могут привести: общие заболевания организма (лихорадочные состояния, болезни желудочно-кишечных тракта, печени, гиповитаминозы и т. д.), зубные болезни, нарушение слюноотделения и изменение состава слюны, отсутствие аппетита, плохое пережевывание пищи, ротовое дыхание, преимущественное употребление мягкой пищи и др.
Роль гигиены полости рта в профилактике и лечении стоматологических заболеваний велика, так как поддержание здорового состояния полости рта. начатое с раннего детства (с 2 лет), снижает частоту возникновения кариеса, заболеваний десен и другой патологии полости рта. Своевременное удаление зубного налета препятствует образованию зубной бляшки, что улучшает контакт чистой поверхности зуба со слюной, повышает обмен минеральных веществ в зубе, усиливает созревание и обызвествление зубов, формируя устойчивость зубов к кариесу. Удаление зубного налета устраняет условия возникновения воспаления слизистой оболочки рта, предупреждая развитие гингивитов и пародонтоза. Высокий уровень гигиены полости рта в процессе лечения кариеса и пародонтоза ускоряет достижение результатов лечения и закрепляет их.
Гигиеническое состояние полости — рта достигается с помощью индивидуальных гигиенических мероприятий (полоскание и чистка зубов щеткой, уход за ортодонтическими аппаратами и зубными протезами) и врачебных оздоровительных мероприятий, включающих санацию полости рта и профессиональную гигиеническую обработку полости рта.
Для оценки гигиенического состояния полости рта используются различные индексы. Для определения качества ухода за полостью рта применяют окраску вестибулярной поверхности шести нижних передних зубов йод-йодисто-калиевый раствором, при которой неочищенная поверхность зубов приобретает коричневый цвет. Количественная оценка производится по пятибалльной системе. В норме гигиенический индекс не превышает 1,1—1,3 балла. С помощью рекомендуемого гигиенического индекса можно оценить качество очистки зубов той или иной пастой, очищающее действие различных гигиенических средств, а также индивидуальную степень и качество очистки зубов.
Индивидуальные гигиенические мероприятия осуществляются с помощью средств личной гигиены (зубные пасты, эликсиры и зубные порошки), которые по составу и целевому назначению могут быть разделены на гигиенические, лечебно-профилактические и лечебные. Очищение зубов пастами производят с помощью зубных щеток. Лицам, пользующими несъемными протезами, необходимо более продолжительное и тщательное очищение зубов и верх поверхностей зубного протеза. Рекомендуется чистить зубы два раза в день — утром и вечером. После каждого приема пищи рекомендуется полоскать рот кипяченой водой и промывать ортодонтические аппараты и съемные протезы под струей воды. Для этой же цели могут быть использованы зубные эликсиры.
Профессиональная гигиеническая обработка полости рта проводится по медицинским показаниям в стоматологическом кабинете или в комнате гигиены полости рта в муниципальной поликлинике, частном стоматологической клинике, школе, детском садике и др. Перед обработкой определяют гигиенический индекс. Затем специальными инструментами, щетками, резиновыми конусами и кругами, а также специальной или шелковой нитью тщательно удаляют зубной камень, зубные бляшки и мягкий налет со всех поверхностей зуба. После профессиональной обработки проводят сеанс противовоспалительной (при воспалении десен) или реминерализующей терапии (при кариесе).
Массовые обследования населения, проведенные в последние годы во всех странах мира, убедительно показали, что гигиена полости рта имеет несомненное профилактическое значение. Во всех случаях при обследовании было установлено, что кариес зубов и заболевания пародонта у лиц, регулярно чистящих зубы, встречались существенно реже. Кроме того, было показано, что гигиена полости рта не только ведет к предупреждению стоматологических заболеваний, но и способствует снижению некоторых общих болезней. Так, при обследовании группы рабочих было установлено, что при регулярном уходе за полостью рта в 2 раза реже обостряются хронические тонзиллиты. Имеются и другие свидетельства о профилактической роли гигиены полости рта, в том числе о влиянии качества ухода за зубами на состояние зубов и пародонта. При обследовании группы детей 7—14 лет установлено, что при хорошем (индекс гигиены 1—1,1 балла) и удовлетворительном (1,2—2,0 балла) гигиеническом состоянии полости рта число кариозных зубов было на 0,9—1,9 меньше, чем при плохом гигиеническом статусе (индекс гигиены более 2,1 балла) (Ю. А. Федоров, В. А. Дрожжина, 1993).
При обследовании большой группы школьников в возрасте 8—16 лет установлено, что при хорошем гигиеническом состоянии полости рта (индекс гигиены 1—1,5 балла) лишь у 5,7% детей выявлены гингивиты, а при плохом уходе за зубами количество выявленных гингивитов достигало 60% (Федоров Ю. А., 1979).
Вместе с тем вопрос о роли гигиены полости рта в профилактике стоматологических заболеваний нуждается в более детальном изучении.
Что касается, педагогов и воспитателей школ и детских садов, то необходимо ввести новые критерии оценки их деятельности в этой области, которые бы также стимулировались материально. Следует, по-видимому, организовать контроль за этой работой со стороны врачей муниципальных центром профилактики, СЭС, для чего необходимо дать им вполне конкретные полномочия и права, регулирующие уровень гигиенических мероприятий в дошкольных учреждениях и школах. Активное взаимодействие врачей-стоматологов, гигиенистов стоматологических, педагогов и врачей СЭС должно поднять уровень гигиенического воспитания населения, улучшить гигиеническое воспитание, стоматологическое просвещение, направленные на профилактику стоматологических и общих заболеваний.
Глава 2. Поверхностные образования на зубах, зубные отложения и методы их выявления
1. Поверхностные образования на зубах и зубные отложения: кутикула, пелликула, зубной налет, зубной камень
На поверхности зуба имеются кутикула, пелликула, а также зубной налет и зубной камень (при неудовлетворительной гигиене полости рта).
Кутикула, или редуцированный эпителий эмалевого органа, теряется вскоре после прорезывания, поэтому существенной роли в физиологии зуба не играет. Это образование, выявленное, в основном, в подповерхностном слое эмали, местами выходит на поверхность в виде микроскопической пленки. В некоторых местах кутикула в виде трубочки доходит до эмалево-дентинного соединения.
Пелликула (приобретенная кутикула) образуется из гликопротеидов слюны на поверхности зуба после его прорезывания. Если зуб контактирует со слюной, то при снятии пелликулы абразивом происходит ее быстрое восстановление. Пелликула является бесструктурным образованием, плотно фиксированным на поверхности зуба, и играет важную роль в избирательном прикреплении бактерий.
От состояния пелликулы зависят процессы диффузии и проницаемости в поверхностном слое эмали. В определенной степени эта оболочка защищает целостность структуры эмали, однако большое количество пелликулы не является показателем резистентности эмали.
Над пелликулой можно обнаружить зубной налет — плотное образование, состоящее из бактерий, расположенных внутри матрицы, которая образуется за счет белков, полисахаридов, липидов и некоторых неорганических веществ (кальция, фосфатов, магния, калия, натрия и др.)
Зубной налет прикреплен к поверхности зуба менее плотно, чем пелликула, в то же время, в отличие от пищевых остатков, его нельзя удалить простым полосканием. Зубной налет начинает накапливаться вскоре после чистки зубов, он образуется путем адсорбции микроорганизмов на поверхности эмали и растет за счет постоянного наслаивания новых бактерий, причем в определенной последовательности: вначале кокковая флора, а затем палочковидные и нитевидные бактерии. По мере роста налета и увеличения его толщины начинают преобладать анаэробные формы бактерий.
Налет обладает пористой структурой, что позволяет углеводам свободно проникать в его глубокие слои. При приеме мягкой пищи и употреблении значительного количества легкоферментируемых углеводов происходит его значительный и быстрый рост.
Чаще всего зубной налет располагается над десной, в пришеечной области, в фиссурах, причем у входа в фиссуры скапливается больше микроорганизмов, чем в глубине.
На 80—85% зубной налет состоит из воды. Что касается минеральных компонентов, то преобладают кальций, общие и неорганические фосфаты, фториды. Кальций в налете может быть связан с бактериями, внеклеточными белками или фосфатами, которые, в свою очередь, могут существовать в виде неорганического ортофосфата или органических соединений. Фторид в низких концентрациях присутствует в жидкости налета и в высоких — в цельном налете. Хотя механизм связывания фторида в налете окончательно не выяснен, существуют предположения, что происходит накопление иона внутри бактерий и образование внеклеточных комплексов с кальцием. Водная фаза (жидкость налета), составляющая 25—35% общего объема, располагается внеклеточно и является «средой инкубации» бактерий.
Зубной налет может быть белого, зеленого и коричневого цвета.
Мягкий белый зубной налет, видимый без окрашивания специальными растворами, накапливается преимущественно в период покоя речевого и жевательного аппарата и при отсутствии надлежащей гигиены полости рта. Этот вид зубного налета может являться причиной запаха изо рта, извращения вкусовых ощущений, а также служить центром минерализации при образовании зубного камня.
Зеленый зубной налет, чаще наблюдаемый у детей и молодых пациентов, располагается тонким слоем на губных поверхностях, преимущественно, фронтальных зубов. Появление этого налета связано с жизнедеятельностью хромогенных микроорганизмов, содержащих хлорофилл.
Коричневый зубной налет чаще встречается у курильщиков, а его цвет зависит от никотина и интенсивности курения. Он с трудом поддается очищению с помощью зубных щеток и паст, поэтому для его удаления зубы следует обрабатывать жесткими щетками и специальными мелкодисперсными пастами.
Коричневый зубной налет может встречаться и у некурящих за счет большого количества пломб из медной амальгамы, а также у лиц, работающих над изготовлением медных, латунных и бронзовых изделий. У детей налет такого цвета чаще образуется на молочных зубах при выделении со слюной большого количества невосстановленного железа, которое, соединяясь в полости рта с серой из распадающихся белковых веществ, и обуславливает окрашивание.
Кальцификация зубного налета приводит к образованию зубного камня, твердых отложений различной консистенции и окраски. Кристаллы фосфата кальция, которые откладываются внутри налета, могут быть тесно связаны с поверхностью эмали. Иногда, особенно при наличии деминерализации, трудно определить, где кончается эмаль и начинается камень. Для образования наддесневого зубного камня используются, в основном, минералы, поступающие из слюны, поддесневого камня — из десневой жидкости. Органическая часть камня представляет собой белково-полисахаридный комплекс, включающий клетки эпителия, лейкоциты, микроорганизмы, остатки пищи.
Отложение камня, иногда значительной толщины, происходит как в поддесневой, так и в наддесневой области. Кальцификация начинается в зубном налете, который присутствует на зубах, по крайней мере, несколько дней.
Наддесневой зубной камень чаще всего локализуется в области нижних фронтальных зубов и щечных поверхностей верхних моляров, где открываются протоки слюнных желез. При отсутствии гигиенического ухода образование камня происходит на зубах, не участвующих в акте жевания. Цвет камня (белый, желтый, коричневый) зависит от воздействия пищевых продуктов, никотина, а также окислов железа, меди и других веществ.
Поддесневой зубной камень выявляется лишь при зондировании. Обычно он темно-коричневого цвета с зеленоватым оттенком, формируется на шейке зуба в пределах десневой бороздки, на цементе корня, в пародонтальном кармане. Камень охватывает шейку зуба, часто образуя выступы, и плотно прикреплен к подлежащей поверхности.
Если у пациента образуется значительное количество зубного камня, то это может быть следствием снижения концентрации пирофосфата, ингибитора образования зубного камня или отсутствия специфического белка слюны, предотвращающего преципитацию фосфата кальция и рост кристаллов.
2. Биохимические процессы в зубном налете
Профилактика заболеваний человека является основой российской медицины.
За последние годы медицинская наука, в частности стоматология, достигла значительных успехов в профилактике ряда заболеваний, а также в ликвидации ряда из них. Стоматология как самый массовый вид медицинской помощи особенно нуждается в постоянном совершенствовании профилактических мероприятий.
Основной особенностью профилактики стоматологических заболеваний является то, что она строится на эпидемиологических исследованиях, скрининге, достижениях современной науки, комплексности, массовости. Особо выделяются мероприятия, направленные на предупреждение кариеса зубов как самой распространенной патологии человека. Профилактика кариеса зубов является общегосударственной социальной проблемой. Ввиду тесной взаимосвязи зубов с внутренними органами и системами организма профилактика кариеса — это предупреждение болезней не только зубов, но и сердечнососудистой системы, желудочно-кишечного тракта, почек, суставов. Поэтому врачу-стоматологу нужно хорошо знать внутренние болезни, педиатрию, общую гигиену, чтобы правильно организовать и проводить профилактические мероприятия.
Государство ассигнует огромные средства для проведения профилактики стоматологических заболеваний. В предупреждении кариеса зубов достигнуты определенные успехи. Но, к сожалению, в некоторых лечебных учреждениях уделяют еще недостаточно внимания профилактической работе, проводят ее кампаниями, несистематически. Не используются огромные возможности стоматологической диспансеризации.
Профилактику нельзя проводить периодами, она должна быть непрерывной. Необходимо строго соблюдать организационные основы. После санации полости рта нужно применять профилактические средства, специальные диеты, проводить динамическое наблюдение над контингентами населения. Опыт показывает, что там, где строго соблюдается такая система, имеются большие достижения в предупреждении кариеса зубов, устранен осложненный кариес, уменьшена частота одонтогенных воспалительных процессов.
Нередко стоматологи сводят профилактику к санации полости рта и не применяют всего комплекса профилактических мероприятий; закончив санацию, не осуществляют контроль проведенной работы; нерегулярно применяют гигиенические профилактические средства.
Профилактика должна занимать ведущее место в работе стоматологических учреждений, в учебных заведениях при чтении курсов стоматологии.
По мнению В.С.Иванова (2001) наибольшее значение имеют четыре вида назубных образований:
1) из неминерализованных отложений зубная бляшка и мягкий зубной налет;
2) из минерализованных — наддесневой и поддесневой зубные камни.
На поверхности зубов человека также имеются кутикула, представляющая собой редуцированный эпителий эмалевого органа, который исчезает после полного прорезывания зуба, и пелликула (приобретенная кутикула), являющаяся бесструктурным образованием, производным гликопротеидов слюны и десневой жидкости, избирательно адсорбирующихся на поверхности эмали за счет электростатического притяжения между отрицательно заряженными гидроксиаппатитами эмали зуба и положительно заряженными макромолекулами десневой жидкости и слюны J.Pratten, 2000; L.A.Christersson (1992). Пелликула защищает целостность структуры эмали зуба, являясь биологическим защитным барьером (В.Л.Быков, 1999), и участвует в образовании зубного налета, создавая условия для колонизации микроорганизмов на поверхности эмали S.E.Mergenhagen (1987). Под действием различных агентов, в том числе табачных смол, может происходить окрашивание пелликулы Э.М.Кузьмина (2005).
Зубная бляшка представляет собой структурированное скопление бактерий, плотно фиксированных на поверхности зуба. Бляшка является мягким, прозрачным, клейким материалом, практически полностью состоящим из бактерий и продуктов их жизнедеятельности H.Marcotte, MC.Lavoie, 1998; K.P.Mintz, P.M.Fives-Taylor (1994).
В отечественной и зарубежной литературе длительно не удаляющуюся с поверхности зубов зубную бляшку называют мягким зубным налетом. Э. Хельвиг, Й. Климек, Т. Аттин (1999) не разделяют термины «зубная бляшка» и «зубной налет» и характеризуют это образование, как структурированный вязкий, войлокообразный налет на зубе, состоящий из компонентов слюны, бактериальных продуктов обмена веществ, остатков пищи и клеток бактерий. Пигментацию зубов у курильщиков следует рассматривать как экзогенное, поверхностное (или глубокое) окрашивание. Наиболее характерно образование темно-коричневого, почти черного налета вдоль шеек зубов, а также на тех поверхностях, которые не участвуют в жевании и плохо очищаются. Может отмечаться также пигментация по периметру пломб, вкладок и вдоль трещин зуба Луцкая И. К. и соавт. (2000); Соловьева A.M. (2002), М.Д.Перова (2002), рассматривая функциональную взаимозависимость данных образований, указывает на то, что налет курильщика, с одной стороны, способен фиксировать на себе мягкий зубной налет, с другой — повреждает звено неспецифической защиты системы иммунитета.
Доказано, что субстанции сигаретного дыма ослабляют основные функции полиморфноядерных лейкоцитов — хемотаксис, фагоцитоз, — а также окислительную антимикробную функцию этих клеток (за счет ингибирования продукции супероксидных анионов и перекиси водорода).
У курильщиков формируется темно-коричневый, почти черный налет. Он обычно располагается на тех же поверхностях зубов, что и у некурящих, т.е. не участвующих в акте жевания и плохо поддающихся мануальной чистке. Также областями более интенсивного скопления налета курильщика являются те участки полости рта, которые в большей степени подвержены воздействию табачного дыма, а именно оральная поверхность зубов. R.Z. LeGeros et al, 1988; И.Г.Лукомский (1960). Налет курильщика специфичен, его коричневая или черная окраска вызвана пигментацией никотином и зависит от интенсивности курения. Он с трудом поддается очищению с помощью традиционных методик чистки зубов зубными щетками и пастами, поэтому для его удаления требуется обработка зубов жесткими щетками и специальными мелкодисперсными пастами.
Образованию большего количества так называемого «налета курильщиков» способствует несоблюдение гигиены полости рта Л. Гринволл (2003).
Согласно МКБ-10 к изменению цвета зубов может приводить курение, а также употребление в пищу напитков и продуктов питания, содержащих красящие агенты (КОЗ.61), отложения на зубах, обусловленные привычкой употреблять табак. Изменение цвета зубов также носит название дисколорит (термин введен в отечественную литературу М.И.Грошиковым).
Так называемый налет курильщика относят к временным изменениям цвета зубов, и он может быть удален с поверхности эмали различными методами. «Налет курильщика» относится к факторам, влияющим на изменение цвета зубов, как микробный налет, который образуется в результате нарушения правил гигиенического ухода за полостью рта в сочетании с курением. «Налет курильщика» имеет большую плотность, чем зубной налет у некурящих И.М.Макеева (2003).
Минерализация зубной бляшки приводит к образованию зубного камня различной консистенции, окраски и степени прочности связи с тканями зуба. Скорость аккумуляции и кальцификации зубных отложений индивидуальны у каждого человека. А.В.Цимбалистов, Г.В.Шторина, Е.С.Михайлова (2002) отмечают возникновение первых признаков минерализации зубной бляшки в среднем через 38 часов после начала ее формирования. Первые очаги минерализации на внутренней поверхности микробной бляшки также были обнаружены уже через 4—8 часов после ее образования, а полноценный зубной камень формируется на 14-й день H.R.Muhlemann (1964). Источником минералов для образования наддесневого зубного камня служит слюна, для образования поддесневого зубного камня — десневая жидкость, образующаяся из сыворотки крови. Поддесневой зубной камень имеет большую плотность и твердость, чем наддесневой Л.М.Лукиных (2003).
Из-за того, что поверхность зубного камня представляет собой твердую структуру с большим количеством мелких выемок, к которым прикрепляются микроорганизмы, он должен удаляться I.D.Mandel, A.Gaffar, 1986; J.Lindhe, S. Nyman (1985).
Сразу после прорезывания зуб покрыт кутикулой и клеточными компонентами редуцированного эмалевого эпителия. Затем эмаль покрывается бесструктурными образованиями. Различают следующие образования: первичную эмалевую кутикулу (подповерхностная и поверхностная) и пелликулу.
Пелликула — производное слюны, состоит из аминокислот и сахаров, из которых образуются полисахариды. Существует мнение, что пелликула образуется на кристаллах гидроксиапатитов. Роль пелликулы неоднозначна: с одной стороны, она выполняет защитную функцию, предохраняя кристаллы эмали от действия кислот, поступающих в полость рта, с другой — способствует прикреплению микроорганизмов и образованию их колоний — зубной бляшки.
Образование налета происходит в определенной последовательности:
1) прикрепление бактерий к пелликуле;
2) образование внеклеточной структуры (матрикса);
3) рост бактерий и образование зубной бляшки.
Существуют различные механизмы прикрепления бактерий в пелликуле. Этому процессу уделяют большое внимание, так как уменьшение фиксации бактерий позволяет снизить кариесогенный потенциал налета на поверхности зуба.
Silvestone указывает на наличие следующих этапов в процессе прикрепления бактерий к пелликуле:
1. адсорбция микромолекул;
2. химическое прикрепление мобильных бактерий;
3. обратимая фиксация бактерий на поверхности;
4. необратимая их фиксация;
5. развитие вторичной микрофлоры.
Образование внеклеточной структуры (матрикса) обусловлено деятельностью микроорганизмов. Матрикс состоит из двух компонентов: белков (преимущественно производных гликопротеинов слюны) и бактериальных экстрацеллюлярных полисахаридов (в основном полимеры углеводов). Белковый компонент образуется за счет осаждения из слюны сиаловых кислот под воздействием ферментов, вырабатываемых микроорганизмами.
При изучении углеводного состава зубной бляшки установлено, что растворимая фракция сухой части налета содержит 6,9%, а нерастворимая — 11,3% углеводов.
Налет быстро образуется при употреблении мягкой пищи, особенно при наличии в пище сахарозы.
Клеточные элементы налета вместе с внеклеточными образованиями создают пористую структуру, что обеспечивает проникновение внутрь слюны и жидких компонентов пищи. Однако накопление в налете конечных продуктов жизнедеятельности микроорганизмов замедляет диффузию, особенно при обильном поступлении углеводов с пищей, так как закрываются межклеточные пространства в нем. В результате этого и происходит накопление органических кислот (молочная, пировиноградная и др.) на ограниченном участке поверхности зуба.
В зубном налете содержатся бактерии — стрептококки, в частности Str. mutans, Str. sanguis и Str. salivarius, для которых характерно анаэробное брожение. В этом процессе субстратом для бактерий в основном являются углеводы, а для отдельных штаммов — аминокислоты. Сахароза — дисахарид, состоящий из фруктозы и глюкозы, которому принадлежит ведущая роль в возникновении кариеса.
Процессы брожения в зубном налете и их активность зависят от количества вовлекаемых углеводов. Наиболее быстро рН снижается при брожении Сахаров (от 6 до 4 в течение нескольких минут), а возвращение к прежнему значению рН (кривая Стефана) происходит медленно. В зубном налете, кроме молочной кислоты, содержатся муравьиная, масляная, пропионовая и другие органические кислоты.
При рассмотрении возможности локального изменения рН на поверхности эмали под зубной бляшкой всегда возникает вопрос о роли буферной емкости слюны. Почему слюна, обладая карбонатной, фосфорной и белковой буферными системами, не оказывает нейтрализующего влияния? Недостаточная нейтрализация образующейся в налете кислоты объясняется ограничением диффузии нейтрализующих соединений, например, кальция, в налет и ограничением диффузии кислотных продуктов из него.
Бактерии, как и другие клетки, содержат биополимеры (нуклеиновые кислоты, белки, полисахариды, липиды и др.), необходимые для их жизни.
Как уже отмечалось, в зубной бляшке преобладают анаэробные бактерии, которые вырабатывают значительное количество ферментов анаэробного гликолиза. В процессе своего роста большинство молочнокислых бактерий, сбраживающих сахара, продуцирует до 90% молочной кислоты. Другие микроорганизмы продуцируют молочной кислоты меньше. Особенно интенсивно происходит процесс гликолиза в присутствии углеводов в период уменьшенного слюноотделения (во время сна). Установлено, что наличие и активность брожения в налете во многом зависят от количества доступных углеводов. Как указывалось, ранее, в присутствии углеводов в зубном налете быстро и значительно снижается рН, затем его значение медленно восстанавливается до нормального уровня.
Низкомолекулярные вещества (сорбит, маннит, ксилит) проникают в зубную бляшку, однако вследствие малой активности фермента, превращающего их во фруктозу, молочная кислота образуется в небольшом количестве. Поэтому не происходит выраженного снижения рН. Крахмал также является «некариесогенным» углеводом, так как молекулы крахмала не способны проникать в зубной налет. Но главное заключается в том, что процессу брожения в этом случае должен предшествовать процесс гидролиза крахмала с образованием глюкозы или мальтозы.
Бактерии зубной бляшки обладают способностью производить внутриклеточные полимеры и накапливать их. Накопление происходит при избытке энергии (в форме углеводов), а расщепление и утилизация резервных веществ в клетках — при недостаточности экзогенных источников для поддержания жизнедеятельности и роста.
Важная роль в развитии кариеса зубов принадлежит образованию микроорганизмами внеклеточных гетерополисахаридов — биополимеров, содержащих различные углеводы (гликаны, леваны, декстраны). Гликаны, обеспечивая слипание бактерий друг с другом и с поверхностью зуба, активно влияют на возникновение кариеса. Установлено, что снижение содержания гликанов ведет к уменьшению кариеса. Продуцирование гликана обусловливает рост (утолщение) зубного налета. Декстран, образующийся из сахарозы при участии декстраназы, является резервным полисахаридом. В процессе расщепления и утилизации декстрана микроорганизмами образуются органические кислоты, которые и оказывают деминерализующее влияние на эмаль зуба. Леван — биополимер, образующийся из сахарозы при участии левансахаразы. При расщеплении левана также образуются органические кислоты, однако леван в большей степени используется микроорганизмами зубной бляшки в качестве источника энергии.
Мягкий зубной налет у большинства людей содержит одни и те же основные виды микроорганизмов, которые представлены в различных пропорциях. При этом на долю стрептококков (mutans, sangvis, mitis, salivarius, faecalis), этиологическая роль которых доказана, приходится более 50% микроорганизмов бляшки. Наибольшей кариесогенностью обладает Streptococcus mutans, образующий характерные колонии, продуцирующий молочную кислоту только из глюкозы, расщепляющий маннит и сорбит, образующий из сахарозы глюкан (Edvardson P., 1968; Guggenheim В., 1968, и др.).
Мягкий зубной налет содержит много эпителиальных клеток, лейкоцитов и макрофагов; со временем он пропитывается минеральными веществами, главным образом кальцием и фосфором. По мере утолщения и «созревания» в пористой и проницаемой для слюны «молодой» зубной бляшке создаются анаэробные условия, в силу чего изменяется ее микробный состав. В зубной бляшке трехмесячного возраста заметно уменьшается удельный вес кариесогенных стрептококков.
Образование мягкого зубного налета в немалой степени связано с утилизацией бактериями остатков пищи, задерживающихся на поверхности зубов. В наибольшей мере бактериями используются вещества, легко диффундирующие в бляшку: сахароза, глюкоза, фруктоза, мальтоза, лактоза.
Особая роль придается декстрану, так как наряду с выраженными адгезивными свойствами, столь важными для фиксации и роста зубной бляшки, этот полисахарид плохо растворим и весьма устойчив в присутствии микроорганизмов (Fitzgerald L., Jordan H., 1968). Добавление в пищу сахарозы приводит к ускорению образования зубной бляшки и оказывает влияние на состав ее флоры.
В последние годы все большее внимание уделяется изучению нормальной микрофлоры человека. Это в значительной мере объясняется значением симбионтных отношений организма человека и микробов в регуляции жизненно важных функций организма человека, а также актуальностью для практического здравоохранения патологических состояний и заболеваний, в развитии которых принимают участие многие представители нормальной и резидентной микрофлоры.
Бактерии, вирусы, грибы и простейшие, населяющие полость рта, в этом плане не являются исключением. Полость рта, ее слизистая оболочка и лимфоидный аппарат челюстно-лицевой области играют уникальную роль во взаимодействии организма человека с окружающим его миром микробов. В процессе эволюции между человеком и микроорганизмами полости рта сформировались сложные многокомпонентные и противоречивые отношения. Микробы способствуют перевариванию пищи и синтезу витаминов и в то же время продуцируют органические кислоты, способствующие развитию кариеса; они оказывают мощное позитивное модулирующее действие на иммунную систему организма и в то же время обеспечивают накопление в зубной бляшке адьювантов и иммуносупрессивных агентов, оказывающих токсическое воздействие на ткани десны и периодонт, наконец, они являются сильнейшими антагонистами патогенной флоры, и в то же время сами способны к инвазии с последующим развитием серьезных заболеваний.
Доминирующее место как по разнообразию обитающей в полости рта видов, так и по количеству занимают бактерии. Поданным различных исследователей, число видов бактерий в этой экологической нише организма человека составляет от 120 до 200. количество бактерий в полости рта по числу видов и по содержанию в единице материала конкурирует с желудочно-кишечным трактом. Содержание микроорганизмов в слюне (ротовой жидкости) составляет от 4 млн. до 5 млрд. в мл, в зубном налете (бляшке) — от 10 до 1000 млрд. в грамме материала.
Полость рта, как экологическую нишу, можно разделить на несколько более мелких, недостаточно отличных друг от друга биотопов:
1 — слизистая оболочка полости рта;
2 — протоки слюнных желез с находящейся в них слюной;
3 — десневая жидкость и зона десневого желобка;
4 — ротовая жидкость;
5 — зубная бляшка.
Физико-химические особенности каждого биотопа — рН среды, вязкость, температура, наличие органических соединений и остатков пищи, парциальное давление газов — обеспечивают существенные различия в составе микробиоценоза каждого из перечисленных биотопов.
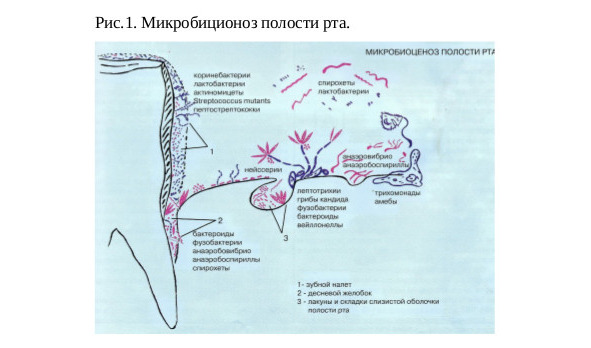
Слизистая оболочка полости рта — наиболее обширный по площади и разнообразный по условиям обитания биотоп. Поэтому микрофлора слизистой существенно варьирует в разных участках. На поверхности слизистой оболочки вегетируют преимущественно грамнегативная анаэробная и факультативно-анаэробная флора, а так же микроаэрофильные стрептококки.
В подъязычной области, на внутренней поверхности щек, в складках и криптах слизистой оболочки полости рта обычно преобладают олигатно-анаэробные виды: вейллонеллы, пептострептококки, лактобактерии, а также стрептококки (S. mitis). Другие микроаэрофильные стрептококки (S.salivarius) обычно колонизируют спинку языка.
На слизистой твердого и мягкого неба, небных дужках, миндалинах в большом количестве встречаются разнообразные стрептококки, коринебактерии, нейссерии, гемафиллы и псевдомонады, а также дрожжеподобные грибы и нокардии.
Протоки слюнных желез и слюна — один из наименее слабо изученных биотопов полости рта.
По данным одних исследователей, из-за высокой бактерицидной активности ферментов, лизоцима, секреторных иммуноглобулинов и других факторов специфической и неспецифической защиты слюна в протоках здорового человека должна быть практически стерильной. Другие допускают наличие незначительного количества бактерий, преимущественно относящихся к облигатно-анаэробным видам (вейллонеллы).
Десневая жидкость и десневой желобок. Десневая жидкость представляет собой транссудат, который секретируется в области десневого желобка и практически сразу контаминируется микрофлорой слизистой оболочки десны и ротовой жидкости. В данном биотопе преобладают нитевидные и извитые облигатно-анаэробные виды бактерий: фузабактерии, лептотрихии, актиномицеты, спириллы, анаэровибрии, кампилобактерии и спирохеты. Это основное место обитания представителей родов группы бактероидов Bacteroides, Porphyromonas, Prevotella. Здесь также встречаются простейшие, дрожжеподобные грибы и микоплазмы.
Концентрация перечисленных микроорганизмов в десневой жидкости резко увеличивается при формировании патологического десневого кармана при пародонтите (пародонтального кармана). Задержка пищи, детрита в кармане, нарушение циркуляции жидкости ведут к резкому падению редокс-потенциала и создают оптимальные условия для размножения разнообразной облигатно-анаэробной флоры, включая Porphyromonas gingivalis, Prevotella mela ninogenica, других представителей группы бактероидов, токсическим факторам которых отводят решающую роль в прогрессировании воспалительного процесса в пародонте.
Ротовая жидкость представляет собой важнейший биотоп полости рта, так как через нее осуществляется взаимодействие между другими частями микробисценоза полости рта и реализуются различные регуляторные воздействия со стороны макроорганизм. Основой ротовой жидкости является слюна, секретируемая из протоков слюнных желез, которая заселяется разнообразной микрофлорой.
В ротовую жидкость постоянно поступают микробы, размножающиеся на слизистой полости рта, в десневом желобке, карманах, складках и в зубной бляшке. В ротовой жидкости они длительно сохраняют жизнеспособность, а многие виды (в частности, не имеющие факторов адгезии к слизистой или эмали) активно размножаются. Это касается, по-видимому, и подвижных форм — вибрионов, селеномонад, спирохет и спирилл.
В ротовой жидкости в значительном количестве содержатся вейллонеллы, микроаэрофильные стрептококки S.salivarius, факультативно-анаэробные стрептококки, аэрококки и микоплазма.
Зубная бляшка представляет собой наиболее сложный и многокомпонентный биотоп, формирующийся на поверхности зуба. В составе зубной бляшки и определяются практически все представители микробной флоры полости рта. Однако их количество существенно варьирует у разных людей и в разные периоды их жизни.
Своеобразие этого биотопа заключается в том, что он в значительной степени является результатам жизнедеятельности различных микроорганизмов орального биоценоза.
Однако в его формировании несомненна определяющая роль макроорганизма и экологических факторов, оказывающих на него влияние в течение жизни (диета, образ жизни, профессиональные вредности и т.п.).
Количественные и качественные нарушения в составе симбионтов данного биотопа, нарушения их взаимодействия с макроорганизмом играют решающее значение в возникновении таких важнейших нозологических форм, как кариес зубов и пародонтит.
Зубная бляшка начинает образовываться уже через 1—2 часа после чистки зубов, причем в динамике ее формирования происходят значительные изменения характера микробиоценоза. Общей тенденцией является изменение состава флоры от доминирования аэробных и факультативно-анаэробных форм, преимущественно кокков, к облигатно-анаэробным грамнегативным палочкам и извитым формам.
1-я фаза формирования зубной бляшки — первые 2—4 часа после тщательной чистки зубов. Она преимущественно состоит из кокков (стрептококки, нейссерии и стафилококки) и коротких палочек (лактобактерии). Это так называемая «ранняя» зубная бляшка.
2-я фаза — от 4—5 дней. Характеризуется уменьшением доли грампозитивных кокков и превалированием грамвариабельных нитевидных форм — лептотрихий, а также фузобактерий.
3-я фаза — от 6—7 дней и далее. Зубная бляшка принимает окончательный по составу симбионтов вид, хотя количественные сдвиги в ней происходят постоянно. Резко снижается количество аэробных видов — нейссерий, ротий, факультативно-анаэробных стрептококков. Доминируют грамнегативные облигатно-анаэробные бактерии ~ бактероиды, фузобактерий, вейллонеллы и грампозитивные — актиномицеты, микроаэрофильные стрептококки и пептострептококки.
Общее количество бактерий в зубной бляшке увеличивается от 90—100 в 1-ой фазе формирования до 1—10 млн. во 2-ой фазе. В 3-ей фазе формирования, в зависимости от многих факторов, количество бактерий исчисляется десятками и сотнями миллиардов в 1 г.
Установлено, что микробы обладают разной аффинностью даже в отношении различных поверхностей зуба. Кроме того, на процесс адгезии влияют и механические факторы, связанные с процессом жевания, физико-химические условия и т. п. Поэтому на разных поверхностях зубов, в ямках и фиссурах. состав микрофлоры несколько отличается даже в пределах одного зуба.
Зубная бляшка формируется также и на поверхности пломб, причем состав ее несколько отличается и зависит от характера и качества пломбировочного материала.
Эти данные имеют важное практическое значение в связи с тем, что состояние зубной бляшки, как известно, является ключевым механизмом возникновения и развития кариеса зубов.
В настоящее время установлено, что в полости рта обитает свыше 90 видов микроорганизмов, среди которых преобладают стрептококки и анаэробные палочки. Количество микроорганизмов в полости рта находится в состоянии определенного взаимодействия с антибактериальными факторами слюны, представляющими собой иммуноглобулины, антимикробные ферменты, а также эндогенные низкомолекулярные бактериостатические вещества.
Главным местом обитания микроорганизмов в полости рта являются зубодесневые карманы, а также зубной налет и бактериальный налет на слизистых оболочках десны и других органов полости рта. Так, например, если в слюне (ротовой жидкости) содержится не более 5 млн. микроорганизмов на 1 мл, то в 1 мл содержимого зубодесневого кармана их содержится несколько миллиардов. Еще больше содержится микроорганизмов в зубном налете.
Lammers (1965), Bowden и соавт. (1975) обнаружили при кариесе дискабактериоз зубного налета за счет усиленного размножения гликолитических бактерий, особенно лактобацилл и стрептококков. Лактобациллы, обладая высоким ацидогенным потенциалом, по данным Hurdie (1976), способны продуцировать кислоту. В период наибольшей активности кариеса (прогрессирующая деминерализация) из зубного налета чаще изолируют лактобациллы (Hommens et al., 1946). В этот же период из зубного налета можно изолировать и другие виды микроорганизмов — стрептококки слюны, количество которых меньше, чем лактобацилл. Однако по данным Bibby и соавт. (1942), McKay (1976), Street и Goldner (1976), Street и соавт. (1976), они способны продуцировать в 3000 раз большие количества кислоты, чем лактобациллы. В период активного кариеса количество стрептококков не увеличивается, но повышается их ацидогенный потенциал.
Кариесогенные штаммы микроорганизмов становятся резистентными к антибиотикам и способны длительно существовать в глубине зубного налета и очагах кариозного поражения (Fitzgerald, Keyes, 1960; Grenby, 1975; Ashley, Wilson, 1977). При кариесе отмечено уникальное свойство стрептококков накапливать углеводы в виде полисахаридов (Heute, 1964), которые позже могут быть метаболизированы в молочную кислоту (Gibbons, Socransky; Hess, Graf, 1975; Theilade et al., 1976).
Положительный хемотаксис гранулоцитов вызывают анаэробные коринебактерии, кишечная палочка, стафилококки, грибы рода Candida, а также Actinomyces naeslundii (Garant, 1976).
Патогены микроорганизмов зубного налета обладают способностью стимулировать секрецию лизосомальных ферментов полиморфонуклеарами, причем это свойство прямо зависит от выраженности синтеза декстрана из сахарозы (McArthur, Taichman, 1976).
Бактериальные антигены зубного налета вызывают сенсибилизацию лимфоцитов и тем самым способствуют осуществлению реакции блаеттрансформации. В зубном налете обнаружено недиализируемое термостабильное вещество, которое усиливает действие митогенов на лимфоциты (Reed и соавт., 1976). Способностью активировать реакцию блаеттрансформации Т- и р-лимфоцитов обладают следующие микроорганизмы: Actinomyces viscosus, Actinomyces naeslundii, Str. mutans, Str. sanguis, Bacteroides melaninogenicus, Veillonella alcalescens, Leptotrichia buccalis, Lactobacillus acidophilus и ряд других. Микроорганизмы зубного налета в значительной степени стимулируют секрецию лимфокинов активизированными Т-лимфоцитами (Lehner и соавт., 1974).
Из зубного налета удалось выделить термостабильное высокомолекулярное вещество, способное оказывать прямой стимулирующий эффект на остеокласты (Hausmann, Wenfeld, 1973), которые, по-видимому, играют основную роль в развитии остеопороза и резорбции костной ткани пародонта (В. В. Паникаровский, А. С. Григорьян, 1976).
Факторы зубного налета оказывают стимулирующее действие на синтез гликозаминогликанов, а также синтез и выделение гиалуроновой кислоты, что может иметь значение в проявлении деминереализирующего эффекта бляшки (Larjana и соавт., 1982).
3. Бактерии — основной этиопатогенетический фактор и фактор риска заболеваний пародонта
О бактериях, как доминирующем факторе развития заболеваний пародонта, написаны сотни, а может даже тысячи статей. Практически во всех статьях речь идет о том, что при возникновении и развитии патологического процесса присутствуют микроорганизмы, к возникновению деструктивных изменений в пародонте причастны лишь некоторые, специфические пародонтопатогены или их масса как целое, наподобие зубному налету. В 1975 г. были опубликованы так называемые теории специфического и неспецифического налета, объясняющие роль зубного налета в возникновении кариеса зубов и заболеваний пародонта.
Согласно специфической теории болезни пародонта вызывают специфические бактерии- пародонтопатогены, содержащиеся в зубном налете. Согласно неспецифической теории заболевания пародонта возникают вследствие воздействия массы бактерий, содержащихся в зубном налете, включая токсические и иммунопатогенетические элементы.
3.1. Краткая микробиология пародонтальных бактерий
Потребление кислорода
По типу энергетического обмена различают аэробные микроорганизмы, потребляющие кислород для синтеза АТФ, анаэробные — непотребляющие кислород и факультативные анаэробы — сочетающие свойства аэробов и анаэробов.
Строение клеточной мембраны, структуры подвижности и агрегации микробов.
В зависимости от способности формировать специальную защитную оболочку — спору- различают спорообразующие и споронеобразующие микроорганизмы. Спорообразующие микробы более вирулентны, устойчивы к фагоцитозу и к воздействиям внешней среды. На поверхности спор часто расположены вещества, определяющие антигенные свойства бактерий, в том числе и внутривидовой специфичности.
Оболочка бактерий — относительно прочная структура, определяющая форму бактерий и их устойчивость к колебаниям осмотического давления. Клеточная мембрана грамотрицательных бактерий имеет толщину 7,5—10 нм и до 30% ее объема составляет пародонтотоксический токсин и антигенлипополисахаридный (LPS) эндотоксин. Мембрана грамотрицательных бактерий не фиксирует традиционные красители, но подвергаются окраске сафарином после предварительной обработки алкоголем.
Мембрана грамположительных клеток толще (15—50 нм) и синим кристаллическим фиолетом окрашивается в синий цвет.
Жгутики — органы движения бактерий.
Фимбрии — многочисленные, ровные, трубочкообразные элементы оболочки, обеспечивающие адгезию бактерии к поверхности. Фимбрии часто содержат специфический бактериальный антиген.
Среди пародонтопатогенон специфический фимбриальный адгезии выделен у P.gingivalis.
Пили — поверхностные филаментозные элементы, предназначенные для межбактериальной адгезии и переноса генетических субстанций также межбактериально.
3.2. Субгингивальный налет
Для возникновения деструктивных форм пародонтита важнейшим является субгингивальный налет, находящийся в пространстве десневой борозды, на корне зуба, на поверхности соединительного эпителия и в пародонтальных карманах. Субгингивальный бактериальный налет содержит примерно 1011 бактерий в 1 г налета и один пародонтальный карман содержит 107 — 108 бактерий. Известно, что большая часть этих бактерий грамотрицательные анаэробы, вырабатывающие большое количество LPS эндотоксина, который обладает огромным иммунореактивным потенциалом.
Зубной налет содержит 80% йоды и 20% сухого остатка, основным компонентом которого (65%) являются неклеточные структуры, главным образом полисахариды, и только 35% составляют бактерии.
Основным связывающим веществом десневого налета является липотеихоиколовая кислота, продуцируемая грамположительными бактериями, которые повышают общий негативный потенциал налета, способствуя его закреплению и накоплению.
Адгезия бактерий к структурам налета обеспечена прежде всего силами Ван-дер-Ваальса, полисахаридными и пектинподобными рецепторами.
Субгингивальный зубной налет характеризуется в основном низким рН. Нутритивный статус налета определяется довольно высоким током жидкости в десневой борозде. Известны теории, в которых зубной налет рассматривается как физиологический фактор пародонта, создающий неблагоприятные условия для развития бактерий.
Пародонтальные патогены зубного налета объединены в так называемые комплексы, которые были выявлены в процессе микробиологических исследований на очень большом материале — 13261 мазков десневого налета.
С точки зрения этиопатогенеза очень важен 1 комплекс, наличие которого тесно коррелирует с глубокими пародонтальными карманами и кровоточивостью десен при зондировании. Этот комплекс образован известными пародонтопатогенными бактериями — Porphiromonas gingivalis, Bacteroides forsithus, Treponema denticola.
Комплекс 2, образующий ядро налета, состоит преимущественно из родственных видов Prevotella intermedia, Prevotella nigrescens и пародонтопатических субвидов Fusobacterium nucleatum. С комплексом 2 связаны и виды Campilobacter rectus, S. showae, C. gracilis, Eubacterium nodatum.
Комплекс 3 образован главным образом стрептококками -Streptococcus sanguis, S. oralis, S. mitis, S. gordonii, S. intermedius.
Комплекс 4 состоит из 3 типов — Capnocytophaga, Eikenella corodens, A. actinomycetemcomitans.
Комплекс 5 образован Actinomyces odontolytikus, Veillonella parvula, b. serotyp A.a. Selenomonas noxia, Actinomyces naeslundii. Эти бактерии образуют поверхностные слои без какого-то либо отношения к остальным комплексам. Как уже было сказано, бактериальный комплекс 1 располагается в местах наибольшей деструкции пародонта.
3.3. «Хорошие» и «плохие» бактерии, населяющие субгингивальную область
Ткани пародонта заселены не только патогенными, но множеством сапрофитных микроорганизмов. В целом в полости рта выявлено 300—400 видов микроорганизмов, из которых только несколько (7—10) являются вероятными патогенами. Различные исследователи дают различное описание видового состава микрофлоры пародонта. Эти различия связаны, видимо, с расовыми, климатическими, социальными, гигиеническими и возрастными различиями исследуемых групп. Нельзя также исключать отличия методов взятия мазков и их изучения в лаборатории.
В интактном пародонте обнаруживают главным образом грамположительные кокки, в частности стрептококки, и актиномицеты. В здоровом пародонте локализуются Streptococcus oralis, A. gerencseriae, A. naeslundii.
Другие авторы отмечают преобладание в здоровом пародонте A. naeslundii, Streptococcus mitis, Streptococcus sanguis.
В здоровом пародонте у 20% исследуемых выявлены темно-пигментированные бактероиды. Эти микроорганизмы признаны пародонтопатогенами, т.к. выявлены при гингивите в 42% случаев, при адультном пародонтите — в 61% и при ювенильном пародонтите в 73% случаев.
При рождении ребенка полость рта стерильна. В процессе кормления и общения с внешней средой происходит колонизация бактериями и прежде всего Streptococcus salivarius и Actinomyces naeslundii. Анаэробная флора появляется до прорезывания зубов. Доминирующими видами микроорганизмов у детей являются разные виды лактобацилл, S.sanguis и S. mutans.
При гингивитах характерно наличие в исследуемых образцах следующих микробов: Actinomyces naeslundii, A. Viscosus, различные виды стрептококков, семейства Veillonella.
Некоторые авторы отмечают повышенное количество актиномицет и уменьшение количества стрептококков и лактобацилл.
B.forsithus. С. rectus и S. noxia имеют свойство перемещаться в места поражения пародонта и з здоровых участков.
Для деструктивных форм адультного пародонтита важным являются комбинации наиболее вирулентных патогенов. Установлено 5—8 пародонтальных патогенов, чаще всего встречающихся в местах наибольшей деструкции пародонта — атрофии десны и альвеолярной кости. К таковым относятся: P.gingivalis, A. Actinomycetemcomitans, P.intermedia, E.corrodens, F. Kucleatum. Однако эти же микробы в малом количестве наблюдали в интактном пародонте и при минимальных повреждениях пародонта. Одно из возможных объяснений этого феномена — различная патогенность отдельных бактериальных групп и серотипов.
Современные концепции этиопатогенеза заболеваний пародонта предусматривают наличие главных, преобладающих бактериальных патогенов, с которыми связывают клинические формы и тяжесть течения заболевания. Таковые присутствуют минимально в начале каждого пародонтального воспалительного и деструктивного процесса. Различная реактивность защитных систем организма в различной степени может модулировать этот процесс. Поэтому, не имея четких доказательств этиотропности конкретного микроорганизма к конкретной форме заболевания пародонта, мы можем говорить лишь о «главных» или «преобладающих» микробных патогенах при определенных клинических проявлениях заболевания. При этом также нельзя игнорировать различные неблагоприятные комбинации, в частности вирулентность других микроорганизмов, а также общую вирулентность флоры зубного налета.
С прогрессивными адультными формами пародонтитов чаще всего связывают так называемые темно пигментированные бактероиды, получившие свое название из-за коричневого и черного окрашивания колоний, растущих на кровяной среде. Это неподвижные, анаэробные, грамотрицательные палочки. Вирулентнейшей из всех видов пародонтальных бактерий является Porphyromonas (Bacteroides) gingivalis, обладающая также способностью ингибировать активность нейтрофилов и другими выраженными патогенными свойствами.
Другим известным патогеном этой группы является Prevotella (Bacteroides) intermedia, тесно связанная с адультными, локализованными ювениальными формами пародонтита и с гингивитом беременных.
Actinobacillus actinomycetemcomitans является доминирующим пато1 сном локализованного ювенильного пародонтита.
Различные виды рода Capnocytophaga ассоциированы с пародонтитом при ювенильном диабете и гранулоцитопенических заболеваниях.
Prevotella intermedia и спирохеты средней величины доминируют при возникновении ANUG.
Вирулентность бактерий может выражаться в прямом токсическом воздействии, вызывающим воспаление и деструкцию, а также опосредованно, например путем стимуляции иммунопатологических деструктивных реакций. Примером «многогранной» вирулентности является Porphyromonas gingivalis, продуцирующая цитотоксичные экстрацеллюлярные гидролитические энзимы, а также фимбрилярные антигены адгезины.
Факторы вирулентности распределяют на две группы:
1 — факторы, определяющие способность микробов прикрепляться к тканям и образовывать колонии;
2 — факторы, вызывающие деструкцию тканей организма.
Пародонтальные патогены обладают многими механизмами фиксации к тканям, проникновения и фиксации в зубном налете. Токсическое действие бактерий определяется их способностью вырабатывать токсины и способность проникать в ткани организма. Последнее свойство называют инвазивностью.
Механизм проникновения пародонтальных патогенов в ткани организма изучали на примере Actinobacillus actinomycetemcomitans и Porphyromonas gingivalis. Он оказался аналогичным таковому у энтеропатических бактерий. А.а. подобно некоторым видам Shigell проникает через клеточную мембрану в клеточные вакуоли, затем в цитоплазму клетки, в которой реплицируется и перемещается в соседнюю клетку. Освобождение из вакуолей происходит благодаря гемолитическому фактору и посредством фосфолипаз С-типа. Проникновение через клеточную мембрану А.а. осуществляют за счет микрофиламентов, P.g. — микрофиламентов и микротубул.
Однако не все пародонтопатогены обладают способностью к бактериальной инвазии тканей пародонта. В эксперименте, при переносе зубного налета из очагов активной деструкции пародонта животным с интактным пародонтом, только Porphyromonas gingivalis активно проникали в ткани, в отличие от неинвазивных типов бактерий, которые образовывали колонии. Очевидно, что высокой инвазивностью обладают только некоторые виды или типы пародонтопатогенов.
Результаты многочисленных исследований показывают, что инвазивность пародонтальных патогенов является существенным фактором в этиопатогенезе заболеваний пародонта.
В настоящее время адультные деструктивные формы пародонтита рассматривают преимущественно как инфекционное заболевание, вызванное грамотрицательными бактериями. Важнейшим фактором их вирулентности является липополисахаридный эндотоксин, находящийся на внешней мембране бактерий. Наибольшее количество эндотоксина локализовано в свободном субгингивальном налете и поверхностных слоях корневого цемента. Наиболее вирулентным компонентом эндотоксина является липид А, активирующий классические составные элементы комплемента. Гетерополисахаридные компоненты эндотоксина активируют альтернативные реакции комплемента.
Прямое и непрямое патогенное действие бактерий на ткани пародонта
Примером прямого патогенного действия бактерий является лейкотоксин, вырабатываемый известным пародонтопатогеном Actinobacillus actinomycetemcomitans, который вызывает лизис PMN-лейкоцитов. Бактерии вырабатывают различные токсические вещества, например, H2S, гидролитические и протеолитические ферменты.
Выработка протеолитических ферментов — коллагеназ, и индуцирование выработки аналогичных ферментов клетками и тканями пародонта — является примером непрямого патогенного действия бактерий.
Porphyromonas gingivalis вырабатывает коллагеназы, непосредственно разрушающие ткани пародонта. В свою очередь при их разрушении происходит активизация их собственных коллагеназ, продуцируемых, например, PMN- лейкоцитами (ММР-8) или коллагеназ фиб-робластического типа (MMP-J), вырабатываемых фибробластами, моноцитами, и остеокластами.
Активация этих коллагеназ происходит при воздействии воспалительных цитокинов (IL-1 alfa, beta, TNF-alfa) и факторов роста (TGF, EGF, PDGF, NGF).
Выработка воспалительных цитокинов, как и освобождение гранул PMN-лейкоцитов связано с воздействием факторов вирулентности пародонтопатогенных микроорганизмов.
При этом формируется цепочка причинно-следственных связей, в начале которой всегда микробные патогены, а в конце — деструкция пародонта.
3.4. Краткий обзор бактерий-пародонтопатогенов
Actinobacillus actinomycetemcomitans (А.а.) — неподвижный, грамотрицательный палочкообразный микроорганизм, для его культивирования необходима анаэробная, гиперкапническая (с повышенным содержанием СО2) среда. На питательных средах образует звездоподобные колонии. Ранее выделяли 3 серотипа. Причем чаще всего встречаются серотипы а и b. Серотип b наблюдали в основном при локализованном ювенильном пародонтите. В настоящее время выпилено 5 серотипов пародонтальных А.а. и вариабельность генотипа. Эти особенности, безусловно, имеют важное значение в патогенезе пародонтопатии.
Основным фактором вирулентности А.а. является лейкотоксин, вызывающий лизис PMN-лейкоцитов, которые теряют свои защитные функции. Высокая продуктивность лейкотоксина определяется лейкотоксиновым геном, который имеет склонность к мутации. А.а. с лейкотоксиновым генами-мутантами ассоциируют с локальным ювенильным пародонтитом (LJP).
Кроме известных факторов адгезии А.а. вырабатывает так называемый аморфным внеклеточный материал, значительно улучшающий адгезию к тканям и другим бактериям..
Другими факторами вирулентности А.а. являются: фактор, ингибирующий фибробласты, коллагеназы, эндотоксины, различные факторы, влияющие на активность нейтрофилов факторы, индуцирующие продукцию цитокинов макрофагами.
А.а. наиболее «подозрительный» патоген среди виновников локального ювенильного пародонтита (LIP), EOP и тяжелых форм адультного пародонтита. При исследовании семей, в которых хотя бы у одного ребенка был поставлен диагноз LJP, у 42,2% родителей и у 58% родственников были выявлены А.а.
Иммунологические исследования больных с LDP показали повышенный титр антител против А.а., но не у всех больных. Титр антител также слабо коррелировал с выраженностью клинических проявлений заболевания. А.а. стимулирует увеличение количества клеток, вырабатывающих иммуноглобулины (Ig), что также имеет важное значение в патогенезе пародонтита.
Инфекция А. а. активирует факторы гуморального иммунитета и выработку антител против А.а. в плазме и слюне. В указанных работах высказываются предположения о возможном отрицательном влиянии на организм человека гуморальных и клеточных иммунологических реакций, индуцируемых пародонтальными патогенами. Кроме того, несомненную опасность для организма человека представляют патологические пародонтальные карманы — резервуары А.а.
В этой связи интересно сообщение о совпадении генотипов А.а., выделенных из пародонтальных карманов и иссеченной аортальной аневризмы, связанной с микотическим эндартериитом. Предположение о том, что пародонтальные А.а. стали причиной столь тяжелого заболевания, может оказаться очень смелым.
Но уже сегодня известно более сотни публикаций, в которых прослеживаются корреляции между пародонтальным статусом и атеросклеротическими изменениями сосудов организма.
Porphyromonas gingivalis (P.g.) — неподвижная, грамотрицательная палочка, анаэроб, на питательных средах образует характерные красно-коричневые колонии. Часто встречается в участках выраженной деструкции пародонта при адультном пародонтите. P.g. — сахароли-тический анаэроб, получающий энергию ферментацией аминокислот, получаемых в результате гидролиза белков. Особенности энергетического обмена определяют и некоторые факторы его вирулентности — выработка экстраклеточных гидролитических ферментов, коллагеназ, цитотоксинов и как минимум 2 типов фимбриальных адгезинов. Капсулярные протеины и полисахариды также являются факторами вирулентности. Посредством выработки медиаторов воспаления P.g. индуцируют лизис костной ткани и одновременно ингибируют ее восстановление. Важным фактором вирулентности является эндотоксин, обладающий широким спектром пародонтопатогенных свойств. Метаболиты, вырабатываемые P.g., могут и непосредственно повреждать ткани пародонта. Это прежде всего NH3 и H2S и жирные кислоты.
Адгезивные механизмы P.g., имеющих фимбрии, обеспечивают фиксацию бактерий на белковом матриксе клеточной мембраны хозяина. Протеолитическая активность P.g. имеет важное значение в поддержке процессов колонизации и инвазии клеток хозяина — важных факторов вирулентности.
Липополисахариды P.g. недостаточно ингибированы в сыворотке и поэтому могут вызвать повышенную продукцию интерлейкина — 1, который запускает целую цепь патологических реакций, которые, помимо всего прочего, способствуют проникновению P.g. и других бактерий в ткани.
В основе антигенов идентифицировано 6 капсулярных серотипов, при этом наблюдали определенное распределение серотипов по возрасту.
Антигены внешней мембраны по-разному влияют на титр IgG у больных пародонтитом. Из 22 антигенов внешней мембраны P.g. один продемонстрировал протектичный иммунологический ответ и второй может стать маркером восприимчивости к пародонтиту (54). В связи с этим большой интерес представляет идея разработки вакцины с капсулярными полисахаридами и фимбрилярными протеинами с целью выработки иммунитета против пародонтальной инфекции, вызванной P.g.
При исследовании титра антител сыворотки у лиц с интактным пародонтом и больных пародонтитом при воздействии поверхностных и LPS- антигенов различных видов P.g. выявлена интересная закономерность: у лиц с интактным пародонтом титр антител достоверно выше. Это наблюдение свидетельствует о значительной роли гуморального иммунитета в защите тканей пародонта от воздействия пародонтопатогенов, в частности, P.g.
С другой стороны, в сыворотке и слюне больных с различными формами пародонтита часто наблюдается повышенный уровень P.g. -специфичных антител, что является еще одним доказательством доминирующей роли данного пародонтопатогена в патогенезе деструктивных форм пародонтита у взрослых.
Prevotella intermedia (P.i.) — неподвижный, грамотрицательный, анаэробный микроорганизм, образующий на кровяных питательных средах характерные коричнево-черные колонии. Известны факторы вирулентности — капсулярный и липополисахаридный эндотоксины, пили и фимбрии. В отличие от других пародонтопатогенов P.i. является активным продуктом гидролитических протеаз, расщепляющих белки пародонтальных тканей и тканевой жидкости на полипептиды. Таким образом P.i. может обеспечивать другие виды микроорганизмов питательными субстратами (полипептиды, аминокислоты), которые они потребляют, но не могут сами вырабатывать из белка. P.i. принадлежит к бактериальным видам, вырабатывающим протеолитические ферменты, поэтому они могут играть важную роль в образовании пародонтальных абсцессов. Одним из факторов вирулентности P.i. является способность связывать IgG посредством F-рецепторов.
Частота выявления P.i. в участках острого, прогрессирующего пародонтита, сопровождающегося деструкцией пародонтальных тканей, в 5—10 раз больше, нежели в участках вялотекущего или хронического пародонтита.
Повышенный уровень антител сыворотки против P.i. установили у больных рефрактерным пародонтитом и ANUG (67,68). В группе темно-пигментированных бактероидов P.i. является вторым, после Porphyromonasgingivalis, «подозреваемым» среди наиболее вероятных возбудителей заболеваний пародонта.
Fusobacterium nucleatum (F.n.) — неподвижный, грамотрицательный, строго анаэробный микроорганизм. Его встречают чаще всею в местах нарушений десневого прикрепления при различных формах пародонтит взрослых. Принадлежит к изолированным бактериям из субгингивального зубного налета и составляет при этом примерно 7—10% от общего количества видов изолированных бактерии. F.n. способен ферментировать простые пептиды, что объясняет его присутствие в субгингивальном и супрагингивальном налете. Его присутствие в различных бактериальных комплексах и роль в патогенезе заболеваний пародонта весьма туманна.
Eikenella corodens (E.c.) — грамотрицательная, капнофильная, асахаролитическая палочка с притупленными концами, которую обнаруживают в различных участках пародонта при активной и деструктивной формах пародонтита.
Bacteroides forsythus (B.f.) — фузиформный микроорганизм, который трудно культивировать на мигательных средах. Однако даже минимальное количество сопровождается повышенным титром B.f. — специфичных антител. B.f. при взаимодействии с другими паро-донтопатогенами вырабатывает специфические пептидазы, разрушающие тканевые структуры, обеспечивающие десневой аттачмент к зубу.
Spirochety- подвижные, грамотрицательные, строго анаэробные микроорганизмы. Спирохеты, встречающиеся в полости рта, принадлежат в большинстве случаев к роду Trepouema. Этот вид микроорганизмов, как правило, идентифицируют в мазках, взятых в глубоких пародонтальных карманах. Чаще всего культивируют Treponema denticola (T.d.) и Treponema socranskii (T.s.). Фактором вирулентности спирохет является их избирательная способность к адгезии к эпителиальным клеткам. Различная способность к aттачменту отмечается не только между отдельными видами спирохет, но и между подтипами и серотипами.
Treponema denticola (T.d.) также рассматривают как возможный этиологический фактор пародонтита в связи с ее способностью активировать выработку интерлейкина-1. Известны также другие факторы вирулентности, в частности химотрипсиноподобная протеаза.
Несмотря на то, что спирохеты относят к категории классических пародонтопатогенов, нет доказательств статистически значимой зависимости наличия их в пародонтальных карманах и заболеваниями пародонта. Их присутствие многократно установлено при различных формах гингивита, преимущественно ANUG, при котором спирохеты составляют до 30% от общего количества бактерий. При этом заболевании обнаружены убедительные доказательства инвазии микроба в клетки.
С заболеваниями пародонта часто ассоциируют и другие виды микроорганизмов: Campilobacter rectus, Streptococcus intermedius, Peptostreptococcus micros, некоторые виды Selenomonas и Eubacterium.
Современные концепции этиопатогенеза заболеваний пародонта однозначно констатируют, что пародонтопатогенные микроорганизмы одновременно являются одним из возможных этиологических факторов и фактором риска.
Особое внимание исследователей к 8—10 типам микроорганизмов, присутствие которых в местах деструкции пародонта расценивается как фактор риска возникновения этих заболеваний. Сегодня мы не можем однозначно связать конкретную нозологическую форму заболеваний пародонта с определенным видом пародонтопатогенных микроорганизмов. Факт наличия пародонтопатогенов в здоровом пародонте свидетельствует больше в пользу мультифакторной модели этиопатогенеза заболеваний пародонта, в которой важное значение придается защитным возможностям организма. Местные и общие иммунологические факторы защиты оказывают влияние на бактерии и ткани пародонта и можно предположить, что их роль в возникновении и течении заболеваний пародонта также весьма значительна.
Микрофлора полости рта изменяется на всех стадиях развития кариозного процесса. Отмечается увеличение высеваемости кислотообразующих штаммов. Особенно большое количество микроорганизмов обнаруживается в зубном налете: Str. mitis, Str. sanguis, Str. mutans, лактобактерий, фузобактерий и др. Заслуживает внимания и тот факт, что у лиц с множественным кариесом установлено повышение биохимической активности стрептококков и лактобактерий, расположенных на поверхности зубов. Избирательная локализация Str. mutans на эмали и высокая адгезивность полисахаридов типа декстрана, левана и др., а также высокая ферментативная активность микроорганизмов расцениваются рядом авторов как состояние кариесовосприимчивости.
В настоящее время имеются данные, что при кариесе изменяются иммунологические показатели. В биологических жидкостях у лиц с пораженными кариесом зубами (кариес-иммунные) уровень иммуноглобулинов класса А значительно выше, чем в норме. У лиц с множественным кариесом в слюне и сыворотке крови снижаются показатели неспецифической резистентности (уровень лизоцима, β-лизинов и др.).
После прорезывания зуба на его поверхности происходят постоянные изменения, которые характеризуются двумя основными взаимопротивоположными явлениями:
1) отложением на поверхности зуба преципитата ротовой жидкости и микроорганизмов;
2) исчезновением зубных отложений и самой зубной ткани вследствие самоочищения и истирания.
Преимущественное направление того или иного процесса непостоянно на разных поверхностях зуба: на жевательной поверхности преобладают процессы стирания на боковых поверхностях зуба, в пришеечнои части — отложения налета. Интенсивность этих процессов зависит от влияния различных общих и местных факторов: болезней организма, самоочищения полости рта, характера пищи, интенсивности чистки зубов и т. д.
Armstrong (1968) предложили следующую схему образования приобретенных поверхностных структур зуба см. Рис. 2.

При изучении динамики отложения зубного налета (Wood, 1966; Kobylanska, 1969; Alexander et al., 1969) установлено, что в течение первых 24 часов образуется пленка гомогенного материала, свободного от бактерий, толщиной примерно 10 мкм. В последующие дни происходят инвазия бактерий и их размножение. Через 5 дней зубной налет покрывает более половины коронки зуба и по количеству значительно (Р <0,001) превышает первоначальный суточный зубной налет. Наиболее быстро мягкий зубной налет накапливается на Щечных поверхностях верхних задних зубов. Распространение налета по поверхности зуба начинается от межзубных промежутков и десневых желобков; рост колонии подобен росту их на агаре (Alexander et al., 1969; Bowden, 1976).
На образование зубного налета существенное влияние оказывают ряд факторов полости рта и прежде всего микроорганизмы. Без микроорганизмов зубной налет не образуется (Richardson, Castald, 1965). Появлению зубного налета в значительной мере способствуют углеводы (Bowen, 1965; Berg, 196/7). Относительно большие количества зубного налета обнаружены у людей, употребляющих много сахарозы (Critchtly ct al., 1968). Пищевые остатки, особенно сладости, быстро накапливаются в местах, где очищение зубов затруднено (Birch, 1968). В экспериментах на животных отмечено прогрессирующее увеличение зубного налета при увеличении количества углеводов в кариесогенной диете. При ограничении потребления сахара налет на зубах быстро уменьшается (Diena et al., 1967). Скорость образования зубного налета зависит от вязкости слюны, микрофлоры полости рта, уровня десквамации эпителия слизистой оболочки рта и воспалительных процессов, а также от самоочищения рта. В наибольшей степени неочищаемы межзубные промежутки (Kato, 1969), отсюда и начинается рост зубного налета.
Механизм образования зубного налета до конца не изучен. Возможны три варианта его образования см. Рис. 3.

Зубной налет — это плотное образование, которое состоит из бактерий, расположенных внутри матрицы. Матрица налета образуется из белков, полисахаридов, липидов и некоторых неорганических веществ (кальций, фосфаты, магний, калий, натрий и др.).
На образование и распределение зубного налета влияют следующие факторы:
— количественный и качественный состав бактериальной микрофлоры полости рта;
— скорость секреции и свойства слюны;
— состояние десны и степень ее воспаления;
— стадия прорезывания и функциональное состояние зуба;
— анатомия и морфология поверхностей зуба;
— качество пищи и количество потребляемых ферментируемых углеводов;
— наличие навыков гигиены полости рта, использование фторидов и других средств профилактики;
— в активные движения языка, губ и челюстей во время жевания и речи.
Зубной налет образуется путем адсорбции микроорганизмов на поверхности эмали и увеличивается вследствие постоянного наслаивания новых бактерий, причем в определенной последовательности: вначале кокковая флора, затем палочковидные и нитевидные бактерии. По мере роста налета и увеличения его толщины начинают преобладать анаэробные формы бактерий. В нормальной микрофлоре полости рта особо выделяются лактобациллы, актиномицеты, Str. salivarius, Str. mutans, которые при определенных условиях (низком значении рН и высоком содержании сахарозы) приобретают выраженные кариесогенные свойства.
В процессе преципитации белков слюны немаловажное значение имеют деятельность кислотообразующих бактерий (Jenkins, Dawes, 1964) и кальций слюны (Berg, 1967). На формирование матрицы зубного налета влияют ферменты бактериального происхождения, например пейраминидаза, участвующая в расщеплении глюкопротеинов до углеводов и полимеризации сахарозы до декстрина-левапа и др. (Leach, Saxton, 1966).
По Masters (1969), устойчивость зубного налета к воздействию слюны или полосканию рта зависит от покрытия поверхности налета слизистым полупроницаемым мукоидным гелем. Гель также защищает бактерии зубного налета от нейтрализующего действия слюны (Masters 1969).
Музин слюны, слущенные клетки эпителия и другие клетки слюны осаждаются на поверхности зуба и тормозят процесс реминерализации (Lenz, 1967). Возможно этот эффект связан с выработкой кислоты на поверхности эмали при расщеплении сахара или с синтезом больших количеств внутри- и внеклеточных полисахаридов бактериями зубного налета (Gibbons ct al., 1964; Wood, 1964, 1966).
Имеются данные о проницаемости зубного налета и других поверхностных образований, но не всегда четко дифференцируется проницаемость зубного налета и пелликулы. Установлено, что органическая пленка на поверхности эмали может явиться препятствием для диффузии ионов в зуб и из него (Lenz, 1967; Gustafson et al., 1968). Соединения, обладающие высокой способностью к диффузии, такие, как глюкоза и мочевина, медленно проникают и питают зубной налет (Jenkins, Dawes, 1964). Проникновение ионов зависит от концентрации их в среде. При больших концентрациях этот процесс происходит быстрее. Murray (1969) показал, что дезинфицирующие сродства, глюкоза и мочевина включаются в зубной налет в количествах, пропорциональных их концентрации в среде и времени экспозиции и обратно пропорциональных толщине налета. Core (1942) отмечено сопротивление проникновению в зубной налет таких агентов, как тимол, бром-крезол. Наблюдается быстрое проникновение в зубной налет глицерофосфата кальция (Bowen, 1969).
Биохимические анализы органических пленок на поверхности зубов до и после их прорезывания выявили количественные изменения в составе поверхностных образований зубов (Plackova et al., 1964).
Анализы одно-пятидневного зубного налета показали, что кальций, органический и неорганический фосфор, натрий и калий содержатся в нем в больших концентрациях, чем в слюнном осадке, и концентрация этих элементов со временем увеличивается, что указывает на абсорбцию их зубным налетом из слюны (Dawes, Jenkins, 1962).
Минерализация, по мнению большинства авторов, защищает кристаллы эмали от растворения (Леонтьев В. К., 1977; Nevesely, 1968; Jenkins, 1970; Silverstone, 1975).
В зубном налете концентрация фтора значительна, но не постоянна. При резком повышении содержания фтора в питьевой воде концентрация его в зубном налете удваивается (Jenkins, Klеinberg, 1956), что, по-видимому, не связано только со слюной, в которой концентрация фтора повышается незначительно (Ericsson, 1968). Некоторое значение имеет при этом длительность контакта зубного налета со слюной (Jenkins, Kkiuburg, 1956).
Фтор влияет на состав зубного налета (Stoppelari et al., 1969), определяет растворимость эмали, что, возможно, является одним из вероятных механизмов резистентности зубов к кариесу (Houte et al., 1969). Gilmore и Poole (1967) установили связь между степенью поражения кариесом и величиной концентрации фтора в зубном налете при различном содержании его в питьевой воде.
Фтор также воздействует на метаболизм органического состава зубного налета и активность клеточных ферментативных процессор (Theilade, Schroeder, 1966). Благодаря ингибированию энолазы фтор приостанавливает гликолиз (Weatherel, 1966) и подавляет бактериальные ферменты (Levenhuizen, 1966), что играет роль в механизме противокариозного действия фтора.
В зубном налете содержится, также большое количество различных микроорганизмов и грибов (Ребреева Л. Н., Кускова В. Ф., 1967; Keyes, 1962). Из бактерий преобладают стрептококки и лактобациллы (Lammers, 1965; Bowden, 1975). Микробная флора зубного налета не является постоянной ни в количественном, ни в качественном отношении. Одно-двухдневный зубной налет состоит, преимущественно из микрококков, в то время как в трех-четырехдневных образцах появляются, а с 5-го дня начинают преобладать нитевидные формы (Ребреева Л. Н., Кускова В. Ф., 1967; Krasse, 1962). В последнее время особое внимание уделяется изучению микроорганизмов зубного налета, обладающих способностью синтезировать йодофильные полисахариды (Houte et al., 1969). Одним из характерных свойств бактерий зубного налета является образование кислот. Биохимическими анализами установлено образование уксусной и молочной кислот (Kanke U., Ranke В., 1968).
рН зубного налета близок к рН ротовой жидкости, так как снижению его препятствует буферная емкость слюны (Noite, Arnim, 1956). Однако, по данным некоторых авторов, он может быть ниже на 0,1—0,2 (Rosen, Weisenstein, 1965) в результате временного дисбактериоза — размножения гликолитических бактерий (Lammers, 1965), чрезмерного употребления сахара (Luoma, 1964) и отложения на зубах мягкого налета.
Обязательным условием образования зубного налета является присутствие в полости рта микроорганизмов. Экспериментально доказано, что у гнотобиотических (безмикробных) животных никогда не образуется зубной налет и зубной камень. В образовании зубного налета принимает участие и слюна. На этот процесс влияет также ряд особенностей поверхности. Многочисленные экспериментальные исследования, выполненные с использованием ультраструктурных, гистохимических, гистофизических и микробиологических методов показали, что в образовании зубного налета можно выделить несколько стадий.
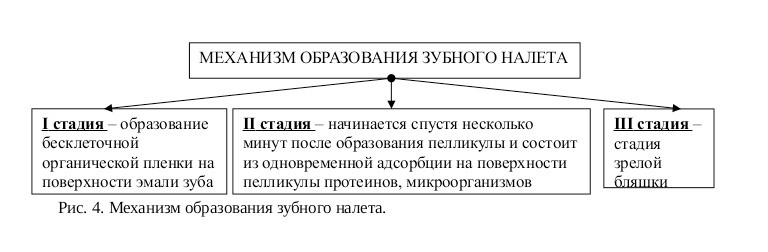
Первая стадия — это образование бесклеточной органической пленки на поверхности эмали зуба. Эту пленку разные авторы называют или приобретенной кутикулой, или пелликулой. Толщина пленки колеблется от 1 до 10 мкм. Образуется она довольно быстро при контакте поверхности зуба со слюной. Обычно на образование пелликулы требуется от нескольких минут до нескольких часов. По своему химическому составу пелликула представляет собой гликопротеиновый комплекс, в составе которого содержится разное количество протеиносвязанных углеводов. По данным В. К. Леонтьева (1976), в пелликуле зубов свиньи содержится 1,7% протеиносвязанных углеводов, коровы — 4,3%, человека — 2,5%. Из общего числа протеиносвязанных углеводов пелликулы 65% составляют гексозы. В составе пелликулы обнаружены также кетосахара и уроновые кислоты. В то же время гликопротеины пелликулы почти не содержат сиаловую кислоту и фукозу, хотя оба эти углевода найдены в значительных количествах в гликопротеинах свежесобранной слюны.
Механизм образования пелликулы полностью не выяснен. Имеется ряд гипотез, которые объясняют ее происхождение (Jenkins, 1968). Одни авторы считают, что пелликула образуется в результате спонтанного осаждения протеинов слюны. Действительно, некоторые протеины не стабильны и легко осаждаются на поверхности зубов, стеклянных пластинках, фильтровальной бумаге и других объектах, помещенных в слюну при нейтральных значениях рН. Это осаждение протеинов не зависит от бактериальной активности, так как происходит в сравнительно активной слюне, собираемой из протоков и, кроме того, мало зависит от присутствия ингибиторов роста бактерий (Midlton, 1965). Осаждение протеинов слюны значительно усиливается при ее подкислении, а также в присутствии ионов кальция и фосфатов. Эти ионы могут способствовать осаждению протеинов из раствора, а также усиливать адгезию осажденных протеинов к поверхности оксиапатита. Прибавление к слюне из поднижнечелюстной железы растворов кальциевых солей вызывает коагуляцию протеинов.
Ионы кальция принимают участие в ранней фазе бактериального прикрепления к органической оболочке эмали, но не влияют на связывание микроорганизмов между собой в процессе формирования зубной бляшки (Newman, 1982).
Rundegren и Erison (1981) обнаружили в слюне высокомолекулярные гликопротеиды, которые обладают способностью агглютинировать бактерии. Подобные агглютинины являются составной частью зубной пелликулы и, по-видимому, определяют начальную адгезию некоторых микроорганизмов полости рта на поверхности зубов. Агглютинины проявляют свою активность лишь в присутствии ионов кальция. Общее содержание агглютининов в слюне составляет около 1% от общей концентрации белка.
Gaughey и Stowell (1966) в экспериментах с водными растворами муцина, взятого из поднижнечелюстной железы, показали, что его адгезия к стеклянным пластинкам существенно увеличивается в присутствии фосфатов. Однако спонтанное осаждение протеинов слюны не может объяснить того факта, что гликопротеины пелликулы резко отличаются по химическому составу от слюнных гликопротеинов (муцина). Эти различия заключаются в том, что в гликопротеинах пелликулы содержится почти в 10 раз меньше протеиносвязанных углеводов, чем в муцинах слюны. Гликопротеины пелликулы не содержат сиаловую кислоту и фукозу.
Leach (1968) доказал, что для осаждения гликопротеинов на поверхности эмали зубов необходима их химическая модификация, которая заключается в отщеплении нейраминовой кислоты и фукозы под влиянием фермента нейраминидазы. На рис. 7 представлена схема такой химической модификации муцина слюны, при которой он лишается отрицательных зарядов и из фибриллярной формы превращается в глобулярную. При этом резко снижается вязкость водных растворов и растворимость гликопротеинов. В нижнечелюстной слюне содержится больше нейраминовой кислоты, чем в околоушной. Так как гликопротеины играют существенную роль в развитии кариеса зубов и пародонтита, то их количество можно определить по количеству нейраминовой кислоты методом фракционирования по Kunstmann (Kleinberg, Kunstmann, 1982).
Для образования пелликулы необходимо, чтобы муцины слюны потеряли почти 90% всех своих протеиносвязанных углеводов. Покрытие зубов пелликулой играет важную защитную роль, поскольку снижает растворимость оксиапатита эмали в 4—6 раз. II стадия образования зубного налета начинается спустя несколько минут после образования пелликулы и состоит из практически одновременной адсорбции на поверхности пелликулы протеинов, микроорганизмов и эпителиальных клеток. Коагуляция, или осаждение протеинов на поверхности пелликулы, происходит по тем же механизмам, что и осаждение их при образовании пелликулы. В этом случае химическая модификация муцинов слюны является важнейшим фактором, способствующим осаждению протеинов на поверхности пелликулы. Осажденные гликопротеины составляют первый и важнейший компонент матрикса будущего зубного налета. Вторым компонентом матрикса являются липкие полисахариды типа декстрана которые вырабатываются некоторыми штаммами стрептококков — Sir. mutans, mitis, sanguis. Выработка декстранов и леваков осуществляется ферментными системами стрептококков с использованием в качестве субстрата пищевой сахарозы. Эти два компонента — химически модифицированные гликопротеины слюны и внеклеточные полисахариды — формируют основную среду (матрикс) зубной бляшки, которая подвергается колонизации оральными микроорганизмами.
Различные виды микробных ассоциаций оказывают различное влияние на адсорбцию Str. mutans по поверхности эмали. Так, из 8 исследованных видов микроорганизмов полости рта 4 вида микробов не оказывали какого-либо влияния на общее количество образовавшегося зубного налета, 3 вида существенно подавляли налетообразование и 1 вид резко увеличивал его общую массу.
Восемнадцать видов анаэробов полости рта обладают способностью разрушать декстран и тем самым тормозить адгезию стрептококков. Наибольшей способностью подавлять микробную адгезию обладают бактероиды.
На агрегацию микроорганизмов и их адсорбцию на поверхности эмали зубов большое влияние оказывают различные анионы и органические макромолекулы. Так, анионы СО32-, Н2РО4- и НРО42- в низких концентрациях стимулируют агрегацию Str. mutans и Actinomyces viscosus. Агрегация микроорганизмов увеличивается в присутствии сахарозы и кальциевых комплексов сиалопротеинов.
Адгезия бактерий к зубу зависит от их ферментативной активности, последовательности воздействия на поверхность зуба, концентрации и взаимодействия между собой. Прилипаемость бактерий к поверхности эмали зуба увеличивается на 60% при добавлении к взвеси микроорганизмов 5% раствора сахарозы, которая стимулирует вторичную колонизацию стрептококков, что не обнаружено при добавлении глюкозы (Adshead и соавт., 1983).
На ранних стадиях развития зубного налета основным клеточным элементом является кокковая микрофлора, которая в последующем сменяется палочковидными и нитевидными формами. Кроме микроорганизмов в зубном налете встречаются эпителиальные клетки, которые после адсорбции на поверхности пелликулы распадаются. Одним из факторов, способствующих осаждению бактерий на поверхности пелликулы, является наличие в слюне веществ, вызывающих агглютинацию микроорганизмов. Эти вещества имеют, по-видимому, протеиновую природу, поскольку они не подвергаются диализу и легко адсорбируются на оксиапатите. По мнению Peret (1978), необходимыми организующими элементами мягкого зубного налета являются микробные ферменты. Автор делит их на 2 группы в зависимости от механизма взаимодействия с компонентами зубного налета. Первая группа включает в свой состав гидролазы, в частности, нейраминидазу и другие мукополисахариды, которые в присутствии слюнных гликолипопротеинов и ионов кальция стимулируют агглютинацию бактерий. Вторая группа ферментов, способствующих образованию зубного налета, представлена синтетазами, в частности, декстрансахарозой, которая способствует образованию из сахарозы декстранов, обладающих липкими свойствами и тем самым усиливающими агглютинацию микроорганизмов.
Спустя несколько дней зубной налет переходит в свою III стадию развития — стадию зрелой зубной бляшки и представляет собой структурно сложное полимикробное образование толщиной до 200 мкм, химический и микробный состав которого описаны нами выше. На этой стадии зубной налет представляет наибольшую опасность для эмали зубов поскольку образуемые им такие патогенные факторы, как гидролитические ферменты (протеиназы, гиалуронидазы и др.) и различные органические кислоты (молочная, пропионовая, уксусная и др.) могут вызывать растворение пелликулы, химическое разрушение и растворение эмали зуба (кавитогенез). При этом зубной налет удаляется вместе с отторгаемыми частями зубной эмали. Однако в тех случаях, когда в зрелом зубном налете создаются условия анаэробиоза, происходит изменение состава микроорганизмов (смена аэробов анаэробами), снижение продукции кислоты и увеличение рН, накопление кальция и его отложение в виде фосфорнокислых солей, наблюдается переход зубного налета в его IV стадию, которая называется зубным камнем.
В механизме образования зубного налета важное значение имеет десневая жидкость. Используя сканирующий электронный микроскоп, Saxton (1973) доказал, что между временем колонизации зубного налета и состоянием десны существует довольно четкая корреляция. Большое количество агрегатов бактерий находится в областях, прилегающих к десне. Это подтверждают данные о наличии электрофоретических фракций протеинов, общих для зубного налета и десневой жидкости.
Считается доказанным на основании исследований, что образование налета происходит в 3 этапа.
Сначала на кутикуле эмали возникает аморфный, не содержащий бактерий слой, затем происходит внедрение бактерий, находящихся в виде небольших колоний в дефектах эмали, их размножение и отложение солей кальция в образовавшуюся матрицу.
В настоящее время существуют 3 теории, объясняющие образование зубного налета. Согласно первой теории, его образование происходит благодаря преципитации белков слюны в их изоэлектрической точке кислотами, продуцируемыми бактериями, согласно второй, белки слюны преципитируют при контактировании с поверхностью эмали, возможно вследствие чередования процессов смачивания и высыхания; согласно третьей теории, благодаря действию бактерий изменяются свойства мукоидов слюны, что вызывает преципитацию и образование зубного налета.
Выявлены 2 основные реакции, которые, по мнению многих авторов, имеют непосредственное отношение к формированию матрицы зубного налета: расщепление гликопротеинов (муцина) гликозидазами (нейраминидазой) до углеводов и ферментативная полимеризация пищевой сахарозы до левана и декстрана. Ферменты, участвующие в этих процессах, экстрацеллюлярного и бактериального происхождения.
Шроедер в результате электронно-микроскопических исследований обнаружил 3 структурно различных типа зубного налета:
1) свободно располагающиеся микроорганизмы, преимущественно кокки;
2) плотно расположенные кокки и палочковидные микроорганизмы;
3) плотную массу кокков, покрытую нитевидными микроорганизмами. Межмикробная матриц имела волокнистую и зернистую структуру.
Патогенное действие бляшки, содержащей кариесогенные микроорганизмы, проявляется не всегда. Вызываемый микробной бляшкой кариозный процесс развивается неодинаково. Такое положение породило тенденцию к делению людей по признаку их устойчивости к кариесу зубов. Современные исследователи различают людей кариесрезистентных и подверженных кариесу. В этой связи обращено внимание на факторы, определяющие устойчивость к кариесу зубов (перенесенные и сопутствующие заболевания, неполноценное питание и др.). Установлено, что взрослые и дети, перенесшие острые инфекционные заболевания (Синицын Р. Г., Жученко Л. В., 1968; Кошовская, В. А. и др., 1970) и отягощенные хроническими заболеваниями (Руссак С. А., 1966; Койфман К. У., Малкес С. А., 1973), особенно интенсивно поражаются кариесом зубов. При этом степень пораженности не связана с теми или иными чертами перенесенного или сопутствующего заболевания. Для различных заболеваний, как правило, чреватых повышенной подверженностью зубов кариесу, общим является то, что они сопровождаются угнетением естественной сопротивляемости организма
Понятие кариесогенности зубного налета связывают с содержанием в нем кариесогенных микроорганизмов, вырабатывающих значительное количество кислот (Volker, Bibby, 1941; Richardson et al., 1965). Роль зубного налета в физиологии зуба изучена недостаточно, но очевидно его защитное действие против кислот, содержащихся в кислых фруктах и др. Механизм этого эффекта — ограничение диффузии кислот в эмаль, т. е. зубной налет служит барьером проницаемости (Stowell et al., 1962; Hardie et al., 1963; Gray et al., 1970).
Несмотря на частичное удаление зубного налета во время жевания или зубной щеткой, с возрастом происходят уплотнения зубных отложений и проникновение их в микротрещины, вследствие чего поверхность зуба становится пигментированной. Установлено, что эти области более резистентны к действию кислот. Механизм этого феномена состоит в том, что в резистентных к кариесу областях обнаружено высокое содержание органических компонентов (Bhussry, Bibby, 1957).
Интенсивность кариеса и гингивита у молодых людей находится в прямой зависимости от количества и распределения налета на зубах. Чаще всего зубной налет располагается над десной, в пришеечной области, в фиссурах. Он представляет собой пористую структуру, что позволяет углеводам свободно проникать в его глубокие слои. При приеме мягкой пищи и употреблении значительного количества легко ферментируемых углеводов происходит значительный и быстрый рост налета.
Следует отметить, что зубной налет менее плотно прикреплен к поверхности зуба, чем пелликула; в то же время в отличие от пищевых остатков его нельзя удалить простым полосканием. Наибольшие трудности представляет очищение фиссур, ямок, проксимальных поверхностей, десневого края.
Ранее мы уже останавливались на механизме образования зубного налета (А. И. Рыбаков, А. В. Гранин, 1970). Налет на зубах бывает чаще всего белого, желтого и зеленого цвета. Белый налет состоит из эпителия, отслоившегося со слизистой оболочки полости рта, остатков пищи и различных микроорганизмов. По данным Lange (1971), микрофлора зубного налета состоит из 36% грамположительных кокков, 11% грамотрицательных, 34% грамположительных палочковидных микробов, 17% грамотрицательных палочек, включая фузобактерии, и 2% спирохет. По данным Ю. А. Федорова (1972), при отсутствии ухода за полостью рта в 1 мг зубного налета содержится до 800 млн. микроорганизмов, тогда как при регулярной чистке зубов — не более 10 млн.
Зубной налет мягкий, тянется, легко удалится. Образуется он почти исключительно на губных и щечных поверхностях шеек зубов, а также между зубами, около десны. С язычной поверхности зубов зубного налета нет, так как он стирается языком. Наличие обильного зубного налета свидетельствует о недостаточном уходе за зубами; налет чаще всего встречается на той стороне челюсти, которая не участвует в акте жевания, а также на нефункционирующих, одиночно стоящих зубах. При недостаточном уходе за полостью рта и нарушении функции жевательной активности зубной налет может приводить к развитию хронического катарального воспаления десны с последующим образованием зубодесневых карманов, краевых хронических перицементитов и т. д. (Powell, 1970; Houver, Frank, 1971, и др.).
При адсорбции мягким зубным налетом солей и минеральных элементов он минерализуется и превращается в зубной камень, который обычно желтого или темно-коричневого цвета. Мягкий зубной налет или образовавшийся на его месте зубной камень служит иногда важным диагностическим показателем функционального состояния данной половины челюсти, т. е. участия ее в акте жевания. Кроме того, по цвету образовавшегося зубного камня можно судить о давности его образования и в некоторой степени об общем состоянии организма. Так, более светлые зубные отложения наблюдаются у лиц с нарушенным солевым обменом. У больных сахарным диабетом, подагрой, ревматизмом отмечается быстрое образование зубных отложений, в связи с чем этим больным необходимо назначать индивидуальные схемы гигиены полости рта.
У здоровых людей налет образуется медленно, зубной камень, возникший на его месте, темнее и тверже. Механизм его образования и его разновидности очень подробно описаны Schroeder (1969).
3.5. Углеводы
Современный человек включает в свой рацион много углеводов, которые можно подразделить на две большие группы:
1) легко ферментируемые углеводы — сахара и крахмал, прошедший кулинарную обработку;
2) сахарозаменители.
Бактерии используют углеводы для питания и построения матрицы зубного налета, и конечным продуктом этого процесса являются органические кислоты, которые вызывают деминерализацию эмали. Самыми выраженными кариесогенными свойствами обладает сахароза, почти такими же — сочетание глюкозы и фруктозы.
Возникновению и прогрессированию кариеса зубов способствуют некоторые особенности питания, характерные для современных условий:
— высокое содержание в пище легко ферментируемых углеводов, особенно сахара;
— увеличение частоты приема пищи;
• уменьшение употребления пищи, требующей интенсивного жевания, приводящего к повышению слюноотделения и «естественному очищению полости рта»;
е уменьшение потребления пищи, способствующей ингибированию кариеса зубов.
Кариесогенное действие сахарозы общепризнано. Высказывается даже суждение, что одним из обязательных условий возникновения кариеса зубов является избыток в диете углеводов (Прохончуков А. А., 1964; Паникаровский В. В. и др., 1968). Действительно, доказано существование тесной корреляции между количеством потребляемого сахара и интенсивностью кариеса зубов.
Изучение качественного состава зубной бляшки приматов, содержавшихся на диете, богатой сахаром, позволило V. Dent и P. Marsh (1981) прийти к заключению, что сахароза является фактором, вовлекающим кариесогенные микроорганизмы в микробное сообщество, входящее в состав мягкого зубного налета. Кариесогенное действие сахара проявляется лишь в присутствии микробной бляшки.
Исследуя природу и свойства зубной бляшки, J. Wood (1969) пришел к выводу, что сахароза накапливается в материале зубной бляшки в виде внутри- и внеклеточных полисахаридов и в течение 24 ч превращается в кислоту.
При употреблении сахарозы постоянно обнаруживаемый при кариесе зубов St. mutans продуцирует молочную кислоту быстрее, чем другие микроорганизмы мягкого зубного налета (Hoeven J., Franken H., 1982). Иными словами, сахара способствуют образованию бляшки, размножению микроорганизмов, которые затем используют их для проявления своего кариесогенного действия. Патогенность мягкого зубного налета, другими словами, его свойство вызывать кариес зубов, в немалой степени зависит от способности входящих в ее состав микроорганизмов вырабатывать кислоты из Сахаров. При измерении рН бляшки J. Kleinberg (1961) нашел его равным 7,2—7,8, что на единицу выше значения рН слюны (6,8—6,9). Под бляшкой, т. е. непосредственно на поверхности эмали, может происходить падение рН до 5,0, при котором возможна декальцинация эмали зуба (Hardwic J., 1962). Между снижением значения рН бляшки, количеством лактобактерий и активностью кариеса зубов существует зависимость (Stephan R., 1953).
Установлено, что продуцируемые микроорганизмами зубной бляшки кислоты могут вызывать деминерализацию эмали. Локальное изменение значения рН в кислую сторону приводит к повышению проницаемости эмали (Кочержинский В. В., 1973). Однако следует иметь в виду, что деминерализация эмали возможна и при щелочном значении рН зубного налета. При этом допускается хеляционный механизм деминерализации эмали (Schatz A., Martin J., 1962). Наряду с этим подтверждено высказанное в 1925 г. Taber мнение о том, что микроорганизмы зубной бляшки проникают в эмаль через эмалевые пластинки — образования органической природы (К. Sbiota, 1966). Следует отметить, что, невзирая на противоречивые представления о происхождении органического вещества, образующего ламеллы (Леус П. А., 1970; Леонтьев В. К., 1977; Tinanoff A., 1976), в эмали различают кислоторастворимую (некоторые белки и пептиды) фазу органических веществ и фазу, нерастворимую в кислотах (Stack M., 1954). Присущее проницаемости эмали свойство изменяться связывают с содержащимся в ней органическим веществом (Jenkins G., 1970).
Более важна частота приема сахара, чем его общее количество. При увеличении частоты приема легко ферментируемых углеводов равновесие между де- и реминерализацией эмали сдвигается в неблагоприятную сторону и наблюдается прогрессирование кариозного процесса. Повышенная концентрация сахара в полости рта сохраняется после приема в течение 20—40 мин, и это время используется микрофлорой зубного налета для утилизации углеводных остатков, обладающих кариесогенным действием.
3.6. Кариесогенные ферменты зубного налета
Как уже отмечалось выше, в зубном налете обнаружено свыше 50 различных ферментов, многие из которых обладают деструктивным действием на ткани зуба. Из таких ферментов наибольшее внимание привлекают протеолитические, продуцируемые самыми разнообразными микроорганизмами (Frostell и соавт., 1973). При гистологическом исследовании эмали Bodecker (1906) и Gottlieb (1921) доказали, что ламеллы, разделяющие эмалевые призмы и содержащие органические вещества, способны растворяться под действием некоторых факторов и тем самым способствовать глубокому распространению кариозного процесса. Дальнейшие исследования Gottlieb и соавт. (1946) позволили прийти к выводу, что первичным этапом развития кариозного поражения является воздействие протеолитических ферментов микроорганизмов, в результате чего разрушаются ламеллы, органические призменные оболочки и эмалевые пупки. Воздействие протеиназ, по мнению этих авторов, облегчает доступ и глубокое проникновение микроорганизмов в глубь эмали с последующим растворением оксиапатита под действием кислот.
Frisbie и соавторы (1947) подтвердили эти данные, обнаружив на гистологических препаратах эмали микроорганизмы в ламеллах, а также гистохимически выявляемые изменения органического матрикса зуба. Деминерализация эмали возникает на втором этапе развития кариеса зубов за счет действия кислот, образуемых при распаде органических веществ эмали (Frisbie, 1950).
Несколько позднее Hard wick и Manly (1952), используя различные физико-химические, гистологические и гистохимические методы исследования, доказали, что кариозный процесс может начинаться с протеолиза. Этим авторам удалось подтвердить наличие микроорганизмов в эмали и дентине.
Наиболее обстоятельные исследования роли протеолитических ферментов микроорганизмов зубного налета в развитии кариеса зубов проведены Schatz и Martin (1956) — авторами протеолиз-хелационной теории кариеса зубов.
Наряду с протеолитическими ферментами в деструкции эмали существенную роль играют различные сульфатазы. Как известно, органические структуры эмали содержат в своем составе различные мукопротеинсульфаты, а также сульфатированные гликозаминогликаны. Сульфатазы, отщепляя неорганический сульфат, вызывают разрушение белковоглизаминокликановых комплексов и тем самым приводят к разрушению органического каркаса эмали и дентина,
Kreitzman (1974) исследовал роль фосфатаз, вырабатываемых микроорганизмами, в растворении минеральных компонентов эмали. При обработке моляров крыс препаратами выделенной из Е. coli фосфопротеиновой фосфатазы в эмали происходят гистологически выявляемые изменения. Наблюдается очаговое поверхностное разрушение эмали, определяемое при окраске пурпуратом аммония. Увеличение сроков инкубации моляров с препаратами фермента увеличивают размеры очага поражения. При обработке ультразвуком возникают очаговые дефекты эмали в местах воздействия фермента фосфатазы. Данные ультраструктурных исследований подтверждают очаговость поражения и свидетельствуют, что в некоторых случаях очаги сливаются под поверхностью, распространяясь по большим сегментам и подрывая обширные области поверхностной эмали.
Инактивированные воздействием тепла контрольные зубы не подвержены влиянию фосфопротеиновой фосфатазы, вероятно, за счет затруднения доступа этого фермента к субстрату. Точно также первоначальная обработка зубов этилендиамином лишает зубы способности разрушаться этими ферментными препаратами, что свидетельствует о необходимости органического компонента эмали для ферментативного действия фосфопротеиновой фосфатазы.
Участие фосфатаз в развитии кариозного процесса подтверждают также многочисленные данные о противокариозном действии пищевых фосфатов, которые обладают способностью ингибировать фосфатазы.
В. В. Кочержинский и соавторы (1975) доказали, что протеолитический фермент химотрипсин увеличивает проницаемость эмали. Сходная химотрипсиноподобная активность обнаружена и в зубном налете. Paunio и соавторы (1968) исследовали действие ряда протеолитических ферментов на порошкообразную эмаль зубов человека и доказали, что бактериальные энзимы (субтилопептидаза и коллагеназа) способны освобождать фосфат из эмали. Проведенные авторами эксперименты подтвердили энзиматическую природу этого процесса. На синтетический оксиапатит протеолитические ферменты не действовали.
Нами исследована активность ферментов в зубном налете людей с множественным кариесом зубов. Установлено, что у этих лиц возрастает скорость образования зубного налета и увеличивается активность в нем основной фосфатазы. Активность кислой фосфатазы, основной и кислой протеиназ у лиц с множественным кариесом зубов не отличаются от соответствующих показателей у здоровых людей.
На интенсивность кариозного процесса оказывает влияние активность амилазы. При генерализованном кариесе зубов активность амилазы в слюне и мягком зубном налете в 2,5 раза превышает норму (Sotosek, 1983).
3.7. Кислотообразующие свойства зубного налета
Миллер (1890) впервые доказал, что в патогенезе кариеса зубов решающую роль играет процесс ферментации углеводов под действием бактерий полости рта с образованием кислот; последние растворяют кальция фосфат эмали или дентина, что приводит к возникновению кариозной полости,
Установлено, что зубной налет, благодаря скоплению микроорганизмов, способен легко и быстро превращать углеводы в кислоту (Markowska и соавт., 1977). О накоплении кислоты в зубном налете свидетельствует снижение рН, которое происходит при инкубации суспензии находящихся в нем микроорганизмов в растворах глюкозы. Как видно из рисунка, прибавление растворов глюкозы каждый раз вызывало снижение рН, причем более высокие концентрации глюкозы вызывают более сильное снижение рН. Механизм образования кислот из углеводов, в частности из сахарозы, представлен на схеме (рис. 7), из которой видно, что сахароза вначале превращается в резервируемые полисахариды, типа левана и декстрана, а затем гидролизуется до глюкозы и фруктозы, которые фосфорилируются и гликолитическим путем превращаются в пируват. В дальнейшем пируват может восстанавливаться в лактат (молочную кислоту) под действием фермента лактатдегидрогеназы, декарбоксилироваться в ацетат под действием пируватдекарбоксилазы либо включаться в цикл трикарбоновых кислот и образовывать ряд органических кислот, в том числе и янтарную кислоту. Последняя под действием специфических ферментов превращается в пропионат. Совокупность этих кислот (молочной, уксусной, пропионовой) образует общий пул кислых продуктов, накапливаемых в зубном налете.
Известно, что сахароза является основным компонентом углеводов в пище, поступающей в организм современного человека. Характер ее превращения в полости рта в значительной мере зависит от степени концентрации в пище.
При низкой концентрации сахароза быстро гидролизуется бактериями полости рта, образуя глюкозу и фруктозу. Напротив, при высокой концентрации в пище сахароза наряду с глюкозой и фруктозой образует внеклеточные глюканы и фруктаны.
Недавние исследования показали, что расщепление внеклеточных полисахаридов тормозится в присутствии сахарозы, что дает основание предполагать ингибирующее действие глюкозы и фруктозы на соответствующие ферменты. При удалении сахарозы в результате бактериального метаболизма либо в результате вымывания ее слюной ингибирование гидролиза внеклеточных глюканов и фруктанов прекращается и эти полимеры превращаются в глюкозу и фруктозу, которые подвергаются ферментации с образованием кислот, а также внутриклеточных полисахаридов, имеющих сходство с гликогеном и амилопектином.
Образование кислот в зубном налете и падение его рН происходит лишь в том случае, если в полость рта поступают углеводы. На рис. 7 показано, что поступление углеводов в организм практически не изменяет рН зубного налета, тогда как введение углеводов в полость рта приводит к прогрессирующему падению рН, вызываемому в одинаковой степени сахарозой, глюкозой или фруктозой. Основной кислотой, продуцируемой зубным налетом, является молочная кислота, однако наряду с ней в его составе обнаружено также значительное количество летучих жирных кислот.
Как показали исследования Geddes (1975), «отдыхающая» зубная бляшка имеет рН, находящийся в слабокислой области. Химический анализ показал присутствие, в таком зубном налете лактата, ацетата, пропионата и малых количеств н-бутирата. В зубном налете, взятом утром натощак, обнаружены кислоты в следующих количествах (в мкмолях Х10—8/мг сырой массы зубного налета): ацетат — 1,77; пропинат — 0,50; 1/ (+) -лактат- 0,25 и D (-) -лактат- 0,55. Спустя 5 мин после приема сахара общее количество кислот возрастает. Наиболее характерно это для лактата, главным образом L (+) -изомера. В то же время концентрация ацетата и пропионата снижается. Прием глюкозы оказывает аналогичное действие. Через 1 ч после приема сахара в зубном налете остается повышенное содержание кислот, однако, соотношение между отдельными веществами такое, как натощак.
Наибольшему снижению рН соответствует максимальное увеличение концентрации молочной кислоты. Вероятно, что кариесогенные свойства зубного налета связаны именно с молочной кислотой, способной растворять кальций, входящий в состав слюны или зуба, даже в те периоды, когда рН поднимается выше критической величины.
Gilmor и Poole (1967) исследовали газохроматографическим методом содержание уксусной, пропионовой и молочной кислот в зубном налете спустя 5 ч после инкубации.
Установлены следующие факты: снижение рН не связано с изменением концентрации любой из этих кислот: концентрация перечисленных кислот у различных субъектов сильно варьирует; концентрация кислот, образуемых внутренним или наружным слоями зубного налета, обычно разная; концентрация молочной кислоты такая же или даже меньше концентрации уксусной или пропионовой кислот.
Образование различных кислот в зубном налете связано с определенными видами микроорганизмов. Стрептококки, являющиеся наиболее сильными кислотообразователями зубного налета, образуют почти исключительно молочную кислоту, лактобациллы наряду с молочной кислотой могут образовывать пропионовую, уксусную и масляную кислоты, нейссерии и вейлонеллы превращают молочную кислоту в пропионовую и уксусную, а углекислый газ и воду-в пировиноградную и уксусную кислоты.
Молочную кислоту, кроме стрептококков, образуют коринебактерии, бактерионемы, актиномицеты и лептотрихии (Markowska и соавт., 1977), пропионовую кислоту образуют Propionibacterium, a Bacteroides oralis и Fusobacterium образуют муравьиную, уксусную, пропионовую и масляную кислоты. Значение рН в зубном налете зависит не только от скорости продукции органических кислот, но также и от доступа слюны к нему. Как известно, слюна содержит значительное количество бикарбонатов, способных нейтрализовать кислоты, поэтому зубной налет, в наибольшей степени контактирующий со слюной, имеет и более высокие значения рН.
Birkhed (1978) исследовал ферментацию различных углеводов и многоатомных спиртов в суспензии зубного налета человека и показал, что сорбит ферментируется намного слабее глюкозы, сахарозы или инвертного сахара. Кислотообразование из фруктозы в среднем на 21% ниже, чем из глюкозы, а маннит и ксилит вообще не образуют кислоты. Galgaher и Fussell (1979) исследовали способность микроорганизмов зубного налета ферментировать 5-атомные спирты с образованием кислот. Сравнивали ксилит, L-арабинит, рибитол с сахарозой. У большинства людей кислоты образуются при ферментации сахарозы, но нередко встречаются индивидуумы, в зубном налете которых находятся микроорганизмы, способные ферментировать ксилит.
4. Биохимические сдвиги в зубном налете и слюне
рН зубного налета в области поражения периодически меняется, повышаясь при контакте с новыми порциями свежей слюны (Nolte, Arnim, 1956) и снижаясь после приема углеводистой пищи или в результате длительного застоя ротовой жидкости в ретенционных участках (Ashley, 1975; Gеddеs, 1975).
В поверхностных слоях эмали под мягким зубным налетом образуются карбонсодержащие промежуточные продукты метаболизма сахара. Полисахариды распадаются до моносахаров и вступают в биохимические реакции со свободными аминокислотами зубного налета. Особенно высока скорость биохимических реакций в зубном налете при кариесе в анаэробных условиях (Engil, 1967).
Фосфаты эмали могут поглощаться органическими компонентами зубного налета, особенно при наличии в нем клеток дрожжей (Keyes, 1962). Ионообменные реакции между эмалью и зубным налетом в участках деминерализации ускоряются благодаря увеличению в зубном налете щелочной фосфатазы, выделяющейся из эпителия десневого края (Ring, 1952).
Таким образом, происходят биохимические изменения состава и свойств ротовой жидкости и особенно зубного налета. В основном эти сдвиги сводятся к повышению содержания кислот и, следовательно, снижению рН. Однако при развившемся кариесе изменения состава слюны могут быть отнесены за счет распада зубной ткани. В связи с этим трудно проанализировать данные А. А. Соленовой (1966), Б. В. Котомина (1970), Б. П. Лисовецкого (1972) и др., установивших при кариесе изменение органических и неорганических компонентов ротовой жидкости.
Предполагаемые механизмы влияния локальных изменений свойств и состава зубного налета и ротовой жидкости на твердые ткани зуба состоят в том, что зубной налет может играть роль полупроницаемой мембраны, и растворы сахаров, имеющие высокое осмотическое давление, могут проходить через нее, контактируя некоторое время с поверхностью зуба. Микроорганизмы могут превратить эти углеводы в кислоты и до того, как эти кислоты будут нейтрализованы слюной, они могут вызвать деминерализацию эмали. На участках зубов рН зубного налета может быть значительно ниже критического для растворения эмали (Fosdick, 1963).
При определенных условиях (особенности питания, негигиеническое содержание полости рта и др.) на ограниченном участке поверхности или в складках эмали зуба в зубном налете суточной или большей давности рН снижается до критического уровня, который поддерживается длительное время или имеет интермиттирующий характер. Микроорганизмы зубного налета прочно оседают на поверхности зуба и в результате ферментативных процессов лизируют защитные органические оболочки зуба (пелликула, кутикула), используя ее как питательную среду. Таким образом, создается возможность непосредственного контакта кислот, образующихся в зубном налете, с минеральными веществами эмали.
Ионы Н+ в зоне длительного источника кислотообразования, соприкасаясь с апатитами, вызывают их растворение, которое может быть равномерным, если кислотообразование на поверхности эмали происходит достаточно активно, или неравномерным, если образовавшиеся кислоты частично нейтрализуются компонентами слюны. В силу того, что поверхностный слой эмали трудно поддается растворению (в нем больше фторапатитов), ионы Н+ по межкристаллическим пространствам попадают в подповерхностный слой, где вызывают деминерализацию. Проникновение ионов Н+ возможно в те участки подповерхностного слоя эмали, где призмы доходят до поверхности, и невозможно там, где поверхность эмали образована беспризменным слоем. В последнем случае, если деминерализация и происходит, то по типу растворения поверхностного слоя эмали.
Основными путями проникновения Н+ служат межпризменные микропространства. При этом частично растворяются кристаллы и расширяются межпризменные микропространства. В подповерхностном слое частичная деминерализация происходит также в менее резистентных участках (поперечная исчерченность призм, полосы Ретциуса, межпризменные микропространства). Освободившиеся ионы кальция, фосфора и других элементов через возникшие микропространства выходят в ротовую жидкость. Зона деминерализации распространяется параллельно поверхности зуба, так как концентрация Н+ поддерживается за счет кислотообразования на поверхности эмали. Глубокое проникновение ионов в начале процесса невозможно потому, что по мере углубления они нейтрализуются в процессе деминерализации.
При интермиттирующем типе кислотообразования освободившиеся в процессе деминерализации ионы кальция могут вновь вступить в связь с апатитами эмали или образовать новые типы кристаллов. Если образование кислоты прекращается, ионы кальция, фосфора и др. из ротовой жидкости проникают в возникшие микропространства, где вступают в связь с апатитами или образуют аморфное вещество. Вслед за полным прекращением кислотообразования появившиеся микропространства, заполняются аморфным или кристаллическим веществом и органическим материалом (приостановившийся кариес). При продолжающемся образовании кислоты и процессе деминерализации микропространства постепенно увеличиваются. В них проникают «органические вещества и микроорганизмы, перенося источник кислотообразования внутрь деминерализованного участка. На этих стадиях деминерализация распространяется как параллельно поверхности зуба, так и внутрь (в целом по периферии активного центра, за исключением поверхностного слоя), образуя конусовидный очаг поражения.
Поверхностный слой над очагам поражения растворяется медленнее, чем эмаль глубоких слоев, не только вследствие устойчивости к растворению из-за наличия фторапатитов, но также из-за большей выраженности процессов реминерализации в нем. Однако при продолжении кислотообразования наступает период, когда и в поверхностном слое образуются микропоры, которые затем расширяются до макродефектов, или же наружный слой эмали истончается и проламывается. Далее происходит процесс деструкции, в котором протекают как деминерализация эмали, так и лизис органической субстанции микроорганизмами и продуктами их жизнедеятельности. По периферии центра деминерализации образуется зона гиперминерализации («защитный вал») за счет проникновения в нее освободившихся ионов кальция, фосфора и др. Зона гиперминерализации особенно выражена при приостановившемся кариесе. В очаге поражения может быть несколько таких зон.
Возможный механизм развития деминерализации поверхности эмали зуба под слоем зубного налета описал Fosdisk (1965). Он считал зубной налет органической полупроницаемой мембраной, через которую хорошо проникают сахара, имеющие высокое осмотическое давление, и сравнительно плохо ионы кальция и белковые соединения, так что на поверхности зуба может обеспечиваться длительный контакт глюкозы и кислот, которые из нее образуются.
Другое мнение заключается в том, что зубной налет возможно имеет отношение к протеолизису органической фракции эмали (Bodecker, 1968).
Lammers (1965) считает, что основная роль зубном налета в патогенезе кариеса состоит в создании потенциальной возможности возникновения дисбактериоза, в результате чего усиливается размножение разных видов гликолитических бактерий, которые ферментируют углеводы, снижая рН среды. По данным Stralfors (1957), в зубном налете имеется более 400 млн. микроорганизмов на 1 мг субстрата, что, по подсчетам Winkler, Backer и Dirks (1958), составляет по меньшей мере-70%1 объема зубного налета.
Таким образом, роль зубного налета и бактерий (фактор а) в возникновении и развитии кариеса зубов вполне очевидна. Состав флоры полости рта зависит от пищи, болезней организма и в значительной степени от интенсивности процессов самоочищения и применения искусственных средств гигиены зубов.
При неудовлетворительном очищении зубов от зубного налета и пищевых остатков на поверхности зубов, в первую очередь в ретенционных участках, образуется значительный слой (до нескольких миллиметров) бактериального зубного налета, в котором при условии размножения в основном кислотообразующих микроорганизмов и при наличии углеводистой питательной среды создается относительно высокая концентрация ионов водорода, вступающих во взаимодействие с апатитами эмали. Этому процессу могут способствовать или противодействовать состояние слюны, ротовой жидкости и пищевые остатки.
Кариесогенные свойства ротовой жидкости (фактор б). При патологии зуба в ротовой жидкости происходят определенные сдвиги, обеспечивающие, по-видимому, прогрессирующий характер патологического процесса. Однако в настоящее время, по мнению В. С. Куликовой (1971), еще нельзя ответить на вопрос о том, какие именно стороны трофического влияния слюны выпадают у лиц, страдающих кариесом.
5. Влияние различных факторов на зубной налет
5.1. Влияние антимикробных средств
Учитывая, что зубной налет представляет собой колонии микроорганизмов, не вызывает сомнений необходимость применения антимикробных средств для предотвращения его образования. Имеющиеся данные литературы указывают на высокую эффективность самых различных антибактериальных средств, применяемых в виде полосканий, эликсиров и зубных паст (Rolla, 1976; Saxen и соавт., 1976).
Кратковременное применение антибиотика канамицина в виде геля вызывает значительное снижение уровня бактерий Str. mutans и sanguis в зубном налете, собранном немедленно после применения геля; 14-месячный период применения канамицина-геля вызывает снижение прироста кариеса зубов на 46% (Loesche и соавт., 1977).
На выраженное ингибирующее действие на зубной налет антибиотика ванкомицина указывают De Paola и соавторы (1977), Jordan и De Paola (1977). Авторы исследовали на 268 детях в возрасте 9—11 лет влияние 3% геля ванкомицина на содержание Str. mutans в зубном налете и установили значительное снижение количества этого кариесогенного микроорганизма.
Аналогичным действием обладает 8-оксихинолин, применяемый в виде соли в растворе с концентрацией 4—5% (De Palma и соавт., 1976). Способность оксихинолина тормозить образование зубного налета наблюдалась в опытах in vitro и in vivo.
Большое число исследований было проведено по изучению влияния хлоргексидина и его производных на замедление процесса образования зубного налета (Loe, 1971; Gjermo и соавт., 1975). Благодаря своим бляшкоингибирующим свойствам хлоргексидин нашел широкое применение в профилактике кариеса зубов и пародонтопатии. Хлоргексидин обладает выраженным длительным антимикробным действием, низкой токсичностью и всасываемостью; аллергические реакции при использовании этого препарата крайне редки. Наиболее сильно хлоргексидин тормозит образование зубного налета в присутствии Actinornyces viscosus, Actinomyces naeslundii, Str. mutans (Evans и соавт., 1977).
Препарат обладает выраженным бактериостатическим действием по отношению к грамотрицательным бактериям, грибам, факультативным аэробам и анаэробам.
Минимальная бактерицидная и бактериостатическая концентрация для Str. mutans и Str. sanguis составляет 5 мкг/мл, для Str. salivarius — 2,5 мкг/мл.
При полоскании полости рта раствором хлоргексидина количество бактерий снижается на 70—80%. Оптимум действия хлоргексидина происходит при рН 6—8. Он стойко связывается с тканями полости рта и не разрушается при последующих полосканиях водой (Nagle, Turnbull, 1978). В механизме действия хлоргексидина важное место занимает его способность адсорбироваться на поверхности оксиапатита, что снижает адгезию бактериальных клеток к эмали (Rolla и соавт., 1970). Максимальное связывание препарата происходит через 15—30 с после полоскания. Минимальная эффективная концентрация хлоргексидина, влияющая на наддесневой зубной налет, составляет 0,2% (Nagle, Turnbull, 1978). В составе зубных паст хлоргексидин менее эффективен (Crousaz, 1978).
Полоскание полости рта растворами, содержащими антимикробное средство алексидин, вызывает уменьшение образования зубного налета и предупреждает развитие гингивита. Бляшкоингибирующим действием обладают соли йодной кислоты. Они обладают высокой окислительной способностью, влияют на грамотрицательные анаэробы и спирохеты. При лечении пародонтита солями йодной кислоты отмечается регенерация костной ткани, тормозится образование зубной бляшки (Keyes, Rams, 1984).
5.2. Изменения кровоснабжения пульпы зуба при заболеваниях пародонта
По данным большинства исследователей, микроциркуляторные изменения в тканях пародонта являются одним из решающих факторов в патогенезе заболеваний пародонта (Никитина Т. В., 1982; Ефанов О. И., 1982; Иванов B.C., Беликов П. П., 1985; Петрищев Н. Н., 2001; Орехова Л. Ю. и др., 2004), и предшествуют клиническим проявлениям заболеваний (Данилевский Н. Ф., Колесова Н. А., 1980; Файзиев И. и др., 1985).
По данным О. И. Ефанова (1982), B.C. Барковского (1984), A.M. Чернуха и др. (1984), К. Э. Оразова (1991), Н. К. Логиновой, Е. К. Кречиной (1998) и Л. Н. Воробьевой (2002) уже на начальных стадиях воспалительных заболеваний пародонта выявляются достоверное снижение газообмена по кислороду (при ХГКГ и ХГПлс в 1,2 и 2,16 раз соответственно), уменьшение числа функционирующих капилляров, сброс крови через артерио-венозные анастомозы, минуя капилляры, а также нарушение трофики тканей пародонта, обусловленное структурными и функциональными нарушениями системы микроциркуляции.
В патогенезе пародонтоза важную роль отводят тканевой и циркуляторной гипоксии (Колесова Н. А., Политун A.M., 1981). При пародонтозе в начальной стадии также уменьшается число функционирующих капилляров в тканях пародонта (Барковский B.C. и др., 1984), выявляется повышение тонуса сосудистой стенки, выявляются признаки функциональной недостаточности сосудов (Орехова Л. Ю. и др.. 2004).
В экспериментальных исследованиях на животных было выявлено, что при гингивите объемная скорость кровотока в десне увеличена, и снижена при пародонтите по сравнению с показателями нормальной десны (Файзиев И. и др., 1985).
Снижение скорости кровотока при заболеваниях пародонта в МНР пародонта, выявленное с помощью УЗДГ, отмечено в работах (Ореховой Л. Ю. и др., 1999—2004; Белоусова Н. Н., 2002; Кречиной Е. К., Рахимовой Э. Н., 2005).
Кровеносное русло пульпы зуба является частью микроциркуляторной системы зубодесневого комплекса, и зависит от кровоснабжения целого региона (Логинова Н.К:; 1970; Цымбалов О. В., 1992; Иванов B.C. и др., 2003). Об изменениях в пульпе зубов на ранних стадиях заболеваний пародонта в литературе существуют противоречивые сведения.
По данным некоторых исследователей как при заболеваниях пародонта как начальных (Зюзьков Д. И., 2004), так и развившихся стадиях (Mazer В., Massler. M, 1964) морфологических изменений в пульпе зубов не выявляется. Однако, большинство исследований, как более ранних, так и более поздних лет (Вайс СИ., 1959; Варшавский Л. II, Левин В. Н., 1973; Фролова Т. А.,1975; Ковалев Е. В., Савин В. Р., 1987; Vandenwijngaert S., Vanlcrberghe К.,2000; Ghoddusi J., 2003; Чурилов Н. Н. и др., 2006; Deva V. et. al., 2006) свидетельствуют о нарастающих изменениях сосудов пульпы зуба, при прогрессировании заболеваний пародонта.
Развившиеся стадии заболеваний пародонта приводят к реактивной перестройке тканей пульпы, которые выражаются в дегенеративно-деструктивных изменениях всех элементов пульпы зуба, в том числе сосудов (происходит редукция части капилляров, накопление в ткани пульпы плазматических клеток, денервация и локальное повреждение миелиновых оболочек нервных волокон, разрушение сосудистой стенки гемоциркуляторного русла с выходом и распадом эритроцитов). Генерализованный пародонтит часто сопровождается процессами нарушения минерального обмена в самой ткани пульпы зуба, что выражается в появлении петрификатов. Все это может приводить к гибели клеточных элементов пульпы и отростком одонтобластов (Зельтцер С., Бендер И., 1971; Варшавский А. И., Левин B.C., 1973; Перькова Н. И., 1990; Цимбалистов А. В. и др., 2005). По данным некоторых исследователей (Зюзьков Д. И., 2004) в пульпе зубов у пациентов с пародонтитом средней и тяжелой степени тяжести в 100% случаев отмечаются необратимые изменения.
Морфологическими исследованиями показано, что уже при начальных стадиях заболеваний пародонта обнаруживаются изменения микроциркуляции крови в пульпе, проявляющиеся в уменьшении диаметра артериол, фрагментарном сужении артериол и прекапилляров, появлении извилистости микрососудов, спазме артериолярных и прекапиллярных сфинктеров, изменении анастомозов, увеличении диаметра венул, просветов венуловецулярных анастомозов (Варшавский И. А., Левин В. Н., 1973). По данным Т. А. Фроловой (1975) наибольшие изменения выявляются в корневой пульпе, что автор связывает с анатомической близостью пораженного пародонта.
При пародонтите происходит также изменение реологических свойств циркулирующей в пульпе крови: увеличение вязкости крови, образование эритроцитарных агрегатов, «закупоривающих» главным образом, венулярные сосуды микроциркуляторного русла пульпы (Ковалев Е. В., 1986).
6. Роль зубного налета в развитии кариеса
Кариес зубов — одна из центральных и нерешенных проблем стоматологии. Это заболевание, несомненно, относится к так называемым болезням цивилизации. Его распространение, волны нарастания и спада тесно сопряжены с эпидемиологией других известных недугов человечества, распространившихся в эпоху индустриализации. Возможность ликвидации кариеса, видимо, связана с успехами в профилактике других заболеваний, достижимыми на основе всестороннего оздоровления внешней и внутренней среды организма. Судя по значительным сдвигам в структуре общей заболеваете и, регистрируемым в последнее десятилетие в ряде развитых стран, где перспектива в принципе реализуема не только теоретически, но и практически. Снижение смертности и частоты заболеваний сердечнососудистой системы идет параллельно уменьшению пораженности кариесом, Эти изменения происходят в странах с различными моделями общественного здравоохранения и оздоровительных программ.
Все сказанное относится частной проблеме — кариесу зубов. Так, комитет экспертов ВОЗ (1986), оценивая ситуацию, указывает на большие пробелы в наших знаниях о возможности эффективного предупреждения стоматологических заболеваний. Касаясь потребности в научных исследованиях, эксперты наряду с традиционными задачами впервые говорят о «необходимости разработки методов скрининга для идентификации групп высокого риска» развития кариеса. Эти рекомендации весьма актуальны для нашей страны. Задачи по предупреждению стоматологических заболеваний, поставленные перед обществом, должны решаться в реальных условиях ограниченности материальных и людских ресурсов. Поэтому идентификация групп и концентрация усилий на людях, первостепенно нуждающихся в предупредительной помощи, представляет собой медицински и экономически перспективный путь.
При остром течении кариеса С. Б. Ковязина (1974) установила существенное снижение активности лизоцима крови, паротидной и смешанной слюны. Меньше, чем у здоровых, количества лизоцима в крови и слюне больных кариесом обнаружил A. Cisowski (1973). Он отметил прогрессирование кариозного процесса, которому предшествовало уменьшение активности лизоцима в слюне. У детей в возрасте 3—6 лет, не страдающих кариесом, активность лизоцима слюны достоверно выше, чем у подверженных этому заболеванию (Twetman S. et al., 1981).
Обнаружен антибактериальный фактор слюны, не идентичный лизоциму, в присутствии которого лактобациллы и стрептококки утрачивают жизнеспособность. У людей, иммунных к кариесу, активность антибактериального фактора слюны выше, чем у подверженных кариесу (Marioka Т., 1966). Установлена отрицательная корреляция между активностью антибактериального фактора слюны и интенсивностью кариеса зубов. В сыворотке крови найдено вещество (альбумин), угнетающее активность антибактериального фактора слюны.
У больных с быстро прогрессирующим течением кариеса зубов существенно снижаются значения показателей неспецифической резистентности организма — активности лизоцима и щелочной фосфатазы, в крови и слюне, содержания в крови общего белка, альбуминов и α2-глобулинов (Сайфуллина X. М., 1979).
Лица с иммунной недостаточностью особенно часто поражаются кариесом зубов (Cole M. et al., I977).
Обнаруженное у больных острым кариесом резкое снижение количества секреторного IgA позволило С. Oprisin и соавт. (1973) рассматривать кариес зубов как заболевание, связанное с определенным дефектом иммунологической защиты организма. При обследовании 20 человек в возрасте от 8 до 58 лет, страдавших острыми формами кариеса зубов, выявлены гипопротеинемия, гипоальбуминемия, гипогаммаглобулинемия и повышенное содержание в крови нейраминовой кислоты, что свидетельствует об угнетении естественной сопротивляемости организма (Гусев Ю. С, 1970).
У детей с хроническими заболеваниями стрептококковой природы И. И. Гиниятуллин (1981) наблюдал интенсивный прирост кариеса зубов на фоне достоверного понижения активности лизоцима крови, содержания в ней пропердина и фагоцитарной активности лейкоцитов.
Клинические материалы, подтверждающие существование зависимости развития и течения кариеса зубов от состояния неспецифической резистентности организма, представлены также А. X. Грековым (1981), В. В. Гунчевым (1982), В. В. Старец (1982), Г. И. Червяковой (1984).
Приведенные данные не оставляют сомнений в существовании зависимости устойчивости зубов к кариесу от состояния естественной сопротивляемости организма. Механизмы реализации такой зависимости неодинаковы. Они определяются тем, в какой мере естественная сопротивляемость организма отражается на состоянии местного иммунитета полости рта, составе и свойствах эмали зубов и ротовой жидкости (слюны).
Действие факторов местного иммунитета полости рта, как правило, отражающих состояние естественной сопротивляемости организма, понижено у больных, подверженных кариесу зубов. Это доказано в отношении активности лизоцима и содержания секреторного IgA в слюне.
Следует иметь в виду, что признаки ослабленного местного иммунитета могут иметь место и при высокой неспецифической резистентности организма. Такое положение может наблюдаться при негигиеничном содержании полости рта, при незапломбированных дефектах в зубах, пораженных осложненным и неосложненным кариесом, при обильных зубных отложениях, поражениях десневого края и др.
У людей с ослабленной естественной сопротивляемостью организма ускорено образование мягкого зубного налета. Установившая этот факт 3. А. Ярошкина (1984) показала, что в зубном налете таких людей преобладают кариесогенные штаммы стрептококка. По данным Brown и соавт. (1979), в зубном налете детей с врожденными иммунодефицитами преобладают кариесогенные микроорганизмы.
Резистентность самого поверхностного слоя эмали зуба к кариесу объясняется повышенным содержанием в ней микроэлементов: олова, цинка, железа и др. особенно фтора. При недостаточном поступлении в организм фосфатов, молибдена, ванадия резистентность зубов к кариесу снижается. Фтор, молибден, ванадий, стронций способствуют меньшей восприимчивости зубов к кариесу, воздействуя на состав и обмен зубного налета. Селен, наоборот, увеличивает возможность возникновения кариеса (Luoma, 1964).
Есть основание рассматривать поверхностный слой эмали, которая часто имеет беспризменную структуру, как кариесрезистентный, а призменную подповерхностную зону — как кариесвосприимчивую (Ripa, 1966; Tyler, 1976). Электронно-микроскопические исследования реплик поверхности эмали зуба показали, что кариесвосприимчивы те области, где на поверхность выходят призмы (Innos, Schroff, 1967).
Hodson (1949) отмечал, что эмалевая кутикула в некоторых местах (особенно в желобках и фиссурах) проникает в глубь эмали и является фактором снижения резистентности к кариесу этих участков.
Зубной налет снижает кариесрезистентность зубов, так как является источником микроорганизмов, очагом ферментации углеводов и образования кислот. Однако имеет значение обменная активность фосфатов в зубном налете, которая в кариесактивных областях отлична от таковой в здоровых участках эмали. В резцах нижней челюсти концентрация кальция больше, чем в других участках, покрытых зубным налетом и чаще поражаемых кариесом (Dawes, Jenkins, 1962; Ashley, Wilson, 1977). Среди органических компонентов зубного налета, влияющих на кариесвосприимчивость зубов, основная роль принадлежит углеводам (М. М. Персин, и др., 1971).
Таким образом, ни один из факторов, касающихся как химического состава, так и структурных особенностей эмали и поверхностных образований зуба, даже зубной налет не имеет однозначного толковании как бесспорный фактор кариесрезистентности или кариесвосприимчивости. В соответствии с современными данными следует считать, что кариесрезистентности зубов способствуют нормальный химический состав, оптимальное или слегка повышенное содержание фтора в эмали, полноценная ее структура с малым количеством ламелл, наличие пелликулы, отсутствие мягкого зубного налета. Кариесвосприимчивости благоприятствует пониженная минерализация эмали, низкое содержание фтора, высокое содержание углерода и селена, гипопластические структуры с большим количеством аморфных образований и ламелл, отсутствие пелликулы и беспризменного слоя, образование больших количеств мягкого зубного налета.
Устойчивость зубов к кариесу в немалой мере связана с составом и свойствами слюны. Слюна людей, подверженных кариесу и устойчивых к нему, оказывает неодинаковое влияние на эмаль зубов. У лиц, подверженных кариесу, слюна более вязкая, чем у здоровых, содержание кальция и фосфора в ней изменяется. Подобные изменения обнаруживаются в слюне при патологических состояниях (Максимовский K. М., 1980), дефектном питании (Frankell R., 1973) и других условиях, при которых зубы интенсивно поражаются кариесом.
Изучение состава и свойств слюны у детей с различной устойчивостью к кариесу при неодинаковом состоянии естественной сопротивляемости организма показало, что у детей, подверженных кариесу, содержание кальция в слюне стабильно снижается только при ослабленной сопротивляемости организма (Рединова Т. Л., 1982). У таких детей выявляется и низкое содержание фосфора в слюне. Важно отметить, что после медикаментозного воздействия путем введения внутрь оротата калия наряду с благоприятными изменениями показателей состояния неспецифической резистентности организма в слюне детей повышается содержание неорганических компонентов.
Приведенные данные позволяют считать, что состояние естественной сопротивляемости организма предопределяет как устойчивость зубов к кариесу, так и изменения в зубах и слюне, которые нередко рассматриваются как факторы, вызывающие кариес зубов.
Неопровержимые доказательства существования этиологической роли микроорганизмов в возникновении кариеса зубов получены в экспериментах на гнотобиотических животных, у которых кариес зубов не возникал, несмотря на длительное пребывание на кариесогенной диете (Orland F. et al., 1955; Keys P., 1960; Larsen R., Zipkin I., 1961; Fitzgerald L, 1963).
Вызывающее кариес действие микроорганизмов принято связывать с образованием зубной бляшки (Stephan R., 1953; Van Houte J., 1964; Carlsson V., Egelberg J., 1965; Van Houte J., Sanlou J., 1971). Зубная бляшка — это мягкий зубной налет, интимно связанный с поверхностью зуба. Он рассматривается как конгломерат, основу которого составляют микроорганизмы, фиксированные на полисахаридной строме, в различной степени пропитанной минеральными веществами. Мягкий зубной налет плотно прилегает к поверхности зуба и располагается над пелликулой зуба — тонкой приобретенной органической пленкой, невидимой невооруженным глазом.
На первых порах к приобретенной пелликуле прилипает монослой микроорганизмов (Frank R., Brendel A., 1966). На этот слой, пропитанный межбактериальным матриксом, наслаиваются новые слои бактерий (Selving K., 1969). Зубная бляшка двухдневного возраста почти сплошь состоит из микроорганизмов (McClure F., 1981). Матрикс мягкого зубного налета состоит из полисахаридов, протеинов и в меньшей степени липидов.
Особое место в структуре матрикса мягкого зубного налета придается декстрану — полисахариду, продуцируемому бактериями, составляющими около 70% твердого остатка зубной бляшки. При этом немаловажно, что декстран образуется стрептококками, главным образом из сахарозы (Carlsson V., 1967).
Современный уровень научных знаний не допускает сомнений в том, что начальные этапы кариозного процесса в эмали связаны с ее деминерализацией. Последняя является результатом непосредственного воздействия на поверхность зуба органических кислот, продуцируемых микробами зубной бляшки, что показано многочисленными исследованиями.
Несмотря на некоторые расхождения в оценке самого механизма деминерализации эмали при кариесе зубов, бесспорно, то, что этиологическим фактором выступают микроорганизмы полости рта.
При наличии ряда кариесогенных воздействий (значительное количество сахарозы в пище, присутствие в слюне специфических протеинов, вызывающих агглютинацию микробов и их адгезию к эмали) эти микроорганизмы образуют налет на поверхности зуба. Продуктами жизнедеятельности микрофлоры зубного налета в свою очередь являются различные кариесогенные факторы: органические кислоты, хелаторы (пептиды, аминокислоты), ферменты. Их образование в значительной степени стимулируется наличием легкоферментируемых углеводов в пище.
В образовании зубной бляшки и развитии кариеса большое значение имеют факторы ротовой среды, создающие условия для микробного обитания. Среди них важная роль отводится плохому гигиеническому уходу за зубами, что способствует накоплению мягкого налета с последующим образованием на зубах микробной бляшки.
Было установлено, что различные физиологические и патологические состояния организма отражаются на буферной системе и ферментной активности слюны. Имеющийся в слюне термолабильный фактор проницаемости определяет интенсивность включения в эмаль ионов кальция и фосфора. Изменением его концентрации в слюне регулируется поступление минералов в эмаль.
В полости рта имеются достаточно благоприятные условия для развития и размножения микрофлоры: обилие влаги (слюна), отсутствие света, рН, близкий к нейтральному, пищевые остатки в виде углеводистых и белковых продуктов распада, постоянная оптимальная температура. У кариесвосприимчивых лиц обильно размножаются молочнокислая флора и стрептококки, что способствует развитию кариеса зубов. Размножение этих бактерий при недостаточном гигиеническом уходе за полостью рта ведет к разложению (брожению) пищи и образованию кислот — молочной, уксусной, пировиноградной и др. В этих условиях с каждым глотком пищи или слюны человек заглатывает огромное количество микроорганизмов, которые могут найти благоприятную почву для размножения в различных отделах желудочно-кишечного тракта. Чем больше во рту микробов, тем больше поступает их в желудочно-кишечный тракт. Если в здоровом желудке многие микроорганизмы погибают, то при его заболеваниях, сопровождающихся ахилией, многие микроорганизмы размножаются и затем поступают в кишечник, где всегда находят благоприятную почву для еще более интенсивного размножения. Известно, что некоторые заболевания кишечника обостряются вследствие попадания из полости рта микроорганизмов. Хроническая интоксикация организма усугубляет развитие патологии в пищеварительном тракте, а это в свою очередь неблагоприятно сказывается на состоянии полости рта — получается замкнутый круг. При прочих равных условиях люди с неухоженной полостью рта более подвержены различным общим заболеваниям.
Микроорганизмы полости рта, кроме того, могут аспирироваться, что приводит к развитию заболеваний бронхов и легких. При плохом гигиеническом состоянии полости рта в ней имеется много вязкой слизи, что значительно затрудняет процессы самоочищения зубов и слизистой.
Вследствие сообщения полости рта с внутренним ухом через слуховую трубу проникновение микроорганизмов или продуктов их жизнедеятельности может повести также к заболеванию органа слуха.
Микроорганизмы полости рта в обычных условиях обладают пониженной вирулентностью, однако при каких-либо неблагоприятных условиях (изменения питания, рН слюны, температуры и др.) они могут явиться причиной патологии. Пониженная вирулентность болезнетворных микробов объясняется физиологическим симбиозом их с мало патогенными или совсем непатогенными микроорганизмами. Нарушение этого симбиоза в результате указанных выше изменений приводит к развитию патологии, например кариесу зубов. При этом установлено, что некоторые микроорганизмы начинают вырабатывать кислоту в больших количествах, чем в естественных физиологических условиях полости рта.
При некоторых общих заболеваниях титры микроорганизмов в полости рта повышаются, что может привести к распространению этого заболевания при разговоре, кашле. Кроме того, микроорганизмы могут попасть к другому человеку через общую зубную щетку или в случае пользования общей посудой при приеме пищи. Таким образом, необходимость ухода за полостью рта очевидна.
Частицы пищи, которые остаются в фиссурах и межзубных промежутках, с помощью микроорганизмов быстро подвергаются брожению. Образующиеся при этом кислоты могут растворять минеральный компонент эмали, особенно в тех местах, где пищевые остатки соприкасаются с поверхностью зуба и где они дольше задерживаются. При одновременном соответствующем воздействии эндогенных факторов на зуб может произойти разрушение его тканей.
Различия между отдельными людьми обусловлены, с одной стороны, тем, что унаследовано ими от родителей, а с другой — влиянием окружающей среды. Таким образом, взрослый индивидуум представляет собой продукт сложного взаимодействия двух факторов — наследственности и среды.
Под окружающей средой подразумевается любое воздействие на плод с момента зачатия, а затем на индивидуум извне. Самые первые влияния окружающей среды на человеческий организм проявляются еще во внутриутробном периоде: питание плода зависит от веществ, которые поступают с кровью беременной. В результате недостаточного или неправильного питания будущей матери в определенной степени страдает и ребенок, у которого возможно замедленное созревание костей и зубных тканей. На плод может оказывать влияние даже психическое состояние будущей матери.
На состояние зубов человека в значительной мере влияет питание. Однако нередко при одинаковом питании у одного ребенка развиваются резистентные к кариесу зубы, а у другого — кариесвосприимчивые. В этой связи многими исследователями было установлено, что определенную роль в правильном формировании твердых тканей зуба в антенатальном и постнатальном периодах играет также генетический код. Р. С. Кочиев (1971) показал, что своеобразие зубного комплекса, характерное для различных народов, объясняется происхождением народности, генетическими процессами, обусловленными в основном эндогамией и экзогамией, культурно-бытовой обособленностью. Эти факторы обусловливают особенности формирования и созревания зубов. Подтверждением этого служат также исследования Н. М. Данилкович (1971). Автор, изучая особенности прорезывания постоянных зубов у детей, отметил отчетливую акселерацию двух групп детей по сравнению с их сверстниками, жившими в 1927—1930 гг. «В последние годы широкое распространение в одонтологии получила выдвинутая Butler (1939) и развитая Dahlberg гипотеза морфогенетических полей, согласно которой структура зубов определяется генным контролем, распространяющимся частично на всю зубную систему в целом, частично — на отдельные классы зубов. Предполагается, таким образом, наличие ряда полей или «сфер влияния генов», причем одни поля обладают более широкой областью действия и определяют общие признаки (гистологические, биохимические особенности, общие размеры), а другие имеют более ограниченные сферы действия, определяя развитие признака в пределах одного класса зубов. Общие и классспецифические поля сложным образом взаимодействуют друг с другом. Соседние классспецифические поля также могут «накладываться» одно на другое, давая морфологический эффект уподобления зубов одного класса зубам соседнего класса. Внутри класса имеется область наиболее интенсивного действия поля, где при формировании признака наблюдается максимальная экспрессивность гена и признак получает наиболее полное, совершенное выражение. Эта область называется полюсом морфологического поля, а находящийся в ней зуб, обладающий по целому ряду признаков наиболее высоким уровнем дифференциации (и потому, в частности, выглядящий наиболее консервативным с филогенетической точки зрения), получает в терминологии наименование ключевого зуба данного класса. Полюсы морфогенетических полей большей частью находятся у мезиальной границы каждого класса, вследствие чего расположенные там зубы чаще всего являются ключевыми, или, как их еще называют, стабильными в отличие от вариабельных зубов, располагающихся, как правило, в дистальных отделах класса, где морфогенетическое поле слабее и выраженность большинства признаков теряет четкость по мере удаления от полюсов. Вариабельные зубы в первую очередь подвергаются редукции, т. е. характерному для эволюции зубов человека процессу сокращения размеров, а также уменьшения или полного исчезновения некоторых структурных элементов. Ключевые зубы каждого класса мало подвержены редукции и обычно сохраняют высокий уровень дифференциации. Редукция, проявляясь у разных индивидуумов в разной степени, сильно увеличивает разнообразие возможных морфологических вариантов зубов. Для каждого класса существует свой ряд редукции — дифференциация, т. е. характерный «спектр» наблюдающихся форм от высокодифференцированных до сильно редуцированных. Для вариабельных зубов этот ряд богаче формами, чем для ключевых (А. А. Зубов, 1968). Исходя из этой трактовки, можно наряду с учетом прочих объяснить симметричность поражения зубов кариесом у отдельных лиц.
В. Р. Окушко (1971) обнаружил, что у спортсменов высокой квалификации пораженность зубов кариесом ниже, чем у других лиц. Автор относит гиподинамию к факторам, снижающим резистентность зубочелюстной системы к патологии. Механизм снижения резистентности автор объясняет «морфологической незрелостью систем жевательного аппарата и их инфантильностью, развивающейся из-за несоответствия стабилизированной генетической программы развития фактическим темпам развития, продиктованным акселерацией. Это обстоятельство определяет высокую ранимость зубочелюстной системы в отношении патогенных воздействий, провоцирующих рассматриваемые заболевания. Особенно очевидна такая связь между преждевременным прорезыванием зубов, незрелостью их тканей и кариесом».
Зубы современного человека подвержены постепенному изменению. Создание совершенных орудий труда влияло на органы человека, так как уменьшало физические усилия, изменяло само содержание труда. В частности, уменьшалась гимнастика жевательных мышц вследствие того, что частично отпала необходимость разрывания, раскусывания и интенсивного жевания сырых продуктов питания. Это вело к изменениям зубов, которые закреплялись у потомства, далее еще более прогрессировали и опять закреплялись. Зубы современного человека, таким образом, прошли многочисленные стадии эволюции.
С изменением функции зубов изменились форма, размер, строение и функция челюстей. Для зубов современного человека характерны потеря массивности, прочности и веса, слабое укрепление в альвеолярных отростках челюстей и, наконец, тенденция к редукции и исчезновению зубов мудрости, которые превратились по существу в рудиментарные органы.
Важное значение для правильного формирования и созревания твердых тканей зуба имеют географические и социально-бытовые (экономические) факторы. Наряду с изменениями формы и размеров зубов человека меняются структура и состав их тканей. Основным фактором, влияющим на этот процесс, который нас интересует с точки зрения профилактики кариеса зубов, является тенденция к медленному созреванию зубов, что ведет к развитию кариеса. Как известно, многие общие заболевания начинаются в полости рта или ее состояние способствует их развитию (туберкулез, актиномикоз, остеомиелит челюстей и др.). А. Б. Изачик указывал, что «главным источником заражения туберкулезом являются больные зубы и плохой уход за ними».
Дурной запах выдыхаемого человеком воздуха чаще всего зависит от состояния полости рта. Как известно, запахи небезразличны для жизнедеятельности человека. Они оказывают определенное влияние на функции человеческого организма. Приятные запахи усиливают выделение слюны и деятельность желудочных желез, возбуждают аппетит. Неприятные же запахи вызывают различные отрицательные реакции, приводят к тошноте, рвоте, обмороку и даже заболеванию. Еще П. Г. Дауге (1933) подчеркивал, что в результате вдыхания воздуха из полости рта, в котором имеются больные зубы, происходит хроническое отравление организма. Он писал, что «запущенный рот является величайшим социальным злом».
Разрушенные зубы являются причиной многих заболеваний, так как инфекция из таких зубов разносится во многие органы; она также может способствовать аллергизации организма и является очагом хронической одонтогенной инфекции (А. С. Рабинович, 1960; М. П. Жаков, 1961; Г. Д. Овруцкий и др., 1967). При этом надо учитывать чрезвычайно разветвленную сеть сосудов, отходящих от челюстно-лицевой области (в том числе и к мозгу).
Лечение разрушенных зубов (кариес, пульпит, периодонтит) иногда в общей сложности отнимает у больного и врача больше времени, чем какая-либо операция. Однако оно является профилактикой тяжелых болезней, от которых порой зависит жизнь больных.
Стоматологами замечено, что болезни зубов развиваются чаще всего в тех случаях, когда не проводится достаточного гигиенического ухода за полостью рта. Во рту у таких людей находятся сравнительно большие количества разнообразной микрофлоры; микроорганизмы постоянно заглатываются, что в свою очередь отрицательно влияет на состояние желудочно-кишечного тракта и может приводить к его заболеваниям.
Как показали экспериментальные исследования, проведенные на гнотобиотических животных, для развития кариеса обязательным моментом является присутствие микроорганизмов. Введение per os стрептококков стерильным животным приводит к образованию типичного кариозного поражения зубов. Однако не все стрептококки в одинаковой степени обладают способностью вызывать кариес зубов. Доказано, что лишь некоторые штаммы этих микроорганизмов обладают повышенной способностью образовывать зубной налет и вызывать поражение зубов. Главным биохимическим отличием кариесогенных стрептококков является их способность синтезировать большое количество экстрацеллюлярных желеобразных полисахаридов, в частности декстрана, а также выраженная способность ферментировать сахарозу и другие углеводы с образованием молочной кислоты. Кариесогенные микроорганизмы синтезируют декстраны только из сахарозы, поэтому у хомяков, содержащихся на диете с глюкозой, кариесогенные микроорганизмы не в состоянии вызвать образование зубного налета и кариес моляров.
Fitzgerald, Keyes выделили 2 типа стрептококков хомяков (HS-штаммы) и крыс (FA-штаммы), обладающих кариесогенным действием.
Авторы показали, что выделенные штаммы стрептококков отличаются от классического описания стрептококков и занимают промежуточное положение между кишечной и молочной группами этого рода. Серологически HS- и FA-штаммы отличаются и не могут быть идентифицированы ни с одной из групп стрептококков, классифицированных по Lancefild. Gibbons и соавторы, наоборот, указали на перекрестные серологические реакции HS- и FA-штаммов. Необходимо подчеркнуть, что обе группы микроорганизмов культивировались на глюкозном бульоне и ферментировали маннит, сорбит, инулин, салицин, эскулин и трегалозу, включая р-фруктофуранозидазную часть рафинозы. Эти микроорганизмы образуют также неклеточные полисахариды из сахарозы.
Главным внеклеточным полисахаридом HS-штамма является декстран, тогда как FA-штамм синтезирует леван и декстран. HS- и FA-штаммы стрептококком выделены из зубного налета и из содержимого кариозных полостей зубов человека.
Guggeheim исследовал кариесогенность различных биотипов стрептококков, используя метод относительного гнотобиоза. Результаты его наблюдений представлены в табл. 1.
Таблица 1.
Кариесогенная активность стрептококков у гнотобиотов.

Кариесогенными свойствами обладают все штаммы Str. mutant. Кариесогенность Str. sanguis выражена в очень сильной степени. Sir. salivarius не вызывает кариозного поражения. Из 24 штаммов этого вида стрептококков лишь немногие образуют фиссурный кариес — ранее кариес эмали. Причиной этого является, по-видимому, то обстоятельство, что эти микроорганизмы синтезируют в качестве главного полисахарида леван, растворимый в воде и поэтому неспособный фиксировать их на поверхности зубов. Кроме упомянутых видов, имеется ряд промежуточных форм стрептококков, которые также способны образовывать кариозное поражение. Экспериментальные исследования показали, что HS- и FA-штаммы стрептококков идентичны Str. mutans, описанному впервые в 1924 г. Clarke. Они обладают одинаковой ферментативной способностью в отношении ряда углеводов, все они синтезируют на 5% сахарозном бульоне нерастворимый декстран, который образует гель. Наряду с нерастворимым декстраном они образуют и растворимый леван. Str. mutans толерантен к бульону, содержащему 4% раствор натрия хлорида.
Gehring и соавторы изучали степень пораженности зубов кариесом и частоту наличия Str. mutans в мягком зубном налете у двух групп больных в возрасте 8—17 лет с различным типом питания. В 1-й группе детей употребление сахара и сладостей было сильно ограничено, во 2-й группе дети употребляли сахар и сладости, как обычно. Результаты исследования показали, что кариес зубов и наличие Str. mutans в зубном налете у детей с ограниченным потреблением сладостей были намного ниже.
Street и соавторы исследовали содержание Str. mutans в зубном налете, взятом с различных поверхностей второго нижнего моляра у детей. Авторы установили, что между наличием Str. mutans и кариесом зубов на жевательной и апроксимальной поверхностях зубов существует корреляция. Предпочтительная локализация Str. mutans на какой-либо поверхности зуба не выявлена, однако установлена достоверная зависимость между кариесом на жевательной и апроксимальной поверхности зубов и Str. mutans. Rogers высевал Str. mutans из зубного налета кариозных и гладких интактных поверхностей зубов. В первом случае частота высевания стрептококка составляла 92%, во втором — 26%.
Ranke и соавторы показали, что Str. mutans наиболее активно, по сравнению с остальными стрептококками, образует молочную кислоту. Авторы показали, что наряду со Str. mutans кариесогенными свойствами обладают и гемолитические стрептококки.
Zahradnik и соавторы наблюдали деминерализацию эмали зубов под влиянием Str.mutans. Авторы отметили, что пелликула слюнного происхождения обладает защитным действием, обусловленным, но всей вероятности, избирательной проницаемостью пелликулы. Аналогиям данные еще ранее были получены Hoffmann и соавтор (1973), которые, используя сканирующую микроскопию регулируемым увеличением до 100 000, доказали роль стрептококков и лактобацилл в формировании начальных форм кариеса зубов. Основываясь на большом экспериментальном и клиническом материале, подтверждающем этиологическую роль Str. mutans в развитии кариеса зубов, Woods (1971) предложил тест восприимчивости к этому заболеванию, основанный на обнаружении Str. mutans в материале зубного налета человека. Следует отметить, что в развитии кариеса зубов принимают участие, кроме этого, также и ряд других микроорганизмов. Mikkeisen и Paulsen (1976) полагают, что главным, если не единственным, параметром, характеризующим микрофлору зубного налета при кариесе зубов, является соотношение аэробных и анаэробных микроорганизмов.
Данные микробиологического исследования послужили основанием для обсуждения вопроса об иммунитете к кариесу зубов.
Boweden и Hardy выделили 5 типов Str. mutans — А, В, С, D и Е, которые неравномерно распределены среди населения земного шара. Авторы показали избирательную адсорбцию Str. mutans на поверхности зубов, его способность прочно фиксироваться в первичном очаге и в то же время распространяться на другие поверхности зуба. Перед развитием кариозного поражения 30% всей микрофлоры зубного налета составляют Str. mutans. Ряд микроорганизмов, в частности Str. sanguis (при первоочередном его введении стерильным животным), тормозит развитие кариеса зубов. Необходимо отметить, что восприимчивость к кариесу зубов зависит не только от присутствия кариесогенных штаммов микроорганизмов, так как при одинаковых условиях эксперимента одни крысы поражаются кариесом зубов, а другие нет.
После атаки сахаром рН снижается, в то время как бактерии налета превращают сахар в кислоту. В течение минут рН налета снижается до 4,0 или ниже. Пока рН налета остается в кислотном диапазоне и жидкости налета недонасыщены по сравнению с минералами зуба, происходит деминерализация. Нейтрализация кислот налета системой щелочного буфера в слюне может происходить на протяжении двух или трех часов. Как только кислоты налета нейтрализуются, может происходить реминерализация.
Величина рН, при которой происходит деминерализация или реминерализация зависит от концентрации кальция и фосфора в слюне и жидкости налета. Когда рН на поверхности эмали снижается, налет становится недосыщенным по отношению к минералам зубных тканей, что приводит к вымыванию их из эмали. Когда рН повышается, налет становится пересыщенным по отношению к минералам зубов, результатом чего является переход этих ионов из эмали в деминерализованные места.
Проницаемость твердых тканей зуба имеет большое значение для физиологии этого органа, поскольку обеспечивает процесс реминерализации и созревания эмали. В еще большей степени проницаемость важна в патогенезе кариеса зубов. Многочисленные данные литературы свидетельствуют о том, что при кариесе зубов весьма существенно возрастает проницаемость эмали по отношению как к минеральным, так и органическим веществам (П. А. Леус, 1977). Важнейшим фактором, определяющим повышение проницаемости эмали, является зубной налет. Детальное исследование его влияния на проницаемость твердых тканей зуба провел В. Н. Чиликин (1979) в экспериментах на собаках с использованием метода макроавторадиографии с пластмассовыми каппами, надеваемыми на зубы. Автор доказал, что в участках контакта зубного налета с эмалью проницаемость эмали и дентина для радиоактивного лизина повышается (табл. 1). Как видно из представленных данных, кариесогенный зубной налет увеличивает проницаемость твердых тканей зуба на 82%, то есть в 1,8 раза. В присутствии сахарозы зубной налет увеличивает проницаемость твердых тканей зуба в 2,8 раза.
Установлено, что раствор сахарозы также обладает способностью увеличивать проницаемость, главным образом дентина.
Некоторые авторы изучали эмалерастворяющие свойства зубного налета человека. Для этой цели разработан оригинальный способ оценки растворения эмали путем использования радиоактивной (по 45Са) порошкообразной эмали зубов человека. Инкубация такой эмали в присутствии зубного налета, фосфатного буфера и глюкозы приводит к растворению минеральной части эмали, последовательно возрастающему со временем. Результаты исследования свидетельствуют, что кислотообразующие и эмалерастворяющие свойства зубного налета не являются равнозначными показателями, поскольку эмалерастворяющие свойства определяются не только наличием кислот, но и других соединений, способствующих растворению оксиапатита (хелаторы, ферменты и т. д.).
Результаты исследований последних лет показали, что под воздействием микроорганизмов, находящихся на поверхности зуба, в эмали возникают такие же изменения, как и при кариесе. Использование модели «искусственный рост» позволило установить, что ряд микроорганизмов и в первую очередь стрептококки обусловливают процесс деминерализации в условиях эксперимента.
В настоящее время установлено, что без микроорганизмов кариес не возникает. Выше говорилось об опытах Orlander и соавт. в 50-х годах, когда у молодых крыс, содержащихся на кариесогенном рационе, но в стерильных условиях, кариес не возникал, тогда, как у животных контрольной группы зубы были поражены. В литературе имеются данные экспериментальных исследований, согласно которым применение антибиотиков значительно снижает поражаемость зубов кариесом. Установлено также, что у детей, длительное время применяющих антибиотики по каким-либо медицинским показаниям, снижается интенсивность поражения кариесом. Этот факт, однако, нельзя трактовать как показание к применению антибиотиков с профилактической целью, так как эти препараты вызывают ряд нежелательных побочных эффектов.
Лактобациллы. Грамположительные микроорганизмы, продуцирующие кислоту, характеризуются устойчивостью к ней. Установлено, что у лиц с множественным кариесом в слюне содержится большое количество лактобацилл, которое уменьшается при пломбировании кариозных полостей. Наряду с этим отмечается их малое количество в зубном налете. На основании изложенных фактов был сделан вывод, что лактобациллы не играют ведущей роли в возникновении кариеса, но становятся более активными при наличии кариозной полости.
Стрептококки. Это грамположительные кокки. К кариесогенным видам относят Str. sanguis, Str. salivarius. В возникновении кариеса ведущая роль принадлежит Str. mutans. По данным некоторых авторов, в зубном налете 80—90% общего количества микроорганизмов составляют Str. mutans. Указано на прямую связь между интенсивностью кариеса и количеством микроорганизмов. Считают, что значительный рост числа представителей вида Str. mutans на определенных участках способствует прогрессирующей деструкции эмали.
В результате многочисленных исследований установлено, что в возникновении кариеса важную роль играют следующие свойства микроорганизмов: образование органических кислот и в первую очередь молочной как конечного продукта ферментации углеводов; продуцирование внеклеточного полимера глюкозы (гликана) из сахарозы; способность фиксации и роста микроорганизмов на твердых поверхностях (зуб, стекло, металлическая пластинка).
Указанными свойствами обладает Str. mutans и Str. sanguis, которым отводится наибольшая роль в возникновении кариеса.
Таким образом, кариес зубов — заболевание, этиологически связанное с действием микроорганизмов (St. mutans, St. salivarius, St. mitis). Патогенетические механизмы развития кариеса зубов зависят от состояния неспецифической резистентности организма, оказывающего влияние на способность микроорганизмов размножаться в полости рта и фиксироваться на зубах в виде мягкого зубного налета, а также влияют на состав и свойства слюны и твердых тканей зубов, их устойчивость к патогенному действию микроорганизмов и продуктов их жизнедеятельности.
Многочисленные данные литературы свидетельствуют о том, что зубной налет является одним из важных этиологических и патогенетических звеньев в развитии кариеса. Он локализуется в специфических местах зуба: ямках и фиссурах, на аппроксимальных поверхностях от десен до контактных пунктов и пришеечных областей. Изучение скорости образования зубного налета, рассчитываемой по его массе, образовавшейся на 1 зубе за 1 час (1 сутки), показывает, что в первые 4 часа наблюдается самая высокая скорость отложения зубного налета, в последующие 4 часа она существенно снижается и затем начинает постепенно увеличиваться, возвращаясь к 24 часам к исходному уровню.
Зубной налет наиболее интенсивно образуется в первые сутки, а в последующие дни скорость отложения существенно снижается. Обязательным условием является присутствие в полости рта микроорганизмов. Экспериментально доказано, что у гнотобиотических (безмикробных) животных никогда не образуется зубной налет и зубной камень.
Поданным световой микроскопии (Mandel, 1974), уже на ранних стадиях развития зубная бляшка по своей структуре напоминает ткани, так как состоит из клеток, межклеточного вещества и тканевой жидкости (происходящей, главным образом, из слюны). В раннем зубном налете (образовавшемся за время, меньшее 24 часов) присутствуют десквамированные эпителиальные клетки и лейкоциты, которые в зрелой бляшке (2—3 дневной), содержащей большое количество микроорганизмов, видны не так часто.
Зрелый зубной налет представляет собой сложное образование, в котором главную роль играют некальцифицированные бактериальные массы, тесно прилегающие к поверхности зуба. При ультраструктурном исследовании под слоем микроорганизмов видна пелликула, а между ними — межклеточный матрикс. В 1 мг зубного налета, по данным различных авторов, содержится от 5 до 800 млн. микробов. Они весьма разнообразны по составу.
Ацидофильные бактерии объединяют виды, способные развиваться в кислой среде, протеолитические микроорганизмы вырабатывают протеиназы.
В первую группу входят молочнокислые стрептококки, лактобактерии, актиномицеты, лептотрихии и коринебактерии. Причем стрептококки, актиномицеты и коринбактерии могут развиваться и в основной среде. Наиболее интересным видом молочнокислых стрептококков является Str. mutans в связи с его резко выраженными кариесогенными свойствами.
Среди ацидофильных бактерий зубной бляшки, взятой с кариозного поражения, 15% составляют нитевидные формы (актиномицеты, лактобациллы и лептотрихии).
Появление зубного налета начинается спустя несколько минут после образования безмикробной пелликулы и состоит из практически одновременной адсорбции на поверхности зуба протеинов, микроорганизмов и эпителиальных клеток. Через несколько дней зубной налет переходит в стадию зрелой зубной бляшки и представляет собой структурно сложное полимикробное образование толщиной до 200 мкм. На этой стадии он наиболее опасен для эмали зубов, поскольку продуцируемые патогенные факторы, такие как гидролитические ферменты (протеиназы, гиалуронидазы и др.) и различные органические кислоты (молочная, пропионовая уксусная и др.), могут вызывать растворение пелликулы, химическое разрушение и растворение эмали зуба. При этом зубной налет удаляется вместе с отторгаемыми частями зубной эмали. Однако в тех случаях, когда и зрелом зубном налете создаются условия анаэробиоза, происходит изменение состава микроорганизмов (смена аэробов анаэробами), снижение продукции кислоты и увеличение рН, накопление кальция и его отложение в виде фосфорнокислых солей, наблюдается переход зубного налета в стадию, которая называется зубным камнем.
Keyes (1962) считал, что патологический процесс при кариесе обусловливается взаимодействием триады, включающей в себя человека, микрофлору и пищу.
Зубной налет человека, содержащий микроорганизмы и некоторое количество пищевых субстратов, активизирует кариозный процесс, если не является его причиной. Инокуляция в полость рта зубного налета стерильным животным, содержащимся на кариесогенной диете, вызывает у них кариес (Keyes, 1962).
При кариесе происходит заметное снижение рН зубного налета в области поражения. Stephan (1940), Etherington и Trimble (1934) с помощью микроколориметрической техники измеряли рН зубного налета, который, по их данным, в области кариозного поражения составлял в среднем 5,2. Stephan (1944) отметил рН 5,0 кариесактивного зубного налета. М. Я. Берри (1948) путем измерения локального рН на поверхности кариозных зубов с помощью сурьмяных электродов установил, что концентрация ионов водорода при кариесе снижается по сравнению с нормой. Так, рН ниже 6,0 зарегистрирован в 13,6% случаев, 5,1—5,5 -в 14,3% и ниже 5,0 — в 5,7% случаев.
В кариозном очаге образуется главным образом молочная кислота (Fosdick et al., 1955), однако найдены и другие кислоты: уксусная, бутиловая, пропиоповая и другие, которые могут составлять 1/3—1/2 объема общей кислотности в очаге кариозного поражения (Fosdick, Wessinger, 1937; Neuwirthi, Summerson, 1951).
Устойчивость зубов к кариесу современные авторы ставят в зависимость от состава и свойств эмали, в частности ее поверхностного слоя. Способность твердых тканей зубов обновляться установлена А. А. Прохончуковым (1964). При понижении устойчивости зубов к кариесу, т. е. при подверженности этому заболеванию наблюдаются уменьшение содержания кальция в поверхностном слое эмали, повышение растворимости (Леонтьев В. К., 1978; Cutress L., Malthus M., 1970) и проницаемости этого наиболее минерализованного слоя эмали. Как известно, проницаемость эмали отражает уровень физико-химических процессов в этой ткани и способствует поддержанию ее гомеостаза (Боровский Е. В., Леус П. А., 1978, и др.).
Известно, что в гидроксиапатитах, являющихся основным минеральным компонентом эмали, молярное отношение Са/Р колеблется от 1,30 до 2,00 (Nhuman U., Nhuman M., 1961). При этом установлено, что чем больше отношение Са/Р превышает минимальное (1,30), тем выше способность гидроксиапатита противостоять действию кислот (Леонтьев В. К., 1978). С устойчивостью эмали к действию химических агентов, в частности кислот, некоторые авторы (Боровский Е. В., Леус П. А., 1977) связывают невосприимчивость зубов к кариесу. Установлено снижение содержания кальция в эмали зубов при кариесе и под влиянием воздействий, приводящих к интенсивному поражению зубов кариесом. У детей, страдающих ревматизмом, содержание кальция в эмали зубов снижено (Латышева О. Г., 1959), что особенно резко проявляется у детей, перенесших повторные атаки ревматизма.
Исследование поверхностного слоя эмали у детей, устойчивых и подверженных кариесу при неодинаковом состоянии неспецифической резистентности организма, не выявило существенных различий в содержании кальция и фосфора в поверхностном слое эмали (Рединова Т. Л., 1982). При повторном обследовании с интервалом в 12 мес. у детей с благоприятным состоянием резистентности организма, у которых кариес не развивался, отмечено накопление кальция в количествах, приводящих к существенному возрастанию коэффициента Са/Р. В то же время у детей с неблагоприятным состоянием резистентности организма, у которых имел место интенсивный прирост кариеса в стадии пятна, содержание кальция не увеличивалось и коэффициент Са/Р гидроксиапатита в поверхностном слое эмали не изменялся. Спустя 6 и 12 мес. после реминерализующей терапии у детей с благоприятным состоянием резистентности организма кальций накапливался в поверхностном слое эмали в достоверно большем количестве, чем у ослабленных детей. Прижизненное изучение растворимости поверхностного слоя эмали зубов показало, что растворимость эмали зубов особенно изменчива при кариесе (Кузнецов П. А., Дисталь В. А., 1980). Известно, что растворимость эмали значительно изменяется при воздействии такого общепризнанного противокариозного фактора, как фтор.
Убедительны данные о зависимости растворимости эмали зубов от функционального состояния пульпы (Малехин А. В., 1978; Донской Г. И., 1979; Окушко В. Р., Педорец А. П., 1980; Авсянкин В. И., 1982), с изменениями которого связывают устойчивость зубов к кариесу (Лукомский И. Г., 1955; Окушко В. Р., 1980). Такие свойства эмали зубов, как ее высокая твердость и низкая растворимость, в немалой степени определяющие устойчивость зуба к кариесу, обеспечиваются только при условии сохранения связи эмали зуба с пульпой.
У ослабленных детей понижена растворимость эмали зубов по фосфору. По данным Т. Л. Рединовой (1982), повторно исследовавшей зубы детей, устойчивых к кариесу, растворимость эмали зубов по фосфору при ослабленной резистентности организма достоверно меньше, а коэффициент Са/Р биоптата более высок, чем у детей с благоприятным состоянием неспецифической резистентности организма.
После медикаментозного воздействия на иммунобиологическое состояние организма, приводящего к благоприятным изменениям показателей естественной сопротивляемости, положительные изменения растворимости эмали зубов по фосфору, особенно отчетливо выраженные у детей с неблагоприятным состоянием неспецифической резистентности организма, выявила Т. Л. Рединова (1982).
Таким образом, растворимость эмали зубов — свойство, с которым связывают устойчивость зубов к кариесу, в значительной мере зависит от сопротивляемости организма. Изменения состава и свойства эмали зубов, зависящие от состояния естественной сопротивляемости, по-видимому, опосредуются в основном через пульпу зуба (Лукомский И. Г., 1948; Окушко В. Р., 1981). В пульпе животных, содержащихся на кариесогенных (с избытком сахарозы) диетах, накапливается гликоген (Galuzzo L., 1962). При этом нельзя исключить роль слюны, состав и свойства которой также зависят от состояния неспецифической резистентности организма.
Комплекс возрастных изменений эмали, обусловленных приобретением ею относительной устойчивости к кариесу, обычно обозначаю термином «созревание» (maturation). Этот процесс, тесно связанный с минерализацией, начинается задолго до прорезывания зуба. Момент его завершения точно указать нельзя. Исходя из общих представлений об инволютивных процессах, можно считать, что эти изменения длятся «всю жизнь» зуба. Тотчас после прорезывания минерализация протекает довольно быстро. Со временем наступает ее замедление почти до полного прекращения. Практически моментом наступления зрелости эмали следует считать то время, когда возрастные изменения в ней резко затормаживаются. В соответствии с видовой продолжительностью жизни это время созревания длится у крыс 12—15 дней, у собак — 12—15 мес., у человека — около 10 лет.
Какие же особенности зрелой эмали придают ей такое важное свойство, как устойчивость к кариесу? Ответ на этот вопрос призваны дат многочисленные лабораторные исследования, в которых сопоставляются структурные, химические и физические параметры ткани в возрастном аспекте.
Наиболее отчетливый признак созревания отражает общую для все минерализованных тканей возрастную тенденцию к максимальном обызвествлению. Так же как и в дентине и в костной ткани, в эмали происходит сначала быстрое, затем все более медленное замещение воды и органических соединений неорганическими солями. Последние представлены преимущественно кристаллами гидроксиапатитов (Costache, 1963). С возрастом увеличивается содержание в эмали и микроэлементов, включая фтор (Кодола Н. А., 1979).
Количественные изменения в концентрации химических элементов сопровождаются некоторыми качественными сдвигами. Установлено, что для эмали зрелого зуба характерна большая плотность кристаллической решетки. В зрелой эмали содержится значительно большее количество фторапатитоподобных кристаллов, которые менее растворимы в кислота), чем гидроксиапатиты (Пахомов Г. Н., 1968, 1976).
На большей части поверхности эмали детских зубов определяется призменная структура. Причем головки призм могут выступать над поверхностью эмали, лежать ниже или на одном с ней уровне, слегка контурируя. В последнем случае они придают эмали ячеистый вид. Наличие и призменных, и беспризменных участков усиливает вариабельность структуры, полиморфизм, что согласуется с данными А. В. Галюковой (1972).
Для эмали детских зубов более характерна ячеистая картина, когда центры головок призм представлены углублениями. Значительно реже, преимущественно на гребнях периким, встречаются выступающие над поверхностью головки призм.
Наиболее важное с точки зрения проводимого анализа наблюдение относится к пористости эмали. В последние годы исследователи уделяют все больше внимания этому явлению. Как показывают результаты исследования эмали в сканирующей электронной эмали (СЭМ), пористость на ее поверхности образуется за счет множественных углублений, образовавшихся на скате и дне перикиматий и процессе формирования эмали (Willson, Shroff, 1972; Schumacher, Schmidt, 1972). Кроме того, описаны темные отверстия диаметром до 2 мкм на поверхности беспризменных зон (Mijohi, Nacata, 1972) и поры на поверхности непрорезавшихся зубов (Grabb, 1976; Fejerscov, Jasephsen, 1984). Boyde и Wood (1969), обнаружив эмали усиливается зонами гипоминерализации в поверхностном слое. В ряде случаев кариес в стадии пятна обнаруживается гистологически (Окушко В. Р., Ручица Л. К, 1977; Feamhead, Kowasaki, 1982).
Зубы людей в возрасте 20—40 лет характеризуются меньшей рельефностью эмали по сравнению с детскими. Перикиматии стираются и сохраняются лишь частично, преимущественно в пришеечной области. Затем они вовсе исчезают. На контактирующих поверхностях зубов появляются фасетки стертости. Большая часть поверхности эмали зубов в зрелом возрасте беспризменная, призмы обнаруживаются лишь изредка на отдельных участках в основном пришеечной области и апроксимальных поверхностей. Беспризменные участки имеют мелкозернистую структуру, образованную кристаллами. Для зон с призменной структурой характерно возвышение головок призм над поверхностью эмали. Ни в одном случае не обнаруживается на интактной поверхности эмали микропор, встречающихся на детской эмали.
В возрастной группе 45—70 лет зубы отличаются значительной стертостью бугров и режущего края. В результате на контактных поверхностях, определяются фасетки стертости. Площадь их с возрастом увеличивается. Поверхность эмали в оптическом микроскопе выглядит относительно гладкой. Обнаруживается значительное число царапин, борозд, трещин. Большая часть поверхности беспризменная. В сканирующем электронном (микроскопе на отдельных зубах можно обнаружить призменные участки, причем головки призм выступают над поверхностью. Полосы и царапины нa зубе идут в различных направлениях. Трещины чаще располагаются на вестибулярной поверхности параллельно вертикальной оси зуба. Как правило, они заполнены гравиеподобными отложениями, аморфным веществом. Обнаруживаются также крупные кристаллы. Очевидно, заполнение трещин имеет защитный характер, предохраняя от разрушения глубокие слои эмали (Галюкова А. В., 1972).
Итак, выявленные методами интерференционного контраста и СЭМ основные закономерности возрастных изменений структуры поверхности эмали в значительной степени зависят от биологического возраста зуба. По мере созревания эмали снижается рельефность ее поверхности, характерная для детских и полуретинированных зубов, исчезают перикиматии. На зрелой эмали никогда не обнаруживается пористость, обусловленная ячеистой призменной структурой эмали и наличием ультрамикропор. Большая часть поверхности становится беспризменной. Таким образом, в результате возрастных изменений исчезает вариабельность структур.
7. Зубная бляшка
Зубная бляшка — скопление микроорганизмов различных типов, которые плотно фиксированы на матрице, расположенной на поверхности зуба.
Концентрация бактерий в единице объема зубной бляшки и их соотношение имеют значительные индивидуальные колебания, однако считают, что более 70% колоний составляют стрептококки, 15% — вейлонеллы и нейссерии и 15% вся остальная микрофлора.
В зубной бляшке большинство бактерий кислотообразующие, хотя имеются протеолитические бактерии, грибы (в первую очередь Candida albicans), дифтероиды, в том числе анаэробные бактероиды, фузобактерии и др.
Зубная бляшка начинает накапливаться уже через 2 ч после чистки зубов. В течение суток в налете преобладает кокковая флора, а затем она меняется. Первоначально образованный налет содержит анаэробные микроорганизмы, более зрелый — аэробные и анаэробные.
Установлено, что в механизме образования зубного налета и его фиксации на поверхности эмали важная роль принадлежит сахарам — моно- и дисахаридам, и микроорганизмам, в первую очередь Str. mutans, которые активно формируют зубной налет на гладких поверхностях зуба. Распространение зубного налета по поверхности зуба происходит от межзубных промежутков и десневых желобков.
На интенсивность развития зубного налета, кроме микроорганизмов полости рта и углеводов, влияют вязкость слюны, десквамация эпителия слизистой оболочки рта, наличие очагов воспаления в полости рта, характер самоочищения.
Зубная бляшка устойчива к полосканию рта, не смывается слюной, так как ее поверхность покрыта полупроницаемым мукоидным слоем, который в значительной степени препятствует нейтрализации очага снижения рН, образующегося по поверхности эмали. Она снимается при тщательной механической обработке зубной щеткой.
Содержание микроэлементов в зубной бляшке изменчиво. Однако установлено, что в поверхностном слое эмали наиболее высокие концентрации тех элементов, которые в значительном количестве содержатся в зубном налете: железо, цинк, фтор.
Особого внимания заслуживает фтор, противокариесное действие которого является бесспорным. Установлено, что содержание фтора в зубной бляшке может быть в десятки и даже сотни раз больше, чем в слюне. Важно, что концентрация фтора в зубном налете в значительной степени зависит от его содержания в питьевой воде.
Не вызывает сомнения, что зубная бляшка способствует возникновению кариеса. В эпидемиологических исследованиях установлена высокая зависимость между большим количеством зубного налета и развитием кариеса. Однако имеются факты, когда у отдельных лиц и этнических групп налета много, а кариеса нет. Клинические исследования показали, что кариесогенность углеводов уменьшается при длительном пережевывании пищи, что объясняют увеличением слюноотделения и нейтрализации образующихся кислот. Указывают также на зависимость кариесогенности зубной бляшки от содержания в ней минеральных компонентов: чем больше в ней кальция и фосфора, тем меньше ее кариесогенный потенциал. Не исключено также противокариозное действие фтора зубного налета, ингибирующего процесс кислотообразования бактериями.
Зубная бляшка начинает образовываться уже через 1—2 часа после чистки зубов, причем в динамике ее формирования происходят значительные изменения характера микробиоценоза. Общей тенденцией является изменение состава флоры от доминирования аэробных и факультативно-анаэробных форм, преимущественно кокков, к облигатно-анаэробным грамнегативным палочкам и извитым формам.
1-я фаза формирования зубной бляшки — первые 2—4 часа после тщательной чистки зубов. Она преимущественно состоит из кокков (стрептококки, нейссерии и стафилококки) и коротких палочек (лактобактерии). Это так называемая «ранняя» зубная бляшка.
2-я фаза — от 4—5 дней. Характеризуется уменьшением доли грампозитивных кокков и превалированием грамвариабельных нитевидных форм — лептотрихий, а также фузобактерий.
3-я фаза — от 6—7 дней и далее. Зубная бляшка принимает окончательный по составу симбионтов вид, хотя количественные сдвиги в ней происходят постоянно. Резко снижается количество аэробных видов — нейссерий, ротий, факультативно-анаэробных стрептококков. Доминируют грамнегативные облигатно-анаэробные бактерии ~ бактероиды, фузобактерий, вейллонеллы и грампозитивные — актиномицеты, микроаэрофильные стрептококки и пептострептококки.
Общее количество бактерий в зубной бляшке увеличивается от 90—100 в 1-ой фазе формирования до 1—10 млн. во 2-ой фазе. В 3-ей фазе формирования, в зависимости от многих факторов, количество бактерий исчисляется десятками и сотнями миллиардов в 1 г.
7.1. рН зубной бляшки и роль слюны в ее нормализации
Известно, что значение рН и буферные свойства зубной бляшки играют определяющую роль в характере ионообменных процессов эмали и вероятности развития кариеса зубов. В связи с этим изучение факторов, определяющих изменение рН зубной бляшки и механизмов его нормализации, является актуальной проблемой профилактической стоматологии.
Термин «зубной бляшка в состоянии покоя» применяется для определения значения рН бляшки через 2—2,5 часа после последнего приема углеводов. Термином «голодная» называют бляшку, которая не подвергалась экспозиции углеводов в течение 8—12 час.
При неизменных условиях рН бляшки остается стабильным, хотя существуют индивидуальные различия, а также различия между отдельными участками в полости рта. рН бляшки в состоянии покоя обычно лежит в пределах от 6 до 7. Голодная бляшка имеет рН от 7 до 8.
Зубная бляшка в состоянии покоя содержит относительно высокий уровень ацетата по сравнению с лактатом (Higham S.M., Edgar W.M., 1989).
Источники повышенного уровня ацетата в зубной бляшке:
— накопление конечных продуктов расщепления аминокислот;
— метаболическое расщепление резервов внутриклеточных и внеклеточных бактериальных полисахаридов;
— расщепление слюнных гликопротеинов.
Кислые продукты метаболизма в зубной бляшке содержатся в более высокой концентрации, чем в слюне. Задержке кислых продуктов в зубной бляшке способствует повышенная вязкость нестимулированной слюны.
Буферная емкость зубной бляшки определяется двумя видами буферных систем:
1. Местносинтезируемые буферные системы. К ним относятся аммиак, протеины и макромолекулы зубной бляшки. Преобладающие аминокислоты зубной бляшки — пролин и глютамат.
2. «Мигрирующие» буферные системы: фосфаты и бикарбонаты. Они поступают в зубную бляшку из слюны. Кристаллы фосфатов кальция присутствуют уже в молодой зубной бляшке. При накоплении кислых продуктов они могут растворяться, повышая буферную емкость бляшки и ее перенасыщенность ионами кальция и фосфора. Эти механизмы препятствуют деминерализации эмали. Чем выше содержание фосфата кальция в бляшке, тем ниже активность кариеса.
Наличие двух видов буферных систем приводит к тому, что рН «голодной» зубной бляшки нередко оказывается выше рН слюны.
7.2. Критическое и минимальное значение рН зубной бляшки
Изменения рН зубной бляшки, развивающиеся после поступления в полость рта углеводов, называют кривой Стефана.
Минимальное значение рН зубной бляшки — наименьшее значение рН кривой Стефана. Чем ниже минимальное значение рН, тем глубже кривая Стефана.
Минимальное значение рН бляшки и продолжительность снижения рН до минимальных значений определяется несколькими факторами:
— Сохраняются ли во рту легкоферментируемые углеводы или удаляются благодаря току слюны.
— Произошло ли снижение рН до значений, при которых нарушается функционирование бактериальных ферментативных систем.
— Большое значение имеет буферная емкость слюны, особенно, стимулированной, и самой зубной бляшки рН среды определяет концентрацию минеральных ионов, необходимую для создания перенасыщенности раствора, что является основным условием поддержания нормальною минерального состава эмали зуба. При снижении рН в кислую сторону степень минерализации раствора, необходимая для его перенасыщения, повышается. «Критический» уровень — значение рН, при котором слюна и бляшка теряют способность к перенасыщению кальцием и фосфатами. Утрата слюной и зубной бляшкой свойств перенасыщенного раствора создает опасность активной деминерализации эмали. Критическим уровнем рН зубной бляшки является значение 5,7. Снижение минимального значения рН ниже критического уровня создает условия для активной деминерализации эмали. Чем дольше значение рН остается ниже критического уровня, тем выше опасность развития кариеса.
7.3. Механизмы снижения рН зубной бляшки
Два основных фактора определяют степень снижения рН зубной бляшки:
— наличие экзогенных легкоферментируемых углеводов, обычно, сахаров.
— низкая буферная емкость нестимулированной слюны.
Кислотопродуцирующие бактерии зубной бляшки быстро ферментируют ряд углеводов до конечных кислых продуктов. После воздействия Сахаров (легкоферментируемых углеводов) на бляшку рН быстро снижается, достигая минимальных значений через 5—20 мин, а затем начинает медленно возвращаться к исходному уровню, полностью восстанавливаясь через 30—60 мин.
Снижение рН бляшки сопровождается накоплением в ее составе лактата (Geddes DA, 1972) При этом содержание ацетата в зубной бляшке снижается. Природа кислот в зубной бляшке имеет большое значение, поскольку они различаются по своей способности повреждать эмаль.
По мере падения рН содержание в зубной бляшке аммиака и аминокислот, имеющих щелочную реакцию, быстро снижается (Higham S.M., Edgar W.M., 1989). Это может быть связано с утилизацией азотистых материалов для анаболических реакций, которые стимулируются накоплением энергии, полученной в результате ферментации углеводов.
Механизмы повышения рН зубной бляшки
Постепенное повышение рН с возвращением к исходным значениям определяется многими механизмами:
1. Диффузия кислот из бляшки в слюну и в эмаль зуба.
2. Выработка щелочных продуктов в бляшке.
2.1. Главный щелочной компонент зубной бляшки — аммиак, щелочное вещество, нейтрализующее кислоты и способствующее повышению рН.
Механизмы образования аммиака в зубной бляшке:
— расщепление мочевины,
— дезаминирования аминокислот, особенно аргинина и аргининсодержащих пептидов. Дезаминирование одного моль аргинина приводит к освобождению одного моль аммиака.
2.2. Реакция декарбоксилирования приводит к накоплению в зубной бляшке аминов, также способствующих повышению рН. Реакция Стрикланда играет важную роль в повышении рН зубной бляшки. Она заключается в раскрытии кольца пролина при участии двух водородных ионов лактата. С одной стороны, расходуется лактат. С другой стороны, образующееся в результате реакции вещество DAVA имеет щелочную реакцию, обусловленную наличием свободной амино-группы (Curtis M.A., Kemp C.W., 1984).
Все перечисленные реакции имеют большое значение в ощелачивании зубной бляшки при умеренном употреблении углеводов, но недостаточно эффективны при частом приеме сахаров.
1. Глютамат является преобладающим типом аминокислот в зубной бляшке после снижения рН в ней (Higham S.M., Edgar W.M., 1989). Это соединение чрезвычайно важно, поскольку может быть использовано в качестве аминодонора для синтеза ряда аминокислот. Их накопление способствует нейтрализации рН зубной бляшки.
2. Некоторые бактерии, например, Veillonella, способны превращать лактат в более слабые органические кислоты. Через 30 мин после приема легкоферментируемых углеводов рН зубной бляшки почти возвращается к исходному значению. Однако состав органических кислот (пропорциональное соотношение лактата и ацетата в бляшке) нормализуется значительно позже.
7.4. Влияние слюны на рН зубной бляшки
Многочисленные исследования посвящены изучению того, какое влияние оказывает слюна на изменения рН зубной бляшки (форму кривой Стефана), вызванные полосканием полости рта растворами сахаров. Установлено, что в отсутствие слюны рН зубной бляшки снижается значительно сильнее и дольше остается в пределах опасных значений.
Установлено, что у лиц, не имеющих кариеса, по сравнению с теми, кто подвержен развитию кариеса, следующее:
— Имеется тенденция к повышению рН зубной бляшки в состоянии покоя.
— Ниже минимальные значения рН кривой Стефана.
— Быстрее восстанавливается исходное значение рН зубной бляшки после приема легкоферментируемых сахаров.
Однако, в отсутствие слюны эти различия не проявляются.
Таким образом, слюна является основным фактором модификации рН зубной бляшки и защиты зубов от кариеса (Abelson. Mandel, 1981).Это доказывает важную роль слюны в поддержании нейтрального значения рН зубной бляшки и полости рта в целом.
Факторы, определяющие буферные свойства слюны
Буферные свойства слюны, т. е. способность к нейтрализации органических кислот и поддержанию нейтрального или слабощелочного значения рН, определяются рядом факторов:
— Клиренс.
— Буферные системы.
7.5. Буферные свойства слюны зависят от характера ее секреции
Нестимулированная слюна вырабатывается в отсутствие внешней стимуляции (например, жевания или вкусовых раздражителей). Скорость ее выделения может быть подвержена довольно значительным суточным и сезонным колебаниям. Пик нестимулирогзанной секреции приходится на середину дня, а в ночное время выделение слюны резко снижается.
Стимулированная слюна секретируется под влиянием раздражения вкусовых рецепторов, жевания и других возбуждающих стимулов (например, как следствие рвотного рефлекса). Стимулированная слюна отличается от нестимулированной как по скорости секреции, так и по составу. Слюноотделение можно стимулировать механически, например, за счет жевания резинки даже без вкусового наполнителя. Вкусовые раздражители способствуют более активной стимуляции секреции. Из вкусовых ощущений наиболее интенсивным стимулятором является кислый вкус.
Стимулированная слюна характеризуется заметным преимуществом по сравнению с нестимулированной по целому ряду показателей, отражающих ее защитный противокариозный потенциал, таких, как скорость секреции, нейтрализующая способность, минерализующий потенциал, содержание факторов местного иммунитета.
Клиренс слюны
Клиренс слюны характеризует скорость растворения и удаления из полости рта Сахаров и кислот. Скорость секреции слюны — важнейший фактор, определяющий скорость самоочищения полости рта. При высокой скорости клиренса слюны кривая Стефана зубной бляшки имеет пологую форму: снижение рН зубной бляшки незначительное. При низком клиренсе кривая Стефана глубокая из-за сильного снижения рН зубной бляшки.
Во фронтальном участке в области щечной поверхности верхних зубов скорость клиренса наименьшая, на язычной поверхности нижних зубов — наибольшая. В боковых отделах зубного ряда скорость клиренса имеет промежуточные значения. В соответствии с показателями клиренса самые низкие значения рН зубов бляшки определяются на аппроксимальных поверхностях верхних фронтальных зубов.
7.6. Буферные системы слюны
— Бикарбонатная — основная буферная система стимулированной слюны. Концентрация бикарбонатов в нестимулированной смешанной слюне находится в пределах 1 ммоль/л, а в стимулированной смешанной слюне повышается до 15 ммоль/л. Доказано, что стимулированная слюна приводит к достоверному повышению рН зубной бляшки, нейтрализуя кислые продукты в ее составе.
— Фосфатная — основная буферная система нестимулированной слюны. Защитная роль фосфатов определяется не только буферными свойствами, но и способностью повышать минерализующий потенциал слюны.
— Другие факторы, повышающие рН:
— Мочевина слюны: многие микроорганизмы превращают ее в аммиак.
— Сиалин — основной пептид, содержащий аргинин.
— Амины — продукты декарбоксилирования аминокислот. Амины имеют щелочную реакцию и способны взаимодействовать с водородными ионами.
8. Зубной камень
Многие авторы считают зубной камень одним из этиологических факторов в развитии пародонтита. В этиологии и патогенезе болезней пародонта важную роль играет зубной камень, причина образования которого окончательно не выяснена. Зубной камень вызывает раздражение десны, усиливает воспалительный процесс, что способствует его дальнейшему росту. На шероховатой поверхности зубного камня задерживаются остатки пищи, слущивающийся эпителий и микробы. В докладе научной группы ВОЗ (Эпидемиологии, этиология и профилактика болезней пародонта: Докл. науч. группы ВОЗ. — М, 1980) зубной камень определяется как «минерализованная зубная бляшка, прикрепленная к эмали и покрывающая поверхность зуба» (Пилат Т. Л.,1986.). В ряде теории образования зубного камня основная роль отводится микробам (стрептококкам, актиномицетам и др.), способным захватывать и задерживать твердые отложения на поверхности зубов (Боровский Г.. В., Грошиков М, И., Патрикеев В. К. и др., 1982; Пилат Т. Л., 1983; Broukal Z., Svejda J., 1973). Тщательное полирование поверхности зуба ограничивает возможность отложения зубной бляшки и зубного камня (Diedrich P., Vahl L., Bamfleur W., Mutschelknaus R., 1975; Jones S., Lozda I., Boyde А., 1972.).
По данным Я. С. Утштейи (1923), приблизительно у 60—70% населения в зубном налете постепенно откладываются минеральные компоненты, превращая его в зубной камень. Неодинаковая склонность разных людей к образованию зубного камня и механизм его образования изучены не полностью. Предполагается, что образование зубного камня — ферментативный процесс. Smith (1930) указывал, что зубной камень отлагается в результате воздействия фермента, который освобождается из эпителия десны, особенно при гингивитах.
У лиц, склонных к образованию камня, отмечены низкая концентрация ионов водорода ротовой жидкости (Stones, 1966) и низкая вязкость слюны (Stewart, 1952; Schrocder, 1964). В слюне людей, предрасположенных к образованию зубного камня, установлено большее содержание белка и меньшее — фруктозы и гексозы (Mandel, Thompson, 1965).
Кальцификация зубного налета приводит к образованию зубного камня (твердые отложения различной консистенции и окраски). Зубной камень образуется вследствие минерализации зубного налета, отложения в нем неорганических веществ. Минеральные соли откладываются на коллоидной основе зубного налета, сильно изменяя соотношение между мукопротеидами, микроорганизмами, слюнными тельцами, слущенным эпителием и остатками пищи, что, в конечном счете, ведет к частичной или полной его минерализации (Volker, Bibby, 1947). В основном зубной камень образуется путем импрегнации зубного налета кристаллами фосфата кальция. Для отвердения мягкой матрицы необходимо около 12 дней. Начало минерализации становится очевидным уже через 1—3 дня после образования налета (Thonard, 1966).
Зубной камень (calculus dentalis) — это минерализованные отложения на поверхности естественных или искусственных зубов. По отношению к десне зубной камень бывает наддесневым и поддесневым. Наддесневой зубной камень располагается над гребнем десневого края, его легко обнаружить на поверхности зубов. Этот камень обычно сероватого или бело-жёлтого цвета, твёрдой или глинообразной консистенции, легко отделяется от зубной поверхности путем соскабливания или скалывания. Наддесневой зубной камень чаще всего локализуется на тех поверхностях зубов, которые расположены рядом с устьями выводных протоков слюнных желез.
Различают наддесневой (слюнной) зубной камень (salivary calculi) и поддесневой (сывороточный) зубной камень (serumal calculi). Первый из них, чаще встречающийся, образуется вследствие минерализации мягких зубных отложений и чаще всего локализуется на язычной поверхности нижних фронтальных зубов и щечных поверхностях верхних моляров. Поддесневой зубной камень образуется в результате коагуляции белковых и минеральных веществ сыворотки крови и воспалительных экссудатов и локализуется преимущественно на шейке зуба, на цементе корня и в зубодесневых карманах (А. П. Грохольский, Т. Н. Файзуллаев, 1982). Поддесневой зубной камень выявляется лишь при зондировании. Этот камень обычно плотный, твердый, темно-коричневого или зеленовато-черного цвета плотно прикреплен к подлежащей поверхности зуба. Камень охватывает шейку зуба в пределах десневой бороздки, может располагаться на цементе корня, в пародонтальном кармане. Состав поддесневого камня сходен с наддесневым.
Полагают, что зубной камень, особенно расположенный у шейки зуба, вызывает механическое раздражение десны, закрывает выход из зубодесневого кармана и тем самым препятствует выхождению из него микробов, мигрирующих лейкоцитов и продуктов их распада.
Зубной камень образуется из мягкого зубного налета. Спустя несколько недель после образования последнего в нем появляются первые признаки минерализации. Однодневный зубной налет содержит около 19 мг/г сухой массы кальция и 27 мг/г фосфора. Такое высокое содержание ионов обусловлено, по-видимому, осаждением их из слюны в составе гликозаминогликановых комплексов. Осаждению этих комплексов способствует потеря углекислого газа и связанный с этим подъемом рН слюны (Kjeinberg, 1974). Уже на 2-й день концентрация кальция и фосфора в зубном налете снижается почти в 1,5 раза.
Образованию кристаллов оксиапатита в значительной степени содействует повышение рН в зубной бляшке. При этом основная реакция ее создается за счет аммиака, образуемого из мочевины слюны под действием бактериальной уреазы. Между степенью повышения рН наддесневой зубной бляшки и глубиной зубодесневого кармана существует прямая пропорциональная зависимость. Не исключено, что такая основная среда оказывает весьма благоприятное действие на протеолитические ферменты микроорганизмов.
Детальное исследование структуры зубного камня с помощью химического, рентгеноструктурного анализа и инфракрасной спектроскопии (Oelzner и соавт., 1973) показало, что зубной камень на 80% состоит из неорганических веществ, основными из которых являются кальция фосфаты. В частности, октакальций фосфат (брушит) составляет почти 50% зубного камня.
В зависимости от количества минеральных веществ изменяется консистенция зубного камня:
— при 50—60% минеральных соединений — мягкая,
— 70—80% — средняя и более 80% — твердая.
Исследование зубного камня, проведенное А. А. Колесовым (1957), показало, что кристаллические свойства этого образования изменяются в зависимости от соотношения между кристаллическими и аморфными веществами.
Следует отметить, что химический, состав зубного камня претерпевает весьма значительные колебания у разных индивидуумов.
Механизм образования зубного камня еще полностью не выяснен, однако в его формировании важную роль играют не только ионы кальция, но также и активность ряда ферментов слюны. Так, Nowalska-Kwapisz (1978), исследуя активность кислой фосфатазы и быстроту отложения камня, доказала прямую зависимость между активностью кислой фосфатазы и отложением зубного камня.
Kobylanska (1970) установила, что независимо от места забора зубного налета (нижние резцы, верхние резцы, язычная или губная поверхность) в них всегда имеются очаги обызвествления, определяемые гистохимическим методом (по реакции на кальций).
Broukal и Svejda (1977) с помощью сканирующего микроскопа изучали структуру поверхностного, внутреннего и адгезионного слоев зубного камня человека в зависимости от возраста и топографических особенностей этого отложения. Первые признаки минерализации наблюдаются через 3—6 нед после образования зубного налета. При этом микробные клетки запустевают, хотя местами наблюдается начальная микробная структура, замаскированная тонкогранулярным материалом, содержащим полиэндрические кристаллы. Спустя 2—3 мес. в зубном камне преобладают минерализованные вещества, образующие целые поля игольчатых призматических и кубических кристаллов. Адгезионная поверхность камня так же, как и поверхность зубной эмали и цемента, после удаления зубного камня обычно покрывается слоем кристаллических агломератов и тонкой гранулярной массой.
Jones (1972) при ультраструктурном исследовании установил, что начало образования зубного камня, как правило, связано с наличием углублений на поверхности эмали, отчего зубной камень быстрее образуется в расщелинах между минерализованными концами прободающих волокон, в кариозных углублениях цемента и других карманах поверхности зуба. Эти данные свидетельствуют о том, что полное удаление зубного камня связано с необходимостью разрушения поверхности эмали. Однако Canis и соавторы (1979) считают, что такое плотное присоединение зубного камня к эмали является лишь одним из способов его отложения. Чаще всего между зубным камнем и эмалью располагается кутикула.
Причины возникновения зубного камня следующие:
1. Нарушение обмена веществ. В слюне снижается концентрация пирофосфата-ингибитора образования зубного камня и специального белка, предотвращающего преципитацию фосфата кальция и рост кристаллов.
2. Плохая гигиена полости рта. Если с поверхности зуба полностью не удалить мягкий зубной налёт, то он постепенно превратится в зубной камень. Мягкий зубной налет представляет собой желтоватое или серовато-белое, мягкое и липкое отложение, неплотно прилегающее к поверхности зуба. Он накапливается на поверхности зубов, пломб, десны после еды. Установлено, что белое вещество налета является конгломератом микроорганизмов, постоянно слущивающихся эпителиальных клеток, лейкоцитов, смеси слюнных протеинов и липидов с частичками пищи. Мягкий зубной налет не имеет постоянной внутренней структуры. Его раздражающее действие на десну связано с бактериями и продуктами их жизнедеятельности. В связи с гигиеной полости рта, приемом пищи, особенно твёрдой и плотной, часть мягкого налёта с поверхности зубов и дёсен постоянно удаляется, однако он быстро образуется вновь. Мягкий зубной налёт может быть причиной неприятного запаха изо рта (галитоза), извращения вкусовых ощущении, а также служить центром минерализации при образовании зубного камня.
3. Питание. Мягкая и рафинированная пища увеличивает количество мягкого зубного налёта.
4. Курение. Мягкий зубной налёт быстро пропитывается смолянистыми соединениями и превращается в твёрдый зубной камень в несколько раз быстрее, чем у не курящих людей.
5. Алкоголь. Ухудшает обмен веществ и изменяет микрофлору полости рта, является причиной неприятного запаха из полости рта.
6. Скученность зубов затрудняет чистку зубов особенно в области шейки зуба.
7. Ортодонтические и ортопедические конструкции иногда тоже приводят к образованию зубного камня, по причине ухудшения гигиены полости рта.
Общеизвестно, что необходимое условие успешного лечения заболеваний пародонта — своевременное удаление зубного камня. С этой целью используют различные методы: инструментальный, химический, ультразвуковой. Чаще всего в практической стоматологии используется инструментальный метод снятия зубного камня, при котором с помощью различного типа долотообразных, серповидных, пуговчатых и напильникообразных крючков, экскаваторов и кюреток снимают (соскабливают) зубные отложения. Остатки зубных отложений удаляют при помощи предложенных А. П. Грохольским и Т. Н. Файзуллаевым (1982) специальных полировочных щеток, приводимых во вращение бормашиной. При этом происходит также сглаживание шероховатостей на поверхности зубов. Для удаления поддесневого зубного камня рекомендуется использовать специальный аппарат, осуществляющий вакуум-кюретаж (Н. Ф. Данилевский и соавт., 1968).
Химические методы удаления зубных отложений применяются редко, так как используемые в них сильнодействующие кислоты, хелаторы и другие соединения оказывают повреждающее действие на эмаль зубов и ткани пародонта.
В последние годы все более широкое признание получает ультразвуковой способ снятия зубного камня, который менее травматичен и болезнен и более эффективен. Соответствующие ультразвуковые аппараты (УСП-1) выпускаются отечественной медицинской промышленностью.
9. Отдельные этапы развития взглядов на происхождение кариеса зубов
Зубы человека, как известно, претерпевают в филогенезе значительные изменения. Чем более развито общество, тем интенсивнее процесс эволюции. В древние времена у людей, употреблявших сырое мясо, грубые, не измененные кулинарной обработкой продукты, были здоровые зубы. Постепенно, с усовершенствованием орудий труда, уменьшалась физическая нагрузка на все мышцы, в том числе и челюстно-лицевой области. Если раньше человек затрачивал значительные мышечные усилия для разрывания кусков мяса и других твердых продуктов, то теперь и этом пег необходимости. Варка мяса в значительной степени ослабляла акт жевания. В связи с этим жевательные мышцы и зубы постепенно отключались от работы, а это в свою очередь приводило к их изменению. Приобретенные изменения закреплялись у потомства, продолжая далее нарастать. Зубы современного человека прошли многочисленные эволюционные стадии.
В результате тщательной кулинарной обработки пищи и влияния других факторов на жизнь современного человека зубы продолжают уменьшаться в размерах, ускоряются сроки прорезывания их, увеличивается интенсивность поражения зубов кариесом.
Наряду с изменениями формы и размеров зубов современного человека происходит изменение их тканей. Отмечена тенденция к замедлению созревания эмали зубов, что является одной из основных причин более интенсивного поражения их кариесом.
Кариес зубов известен уже давно, поэтому представление о нем как о патологии последних веков является неверным, хотя оно бытует в настоящее время даже среди некоторых стоматологов.
Исследования этиологии и патогенеза кариеса зубов начались в XVIII столетии, однако научно обоснованные, достоверные данные по этой проблеме относятся к XX столетию. В нашей стране большое внимание изучению этиологии и патогенеза кариеса зубов уделяли П. Г. Дауге, А. И. Евдокимов, И. Г. Лукомский, Д. А. Энтин, Е. М. Гофунг, И. О. Новик, И. А. Бегельман и др. Материалы этих исследований подробно изложены в различных работах, поэтому нет смысла повторять их. Мы остановимся только на некоторых, на наш взгляд основных данных, полученных указанными авторами.
Д. А. Энтин (1938) установил различие свойств слюны у кариесрезистентных и кариесвосприимчивых людей. Зуб является полупроницаемой мембраной, с одной стороны которой находится транссудат крови, а с другой- слюна, т. е. внутренняя и внешняя среды, состояние которых обусловливает благоприятные или неблагоприятные отношения между зубом и слюной. При благоприятных условиях имеет место центробежное направление (от пульпы к эмали) осмотических токов. Это обеспечивает нормальное питание эмали и дентина, благодаря чему зубы резистентны к кариесу. При неблагоприятных взаимоотношениях между зубом и окружающей его средой направление токов может быть ослаблено, а в некоторых случаях осмотические токи могут принять центростремительное (от эмали к пульпе) направление, что ведет к нарушению питания эмали и создает условия для развития кариеса.
Данные Д. А. Энтина о физико-химических закономерностях взаимоотношений сред кровь-эмаль-слюна послужили предпосылкой для дальнейших исследований проницаемости эмали и дентина зубов для различных веществ. Мы придаем проницаемости эмали очень большое значение в связи с процессами формирования и созревания твердых тканей зуба в норме, де- и реминерализации — при патологии.
И. Г. Лукомским была разработана так называемая биологическая теория кариеса зубов. Автор писал: «Мы рассматриваем кариозный процесс как сложное патологическое явление нервно-рефлекторного порядка» (1955). Развитие кариозного процесса И. Г. Лукомский представлял следующим образом: внешние (экзогенные) факторы (недостаток витаминов, особенно группы В и D, солей кальция, фосфора, фтора в пище, фтора в питьевой воде, отсутствие или недостаток ультрафиолетовых лучей) приводят к нарушению минерального и белкового обмена в организме, т. е. к эндогенным изменениям, влияющим на трофику эмали и дентина. В результате этого поражаются одонтобласты. Функция их становится ослабленной (астеничной), а затем неполноценной (дебильной).Изменяются и морфологические особенности клеток, развиваются трофические изменения твердых тканей зуба и деминерализация эмали. Далее процесс деминерализации переходит на дентин, т. е. образуется кариозная полость.
И. Г. Лукомский считал, что наряду с упомянутыми деструктивными при кариесе отмечаются сопряженные явления, которые выражаются в основном в дегенерации тканей. К деструктивным явлениям автор относил гиперминерализацию, замедленную организацию предентина, а также образование прозрачного (вторичного) дентина. Образование их при кариесе П. Г. Лукомский связывал с нарушением трофики твердых тканей зуба в результате «порочной функции одонтобластов».
В 1971 г. нами (А. И. Рыбаков) предложена рабочая концепция патогенеза кариеса зубов, основанная на многолетних экспериментально-клинических исследованиях автора и коллектива ЦНИИС. В основе этой концепции лежат возрастные аспекты развития зубочелюстной системы, влияние эндогенных и экзогенных факторов в определенные периоды формирования и функционирования жевательного аппарата, значение взаимосвязи зубочелюстной системы с внутренними органами, состояние пульпы, развитие взаимообусловленности внутренних и внешних факторов, создающих фон для поражения зубов.
По нашему мнению, кариес зубов нужно изучать с эмбрионального периода. Огромное практическое значение имеет исследование самого начала развития зубов.
Формирование зуба начинается с 5 мес. беременности. В этой фазе фактором, предрасполагающим к развитию кариеса в будущем, является код генетической информации. Создается, таким образом, наследственная предрасположенность к кариесу. Наследственные признаки возникают строго регулярно у различного числа больных в каждом поколении, в связи с чем зубы поражаются кариесом у лиц обоего пола. Характер передачи наследственности — доминантный тип ее. В этой фазе фоном для развития кариеса могут служить дефекты формирования зубов. К экзогенным факторам, оказывающим влияние на возникновение кариозного фона, следует отнести болезни матери.
Возможные изменения формирования зубов во второй фазе развития плода мы связываем с нарушением формирования внутренних органов и расстройством функций у плода. Нарушения формирования твердых тканей зуба являются предрасполагающим моментом, так как в дальнейшем, при воздействии неблагоприятных факторов внешней или внутренней среды организма человека, ткани, сформировавшиеся с определенными дефектами, ранимы в первую очередь.
В третьей фазе развития плода, на 5-м месяце внутриутробного периода, формируются зачатки постоянных зубов. Первостепенную роль в этом процессе играют заболевания матери, характер ее питания.
После рождения ребенка мы различаем несколько стадий развития детского организма, для которых характерны определенные главные факторы, или пусковые механизмы, способствующие развитию кариеса зубов. В возрасте от 6 мес. до 6 лет таким пусковым механизмом является недостаточное поступление фтора в организм, в 6—7 лет — неадекватное воздействие среды, связанное с изменением режима (школа), в 12—17 лет — перестройка организма в связи с половым созреванием, а в 17—20 лет — ферментативная недостаточность, связанная с тем, что наблюдаемая в этом возрасте замена регулярного приема пищи нерегулярным употреблением сладостей ведет к нарушению функций инсулярного аппарата. Пусковым механизмом кариеса зубов в 20-40-летнем возрасте служат заболевания внутренних органов и систем организма, а после 40 лет-травма, негигиеническое содержание рта, нарушение питания.
Таблица 2.
Рабочая концепция патогенеза кариеса зубов
Отмечая важное значение гигиены полости рта в профилактике кариеса, необходимо указать, что основными предрасполагающими условиями его развития в первую очередь являются особенности формирования зубов и челюстей во внутриутробном периоде.
10. Основы профилактики кариеса зубов
Весь комплекс воспитательных, профилактических мероприятий, все санитарно-гигиенические нормы направлены в нашей стране на повышение неспецифических, защитных механизмов растущего организма человека. Результатом этого является возросший уровень физического развития, резкое снижение заболеваемости и смертности, ликвидация ряда детских заболеваний и значительно более легкое течение многих болезней у сегодняшнего поколения детей. Все это связано с изменением реактивности организма детей и подростков. Проведение в жизнь оптимальных санитарно-гигиенических мероприятий способствовало частичному изменению биологических свойств (реактивности) организма ребенка, в результате чего характер течения некоторых заболеваний изменился. Существенную роль в указанном процессе играет такой фактор, как применение все новых и новых медикаментов, в первую очередь антибиотиков. В результате введения их в организм происходят ослабление возбудителей, изменение клинической картины болезней и другие изменения. Эти закономерности можно проследить на примере дизентерии и других заболеваний, традиционные возбудители которых утрачивают вирулентность и проявляются новые. В связи с этим должны меняться и профилактические мероприятия.
В течение многих веков человек постоянно подвергался воздействию каких-либо неблагоприятных факторов. В ответ на них в организме развились и были закреплены наследственные механизмы биологической адаптации к внешней среде. Однако в современных условиях особенно быстрого изменения среды обитания человек сталкивается с опасностями, не имеющими себе равных в прошлом. Таким образом, в сложных взаимосвязях экологической системы Земли, особенно на протяжении последних 2—3 десятилетий, возникли и действуют различные новые факторы, способные чрезвычайно интенсивно влиять на организм как отдельного индивидуума, так и целых групп животных и человека. К таким факторам можно отнести в первую очередь загрязнение воздуха и воды промышленными отходами, ядовитыми веществами (ртуть, мышьяк) и различными ядохимикатами (пестициды и др.), увеличение радиации, употребление в пищу некоторых синтетических добавок и т. д. Вот почему чрезвычайно важна охрана природы и окружающей среды от загрязнения. В настоящее время вполне очевидна зависимость здоровья человечества от правильного решения возникшей проблемы «человек и среда».
В нашей стране органы здравоохранения проводят санитарно-гигиеническое воспитание населения с помощью печати, кино, телевидения, путем устных выступлений и других форм пропаганды. Каждый человек знает, что для предупреждения любого заболевания, в том числе кариеса зубов, необходимы, прежде всего, общие оздоровительные мероприятия, укрепление организма. К ним относятся:
1) грудное вскармливание; сбалансированное по всем показателям (включая ритмичность) питание;
2) рациональный режим труда и отдыха; занятия физкультурой и спортом;
3) выполнение основных индивидуальных санитарно-гигиенических мероприятий;
4) постоянное медицинское наблюдение;
5) применение специальных профилактических методов и средств.
Общественный строй нашей страны создал огромные материальные предпосылки для постоянного улучшения здоровья человека и предупреждения различных заболеваний. Основное направление советской медицины — профилактика. Этому, в конечном счете, подчинена вся система нашего здравоохранения.
Забота о здоровых зубах человека должна начинаться еще в период внутриутробного развития плода, когда формируются все органы, в том числе зубы. Известный тезис «Здоровье будущей матери — залог здоровья ребенка» должен явиться для стоматологов основой широкой пропаганды профилактики.
В нашей стране профилактика кариеса зубов включает широкий комплекс социально-гигиенических мероприятий. Для наиболее эффективного их осуществления врач, прежде всего, должен обратить внимание на эмоциональную сферу деятельности человека. Подлинная его культура неотъемлема от воспитанности. Воспитание — это не только приобретение определенных санитарно-гигиенических знаний, а создание стойких привычек.
Санитарно-гигиеническое воспитание человека в нашем обществе ведется в самых различных формах. Им занимаются семьи, учебные заведения, общественные организации, печать, кино и т. д. Конечно, условия современной жизни ведут к очень большой эмоциональной нагрузке, а приспособительные механизмы организма не соответствуют ей. Но, несмотря на это, резервы у человека есть, о чем свидетельствует выносливость спортсменов, космонавтов и пр. Только тренировка поможет преодолеть несогласованность физиологических и социальных ритмов.
Среди профилактических мероприятий по охране здоровья женщин и детей самым действенным явилась диспансеризация. Одной из ее форм является патронаж.
Патронаж — форма работы лечебно-профилактических учреждений, целью которого является охрана здоровья матери и ребенка, внедрение правил личной гигиены и улучшение санитарно-гигиенических условий в быту, проведение комплекса оздоровительных мероприятий. Впервые патронаж был организован передовыми русскими врачами в 1911 -1912 гг. в Москве, Петербурге, Риге, но ввиду тяжелых условий жизни населения и недостаточной сети медицинских учреждений в дореволюционной России не мог оказать существенного положительного влияния на здоровье детей. Советские педиатры всегда придавали огромное значение патронажной работе. В 1923 г. на II Всероссийском совещании по охране материнства и младенчества проф. А. Н. Антонов говорил: «…патронажные сестры должны быть пионерами охраны материнства и младенчества в деревне» (цит. по С. Л. Полчановой, 1968).
В настоящее время патронаж получил широкое распространение и является обязательным в работе всех женских и детских консультаций, поликлиник, сельских врачебных участков, фельдшерско-акушерских пунктов. При лечебно-профилактических учреждениях имеются патронажные медицинские сестры; патронаж могут осуществлять и другие медицинские работники. Профилактическому патронажу подлежат все дети с момента рождения. Частоту патронажных посещений определяет врач. При патронаже можно максимально индивидуализировать медицинские рекомендации, помочь выполнить их применительно к условиям жизни данной семьи.
Желательно на каждый месяц составлять план посещений. Первое посещение новорожденных и больных детей следует проводить вне очереди. При патронаже беременных и детей должны использоваться рекомендации, разработанные стоматологами (Г. С. Чучмай, 1968; И. Д. Бульда, 1968; А. И. Рыбаков, 1968; А. И. Рыбаков, А. В. Гранин, 1969; М. Н. Цинкер, 1969). В дальнейшем дети должны постоянно находиться под диспансерным наблюдением стоматологических учреждений.
Различия между отдельными людьми обусловлены, с одной стороны, тем, что унаследовано ими от родителей, а с другой — влиянием окружающей среды. Таким образом, взрослый индивидуум представляет собой продукт сложного взаимодействия двух факторов — наследственности и среды.
Под окружающей средой подразумевается любое воздействие на плод с момента зачатия, а затем на индивидуум извне. Самые первые влияния окружающей среды на человеческий организм проявляются еще во внутриутробном периоде: питание плода зависит от веществ, которые поступают с кровью беременной. В результате недостаточного или неправильного питания будущей матери в определенной степени страдает и ребенок, у которого возможно замедленное созревание костей и зубных тканей. На плод может оказывать влияние даже психическое состояние будущей матери.
На состояние зубов человека в значительной мере влияет питание. Однако нередко при одинаковом питании у одного ребенка развиваются резистентные к кариесу зубы, а у другого — кариесвосприимчивые. В этой связи многими исследователями было установлено, что определенную роль в правильном формировании твердых тканей зуба в антенатальном и постнатальном периодах играет также генетический код. Р. С. Кочиев (1971) показал, что своеобразие зубного комплекса, характерное для различных народов, объясняется происхождением народности, генетическими процессами, обусловленными в основном эндогамией и экзогамией, культурно-бытовой обособленностью. Эти факторы обусловливают особенности формирования и созревания зубов. Подтверждением этого служат также исследования Н. М. Данилкович (1971). Автор, изучая особенности прорезывания постоянных зубов у детей, отметил отчетливую акселерацию двух групп детей по сравнению с их сверстниками, жившими в 1927—1930 гг. «В последние годы широкое распространение в одонтологии получила выдвинутая Butler (1939) и развитая Dahlberg гипотеза морфогенетических полей, согласно которой структура зубов определяется генным контролем, распространяющимся частично на всю зубную систему в целом, частично — на отдельные классы зубов. Предполагается, таким образом, наличие ряда полей или „сфер влияния генов“, причем одни поля обладают более широкой областью действия и определяют общие признаки (гистологические, биохимические особенности, общие размеры), а другие имеют более ограниченные сферы действия, определяя развитие признака в пределах одного класса зубов. Общие и классспецифические поля сложным образом взаимодействуют друг с другом. Соседние классспецифические поля также могут „накладываться“ одно на другое, давая морфологический эффект уподобления зубов одного класса зубам соседнего класса. Внутри класса имеется область наиболее интенсивного действия поля, где при формировании признака наблюдается максимальная экспрессивность гена и признак получает наиболее полное, совершенное выражение. Эта область называется полюсом морфологического поля, а находящийся в ней зуб, обладающий по целому ряду признаков наиболее высоким уровнем дифференциации (и потому, в частности, выглядящий наиболее консервативным с филогенетической точки зрения), получает в терминологии наименование ключевого зуба данного класса. Полюсы морфогенетических полей большей частью находятся у мезиальной границы каждого класса, вследствие чего расположенные там зубы чаще всего являются ключевыми, или, как их еще называют, стабильными в отличие от вариабельных зубов, располагающихся, как правило, в дистальных отделах класса, где морфогенетическое поле слабее и выраженность большинства признаков теряет четкость по мере удаления от полюсов. Вариабельные зубы в первую очередь подвергаются редукции, т. е. характерному для эволюции зубов человека процессу сокращения размеров, а также уменьшения или полного исчезновения некоторых структурных элементов. Ключевые зубы каждого класса мало подвержены редукции и обычно сохраняют высокий уровень дифференциации. Редукция, проявляясь у разных индивидуумов в разной степени, сильно увеличивает разнообразие возможных морфологических вариантов зубов. Для каждого класса существует свой ряд редукции — дифференциация, т. е. характерный „спектр“ наблюдающихся форм от высокодифференцированных до сильно редуцированных. Для вариабельных зубов этот ряд богаче формами, чем для ключевых» (цит. по А. А. Зубову, 1968). Исходя из этой трактовки, можно наряду с учетом прочих объяснить симметричность поражения зубов кариесом у отдельных лиц.
В. Р. Окушко (1971) обнаружил, что у спортсменов высокой квалификации пораженность зубов кариесом ниже, чем у других лиц. Автор относит гиподинамию к факторам, снижающим резистентность зубочелюстной системы к патологии. Механизм снижения резистентности автор объясняет «морфологической незрелостью систем жевательного аппарата и их инфантильностью, развивающейся из-за несоответствия стабилизированной генетической программы развития фактическим темпам развития, продиктованным акселерацией. Это обстоятельство определяет высокую ранимость зубочелюстной системы в отношении патогенных воздействий, провоцирующих рассматриваемые заболевания. Особенно очевидна такая связь между преждевременным прорезыванием зубов, незрелостью их тканей и кариесом».
Зубы современного человека подвержены постепенному изменению. Создание совершенных орудий труда влияло на органы человека, так как уменьшало физические усилия, изменяло само содержание труда. В частности, уменьшалась гимнастика жевательных мышц вследствие того, что частично отпала необходимость разрывания, раскусывания и интенсивного жевания сырых продуктов питания. Это вело к изменениям зубов, которые закреплялись у потомства, далее еще более прогрессировали и опять закреплялись. Зубы современного человека, таким образом, прошли многочисленные стадии эволюции.
С изменением функции зубов изменились форма, размер, строение и функция челюстей. Для зубов современного человека характерны потеря массивности, прочности и веса, слабое укрепление в альвеолярных отростках челюстей и, наконец, тенденция к редукции и исчезновению зубов мудрости, которые превратились по существу в рудиментарные органы.
Важное значение для правильного формирования и созревания твердых тканей зуба имеют географические и социально-бытовые (экономические) факторы. Наряду с изменениями формы и размеров зубов человека меняются структура и состав их тканей. Основным фактором, влияющим на этот процесс, который нас интересует с точки зрения профилактики кариеса зубов, является тенденция к медленному созреванию зубов, что ведет к развитию кариеса. Как известно, многие общие заболевания начинаются в полости рта или ее состояние способствует их развитию (туберкулез, актиномикоз, остеомиелит челюстей и др.). А. Б. Изачик указывал, что «главным источником заражения туберкулезом являются больные зубы и плохой уход за ними».
Дурной запах выдыхаемого человеком воздуха чаще всего зависит от состояния полости рта. Как известно, запахи небезразличны для жизнедеятельности человека. Они оказывают определенное влияние на функции человеческого организма. Приятные запахи усиливают выделение слюны и деятельность желудочных желез, возбуждают аппетит. Неприятные же запахи вызывают различные отрицательные реакции, приводят к тошноте, рвоте, обмороку и даже заболеванию. Еще П. Г. Дауге (1933) подчеркивал, что в результате вдыхания воздуха из полости рта, в котором имеются больные зубы, происходит хроническое отравление организма. Он писал, что «запущенный рот является величайшим социальным злом».
Разрушенные зубы являются причиной многих заболеваний, так как инфекция из таких зубов разносится во многие органы; она также может способствовать аллергизации организма и является очагом хронической одонтогенной инфекции (А. С. Рабинович, 1960; М. П. Жаков, 1961; Г. Д. Овруцкий и др., 1967). При этом надо учитывать чрезвычайно разветвленную сеть сосудов, отходящих от челюстно-лицевой области (в том числе и к мозгу).
Лечение разрушенных зубов (кариес, пульпит, периодонтит) иногда в общей сложности отнимает у больного и врача больше времени, чем какая-либо операция. Однако оно является профилактикой тяжелых болезней, от которых порой зависит жизнь больных.
Стоматологами замечено, что болезни зубов развиваются чаще всего в тех случаях, когда не проводится достаточного гигиенического ухода за полостью рта. Во рту у таких людей находятся сравнительно большие количества разнообразной микрофлоры; микроорганизмы постоянно заглатываются, что в свою очередь отрицательно влияет на состояние желудочно-кишечного тракта и может приводить к его заболеваниям.
В полости рта имеются достаточно благоприятные условия для развития и размножения микрофлоры: обилие влаги (слюна), отсутствие света, рН, близкий к нейтральному, пищевые остатки в виде углеводистых и белковых продуктов распада, постоянная оптимальная температура. У кариесвосприимчивых лиц обильно размножаются молочнокислая флора и стрептококки, что способствует развитию кариеса зубов. Размножение этих бактерий при недостаточном гигиеническом уходе за полостью рта ведет к разложению (брожению) пищи и образованию кислот — молочной, уксусной, пировиноградной и др. В этих условиях с каждым глотком пищи или слюны человек заглатывает огромное количество микроорганизмов, которые могут найти благоприятную почву для размножения в различных отделах желудочно-кишечного тракта. Чем больше во рту микробов, тем больше поступает их в желудочно-кишечный тракт. Если в здоровом желудке многие микроорганизмы погибают, то при его заболеваниях, сопровождающихся ахилией, многие микроорганизмы размножаются и затем поступают в кишечник, где всегда находят благоприятную почву для еще более интенсивного размножения. Известно, что некоторые заболевания кишечника обостряются вследствие попадания из полости рта микроорганизмов. Хроническая интоксикация организма усугубляет развитие патологии в пищеварительном тракте, а это в свою очередь неблагоприятно сказывается на состоянии полости рта — получается замкнутый круг. При прочих равных условиях люди с неухоженной полостью рта более подвержены различным общим заболеваниям.
Микроорганизмы полости рта, кроме того, могут аспирироваться, что приводит к развитию заболеваний бронхов и легких. При плохом гигиеническом состоянии полости рта в ней имеется много вязкой слизи, что значительно затрудняет процессы самоочищения зубов и слизистой.
Вследствие сообщения полости рта с внутренним ухом через слуховую трубу проникновение микроорганизмов или продуктов их жизнедеятельности может повести также к заболеванию органа слуха.
Микроорганизмы полости рта в обычных условиях обладают пониженной вирулентностью, однако при каких-либо неблагоприятных условиях (изменения питания, рН слюны, температуры и др.) они могут явиться причиной патологии. Пониженная вирулентность болезнетворных микробов объясняется физиологическим симбиозом их с мало патогенными или совсем непатогенными микроорганизмами. Нарушение этого симбиоза в результате указанных выше изменений приводит к развитию патологии, например кариесу зубов. При этом установлено, что некоторые микроорганизмы начинают вырабатывать кислоту в больших количествах, чем в естественных физиологических условиях полости рта.
При некоторых общих заболеваниях титры микроорганизмов в полости рта повышаются, что может привести к распространению этого заболевания при разговоре, кашле. Кроме того, микроорганизмы могут попасть к другому человеку через общую зубную щетку или в случае пользования общей посудой при приеме пищи. Таким образом, необходимость ухода за полостью рта очевидна.
Частицы пищи, которые остаются в фиссурах и межзубных промежутках, с помощью микроорганизмов быстро подвергаются брожению. Образующиеся при этом кислоты могут растворять минеральный компонент эмали, особенно в тех местах, где пищевые остатки соприкасаются с поверхностью зуба и где они дольше задерживаются. При одновременном соответствующем воздействии эндогенных факторов на зуб может произойти разрушение его тканей.
Ранее мы уже останавливались на механизме образования зубного налета (А. И. Рыбаков, А. В. Гранин, 1970). Налет на зубах бывает чаще всего белого, желтого и зеленого цвета. Белый налет состоит из эпителия, отслоившегося со слизистой оболочки полости рта, остатков пищи и различных микроорганизмов. По данным Lange (1971), микрофлора зубного налета состоит из 36% грамположительных кокков, 11% грамотрицательных, 34% грамположительных палочковидных микробов, 17% грамотрицательных палочек, включая фузобактерии, и 2% спирохет. По данным Ю. А. Федорова (1972), при отсутствии ухода за полостью рта в 1 мг зубного налета содержится до 800 млн. микроорганизмов, тогда как при регулярной чистке зубов — не более 10 млн.
Зубной налет мягкий, тянется, легко удалится. Образуется он почти исключительно на губных и щечных поверхностях шеек зубов, а также между зубами, около десны. С язычной поверхности зубов зубного налета нет, так как он стирается языком. Наличие обильного зубного налета свидетельствует о недостаточном уходе за зубами; налет чаще всего встречается на той стороне челюсти, которая не участвует в акте жевания, а также на нефункционирующих, одиночно стоящих зубах. При недостаточном уходе за полостью рта и нарушении функции жевательной активности зубной налет может приводить к развитию хронического катарального воспаления десны с последующим образованием зубодесневых карманов, краевых хронических перицементитов и т. д. (Powell, 1970; Houver, Frank, 1971, и др.).
При адсорбции мягким зубным налетом солей и минеральных элементов он минерализуется и превращается в зубной камень, который обычно желтого или темно-коричневого цвета. Мягкий зубной налет или образовавшийся на его месте зубной камень служит иногда важным диагностическим показателем функционального состояния данной половины челюсти, т. е. участия ее в акте жевания. Кроме того, по цвету образовавшегося зубного камня можно судить о давности его образования и в некоторой степени об общем состоянии организма. Так, более светлые зубные отложения наблюдаются у лиц с нарушенным солевым обменом. У больных сахарным диабетом, подагрой, ревматизмом отмечается быстрое образование зубных отложений, в связи с чем этим больным необходимо назначать индивидуальные схемы гигиены полости рта.
У здоровых людей налет образуется медленно, зубной камень, возникший на его месте, темнее и тверже. Механизм его образования и его разновидности очень подробно описаны Schroeder (1969).
Отмечая важное значение гигиены полости рта в профилактике кариеса, необходимо указать, что основными предрасполагающими условиями его развития в первую очередь являются особенности формирования зубов и челюстей во внутриутробном периоде.
Пломбирование зубов — лечебное, гигиеническое и, следовательно, профилактическое мероприятие. Здесь следует с сожалением заметить, что эта лечебно-профилактическая процедура проводится всеми стоматологами, а вот чисто предупредительные, значительно более ценные мероприятия, на которых мы остановимся ниже, осуществляются еще не повсеместно. Ранее принятая система санации рта только путем пломбирования не соответствует сегодняшнему уровню развития науки. Убедительно показано, что есть более эффективные методы, отвечающие задачам профилактики кариеса зубов, тогда как пломбирование зубов является профилактикой осложнений кариеса.
Несмотря на общеизвестную истину, что «предупредить болезнь легче, чем лечить», профилактика кариеса зубов осуществляется в настоящее время на практике не совсем правильно. Еще в 1933 г. П. Г. Дауге писал, что «…нас интересует с социальной точки зрения совершенно другого порядка профилактика, гласящая, что вся плановая профилактическая зубоврачебная работа нами должна вестись так, чтобы в перспективе всякое зубное протезирование стало лишним или, по крайней мере, было сведено к минимуму».
11. Роль зубных отложений в развитии стоматологических заболеваний
В работах ученых, посвященных роли зубных отложений в развитии стоматологических заболеваний, независимо от подхода к проблеме большое внимание уделяется зубному налету. На интенсивность образования зубного налета влияют частота приема пищи, ее характер:
— количество белков и углеводов в рационе,
— концентрация ионов водорода в рационе,
— скорость слюноотделения,
— наличие пломбированных зубов,
— кариесактивность или кариесрезистентность.
В патологии пародонта различают пародонтит (воспаление тканей пародонта, характеризующееся прогрессирующей деструкцией периодонтальной связки и кости) и пародонтоз (дистрофическое поражение пародонта). Эти патологические состояния приводят к глубокому нарушению анатомо-физиологической целостности зубочелюстной системы.
Этиология пародонтита и пародонтоза полностью еще не выяснена, однако известен ряд факторов, участие которых в возникновении этих заболеваний не вызывает сомнения.
К таким факторам относят микроорганизмы полости рта, особенности питания, недостаточную функциональную нагрузку на зубочелюстную систему, состояние макроорганизма.
Участие микроорганизмов в развитии воспаления тканей пародонта общепризнано как отечественными, так и зарубежными стоматологами.
Развитие пародонтита находится в прямой зависимости от количества зубного налета и общей микробной обсемененности полости рта и в обратной — от эффективности гигиенических мероприятий.
Установлено, что при интактном пародонте на 3-5-й день после прекращения ухода за полостью рта параллельно с увеличением зубного налета развивается гингивит, который рассматривается рядом авторов как предстадия пародонтита.
Гигиенические мероприятия быстро снимают все явления воспаления.
Одновременное подавление грамотрицательной флоры антибиотиком ванкомицином позволяло предотвратить развитие гингивита при прекращении гигиены полости рта.
Прямая зависимость между количеством зубного налета и тяжестью гингивита, а также повреждением альвеолярной кости и глубиной прорастания эпителиального прикрепления зуба у крыс была установлена Louridis и соавторами (1971). Введение антибиотиков снижает образование зубного налета и интенсивность поражения пародонта у грызунов.
Некоторые авторы считают пародонтит инфекционным заболеванием, поскольку существует возможность заражения хомяков пародонтитом путем введения выделенной из зубного налета аэробной грамположительной филаментозной бактерии Odontomyces viscosus.
Убедительным доказательством роли микроорганизмов в развитии пародонтита являются опыты на гнотобионтах, которые показали, что только одно введение таким животным чистых культур Str. mutans или Actinomyces viscosus вызывает поражение пародонта. Большинство авторов считает, что главную роль в этиологии пародонтита играет ассоциация Str. mutans, Actionomyces viscosus и Bacteroides melaninogenicus.
При развитии гингивита и пародонтита, как правило, тканевая инвазия пародонта микроорганизмами сопровождается преходящей бактериемией. Наличие микробов в межклеточном веществе и внутри клеток эпителия и соединительной ткани десны установлено с помощью бактериологических, гистологических, иммунологических и ультраструктурных методов исследования, причем глубже всего в пародонт проникают спириллы и простейшие.
Вторым этиологическим фактором пародонтита является характер питания. Прежде всего, следует отметить изменения физико-химического состояния и химического состава пищи современного человека. Пища стала менее грубой, как правило, она употребляется в измельченном и термически обработанном виде. За последние 100 лет в рационе человека резко возрос удельный вес сахарозы, которая, как уже отмечалось выше, создает благоприятные условия для развития микроорганизмов и образования зубного налета.
Третьим этиологическим фактором, способствующим возникновению пародонтита, является гиподинамия зубочелюстной системы. Переход от грубой к мягкой пище снял значительную часть функциональных нагрузок на пародонт, что привело к развитию атрофии от бездействия. В эксперименте на животных можно предотвратить атрофию альвеолярного отростка с помощью вынужденной подвижности, чем доказано влияние общей гиподинамии на состояние зубочелюстной системы.
Четвертым условием развития пародонтита является соответствующее состояние макроорганизма, характеризующееся нарушением психосоматических взаимоотношений и нейроэндокринной регуляции, что приводит к недостаточности гомеостатических систем и, как следствие этого, развитию патологической реакции в пародонте.
Патогенез пародонтита представляет собой сложную систему процессов, протекающих на различных уровнях биологической организации организма. В литературе имеются данные, свидетельствующие о роли наследственных, генетических факторов в развитии пародонтита. Однако в большинстве случаев пародонтит не является врожденным заболеванием. Скорее всего, пародонтит — проявление изменчивости фенотипа. Именно этим объясняется увеличение случаев заболевания пародонтитом с возрастом, а также в результате различных органических поражений внутренних органов, прежде всего желудка, кишок и печени. А. И. Евдокимов считает наиболее важным фактором в патогенезе пародонтита артериосклероз сосудов пародонта.
Практически всегда пародонтит связан с эндокринными нарушениями. Роль нарушений центральной нервной и вегетативной нервной систем в патогенезе пародонтита подтверждается многочисленными экспериментальными данными.
Важнейшим патогенетическим звеном является повышенная миграция лейкоцитом в полость рта, причем, чем между тяжестью заболевания и размером миграции существует прямо пропорциональная зависимость.
Миграция лейкоцитов в полость рта, и инфильтрация этими клетками тканей десны стимулируется различными хемотаксическими веществами, из которых наиболее активными являются антигены микроорганизмов зубного и десневого налетов.
Между выявлением полиморфноядерных гранулоцитов и бактериальной обсемененностью зубодесневых (пародонтальных) карманов существует прямая связь.
Лейкоциты обладают выраженным цитотоксическим действием вследствие секреции различных медиаторов воспаления, например, гистамина, простагландинов, а также лизосомальных ферментов, обладающих деструктивным действием.
Секреция лизосомальных ферментов полиморфонуклеарами в значительной степени стимулируется оральными микроорганизмами.
В тканях пародонта на высоте развития пародонтита преобладают лимфоциты, которые составляют почти 60—65% всех клеточных элементов области поражения. В дальнейшем под влиянием факторов зубного налета лимфоциты воспаленной десны вступают в реакцию бласттрансформации, которую стимулируют лизосомальные ферменты полиморфонуклеаров, инфильтрирующих ткани пародонта.
Результатом бласттрансформации является превращение бета-лимфоцитов в плазматические клетки, а Т-лимфоцитов — в тканевые базофилы. Дегрануляция тканевых базофил приводит к выходу в ткани пародонта медиаторов воспаления. Активированные Т-лимфоциты секретируют медиаторы замедленной гиперчувствительности — лимфокины, содержание которых в тканях десны при пародонтите возрастает во много раз. Лимфокины обладают способностью активизировать проколлагеназу, усиливать хемотаксис полиморфонуклеаров и моноцитов, стимулировать деятельность остеокластов, а также повышают сосудистую проницаемость.
Закономерным следствием всех этих процессов является развитие воспаления и дистрофии, сменяющейся атрофией мягких и твердых тканей пародонта, что и составляет основу морфологических изменений при заболеваниях пародонта.
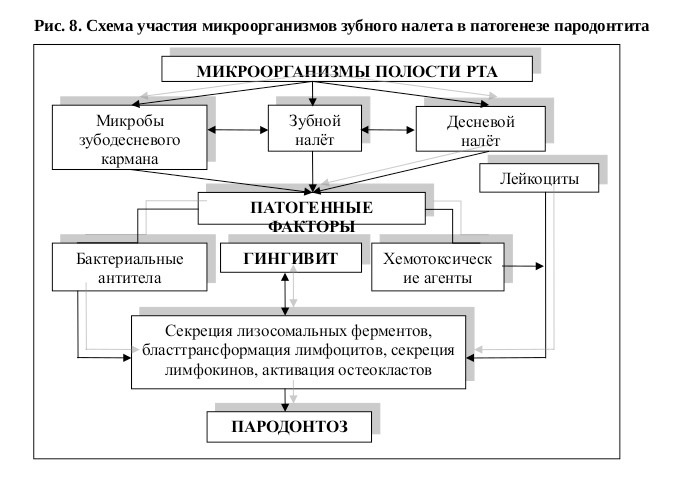
12. Реминерализация и деминерализация эмали
Основные звенья патогенеза кариеса условно можно представить следующим образом. При воздействии органических кислот на эмаль происходит ее растворение (деминерализация), сопровождающееся изменением формы, размеров и ориентации кристаллов гидроксиапатита. В кристаллической решетке биологических апатитов, к которым относится эмаль, имеются вакантные места и дефекты — отсутствие атома или колонок атомов (так называемые дислокации). Эти дефекты кристаллической решетки являются причиной быстрого проникновения в эмаль органических кислот.
Степень деминерализации эмали при кариесе зубов зависит от концентрации нейтральных комплексов кальция, фосфора, фторида и органических кислот, от структуры и химического состава эмали. Менее стойки при деминерализации те соединения эмали, которые по химическому составу и строению отличаются от гидроксиапатита.
В начальных стадиях кариеса патологический процесс в основном развивается в подповерхностных слоях эмали, что вызывает изменение ее физико-химических свойств, в результате чего появляется белое кариозное пятно. Поверхностный слой эмали в этой области относительно сохранен, что связано, вероятно, с разницей в химическом составе поверхностного и подповерхностного слоев эмали, поступлением минеральных компонентов, как из ротовой жидкости, так и из подповерхностного повреждения. На поверхности кариозного пятна формируется аморфная защитная пленка. Из поврежденного подповерхностного участка происходит потеря кальция, фосфора, магния, карбонатов, понижается плотность эмали, повышается ее растворимость.
При формировании очаговой деминерализации происходит преимущественно декальцинация. Во время ионного обмена ионы водорода до определенного предела могут поглощаться эмалью без разрушения ее структуры, при этом снижается величина Са/Р-коэффициента. Этот процесс обратим, и при благоприятных естественных условиях или под воздействием реминерализирующих жидкостей ионы кальция могут вновь поступать в кристаллическую решетку, вытесняя ионы водорода.
Кариес в стадии пятна (синонимы: начальный кариес, белое пятно эмали) — благоприятное время для реминерализации, так как в этот период органическая матрица эмали еще сохранена и может служить центрами нуклеации для роста кристаллов; сохранена и целость эмали, так как не разрушен поверхностный слой.
В то же время, поскольку в этом процессе участвуют ионы кальция, деминерализация эмали может вызвать такие физико-химические изменения, которые приводят к протеолизу органической матрицы, разрушению эмали в области пятна и образованию полости.
Для успешного лечения очаговой деминерализации эмали применяют препараты, которые восполняют дефекты кристаллической решетки, повышают резистентность эмали к действию кислот, понижают ее проницаемость.
Реминерализация — частичное восстановление плотности поврежденной эмали. Этот процесс в чем-то подобен минерализации зубов после прорезывания. Отличие состоит только в том, что в первом случае вследствие предшествующей кариозной атаки каналы диффузии заполнены минералами, поступающими из подповерхностного слоя. Результатом этого является невозможность проникновения ионов из реминерализирующих растворов в глубокие слои эмали и гипоминерализованные области.
В процессе реминерализации кальций и фосфаты диффундируют внутрь зуба через слюну или зубной налет и осаждаются в виде нового материала в области, ранее пораженной кариесом. Реминерализация — это обогащение кальцием и фосфатами частично деминерализованных тканей путем образования новых минеральных солей. Образование новых минеральных солей происходит путем возобновления обычной кристализации уже существующих, но частично деминерализированных кристаллов или путем образования новых кристаллов.
В естественных условиях источником поступления в эмаль кальция, фосфора и фторидов является ротовая жидкость. Зрелая эмаль может поглощать ионы фтора даже в таких низких концентрациях, какие присутствуют в ротовой жидкости. Реминерализирующий потенциал слюны позволяет остановить кариес в стадии белого пятна только в 50% случаев, поэтому приходится прибегать к применению различных реминерализирующих средств, которые должны не только восполнить имевшиеся или появившиеся во время кариозной атаки дефекты в кристаллической решетке эмали, но и повысить ее резистентность.
Кальций является необходимым компонентом реминерализации, независимо от того, откуда он поступает: из ранее деминерализованных областей, из зубного налета, слюны или из всех источников вместе взятых. Отметим, что в многочисленных испытаниях было показано: наличие кальция в зубных пастах не влияет на эффективность редукции кариеса.
Ключевую роль в процессе реминерализации играют фториды, стимулируя фазовые превращения в минеральных веществах, ускоряя рост кристаллов и процесс реминерализации, а также замедляя деминерализацию кристаллов поверхности зуба. Вновь образующиеся минеральные соли менее растворимы, чем исходные. По своему составу они могут быть аналогичны фторапатиту либо гидроксиапатиту, но с меньшей содержанием карбонатов и примесей.
Исходя из этого, можно сделать вывод: для процесса реминерализации необходимы как кальций, так и фосфаты. Оба эти вещества в достаточном количестве поступают из эндогенных источников.
С учетом сроков прорезывания постоянных зубов и возрастных физиологических особенностей детей реминерализирующую терапию целесообразно начинать с 6 лет, что позволяет повысить резистентность эмали. Первым этапом этого процесса должно быть обогащение эмали кальцием и фосфатами с последующим введением препаратов фтора, которые уменьшают проницаемость эмали.
По мнению большинства исследователей, реминерализирующие препараты должны включать в себя различные вещества, повышающие резистентность эмали, — кальций, фосфор, фторид, стронций, цинк и др. Под воздействием этих препаратов происходит интенсивное формирование кристаллов фторида кальция различной степени кристаллизации и формы. В результате образуется очень тонкая пленка, прочно связанная с матрицей эмали и покрывающая весь участок очаговой деминерализации.
Об эффективности реминерализации можно судить по стабилизации или исчезновению белых пятен эмали, снижению интенсивности развития кариеса.
Реминерализация пораженных подповерхностных слоев происходит, когда диссоциированные молекулы кальция и фосфатов рекомбинируют с образованием кристалла, причем даже менее растворимого, чем исходный. Этот процесс ускоряется в присутствии фторидов. Таким образом, фториды оказывают влияние на процесс реминерализации, действуя как катализатор. Под их влиянием ускоряется восстановление эмали и приостанавливается или даже происходит обратное развитие процесса разрушения зуба.
Деминерализация (примерная реакция):
Са10 (РО4) (ОН) 6 + кислоты зубного налета → Са + Р
Реминерализация (примерная реакция):
Са + Р → Са10 (РО4) (FО)
F
12.1. Принципы применения реминерализирующих растворов
Принцип реминерализующей консервативной терапии начального кариеса (в стадии мелового пятна) состоит в возмещении утерянных минеральных элементов эмали в период предшествующей частичной ее деминерализации. В связи с тем, что основными компонентами эмали зуба являются кальций и фосфат, они и составляют основу деминерализующих растворов.
Реминерализация (вторичная искусственная минерализация) твердых тканей зуба возможна благодаря проницаемости эмали и дентина для ионов и молекул веществ в центростремительном направлении. Проникшие ионы минеральных элементов оседают на органической основе, образуя кристаллическое вещество, или включаются в структуру неразрушившихся кристаллов апатита эмали.
Существуют весьма различные композиции реминерализующих растворов, однако основу их составляют фосфат, кальций, фтор. Наиболее широко используют по рекомендациям Е. В. Боровского, П. А. Леуса (1976), Г. Н. Пахомова 10% растворы глюконата кальция, 2 — 10% растворы подкисленного фосфата кальция и др. Показанием для их применения являются единичные и множественные белые, светло-коричневые пятна на гладких поверхностях зубов. Используются эти растворы в виде аппликаций или путем электрофореза.
Методика их применения заключается в следующем. Поверхность зубов, которые будут обрабатывать реминерализующим раствором, очищают от зубного налета щеткой или ватным тампоном, а затем высушивают струей теплого воздуха или марлевой салфеткой. Затем зубы изолируют от слизистой оболочки десны и накладывают на поверхность кариозных пятен ватные тампоны, смоченные реминерализующей жидкостью. Длительность аппликаций — 15 — 20 мин, в течение которых тампоны меняют 3—4 раза (в среднем через каждые 5 мин). После удаления тампона с реминерализующей жидкостью на поверхность зуба накладывают ватные тампоны, смоченные 2 -4% раствором фтористого натрия. Длительность аппликации — 2 — 3 мин. После процедуры пациенту не рекомендуют пить и принимать пищу в течение 2 ч.
Курс реминерализующей терапии состоит обычно из 15 — 20 аппликаций, однако в отдельных случаях (при множественном кариесе зубов) их число может быть увеличено до 30 процедур. Аппликации проводятся ежедневно, в крайнем случае через день. В случае вынужденного перерыва курс лечения следует провести заново. В заключение больному рекомендуют уход за полостью рта с пастой.
По нашим данным, неплохой эффект оказывает электрофорез 2,5%, раствора глицерофосфата кальция, который проводится ежедневно (или через день) в течение 10 — 15 дней.
1. Реминерализирующая терапия:
а) курсовое местное применение в виде аппликаций фторсодержащих лаков, гелей, растворов;
б) эндогенная фторпрофилактика путем приема больными лекарственных форм фторидов, например, натрия фторид, изготовленных в виде таблетки, драже и т. д.
в) мероприятия по увеличению резистентности зубов к кариесу (реминерализующая терапия) при применении ортодонтического лечения.
Рекомендуется проведение реминерализующей терапии за 1 месяц до фиксации аппарата. По мнению большинства исследователей, в состав реминерализующих препаратов должны входить вещества, повышающие резистентность эмали — такие, как фтор, кальций, фосфор, стронций и др., присутствие которых в эмали может стабилизировать и поддерживать ее целостность. Возмещение убыли минеральных элементов деминерализованной эмали зубов — основной принцип локальной реминерализующей терапии. Наиболее широко применяемым методом местной терапии при кариесе зубов является аппликационный метод, когда реминерализующее средство наносят на очищенную, высушенную поверхность зуба.
Существует множество методик повышения резистентности эмали (см. Рис. 9).
— Методика Леуса-Боровского (1972): 10% раствор глюконата кальция; курс 15—20 процедур по 5 минут с последующей аппликацией фторида натрия.
— Методика Колесова А. А. и др. (1976).
— Методика применения препарата «Ремодент»: на поверхность пораженных зубов накладывают рыхлый ватный тампон в ортодонтических ложках, пропитанный раствором; курс — 10 процедур по 10—15 минут до и после ортодонтического лечения.
В качестве средств профилактики и лечения начального кариеса используются также реминерализующие кальций-фосфатные гели (Леонтьев В. К., Сунцов В. Г.). Благодаря структурированным водным пространствам в гелях обеспечивается защитный эффект относительно взаимодействия Са2+ и НРО42-, что позволяет сохранить минерализующие компоненты в свободном активном состоянии и тем самым обеспечить существенное повышение их проникновения в кристаллическую решетку эмали. Гели перенасыщены ионами кальция и фосфата относительно их концентрации в слюне. Обычно для профилактики кариеса зубов назначается чистка гелями курсами 2—3 раза в год по 10—15 дней на курс.
Отдельно следует выделить метод глубокого фторирования (см. Приложение №1), предложенный для эффективной профилактики кариеса немецким профессором А. Кнаппвостом. Глубокое фторирование проводится путем последовательной обработки эмали сначала раствором магниево-фтористого силиката, а затем суспензией высокодисперсной гидроокиси кальция (соответственно препараты №1 и №2 из комплекта тифенфлюорид, эмаль-герметизирующий ликвид). Образуется фторо-силикатный комплекс, который затем спонтанно распадается с образованием микрокристаллов фтористого кальция, магния и меди, а также полимеризованной кремниевой кислоты. Кристаллики фторидов лежат как на поверхности, так и, самое главное, в глубине пор эмали в геле кремниевой кислоты, защищенные от вымывания.
Они выделяют в высокой концентрации в течение длительного времени (более 1 года) фтор, который способствует надежной реминерализации, в том числе в проблемных зонах, то есть межконтактных областях, фиссурах. При этом образуется апатит, обогащенный фтором, который при интактности кератиновых волокон ведет к полному восстановлению кариозного участка.
Тифенфлюорид содержит ионы меди. Согласно результатам многочисленных исследований, ионы меди проявляют сильные бактерицидные свойства, особенно против анаэробов. Кроме того, они исключительно мощно подавляют протеолитическую активность микроорганизмов. Особенно важным представляется долговременность их действия, обусловленная каталитическим окислением образующегося сульфида меди. Сочетание воздействия глубокого фторирования, а именно — сильной долговременной реминерализации, и защита кератиновых волокон от протеолиза, обеспечивает высокую эффективность тифенфлюорида в профилактике кариеса. Методика проведения: освобожденную от зубного налета, подсушенную поверхность зуба, в том числе межзубные пространства и углубления фиссур, смачивают сначала первым входящим в комплект раствором, а через 0,5—1 минуту — вторым. Спустя 0,5—1 3 минуту, пациенту разрешается прополоскать рот. На этом процедура закончена.
Методика Боровского Е. В., Леус П. А. (1972 г.)
Алгоритм:
— очистить зубы гигиенической пастой в течение 2—3 мин;
— обложить все поверхности зубов верхней и нижней челюсти тампонами, пропитанными 10%-ным раствором глюконата кальция на 3—5 мин;
— удалить ватные тампоны с 10%-ным раствором глюконата кальция (при необходимости сплюнуть);
— обложить все поверхности зубов верхней и нижней челюсти тампонами, пропитанными 2%-ным раствором фторида натрия на 1—2 мин;
— дать рекомендации (не есть, не пить в течение 20—30 мин).
Курс профилактики: 3 процедуры, проводимые через день, повторный курс показан через 5—6 месяцев.
Методика Колесова А. А. и др. (1976 г.)
Алгоритм:
— снять зубной налет (зубной камень);
— изолировать зубы от слюны ватой;
— просушить зубы воздухом;
— провести аппликацию всех поверхностей зубов верхней и нижней челюсти 10% -ным раствором глюконата кальция в течение 20 мин;
— удалить ватные тампоны с 10% -ным раствором глюконата кальция;
— провести аппликацию всех поверхностей верхней и нижней челюсти 2%-ным раствором фторида натрия на 2—3 мин;
— удалить тампоны из полости рта;
— дать рекомендации.
Курс профилактики: 15—20 аппликаций. Примечание, препараты можно вводить с помощью электрофореза, для детей процедура длится 5 мин. Фторид натрия (2%-ный раствор) вводится после третьей аппликации 10%-ным раствором глюконата кальция.
13. Этиология и патогенез воспалительных заболеваний пародонта
В настоящее время этиологические факторы и патогенетические механизмы развития воспалительных заболеваний пародонта изучены достаточно хорошо, что позволяем проводить эффективную профилактику и адекватное лечение.
К воспалительным заболеваниям пародонта относятся гингивит и пародонтит, основным патогенетическим фактором возникновения, которых является микробный налет. Наибольшее значение в развитии воспаления имеют микроорганизмы: Str. sanguis, Вас. melonogenicus, Actinomyces viscosus и др.
Как любое воспаление, вызванное инфекционным агентом, воспаление тканей пародонта зависит не только от наличия микроорганизмов, но и от общего состояния всего организма. Остроту процесса, его клинико-морфологические особенности и исход воспаления определяет реактивность организма пациента,
В свете современных представлений, в патогенезе заболеваний пародонта можно выделить несколько этапов (Genco R.J, et al., 1990) (см. Рис. 10).
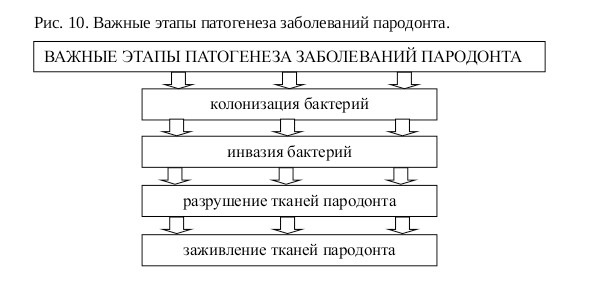
Колонизация бактерий. Вначале происходит колонизация бактерий, преимущественно Str. sanguis и Actinomyces. Они прочно прикрепляются к поверхности зуба, покрытой пелликулой. После этого присоединяются и другие микроорганизмы, происходят их рост и увеличение массы зубного налета в разных направлениях, в том числе в сторону верхушки зуба.
Инвазия бактерий. В этот период микроорганизмы и их токсины через эпителий бороздки или пародонтального кармана проникают в десну на разную глубину, вплоть до поверхности альвеолярной кости. Этот этап способствует переходу гингивита в пародонтит.
Разрушение тканей пародонта. По мере поступления микроорганизмов или их фрагментов может происходить разрушение тканей пародонта. Этому в значительной степени способствуют состав микробного зубного налета, прием легкоусвояемых углеводов и степень реактивности организма (заболевания эндокринной системы, желудочно-кишечного тракта и др.). Деструкция тканей пародонта является следствием прямого токсического влияния экзотоксинов или гистолитических ферментов (например, бактериальная коллагеназа). Кроме того, бактериальные компоненты могут способствовать выработке организмом человека токсичных продуктов, которые ведут к деструкции тканей.
Заживление тканей пародонта. В этой стадии происходит эпителизация тканей пародонта. Гистологические и клинические данные указывают на то, что в течении заболеваний пародонта различаются периоды обострения и ремиссии. Периоды ремиссии характеризуются уменьшением воспаления, восстановлением коллагеновых волокон и довольно часто фиброзом десны. Одновременно на рентгенограммах прослеживается изменение костных альвеолярных контуров.
Знание ведущих звеньев патогенеза воспалительных изменений в тканях пародонта определяет выбор методов выявления ранних признаков патологии и способов профилактики с устранением местных и общих факторов риска.
Местные факторы риска возникновения болезней пародонта:
— чрезмерное потребление мягкой пиши;
— плохой гигиенический уход за полостью рта;
— уменьшение секреции слюны;
— нависающие края пломб;
— наличие ортодонтических аппаратов;
— аномалии расположения зубов (скученность, дистопия);
— аномалии развития слизистой оболочки полости рта (мелкое преддверие рта, аномальное при крепление уздечек губ и языка);
— механическое повреждение;
— химическая и физическая травма;
— ошибки при ортодонтическом и ортопедическом лечении.
Среди общих факторов риска развития болезней пародонта необходимо, прежде всего, выделить:
• различные эндокринные заболевания (сахарный диабет, гипофизарный нанизм, нарушение гормональной функции половой системы);
— нервно-соматические заболевания;
— ревматизм;
— туберкулез;
— нарушение обмена веществ;
— гиповитаминозы и др.
В настоящее время знание факторов риска, их своевременное устранение позволяет предотвратить развитие заболеваний пародонта или при невозможности их полного устранения уменьшить выраженность патологических изменений.
Историю этиологии и патогенеза основных заболеваний пародонта в стоматологии можно разделить на два четко разграниченных этапа. Первый этап длился до 1935 г. и состоял в накоплении фактического материала. В последующие годы (второй этап) началось формирование теоретических концепций, целью которых было объяснить роль сосудистого фактора в этиологии и патогенезе заболеваний пародонта.
Впервые логически стройные и экспериментально обоснованные представления о роли сосудистых механизмов в поражении пародонта были разработаны М. С. Шварцем в 1935 году. В своих работах он показал, что патологический процесс начинается с расстройства функциональной активности желудочно-кишечного тракта, сопровождающегося дисбактериозом, гниением пищевого белка и увеличенным поступлением в воротную вену аминов (этиламина, гистамина, тирамина и фенилэтиламина). Возникающая под их влиянием недостаточность дезинтоксикационной функции печени устраняет основной барьер на их пути в общую систему кровообращения. Специфическая чувствительность микрососудов пародонта к аминам, обнаруженная М. С. Шварцем предопределяет локализацию дистрофического процесса вследствие избирательной адсорбции аминов, нарушения капиллярно-тканевого обмена и местного усиления образования гистамина, замыкающего порочный круг. Указанная адсорбционная способность капилляров десны резко усиливается с возрастом. Этим подготавливается почва для развития воспалительного процесса под влиянием многочисленных микроорганизмов полости рта. Наиболее слабым звеном описанной гипотезы является отсутствие ответа на вопрос о причине исходного нарушения деятельности пищеварительной системы.
Другой сосудистой теорией возникновения и развития патологии пародонта обнаруживаются в трудах А. И. Евдокимова, который впервые заявил об пародонтите как о заболевании, развивающемся на почве общих конституциональных расстройств. На основе сходства перенесенной и сопутствующей патологии в анамнезе этих больных с перечнем болезней по схеме проф. В. И. Скворцова, ведущих к развитию ацидоза или алкалоза, А. И. Евдокимов выдвинул гипотезу о патогенной роли нарушений концентрации водородных ионов в качестве ведущего «конституционального момента» в этиологии альвеолярной пиореи.
В последствие Д. А. Энтиным была предложена новая концепция о причинной роли аллергических заболеваний, острых и хронических инфекций в первичном поражении сосудов пародонта, ведущем к развитию пропорциональной по интенсивности вторичной дистрофии альвеолярной кости выдвинул теорию о возможных причин развития артериолосклероза в сосудах пародонта.
Логическое совершенствование указанной концепции нашло в дальнейших трудах А. И. Евдокимова, в которых он подвергнул критике с этих позиций как сторонников инфекционной, так и нейродистрофической природы пародонтоза, включая при этом в число этиологических моментов первичного склероза сосуды пародонта. Кроме того, в этой концепции было указано на то, что кроме известных причин атеросклероза, необходимо принимать во внимание также возраст, гиповитаминозы, диабет и ряд других предшествующих или сопутствующих внутренних болезней.
Эти взгляды нашли поддержку в теоретических обзорах по пародонтологии в работах академика А. И. Рыбакова, постулирующих положение о том, что сосудистая патология является основой развития поражения челюстей пародонтозом, а все остальные изменения в тканях пародонта, в органах полости рта, внутренних органах и системах организма носят вторичный характер
Клинико-эпидемиологические работы, проведенные с помощью функциональных и патоморфологических методов исследования, подтверждают совпадение распространенности атеросклероза, гипертонической болезни и патологии пародонта у лиц в возрасте старше 40 лет.
При патогистологическом исследовании трупного материала подтверждено наличие известного параллелизма между тяжестью поражения сосудов и степенью деструкции альвеолярной кости, а также интенсивностью пролиферации десневого эпителия, причем последнее послужило даже основанием для декларации исключительной роли поражения сосудов в образовании патологического зубодесневого кармана.
С другой стороны, полностью было сохранило теоретические значение старого высказывания Д. А. Энтина о том, что болезни пародонта «хотя и протекают в огромном проценте случаев одновременно с теми или иными болезнями обмена и эндокринными расстройствами, все же не находятся в прямой связи с последними, имея, может быть, общий с ними этиологический момент, но различный патогенез».
Именно поэтому заболевания сердечнососудистой системы нельзя считать патогенетическим фактором альвеолярной пиореи, так как они представляют интерес лишь как доказательство наличия в таких случаях одинаковой причины, действующей иногда избирательно лишь на зубы или на другие органы, создавая в этой группе совпадения синдромного характера.
Приведенные положения подкрепляются также клиническими фактами развития местного артериолосклероза в пародонте у лиц без каких-либо отчетливых признаков атеросклероза, и наоборот, наличием интактных тканей пародонта во многих случаях атеросклероза.
Следует отметить, что концепция А. И. Евдокимова была подвергнута принципиальной критике сторонниками традиционных представлений о нейродистрофической природе пародонтоза — все они единодушно считают причиной сосудистых расстройств в тканях пародонта первичное нарушение деятельности нервной системы, хотя и расходятся во мнениях о его истоках, называя в качестве таковых бактериальные токсины, эмоционально-психическое перенапряжение и предшествующую патологию внутренних органов.
Поэтому главной заслугой А. И. Евдокимова является то, что он первым увидел общность ряда причинных моментов в этиологии атеросклероза и основных болезней пародонта. Особенно ярко он описал это в своих первых публикациях по данному вопросу об этиологическом значение в возникновении альвеолярной пиореи не самого атеросклероза, а именно причин атеросклероза — психического перенапряжения, гиподинамии и других патогенных факторов, так и не привлекших должного внимания исследователей этой проблемы. В качестве одного из недостатков данной концепции представляются то, что позже появилась излишняя категоричность ряда положений, а также наличие диспропорции между умозрительным характером большинства принципиально важных связок в предполагаемой патогенетической последовательности событий и недостаточным экспериментальным их обоснованием.
Третьей теорией развития изменения состояний тканей пародонта является представления о первичной роли дистрофических изменений с последующим, но не обязательным присоединением воспалительного процесса в динамике заболевания, а общей экспериментальной базой — обнаружение гипоксии пародонта, предшествующей или сочетающейся с поражениями микрососудов на ранних стадиях развития заболевания.
Так в работах И. О. Новика было выявлено закономерное резкое падение потребления кислорода дистрофически измененными тканями пародонта. Это позволило ему предложить рабочую гипотезу последовательности событий патогенеза, в которой причиной развития функциональных и структурных изменений сосудов является тканевая гипоксия. Для объяснения же причины возникновения самой гипоксии он фактически привлек известные данные о развитии местного гиповитаминоза С при нарушении нейротрофической регуляции.
Однако результаты последующих гистохимических, электронно-микроскопических и традиционных гистологических исследований внесли принципиальные изменения в описанную схему. Прежде всего, было обнаружено инициальное значение нарушения энергетического обмена эндотелия обменных микрососудов, связанного со структурными изменениями митохондрий и гипофункцией локализованных в них дегидрогеназ.
Указанными авторами впервые описана также, в тесной связи со стадиями заболевания, последовательность вызываемых гипоксией эндотелия органических поражений сосудов от мукойдного набухания до гиалиноза и склероза, резкого повышения проницаемости гистогематического барьера для жидкости, белка и флюоресцирующих красителей, особенно четко выявляющегося в условиях гидростатической нагрузки. Далее этот комплекс сосудистых изменений приводит, по их представлениям, к генерализованной кислородной недостаточности пародонта, вызывающей его дистрофию с соответствующими метаболическими и структурными нарушениями.
Последняя концепция имеет ряд недостатков. Так, в патогенетическом отношении это, прежде всего отсутствие хотя бы предположительной взаимосвязи со всеми остальными молекулярными, клеточными и системными механизмами развития заболевания. Отказ от первоначальных представлений И. О. Новика об инициальном значении нейродистрофического процесса в развитии гипоксии пародонта, в целом оправданный современными данными, без его альтернативной замены каким-либо другим причинным моментом оставляет открытым вопрос об истоках первоначального повреждения митохондрий эндотелиальных клеток обменных микрососудов.
Четвертая оригинальная концепция, сформулированная Н. А. Жижиной и А. А. Прохончуковым и успешно продолженным в ЦНИИС Минздрава СССР фундаментальным исследованиям функционального состояния и механизмов нарушения местной гемодинамики в тканях пародонта.
В этих исследованиях реографически были продемонстрированы нарастающие затруднения притока и оттока крови вследствие падения эластичности и повышения тонуса вплоть до спазма и последующей облитерации сосудов в динамике поражения пародонта у людей.
Нарушения реактивности сосудов на функциональные пробы заключались в резком увеличении латентного периода и продолжительности ответной реакции при значительно меньшей ее выраженности. С помощью полярографического метода была выявлена ранняя фаза повышения рО2 в десне при катаральном гингивите, сменяющаяся его падением при хроническом течении и прогрессирующим уменьшением этого показателя по мере вовлечения в патологический процесс костной ткани пародонта, причем в начальной стадии заболевания функциональный ответ на кислородную пробу существенно увеличивался, а в развившейся стадии несколько уменьшался. Важно, что у пациентов без сопутствующей патологии перечисленные изменения носили исключительно местный характер.
На основе сравнительного анализа ряда литературных данных указанными авторами была предложена новая концепция патогенеза заболеваний пародонта, краеугольным камнем которой является представление об инициальной, триггерной роли функциональных изменений сосудов пародонта, возникающих под влиянием медиаторов воспаления и проявляющихся в изменении реактивности и тонуса сосудистой стенки, которые последовательно в динамике заболевания сменяются органическими поражениями атеросклеротического характера с полной утратой способности к приспособительным, компенсаторным реакциям.
Фактически в этой концепции прослеживаются в тесной взаимосвязи две самостоятельные цепи патогенеза — метаболическая и сосудистая, четко разграниченные авторами по этапам развития на 4 фазы функциональных и органических (обратимых или необратимых) нарушений, приводящих к возникновению воспаления, аллергии и затем деструкции тканей пародонта, т.е. к отчетливой последовательности патогенетических событий, характерных для пародонтита.
Метаболический путь патогенеза при этом запускается патогенным воздействием микрофлоры зубной бляшки, активирующей эмиграцию полиморфонуклеаров и калликреинкининовую систему слюны. С этого момента по одной линии развиваются местные нарушения метаболизма, гипоксия с ацидозом, торможением анаболизма, патологией межклеточных мембран. А по другой — последовательно дилатация, спазм резистентных сосудов, гипотония емкостных сосудов, капилляроваскулит и артериолосклероз.
Все серьезные достоинства и определенные недостатки этой теории, образно говоря, не просто функционально, но органически связаны между собой. Во-первых, выявленная последовательность взаимосвязанных метаболических и функциональных событий в развитии необратимых структурных изменений сосудов имеет важное теоретическое значение не только и даже не столько для стоматологии, сколько для общей патологии, так как очевиден ее универсальный характер, применимый для воспалительно-дистрофического процесса любой локализации. С другой стороны, развиваемая концепция почти полностью абстрагируется от постадийных клинических проявлений гингивита, пародонтита и пародонтоза, не содержит их патогенетической привязки к анализируемым сосудисто-метаболическим процессам, что является несомненным преимуществом более ранних разработок.
Во-вторых, на конкретном примере частной патологии авторы рассматривают общую проблему взаимоотношения строения и функции, являющуюся одной из центральных методологических проблем морфологии и физиологии в дискуссионной статье первичность функциональных изменений сосудов пародонта, по нашему мнению, справедлива только в пределах одного структурного уровня — тканевого, на котором сосуд впервые выступает в качестве целостного самостоятельного элемента со своей специфической функцией. Трактуемая в этом смысле основная идея авторов о последовательной смене функциональных изменений сосудов органическими находит подтверждение в специальных экспериментах по изучению влияния повышенного венозного давления на компенсаторную перестройку структуры сосудов, в которых убедительно продемонстрировано, как длительное напряжение функции клетки становится причиной ее повреждения, даже необратимого.
С другой стороны, нельзя забывать, что в основе всех функциональных изменений всегда лежат синхронно и сопряжено протекающие структурно-морфологические эквивалентные изменения. Только ультраструктурные повреждения клетки предопределяют так называемые «функциональные» изменения ее жизнедеятельности, что было непосредственно показано и на примере сосудов пародонта. Это представление, к сожалению, не учитывается в соответствующей схеме анализируемой главы, хотя мы, как прямо сказано в ранее изданной монографии, «под недостаточностью функции понимают такое ее качественное состояние, которое возникает в результате органических изменений тканей (систем, органов) или нарушений их регуляторных механизмов».
В-третьих, новым и чрезвычайно ценным для развития современной стоматологической мысли является объективное утверждение авторов об исключительной принадлежности разбираемых ими механизмов к области патогенеза заболеваний пародонта. Весь накопленный в настоящее время экспериментаторами и клиницистами фактический материал однозначно свидетельствует о непременном вовлечении микрососудистого русла пародонта в качестве мишени действия этиологических и промежуточных патогенетических причинных факторов развития патологического процесса, что послужило даже основанием для ошибочной трактовки в ряде перечисленных теорий наблюдаемых местных и общих расстройств гемодинамики в качестве причины (в этиологическом понимании) патологии пародонта.
Следует отметить, что схема патогенеза разработанная Н. А. Жижиной и А. А. Прохончуковым имеет ряд недостатков. Весь сложнейший комплекс триггерных нарушений иммунного ответа, образования и освобождения в месте повреждения биологически активных веществ в ней сведен к усилению эмиграции полиморфонуклеаров и активации калликреинкининовой системы, а непосредственно следующие за ними нарушения проницаемости мембран и барьеров перемещены на значительно более поздние этапы развития патологического процесса. Вывод о первичном характере дилататорной сосудистой реакции делается только на основании косвенных результатов полярографических исследований напряжения кислорода, а не прямых реографических данных такого рода, которые отсутствуют в предшествующих фактологических публикациях.
Таким образом, все проанализированные теории, направленные на объяснение сосудистых механизмов патологии пародонта, базируются на различных теоретических и фактических предпосылках. Поэтому выявленные недостатки одной теории часто компенсируются достоинствами другой, что делает актуальной необходимость их интеграции на единой методологической основе.
Применительно к воспалению пародонта и разобранным выше сосудистым механизмам его патогенеза причиной болезни, по современным данным, является ассоциация обитающих в ротовой полости стрептококков, бактероидов и актиномицетов, взаимодействие которых с макроорганизмом динамически детерминизировано специфическими законами биоценотического уровня организации живой природы. Функциональная система, направленная на элиминацию инфекционного агента, в данном случае формируется преимущественно из гуморальных и клеточных элементов иммунной системы с ограниченным участием лишь обязательных для осуществления антимикробного эффекта элементов других систем организма. Запуск магистрального пути статогенеза с формированием характерной для него патологической системы происходит с момента образования гиперактивной детерминантной структуры, скорее всего в системе комплемента, лимфокинов или лизосомальных ферментов, последовательно и закономерно вызывая развитие клинических симптомов, разумеется, во взаимодействии с механизмами подавления и ликвидации патологической системы, компенсации и восстановления нарушенных функций. Ранее Барабаш Р. Д. показал, что защитные по своей сути реакции молекулярных, клеточных и тканевых систем трофики и иммунитета пародонта приобретают патологическую форму вследствие избыточности их приспособительной активации и одновременного нарушения реактивности включаемых в них элементов. При таком подходе, очевидно, что результатом действия магистрального пути патогенеза будут местные нарушения структуры и функции всех или большинства элементов очага повреждения, в том числе сосудов соединительной ткани, а в масштабе всего организма, если исключить расстройства пищеварения после расшатывания и выпадения зубов, — только перестройка системы иммунитета.
Специфика множественных побочных путей патогенеза основных болезней пародонта в свою очередь определяется свойствами конкретных этиологических условий внешней и внутренней среды, каждое из которых в отдельных клинических случаях может выдвигаться на первый план в качестве основного повода, подготавливающего достаточный общий фон для сенсибилизации организма и освобождения действия микробной причины заболевания. Так, на видовом уровне включается вероятностный механизм супрадетерминации распространения патологии в связи с травматизацией высшей нервной деятельности, нарушениями характера питания и гиподинамией.
Характерным свойством побочных (для патологии пародонта, но магистральных для других внутренних болезней) путей реализации в патогенезе предрасполагающего действия этиологических условий является общий, генерализованный характер реакции организма, вызывающий эквивалентные местные изменения реактивности в очаге поражения. Адекватность этого положения для всех перечисленных условий возникновения и развития заболеваний пародонта может быть легко проиллюстрирована, например, эмоциональным стрессом. Развивающийся под его влиянием побочный путь патогенеза связан с локализацией гиперактивной детерминантной структуры в образованиях промежуточного мозга, определяющей особенности формирования соответственно функциональной и патологической систем на базе регуляторных центров эндокринной и вегетативной нервной систем. Опосредуемое в этой ситуации глюкокортикоидами подавление всего тимико-лимфоцитарного аппарата неизбежно приводит к снижению и местного иммунитета органов ротовой полости, усиленный липолиз с накоплением НАД-Н переключает энергетический обмен организма на пути глюконеогенеза, а в сочетании с неврогенными и биогенными нарушениями сосудистого тонуса резко ускоряет развитие атеросклеротического поражения магистральных сосудов и генерализованного артериолосклероза, также ограничивающего функциональные резервы микроциркуляторного русла пародонта.
Сейчас мы представляем вашему вниманию теорию роли сосудистой системы в патогенезе заболеваний пародонта.
Нарушения метаболических процессов в тканях пародонта, возникающие в результате ряда экзо- и эндогенных воздействий и дисфункции ферментативных систем, вызывают расстройство кровоснабжения пародонта. Микроциркуляция крови играет ключевую роль в обеспечении тканей и компенсаторных процессах при развитии как воспалительных, так и ишемических поражений тканей.
Изучение вопросов регуляции системы микроциркуляции при воспалении и пародонте позволяет оценить роль функциональных изменений при воспалении, разработать терапевтические мероприятия и оцепить их эффективность.
В связи с этим необходимо рассмотрев особенности микроциркуляции и пародонте в норме и в динамике развития хронического воспалительного процесса.
М. К. Гейкин (1957) предложил микрососудистую сеть десны условно разделить на 3 зоны: 1 — десневой край, 2 — прикрепленная десна, 3 — переходная складка. Исследованиями отечественных ученых было установлено, что число и форма капилляров подвержены значительным колебаниям в зависимости от удаленности от края десны. Изучение микроциркуляторного русла десны человека в норме и патологии, в возрастном аспекте было проведено Н. А. Левиным (1978). В основе патофизиологического механизма нарушения микроциркуляции лежат параллельные изменения в трех взаимосвязанных компонентах: кровь — стенка микрососуда — окружающее интерстициальное пространство. В интактном пародонте в 1-й и 2-й зонах наблюдаются только капиллярные петли, по форме похожие на «дамские шпильки», вершиной обращенные к десневому краю. При 100-кратном увеличении они видны в 1-й зоне в виде запятых, а во 2-й зоне они уже заметны вместе с венулярными и артериолярными браншами. В 3-й зоне имеются все элементы микрососудистой сети десны. Венулярный отдел микроциркуляторного русла десны очень богат элементами с обилием анастомозов между ними. В норме ни в одной из зон десны не наблюдается извитости микрисосудов. Ток крови непрерывный и пульсирующий в артериолах и венулах, а также в функционирующих капиллярах. Для 3-й зоны десны характерно наличие плазматических капилляров, в которых отсутствует поток эритроцитов. При тяжелой форме пародонтита отмечается спазм артериол и прекапиллярных сфинктеров. В очагах хронического воспаления капилляры извиты и расширены и содержат варикозные участки. Вокруг капилляров и посткапиллярных венул наблюдаются микрокровоизлияния и лейкоцитарные инфильтраты.
Воспаление в десне делится на четыре последовательно развивающихся стадии (см. Рис. 11)
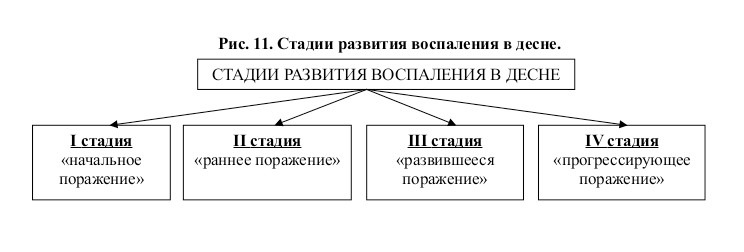
Первая стадия, называемая «начальное поражение», — является нормальной реакцией тканей десны на начало колонизации бляшки. Она возникает в течение четырех дней и заключается в усиленной сосудистой реакции и повышенной проницаемости ткани, что делает возможным поступление жидкости и клеток из крови в пораженную область. Вторая стадия — «раннее поражение» — начинается через неделю после формирования бляшки и выражается в появлении клинических симптомов гингивита в дополнение к имеющимся лимфоцитам и макрофагам. Третья стадия — «развившееся поражение» — характеризуется дальнейшей деструкцией соединительнотканных волокон, образованием десневого кармана и преобладанием клеток плазмы крови в тканях. Последняя стадия воспаления — «прогрессирующее поражение» характеризуется деструкцией опорно-удерживающих тканей. Эта стадия известна как пародонтит. Стабилизировать состояние тканей пародонта внутри каждой из этих стадий на долгий период, предупредить их деструкцию можно в результате лечения.
Ранним признаком расстройства микроциркуляции в пародонте является локальный спазм артериальных сосудов, застойные явления в венулярном отделе и снижение интенсивности кровотока и нутритивном звене. Дефицит капиллярного кровотока отражается на механизмах, регулирующих изменения гемодинамики в капиллярах, изменении гидростатического давления, что отражается на транскапиллярном массопереносе, микроциркуляции и гемореологии (Козлов В. И., 1987., Козлов В. И., 1993.). Кровоток на микроциркуляторном уровне подвержен временным и пространственным вариациям. Эта изменчивость во многом зависит от функциональной активности органа, динамического постоянства внутренней среды и устойчивости основных физиологических функций организма. Расстройство капиллярного кровотока, начинающееся со снижения его интенсивности, а заканчивающееся развитием капиллярного стаза, можно рассматривать как центральное звено в развитии микроциркуляторных нарушений, поэтому объективная регистрация состояния капиллярного кровотока важна для прогноза результатов лечения патологических процессов в пародонте.
На протяжении последних 15—20 лет практическое внедрение современных эффективных методов профилактики и лечения одного из таких основных стоматологических заболеваний как пародонтоза — устойчиво занимает одно из важных мест в исследованиях как отечественных, так и зарубежных стоматологов.
Вместе с тем среди жителей России частота поражения заболеваниями пародонта практически не снижается, а имеет тенденцию к распространению, особенно среди людей молодого возраста.
По данным Всемирной организации здравоохранения воспалительные заболевания тканей пародонта часто встречаются среди всей стоматологической патологии и составляют от 10 до 65%. Очень высок уровень заболеваний пародонта в возрасте 15—19 лет (55 — 89%) и в возрасте 35 44 года (65 — 98%). Распространенность зависит от сопутствующих заболеваний, характера питания, демографических особенностей, профессиональных факторов, климатогеографических условий.
Большинство исследователей отмечает тесную взаимосвязь заболеваний пародонта с патологией различных органов и систем человека: пищеварительной, эндокринной, сердечнососудистой, мочевыделительной и др. Их развитие нередко приводит к деструктивным изменениям в тканях пародонта, особенно у лиц молодого возраста. При отсутствии своевременного лечения патологии возможны такие серьезные последствия, как формирование деструкции костной ткани, увеличение подвижности и выпадение зубов, ослабление резистентности организма.
Течение воспалительных заболеваний пародонта зависит от факторов, как местного, так и общего характера. Многоплановость патогенеза воспаления тканей пародонта заключается в активации патогенной микрофлоры полости рта, снижении иммунитета и нарушении микроциркуляции в пародонте на фоне изменения общей реактивности организма.
Одной из актуальных проблем современной пародонтологии остается поиск эффективных способов лечения заболеваний пародонта воспалительной природы.
Терапевтические мероприятия, направленные на устранение патогенных факторов, должны носить комплексный характер. В настоящее время в пародонтологической практике широко используются такие препараты, как антибиотики, сульфаниламиды, нестероидные противовоспалительные препараты и др. Однако использование химически синтезированных лекарственных средств сопряжено с возникновением аллергических реакций. При выборе методов лечения предпочтительнее лекарственные средства растительного происхождения в сочетании с традиционной терапией. В связи с этим следует считать оправданной разработку способов лечения, улучшающих микроциркуляцию, устойчивость тканей пародонта к патогенной микрофлоре. Одними из них являются использование фитопрепаратов и гирудотерапия. Такой подход будет способствовать повышению эффективности лечения, увеличению продолжительности сроков ремиссии.
Несмотря на большой арсенал средств и методов, лечение воспалительных заболеваний пародонта остается не решенной до конца проблемой. В связи с этим актуален поиск новых подходов к лечению заболеваний пародонта. Лечение больных хроническим генерализованным пародонтитом должно быть направлено на коррекцию общего и местного иммунитета, нормализацию состояния МЦР пародонта, микробиоценоза полости рта и пародонтального кармана. К таким методам относится гирудотерапия. Гирудотерапия обладает многогранным действием и оказывает рефлекторный, обезболиващий, противоотечный, противовоспалительный, иммуномодулирующий, противосвертываюший эффекты. Вместе с тем, недостаточно изучено и не всегда подтверждено дополнительными исследованиями влияние гирудотерапии при заболеваниях пародонта.
Не имеется достаточных, клинических наблюдений при сочетанном поражении тканей пародонта и внутренних органов. В связи с этим необходимым является научное обоснование применения и оценка клинической эффективности гирудотерапии при лечении воспалительных заболеваний пародонта.
В этой связи важное значение приобретают новые подходы к планированию лечебно-профилактической работы, направленной на совершенствование диагностики по своевременному выявлению патологического процесса, его купированию и стабилизации, а также этиопагогенетической терапии и профилактики заболеваний пародонта, а также на устранение пародонтопатогенных факторов.
Следует также отметить, что в последнее время при лечении заболеваний пародонта, наряду с медикаментозными, хирургическими и ортопедическими методами, все более широкое применение находят физиотерапевтические методы и фитотерапия, которая, по мнению многих авторов, является одним из перспективных направлений в стоматологии, так как она предлагает использование биологически активных веществ растительного происхождения.
По мнению этих же авторов её возрастающая популярность объясняется тем, что лекарственные препараты растительного происхождения обычно действуют мягче, чем синтетические. Кроме того, у них меньше побочных эффектов и они реже вызывают аллергические реакции.
Из литературы и многочисленных публикаций известно, что умело составленные сборы можно при необходимости принимать длительно (годами) без опасения причинить вред больному, а это имеет важное значение при лечении хронических заболеваний полости рта.
Вместе с тем, рациональная фитотерапия помогает восстановлению нарушенного обмена веществ, стабилизации артериального давления, улучшению коронарного кровообращения и кровоснабжения головного мозга, способствует повышению работоспособности и т. д.
Кроме того, применение фитотерапии патогенетически обосновано при многих заболеваниях, как внутренних органов, так и систем организма человека. Однако, несмотря на наличие отдельных публикаций об использовании лекарственных растений при лечении стоматологических заболевания (кариес зубов, пульпит, периодонтит, болезней пародонта и слизистой оболочки полости рта) в специализированной стоматологической литературе отсутствуют убедительные сведения о сравнительной эффективности различных лекарственных растений и сборов из них, и лекарственных форм из растительного сырья, а также способы использования последних в комплексной терапии воспалительных заболеваний пародонта, особенно на хирургическом этапе лечения в развившейся стадии генерализованного пародонтита.
Поэтому совершенствование и повышение эффективности комплексного лечения заболеваний пародонта путем поиска новых и современных способов фитотерапии, научное обоснование целесообразности их применения является актуальной задачей для практического здравоохранения.
Исследования, проводимые в этой области, безусловно, помогут выявить оптимальные методы использования лекарственных форм из растительного сырья в до и послеоперационном периодах у больных генерализованным пародонтитом. Кроме того, это также может обеспечить эффективность местных лечебных мероприятий, а именно: предупредить в тканях пародонта прогрессирование и рецидивирование воспалительного процесса.
Ниже мы попытаемся провести анализ воспалительных заболеваний пародонта, а также причины возникновения и механизмы его развития.
Воспалительные заболевания пародонта представляют собой одну из наиболее сложных проблем современной стоматологии. Значительная распространенность, большая потеря зубов у пациентов, неблагоприятное влияние очагов пародонтальной инфекции на организм — все это определяет как медицинскую, так и социальную значимость данной проблемы.
К настоящему времени установлено, что основными этиологическими факторами в развитии воспалительных заболеваний пародонта является изменение состава микрофлоры полости рта и, в частности, пародонтального комплекса, нарушение местных иммунологических реакций и функционального состояния тканей пародонта, а также состояние внутренних органов и систем организма.
Основную роль в возникновении и развитии заболеваний пародонта отводят воздействию местных факторов — микробной бляшке, патогенной флоре смешанной слюны, различным видам нарушения артикуляционного равновесия, ослаблению специфических и неспецифических факторов защиты полости рта. В то же время, признавая важность отдельных факторов, нельзя не учитывать роль наследственности и питания. Ведущее место среди исследований этого направления занимают работы о роли микробного фактора. Сторонники этой концепции отводят действию бактериальных токсинов роль пускового механизма в развитии воспаления соединительной ткани пародонта. Круговая связка разрушается вследствие действия микроорганизмов бляшки и воспаления в 2% случаев у лиц 17 лет и в 98% у лиц старше 60 лет. Особое внимание при этом уделяется действию микробных эндотоксинов (липоидно — полисахаридно — нуклеиновые комплексы), способных проводить к выраженным морфологическим изменениям: остановке митоза, вакуолизации и лизису клеток пародонта, сенсибилизации и аутоаллергии организма.
Возникновению воспалительных изменений в пародонте способствуют общие заболевания организма, которые снижают резистентность околозубных тканей по отношению к бактериям зубной бляшки. Важнейшими из них являются: сахарный диабет, лейкемия, гипо- и авитаминозы, заболевания желудочно-кишечного тракта.
Ассоциация бактерий, включающая бактероиды, фузобактерии, актиномицеты и микроанаэробные стрептококки, является ведущей в развитии микробной инвазии в ткани пародонта. По рекомендации ВОЗ (1995) среди нормальной флоры полости рта с анаэробным типом дыхания следует выделять так называемые «пародонтопатогенные» виды, которые отличаются высокими адгезивными, инвазивными и токсическими свойствами по отношению к тканям пародонта. Бактериологическое исследование позволило выявить, что в десневой борозде бляшка состоит, в основном, из грамположительных факультативных анаэробных кокков и палочек (Streptococcus sanguis — около 1/4 и Streptococcus mitis — 1/8 всех изолятов). В меньших количествах представлены микрококки, Streptococcus epidermidis, пептострептококки. Из грамположительных факультативных анаэробных палочек 35% составляют актиномицеты: A. israelii, A. naeslundii, A. visicosus, A. odontolyticus, а также Rothia dentocariosae, Araelmia propionica (Propionibacterium).
На долю факультативно-анаэробных грамположительных кокков приходится 40% изолятов, грамположительных анаэробных палочек 35%, грамотрицательных анаэробных палочек — 13%, грамположительных факультативно анаэробных палочек — 10%.
Равновесие в микробиоценозе полости рта определяется как бактериальным синергизмом, так и антагонистическими отношениями внутри сообщества. У больных с воспалительными заболеваниями пародонта при темнопольной микроскопии выявляется значительный сдвиг в сторону палочковидных форм и спирохет, количество которых возрастает до 40%. Соотношение подвижных форм к неподвижным увеличивается до 1:1 (в норме 1:49). Электронно-микроскопическое исследование поддесневой бляшки при пародонтите выявило, что к цементу прикреплены, в основном, грамположительные микробы. Грамотрицательные клетки, жгутиковые и спирохеты присутствуют в большом количестве в неплотных слоях поддесневой бляшки, которая распространяется до верхушечной части кармана.
В настоящее время, по данным ВОЗ, к пародонтопатогенным видам относят, прежде всего, двух представителей группы бактероидов — Роrphyromonas gringivalis и Prevotella melaninogenica. Эти грамотрицательные микробы обладают способностью прилипать в большом количестве к эпителиальным клеткам, гидроксиапатиту и к грамположительным бактериям. Их адгезивные свойства ингибируются в присутствии человеческой слюны и сыворотки крови, однако способность к коаггрегации с грамположительными бактериями при этом сохраняется.
Актиномицеты, стрептококки, грамотрицательные бактерии группы бактероидов (Porphyromonas gingivalis, Prevotella melaninogenica), а также анаэробные спириллы, спирохеты и фузобактерии формируют «пародонтопатогенные виды» (по классификации ВОЗ, 1995), которые отличаются от других высокоадгезивными, инвазивными и токсическими свойствами. Ассоциация спирохет с актиномицетами является оптимальной для пенетрации тканей пародонта и развития воспаления. Что же касается стафилококков и пиогенных стрептококков, то их роль как этиологического фактора менее значима.
Микроорганизмы, встречающиеся при болезнях пародонта, продуцируют некротизирующие экзотоксины и ферменты такие, как коллагеназа, эластаза, фибриполизин, гиалуронидаза и другие. Некоторые бактерии выделяют кислую фосфатазу и фосфолипазу — α, которая способствует усилению воспаления и резорбции костной ткани пародонта).
Пародонтопатогенный потенциал бактерий определяется как прямым повреждающим действием вырабатываемых ими продуктов, так и запуском иммунного ответа на антиген микробов.
При исследовании содержимого десневого кармана у больных пародонтитом определяются иммуноглобулины классов A, G, М, фракции комплемента СЗ, С5, лейкоциты. Ткани десны обильно инфильтрированы плазматическими клетками, лимфоцитами и макрофагами (моноцитами). Все это позволяет считать, что многие реакции антиген — антитело, проявления клеточного иммунитета происходят именно здесь, в тканях пародонта и альвеолярной кости. Если придерживаться только микробной этиологии пародонтита, то очевидно, что для развития заболевания должны сочетаться следующие условия:
1. Присутствие пародонтопатогенных видов бактерий в количестве достаточном для того, чтобы начался патологический процесс.
2. Условия обитания в нише должны способствовать росту и размножению бактерий.
— В тканях пародонта должны отсутствовать микробы-антагонисты пародонто-патогенных бактерий.
— Микроб должен пространственно локализоваться так, чтобы он или продукты его жизнедеятельности могли действовать на клетки-мишени.
— Организм человека должен быть чувствительным к микробам или продуктам их жизнедеятельности.
В возникновении и развитии воспалительных заболеваний пародонта (гингивита, пародонтита) большинство специалистов придают ведущую роль микроорганизмам зубной бляшки. Исследования, проведенные этими учеными, по изучению микрофлоры зубодесневых желобков здорового человека доказывают преобладание в них стрептококков и актиномицетов. Ими выявлено несколько видов микроорганизмов, которые играют важную роль в предупреждении колонизации зубодесневой борозды более патогенными микроорганизмами, например, Strr. sanguis, Str. uberis, Veil lonella parvula, Rothia dentocariosa, Сарnocytophaga осhracеа, Ргоpionibacterium acnes.
По мнению же В. С. Иванова (1998) в возникновении гингивита важную роль играет количество микробов и их вирулентность, что обусловливается состоянием гигиены полости рта, особенностями питания, а также рядом патофизиологических факторов, а именно: составом, свойствами и функциональными нарушениями слюны, наличием ротового дыхания. К содействующим факторам автор относит наличие зубного камня, анатомические особенности зубов, кариес и некоторые ятрогенные факторы. Немаловажное значение также придается окклюзионной травме и состоянию общей резистентности организма, определяемой возрастом, наличием системных заболеваний внутренних органов, генетическими нарушениями, алиментарным фактором, влиянием лекарственных препаратов и рядом психосоматических факторов. Специфические микробные факторы при неадекватной реактивности организма способствуют прогрессированию течения гингивита и переходу его в пародонтит.
Значение неудовлетворительной гигиены полости рта, как одного из ведущих факторов развития воспаления в тканях пародонта подтверждено исследованиями Т. И. Лемецкой (1966), а также в работах Хазановой В. В.и Земской Е. А. (1976), в которых установлено наличие стойкой внутренней связи между распространенностью воспалительных заболеваний пародонта, тяжестью их течения и уровнем гигиены полости рта независимо от того, какую форму оно принимает — гингивита, стоматита или пародонтита.
В этих работах показано, что количество бляшек на поверхности коронковой части зуба свидетельствует не только об интенсивности бляшкообразования, но и о частоте и тщательности их удаления, то есть о гигиене полости рта, которая фактически служит отправной точкой интенсивности скопления микробов на твердых тканях зубов.
Микроорганизмы полости рта, которые образуют колонии в области десневого края, и вызывает воспалительную реакцию в тканях десны.
Результаты многих исследований также указывают на роль микробной бляшки, как главного этиологического фактора воспалительных заболеваний пародонта.
Полученные эпидемиологические сведения говорят о наличии связи между зубным камнем и болезнями пародонта (гингивитами, пародонтитами), которые вероятнее всего касаются не особенностей минерального состава зубного камня и его объема, а, скорее, о характере скоплений микробов персистирующих на поверхности камня, что создает благоприятные условия для адгезии микробных бляшек на поверхности зуба.
Несоблюдение должной гигиены полости рта вызывает существенные изменения микробного состава в различные сроки формирования бляшки: в однодневных микробных, бляшках преобладают кокки, в трехдневных — кокки и палочки, в шестидневных — наряду с кокками и палочками, появляются подвижные формы — спирохеты, а также образуются микробные комплексы в форме неправильного шара с бугристой поверхностью или изогнутой ленты, состоящей из взаимопереплетающихся кистей.
Результаты микробиологических исследований при гингивите показывают рост количества актиномицетов, а также грамотрицательных бактерий: Fusobacterium, Veillonella, Treponema.
Считается, что гингивит, по своей сути — это воспаление соединительной ткани в ответ на раздражение за счет микроорганизмов и их токсинов, особенно эндотоксинов грамотрицательной микрофлоры, которые проявляют агрессивное воздействие в месте бактериальной аппликации, стимулируют формирование антител, вызывают сосудистые расстройства, нарушают клеточный обмен.
Проникновение эндотоксинов в ткани становится возможным в результате действия микробных ферментов (гиалуронидаза, хондроитинсульфатаэа, протеаза, коллагеназа и т.п.). Если лечение не проводится, то гингивит, как первичное заболевание с прогрессирующим течением, переходит в пародонтит. Главную роль в этом процессе отводят патогенной микрофлоре. Различные виды воспаления десны и соответствующие им формы гингивитов обусловлены только индивидуальной реактивностью больного.
Следует отметить, что на сегодняшний день признается существование пародонтопатогенной микрофлоры, в основном относящейся к грамотрицательным анаэробам, и группы Bactoroides, и способствующей возникновению быстро прогрессирующего пародонтита.
Агрессивность этой микрофлоры связывают с наличием в ней протеолитических ферментов и эндотоксинов, непосредственно повреждающих ткани десны и зубоэпителиального прикрепления и вызывающих негативные изменения в местных защитных реакциях организма.
Понимание этиологии и патогенеза пародонтита необходимо не только для установления роли микробов в этом процессе, но также и для выяснения условий, способствующих росту бляшки, определению роли местных и системных факторов, которые могут влиять на резистентность или чувствительность тканей пародонта к бактериям, продуктам их жизнедеятельности. Изучение индивидуальных особенностей организма хозяина в функционировании деструктивных и защитных механизмов при пародонтите позволяет оптимизировать, комплексное лечение данного заболевания.
Между тем даже исследования последнего времени пока не позволили достоверно выявить определенного возбудителя, причастного к появлению воспалительного процесса в тканях пародонта. Поэтому вполне вероятно, что инфекционный агент является предполагаемым и, возможно, не единственным этиологическим фактором, реализующим свое патогенное действие через сложные взаимоотношения с аутореактивными клетками иммунной системы организма человека.
Вместе с тем, одним из этиологических факторов заболеваний пародонта считают и хламидийную инфекцию, учитывая большую распространенность последней, прежде всего у молодого населения страны.
Микробиологические исследования в области воспалительных заболеваний пародонта говорят о том, что современные методы диагностики позволяют выявить наличие более 500 видов бактерий, верифицированных в поддесневых зубных бляшках, и только дюжину из них можно связать с этиологией этих заболевании. Эти возбудители получили название «маркерных» микроорганизмов.
Имеются также сведения, подтвержденные экспериментальными исследованиями, о роли перикисного окисления липидов в патогенезе пародонтита. Сформулирована концепция перикиснолизосомальных механизмов в развитии воспалительных заболеваний пародонта.
Наличие соматических заболеваний в организме человека вносит существенное отличие в этиопатогенез заболеваний пародонта. Для сочетанной патологии характерно взаимоотягощающее течение заболеваний за счет наличия тесной функциональной связи между пораженными органами.
Желудочно-кишечный тракт и ткани пародонта имеют тесную анатомическую, нервную и гуморальную взаимосвязь. Они являются различными отделами единой морфофункциональной системы, поэтому полость рта тонко реагирует на изменения, происходящие о ней. Заболевания пародонта при патологии желудочно-кишечного тракта встречаются у 68—90% обследованных пациентов.
Генерализованный пародонтит представляет собой воспалительно-дистрофический процесс, сопровождающийся глубокими деструктивными изменениями тканей под влиянием сочетанного воздействия различных экзо- и эндогенных факторов. В то же время патоморфологической основой язвенной болезни также является хроническое воспаление с деструкцией слизистой и подслизистой оболочки желудка и двенадцатиперстной кишки. Общность патоморфологических процессов при пародонтите и язвенной болезни гастродуоденальной зоны позволяет предположить наличие единых, пусковых механизмов их развития.
Заболевания ЖКТ часто регистрируются с заболеваниями пародонта даже при удовлетворительном гигиеническом состоянии полости рта. Генерализованный пародонтит и язвенная болезнь при сочетанном течении имеют взаимоотягощающий характер. При заболеваниях пародонта, протекающих на фоне язвенной болезни, в 100% случаев развиваются воспалительно-дистрофические изменения в слизистой оболочке желудка, соответствующие активному хеликобактерному гастриту.
В комплексном лечении хронических воспалительных заболеваний пародонта необходима не только противомикробная терапия, но и восстановление кровотока в тканях пародонта.
Ряд ученых и практикующих врачей связывают развитие воспалительных заболеваний пародонта с системными поражениями: патологией центральной, периферической нервной системы, нарушениями со стороны сосудистой, иммунной и других систем.
Взаимодействие между микробами полости рта и иммунной системой человека, несомненно, играют одну из важных ролей в этиопатогенезе заболеваний пародонта и иммунологические исследования показывают, что в формировании гингивита участвуют те же патогенетические механизмы. Вместе с тем исследования показали, что при пародонтите может локально существовать Т-клеточно-макрофагальный иммунорегуляторный дисбаланс, и что он может быть антигенспецифичным.
Многие авторы отводят роль первичного фактора в развитии заболеваний пародонта нарушениям микроциркуляции крови, считая микробное воздействие вторичным, так как с возрастом изменения в кровеносных сосудах пародонта, могут влиять на резистентность организма.
Внутри каждой из этих стадий на долгий период, предупредить их деструкцию можно в результате лечения.
Ранним признаком расстройства микроциркуляции в пародонте является локальный спазм артериальных сосудов, застойные явления в венулярном отделе и снижение интенсивности кровотока и нутритивном звене. Дефицит капиллярного кровотока отражается на механизмах, регулирующих изменения гемодинамики в капиллярах, изменении гидростатического давления, что отражается на транскапиллярном массопереносе, микроциркуляции и гемореологии. Кровоток на микроциркуляторном уровне подвержен временным и пространственным вариациям. Эта изменчивость во многом зависит от функциональной активности органа, динамического постоянства внутренней среды и устойчивости основных физиологических функций организма. Расстройство капиллярного кровотока, начинающееся со снижения его интенсивности, а заканчивающееся развитием капиллярного стаза, можно рассматривать как центральное звено в развитии микроциркуляторных нарушений, поэтому объективная регистрация состояния капиллярного кровотока важна для прогноза результатов лечения патологических процессов в пародонте.
Установлено также, что первичная ответная реакция сосудистой системы пародонта на жевательную нагрузку выражается в использовании имеющихся функциональных резервов. Дальнейшее повышение нагрузки при уже использованных резервах сосудов пародонта при отсутствии адаптационных процессов приводит к глубокому нарушению функциональной активности сосудов.
Это же подтверждается исследованиями Л. С. Величко (1985). По его мнению, если повторная нагрузка действует в одном и том же направлении и повторяется через короткий период, когда еще не наступила нормализация сосудистого русла, то создаются условия для периодического нарушения транспортного подвода к зонам наибольшей физиологической деформации, нарушению трофики тканей этих зон. Развивающиеся застойные явления, как правило, обусловливают и увеличение подвижности зуба, а, значит, и нарастания влияния механического воздействия на сосудистую стенку.
Эпидемиологические же исследования подтверждают высокую распространенность гингивита и генерализованного пародонтита при патологии желез внутренней секреции.
В настоящее время получила дальнейшее развитие механическая теория этиологии и патогенеза заболеваний, пародонта, где главная роль отводится функциональной перегрузке жевательного аппарата.
Важное значение придают наследственным факторам, окклюзионной травме пародонта, анатомическим особенностям челюстей и зубов, неправильно изготовленным протезам и пломбам, бруксизму. Проведенные экспериментальные исследования на животных показывают, что зубы, имеющие пародонтальные карманы, испытывают дополнительное окклюзионное давление, при этом резорбция костной ткани ускорялась.
Ряд же специалистов склонны считать, что окклюзионное давление не является исходной причиной гингивитов или пародонтитов.
В ряде работ доказано, что неблагоприятное влияние на ткани пародонта оказывает диета, богатая углеводами.
Вместе с тем рядом ученых было высказано предположение, что психосоматический стресс предрасполагает к развитию острого гингивита. Вместе с тем другие факторы такие, как изменения в рационе питания или в контроле за бляшкообразованием, отмечаются также у лиц, страдающих гингивитом, нельзя расценивать собственно стресс как важный фактор развития заболевания.
Из проведенных исследований остается не совсем ясным, как микрофлора на начальном этапе преодолевает естественные механические, химические и биологические барьеры. По мнению Д. М. Цепова и А. И. Николаева (2002) возникновение и течение патологического процесса (ремиссия, обострение, прогрессирование, осложнения) обусловлено меняющимися взаимоотношениями макро- и микроорганизмов.
Считается, что хронизация воспалительного процесса связана, прежде всего, с недостаточностью различных звеньев иммунной системы, приводящих к накоплению иммунных комплексов, срыву адекватных реакций межклеточных корреляций, возникновению «каскадов порочных кругов» и развитию аутоиммунизации.
Из сказанного выше, становится очевидным, что ремиссия хронического заболевания остается, при кажущемся сходстве со здоровьем, стадией болезни. Этой точки зрения придерживаются многие специалисты в данной области.
Подводя итог современным представлениям на этиологию и патогенез воспалительных заболеваний пародонта, можно сделать вывод о том, что гингивиты и пародонтиты могут развиваться под влиянием как местных причин, так и сочетанного воздействия местных и общих (эндогенных) факторов на фоне измененной реактивности организма. Такие представления об этиопатогенезе воспалительных заболеваний пародонта должны обусловливать для практикующего врача-стоматолога (пародонтолога) соответствующие технологии улучшения качества индивидуальной гигиены полости рта, а также своевременного лечения общесоматических заболеваний, регулярных посещений больными врача-стоматолога с целью диспансерных осмотров и противорецидивного лечения и т. п.
Это возможно только при наличии у больного высокого уровня мотивации к лечению и проведение обучения больного основным навыкам гигиены полости рта.
Эксперты ВОЗ считают, что в 70—80% случаев успех лечения заболевании пародонта зависит от качества ухода за полостью рта.
Установлено, что регулярно за полостью рта ухаживают лишь 25—40% взрослого населения страны. Поэтому регулярные гигиенические мероприятия при заболеваниях пародонта приобретают не только профилактическое, но и лечебное значение.
Вместе с тем лечение заболеваний пародонта не сводится лишь к гигиеническим мероприятиям. Со стороны врачей-пародонтологов, гигиенистов стоматологических необходим индивидуальный подход к каждому больному, который предусматривает обязательный учет особенностей состояния как полости рта, так и всего организма в целом, а также психологии пациента. Успешным может быть только комплексное лечение, сочетающее применение различных местных и общих методов и средств воздействия на различные звенья патогенеза заболевания.
В зависимости от информированности врача о характере патологического процесса, причинах и механизмах его развития, лечение может быть этиотропным, патогенетическим, симптоматическим или сочетать в себе элементы перечисленных способов лечения.
При всех воспалительных заболеваниях пародонта лечение должно проводиться на фоне сбалансированной диеты с достаточным количеством белков и витаминов, адекватной гигиены полости рта, применения больным в виде полосканий или ротовых ванночек раствором слабых антисептиков, настоев (отваров) лекарственных трав. Ряд лечебных мероприятий является необходимым для любого воспалительного поражения пародонта. К таким местным мероприятиям относят: удаление назубных отложений, санацию полости рта, ортопедическое или ортодонтическое лечение (по показаниям), применение фармако- и физиотерапии.
Переход здравоохранения Российской Федерации на принципы страховой медицины потребовал повышения качества оказания всех видов медицинской помощи, в том числе стоматологической. Это неизбежно привело к возрастанию роли профилактических направлений в медицине, и, следовательно, привело к развитию и совершенствованию методов профессиональной гигиены полости рта.
В отличие от гингивита, пародонтит характеризуется на органном уровне наличием стойкого прогрессирующего воспаления десны, деструкцией периодонта и костной ткани альвеолярных дуг челюстей, а на уровне организма в целом — имеет место формирование хронического очага одонтогенной инфекции.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.