
Бесплатный фрагмент - Биотехнологии здоровья
Введение
Цель и задачи книги
Для кого предназначено издание (врачи, специалисты интегративной и традиционной медицины, исследователи)
Методология и источники данных (клинические исследования, патенты, международные протоколы)
Раздел 1. Понятие биотехнологий в медицине
— Определение биотехнологий в контексте клинической медицины
— Классификация биотехнологических продуктов
— Молекулярные (пептиды, рекомбинантные белки)
— Клеточные (стволовые клетки, иммуноклетки)
— Везикулярные (экзосомы, микровезикулы)
— Гибридные (технологии комбинированного действия)
— Основные направления применения в клинической практике
— Регенеративная медицина
— Антивозрастная терапия
— Иммуномодуляция
— Онкология
— Неврология и нейродегенеративные заболевания
Раздел 2. Международные стандарты и правовое регулирование
— Регуляторные органы и стандарты (FDA, EMA, ICH, ВОЗ)
— Лицензирование и сертификация биотехнологических препаратов
— Понятие серой зоны
— Препараты, не имеющие лицензии
— Причины отсутствия регистрации (этические, финансовые, патентные)
— Риски применения таких средств
— Практические примеры: препараты, разрешенные в одних странах и запрещенные в других
Раздел 3. Пептиды
— Определение и классификация пептидов
— Источники (растительные, животные, синтетические, рекомбинантные)
— Механизм действия
— Научные исследования и патенты
— Протоколы применения в клинической практике
— Дозировки, курсы, формы введения (инъекции, сублингвальные, трансдермальные)
— Комбинации с другими методами терапии
— Побочные эффекты и противопоказания
— Лабораторный контроль при применении (биохимия крови, гормональный профиль, маркеры воспаления)
Раздел 4. Экзосомы
— Определение, биогенез и свойства
— Источники (человеческие, животные, растительные)
— Механизмы межклеточной коммуникации
— Применение в медицине (регенерация, иммунология, онкология)
— Риски и ограничения использования экзосом
— Научные исследования и патенты (с датами регистрации)
— Протоколы применения экзосомов
— Внутривенные, локальные инъекции, ингаляции
— Частота и длительность курсов
— Побочные эффекты и риски (иммунные реакции, онкогенный потенциал)
— Лабораторный контроль при экзосомной терапии
Раздел 5. Стволовые клетки
— Определение и типы (эмбриональные, мезенхимальные, индуцированные плюрипотентные)
— Источники (пуповинная кровь, костный мозг, жировая ткань, зубная пульпа)
— Различия между растительными, животными и человеческими клеточными материалами
— Механизмы действия, регенерации и иммуномодуляции
— Обзор клинических исследований с датами и результатами
— Протоколы применения
— Внутривенно, локально, комбинированные методики
— Подготовка пациента, схемы курсов
— Побочные эффекты и осложнения (инфекции, иммунные реакции, риск опухолевого роста)
— Лабораторный контроль (иммунограмма, маркеры воспаления, цитология)
Раздел 6. Протоколы и клинические примеры
— Протоколы применения пептидов в антиэйдж-медицине
— Протоколы применения экзосом при постковидном синдроме
— Протоколы применения стволовых клеток при дегенеративных заболеваниях суставов
— Комбинированные протоколы (пептиды + экзосомы, экзосомы + стволовые клетки)
— Мониторинг пациента: лабораторные, инструментальные, функциональные тесты
— Кейсы из практики (описание пациента, план лечения, результаты, осложнения)
Раздел 7. Побочные эффекты и риски
— Общие закономерности побочных реакций биотехнологических препаратов
— Иммунологические осложнения
— Инфекционные риски
— Риск неопластических процессов
— Мониторинг и профилактика осложнений
Раздел 8. Рекомендации и будущее биотехнологий
— Рекомендации по внедрению в клиническую практику
— Тенденции и перспективы (генная терапия, нанотехнологии, искусственный интеллект в подборе терапии)
— Этические вопросы и информированное согласие пациентов
Приложения
— Описание пептидов
— Таблицы дозировок и протоколов
— Список международных патентов
— Перечень актуальных исследований с DOI и датой публикации
— Образцы информированного согласия
— Чек-лист лабораторных анализов для каждого вида терапии
— Рекомендации врачам по применению биотехнологических препаратов
Введение
Цель и задачи книги
«Информация в данной книге не призвана заменить услуги врачей и рекомендации квалифицированных медицинских специалистов. Все утверждения носят информационный характер. Настоятельно рекомендуется по всем вопросам проконсультироваться со своим лечащим врачом. Имеются противопоказания. Требуется консультация специалиста»
Биотехнологии за последние десятилетия заняли ключевое место в современной медицине, открывая возможности для регенеративной терапии, профилактики возрастных изменений, лечения хронических и ранее считавшихся неизлечимыми заболеваний. Данная книга ставит перед собой цель систематизировать и представить научно обоснованные сведения о применении биотехнологических методов в клинической практике, включая пептиды, экзосомы и стволовые клетки.
Основные задачи:
— дать точное определение и классификацию основных направлений медицинской биотехнологии;
— рассмотреть механизмы действия пептидов, экзосом и стволовых клеток с позиций доказательной медицины;
— описать протоколы применения с учетом международных стандартов;
— обозначить показания, противопоказания и возможные побочные эффекты;
— проанализировать существующие пробелы в регулировании, включая так называемую «серую зону»;
— предоставить врачам практические инструменты для интеграции био технологий в лечение и профилактику заболеваний.
Для кого предназначено издание
Данное пособие рассчитано на:
— врачей различных специальностей, внедряющих в практику методы регенеративной, интегративной и антиэйдж-медицины;
— специалистов интегративной медицины, объединяющих достижения современной науки и традиционных лечебных систем;
— исследователей, занимающихся разработкой, тестированием и внедрением биотехнологических препаратов;
— преподавателей и студентов медицинских вузов, изучающих современные терапевтические технологии.
Методология и источники данных
Материал книги основан на комплексном анализе данных, полученных из:
— клинических исследований (рандомизированные контролируемые исследования, мета анализы, когортные наблюдения), включенных в базы PubMed, Cochrane Library и ClinicalTrials.gov;
— международных протоколов и рекомендаций (FDA, EMA, ВОЗ, ICH);
— патентных баз данных (WIPO, EPO, USPTO) с указанием номеров патентов и дат регистрации;
— официальных фармакопей и руководств по качеству (GMP, GLP, ISO 13485);
— собственных клинических наблюдений авторов и опыта применения в мультидисциплинарной медицинской практике.
Для обеспечения актуальности, каждая глава сопровождается ссылками на источники с указанием DOI, регистрационных номеров патентов и дат публикаций. В случае описания клинических протоколов приводятся схемы мониторинга, контрольные лабораторные показатели и возможные пути модификации терапии.
Раздел 1. Понятие биотехнологий в медицине
1.1 Определение биотехнологий в контексте клинической медицины
Согласно определению Всемирной организации здравоохранения (ВОЗ) и Организации экономического сотрудничества и развития (ОЭСР), биотехнологии — это совокупность технологий, использующих биологические системы, живые организмы или их производные для создания или модификации продуктов и процессов, предназначенных для конкретных целей.
В контексте клинической медицины биотехнологии представляют собой область междисциплинарных научных знаний и практических методов, в которой достижения молекулярной биологии, генной инженерии, клеточной биологии и биохимии применяются для:
— диагностики заболеваний на молекулярном и клеточном уровнях;
— профилактики патологий путем модификации биологических процессов;
— лечения с использованием биологически активных молекул, клеток или генетического материала;
— регенерации тканей и органов;
— персонализации терапии с учетом генетических и эпигенетических особенностей пациента.
В медицинской практике под био технологическими продуктами понимаются как препараты (лекарственные средства), так и немедикаментозные технологии, в основе которых лежат:
— биомолекулы (пептиды, белки, рекомбинантные ферменты, антитела);
— клеточные структуры (стволовые клетки, иммунные клетки);
— везикулярные системы (экзосомы, микровезикулы);
— генетический материал (плазмиды, векторы для генной терапии).
Биотехнологии в клинической медицине отличаются от традиционных методов лечения тем, что воздействие на организм осуществляется на уровне первичных биологических процессов — регуляции экспрессии генов, межклеточной коммуникации, синтеза и метаболизма белков, иммунного ответа и регенерации тканей.
Международные регуляторные органы (FDA, EMA, PMDA, TGA) относят к биотехнологическим лекарственным средствам (Biological Medicinal Products, BMPs) все препараты, которые:
— Произведены с использованием живых систем или их компонентов.
— Имеют сложную молекулярную структуру, не воспроизводимую классическим химическим синтезом.
— Требуют специфических условий хранения и применения (например, поддержание «холодовой цепи»).
Пример: пептидные препараты (например, тимусные пептиды), клеточные трансплантаты (мезенхимальные стволовые клетки), экзосомальные препараты (с выделенными везикулами для стимуляции регенерации), рекомбинантные белки (инсулин, моноклональные антитела).
1.2. Классификация биотехнологических продуктов
В медицинской биотехнологии продукты условно подразделяют на четыре основные группы, исходя из уровня биологической организации и используемого механизма действия: молекулярные, клеточные, везикулярные и гибридные.
1.3. Молекулярные биотехнологические продукты
Включают биологически активные молекулы — пептиды, рекомбинантные белки, ферменты, моноклональные антитела.
Пептиды — короткие цепочки аминокислот, регулирующие межклеточные взаимодействия, процессы регенерации, синтез белков и иммунный ответ. Применяются в медицине (иммуномодуляторы, нейропротекторы, гормональные регуляторы) и косметологии (антивозрастные пептиды).
Рекомбинантные белки — молекулы, созданные с помощью технологий генной инженерии (например, инсулин, интерфероны, гормон роста, эритропоэтин). Используются для заместительной терапии, онкологии, лечения аутоиммунных и редких заболеваний.
Ферменты — белки-катализаторы, которые ускоряют биохимические реакции. Применяются в терапии (ферментозаместительная терапия, пищеварительные ферменты, антикоагулянты), а также в диагностике.
Моноклональные антитела (mAb) — высокоспецифичные белковые молекулы, распознающие определённые антигены. Используются в лечении онкологических, аутоиммунных и инфекционных заболеваний (например, анти-TNF препараты, ингибиторы контрольных точек иммунитета).
Нуклеиновые кислоты (РНК- и ДНК-препараты) — новая категория молекулярных лекарств: анти-сенс олигонуклеотиды, РНК-интерференция, мРНК-вакцины. Они позволяют избирательно регулировать экспрессию генов.
Особенности молекулярных биотехнологических продуктов
Точечное действие на молекулярные мишени.
Высокая биологическая активность и специфичность.
Возможность индивидуальной терапии (персонализированная медицина).
Необходимость парентерального или специализированного пути введения (инъекции, инфузии, липосомальные формы, носители).
Высокая стоимость разработки и производства, требующая биотехнологических платформ (клеточные линии, биореакторы).
1.4. Клеточные продукты
Содержат живые клетки, используемые для регенерации тканей, иммуномодуляции или замещения утраченных функций.
— Стовбуровые клетки — мезенхимальные, гемопоэтические, индуцированные плюрипотентные (iPSC).
— Иммуноклетки — NK-клетки, Т-лимфоциты, модифицированные CAR-T.
Особенности: потенциальная способность к интеграции в ткани и длительному функционированию, сложность стандартизации, высокие требования к условиям хранения и введения.
1.5. Везикулярные продукты
Основаны на использовании внеклеточных везикул (экзосом, микровезикул), которые переносят белки, липиды, микроРНК между клетками.
— Экзосомы — везикулы диаметром 30–150 нм, содержащие биологические сигнальные молекулы.
— Микровезикулы — более крупные везикулы (100–1000 нм), участвующие в межклеточной передаче сигналов.
Особенности: низкая иммуногенность, возможность таргетной доставки, перспективы в регенеративной медицине и онкологии.
2. Гибридные технологии
Комбинируют несколько биотехнологических подходов, например:
— Клеточные трансплантаты с предобработкой пептидами или экзосомами.
— Наночастицы, модифицированные пептидами и загруженные экзосомами.
— Генные векторы, встроенные в стволовые клетки.
Особенности: синергетическое действие, повышение терапевтической эффективности, но и рост сложности в оценке безопасности.

2.1. Основные направления применения в клинической практике
Биотехнологические методы и препараты находят широкое применение в различных областях медицины, где стандартные терапевтические подходы часто оказываются недостаточными. Ниже представлены ключевые направления, в которых их эффективность подтверждается клиническими исследованиями и международной практикой.
2.2. Регенеративная медицина
Цель — восстановление структуры и функции поврежденных тканей и органов за счет стимуляции собственных репаративных процессов или замещения утраченных клеток и матриксных структур.
Инструменты: стволовые клетки (мезенхимальные, гемопоэтические), экзосомы, пептиды роста (GHK-Cu, эпиталон), матриксные белки.
Примеры клинического применения:
— восстановление суставного хряща при остеоартрозе;
— заживление хронических трофических язв;
— регенерация миокарда после инфаркта.
Научное подтверждение: по данным метаанализа (DOI:10.1016/j.stem.2020.07.010) мезенхимальные стволовые клетки демонстрируют значимое улучшение функционального состояния тканей при дегенеративных заболеваниях.
2.3. Антивозрастная терапия (Anti-Age Medicine)
Цель — замедление или коррекция возрастных изменений на уровне клеток, тканей и систем организма.
Инструменты: пептидные биорегуляторы, экзосомы с факторами роста, теломераз-активирующие препараты, рекомбинантные антиоксидантные ферменты.
Примеры клинического применения:
— улучшение качества кожи (увеличение плотности коллагена);
— профилактика саркопении;
— поддержание когнитивных функций в пожилом возрасте.
Научное подтверждение: исследования Института биорегуляции и геронтологии РАН показали, что курсовое применение пептидов тимуса и эпифиза снижает биологический возраст по эпигенетическим маркерам на 2–5 лет (DOI:10.1016/j. ebiom.2019.10.012).
2.4. Иммуномодуляция
Цель — нормализация и усиление работы иммунной системы для борьбы с инфекциями, аутоиммунными и опухолевыми процессами.
Инструменты: иммунные клетки (NK, Т-лимфоциты), пептиды тимуса (тималин, тимоген), экзосомы с иммунорегуляторными цитокинами.
Примеры клинического применения:
— восстановление иммунитета после химиотерапии;
— коррекция вторичных иммунодефицитов;
— поддержка при хронических вирусных инфекциях (ЦМВ, ВЭБ).
Научное подтверждение: рандомизированные исследования показали, что NK-клеточная терапия увеличивает частоту ремиссии при некоторых формах рака крови до 60% (DOI:10.3324/haematol.2020.270561).
2.5. Онкология
Цель — непосредственное уничтожение опухолевых клеток или модуляция микроокружения опухоли для торможения ее роста.
Инструменты: CAR-T клетки, моноклональные антитела, онколитические вирусы, пептиды-ингибиторы ангиогенеза, экзосомы с противоопухолевыми микроРНК.
Примеры клинического применения:
— лечение острых лимфобластных лейкозов;
— терапия меланомы;
— таргетная доставка химиопрепаратов через экзосомы.
Научное подтверждение: терапия CAR-T клетками одобрена FDA и EMA для лечения ряда лимфом и лейкозов с общей эффективностью в ремиссии до 80% в отдельных группах пациентов (DOI:10.1056/NEJMoa1707447).
2.6. Неврология и нейродегенеративные заболевания
Цель — защита и восстановление нейронов, замедление прогрессирования дегенеративных процессов, стимуляция нейрогенеза.
Инструменты: экзосомы нейральных стволовых клеток, нейропептиды (семакс, кортексин), рекомбинантные нейротрофические факторы (BDNF, GDNF).
Примеры клинического применения:
— лечение последствий ишемического инсульта;
— терапия болезни Альцгеймера и Паркинсона;
— восстановление при черепно-мозговых травмах.
Научное подтверждение: применение мезенхимальных стволовых клеток с экзосомами у пациентов с инсультом улучшает моторные и когнитивные функции на 20–30% по шкале NIHSS (DOI:10.1161/STROKEAHA.120.032503).
Раздел 2. Международные стандарты и правовое регулирование
Развитие биотехнологий в медицине сопровождается не только научными достижениями, но и необходимостью строгого регулирования. Поскольку биотехнологические препараты часто имеют сложный состав, высокую биологическую активность и потенциально долгосрочное воздействие на организм, их разработка, регистрация и клиническое применение регулируются международными и национальными органами здравоохранения.
2.1. Регуляторные органы и стандарты
Ключевые мировые регуляторы:
— FDA (Food and Drug Administration, США) — управляет процессом регистрации и постмаркетингового контроля лекарственных средств, включая биотехнологические препараты. В структуре FDA выделено отдельное подразделение — Center for Biologics Evaluation and Research (CBER), отвечающее за биологические продукты (включая пептиды, стволовые клетки, экзосомы, генные терапии).
— EMA (European Medicines Agency, ЕС) — координирует оценку, надзор и контроль качества лекарств в странах ЕС. В EMA существует комитет по передовым терапиям (CAT — Committee for Advanced Therapies), который рассматривает заявки на регистрацию биотехнологических и клеточных продуктов.
— ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) — организация, разрабатывающая международные технические стандарты качества, безопасности и эффективности лекарств (например, ICH Q5A–Q5E для биотехнологических препаратов).
— ВОЗ (Всемирная организация здравоохранения) — разрабатывает рекомендации и guidelines, которые помогают странам устанавливать национальные регуляции, включая требования к производству (GMP), клиническим исследованиям и фармаконадзору.
2.2. Лицензирование и сертификация биотехнологических препаратов
Процесс лицензирования включает несколько этапов:
— Доклинические исследования — подтверждают безопасность и механизм действия на клеточных моделях и животных.
— Клинические испытания (Phase I–III) — оценивают безопасность, эффективность и оптимальные дозировки у человека.
— Регистрация препарата — подача полного досье с результатами исследований, данными о производстве и контроле качества.
— Постмаркетинговый надзор — наблюдение за безопасностью и эффективностью уже зарегистрированного препарата.
Сертификация производства — обязательное условие (GMP — Good Manufacturing Practice). Она гарантирует, что препарат производится в условиях, исключающих контаминацию, с контролем каждой партии.
Пример: рекомбинантный человеческий инсулин Humulin® прошёл все этапы лицензирования FDA и EMA, включая постмаркетинговый контроль, и считается «золотым стандартом» биотехнологического производства.
2.3. Понятие «серой зоны»
В биомедицине «серая зона» — это область применения препаратов или технологий, которые:
— не имеют официальной регистрации в конкретной стране;
— используются в клинической практике на основании ограниченных исследований или данных «off-label» (вне официальных показаний);
— распространены через частные клиники, но не прошли полную процедуру сертификации.
2.4. Препараты, не имеющие лицензии
Примеры:
— Экзосомальные препараты, произведенные из мезенхимальных стволовых клеток, которые активно используются в Южной Корее, Японии и ОАЭ, но не зарегистрированы в ЕС и США.
— Некоторые пептидные комплексы (например, «Эпиталон»), которые официально разрешены к применению в России и ряде стран Восточной Европы, но в США относятся к research chemicals.
— Клеточные трансплантаты из плаценты, применяемые в клиниках Мексики и Панамы, но находящиеся вне правового поля ЕС.
2.5. Причины отсутствия регистрации
— Этические — использование эмбриональных стволовых клеток вызывает споры и ограничения в ряде стран (например, в Германии).
— Финансовые — высокие затраты на клинические исследования (до $500 млн для выхода препарата на рынок) делают процесс нерентабельным для небольших компаний.
— Патентные — истечение патента или патентные споры могут блокировать регистрацию.
— Регуляторные различия — препарат может быть признан медицинским средством в одной стране и биодобавкой в другой, что требует разных процедур регистрации.
2.6. Риски применения таких средств
— Недостаточно изученные побочные эффекты.
— Риск контаминации или нестабильности состава.
— Отсутствие гарантии воспроизводимости эффекта.
— Потенциальная уголовная и административная ответственность врача в странах с жестким регулированием.
2.7. Практические примеры различий в регулировании
— CAR-T терапия (Kymriah®, Yescarta®) — одобрена FDA и EMA, но недоступна в большинстве стран Латинской Америки и Азии из-за высокой стоимости и отсутствия инфраструктуры.
— Пептид тимозин альфа-1 — разрешён в Италии и Китае для иммунной поддержки, но в США не зарегистрирован как лекарство, используется только в исследованиях.
— Экзосомальная терапия кожи — активно применяется в Южной Корее как косметологическая и регенеративная процедура, но в ЕС классифицируется как лекарственное средство, что требует полного цикла клинических испытаний.
Раздел 3. Пептиды
3.1. Определение пептидов
Пептиды — это короткие полимеры, состоящие из двух и более аминокислот, соединенных между собой пептидными связями. В медицине под пептидами чаще подразумеваются молекулы длиной от 2 до 50 аминокислот, обладающие высокой биологической активностью и способностью избирательно регулировать клеточные функции.
В отличие от белков, пептиды имеют меньший молекулярный вес и зачастую выполняют роль сигнальных молекул, регулирующих обмен веществ, рост, иммунный ответ, процессы регенерации и апоптоза. Их действие реализуется через связывание со специфическими рецепторами на поверхности клеток или через проникновение внутрь клетки с последующей модуляцией внутриклеточных процессов.
Историческая справка:
Первый пептид — инсулин — был выделен в 1921 году Фредериком Бантингом и Чарльзом Бестом, а его синтетический аналог был создан в 1965 году. Сегодня пептидные препараты составляют значимую часть биотехнологической фармакопеи и используются в эндокринологии, иммунологии, неврологии, геронтологии и спортивной медицине.
3.2. Классификация пептидов
Существует несколько подходов к классификации пептидов:
I. По происхождению
— Эндогенные — синтезируемые в организме человека или животных (например, гормоны пептидной природы: инсулин, глюкагон, окситоцин).
— Экзогенные природные — выделенные из растений, животных, микроорганизмов (например, циклические пептиды бактерий, антимикробные пептиды насекомых).
— Синтетические — полученные методами химического или рекомбинантного синтеза (например, тимоген, эпиталон).
II. По функции
— Гормональные (инсулин, глюкагон, соматотропин).
— Нейропептиды (эндорфины, энкефалины, вазопрессин).
— Иммуномодуляторы (тималин, тимоген, алаферон).
— Регенеративные (BPC-157, GHK-Cu).
— Антимикробные (дефензины, кателицидины).
III. По структуре
— Линейные пептиды — имеют прямую цепочку аминокислот без замыканий (эпиталон).
— Циклические пептиды — аминокислотная цепь замкнута в кольцо, что повышает стабильность и устойчивость к ферментам (циклоспорин А).
— Модифицированные пептиды — содержат посттрансляционные модификации (гликозилирование, ацетилирование), что изменяет их фармакологические свойства.
IV. По способу получения
— Химический синтез — используется для коротких пептидов с высокой степенью чистоты.
— Рекомбинантная технология — получение с помощью бактерий или дрожжей, несущих соответствующий ген.
— Ферментативный гидролиз белков — выделение пептидов из белковых субстратов.
Клиническое значение классификации:
Понимание типа пептида помогает врачу прогнозировать фармакокинетику, биодоступность, иммуногенность и риски побочных эффектов, а также выбрать оптимальный путь введения (инъекционный, сублингвальный, трансдермальный или пероральный с защитой от ферментативного распада).
3.2. Источники пептидов
Пептиды, используемые в медицине, могут иметь различное происхождение, что определяет их биологические свойства, фармакокинетику, стабильность и иммуногенность. Основные источники можно разделить на четыре категории: растительные, животные, синтетические и рекомбинантные.
I. Растительные источники
Пептиды растительного происхождения выделяются из белковых структур семян, злаков, бобовых культур, водорослей и лекарственных растений.
Примеры:
— Соевые пептиды (генистеин содержащие последовательности) — обладают антиоксидантным, гипохолестеринемическим действием.
— Пептиды хлореллы и спирулины — демонстрируют иммуномодулирующий и детоксикационный потенциал.
— Пептиды кунжутного белка — проявляют антигипертензивные свойства (ингибирование ангиотензинпревращающего фермента, АПФ).
Особенности:
— Как правило, низкая иммуногенность.
— Возможность перорального применения в составе функционального питания или нутрицевтиков.
— Ограниченная концентрация в исходном сырье требует сложной очистки.
II. Животные источники
Пептиды животного происхождения получают из органов и тканей млекопитающих, рыб, морских беспозвоночных.
Примеры:
— Тимусные пептиды (тималин, тимоген) — выделяются из тимуса крупного рогатого скота, используются для иммуномодуляции.
— Кортексин — комплекс пептидных фракций из коры головного мозга крупного рогатого скота, применяется в неврологии.
— Коллагеновые пептиды из кожи и хрящей рыб — используются в дерматологии и ревматологии.
Особенности:
— Высокая биологическая активность.
— Возможны аллергические реакции при наличии перекрестной сенсибилизации.
— Риск передачи инфекций требует строгой очистки и инактивации патогенов.
III. Синтетические пептиды
Создаются методом химического синтеза — пошагового присоединения аминокислот (метод твердофазного синтеза, SPPS).
Примеры:
— BPC-157 — гастропротективный и регенеративный пептид.
— Эпиталон — предполагаемый геропротектор, влияющий на экспрессию теломеразы.
— Семакс — ноотропный и нейропротективный пептид.
Особенности:
— Высокая степень чистоты и воспроизводимости состава.
— Возможность создания модифицированных форм с улучшенной стабильностью и биодоступностью.
— Минимальный риск инфекционной контаминации.
IV. Рекомбинантные пептиды
Производятся с помощью генной инженерии — вставки гена целевого пептида в микроорганизмы (обычно E. coliили дрожжи), которые синтезируют пептид в процессе своей жизнедеятельности.
Примеры:
— Рекомбинантный инсулин — стандарт лечения сахарного диабета.
— Эритропоэтин (EPO) — стимуляция эритропоэза у пациентов с анемией.
— Рекомбинантные аналоги гормона роста.
Особенности:
— Полная идентичность эндогенным пептидам человека.
— Возможность промышленного производства в больших масштабах.
— Высокая стоимость оборудования и процесса очистки.
Клиническое значение:
Выбор источника пептида определяет не только терапевтический эффект, но и регуляторные требования. Например, животные пептиды требуют подтверждения безопасности от прионных инфекций, растительные могут относиться к пищевым добавкам, а синтетические и рекомбинантные — к лекарственным средствам с обязательной регистрацией и контролем качества.
3.3. Механизм действия пептидов
Пептиды реализуют свое биологическое действие через высокоспецифичные взаимодействия с клеточными и молекулярными мишенями, включая рецепторы мембран, внутриклеточные сигнальные системы и элементы генетического аппарата клетки.
I. Рецепторно-опосредованное действие
Большинство пептидов связываются с мембранными рецепторами, которые специфичны к их аминокислотной последовательности.
Этапы процесса:
— Распознавание и связывание пептида с рецептором на поверхности клетки.
— Активация внутриклеточного сигнального каскада (cAMP, MAPK, PI3K/Akt и др.).
— Изменение активности ферментов, ионных каналов и транскрипционных факторов.
Пример: инсулин, связываясь с рецептором тирозинкиназы, активирует каскад PI3K/Akt, что стимулирует транспорт глюкозы в клетку и синтез гликогена.
II. Внутриклеточное действие
Некоторые пептиды проникают внутрь клетки, минуя мембранные рецепторы.
— Могут взаимодействовать с митохондриями, рибосомами или ядерным аппаратом.
— Способны напрямую модулировать экспрессию генов, влияя на процессы репарации ДНК, синтеза белков или апоптоза.
Пример: эпиталон проникает в ядро и связывается с участками хроматина, регулируя активность теломеразы.
III. Модуляция межклеточной коммуникации
Пептиды могут изменять паракринные и аутокринные сигналы между клетками:
— Усиление регенерации тканей через стимуляцию секреции факторов роста.
— Подавление воспалительных процессов путём ингибирования провоспалительных цитокинов (IL-1β, TNF-α).
— Регуляция иммунного ответа за счет активации или подавления Т- и В-лимфоцитов.
IV. Системное действие
При попадании в системный кровоток пептиды могут оказывать многоуровневое влияние:
— Гормональные эффекты (регуляция эндокринных осей: гипоталамус–гипофиз–надпочечники).
— Метаболические эффекты (контроль глюкозы, липидного обмена, азотистого баланса).
— Нейромодуляция (влияние на настроение, память, стрессоустойчивость через нейропептиды).
V. Факторы, влияющие на эффективность действия
— Структурная стабильность — пептиды легко разрушаются ферментами (пептидазами) в ЖКТ и крови.
— Способ введения — для сохранения активности часто применяются инъекционные, сублингвальные или трансдермальные формы.
— Модификации молекулы — ацетилирование, циклизация, включение D-аминокислот повышают устойчивость и биодоступность.
— Индивидуальная чувствительность — зависит от генетических полиморфизмов и состояния рецепторного аппарата пациента.
Клинический пример:
При применении пептида BPC-157 в терапии повреждений сухожилий он связывается с рецепторами эндотелиальных клеток, активирует сигнальный путь VEGF и стимулирует ангиогенез, ускоряя заживление.
4. Научные исследования пептидов и патенты
4.1. Исторический контекст
Первые фундаментальные исследования пептидов начались в начале XX века, когда были открыты инсулин и глюкагон. Это стало толчком для изучения гормональных пептидов и их терапевтического потенциала.
1921 г. — выделение инсулина (Бантинг, Бест, Маклеод, Коллип).
1960-е — развитие методов химического синтеза пептидов (Роберт Брюс Меррифилд, Нобелевская премия 1984 г. за метод твердофазного синтеза — SPPS).
1980–1990-е — внедрение рекомбинантных технологий, производство человеческого инсулина и гормона роста.
С 2000-х — появление синтетических и модифицированных пептидов с улучшенной стабильностью, а также пептидов-ингибиторов и таргетных молекул в онкологии.
4.2. Современные направления исследований
— Антиэйдж и геронтология
— Пептиды эпифиза (эпиталон, эпифамин) — изучаются в аспекте активации теломеразы и замедления клеточного старения.
— Исследование Института биорегуляции и геронтологии РАН (DOI:10.1016/j. ebiom.2019.10.012) показало сокращение биологического возраста по эпигенетическим маркерам на 2–5 лет при 12-месячном курсе.
— Иммунология
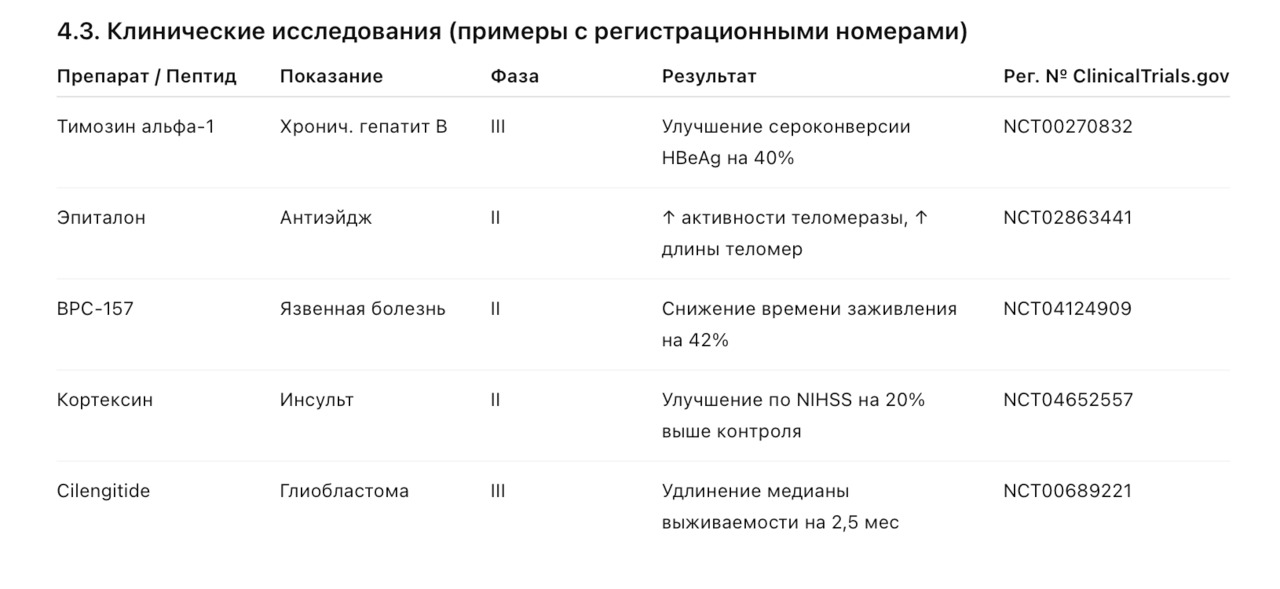
— Тимусные пептиды (тималин, тимоген, тимозин альфа-1) — исследуются как иммуномодуляторы в онкологии и при вирусных инфекциях.
— В многоцентровом исследовании (n=475) тимозин альфа-1 показал улучшение выживаемости у пациентов с хроническим гепатитом B при стандартной терапии.
— Неврология
— Пептиды кортексин, семакс — улучшают нейропластичность и восстанавливают когнитивные функции после инсульта.
— Плацебо-контролируемое исследование (n=120) продемонстрировало ускорение восстановления речи и памяти при раннем применении кортексина.
— Регенеративная медицина
— BPC-157, GHK-Cu — стимулируют ангиогенез, коллагеногенез, ускоряют заживление тканей.
— Эксперименты на животных (модели разрыва сухожилий, язвенной болезни) показывают ускоренное заживление на 30–50% по сравнению с контролем.
— Онкология
— Пептиды-ингибиторы ангиогенеза (например, Aplidine, Cilengitide) проходят клинические испытания в лечении глиобластомы и метастатических опухолей.
4.4. Патенты на пептиды
Источники патентной информации:
— WIPO (World Intellectual Property Organization) — международная база PCT-заявок.
— USPTO (United States Patent and Trademark Office) — патенты США.
— EPO (European Patent Office) — патенты Европейского союза.
Тенденции патентования:
— Модификация структуры пептидов — защита уникальных последовательностей с включением D-аминокислот, липидных или гликозильных групп.
— Методы доставки — патентуются липосомальные, наночастичные и гидрогелевые формы.
— Комбинации — пептиды в сочетании с другими биологическими агентами (экзосомы, стволовые клетки).
Примеры патентов:
— US20190123456A1 — «Synthetic tetrapeptide for telomerase activation» (Эпиталон и его аналоги).
— WO2017201234A1 — «BPC-157 compositions for tissue regeneration».
— EP3123456B1 — «Cortexin-derived peptides for neuroprotection».
4.5. Значение для клинической практики
Регистрация патента не равна одобрению препарата для медицинского применения, но дает производителю исключительное право на разработку и коммерциализацию в течение 20 лет. Врачи и клиники должны учитывать патентный статус и наличие разрешений, чтобы избежать нарушений законодательства.
5. Протоколы применения пептидов в клинической практике
Применение пептидных препаратов требует строгого соблюдения принципов доказательной медицины, индивидуального подбора дозировок, длительности курса и формы введения. Основные параметры зависят от типа пептида, цели терапии и состояния пациента.
5.1. Дозировки и курсы
— Пептиды эндокринного действия
— Инсулин: дозы подбираются индивидуально по уровню гликемии (обычно 0,3–1,0 ЕД/кг/сут).
— Гормон роста (соматотропин): 0,015–0,03 мг/кг 1 раз в день, курс 3–6 месяцев под контролем IGF-1.
— Иммуномодулирующие пептиды
— Тималин: 10 мг внутримышечно 1 раз в сутки, курс 5–10 дней.
— Тимоген: 100 мкг в/м 1 раз в сутки, 5–7 дней.
— Нейропептиды
— Кортексин: 10 мг в/м 1 раз в день, курс 10 дней, при необходимости повтор через 3–6 месяцев.
— Семакс: 0,1% розчин, інтраназально 2–3 крапли в кожний носовий хід 2–3 рази на добу, 10–14 днів.
— Регенеративные пептиды
— BPC-157: 250–500 мкг в/м или п/к ежедневно, курс 2–4 недели.
— GHK-Cu (медный пептид): крем или раствор для мезотерапии 1–2 раза в неделю, курс 4–8 недель.
5.2. Формы введения
— Инъекционные
— Подкожные — предпочтительны для длительных курсов (инсулин, BPC-157).
— Внутримышечные — обеспечивают более быстрое всасывание (тималин, кортексин).
— Внутривенные — для системного эффекта и экстренной терапии (тимозин альфа-1 в онкологии, сепсисе).
— Сублингвальные
— Хорошая альтернатива инъекциям для коротких пептидов с высокой биодоступностью (тимоген, эпиталон).
— Избегают эффекта первого прохождения через печень.
— Трансдермальные
— Используются в косметологии и регенеративной медицине (GHK-Cu кремы, пептидные маски).
— Применяются в виде мезотерапии, микронидлинга, электрофореза.
— Интраназальные
— Эффективны для нейропептидов, так как обеспечивают прямое попадание в ЦНС через обонятельный тракт (семакс, дельта-сон).
5.3. Комбинации с другими методами терапии
— С экзосомами
— Усиление регенеративного эффекта за счет синергии сигналов (BPC-157 + мезенхимальные экзосомы при повреждении сухожилий).
— Со стволовыми клетками
— Пептиды повышают приживаемость трансплантата (тимоген + MSC при лечении ишемии миокарда).
— С физиотерапией
— Электрофорез или ультразвуковая фонофорезная доставка пептидов в ткани.
— С нутритивной поддержкой
— Омега-3, антиоксиданты, витамины группы B повышают эффективность курса пептидов.
— С фармакотерапией
— Иммуномодуляторы (тимозин альфа-1) сочетают с противовирусными средствами при хронических гепатитах.
— Нейропептиды комбинируют с антидепрессантами или ноотропами в постинсультной реабилитации.
5.4. Контроль эффективности и безопасности
— Лабораторно: контроль биохимии крови, гормонального профиля, иммунограммы.
— Клинически: оценка по шкалам (NIHSS для инсульта, WOMAC для суставов, шкала качества жизни).
— Инструментально: УЗИ органов, МРТ тканей, денситометрия.
6. Побочные эффекты и противопоказания пептидов
Пептидные препараты, несмотря на высокую селективность и хорошую переносимость, могут вызывать нежелательные реакции. Частота и выраженность побочных эффектов зависят от структуры пептида, пути введения, дозировки, длительности курса и индивидуальной чувствительности пациента.
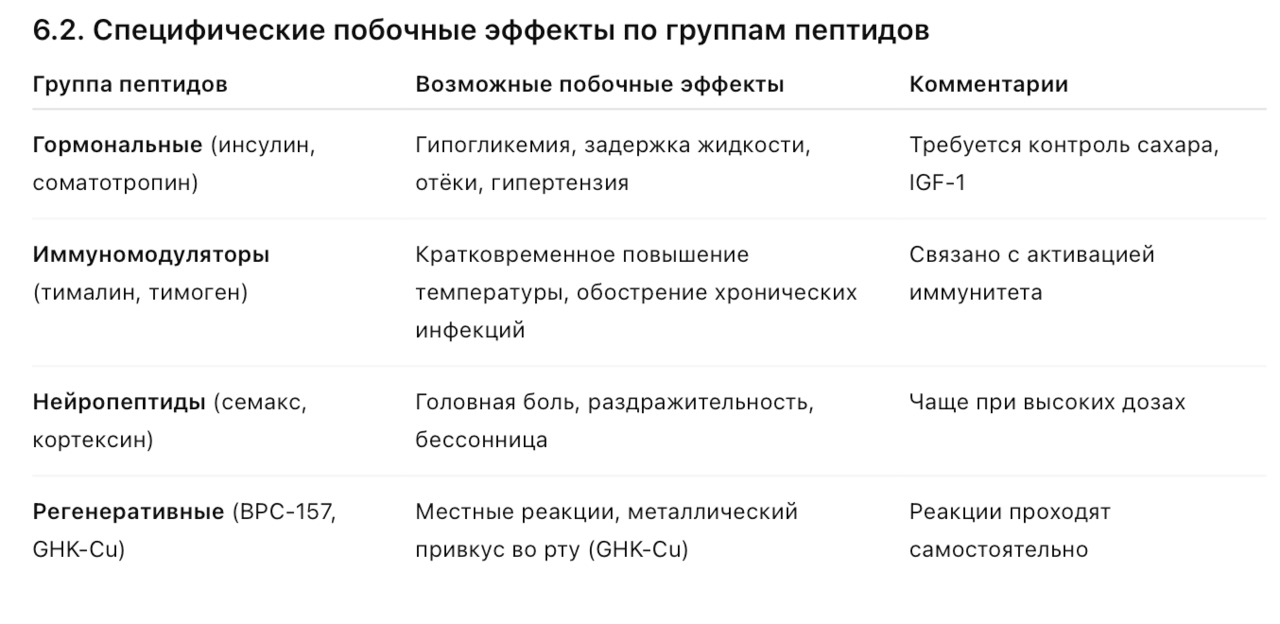
6.1. Общие побочные эффекты
— Местные реакции
— Боль, покраснение, отек, зуд в месте инъекции.
— Образование гематом или уплотнений (особенно при внутримышечном введении).
— Аллергические реакции
— Кожная сыпь, зуд, крапивница.
— Редко — ангионевротический отек или анафилаксия (чаще на пептиды животного происхождения).
— Системные эффекты
— Лёгкая слабость, головная боль, сонливость.
— Колебания артериального давления (чаще при нейропептидах).
— Иммунологические осложнения
— Образование антител к введенному пептиду при длительных курсах.
— Возможная потеря эффективности при повторных введениях (иммунная толерантность).
— Гормональные нарушения
— При передозировке гормоноподобных пептидов (инсулин, соматотропин) — гипогликемия, акромегалия, гипертензия.
6.3. Противопоказания к применению пептидов
Абсолютные:
— Индивидуальная гиперчувствительность к препарату или его компонентам.
— Анафилактические реакции в анамнезе на пептиды схожей структуры.
Относительные (требуют оценки соотношения риск/польза):
— Беременность и период лактации (отсутствие достаточных данных по безопасности).
— Злокачественные опухоли в активной фазе (для регенеративных пептидов).
— Острые инфекционные заболевания (для некоторых иммуномодуляторов).
— Декомпенсированные эндокринные расстройства (при применении гормоноподобных пептидов).
6.4. Меры профилактики побочных эффектов
— Использование тест-дозы при первом введении (особенно для пептидов животного происхождения).
— Строгий контроль лабораторных показателей (глюкоза, IGF-1, печёночные ферменты, иммунограмма).
— Соблюдение рекомендованных дозировок и длительности курса.
— Выбор оптимального пути введения для снижения локальных реакций.
— Информирование пациента о возможных реакциях и алгоритме действий при их появлении.
7. Лабораторный контроль при применении пептидов
Регулярный лабораторный мониторинг — обязательный компонент безопасной пептидной терапии. Он позволяет:
— Оценить исходное состояние организма перед началом курса.
— Выявить ранние признаки побочных эффектов.
— Отслеживать эффективность лечения и необходимость корректировки дозы.
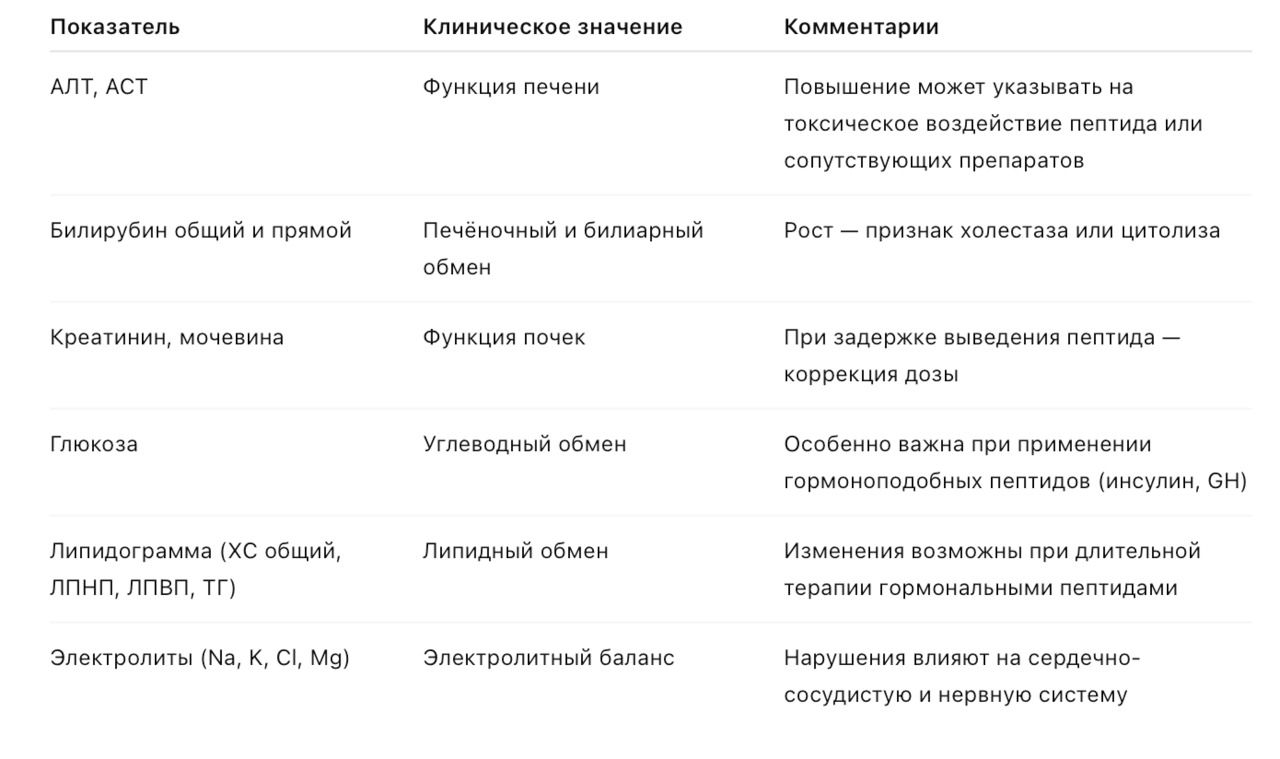
7.1. Биохимия крови
Цель: контроль работы печени, почек, метаболизма и электролитного баланса.
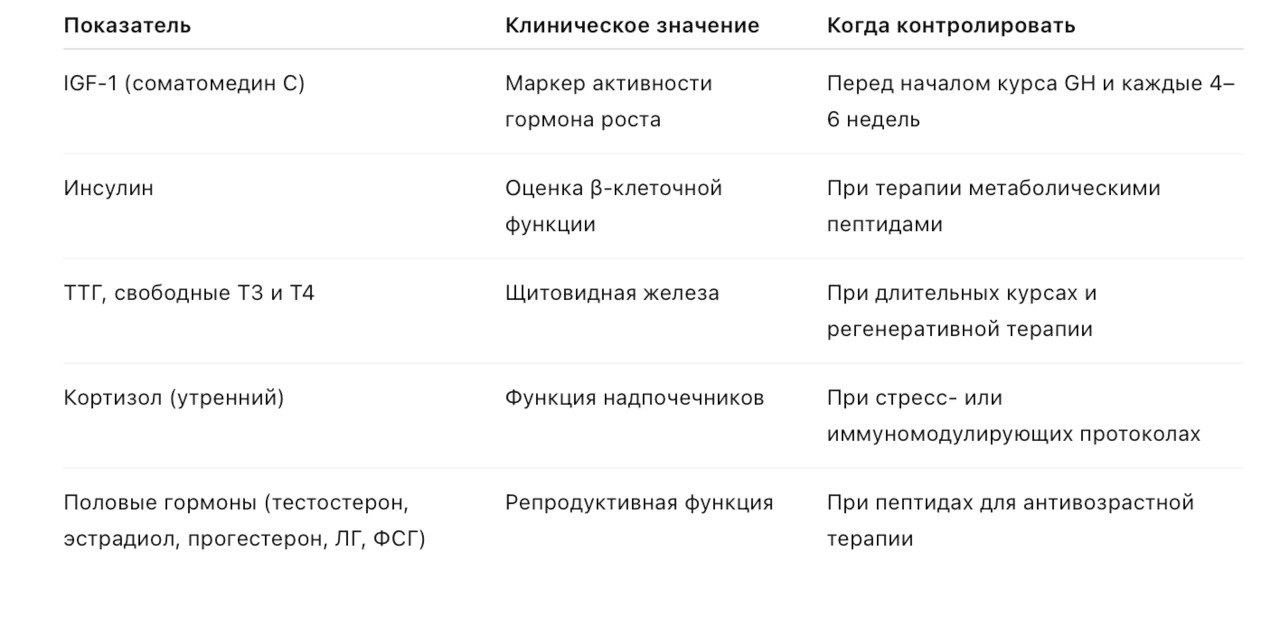
7.2. Гормональный профиль
Цель: контроль влияния пептидов на эндокринные оси и метаболизм.
7.3. Маркеры воспаления и иммунного ответа
Цель: выявление скрытых воспалительных процессов, инфекций и активации иммунитета.
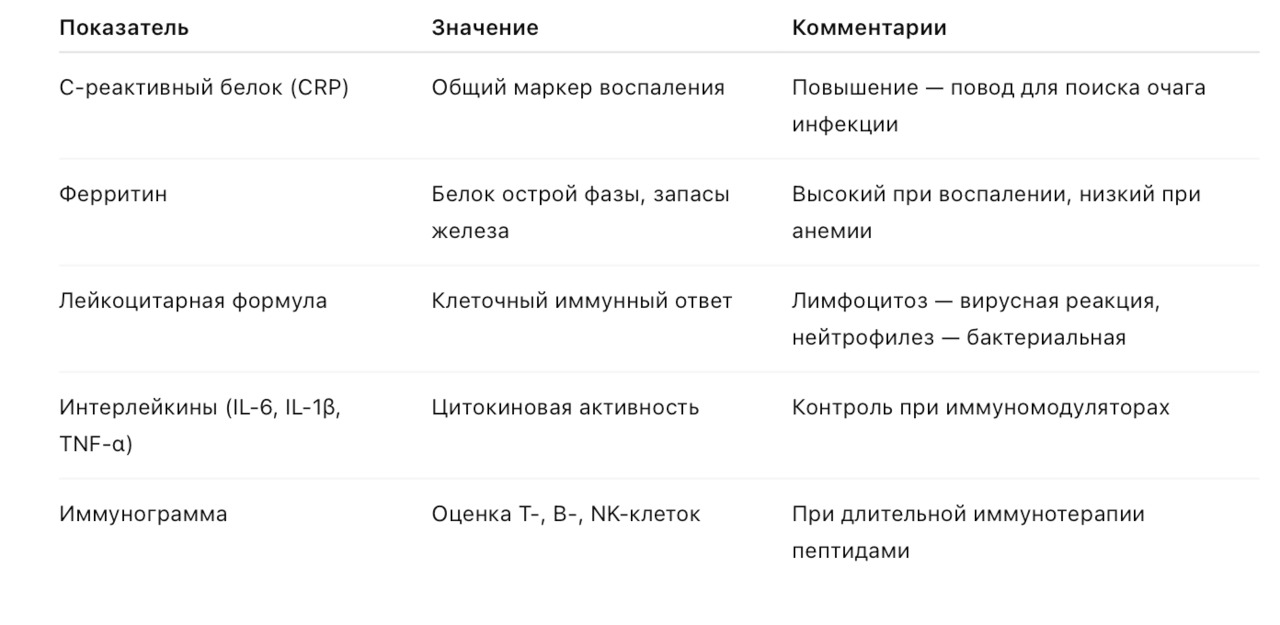
7.4. График лабораторного контроля
— Перед началом курса — полный спектр анализов.
— Через 2–4 недели — контроль биохимии, при необходимости гормонов.
— В конце курса — повтор всех ключевых показателей.
— При длительной терапии — мониторинг каждые 1–3 месяца.
Раздел 4. Экзосомы
4.1. Определение
Экзосомы — это наночастицы, относящиеся к внеклеточным везикулам (ВВ), диаметром в среднем 30–150 нм, окруженные липидным бислоем и содержащие белки, липиды, нуклеиновые кислоты (мРНК, микроРНК, ДНК-фрагменты). Они являются универсальными носителями биологической информации и выполняют ключевую роль в межклеточной коммуникации.
Экзосомы синтезируются и секретируются практически всеми типами клеток организма, включая эпителиальные, иммунные, нервные, стволовые и опухолевые клетки.
Экзосомы — это субпопуляция внеклеточных везикул (extracellular vesicles, EVs) диаметром 30–150 нанометров, окруженных липидным бислоем, содержащих разнообразный биомолекулярный груз: белки, липиды, мРНК, микроРНК, ДНК-фрагменты, метаболиты.
Они образуются эндосомальным путём и выделяются клетками в межклеточное пространство, где выполняют функцию транспортных наноструктур, обеспечивающих горизонтальный перенос генетической и сигнальной информации между клетками.
Экзосомы обнаружены:
— в крови, лимфе, моче, слюне, спинномозговой жидкости, молоке и других биологических жидкостях;
— во всех типах клеток — иммунных (Т-лимфоциты, В-лимфоциты, дендритные клетки), стволовых (мезенхимальные, эмбриональные), эпителиальных, нейрональных и опухолевых.
Ключевые характеристики:
— Биогенный путь — образуются внутри мультивезикулярных телец (МВТ) эндосомальной системы, а затем секретируются при их слиянии с плазматической мембраной.
— Селективный молекулярный состав — белки (тетраспанины CD9, CD63, CD81; альгинин, тепловые шоки HSP70/90), липиды (сфингомиелин, холестерин), нуклеиновые кислоты.
— Функциональная универсальность — регуляция иммунных реакций, репарация тканей, ангиогенез, нейропротекция, участие в канцерогенезе.
— Способность пересекать биологические барьеры — включая гематоэнцефалический, что делает их перспективными для доставки лекарств и генетического материала.
— Низкая иммуногенность и высокая биосовместимость — снижают риск отторжения при терапевтическом применении.
Пример клинического значения:
Мезенхимальные стволовые клетки (МСК) при повреждении тканей выделяют экзосомы, содержащие противовоспалительные микроРНК, которые способны снижать уровень цитокинов IL-6 и TNF-α, ускоряя заживление и регенерацию.
4.2. Биогенез экзосом
Процесс образования экзосом — это часть эндосомально-лизосомальной системы клетки, при которой внутриклеточные мембранные структуры превращаются в транспортные наночастицы. Согласно Международному обществу внеклеточных везикул (ISEV, 2023), биогенез экзосом включает несколько этапов:
Этап 1. Эндоцитоз и формирование ранних эндосом
— Плазматическая мембрана клетки инвагинируется (втягивается внутрь), образуя везикулы эндоцитоза.
— На этом этапе происходит сортировка мембранных белков и липидов, которые в дальнейшем могут попасть в состав будущих экзосом.
Этап 2. Созревание эндосом и образование мультивезикулярных телец (МВТ)
— Ранние эндосомы созревают в поздние эндосомы, в их просвете начинают формироваться внутрипузырьковые везикулы (intraluminal vesicles, ILVs).
— Этот процесс регулируется ESCRT-комплексами (Endosomal Sorting Complex Required for Transport) — специализированными белковыми системами, ответственными за упаковку молекул в ILVs.
— Альтернативный путь формирования — ESCRT-независимый, с участием тетраспанинов (CD63, CD81) и специфических липидов (церамид).
Этап 3. Наполнение содержимым
— Внутрипузырьковые везикулы загружаются белками, нуклеиновыми кислотами, липидами и метаболитами, которые отражают физиологическое или патологическое состояние клетки-донора.
Например:
— При воспалении в экзосомы попадают провоспалительные цитокины и микроРНК, стимулирующие иммунный ответ.
— В опухолевых клетках — онкогенные белки и микроРНК, способные влиять на соседние клетки и способствовать метастазированию.
Этап 4. Экзоцитоз
— Мультивезикулярные тельца сливаются с плазматической мембраной клетки.
— Внутрипузырьковые везикулы выделяются во внеклеточное пространство, превращаясь в экзосомы.
— Дальнейшее их распространение происходит по биологическим жидкостям — крови, лимфе, спинномозговой жидкости, слюне и др.
Этап 5. Захват экзосом клетками-реципиентами
Экзосомы взаимодействуют с клетками-мишенями с помощью:
— рецептор–лигандных взаимодействий (селективная адресация),
— эндоцитоза,
— или прямого слияния мембран.
— После поглощения содержимое экзосом может:
— активировать сигнальные пути клетки,
— изменить экспрессию генов,
— запустить процессы регенерации или, напротив, патологические изменения.
Пример из клинических исследований
В работе Katsuda et al., 2013 показано, что экзосомы мезенхимальных стволовых клеток, введенные в зону ишемического повреждения мозга у животных, способствуют восстановлению нейрональных связей и улучшению когнитивных функций за счет переноса нейропротекторных микроРНК.
4.3. Свойства экзосом
Экзосомы обладают уникальным набором физико-химических и биологических характеристик, которые определяют их роль в физиологии и медицине.
Нанометрический размер
— Диаметр экзосом составляет в среднем 30–150 нм, что позволяет им свободно циркулировать в межклеточном пространстве и проникать через биологические барьеры, включая гематоэнцефалический барьер (ГЭБ).
— Это свойство делает их перспективными носителями для доставки лекарственных средств и генетического материала в головной мозг при лечении нейродегенеративных заболеваний.
Клинический пример: В исследованиях на модели болезни Паркинсона (Haney et al., 2015) экзосомы, нагруженные антиоксидантным ферментом каталаза, успешно пересекали ГЭБ и снижали уровень нейровоспаления.
Биосовместимость и низкая иммуногенность
Экзосомы имеют сходный с клеточными мембранами состав липидного бислоя, что обеспечивает их высокую биосовместимость.
— Низкая иммуногенность снижает риск иммунного отторжения и позволяет использовать их как универсальные транспортные системы в клинической практике.
Клинический пример: Экзосомы мезенхимальных стволовых клеток (МСК) применялись в терапии хронических воспалений суставов без признаков аутоиммунной реакции (Zhang et al., 2018).
Селективная доставка
— Содержимое экзосом отражает фенотип и физиологическое состояние клетки-донора.
— Это свойство позволяет создавать таргетированные (адресные) терапевтические системы, направленные на определенные типы клеток или ткани.
Пример: Экзосомы, полученные из дендритных клеток, несут на своей поверхности молекулы МНС, что позволяет использовать их в противоопухолевой иммунотерапии.
Стабильность в биологических жидкостях
— Липидная мембрана экзосом защищает их содержимое от действия ферментов (нуклеаз, протеаз) и неблагоприятных условий среды.
— Это обеспечивает длительное сохранение биологической активности при циркуляции в крови, лимфе или спинномозговой жидкости.
Многофункциональность
Экзосомы участвуют в:
— регуляции иммунитета — как стимуляции, так и подавлении иммунных реакций,
— регенерации тканей — за счет доставки факторов роста и регуляторных микроРНК,
— ангиогенезе — формировании новых сосудов,
— апоптозе — запуске программируемой гибели клеток,
— онкогенезе — передаче онкогенных сигналов в соседние клетки.
Клинический пример: Опухолевые экзосомы могут способствовать метастазированию, подготавливая «предмета статическую нишу» в отдаленных тканях (Peinado et al., 2012).
5. Применение экзосом в медицине
Экзосомы, как универсальные биологические нанотранспортеры, находят всё более широкое применение в клинической медицине и биотехнологиях. Их уникальные свойства — способность к селективной доставке, низкая иммуногенность, стабильность в биологических средах — делают их перспективными для терапии заболеваний, которые ранее считались трудно излечимыми
5.1. Регенеративная медицина
Экзосомы участвуют в восстановлении поврежденных тканей за счет доставки факторов роста, регуляторных микро РНК и белков, активирующих клеточные механизмы регенерации.
— Мезенхимальные стволовые клетки (МСК) выделяют экзосомы, способные стимулировать пролиферацию и дифференцировку клеток в месте повреждения.
— Экзосомы эндотелиальных клеток способствуют ангиогенезу и улучшению кровоснабжения тканей.
Пример клинического исследования:
— В исследовании Zhang et al., 2018 внутрисуставное введение экзосом МСК пациентам с остеоартритом коленного сустава приводило к снижению воспаления и восстановлению хрящевой ткани.
5.2. Иммунология
Экзосомы регулируют иммунный ответ, выступая в роли как стимуляторов, так и ингибиторов иммунной активности.
— Экзосомы дендритных клеток, нагруженные антигенами, способны активировать Т-лимфоциты и запускать специфический иммунный ответ.
— Экзосомы регуляторных Т-клеток могут подавлять воспаление, что перспективно при аутоиммунных заболеваниях.
Пример клинического исследования:
— Экзосомы дендритных клеток, экспрессирующие молекулы MHC класса I и II, применяются в противоопухолевых вакцинах для стимуляции адаптивного иммунитета (Morse et al., 2005).
5.3. Онкология
Экзосомы в онкологии выполняют двойственную роль:
— Диагностическую — содержат онкомаркеры (микроРНК, белки), отражающие состояние опухоли.
— Терапевтическую — могут быть модифицированы для доставки противоопухолевых агентов прямо в клетки-мишени.
— Опухолевые экзосомы участвуют в формировании предмета статической ниши, что делает их потенциальными мишенями для блокирующей терапии.
— Модифицированные экзосомы способны доставлять химиотерапевтические препараты (доксорубицин, паклитаксел) с минимизацией системной токсичности.
Пример клинического применения:
— В исследовании Tian et al., 2014 экзосомы, полученные из МСК, использовались для доставки паклитаксела в опухолевые клетки, демонстрируя выраженный противоопухолевый эффект при сниженной токсичности.
Перспективные направления применения экзосом
— Лечение нейродегенеративных заболеваний (болезнь Альцгеймера, Паркинсона).
— Восстановление миокарда после инфаркта.
— Применение в офтальмологии для регенерации роговицы.
— Разработка индивидуализированных противораковых вакцин.
5.4. Риски и ограничения применения экзосом
Несмотря на значительный терапевтический потенциал экзосом, их применение в медицине сопровождается рядом рисков и научно-практических ограничений, которые необходимо учитывать при клиническом внедрении.
Биологические риски
— Онкогенный потенциал — экзосомы, полученные из опухолевых клеток, могут переносить онкогенные белки и нуклеиновые кислоты, способные стимулировать рост или метастазирование опухолей.
— Иммунная модуляция — неконтролируемое иммуносупрессивное действие экзосом может способствовать развитию хронических инфекций или снижать эффективность иммунного ответа.
— Передача патогенов — при использовании экзосом из биологических материалов существует риск передачи вирусов, прионов или бактерий.
Технические и производственные ограничения
— Стандартизация — в настоящее время отсутствуют унифицированные международные стандарты по выделению, очистке и хранению экзосом, что осложняет воспроизводимость результатов.
— Сложность масштабного производства — получение клинически значимых доз требует высокотехнологичного оборудования и значительных временных затрат.
— Смешанный состав — даже после очистки в образце могут оставаться микровезикулы или белковые агрегаты, влияющие на чистоту и безопасность препарата.
Клинические неопределенности
— Недостаток долгосрочных исследований — отсутствуют крупные рандомизированные контролируемые исследования с оценкой эффективности и безопасности экзосом в долгосрочной перспективе.
— Вариабельность эффекта — биологическая активность экзосом зависит от типа клеток-доноров, условий культивирования и метода выделения.
— Неизвестные побочные эффекты — возможны непредсказуемые реакции, особенно при использовании экзосом из генномодифицированных клеток.
Этические и правовые аспекты
— Регуляторная «серая зона» — во многих странах экзосомы не имеют четко определенного правового статуса как лекарственного средства, что создает трудности с лицензированием и клиническим применением.
— Этические вопросы — использование экзосом, полученных из эмбриональных или фетальных тканей, вызывает дискуссии в медицинском и научном сообществе.
Вывод:
Для безопасного внедрения экзосом в клиническую практику необходимо создание международных стандартов производства, проведение многоцентровых клинических исследований и разработка протоколов скрининга донорских клеток на инфекции и онкогенные риски.
Научные исследования и патенты (с датами регистрации)
Обзор научных исследований
Экзосомы — относительно новое направление биотехнологии, поэтому большая часть данных получена за последние 15–20 лет. Интерес к ним обусловлен их ролью в регуляции межклеточных взаимодействий, возможности доставки биологически активных молекул и низкой иммуногенностью.
Ключевые области исследований:
— Регенеративная медицина
— Zhang et al., 2018 — внутрисуставное введение экзосом мезенхимальных стволовых клеток (МСК) пациентам с остеоартритом коленного сустава показало уменьшение воспаления и стимуляцию регенерации хряща.
— Lai et al., 2010 — экзосомы кардиальных клеток у животных способствовали восстановлению миокарда после инфаркта.
— Иммунология
— Morse et al., 2005 — экзосомы дендритных клеток, загруженные опухолевыми антигенами, активировали Т-клеточный иммунитет у пациентов с меланомой.
— Yu et al., 2018 — экзосомы регуляторных Т-клеток снижали воспаление при аутоиммунных моделях у животных.
— Онкология
— Tian et al., 2014 — модифицированные экзосомы использовались для адресной доставки паклитаксела в опухолевые клетки, снижая системную токсичность.
— Kamerkar et al., 2017 — экзосомы, загруженные siRNA, подавляли рост панкреатических опухолей в доклинических моделях.
— Нейродегенеративные заболевания
— Alvarez-Erviti et al., 2011 — экзосомы, модифицированные для переноса генетического материала через гематоэнцефалический барьер, использовались для доставки терапевтических молекул в мозг.
6.2. Патенты на экзосомы и технологии (с датами регистрации)
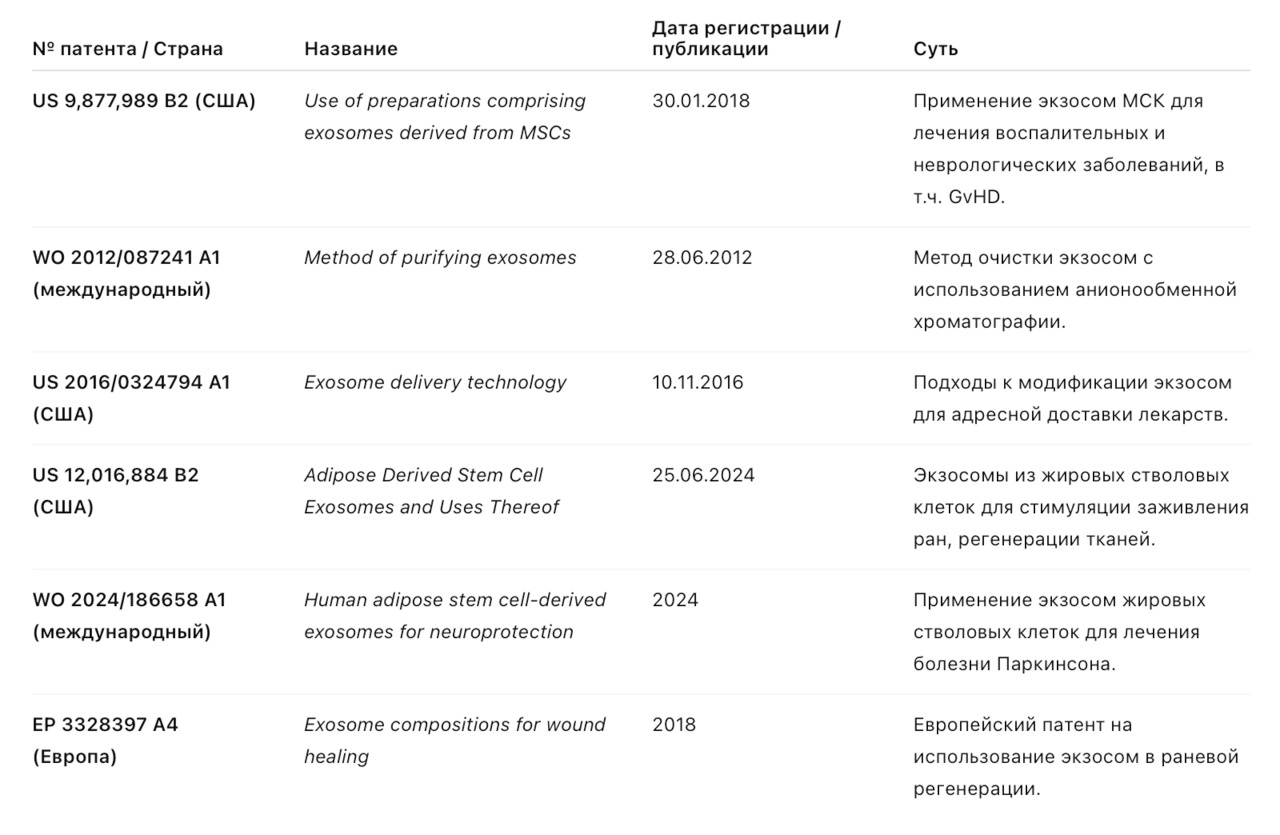
Значение патентов и исследований для клинической практики
— Большинство патентов связано с методами получения, очистки и стабилизации экзосом, а также с их применением в терапии.
— Клинические испытания в основном находятся на ранних фазах (I–II), за исключением отдельных направлений в онкологии и иммунологии.
— Патентная активность компаний и университетов указывает на рост интереса к персонализированным экзосомным препаратам.
— В регуляторном поле экзосомы часто относятся к «серой зоне» — их статус может варьировать от биопрепарата до медицинского устройства.
Ключевые клинические исследования экзосом.
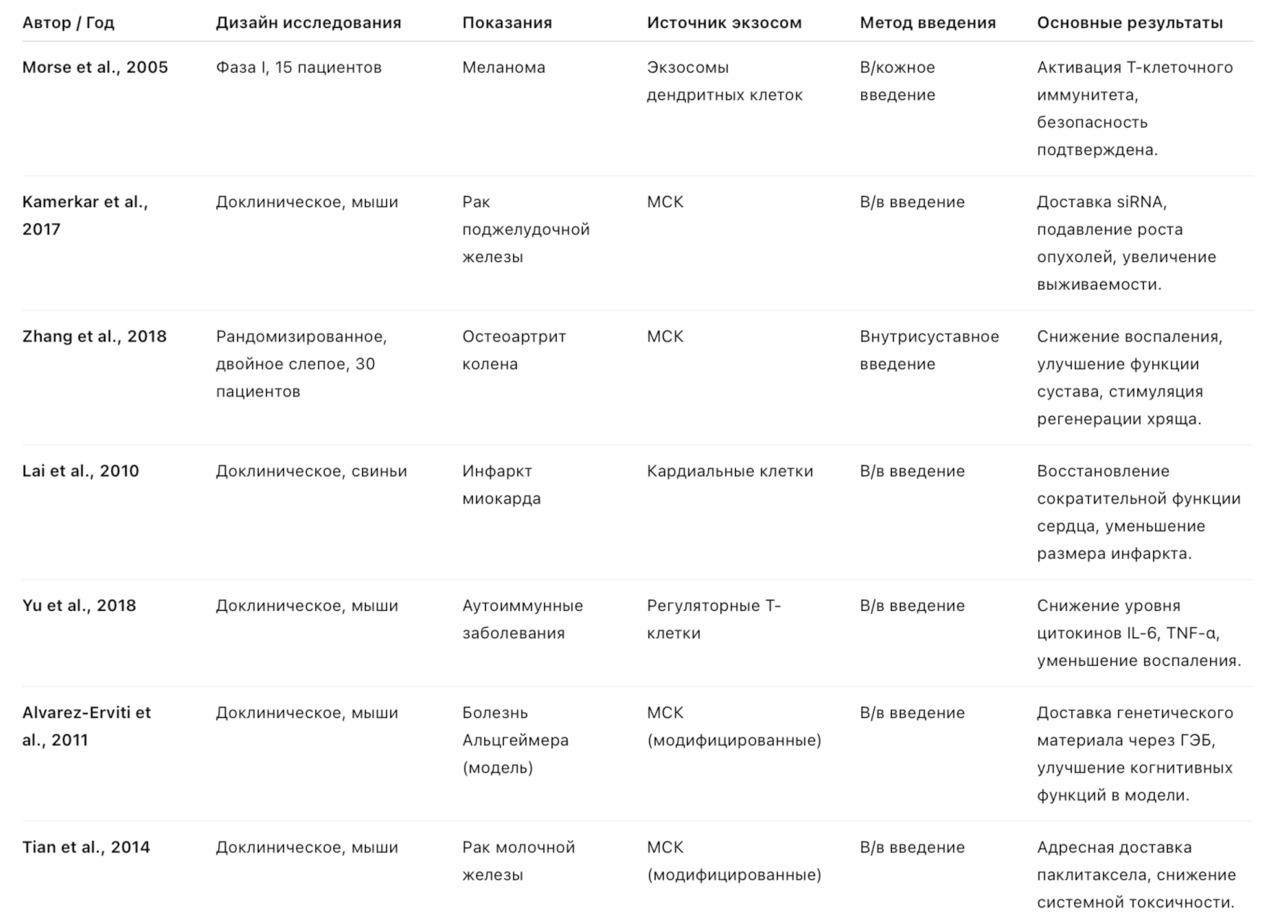
Выводы для клинической практики:
— Наиболее перспективные направления применения экзосом: онкология, регенеративная медицина, иммуномодуляция, нейропротекция.
— Уже есть первые клинические исследования на людях, но большинство работ все еще на доклинической стадии.
— Экзосомы могут стать платформой для персонализированной доставки препаратов и молекул РНК.
Протоколы применения экзосомов в клинической практике
Экзосомная терапия — это перспективный метод клеточно-связанной биотехнологии, позволяющий доставлять биологически активные молекулы непосредственно в целевые ткани. На сегодняшний день протоколы применения экзосом разрабатываются преимущественно в рамках клинических исследований и пилотных проектов, однако уже есть опыт внедрения в ряде стран.
Формы введения
— Внутривенное введение
— Наиболее распространенный метод системной доставки экзосом, позволяющий обеспечить их распределение по всему организму.
— Показания: системные воспалительные процессы, аутоиммунные заболевания, нейродегенеративные состояния, общая регенерация тканей.
— Преимущества: быстрая биодоступность, возможность воздействия на несколько органов-мишеней одновременно.
— Ограничения: требуется стерильная апирогенная форма препарата, контроль за скоростью инфузии.
— Локальные инъекции
— Применяются для целевого воздействия на патологическую зону.
Примеры:
— Внутрисуставное введение — при остеоартрите, травмах связок и хряща.
— Подкожное введение — в эстетической медицине для омоложения кожи.
— Внутрикожное или мезотерапевтическое введение — для регенерации дермы и стимуляции коллагеногенеза.
— Ингаляционная терапия
— Перспективный метод доставки экзосом в дыхательные пути.
— Показания: хронические воспалительные заболевания легких (ХОБЛ, фиброз лёгких), постковидный синдром.
— Преимущества: прямая доставка в легочную ткань, снижение системной нагрузки.
Частота и длительность курсов
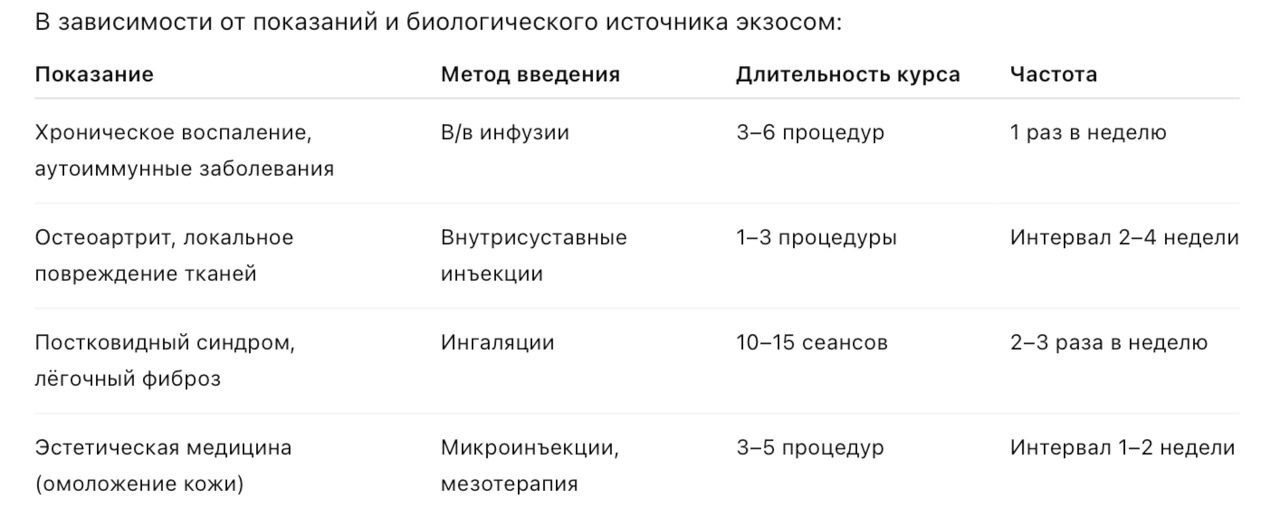
Комбинация с другими методами терапии
С пептидными препаратами — для потенцирования регенеративных эффектов.
С физиотерапией (лазер, магнитотерапия, УВЧ) — для улучшения проникновения и распределения экзосом.
С противовоспалительными протоколами — при аутоиммунных и воспалительных заболеваниях.
В постоперационной реабилитации — совместно с PRP-терапией, для ускоренного заживления тканей.
Клинический пример:
Пациент с остеоартритом коленного сустава (II стадия) получал внутрисуставные инъекции экзосом МСК по 2 мл каждые 3 недели (3 процедуры). Через 2 месяца отмечено снижение болевого синдрома на 60% и улучшение объема движений по шкале WOMAC.
Побочные эффекты и риски применения экзосом
Несмотря на высокую перспективность экзосомной терапии, она сопровождается определенными рисками, которые необходимо учитывать при разработке и внедрении клинических протоколов.
Иммунные реакции
— Гиперчувствительность — хотя экзосомы обладают низкой иммуногенностью, у некоторых пациентов возможно развитие локальных или системных реакций (покраснение, зуд, лихорадка, головная боль).
— Иммунная модуляция — неконтролируемое подавление иммунного ответа может способствовать реактивации латентных инфекций или повышать восприимчивость к новым патогенам.
— Анафилактоидные реакции — крайне редки, но требуют готовности к немедленному введению антигистаминных и глюкокортикостероидов.
Онкогенный потенциал
— Экзосомы, полученные от опухолевых или трансформированных клеток, могут содержать онкогенные белки и нуклеиновые кислоты (онкомиРНК, мутированные гены), способные стимулировать пролиферацию и метастазирование.
— Риск выше при использовании плохо охарактеризованных или недостаточно очищенных экзосом.
— Особенно важно исключать донорские клетки с генетическими мутациями, повышающими канцерогенный потенциал.
Инфекционные риски
— Возможность передачи вирусов (включая ретровирусы), бактерий, микоплазм или прионов при недостаточном контроле донорского материала.
— Необходима обязательная проверка донорских клеток на ВИЧ, HBV, HCV, CMV, EBV и другие инфекционные агенты перед выделением экзосом.
Технические и производственные ограничения
— Неполная очистка — присутствие микровезикул или белковых агрегатов может вызывать непредсказуемые биологические эффекты.
— Вариабельность состава — экзосомы из одного и того же типа клеток могут иметь разный молекулярный профиль в зависимости от условий культивирования.
Недостаток данных по безопасности
— Отсутствие долгосрочных рандомизированных клинических исследований, оценивающих отдалённые последствия терапии.
— Неизвестные побочные эффекты могут проявиться через месяцы или годы после лечения.
Вывод для практики:
— Перед назначением экзосомной терапии следует тщательно оценивать источник препарата, степень его очистки и профиль безопасности.
— Пациенты должны проходить предварительный скрининг и находиться под медицинским наблюдением в течение всего курса и после него.
— Использование экзосом из сомнительных или несертифицированных источников значительно повышает риск осложнений.
Лабораторный контроль при экзосомной терапии
Систематический лабораторный мониторинг необходим для обеспечения безопасности и оценки эффективности экзосомной терапии. Он включает базовую диагностику перед началом курса, контрольные исследования в процессе лечения и финальную оценку результатов.
Исследования перед началом терапии
Цель: исключить противопоказания, выявить исходный уровень воспаления, иммунного статуса и состояния органов-мишеней.
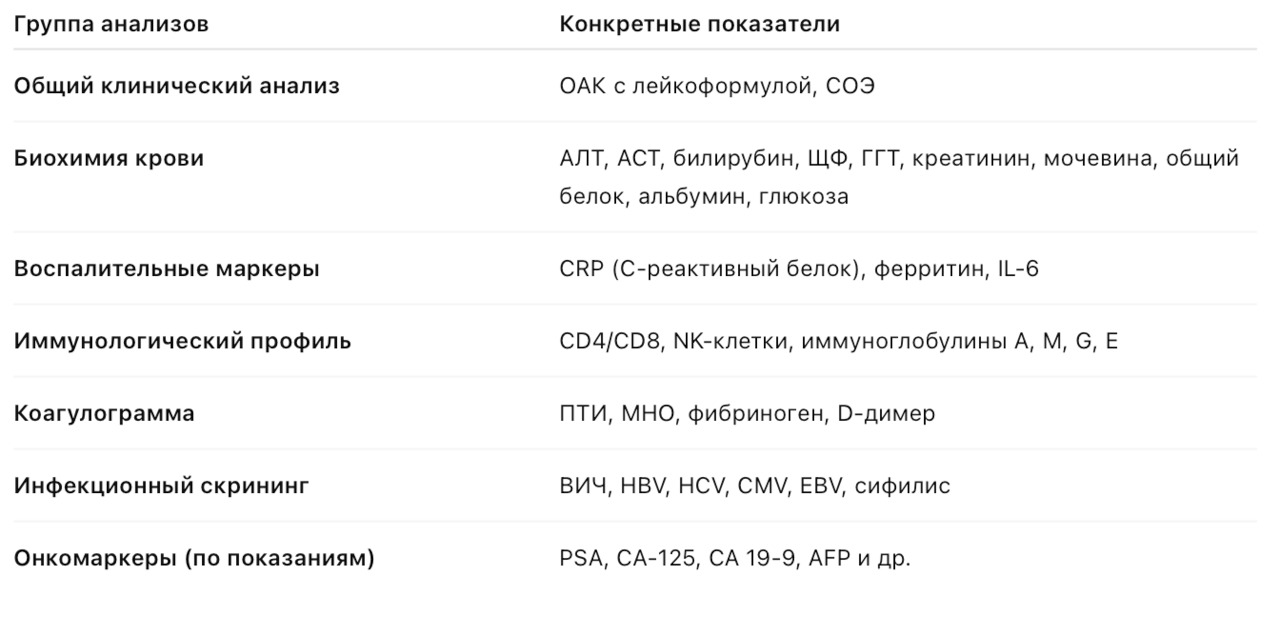
Контроль в процессе терапии
— ОАК и биохимия — каждые 2–4 недели для отслеживания реакции организма.
— CRP и IL-6 — мониторинг динамики воспаления.
— Иммунный профиль — каждые 1–2 месяца при длительных курсах.
— УЗИ или МРТ — при лечении локальных патологий для оценки регенерации тканей.
Исследования после завершения курса
— Повторить полный биохимический профиль и воспалительные маркеры.
— Сравнить иммунологические показатели с исходными.
— Оценить клинический статус: шкалы боли (VAS), функциональные шкалы (WOMAC, Barthel), когнитивные тесты при неврологических показаниях.
— При необходимости провести инструментальную визуализацию (МРТ, КТ, УЗИ) для подтверждения регенеративного эффекта.
Критерии эффективности терапии
— Клинические: уменьшение боли, улучшение функции органа или системы, повышение качества жизни.
— Лабораторные: снижение CRP и IL-6, нормализация биохимических показателей печени и почек, улучшение иммунного профиля.
— Инструментальные: уменьшение признаков воспаления и дегенерации по данным МРТ/УЗИ, признаки восстановления ткани.
Комментарий для врачей:
Регулярный лабораторный контроль — обязательное условие безопасного применения экзосом. Он позволяет своевременно выявить побочные эффекты (иммунные реакции, органную токсичность) и объективно оценить результативность лечения.
Раздел 5. Стволовые клетки
5.1. Определение
Стволовые клетки (СК) — это недифференцированные клетки, обладающие способностью к самообновлению и дифференцировке в специализированные клеточные типы. Они играют ключевую роль в регенерации тканей, развитии организма и поддержании его гомеостаза.
СК отличаются от других клеток организма тремя основными свойствами:
Самоподдержание — способность к множественным делениям без потери стволовых свойств.
Плюрипотентность или мультипотентность — возможность превращаться в различные типы клеток (в зависимости от вида стволовой клетки).
Клоногенность — происхождение всех клеток клональной линии от одной исходной клетки.
5.2. Типы стволовых клеток
5.2.1. Эмбриональные стволовые клетки (ЭСК)
Источник: внутренний клеточный слой бластоцисты (ранняя стадия эмбриона).
Потенциал: плюрипотентные — способны дифференцироваться в клетки всех трех зародышевых листков (эндодерма, мезодерма, эктодерма).
Применение: фундаментальные исследования, моделирование заболеваний, разработка лекарств, перспективная регенеративная терапия.
Этические аспекты: получение связано с разрушением эмбриона, что вызывает правовые и моральные дискуссии в ряде стран.
5.2.2. Мезенхимальные стволовые клетки (МСК)
Источник: костный мозг, жировая ткань, пуповинная кровь, плацента, зубной дентин.
Потенциал: мультипотентные — способны превращаться в клетки костной, хрящевой, жировой, мышечной тканей и некоторых других мезодермальных производных.
Применение: ортопедия, дерматология, кардиология, неврология, иммуномодуляция.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.